用于促进水化的制剂及其使用方法
文献发布时间:2024-04-18 19:52:40
相关的专利申请
本申请要求2020年7月2日提交的美国临时申请No.63/047,300的优先权,出于所有目的将该临时申请通过引用并入本文中。
技术领域
本文描述了有用于在有需要的受试者中促进水化和/或肠屏障功能的氨基酸制剂。本文所述的制剂和方法有用于在有需要的受试者中促进水化和/或肠屏障功能。在一些实施方案中,此类受试者是健康的,但是需要或想要会促进快速水化(例如,在施用后15-90分钟内)和/或会促进肠屏障功能的制剂。在一些实施方案中,这些受试者患有与脱水和/或肠屏障功能受损相关的障碍或疾病。本文还涵盖本文所述的氨基酸制剂用于在有需要的受试者中促进水化和/或肠屏障功能、用于治疗与脱水和/或肠屏障功能受损相关的障碍或疾病、以及在制备供治疗与脱水和/或肠屏障功能受损相关的障碍或疾病的药物中的用途。
背景技术
当水分流失超过水分摄入时,受试者发生脱水。脱水可以从轻度脱水(可以通过增加流体摄入来解决)到严重脱水(可能需要医疗看护)不等。脱水可由多种原因引起,包括但不限于:与体力消耗相关的过度出汗、长时间暴露于高温(例如,温度≥37℃)和/或低湿度(例如,诸如沙漠气候典型的湿度)以及与呕吐和/或腹泻相关的疾病或障碍。
所摄入流体的快速胃排空和肠吸收对于快速补充运动-热应激期间发生的汗液流失至关重要。无法补充汗液流失会导致脱水,这会增加生理压力并削弱耐力,尤其是在受热的情况下。摄入的流体可供补充汗液流失的速率取决于流体从胃排空的速度(胃排空速率)和肠部位的吸收速率。
发明内容
所涵盖的实施方案由权利要求限定,而不是本发明内容。本发明内容是对各个方面的高层次概述并介绍了一些概念,这些概念将在下面的“具体实施方式”章节中进一步描述。本发明内容不旨在识别所要求保护的主题的关键或基本特征,也不旨在孤立地用于确定所要求保护的主题的范围。应通过参考整个说明书的适当部分、任何或所有附图以及每项权利要求来理解主题。
在一些实施方案中,提供了用于在有需要的受试者中促进水化的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述游离氨基酸基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。
在一些实施方案中,提供了用于在有需要的受试者中促进肠屏障功能的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中该游离氨基酸基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲液、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。
在所述制剂或用途的一些实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。
在所述制剂或用途的一些实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。
在所述制剂或用途的一些实施方案中,所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其一些实施方案中,可忽略量的赖氨酸为小于1mM,可忽略量的甘氨酸为小于0.5mM,和/或可忽略量的甘氨酸为小于0.5mM。
在所述制剂或用途的一些实施方案中,所述治疗有效的游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。
在所述制剂或用途的一些实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其一些实施方案中,所述制剂处于溶液中。
在所述制剂或用途的一些实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM;或者天冬氨酸的浓度在28mM至29mM的范围内。
在所述制剂或用途的一些实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.0天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.9天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;该摩尔比为约2.8天冬氨酸/1丝氨酸;该摩尔比为约0.9天冬氨酸/1丝氨酸;该摩尔比为约1.8天冬氨酸/1丝氨酸;或者该摩尔比为约1.2天冬氨酸/1丝氨酸。
在该制剂或用途的一些实施方案中,天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.5天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至1.9天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.5天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.1天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比为约3.8天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约1.4天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约3.2天冬氨酸/1缬氨酸;或者天冬氨酸/缬氨酸的摩尔比为约2天冬氨酸/1缬氨酸。
在所述制剂或用途的一些实施方案中,天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.9天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.8天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.7天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.6天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.5天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比为约5.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约1.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约4.4天冬氨酸/1异亮氨酸;或者天冬氨酸/异亮氨酸的摩尔比为约2.8天冬氨酸/1异亮氨酸。
在所述制剂或用途的一些实施方案中,天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.9天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.8天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.7天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.6天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.5天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.6天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约5.5天冬氨酸/1苏氨酸;天冬氨酸/苏氨酸的摩尔比为约1.7天冬氨酸/1苏氨酸;天冬氨酸/苏氨酸的摩尔比约为4.4天冬氨酸/1苏氨酸;或者天冬氨酸/苏氨酸的摩尔比为约2.8天冬氨酸/1苏氨酸。
在所述制剂或用途的一些实施方案中,天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比为约35.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.0天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约17.5天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约15.3天冬氨酸/1酪氨酸;或者天冬氨酸/酪氨酸的摩尔比为约11.7天冬氨酸/1酪氨酸。
在所述制剂或用途的一些实施方案中,所述制剂还包含至少一种盐。
在所述制剂或用途的一些实施方案中,游离氨基酸中的至少一者或游离氨基酸中的每一者为L-氨基酸。
在所述制剂或用途的一些实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。在其一些实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含至少15%的相对增加。
在所述制剂或用途的一些实施方案中,促进的肠屏障完整性反映以下中的至少一者:肠通透性的减小;E-钙粘蛋白(E-cadherin)表达和/或活性的增加;咬合蛋白(occludinprotein)表达和/或活性的增加;封闭蛋白-2(claudin-2protein)表达和/或功能的降低;或它们的任何组合。
在所述制剂或用途的一些实施方案中,所述制剂经配制以供通过肠内途径施用。在其一些实施方案中,所述制剂经配制以供口服施用。
在所述制剂或用途的一些实施方案中,饮料包含所述制剂。在所述制剂或用途的一些实施方案中,所述制剂以饮料的形式使用。
在所述制剂或用途的一些实施方案中,受试者为哺乳动物。在其一些实施方案中,哺乳动物为人、猫、狗、猪、马、奶牛、绵羊、野牛或山羊。在所述制剂或用途的一些实施方案中,受试者为鸟或爬行动物。在其一些实施方案中,鸟为鸡、火鸡、鸭、鹅、鹌鹑、鸽子、孔雀、鹦鹉(例如,锥尾鹦哥)、澳洲鹦鹉、凤头鹦鹉或其他驯养的鸟物种或家庭宠物鸟物种。
在所述制剂或用途的一些实施方案中,所述制剂用于在健康受试者中促进水化。
在所述制剂或用途的一些实施方案中,所述制剂用于在有需要的受试者中治疗与脱水相关的疾病或障碍。
在所述制剂或用途的一些实施方案中,所述制剂用于制备供在健康受试者中促进水化或供在有需要的受试者中治疗与脱水相关的疾病或障碍的药物。
在所述制剂或用途的一些实施方案中,所述制剂用于在健康受试者中促进水化或在有需要的受试者中治疗与脱水相关的疾病或障碍的方法中。
在所述制剂、用途、药物或方法的一些实施方案中,与脱水相关的疾病或障碍包含发烧、水肿、失禁或肾衰竭或它们的任何组合中的至少一者。
在一些实施方案中,提供了用于在有需要的受试者中促进水化的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;并且其中所述治疗有效的游离氨基酸组合足以在受试者中促进水化。在所述制剂或用途的一些实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其一些实施方案中,所述制剂处于溶液中。在所述制剂或用途的一些实施方案中,所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸;以及治疗有效量的游离氨基酸异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者。在所述制剂或用途的一些实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。
在一些实施方案中,提供了用于在有需要的受试者中促进水化的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;以及治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;并且其中所述治疗有效的游离氨基酸组合足以在受试者中促进水化。在所述制剂或用途的一些实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其一些实施方案中,所述制剂处于溶液中。在所述制剂或用途的一些实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;其中天冬氨酸的浓度在17mM至20mM的范围内;其中天冬氨酸的浓度在18mM至19mM的范围内;其中天冬氨酸的浓度在20mM至30mM的范围内;其中天冬氨酸的浓度在25mM至30mM的范围内;其中天冬氨酸的浓度在27mM至30mM的范围内;或者其中天冬氨酸的浓度在28mM至29mM的范围内。在所述制剂或用途的一些实施方案中,所述制剂还包含至少一种盐。
在一些实施方案中,提供了一种治疗性制剂,其包含:治疗有效的游离氨基酸组合,其中所述游离氨基酸基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;其中游离氨基酸天冬氨酸的总重量百分比在所述游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合。在所述制剂的一些实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。在所述制剂的一些实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。在所述制剂的一些实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其一些实施方案中,所述制剂处于溶液中。在所述制剂的一些实施方案中,所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其一些实施方案中;可忽略量的赖氨酸为小于1mM,可忽略量的甘氨酸为小于0.5mM,和/或可忽略量的甘氨酸为小于0.5mM。在所述制剂的一些实施方案中,游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。在所述制剂的一些实施方案中,所述制剂还包含至少一种盐。
在一些实施方案中,本文所述的氨基酸制剂用于在健康受试者中促进水化。此类受试者可能例如从事会降低水化水平的体力活动。此类健康受试者可以是任何年龄。例如,对于人,健康受试者可以是婴儿、儿童、成人或老年人(例如,65岁或以上)。
在一些实施方案中,本文所述的氨基酸制剂用于在有需要的受试者中治疗与脱水相关的疾病或障碍。示例性的此类与脱水相关的疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);和失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在一些实施方案中,本文所述的氨基酸制剂用于制备供在有需要的受试者中治疗与脱水相关的疾病或障碍的药物。示例性的此类与脱水相关的疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);和失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在一些实施方案中,本文所述的氨基酸制剂用于在有需要的受试者中治疗与脱水相关的疾病或障碍的方法。示例性的此类与脱水相关的疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);和失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在一些实施方案中,受试者已诊断患有与脱水相关的疾病或障碍。在一些实施方案中,所述人或其他哺乳动物为老年受试者(例如,70岁或以上的人)。在一些实施方案中,相对于护理老年受试者的医师所建议的推荐摄入量或医疗机构设定的标准,老年受试者可能表现出降低的流体摄入量。在一些实施方案中,受试者已诊断患有与脱水相关的疾病或障碍,包括但不限于:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);和失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在一些实施方案中,所述制剂中所存在的游离氨基酸中的每一者的浓度在0.1mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸、缬氨酸、异亮氨酸和苏氨酸中的每一者的浓度在5mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸和缬氨酸中的每一者的浓度在8mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸和丝氨酸中的每一者的浓度在10mM至30mM的范围内。
在一些实施方案中,pH在2.0至8.0、2.5至8.0、3.0至8.0、3.5至8.0、4.0至8.0、4.5至8.0、5.0至8.0、5.5至8.0、6.0至8.0、6.5至8.0、7.0至8.0、7.5至8.0、2.0至3.0、2.5至4.0;3.0至4.0;3.3至3.8的范围内,或者为约2.5、2.6、2.9、3.4或3.8。
设想了单独描述的实施方案的所有组合。
附图说明
本文仅以举例的方式,参照附图描述本公开的一些实施方案。现在具体详细参考附图,应强调,所示实施方案是以举例的方式并且是出于对本公开实施方案的说明性论述的目的。就这一点而言,结合附图进行的描述使得对于本领域技术人员而言如何实践本公开的实施方案是显而易见的。
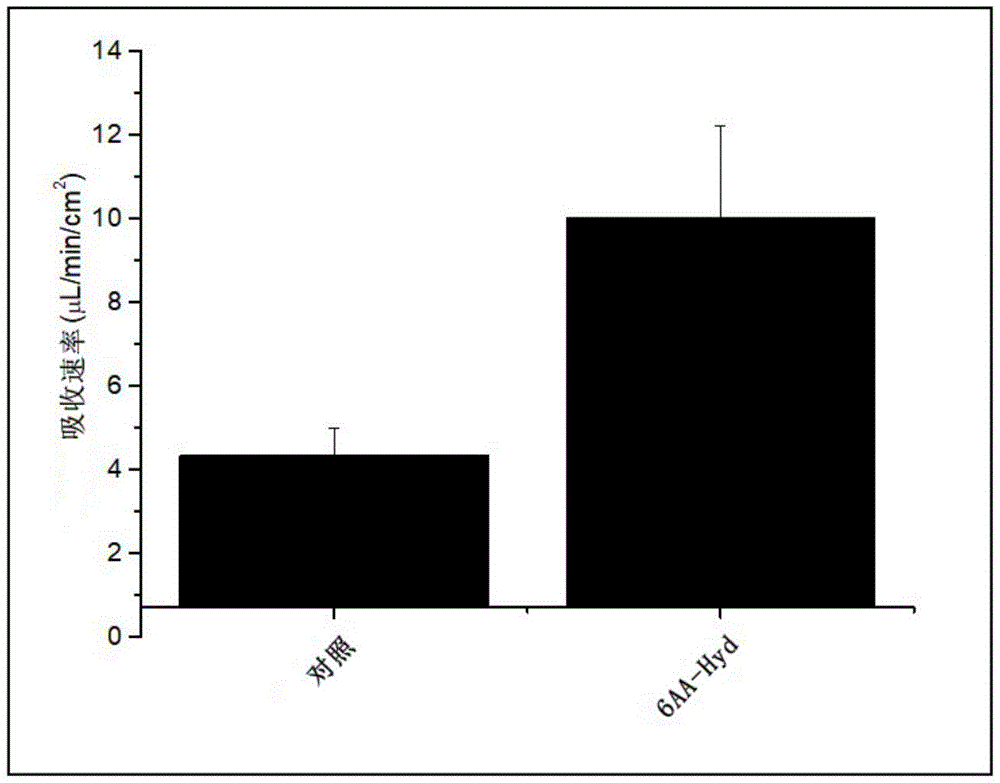
图1:使用大鼠单向肠灌流测定法在15-90分钟温育时间下测定的吸收速率。对照(含17mM Na的林格氏盐水);6AA-水化(“6AA-Hyd”;具有酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸的含17mM Na的林格氏盐水)。对照与6AA-Hyd之间观察到的差异在统计学上是显著的,如P<0.05反映的。
图2:使用大鼠单向肠灌流测定法在105-180分钟温育时间下测定的吸收速率。对照(含17mM Na的林格氏盐水);6AA-Hyd。对照与6AA-Hyd之间观察到的差异在统计学上是显著的,如P<0.05反映的。
图3A和图3B:使用大鼠单向肠灌流测定法在15-90分钟温育时间(图3A)或105-180分钟温育时间(图3B)下测定的吸收速率。对照(含17mM Na的林格氏盐水);6AA-Hyd;和8AA(具有赖氨酸、天冬氨酸、甘氨酸、异亮氨酸、苏氨酸、酪氨酸、缬氨酸和丝氨酸的含17mM Na的林格氏盐水)。对照与6AA-Hyd和8AA中的每一者之间观察到的吸收速率差异在统计学上是显著的。在15-90分钟温育时间或105-180分钟温育时间下6AA-Hyd与8AA之间观察到的吸收速率差异在统计学上是显著的。
图4:与6AA-Hyd的单种氨基酸相关的净钠(Na)吸收。对照与所示氨基酸中的每一者之间观察到的差异在统计学上是显著的。
图5:使用大鼠单向肠灌流测定法在15-90分钟温育时间下测定的吸收速率。对照(不含游离氨基酸的制剂);5mM天冬氨酸(Asp);10mM Asp;20mM Asp;30mM Asp;和40mMAsp。5mM、10mM、20mM、30mM和40mM Asp制剂中的每一者均包含6AA-Hyd的所有六种氨基酸;在5mM、10mM、20mM、30mM和40mM Asp制剂中,Asp与丝氨酸的比率是恒定的;在5mM、10mM、20mM、30mM和40mM Asp制剂中,Asp与缬氨酸的比率是恒定的;在5mM、10mM、20mM、30mM和40mM Asp制剂中,Asp与苏氨酸的比率是恒定的;在5mM、10mM、20mM、30mM和40mM Asp制剂中,Asp与酪氨酸的比率是恒定的;并且在5mM、10mM、20mM、30mM和40mM Asp制剂中Asp与异亮氨酸的比率是恒定的。缩写:平均值的标准误差(SEM);和动物数量(N)。
具体实施方式
除了已公开的那些有益效果和改善以外,根据以下结合附图进行的描述,本公开的其他目标和优点将变得显而易见。本公开的详细实施方案在本文进行了公开;然而,应当理解所公开的实施方案仅仅是本公开的示例,本公开可以以各种形式体现。另外,关于本公开的各个实施方案给出的实施例每一者旨在示例,而不是限制。
本文描述了有用于在有需要的受试者中促进水化的氨基酸制剂。本文所述的制剂和方法有用于在有需要的受试者中促进水化。在一些实施方案中,此类受试者是健康的,但是需要或想要会促进快速水化(例如,在施用后15-90分钟内)的制剂。在一些实施方案中,此类受试者患有与脱水相关的障碍或疾病。本文还涵盖本文所述的氨基酸制剂在有需要的受试者中促进水化、治疗与脱水相关的障碍或疾病以及在制备供治疗与脱水相关的障碍或疾病的药物中的用途。
本文描述了有用于在有需要的受试者中促进肠屏障功能的氨基酸制剂。本文所述的制剂和方法有用于在有需要的受试者中促进肠屏障功能。在一些实施方案中,此类受试者是健康的,但是需要或想要会促进肠屏障功能的制剂。在一些实施方案中,此类受试者患有与肠屏障功能受损相关的障碍和疾病。本文还涵盖本文所述的氨基酸制剂用于在有需要的受试者中促进肠屏障功能、用于治疗与肠屏障功能受损相关的障碍或疾病、以及在制备供治疗与肠屏障功能受损相关的障碍或疾病的药物中的用途。
屏障功能至少部分与紧密连接完整性相关。紧密连接完整性的改善与肠通透性测量值的减小、封闭蛋白-2表达的降低以及咬合蛋白和e-钙粘蛋白的增加相关。不受限制流量通路(unrestricted flux pathway)的受损上皮细胞的屏障修复也可以通过绒毛和隐窝衬里上皮细胞的改善、隐窝和绒毛形态的改善以及LGR5+干细胞增殖证明。改善的屏障功能可减少肠道内毒素,或其他抗原性物质向全身隔室的泄漏,从而减少或预防全身性炎症。
本文还包括一种在有需要的受试者中促进水化的方法,该方法包括:以用有效量向所述受试者经口施用本文所述的氨基酸制剂,所述有效量足以在所述有需要受试者中促进流体吸收。在一些实施方案中,氨基酸制剂以包含所述氨基酸制剂和任选地包含调味剂的饮料的形式施用。在一些实施方案中,此类受试者是健康的,但是需要或想要会促进快速水化(例如,在施用后15-90分钟内)的制剂。在一些实施方案中,此类受试者患有与脱水相关的障碍或疾病。
本文还涵盖用于在有需要的受试者中促进肠屏障功能的方法,该方法包括:以有效量向受试者经口施用本文所述的氨基酸制剂,所述有效量足以在所述有需要受试者中维持或促进肠屏障完整性。在一些实施方案中,氨基酸制剂以包含所述氨基酸制剂和任选地包含调味剂的饮料的形式施用。在一些实施方案中,此类受试者是健康的,但是需要或想要会促进快速水化(例如,在施用后15-90分钟内)的制剂。在一些实施方案中,此类受试者患有与脱水相关的障碍或疾病。
在一些实施方案中,“6AA-Hyd”是用于在有需要的受试者中促进水化和/或肠屏障功能的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成,其中天冬氨酸的浓度在14mM至30mM的范围内;水;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在所述受试者中促进水化或肠屏障完整性。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。在其实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。在其实施方案中,所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其实施方案中,所述治疗有效的游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。在其实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;其中天冬氨酸的浓度在17mM至20mM的范围内;其中天冬氨酸的浓度在18mM至19mM的范围内;其中天冬氨酸的浓度在20mM至30mM的范围内;其中天冬氨酸的浓度在25mM至30mM的范围内;其中天冬氨酸的浓度在27mM至30mM的范围内;或者其中天冬氨酸的浓度在28mM至29mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;或者天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内,或者它们的任何组合。在其实施方案中,该制剂还包含至少一种盐。在其实施方案中,游离氨基酸中的至少一者或者游离氨基酸中的每一者为L-氨基酸。在其实施方案中,促进的水化可通过(例如,在灌流测定法诸如本文所述的灌流测定法中或在受试者中)增加的流体吸收速率来证明。增加的速率可以相对于不含游离氨基酸的相同制剂的流体吸收速率来测定。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含至少15%的相对增加。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含15%至200%的相对增加。在其实施方案中,相对于存在对照制剂(例如,水或不含所述游离氨基酸的相同制剂)时的(例如,受试者中的)肠通透性测量值、跨膜封闭蛋白-2表达、咬合蛋白和e-钙粘蛋白这些肠屏障功能指标,促进肠屏障完整性可通过肠通透性测量值的减小、跨膜封闭蛋白-2表达的降低和/或咬合蛋白和e-钙粘蛋白的增加来证明。在其实施方案中,该制剂经配制以供通过肠内途径施用(例如,口服)。在其实施方案中,可将该制剂掺入饮料中以供饮用。合适的受试者包括任何动物,包括哺乳动物。示例性的非哺乳动物动物包括:爬行动物和驯养的鸟类(例如,鸡和火鸡)。示例性的哺乳动物包括:人、猫、狗、猪、马、奶牛、绵羊或山羊。此类受试者可能是健康的(例如,明显无疾病),或者可能患有与脱水或屏障功能受损相关的疾病或障碍。示例性的此类疾病或障碍包含:发烧、水肿、失禁或肾衰竭,或它们的任何组合。
在一些实施方案中,“6AA-Hyd”是用于在有需要的受试者中促进水化和/或肠屏障功能的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成,其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%或30%至80%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在所述受试者中促进水化或肠屏障完整性。在其实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。在其实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。在其实施方案中,该制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其实施方案中,所述治疗有效的游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。在其实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;其中天冬氨酸的浓度在17mM至20mM的范围内;其中天冬氨酸的浓度在18mM至19mM的范围内;其中天冬氨酸的浓度在20mM至30mM的范围内;其中天冬氨酸的浓度在25mM至30mM的范围内;其中天冬氨酸的浓度在27mM至30mM的范围内;或者其中天冬氨酸的浓度在28mM至29mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;或者天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内,或者它们的任何组合。在其实施方案中,该制剂还包含至少一种盐。在其实施方案中,游离氨基酸中的至少一者或者游离氨基酸中的每一者为L-氨基酸。在其实施方案中,促进的水化可通过(例如,在灌流测定法诸如本文所述的灌流测定法中或在受试者中)增加的流体吸收速率来证明。增加的速率可以相对于不含游离氨基酸的相同制剂的流体吸收速率来测定。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含至少15%的相对增加。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含15%至200%的相对增加。在其实施方案中,相对于存在对照制剂(例如,水或不含所述游离氨基酸的相同制剂)时的(例如,受试者中的)肠通透性测量值、跨膜封闭蛋白-2表达、咬合蛋白和e-钙粘蛋白这些肠屏障功能指标,促进肠屏障完整性可通过肠通透性测量值的减小、跨膜封闭蛋白-2表达的降低和/或咬合蛋白和e-钙粘蛋白的增加来证明。在其实施方案中,该制剂经配制以供通过肠内途径施用(例如,口服)。在其实施方案中,可将该制剂掺入饮料中以供饮用。合适的受试者包括任何动物,包括哺乳动物。示例性的非哺乳动物动物包括:爬行动物和驯养的鸟类(例如,鸡和火鸡)。示例性的哺乳动物包括:人、猫、狗、猪、马、奶牛、绵羊或山羊。此类受试者可能是健康的(例如,明显无疾病),或者可能患有与脱水或屏障功能受损相关的疾病或障碍。示例性的此类疾病或障碍包含:发烧、水肿、失禁或肾衰竭,或它们的任何组合。
在一些实施方案中,“6AA-Hyd”是用于在有需要的受试者中促进水化和/或肠屏障功能的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成,其中游离氨基酸天冬氨酸和游离氨基酸丝氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的50%至85%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在所述受试者中促进水化或肠屏障完整性。在其实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。在其实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。在其实施方案中,所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其实施方案中,所述治疗有效的游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。在其实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;其中天冬氨酸的浓度在17mM至20mM的范围内;其中天冬氨酸的浓度在18mM至19mM的范围内;其中天冬氨酸的浓度在20mM至30mM的范围内;其中天冬氨酸的浓度在25mM至30mM的范围内;其中天冬氨酸的浓度在27mM至30mM的范围内;或者其中天冬氨酸的浓度在28mM至29mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;或者天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内,或者它们的任何组合。在其实施方案中,该制剂还包含至少一种盐。在其实施方案中,游离氨基酸中的至少一者或者游离氨基酸中的每一者为L-氨基酸。在其实施方案中,促进的水化可通过(例如,在灌流测定法诸如本文所述的灌流测定法中或在受试者中)增加的流体吸收速率来证明。增加的速率可以相对于不含游离氨基酸的相同制剂的流体吸收速率来测定。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含至少15%的相对增加。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含15%至200%的相对增加。在其实施方案中,相对于存在对照制剂(例如,水或不含所述游离氨基酸的相同制剂)时的(例如,受试者中的)肠通透性测量值、跨膜封闭蛋白-2表达、咬合蛋白和e-钙粘蛋白这些肠屏障功能指标,促进肠屏障功能可通过肠通透性测量值的减小、跨膜封闭蛋白-2表达的降低和/或咬合蛋白和e-钙粘蛋白的增加来证明。在其实施方案中,该制剂经配制以供通过肠内途径施用(例如,口服)。在其实施方案中,可将该制剂掺入饮料中以供饮用。合适的受试者包括任何动物,包括哺乳动物。示例性的非哺乳动物动物包括:爬行动物和驯养的鸟类(例如,鸡和火鸡)。示例性的哺乳动物包括:人、猫、狗、猪、马、奶牛、绵羊或山羊。此类受试者可能是健康的(例如,明显无疾病),或者可能患有与脱水或屏障功能受损相关的疾病或障碍。示例性的此类疾病或障碍包含:发烧、水肿、失禁或肾衰竭,或它们的任何组合。
在一些实施方案中,“6AA-Hyd”是用于在有需要的受试者中促进水化和/或肠屏障功能的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成,其中游离氨基酸天冬氨酸、游离氨基酸丝氨酸和游离氨基酸缬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的60%至96%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在所述受试者中促进水化或肠屏障功能。在其实施方案中,天冬氨酸的浓度在14mM至30mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。在其实施方案中,天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。在其实施方案中,所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。在其实施方案中,所述治疗有效的游离氨基酸组合由游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成。在其实施方案中,天冬氨酸的浓度在15mM至20mM的范围内;其中天冬氨酸的浓度在17mM至20mM的范围内;其中天冬氨酸的浓度在18mM至19mM的范围内;其中天冬氨酸的浓度在20mM至30mM的范围内;其中天冬氨酸的浓度在25mM至30mM的范围内;其中天冬氨酸的浓度在27mM至30mM的范围内;或者其中天冬氨酸的浓度在28mM至29mM的范围内。在其实施方案中,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;或者天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内,或者它们的任何组合。在其实施方案中,该制剂还包含至少一种盐。在其实施方案中,游离氨基酸中的至少一者或者游离氨基酸中的每一者为L-氨基酸。在其实施方案中,促进的水化可通过(例如,在灌流测定法诸如本文所述的灌流测定法中或在受试者中)增加的流体吸收速率来证明。增加的速率可以相对于不含游离氨基酸的相同制剂的流体吸收速率来测定。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含至少15%的相对增加。在其实施方案中,相对于不含游离氨基酸的相同制剂所测定的增加的速率包含15%至200%的相对增加。在其实施方案中,相对于存在对照制剂(例如,水或不含所述游离氨基酸的相同制剂)时的(例如,受试者中的)肠通透性测量值、跨膜封闭蛋白-2表达、咬合蛋白和e-钙粘蛋白这些肠屏障功能指标,促进肠屏障功能可通过肠通透性测量值的减小、跨膜封闭蛋白-2表达的降低和/或咬合蛋白和e-钙粘蛋白的增加来证明。在其实施方案中,该制剂经配制以供通过肠内途径施用(例如,口服)。在其实施方案中,可将该制剂掺入饮料中以供饮用。合适的受试者包括任何动物,包括哺乳动物。示例性的非哺乳动物动物包括:爬行动物和驯养的鸟类(例如,鸡和火鸡)。示例性的哺乳动物包括:人、猫、狗、猪、马、奶牛、绵羊或山羊。此类受试者可能是健康的(例如,明显无疾病),或者可能患有与脱水或屏障功能受损相关的疾病或障碍。示例性的此类疾病或障碍包含:发烧、水肿、失禁或肾衰竭,或它们的任何组合。
在一些实施方案中,用于促进水化或促进肠屏障功能的制剂包含至少一种盐。在一些实施方案中,所述至少一种盐是钠盐。示例性钠盐包括例如NaCl和柠檬酸单钠、柠檬酸二钠或柠檬酸三钠。在一些实施方案中,用于促进水化的制剂包含不止一种钠盐。在一些实施方案中,该制剂包含至少0.5mM Na、至少5mM Na、至少10mM Na、至少15mM Na、至少20mMNa、至少30mM Na、至少40mM Na、至少50mM Na、至少60mM Na或至少70mM Na。在一些实施方案中,该制剂包含范围为0.5mM–50mM的Na、范围为5mM–50mM的Na、范围为10mM–50mM的Na、范围为15mM–50mM的Na、范围为20mM–50mM的Na、范围为25mM–50mM的Na、范围为30mM–50mM的Na或范围为40mM–50mM的Na。在一些实施方案中,该制剂包含范围为0.5mM–30mM的Na、范围为5mM–30mM的Na、范围为10mM–30mM的Na、范围为15mM–30mM的Na、范围为20mM–30mM的Na或范围为25mM–30mM的Na。在一些实施方案中,该制剂包含范围为0.5mM–25mM的Na、范围为5mM–25mM的Na、范围为10mM–25mM的Na、范围为15mM–25mM的Na、范围为15mM–20mM的Na或范围为20mM–25mM的Na。在一些实施方案中,该制剂包含15mM Na、16mM Na、17mM Na、18mM Na、19mMNa或20mM Na。其他示例性盐包括柠檬酸钾和柠檬酸镁。
含17mM Na的林格氏溶液包含水中的以下物质:
在一个示例性实施方案中,“6AA-Hyd”制剂包含在含17mM Na的林格氏溶液中的以下制剂,并且是用于在有需要的受试者中促进水化或肠屏障功能的制剂,其中所述制剂包含:治疗有效量的游离氨基酸组合,其中所述游离氨基酸组合基本上由酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;其中天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;其中天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中促进水化。游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内。
“8AA”制剂包含在含17mM Na的林格氏溶液中的以下制剂,并且是一种对比制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述游离氨基酸的有效组合基本上由赖氨酸、天冬氨酸、甘氨酸、异亮氨酸、苏氨酸、酪氨酸、缬氨酸和丝氨酸组成;并且其中天冬氨酸的浓度为8mM;并且其中天冬氨酸/丝氨酸的摩尔比为0.8天冬氨酸/1丝氨酸。游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的15%至16%的范围内。
基于本文给出的结果,选取6AA-Hyd作为本发明的示例性制剂,其在大鼠中进行的单向肠灌流测定法中,相对于不含游离氨基酸的相同制剂,展现出流体吸收速率实质且显著的增加,该测定法充当重演如本文所述的水化特征的模型系统。本文给出的结果简要介绍如下:
在灌流15-90分钟时,6AA-Hyd的流体吸收速率比对照溶液[对照(含17mM Na的林格氏盐水);不含游离氨基酸的相同制剂]高约1.3倍(约131%)。参见图1。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图1所给出的误差棒所反映的。
即使在灌流105-180分钟时,6AA-Hyd与对照之间持续存在显著差异。实际上,在灌流105-180分钟时,6AA-Hyd的吸收速率比对照溶液[对照(含17mM Na的林格氏盐水)]的吸收速率高约0.8倍(约83%)。参见图2。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图2所给出的误差棒所反映的。
表1:与图3A和3B中图示的灌流研究结果相关的另外的细节.
平均值的标准误差(SEM);动物数量(N)
如图3A所示,在灌流15-90分钟时,6AA-Hyd的流体吸收速率比对照溶液[对照(含17mM Na的林格氏盐水);不含游离氨基酸的相同制剂]的流体吸收速率高约0.9倍(约87%)。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图3A所给出的误差棒和所示的P值所反映的,该值被认为是非常显著的。图3A还显示在灌流15-90分钟后6AA-Hyd展现出比8AA高约0.7倍(约74%)的吸收速率;该结果在统计学上是显著的,如通过所示出的误差棒和P值所示的。
如图3B所示,在灌流105-180分钟时,6AA-Hyd的流体吸收速率比对照溶液[对照(含17mM Na的林格氏盐水);不含游离氨基酸的相同制剂]的流体吸收速率高约0.7倍(约72%)。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图3B所给出的误差棒和所示的P值所反映的,该值被认为是非常显著的。图3B还显示在灌流105-180分钟后6AA-Hyd展现出比8AA高约0.4倍(约39%)的吸收速率;该结果在统计学上是显著的,如通过所示出的误差棒和P值所示的。
钠吸收的增加(这是流体吸收的一个指标)可以通过例如测量尤斯室中的苯扎米尔/阿米洛利敏感电流来测定。增加的净钠吸收与增加的净水吸收相关,由此水响应于由例如钠-氢交换体3(NHE3)和/或氨基酸共转运建立的渗透钠梯度而穿过细胞间隙扩散到循环中。增加的钠吸收与增加的顶端膜NHE3表达和钠偶联氨基酸转运有关。如图4所示,游离氨基酸天冬氨酸、丝氨酸和缬氨酸中的每一者所赋予的净钠吸收显著高于对照溶液。
图5给出了柱状图,该图描绘了使用大鼠单向肠灌流测定法在15-90分钟温育时间下所测定的流体吸收速率。图5示出了在较高的天冬氨酸(Asp)浓度下流体吸收速率较高的趋势。在14mM至30mM Asp的范围内观察到Asp诱导的流体吸收速率峰值,如20mM Asp和30mMAsp下的最大流体吸收速率所反映的。图5还显示40mM Asp使流体吸收速率下降。这些结果表明,流体吸收速率峰值与在约14mM至30mM范围内的Asp浓度相关。
在一些实施方案中,6AA-Hyd中存在的游离氨基酸每一者的浓度在0.1mM至30mM或0.5mM至30mM的范围内。在一些实施方案中,所述制剂中存在的游离氨基酸每一者的浓度在0.1mM至20mM或0.5mM至20mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸、缬氨酸、异亮氨酸和苏氨酸中的每一者的浓度在5mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸和缬氨酸中的每一者的浓度在8mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸和丝氨酸中的每一者的浓度在10mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸和丝氨酸中的每一者的浓度在10mM至20mM的范围内。
在一些实施方案中,6AA-Hyd的pH在2.0至8.0、2.5至8.0、3.0至8.0、3.5至8.0、4.0至8.0、4.5至8.0、5.0至8.0、5.5至8.0、6.0至8.0、6.5至8.0、7.0至8.0、7.5至8.0、2.0至3.0、2.5至4.0;3.0至4.0;3.3至3.8的范围内,或者为约2.5、2.6、2.9、3.4或3.8。
如本文所用,短语“增加的流体吸收速率”可用于指使用大鼠单向肠灌流测定法测量,流体吸收速率增加5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%、200%、300%、400%或500%,其中增加的速率是相对于不含游离氨基酸的相同制剂测定的并且其中增加的速率可以在灌流15-90分钟时测定。
如本文所用,短语“增加的流体吸收速率”可用于指使用大鼠单向肠灌流测定法测量,流体吸收速率增加一倍、两倍、三倍、四倍、五倍、六倍、七倍、八倍、九倍、十倍、十五倍、二十倍、三十倍、四十倍或五十倍,其中增加的速率是相对于不含游离氨基酸的相同制剂测定的并且其中增加的速率可以在灌流15-90分钟时测定。
如本文所用,短语“促进水化”可用于反映使用大鼠单向肠灌流测定法测量,流体吸收速率增加5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%、200%、300%、400%或500%,其中增加的速率是相对于不含游离氨基酸的相同制剂测定的并且其中增加的速率可以在灌流15-90分钟时测定。
如本文所用,短语“促进水化”可用于反映使用大鼠单向肠灌流测定法测量,流体吸收速率增加一倍、两倍、三倍、四倍、五倍、六倍、七倍、八倍、九倍、十倍、十五倍、二十倍、三十倍、四十倍或五十倍,其中增加的速率是相对于不含游离氨基酸的相同制剂测定的并且其中增加的速率可以在灌流15-90分钟时测定。
如本文所用,术语“健康受试者”可用于指未诊断患有急性医学病症的受试者。在一些实施方案中,健康受试者是健康的人。健康的人可涵盖,例如,任何级别和/或年龄(从业余到专业)的运动员、军人、老年人(例如,65岁或以上的人)或暴露于不利条件(诸如极端高温)的工人,他们希望维持或恢复水化水平和/或维持或恢复肠屏障功能。
如本文所述,流体吸收或流体吸收速率的增加可通过例如在大鼠单向肠灌流测定法中测量流体摄入来测定。钠吸收的增加(这是流体吸收的一个指标)可以通过例如测量尤斯室中的苯扎米尔/阿米洛利敏感电流来测定。
基于本文给出的结果,选取6AA-Hyd作为示例性制剂,其在本文所述的模型系统(其中肠流体吸收可定量)中相对于对照溶液(不含游离氨基酸的相同制剂)展现出实质和显著的流体吸收速率增加。
如本文所述,本文所述的制剂可以是粉末形式或液体形式。因此,在一些实施方案中,本文所述的制剂可以是粉末制剂或液体制剂。
本发明人已建立了一种模型系统,在该系统中评价哺乳动物肠道环境中的净流体吸收速率。更具体地讲,已发展了供肠腔灌流的麻醉大鼠模型(大鼠单向肠灌流测定法),其可用于定量肠流体吸收,特别是流体吸收速率。检测和定量快速流体吸收速率的能力在评价再水化溶液(诸如,例如6AA-Hyd)的情况下是有用的,至少是因为快速流体吸收速率是再水化溶液的理想特征。当为了维持或恢复健康受试者的正常水化水平而饮用本文所述的这种再水化溶液时,快速的流体吸收速率(其继而导致快速的再水化)是期望的目标。或者,当为了在患有与脱水相关的疾病或障碍的受试者中维持或恢复正常的水化水平而饮用本文所述的这种再水化溶液时,快速的流体吸收速率(其继而导致快速的再水化)是期望的、甚至迫切的目标。如本文所述,测定快速再水化的一种方法是测定流体吸收速率,其可以在大鼠单向肠灌流测定法中在灌流开始后的最初15-90分钟和/或最初105-180分钟内检测到。事实上,在大鼠单向肠灌流测定法中从灌流开始后15-90分钟的时间点得出的结果与流体吸收速率最相关,流体吸收速率继而又转化为该时间段的快速再水化。
基于本文给出的结果,将6AA-Hyd选定为示例性制剂,其展现出相对于对照溶液(含17mM NaCl的林格氏溶液;不含游离氨基酸的相同制剂)快速(例如,在大鼠单向肠灌流测定法中,在灌流开始的15-90分钟内)增加肠流体吸收速率的能力,并且当与不同的氨基酸制剂(例如8AA)相比时展现出统计学上显著的肠流体吸收速率增加。在例如图3A-3B中示出了6AA-Hyd相对于8AA在灌流15-90分钟或105-180分钟时增加肠流体吸收速率的能力方面的优势。
如本文所述,肠流体吸收速率的快速增加可通过例如在大鼠单向肠灌流测定法中在灌流15-90分钟和/或灌流105-180分钟内测量流体吸收来测定。可将在例如灌流15-90分钟内对特定制剂进行的定量测量与在相同灌流时间范围内测量的对照溶液(例如,含17mMNaCl的林格氏溶液;不含游离氨基酸的相同制剂)的流体吸收进行比较,以测定相对于对照溶液的百分比增加。参见例如,图1、图2、图3A和图3B。还可以将对特定制剂进行的定量测量与例如在灌流15-90分钟和/或灌流105-180分钟内测量的测试制剂的流体吸收速率进行比较以作为相对比较,以鉴别对于增加肠流体摄取速率的能力而言具有增强的特性的制剂。还可以将针对特定制剂进行的定量测量与例如在灌流15-90分钟和/或灌流105-180分钟内测量的阳性对照制剂的流体吸收速率进行比较以作为治疗与脱水相关的疾病或障碍的效力预测的相对比较。
屏障功能:肠上皮由通过紧密连接结合在一起的单层细胞组成。肠上皮提供两个关键功能:其允许营养物质、水和离子的通过和吸收;并且其形成了一个高度调节的屏障,该屏障将身体与有害的管腔内容物(诸如毒素、微生物和抗原)分隔开。此外,诸如非甾体抗炎药(NSAID)、运动和照射之类的应激原可导致局部和全身炎症应答发生的暂时“开窗期”机会。通过维持和/或恢复肠上皮屏障的功能,选择性渗透的严格标准得以保持,并最小化或防止肠上皮的病理渗漏及穿过肠上皮的浸润。
紧密连接实质地帮助维持完整上皮细胞的屏障功能。紧密连接包含跨膜蛋白、胞质蛋白、细胞骨架蛋白和调节蛋白的复杂网络。两种不同的途径(称为孔和漏孔)调节完整上皮细胞的细胞旁路流量。在溃疡或剥脱的上皮细胞中,不受限流量通路占主导地位。肠上皮屏障功能降低与某些胃肠疾病[例如炎性肠病(IBD)]和全身性疾病(例如移植物抗宿主病)相关,但缺少其他诱因时不足以引起疾病。来自实验性结肠炎(IBD的一种)小鼠模型的实验证据表明,细胞旁通透性的增加会加速实验性结肠炎,并且紧密连接屏障功能的保存会延缓疾病进展。目前没有可用的专门调节上皮屏障功能的疗法。因此,本文所述的维持和/或恢复屏障功能的氨基酸制剂可用于未满足的治疗需求。
紧密连接的完整性实质地有助于屏障功能,紧密连接完整性的改善与肠通透性测量值的减小相关。粘附连接和桥粒提供维持细胞间相互作用所必需的粘附力。钙粘蛋白(其为单次跨膜蛋白,与相邻细胞上的钙粘蛋白的胞外部分发生同型相互作用)是粘附连接的组成部分。钙粘蛋白与胞质蛋白p120连环蛋白和β-连环蛋白直接相互作用,p120连环蛋白和β-连环蛋白继而与α-连环蛋白相互作用。α-连环蛋白调节连接周围的肌动蛋白的组装,从而强化蛋白质-蛋白质的相互作用。此外,粘附连接是高效紧密连接组装所必需的,这一功能在体外研究中归因于上皮钙粘蛋白(E-钙粘蛋白)和α-连环蛋白二者。事实上,E-钙粘蛋白和咬合蛋白的增加可以被视为紧密连接完整性的恢复或改善的指示。隐窝和绒毛形态的改善以及LGR5+干细胞增殖也是受损上皮细胞屏障修复和不受限流量通路缩减的积极指标。紧密连接完整性也与封闭蛋白-2表达和功能的降低相关。因此,肠通透性减小、E-钙粘蛋白表达和/或活性增加、咬合蛋白表达或活性增加、封闭蛋白-2表达或功能降低、或它们的任何组合中的至少一项所指示的紧密连接完整性的改善提供了本文所述氨基酸制剂所赋予的治疗功效的积极指标。这种增加和降低可以是相对于阴性对照(诸如,例如,水或在其中制备所述氨基酸制剂但不含所述游离氨基酸的相同溶液)来测定。
如本文所用,术语“肠屏障功能”是指肠粘膜的特性,其确保抗原性管腔内容物充分封围在肠腔内,从而防止这些有害管腔内容物转移到全身隔室,同时保存吸收营养的能力并执行胃肠粘膜的功能。该术语也可用于指肠上皮的单细胞层展现出选择性渗透功能的能力(即,使不期望的管腔内容物充分封围在肠内同时保存吸收营养的能力)。
如本文所用,术语“肠屏障完整性”是指使抗原性管腔内容物充分封围在肠腔内,从而防止这些有害管腔内容物转移到全身隔室。该术语也可用于指肠屏障功能被恰当维持到的程度。
在整篇说明书和权利要求书中,下文的术语取在本文中与之明确相关的含义,除非上下文另有明确说明。本文所用的短语“在一个实施方案中”、“在实施方案中”和“在一些实施方案中”不一定指相同的实施方案,但其可以指相同的实施方案。此外,本文所用的短语“在另一个实施方案中”和“在一些另外的实施方案中”不一定指不同的实施方案,但其可以指不同的实施方案。本公开的所有实施方案旨在是可组合的,而不脱离本公开的范围或精神。
如本文所用,术语“基于”不是排他性的,并允许是基于未描述的另外的因素,除非上下文另有明确说明。此外,在整篇说明书中,“一”、“一个(种)”和“所述”包括多个指代物。“在……中”的含义包括“在……中”和“在……上”。
“有效量”或“有效剂量”的药剂(或含有此类药剂的组合物)是指例如,当根据所选的施用形式、途径和/或时间表递送至细胞或生物体时,足以实现所需的生物学和/或药理学效果的量。短语“有效量”和“治疗有效量”可互换使用。如本领域普通技术人员将理解的,有效的特定药剂或组合物的绝对量可根据诸如期望的生物学或药理学终点、待递送的药剂、靶组织等之类的因素而变化。本领域普通技术人员还将理解,在各个实施方案中,“有效量”可与细胞接触或以单剂量或通过使用多剂量施用给受试者。在一些实施方案中,有效量是在细胞中增加流体吸收速率的量。在一些实施方案中,有效量是通过在有需要的受试者快速增加流体吸收速率来促进水化的量。在一些实施方案中,有效量是通过在受试者中快速增加流体吸收速率来减少与脱水相关的疾病或障碍的症状和/或治疗该疾病或障碍的量。
本文中在治疗受试者语境中所用的“治疗”、“处理”和类似术语是指为受试者提供医疗和/或外科管理。治疗可包括但不限于向受试者施用药剂或组合物(例如药物组合物)。如本文所用,术语“治疗”或其任何语法变体(例如,治疗、进行治疗等)包括但不限于缓解疾病或病症的症状;和/或减少、阻止、抑制、减轻或影响疾病或病症的进展、严重程度和/或范围。
治疗的效果还可以包括减少疾病或疾病的一种或多种症状或表现的发生或复发的可能性。可向患有疾病的受试者或相对于普通群体的成员具有增加的发展疾病风险的受试者施用治疗剂。在一些实施方案中,可向已经患有疾病但不再显示该疾病证据的受试者施用治疗剂。可以施用该药剂,例如,以降低疾病复发的可能性。可以预防性地,即在疾病的任何症状或表现出现之前施用治疗剂。
“预防性治疗”是指为未发展疾病或未显示疾病证据的受试者提供医疗和/或外科管理,以便例如,降低疾病将会发生的可能性或降低疾病发生时疾病原本的严重程度。受试者可能已被确定为有发展该疾病的风险(例如,相对于普通群体风险增加,或因为具有增加发展该疾病可能性的风险因素)。
如本文所用,术语“改善”或其任何语法变体(例如,改善、进行改善等)包括但不限于延迟发病或降低疾病或病症(例如,与脱水或其并发症相关的疾病或障碍)的严重程度。如本文所用,改善不需要完全没有症状。
术语“病症”、“疾病”和“障碍”可以互换使用。
在各种实施方案中,“受试者”可以是任何脊椎动物生物体。受试者可以是药剂所施用的个体,例如用于实验、诊断和/或治疗目的,或从其获得样品或对其进行手术。在一些实施方案中,受试者是哺乳动物,例如人;非人灵长类动物(例如猿、黑猩猩、猩猩、猴);驯养的动物诸如狗、猫、兔、牛、阉牛、马、猪、绵羊、山羊、鸡、火鸡、美洲驼、小鼠和大鼠。在一些实施方案中,受试者为人。人可以是任何一种性别且可以处于任何发育阶段。在一些实施方案中,受试者暴露于会导致过度出汗的气候条件(例如,酷热),过度出汗可继而导致不同程度的脱水。
在一些实施方案中,受试者已诊断患有与脱水相关的疾病或障碍。在一些实施方案中,所述人或其他哺乳动物为老年受试者(例如,70岁或以上的人)。在一些实施方案中,相对于护理老年受试者的医师所建议的推荐摄入量或医疗机构设定的标准,老年受试者可能展现出降低的流体摄入量。在一些实施方案中,受试者已诊断患有与脱水相关的疾病或障碍,包括但不限于:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在腹膜炎时所观察到的);失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
所谓“可忽略的量”,其意指在例如大鼠单向肠道灌注中,所存在的氨基酸不会快速增加流体吸收速率。或者,在一些实施方案中,即使氨基酸存在于制剂中,但它的存在量也不会影响在例如大鼠单向肠灌流中的流体吸收速率或者治疗有需要的受试者的治疗效果。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于100mg/l、50mg/l、10mg/l、5mg/l、1mg/l、0.5mg/l、0.1mg/l或0.01mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于100mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于50mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于10mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于5mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于1mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于0.5mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于0.1mg/l的量。在一些实施方案中,可忽略的量为其中氨基酸的总浓度小于0.01mg/l的量。
在一些实施方案中,可忽略量的赖氨酸为小于1mM,可忽略量的甘氨酸为小于0.5mM,和/或可忽略量的甘氨酸为小于0.5mM。
术语“氨基酸”涵盖包含胺(-NH
如本文所用,术语“盐”是指任何及所有的盐,并且涵盖药学上可接受的盐。
术语“载体”可以指与本文所述制剂一起施用的任何稀释剂、辅剂、赋形剂或溶媒。合适的药物载体的实例描述于Remington’s Essentials of Pharmaceuticals,第21版,编辑Felton,2012年中,其以引用的方式并入本文。
用于包含在本文所述制剂中的示例性盐包括氯化钠、氯化钾、氯化钙、氯化镁、柠檬酸三钠、碳酸氢钠、使用磷酸一钠、磷酸二钠或磷酸三钠的葡萄糖酸钠磷酸盐缓冲液或它们的任何组合。
电解质是在溶液中解离并具有传导电流能力的物质。电解质是阳离子(带正电)或阴离子(带负电)。盐在溶剂(诸如,例如水)中的溶解会产生电解质溶液,因为盐的组分离子在称为溶剂化的过程中解离。例如,当氯化钠或食盐加入水中时,盐溶解并分解成其组分离子钠(Na+)和氯离子(Cl-)。如本文所用,当提及溶液中的盐时,应理解,根据盐与其组分离子之间的化学关系,术语盐与术语电解质相关。
示例性稀释剂包括碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、纤维素、微晶纤维素、高岭土、抗淀粉酶淀粉以及它们的混合物。
用于制造所提供的药物组合物的药学上可接受的赋形剂包括惰性稀释剂、分散剂和/或造粒剂、表面活性剂和/或乳化剂、崩解剂、粘合剂、防腐剂、缓冲剂、润滑剂和/或油。赋形剂诸如可可脂和栓剂蜡、着色剂、包衣剂、甜味剂、调味剂和芳香剂也可存在于组合物中。
实现有效量所需的氨基酸制剂的确切量将因受试者而异,这取决于例如受试者的物种、年龄和一般状况、副作用或障碍的严重程度、特定化合物的特性、施用方式等。有效量可以包括在单剂量(例如,单次口服剂量)或多剂量(例如,多次口服剂量)中。在一些实施方案中,当向受试者施用或者向组织或细胞施加多剂量时,所述多剂量中的任何两个剂量包括不同或基本相同量的本文所述的氨基酸组合物。在一些实施方案中,当向受试者施用或者向组织或细胞施加多个剂量时,向受试者施用多剂量或者向组织或细胞施加多剂量的频率为一天三剂、一天两剂、一天一剂、每隔一天一剂、每三天一剂、每周一剂、每两周一剂、每三周一剂或每四周一剂。在一些实施方案中,向受试者施用多剂量或者向组织或细胞施加多剂量的频率为每天一剂。在一些实施方案中,向受试者施用多剂量或者向组织或细胞施加多剂量的频率为每天两剂。在一些实施方案中,向受试者施用多剂量或者向组织或细胞施加多剂量的频率为每天三剂。在一些实施方案中,当向受试者施用或者向组织或细胞施加多剂量时,所述多剂量的第一剂与最后一剂之间的持续时间为一天、两天、四天、一周、两周、三周、一个月、两个月、三个月、四个月、六个月、九个月、一年、两年、三年、四年、五年、七年、十年、十五年、二十年或者受试者、组织或细胞的寿命。在一些实施方案中,所述多剂量的第一剂与最后一剂之间的持续时间为三个月、六个月或一年。在一些实施方案中,所述多剂量的第一剂与最后一剂之间的持续时间为受试者、组织或细胞的寿命。
在一些实施方案中,本文所述的剂量(例如,单剂量,或者多剂量的任何剂量)独立地包括0.1μg与1μg之间、0.001mg与0.01mg之间、0.01mg与0.1mg之间、0.1mg与1mg之间、1mg与3mg之间、3mg与10mg之间、10mg与30mg之间、30mg与100mg之间、100mg与300mg之间、300mg与1000mg之间、1g与10g之间、1g与15g之间或者1g与20g之间(包括以上范围的端点值)的本文所述氨基酸组合物。在一些实施方案中,本文所述的剂量独立地包括1mg与3mg之间(包括1mg和3mg)的本文所述氨基酸组合物。在一些实施方案中,本文所述的剂量独立地包括3mg与10mg之间(包括3mg和10mg)的本文所述氨基酸组合物。在一些实施方案中,本文所述的剂量独立地包括10mg与30mg之间(包括10mg和30mg)的本文所述氨基酸组合物。在一些实施方案中,本文所述的剂量独立地包括30mg与100mg之间(包括30mg和100mg)的本文所述氨基酸组合物。
本文所述的剂量范围为将所提供的药物组合物施用给成人提供指导。给例如儿童或青少年施用的量可以由医师或本领域技术人员确定,并且可能低于或等于施用给成人的量。
与脱水相关的疾病或障碍,包括但不限于:发烧[疾控中心认为,如果某人的温度等于或超过100.4°F(38℃),则他/她就是发烧];水肿,其导致流体向腹腔或器官内的流失增加(诸如在腹膜炎时所观察到的);失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在一些实施方案中,本文所述的氨基酸制剂掺入饮料中以供饮用。在一些实施方案中,将6AA-Hyd或者6AA-Hyd中6种氨基酸中的每一者或至少一者作为干粉添加至包含盐和所需调味剂的溶液并通过混合而溶解在溶液中以产生功能饮料。此类功能饮料展现出通过包含6AA-Hyd而赋予的有益特性。此类有益特性的实例包括在已饮用该功能饮料的受试者中促进水化和/或肠屏障功能的能力。简而言之,调节该溶液的体积以抵消所加入的6AA-Hyd的体积从而实现该功能饮料中六种氨基酸中每一者以及该溶液中存在的任何盐或期望的调味剂的期望最终浓度。通过减少水相对于溶液中的其他组分的量来实现体积的调节,从而调节由于添加6AA-Hyd而导致的体积变化。
在示例性实施方案中,将1-15g、1-12.5g、1-10g、1-7.5g或1-5g的6AA-Hyd添加至溶液以产生包含盐和调味剂的功能饮料。在示例性实施方案中,所生成的功能饮料具有16-30盎司(oz)的份量,并包装在合适的容器中。在示例性实施方案中,所生成的功能饮料具有20盎司的份量,并包装在合适的容器中。
功能饮料根据感官剖面(sensory profile)进行可接受性评估。感官剖面的考虑因素包括:口感、货架期、风味强度、甜度、苦味、气味和外观。可调节溶液(在其中加入6AA-Hyd以制备功能饮料)或该功能饮料的pH以匹配期望的风味属性。可将诸如芳香风味剂、掩蔽剂和/或色素之类的额外化合物掺入溶液(在其中加入6AA-Hyd以制备功能饮料)或功能饮料中,以实现期望的感官剖面目标。
本文引用的所有先前专利、出版物和测试方法均以引用的方式全文并入本文。
具体实施方式
6AA-Hyd是本文所述的示例性制剂。为了简单起见,所选氨基酸中的每一者都用以下氨基酸的标准单大写字母表示:天冬氨酸(D)、丝氨酸(S)、缬氨酸(V)、异亮氨酸(I)、苏氨酸(T)和酪氨酸(Y)。
在一些实施方案中,所述制剂包含以下物质、基本上由以下物质组成或由以下物质组成:游离氨基酸天冬氨酸(D)和丝氨酸(S)以及游离氨基酸缬氨酸(V)、异亮氨酸(I)、苏氨酸(T)或酪氨酸(Y)中的至少一者,其中天冬氨酸的浓度在14mM至30mM的范围内;并且其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。该实施方案的不同组合在如下列表1中给出:六氨基酸:D、S、V、I、T和Y;五氨基酸子集:D、S、V、I和T;D、S、V、I和Y;D、S、V、T和Y;D、S、I、T和Y;四氨基酸子集:D、S、V和I;D、S、V和T;D、S、V和Y;D、S、I和T;D、S、I和Y;D、S、T和Y;三氨基酸子集:D、S和V;D、S和I;D、S和T;D、S和Y。
因此,本文涵盖包含所选六氨基酸D、S、V、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中快速增加流体吸收(如流体吸收速率所反映的)和/或治疗与脱水相关的疾病或障碍以及用于制备供治疗与脱水相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的三氨基酸子集、四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、S、V、I、T、Y的二氨基酸子集(D、S)、三氨基酸子集、四氨基酸子集或五氨基酸子集的任何组合和D、S,V、I、T、Y。
本文还涵盖的是包含所选六氨基酸D、S、V、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中促进肠屏障功能和/或治疗与肠屏障功能受损相关的疾病或障碍以及用于制备供治疗与肠障碍功能受损相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的三氨基酸子集、四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、S、V、I、T、Y的二氨基酸子集(D、S)、三氨基酸子集、四氨基酸子集或五氨基酸子集的任何组合和D、S、V、I、T、Y。
在一些实施方案中,该制剂包含以下物质、基本上由以下物质组成或由以下物质组成:游离氨基酸天冬氨酸(D)和缬氨酸(V)以及游离氨基酸丝氨酸(S)、异亮氨酸(I)、苏氨酸(T)或酪氨酸(Y)中的至少一者;其中天冬氨酸的浓度在14mM至30mM的范围内;并且其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内。该实施方案的不同组合在如下列表2中所示:六氨基酸:D、V、S、I、T和Y;五氨基酸子集:D、V、S、I和T;D、V、S、I和Y;D、V、S、T和Y;D、V、I、T和Y;四氨基酸子集:D、V、S和I;D、V、S和T;D、V、S和Y;D、V、I和T;D、V、I和Y;D、V、T和Y;以及三氨基酸子集:D、V和S;D、V和I;D、V和T;D、V和Y。
因此,本文涵盖包含所选择的六种氨基酸D、V、S、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中快速增加流体吸收(如流体吸收速率所反映的)和/或治疗与脱水相关的疾病或障碍以及用于制备供治疗与脱水相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的三氨基酸子集、四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、V、S、I、T、Y的二氨基酸子集(D、V)、三氨基酸子集、四氨基酸子集或五氨基酸子集的任何组合和D、V、S、I、T、Y。
本文还涵盖的是包含所选择的六种氨基酸D、V、S、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中促进肠屏障功能和/或治疗与肠屏障功能受损相关的疾病或障碍以及用于制备供治疗与肠障碍功能受损相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的三氨基酸子集、四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、V、S、I、T、Y的二氨基酸子集(D、V)、三氨基酸子集、四氨基酸子集或五氨基酸子集的任何组合和D、V、S、I、T、Y。
在一些实施方案中,该制剂包含以下物质、基本上由以下物质组成或由以下物质组成:游离氨基酸天冬氨酸(D)、丝氨酸(S)和缬氨酸(V),以及任选地,游离氨基酸异亮氨酸(I)、苏氨酸(T)或酪氨酸(Y)中的至少一者;其中天冬氨酸的浓度在14mM至30mM的范围内;并且其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内。该实施方案的不同组合在如下列表3中所示:六氨基酸:D、S、V、I、T和Y;五氨基酸子集:D、S、V、I和T;D、S、V、I和Y;D、S、V、T和Y;以及四氨基酸子集:D、S、V和I;D、S、V和T;D、S、V和Y。
因此,本文涵盖包含所选择的六种氨基酸D、S、V、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中快速增加流体吸收(如流体吸收速率所反映的)和/或治疗与脱水相关的疾病或障碍以及用于制备供治疗与脱水相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、S、V、I、T、Y的三氨基酸子集(D、S、V)、四氨基酸子集或五氨基酸子集的任何组合和D、S、V、I、T、Y。
本文还涵盖的是包含所选择的六种氨基酸D、S、V、I、T、Y及其子集的制剂(例如,药物制剂)及其用于在有需要的受试者中促进肠屏障功能和/或治疗与肠屏障功能受损相关的疾病或障碍以及用于制备供治疗与肠障碍功能受损相关的疾病或障碍的药物的用途,所述子集包含所选六氨基酸的四氨基酸子集或五氨基酸子集。上述推理同样适用于本文所述的所选六氨基酸D、S、V、I、T、Y的三氨基酸子集(D、S、V)、四氨基酸子集或五氨基酸子集的任何组合和D、S、V、I、T、Y。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸、基本上由其组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸、基本上由其组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸、基本上由其组成或由其组成:其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;和水;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸、基本上由其组成或由其组成;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;和水;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;和治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;以及治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;以及治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成或由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;和治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或水或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进流体吸收,从而促进水化。在其实施方案中,促进的流体吸收反映受试者中增加的流体吸收速率,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
在一些实施方案中,本文所述的示例性制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成或由其组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;以及任选地,至少一种药学上可接受的载体、缓冲剂、电解质、辅剂、赋形剂或它们的任何组合;其中所述治疗有效的游离氨基酸组合足以在受试者中促进肠屏障完整性,从而促进肠屏障功能。在其实施方案中,促进的肠屏障完整性反映受试者中以下中的至少一者:肠通透性的减小;E-钙粘蛋白表达和/或活性的增加;咬合蛋白表达和/或活性的增加;封闭蛋白-2表达和/或功能的降低;或者它们的任何组合,其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实验方案中使用的并且本文给出了结果的对照溶液包括:对照(含17mM Na的林格氏盐水)。含17mM NaCl的林格氏盐水也充当对照溶液,向其中添加6AA-Hyd的6种选定氨基酸(天冬氨酸、丝氨酸、缬氨酸、苏氨酸、异亮氨酸和酪氨酸)或8AA的8种选定氨基酸(天冬氨酸、丝氨酸、缬氨酸,苏氨酸、异亮氨酸、酪氨酸、赖氨酸和甘氨酸)以分别生成6AA-Hyd和8AA。8AA(天冬氨酸、丝氨酸、缬氨酸、苏氨酸、异亮氨酸、酪氨酸、赖氨酸和甘氨酸)充当实验方案中采用的阳性对比溶液。在本文给出的研究中8AA用作阳性对比物,因为其促进钠吸收和流体摄入。
在一些实施方案中,本文所述的制剂可任选包含单糖葡萄糖、至少一种含葡萄糖的二糖或它们的任何组合,其中单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合的总浓度大于0mM且小于200mM;大于0mM且小于190mM;大于0mM且小于180mM;大于0mM且小于170mM;大于0mM且小于160mM;大于0mM且小于150mM;大于0mM且小于140mM;大于0mM且小于130mM;大于0mM且小于120mM;大于0mM且小于110mM;大于0mM且小于100mM;或者大于0mM且小于90mM。在其实施方案中,单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于85mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于80mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于75mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于70mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于65mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于60mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于55mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于50mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于45mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于40mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于35mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于30mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于25mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于20mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于15mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于10mM;单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合大于0mM且小于5mM。
在其一些实施方案中,单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合在10-90mM的范围内;在10-85mM的范围内;在10-80mM的范围内;在10-75mM的范围内;在10-70mM的范围内;在10-65mM的范围内;在10-60mM的范围内;在10-55mM的范围内;在10-50mM的范围内;在10-45mM的范围内;在10-40mM的范围内;在10-35mM的范围内;在10-30mM的范围内;在10-25mM的范围内;在10-20mM的范围内;在5-90mM的范围内;在5-85mM的范围内;在5-80mM的范围内;在5-75mM的范围内;在5-70mM的范围内;在5-65mM的范围内;在5-60mM的范围内;在5-55mM的范围内;在5-50mM的范围内;在5-45mM的范围内;在5-40mM的范围内;在5-35mM的范围内;在5-30mM的范围内;在5-25mM的范围内;在5-20mM的范围内;在1-90mM的范围内;在1-85mM的范围内;在1-80mM的范围内;在1-75mM的范围内;在1-70mM的范围内;在1-65mM的范围内;在1-60mM的范围内;在1-55mM的范围内;在1-50mM的范围内;在1-45mM的范围内;在1-40mM的范围内;在1-35mM的范围内;在1-30mM的范围内;在1-25mM的范围内;或在1-20mM的范围内。
在一些实施方案中,所述治疗性组合物不含有任何糖,包括任何单糖、二糖、寡糖、多糖和碳水化合物。在一些实施方案中,所述治疗性组合物不含葡萄糖和/或可水解成葡萄糖的任何二糖、寡糖、多糖和碳水化合物。在一些实施方案中,所述组合物不含乳糖。在一些实施方案中,所述治疗性组合物不含果糖和/或半乳糖,和/或可水解成果糖和/或半乳糖的二糖、寡糖、多糖和碳水化合物。
本文所用的术语“基本上由……组成”将成分和步骤的范围限制在指定的材料或步骤以及不实质影响本发明(例如,制剂或组合物及其用于促进快速水化和/或用于治疗与脱水相关的障碍的用途以及用于治疗与脱水相关的障碍的方法)的基本特征和新颖特征的那些材料或步骤。例如,通过使用“基本上由……组成”,治疗性组合物不含权利要求中未明确提到的任何成分,包括但不限于游离氨基酸、二肽、寡肽或多肽或蛋白质;以及对促进快速水化和/或对治疗与脱水相关的障碍以及治疗与脱水相关的障碍的方法具有直接影响的单糖、二糖、寡糖、多糖和碳水化合物。在“基本上由……组成”的背景中,可以基于使用大鼠单向肠灌流测定法在15-90分钟温育时间时测定的流体吸收的快速变化来确定直接影响,其中贡献至多1%、2%、3%、4%或5%的增加或减少的成分的存在不实质影响本文所述制剂或组合物的基本特征和新颖特征,因而可落入术语“基本上由……组成”的范围内。
小肠吸收速率的变化可以通过例如使用大鼠单向肠灌流测定法来测定,如本文的“材料和方法”部分所示。
在一些实施方案中,设想了一种用于在有需要的受试者中促进水化的制剂,其中该制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收,如通过增加的流体吸收速率所反映的,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定;以及任选地包含水。在所述制剂的一些实施方案中,天冬氨酸的浓度在14mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM;或者天冬氨酸的浓度在28mM至29mM的范围内。在所述制剂的一些实施方案中,天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比为约35.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.0天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约17.5天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约15.3天冬氨酸/1酪氨酸;或者天冬氨酸/酪氨酸的摩尔比为约11.7天冬氨酸/1酪氨酸。
本文在下面按数字排序列出了一些实施方案:
实施方案1-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,
其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;以及任选地包含水;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案2-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和丝氨酸;和治疗有效量的游离氨基酸缬氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;以及水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案3-根据实施方案1-2中任一项的制剂,其中天冬氨酸的浓度在15mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM的范围内;或者天冬氨酸的浓度在28mM至29mM的范围内。
实施方案4-根据实施方案1-3中任一项的制剂,其中天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量百分比。
实施方案5–根据实施方案1-4中任一项的制剂,其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.0天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.9天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;该摩尔比为约2.8天冬氨酸/1丝氨酸;该摩尔比为约0.9天冬氨酸/1丝氨酸;该摩尔比为约1.8天冬氨酸/1丝氨酸;或者该摩尔比为约1.2天冬氨酸/1丝氨酸。
实施方案6–根据实施方案1-5中任一项的制剂,其中当存在缬氨酸时,天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.5天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至1.9天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.5天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.1天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比为约3.8天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约1.4天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约3.2天冬氨酸/1缬氨酸;或者天冬氨酸/缬氨酸的摩尔比为约2天冬氨酸/1缬氨酸。
实施方案7–根据实施方案1-6中任一项的制剂,其中当存在异亮氨酸时,天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.9天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.8天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.7天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.6天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.5天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比为约5.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约1.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约4.4天冬氨酸/1异亮氨酸;或者天冬氨酸/异亮氨酸的摩尔比为约2.8天冬氨酸/1异亮氨酸。
实施方案8-根据实施方案1-7中任一项的制剂,其中当存在苏氨酸时,天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.9天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.8天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.7天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.6天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.5天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.6天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约5.5天冬氨酸/1苏氨酸;天冬氨酸/苏氨酸的摩尔比为约1.7天冬氨酸/1苏氨酸;天冬氨酸/苏氨酸的摩尔比约为4.4天冬氨酸/1苏氨酸;或者天冬氨酸/苏氨酸的摩尔比为约2.8天冬氨酸/1苏氨酸。
实施方案9–根据实施方案1-8中任一项的制剂,其中当存在酪氨酸时,天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;
天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比约为35.8天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比约为23.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比约为23.0天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约17.5天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约15.3天冬氨酸/1酪氨酸;或者天冬氨酸/酪氨酸的摩尔比为约11.7天冬氨酸/1酪氨酸。
实施方案10-根据实施方案1-9中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸组成。
实施方案11-根据实施方案1-9中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸,以及任选地,游离氨基酸异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者。
实施方案12-根据实施方案1-9或11中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、丝氨酸、缬氨酸和异亮氨酸组成;或者基本上由治疗有效量的游离氨基酸天冬氨酸、丝氨酸、缬氨酸和苏氨酸组成;以及任选地,游离氨基酸酪氨酸。
实施方案13-根据实施方案1-9或11中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、丝氨酸、缬氨酸、异亮氨酸、苏氨酸和酪氨酸组成。
实施方案14-根据实施方案1-9中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、丝氨酸和异亮氨酸;以及任选地,游离氨基酸苏氨酸或酪氨酸或它们的任何组合中的至少一者;天冬氨酸、丝氨酸和苏氨酸;以及任选地,游离氨基酸酪氨酸;天冬氨酸、丝氨酸、缬氨酸和异亮氨酸;以及任选地,游离氨基酸苏氨酸或酪氨酸或它们的任何组合中的至少一者;天冬氨酸、丝氨酸、缬氨酸和苏氨酸;以及任选地,游离氨基酸酪氨酸;天冬氨酸、丝氨酸和酪氨酸;或者天冬氨酸、丝氨酸、缬氨酸和酪氨酸。
实施方案15-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸或基本上由其组成;和任选地包含水;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案16-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合包含治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸或基本上由其组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案17-根据实施方案15-16中任一项的制剂,其中天冬氨酸的浓度在15mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM的范围内;或者天冬氨酸的浓度在28mM至29mM的范围内。
实施方案18–根据实施方案15-17中任一项的制剂,其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.0天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.9天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;该摩尔比为约2.8天冬氨酸/1丝氨酸;该摩尔比为约0.9天冬氨酸/1丝氨酸;该摩尔比为约1.8天冬氨酸/1丝氨酸;或者该摩尔比为约1.2天冬氨酸/1丝氨酸。
实施方案19–根据实施方案15-18中任一项的制剂,其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.5天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至1.9天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.5天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.1天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比为约3.8天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约1.4天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约3.2天冬氨酸/1缬氨酸;或者天冬氨酸/缬氨酸的摩尔比为约2天冬氨酸/1缬氨酸。
实施方案20–根据实施方案15-19中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、丝氨酸和缬氨酸组成。
实施方案21–一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;和治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;以及任选地包含水;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案22–一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸和缬氨酸;和治疗有效量的游离氨基酸丝氨酸、异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者;以及水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案23-根据实施方案21-22中任一项的制剂,其中天冬氨酸的浓度在15mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM的范围内;或者天冬氨酸的浓度在28mM至29mM的范围内。
实施方案24–根据实施方案21-23中任一项的制剂,其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸范围内;
天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.5天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至1.9天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.5天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.1天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比为约3.8天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约1.4天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约3.2天冬氨酸/1缬氨酸;或者天冬氨酸/缬氨酸的摩尔比为约2天冬氨酸/1缬氨酸。
实施方案25–根据实施方案21-24中任一项的制剂,其中当存在丝氨酸时,天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.0天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.9天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;该摩尔比为约2.8天冬氨酸/1丝氨酸;该摩尔比为约0.9天冬氨酸/1丝氨酸;该摩尔比为约1.8天冬氨酸/1丝氨酸;或者该摩尔比为约1.2天冬氨酸/1丝氨酸。
实施方案26–根据实施方案21-25中任一项的制剂,其中当存在异亮氨酸时,天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.9天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.8天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.7天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.6天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.5天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.8天冬氨酸/1异亮氨酸的范围内;
天冬氨酸/异亮氨酸的摩尔比为约5.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约1.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约4.4天冬氨酸/1异亮氨酸;或者天冬氨酸/异亮氨酸的摩尔比为约2.8天冬氨酸/1异亮氨酸。
实施方案27–根据实施方案21-26中任一项的制剂,其中当存在苏氨酸时,天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;
天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.9天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.8天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.7天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.6天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.5天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.6天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约5.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约4.4天冬氨酸/1苏氨酸的范围内;或者天冬氨酸/苏氨酸的摩尔比为约2.8天冬氨酸/1苏氨酸。
实施方案28–根据实施方案21-27中任一项的制剂,其中当存在酪氨酸时,天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比约为35.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比约为23.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比约为23.0天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约17.5天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约15.3天冬氨酸/1酪氨酸;或者天冬氨酸/酪氨酸的摩尔比为约11.7天冬氨酸/1酪氨酸。
实施方案29–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、缬氨酸和丝氨酸组成。
实施方案30–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、缬氨酸和丝氨酸,以及任选地,游离氨基酸异亮氨酸、苏氨酸或酪氨酸或它们的任何组合中的至少一者。
实施方案31–根据实施方案21-28或30中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸天冬氨酸、缬氨酸、丝氨酸和异亮氨酸组成;或者基本上由治疗有效量的游离氨基酸天冬氨酸、缬氨酸、丝氨酸和苏氨酸组成;以及任选地,游离氨基酸酪氨酸。
实施方案32–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、缬氨酸、丝氨酸和苏氨酸,以及任选地,游离氨基酸异亮氨酸或酪氨酸或它们的任何组合中的至少一者。
实施方案33–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、缬氨酸、丝氨酸、异亮氨酸和苏氨酸,以及任选地,游离氨基酸酪氨酸。
实施方案34–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由以下组成:治疗有效量的游离氨基酸天冬氨酸、缬氨酸和异亮氨酸;以及任选地,游离氨基酸苏氨酸或酪氨酸或它们的任何组合中的至少一者;天冬氨酸、缬氨酸和苏氨酸;以及任选地,游离氨基酸酪氨酸;或者天冬氨酸、丝氨酸、缬氨酸和酪氨酸。
实施方案35–根据实施方案21-28中任一项的制剂,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的天冬氨酸、缬氨酸、丝氨酸、异亮氨酸、苏氨酸和酪氨酸组成。
实施方案36-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;和任选地包含水;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案37–一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案38-一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;和任选地包含水;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中游离氨基酸天冬氨酸的总重量百分比在所述治疗有效的游离氨基酸组合的总重量的30%至55%的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案39–一种用于在有需要的受试者中促进水化的制剂,其中所述制剂包含:治疗有效的游离氨基酸组合,其中所述治疗有效的游离氨基酸组合基本上由治疗有效量的游离氨基酸酪氨酸、异亮氨酸、苏氨酸、缬氨酸、丝氨酸和天冬氨酸组成;和水;其中天冬氨酸的浓度在14mM至30mM的范围内;其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至0.9天冬氨酸/1丝氨酸的范围内;其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;其中所述治疗有效的游离氨基酸组合足以在所述受试者中增加流体吸收速率,从而在所述受试者中促进水化;并且其中所述增加的速率是相对于不含游离氨基酸的相同制剂测定的。
实施方案40–根据实施方案36-39中任一项的制剂,其中天冬氨酸的浓度在15mM至20mM的范围内;天冬氨酸的浓度在17mM至20mM的范围内;天冬氨酸的浓度在18mM至19mM的范围内;天冬氨酸的浓度在20mM至30mM的范围内;天冬氨酸的浓度在25mM至30mM的范围内;天冬氨酸的浓度在27mM至30mM的范围内;或者天冬氨酸的浓度在28mM至29mM的范围内。
实施方案41–根据实施方案36-40中任一项的制剂,其中天冬氨酸/丝氨酸的摩尔比在2.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在2.0天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.9天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.8天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.7天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.6天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.5天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.4天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.3天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.2天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;天冬氨酸/丝氨酸的摩尔比在1.1天冬氨酸/1丝氨酸至1天冬氨酸/1丝氨酸的范围内;该摩尔比为约2.8天冬氨酸/1丝氨酸;该摩尔比为约0.9天冬氨酸/1丝氨酸;该摩尔比为约1.8天冬氨酸/1丝氨酸;或者该摩尔比为约1.2天冬氨酸/1丝氨酸。
实施方案42–根据实施方案36-41中任一项的制剂,其中天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.8天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.4天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.5天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.6天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.7天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.6天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.5天冬氨酸/1缬氨酸至1.8天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至1.9天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在3.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.5天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.2天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比在2.1天冬氨酸/1缬氨酸至2.0天冬氨酸/1缬氨酸的范围内;天冬氨酸/缬氨酸的摩尔比为约3.8天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约1.4天冬氨酸/1缬氨酸;天冬氨酸/缬氨酸的摩尔比为约3.2天冬氨酸/1缬氨酸;或者天冬氨酸/缬氨酸的摩尔比为约2天冬氨酸/1缬氨酸。
实施方案43–根据实施方案36-42中任一项的制剂,其中天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.5天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至1.9天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在5.0天冬氨酸/1异亮氨酸至2.0天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.9天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.8天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.7天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.6天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.5天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.5天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.6天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.7天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比在4.4天冬氨酸/1异亮氨酸至2.8天冬氨酸/1异亮氨酸的范围内;天冬氨酸/异亮氨酸的摩尔比为约5.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约1.5天冬氨酸/1异亮氨酸;天冬氨酸/异亮氨酸的摩尔比为约4.4天冬氨酸/1异亮氨酸;或者天冬氨酸/异亮氨酸的摩尔比为约2.8天冬氨酸/1异亮氨酸。
实施方案44–根据实施方案36-43中任一项的制剂,其中天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.5天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至1.9天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在5.0天冬氨酸/1苏氨酸至2.0天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.9天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.8天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.7天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.6天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.5天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.5天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.6天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.7天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比在4.4天冬氨酸/1苏氨酸至2.8天冬氨酸/1苏氨酸的范围内;天冬氨酸/苏氨酸的摩尔比为约5.5天冬氨酸/1苏氨酸;
天冬氨酸/苏氨酸的摩尔比为约1.7天冬氨酸/1苏氨酸;天冬氨酸/苏氨酸的摩尔比为约4.4天冬氨酸/1苏氨酸;或天冬氨酸/苏氨酸的摩尔比为约2.8天冬氨酸/1苏氨酸。
实施方案45-根据实施方案36-44中任一项的制剂,其中天冬氨酸/酪氨酸的摩尔比在40.0天冬氨酸/1酪氨酸至9.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在36.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至10.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至15.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比在24.0天冬氨酸/1酪氨酸至20.0天冬氨酸/1酪氨酸的范围内;天冬氨酸/酪氨酸的摩尔比为约35.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.8天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约23.0天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约17.5天冬氨酸/1酪氨酸;天冬氨酸/酪氨酸的摩尔比为约15.3天冬氨酸/1酪氨酸;或者天冬氨酸/酪氨酸的摩尔比为约11.7天冬氨酸/1酪氨酸。
实施方案46–根据实施方案36-45中任一项的制剂,其中天冬氨酸和丝氨酸的总重量百分比大于缬氨酸、异亮氨酸、苏氨酸和酪氨酸的总重量比。
实施方案47–根据实施方案1-46中任一项的制剂,其中所述制剂还包含至少一种盐。
实施方案48–根据实施方案1-47中任一项的制剂,其中所述制剂还包含药学上可接受的载体、缓冲剂、辅剂或赋形剂。
实施方案49-根据实施方案1-48中任一项的制剂,其中所述制剂不包含单糖葡萄糖、至少一种含葡萄糖的二糖或它们的任何组合;或者当存在时,
单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合的总浓度大于0mM且小于200mM。
实施方案50–根据实施方案49的制剂,其中所述制剂包含:单糖葡萄糖、至少一种含葡萄糖的二糖或它们的任何组合,其中单糖葡萄糖、所述至少一种含葡萄糖的二糖或它们的任何组合的总浓度在0.01mM至200mM的范围内;在0.1mM至200mM的范围;在0.01mM至100mM的范围内;在0.1mM至100mM的范围内;在1mM至100mM的范围内;在5mM至100mM的范围内;在10mM至100mM的范围内;在25mM至100mM的范围内;在50mM至100mM的范围内;在75mM至100mM的范围内;在0.01mM至90mM的范围内;在0.1mM至90mM的范围内;在1mM至90mM的范围内;在5mM至90mM的范围内;在10mM至90mM的范围内;在25mM至90mM的范围内;在50mM至90mM的范围内;或在75mM至90mM的范围内。
实施方案51–根据实施方案1、15、21、36或38中任一项的制剂,其中所述制剂还包含水。
实施方案52–根据实施方案1-51中任一项的制剂,其中所述制剂是无菌的。
实施方案53–根据实施方案1-52中任一项的制剂,其中所述游离氨基酸中的至少一者或所述游离氨基酸中的每一种为L-氨基酸。
实施方案54–根据实施方案1-53中任一项的制剂,其中相对于不含游离氨基酸的相同制剂所测得的增加的速率包含在15%至200%的范围内的相对增加。
实施方案55–根据实施方案1-54中任一项的制剂,其中所述制剂不包含游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合;或者当存在时,游离氨基酸赖氨酸、甘氨酸或色氨酸或它们的任何组合中的每一者以可忽略的量存在。
实施方案56–根据实施方案1-55中任一项的制剂,其中所述制剂经配制以供通过肠内途径施用。
实施方案57–根据实施方案1-56中任一项的制剂,其中所述制剂经配制以供口服施用。
实施方案58–根据实施方案1-57中任一项的制剂,其中所述受试者为哺乳动物。
实施方案59–根据实施方案1-58中任一项的制剂,其中所述哺乳动物为人、猫、狗、猪、马、奶牛、绵羊或山羊。
实施方案60–根据实施方案1-59中任一项的制剂,其中所述哺乳动物为人。
实施方案61–根据实施方案1-60中任一项的制剂,其中所述制剂用于在健康受试者中促进水化。此类受试者可能例如从事会降低水化水平的体力活动。在一些实施方案中,所述人或其他哺乳动物为老年受试者(例如,70岁或以上的人)。在一些实施方案中,相对于护理老年受试者的医师所建议的推荐摄入量或医疗机构设定的标准,老年受试者可能展现出降低的流体摄入量。
实施方案62–根据实施方案1-60中任一项的制剂,其中所述制剂用于在有需要的受试者中治疗与脱水相关的疾病或障碍。与脱水相关的示例性此类疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
实施方案63–根据实施方案1-60中任一项的制剂,其中所述制剂用于制备供在有需要的受试者中治疗与脱水相关的疾病或障碍的药物。与脱水相关的示例性此类疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
实施方案64–根据实施方案1-60中任一项的制剂,其中所述制剂用于在有需要的受试者中治疗与脱水相关的疾病或障碍的方法。与脱水相关的示例性此类疾病或障碍包含:发烧;水肿,其导致流体向腹腔或器官内的流失增加(诸如在例如腹膜炎时所观察到的);失禁(尤其是在70岁或以上的人中),其通过尿生成增加而导致流体损失增加;和/或肾衰竭。
在实施方案1-64中的任一项中,所述制剂中所存在的游离氨基酸中的每一者的浓度在0.1mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸、缬氨酸、异亮氨酸和苏氨酸中的每一者的浓度在5mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸、丝氨酸和缬氨酸中的每一者的浓度在8mM至30mM的范围内。在一些实施方案中,所述制剂中所存在的游离氨基酸天冬氨酸和丝氨酸中的每一者的浓度在10mM至30mM的范围内。在一些实施方案中,pH在2.0至8.0、2.5至8.0、3.0至8.0、3.5至8.0、4.0至8.0、4.5至8.0、5.0至8.0、5.5至8.0、6.0至8.0、6.5至8.0、7.0至8.0、7.5至8.0、2.0至3.0、2.5至4.0;3.0至4.0;3.3至3.8的范围内,或者为约2.5、2.6、2.9、3.4或3.8。
上述本公开的实施方案的变型形式、修改形式和更改形式对本领域技术人员将是显而易见的。所有此类变型形式、修改形式、更改形式等均旨在落入本公开的精神和范围内,仅受所附权利要求的限制。
虽然已经描述了本公开的若干实施方案,但应该理解这些实施方案仅仅是示例性的,并不是限制性的,并且许多修改形式对本领域技术人员将是显而易见的。例如,本文所论述的所有尺寸仅作为实例提供,并且旨在是示例性的而非限制性的。
在本说明书中明确确定的任何特征或元素也可以明确排除作为权利要求中所限定的本发明的一些实施方案的特征或元素。
本文所述的公开可以在不存在本文未具体公开的任何一种或多种元素、一种或多种限制的情况下实践。已采用的术语和表达用作描述术语而非限制术语,并且在使用此类术语和表达时无意排除所示出的和所描述的特征或其部分的任何等同物,但应该认识到各种修改形式在本公开的范围内是可能的。
实施例
实施例1
大鼠单向肠灌流测定法:由于80%的电解质和流体吸收发生在小肠中,因此使用小肠模型来检查本文所述制剂的吸收速率。
方法
使Sprague-Dawley(远交系)雄性大鼠(10-12周龄,大约350-450g)在手术前禁食16小时(禁食大鼠和非禁食大鼠之间的吸收速率没有差异)。在2L/分钟氧气中用4%异氟烷诱导全身吸入麻醉,并用2%异氟烷进一步维持。在整个实验过程中,通过将大鼠放在加热垫上控制体温,如果需要,使用加热灯施加额外的热量。对腹侧腹部进行无菌准备(剪毛并消毒)并在中线/白线处通过手术打开,从腹部取出回肠和远端空肠大约3-5cm长的区段,并用2-0丝线结扎该区段的远端和近端,同时维持该肠段的持续血液供应。将一根无菌的5/3mm外径、15英寸的饲管通过系膜对向部一侧的切口放置进近端的管腔中,并将一根无菌医用级硅胶管(内径2mm)在系膜对向部一侧放置进该排空肠段的远端管腔中,并用结扎丝线固定两根管。将连接有管子的肠段移回腹部,腹壁用3-0尼龙缝合线封闭,并用纸巾作为“毯子”覆盖。将饲管连接至灌流泵,并用测试制剂以150μL/分钟的灌流速率灌流该肠段。如下每15分钟从远端管子收集一次灌流液:在0-90分钟范围内:平衡吸收速率和早期吸收速率(6份样品),以及在90-180分钟范围内:后期吸收速率(6份样品)。在整个实验过程中每15分钟监测一次直肠温度,并调整加热源以确保在整个实验期间维持至少97°F的生理体温。在最后一次采样后,采集心脏血液和肠道组织以供进一步分析。测量该肠段长度和灌流液体积,并根据灌流面积和灌流速率计算吸收速率(μL/分钟/cm
结果
在用指示的测试制剂灌流15-90分钟时,测定吸收速率。如图1所示,6AA-Hyd(含17mM Na的林格氏盐水对照溶液中的6氨基酸组合:天冬氨酸、丝氨酸、缬氨酸、苏氨酸、异亮氨酸和酪氨酸)的吸收速率比对照溶液[对照(含17mM Na的林格氏盐水)]的吸收速率高约1.3倍(约131%)。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图1中所给出的误差棒所反映的。
6AA-Hyd与对照之间的显著差异甚至在后期测定时间时仍然存在。例如,在用指示的测试制剂灌流105-180分钟时,6AA-Hyd的吸收速率比对照溶液[对照(含17mM Na的林格氏盐水)]的吸收速率高约0.8倍(约83%)。参见图2。6AA-Hyd与对照之间的吸收速率差异在统计学上是显著的,如通过例如图2中所给出的误差棒所反映的。
出于比较的目的,测定了6AA-Hyd(对照溶液中的6氨基酸组合:天冬氨酸、丝氨酸、缬氨酸、苏氨酸、异亮氨酸和酪氨酸)在灌流15-90分钟或105-180分钟后的吸收速率,并与8AA[对照溶液中包含8种氨基酸(天冬氨酸、丝氨酸、缬氨酸、苏氨酸、异亮氨酸、酪氨酸、赖氨酸和甘氨酸)的氨基酸制剂]和对照(含17mM Na的林格氏盐水)进行比较。如图3A所示,灌流15-90分钟后,6AA-Hyd展现出比8AA高约0.7倍(约74%)的吸收速率,并且表现出比对照(含17mM Na的林格氏盐水)高约0.9倍(约87%)的吸收速率。如图3B所示,灌流105-180分钟后,6AA-Hyd展现出比8AA高约0.4倍(约39%)的吸收速率,并且表现出比对照(含17mM Na的林格氏盐水)高约0.7倍(约72%)的吸收速率。
实施例2
钠(Na)吸收研究:测量净流体和电解质吸收,其中吸收过程主要发生在绒毛尖端,分泌过程发生在隐窝。对6AA-Hyd中存在的某些氨基酸进行了Na吸收研究。参见例如图4。如图4所示,天冬氨酸、丝氨酸和缬氨酸相对于对照增加了净Na吸收,如在尤斯室中测定的,该方法在下文详述。
方法
尤斯室-钠通量(通用)
将来自8周龄雄性Swiss小鼠的小肠粘膜组织(回肠和空肠)安放于容纳有等渗林格氏溶液的尤斯室中,在整个实验过程中该室用95% O
C。在让组织稳定后,记录电导(G;以mS/cm
Jnet=
(热CPM-空白)x10x0.3
[CPM=每分钟计数,CPM1=先前的样品,CPM2=后面的样品;空白=未添加
如图4所示,溶液中游离氨基酸天冬氨酸、丝氨酸和缬氨酸中的每一者所赋予的净钠吸收显著高于对照溶液。增加的净钠吸收与增加的净水吸收相关,其中水响应于由例如钠-氢交换体3(NHE3)或氨基酸共转运确立的渗透钠离子梯度而穿过细胞间隙扩散到循环中。增加的钠吸收与增加的顶端膜NHE3表达和钠偶联氨基酸转运有关。
实施例3
目的:测试包含6AA-Hyd的饮料对响应运动热应激的血浆肠脂肪酸结合蛋白(IFABP)的影响。
简要背景:运动引起的肠损伤和肠通透性是公认的现象,环境热应激和生理热应变会加剧这些现象。运动-热应激的两个自然后果包括内脏血流量减少和身体热量储存增加,这两者都与运动强度和持续时间以及对生物物理热交换的任何环境限制有关。内脏灌注不足和高温二者都会增加肠上皮损伤的标志物(例如IFABP)和肠上皮通透性的标志物(例如乳果糖-甘露醇比率,L:M)。肠损伤和通透性的间接测量值与破坏的肠紧密连接蛋白的直接测量值一致。细胞氧张力降低、细胞温度升高、细胞因子介导的炎症或这些效应的某些组合被认为促成肠损伤和通透性。旨在保护肠道(例如,减少血液中的IFABP)以及也许减轻运动-热应激对肠道最严重后果的方法仍然有限。
屏障功能至少部分与紧密连接完整性相关。紧密连接完整性的改善与肠通透性测量值的减小、跨膜封闭蛋白-2表达的降低以及咬合蛋白和e-钙粘蛋白的增加相关。不受限流量通路的受损上皮细胞的屏障修复也可以通过隐窝和绒毛形态的改善以及LGR5+干细胞增殖证明。改善的屏障功能可减少肠道内毒素泄漏和全身性炎症。
设计:
一组志愿者(例如,5名志愿者)将在一周内每天喝两瓶(474mL)含6AA-Hyd的饮料。然后,志愿者将在跑步机(TM)上以最大摄氧量的60%在35℃的环境室内跑步2小时。将在即将运动前、刚运动后以及运动后1小时和2小时采集血样。志愿者将在即将运动前饮用一瓶(237毫升)含6AA-Hyd的饮料,并在2小时的运动中每20分钟饮用一次(共7瓶,1.659升)。运动后,允许随意喝水。将为IFABP采集血液。
分析:
使用研究数据库,将运动前后IFABP的个体(例如,n=5)变化(ΔIFABP)与运动饮料试验和对照试验(水)二者观察到的ΔIFABP 95%置信区间进行比较。落入水区间内的数据将被视为负面结果。落在水区间外的数据将被视为正面结果。落在每个区间之间的数据将被认为是不明确的。
