一种琼脂硫酸钡混合液及其制备方法和应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及医学检验技术领域,尤其是涉及一种琼脂硫酸钡混合液及其制备方法和应用。
背景技术
目前随着CT技术的普及和在早期肺癌筛查中的广泛应用,肺部磨玻璃影(GGO)的检出率逐渐升高。GGO是指在高分辨率CT图像上表现为密度轻度增加,呈局灶性云雾状密度的阴影。其病理基础为肿瘤细胞沿肺泡间隔生长,肺泡壁增厚,但肺泡腔未闭塞,其内可有少量粘液或脱落的肿瘤细胞。
GGO又可分为单纯型GGO(pGGO)和混合型GGO(mGGO)。大多数pGGO为恶性程度较低的肿瘤,大多数mGGO为恶性程度高、生长速度快、淋巴结转移率高的肿瘤。对于GGO患者,特别是mGGO患者,其主要治疗方式以胸腔镜手术切除为主,但GGO手术的一个大难题是术中病灶难以扪及。(其GGO病灶与实性病灶不同,GGO病灶较小,且病灶中GGO成分保持其肺泡结构,所以其病灶较软,术中难以扪及)。目前临床上主要常见的GGO定位方式有:CT引导下钢丝引导定位、CT引导下医用胶注射定位、CT引导下亚甲蓝注射定位,以上几类定位技术都存在一些缺陷:
CT引导下钢丝引导定位:在CT引导下用一根带钩钢丝从胸壁穿刺至肺组织内GGO位置,从而达到定位目的。目前该定位技术主要存在以下并发症:患者定位后出现自发性血气胸;定位后由于患者呼吸运动导致钢丝脱落导致定位失败;钢丝定位后部钢丝留于胸壁外,增加胸壁感染风险;钢丝定位后病人需立即进行手术,局限性大;钢丝定位后由于病人呼吸运动导致位于胸壁外钢丝进入胸腔导致肺组织及周围组织损伤。
CT引导下医用胶注射定位:在CT引导下于GGO附近注射医用胶使周围肺组织硬化从而达到定位目的。目前该定位技术主要存在以下问题:注射医用胶,当医用胶外渗出肺组织后会导致肺组织与胸膜严重粘连;当医用胶注射部位离肺结节较近时,医用胶注射后会导致肺磨玻璃结节与周围组织完全粘连成一体,导致手术后无法找到肺结节;医用胶容易在肺组织中扩散,从而导致注射部位大片区域硬化。
CT引导下亚甲蓝注射定位:在CT引导下于CCO附近胸膜表面注射亚甲蓝,对表面胸膜进行标记定位。目前该定位技术主要存在以下问题:深部GGO无法定位;亚甲蓝容易扩散,导致定位准确性差;注射亚甲蓝后无法确定是否定位到相应区域;其注射部分容易出现肺部漏气及出血,导致医源性血气胸;对于长期吸烟患者,亚甲蓝显色效果不明显。
因此,本领域技术人员亟需研制一种GGO定位方式,以克服当前定位方式的缺点,实现对GGO的精准定位。
发明内容
本发明的目的之一在于提供一种琼脂硫酸钡混合液,以解决传统肺磨玻璃结节定位方式并发症多,定位准确性差,以及导致肺磨玻璃结节与周围组织完全粘连成一体从而在手术后无法找到肺结节等技术问题。
本发明提供的琼脂硫酸钡混合液包括以下组分:生理盐水50ml、琼脂1-1.5g和硫酸钡1-1.5g。
本发明的目的之二在于提供一种琼脂硫酸钡混合液的制备方法,包括以下步骤:将生理盐水、琼脂和硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却即得到琼脂硫酸钡混合液。
本发明的目的之三在于提供一种琼脂硫酸钡混合液在肺磨玻璃结节定位方面的应用。
本发明提供的琼脂硫酸钡混合液具有以下优点:1、具有较好稳定性;2、温度在42℃以上保持液态,当温度低于42℃时快速凝固成形性;3、具有良好显影性,能够在CT下明显显影;4、所形成固态凝胶较为稳定。
本发明提供的琼脂硫酸钡混合液的制备方法简单,成本较低,便于大规模生产,利于生产投放市场。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
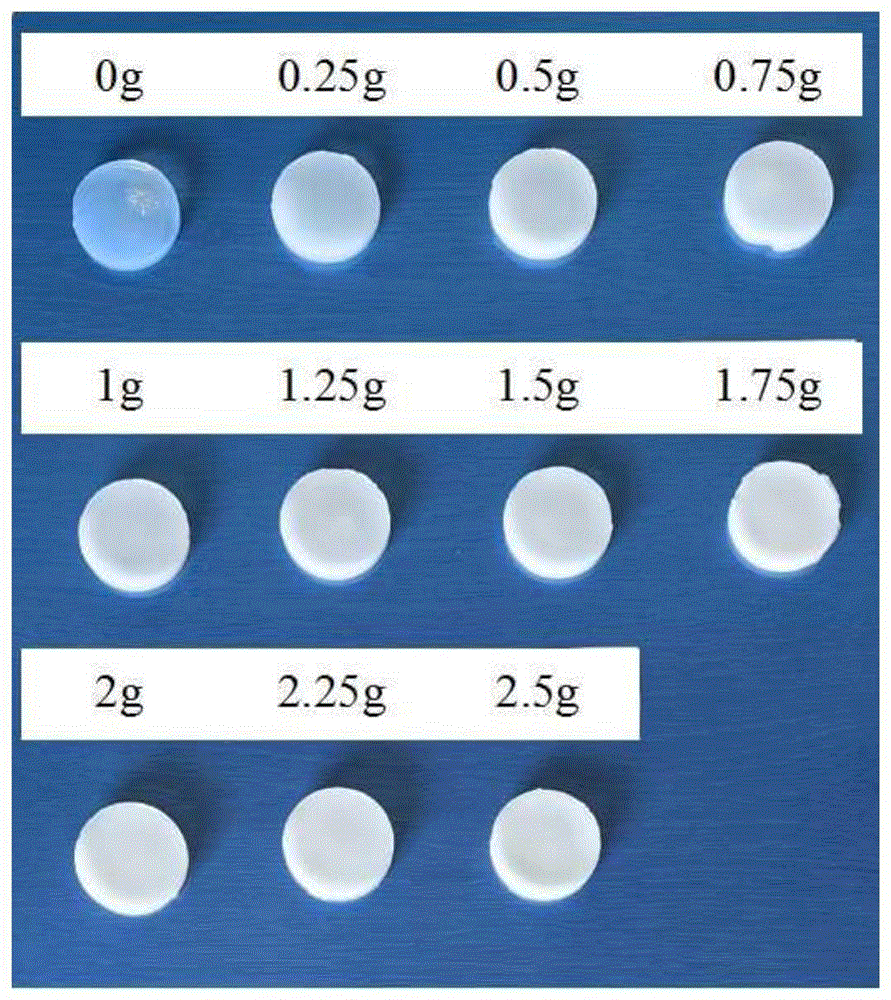
图1为不同浓度硫酸钡所制备的凝胶图片,其中A为在自然光下拍摄的凝胶图片,B为在X射线下拍摄的凝胶图片;
图2为试验例4中实验1组2号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射亚甲蓝),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图3为试验例4中实验1组4号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射医用胶),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图4为试验例4中实验2组1号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射亚甲蓝),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图5为试验例4中实验2组3号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射医用胶),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图6为试验例4中实验3组1号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射亚甲蓝),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图7为试验例4中实验3组4号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射医用胶),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图8为试验例4中实验4组2号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射亚甲蓝),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图9为试验例4中实验4组3号新西兰兔肺部图片:(左肺注射琼脂硫酸钡,右肺注射医用胶),其中A为在CT扫描下拍摄的图片,B为在自然光下拍摄的图片;
图10为试验例4中实验1-4组不同时间肺部在CT扫描下拍摄的图片及在自然光下拍摄的图片(右肺注射亚甲蓝);
图11为试验例4中实验1-4组不同时间肺部在CT扫描下拍摄的图片及在自然光下拍摄的图片(左肺注射琼脂硫酸钡);
图12为试验例4中实验1-4组不同时间肺部在CT扫描下拍摄的图片及在自然光下拍摄的图片(右肺注射医用胶);
图13为试验例4中实验1-4组不同时间肺部在CT扫描下拍摄的图片及在自然光下拍摄的图片(左肺注射琼脂硫酸钡);
图14为试验例4中实验1-4组不同时间肺部在自然光下拍摄的图片及在显微镜下拍摄的图片(右肺注射亚甲蓝);
图15为试验例4中实验1-4组不同时间肺部在自然光下拍摄的图片及在显微镜下拍摄的图片(左肺注射琼脂硫酸钡);
图16为试验例4中实验1-4组不同时间肺部在自然光下拍摄的图片及在显微镜下拍摄的图片(右肺注射医用胶)
图17为试验例4中实验1-4组不同时间肺部在自然光下拍摄的图片及在显微镜下拍摄的图片(右肺注射医用胶)
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
根据本发明的一个方面,本发明提供了一种琼脂硫酸钡混合液,该琼脂硫酸钡混合液包括以下组分:生理盐水50ml、琼脂1-1.5g和硫酸钡1-1.5g。
琼脂:学名琼胶,又名洋菜,冻粉。是人类最早开始使用的胶凝剂。琼脂具有以下特性:溶解性:不溶于冷水和无机、有机溶剂中。加热在95℃以上可溶解于水;胶凝性:在水中加热溶解后,放冷至42℃及以下则形成凝胶。琼脂由于其独特的性质,广泛用于医疗方面。
硫酸钡:为白色无定型粉末。性质稳定,难溶于水、酸、碱或有机溶剂。放射学检查使用硫酸钡剂主要利用其在胃肠道内可吸收X射线而使其显影作用。
琼脂硫酸钡混合液在肺磨玻璃结节定位的原理:利用琼脂在加热状态(加热至94℃及以上)可溶解于水形成琼脂液,其琼脂液在温度低于42℃时会迅速凝固形成不溶于水的琼脂凝胶的原理。(加入硫酸钡目的:硫酸钡具有良好的显影性及稳定性,当硫酸钡加入琼脂液后会形成具有良好显影性的琼脂硫酸钡混合液)将温度大于42℃的琼脂硫酸钡混合液注射于肺组织磨玻璃结节附近(正常机体肺组织温度位于37-39℃之间),由于肺组织温度低于42℃,注射入肺组织的琼脂液会迅速凝固形成不溶于水的琼脂硫酸钡凝胶(固态),从而人为在肺组织内制造出一个人工结节,在手术过程中通过触摸其形成的人工结节从而找到肺组织磨玻璃结节位置,从而能够准确切除肺组织磨玻璃结节。
本发明提供的琼脂硫酸钡混合液具有以下优点:1、具有较好稳定性;2、温度在42℃以上保持液态,当温度低于42℃时快速凝固成形性;3、具有良好显影性,能够在CT下明显显影;4、所形成固态凝胶较为稳定。
在本发明的典型但非限制性的实施方式中,琼脂的质量如为1、1.1、1.2、1.3、1.4或1.5g;硫酸钡的质量如为1、1.1、1.2、1.3、1.4或1.5g。
本发明通过实验证明,当生理盐水为50mL时,琼脂的质量在1-1.5g的范围内,硫酸钡的质量在1-1.5g的范围内时,该琼脂硫酸钡混合物的定位效果较好。
根据本发明的第二个方面,本发明提供了琼脂硫酸钡混合液的制备方法,包括以下步骤:将生理盐水、琼脂和硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却即得到琼脂硫酸钡混合液。
根据本发明的第三个方面,本发明提供了琼脂硫酸钡混合液在肺磨玻璃结节定位方面的应用。
下面结合实施例对本发明提供的技术方案做进一步的描述。试验例1琼脂与生理盐水配比实验
1、不同浓度琼脂液50℃经穿刺针注射通过率测定:
定量:50ml生理盐水、50℃琼脂液;
变量:琼脂(琼脂从0.5g开始,每次增加0.5g,增至2.5g);
实验设计:将琼脂加入生理盐水中充分搅拌均匀后将液体加热直至形成琼脂液为止,待琼脂液温度低于50℃时,用注射器抽取0.5ml琼脂液用针长10cm针粗0.6mm穿刺针,测定不同浓度琼脂液进行穿刺针注射通过率(每组进行10次注射);
实验器材:酒精灯、温度计、注射器、针长10cm针粗0.6mm穿刺针、琼脂、生理盐水、试管、烧杯、玻璃棒;
实验步骤:
①50ml生理盐水与0.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
②50ml生理盐水与0.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
③50ml生理盐水与0.75g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
④50ml生理盐水与1g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑤50ml生理盐水与1.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑥50ml生理盐水与1.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑦50ml生理盐水与1.75g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑧50ml生理盐水与2g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑨50ml生理盐水与2.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数;
⑩50ml生理盐水与2.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射,需进行10次重复注射操作,记录下堵塞穿刺针次数及顺利注射次数。
实验数据:
①50mL生理盐水配比0.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
②50mL生理盐水配比0.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
③50mL生理盐水配比0.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
④50mL生理盐水配比1g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
⑤50mL生理盐水配比1.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
⑥50mL生理盐水配比1.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均顺利注射;
⑦50mL生理盐水配比1.75g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,8次顺利注射,2次堵针;
⑧50mL生理盐水配比2g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,3次顺利吗注射,7次堵针;
⑨50mL生理盐水配比2.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均堵针;
⑩50mL生理盐水配比2.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液经穿刺针注射10次,10次均堵针;
实验结论:根据琼脂与生理盐水配比实验分析,随着琼脂量增加,所制备琼脂液在50℃时流动性逐渐降低。其50ml生理盐水中琼脂量在0.25-1.5g间的琼脂液有良好流动性,均能顺利经穿刺针注射而出;琼脂量在1.75-2g间的琼脂液流动性明显下降,出现堵针情况;当琼脂量大于等于2.25g时琼脂液流动性极差,无法经穿刺针注射而出。
2、凝固时间测定:
定量:50ml生理盐水、50℃琼脂液、37℃底板;
变量:琼脂(琼脂从0.25g开始,每次增加0.25g,增至2.5g)
实验设计:将琼脂加入生理盐水中充分搅拌均匀后将液体加热直至形成琼脂液为止,待琼脂液温度低于50℃时,用注射器抽取0.5ml琼脂液注射至37℃底板上,观测不同浓度琼脂液形成结节时间(每组进行6次测定,取时间平均值);
实验器材:酒精灯、水浴锅、温度计、注射器、琼脂、生理盐水、试管、烧杯、玻璃棒;
实验步骤:
①50ml生理盐水与0.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
②50ml生理盐水与0.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
③50ml生理盐水与0.75g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
④50ml生理盐水与1g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑤50ml生理盐水与1.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑥50ml生理盐水与1.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑦50ml生理盐水与1.75g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑧50ml生理盐水与2g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑨50ml生理盐水与2.25g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
⑩50ml生理盐水与2.5g琼脂混合均匀后加热至94℃以上,待形成琼脂液后使其冷却,待琼脂液温度下降至50℃时用2ml注射器抽取0.5ml琼脂液注射于37℃的平面底板上,需进行6次重复注射操作,记录下其凝固时间;
实验数据:
①50mL生理盐水配比0.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:75秒、70秒、78秒、73秒、80秒、72秒;
②50mL生理盐水配比0.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:50秒、54秒、48秒、51秒、53秒、49秒;
③50mL生理盐水配比0.75g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:40秒、42秒、40秒、38秒、41秒、39秒;
④50mL生理盐水配比1g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:35秒、37秒、34秒、35秒、33秒、36,秒;
⑤50mL生理盐水配比1.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:28秒、26秒、31秒、29秒、27秒、28秒;
⑥50mL生理盐水配比1.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:22秒、21秒、24秒、23秒、20秒、21秒;
⑦50mL生理盐水配比1.75g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:21秒、20秒、23秒、20秒、22秒、20秒;
⑧50mL生理盐水配比2g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:21秒、19秒、20秒、22秒、18秒、20秒;
⑨50mL生理盐水配比2.25g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:20秒、21秒、19秒、18秒、22秒、19秒;
⑩50mL生理盐水配比2.5g琼脂所制备琼脂液50℃时抽取0.5ml琼脂液注射于37℃平板凝固时间:19秒、20秒、20秒、18秒、21秒、18秒。
实验数据分析:求取每组凝固时间平均值:(小数点采取四舍五入)
一组:(75+70+78+73+80+72)÷6=75秒
二组:(50+54+48+51+53+49)÷6=51秒
三组:(40+42+40+38+41+39)÷6=40秒
四组:(35+37+34+35+33+36)÷6=35秒
五组:(28+26+31+29+27+28)÷6=28秒
六组:(22+21+24+23+20+21)÷6=22秒
七组:(21+20+23+20+22+20)÷6=21秒
八组:(21+19+20+22+18+20)÷6=20秒
九组:(20+21+19+18+22+19)÷6=20秒
十组:(19+20+20+18+21+18)÷6=19秒实验结论:琼脂液凝固时间随着琼脂浓度增加而逐渐缩短,当琼脂与生理盐水配比达到1.5g/50ml时凝固时间趋于稳定,不再因琼脂浓度增加而凝固时间明显改变。
琼脂与生理盐水配比实验结论:结合“不同浓度琼脂液50℃经穿刺针注射通过率测定”实验数据及“凝固时间测定”实验数据分析,在50ml生理盐水中配1-1.5g琼脂所制备琼脂液有良好穿刺针通过性,同时其凝固时间较短,利于在注射于肺组织后快速形成琼脂凝胶。
试验例2不同浓度硫酸钡所制备琼脂硫酸钡混合液经穿刺针注射通过率及凝固时间测定实验根据实验一研究,在50ml生理盐水中配1-1.5g琼脂较为适宜,因此选取50ml生理盐水中配1.5g琼脂。
定量:50ml生理盐水、1.5g琼脂变量:硫酸钡(硫酸钡从0.25g开始,每次增加0.25g,增至2.5g);
实验设计:将硫酸钡、琼脂加入生理盐水中充分搅拌均匀后将液体加热直至形成琼脂硫酸钡混合液为止,待琼脂硫酸钡混合液温度低于50℃时,用注射器抽取0.5ml琼脂硫酸钡混合液用针长10cm针粗0.6mm穿刺针进行注射,测定不同浓度琼脂硫酸钡混合液液进行穿刺针注射通过率及凝固时间(每组进行10次注射);
实验器材:酒精灯、温度计、注射器、针长10cm针粗0.6mm穿刺针、琼脂、硫酸钡、生理盐水、试管、烧杯、玻璃棒;
实验步骤:
①50ml生理盐水与1.5琼脂、0.25g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
②50ml生理盐水与1.5琼脂、0.5g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
③50ml生理盐水与1.5琼脂、0.75g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
④50ml生理盐水与1.5琼脂、1g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑤50ml生理盐水与1.5琼脂、1.25g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑥50ml生理盐水与1.5琼脂、1.5g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑦50ml生理盐水与1.5琼脂、1.75g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑧50ml生理盐水与1.5琼脂、2g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑨50ml生理盐水与1.5琼脂、2.25g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间;
⑩50ml生理盐水与1.5琼脂、2.5g硫酸钡混合均匀后加热至94℃以上,待形成琼脂硫酸钡混合液后使其冷却,待琼脂硫酸钡混合液温度下降至50℃时用2ml注射器抽取0.5ml琼脂硫酸钡混合液注射器连接针长10cm针粗0.6mm穿刺针进行快速注射于37℃底板,需进行10次重复注射操作,记录下堵塞穿刺针次数、顺利注射次数及琼脂硫酸钡混合液凝固时间。
实验数据:
①50mL生理盐水配比1.5g琼脂、0.25g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:23秒、21秒、22秒、22秒、24秒、20秒、21秒、23秒、20秒、22秒;
②50mL生理盐水配比1.5g琼脂、0.5g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:21秒、21秒、22秒、23秒、20秒、20秒、21秒、19秒、22秒、21秒;
③50mL生理盐水配比1.5g琼脂、0.75g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:22秒、20秒、18秒、22秒、24秒、19秒、20秒、21秒、21秒、23秒;
④50mL生理盐水配比1.5g琼脂、1g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:21秒、20秒、19秒、22秒、23秒、20秒、18秒、21秒、21秒、22秒;
⑤50mL生理盐水配比1.5g琼脂、1.25g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:19秒、20秒、21秒、22秒、23秒、20秒、22秒、21秒、20秒、22秒;
⑥50mL生理盐水配比1.5g琼脂、1.5g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,10次均顺利注射,凝固时间:22秒、20秒、18秒、22秒、24秒、19秒、20秒、21秒、21秒、23秒;
⑦50mL生理盐水配比1.75g琼脂、1.75g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,9次顺利注射,1次堵针,凝固时间:21秒、19秒、18秒、21秒、23秒、19秒、19秒、22秒、21秒、20秒;
⑧50mL生理盐水配比1.5g琼脂、2g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,9次顺利注射,1次堵针,凝固时间:22秒、18秒、19秒、20秒、21秒、19秒、21秒、21秒、20秒、21秒;
⑨50mL生理盐水配比1.5g琼脂、2.25g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,8次顺利注射,2次堵针,凝固时间:20秒、20秒、19秒、20秒、19秒、21秒、18秒、19秒、20秒、22秒;
⑩50mL生理盐水配比1.5g琼脂、2.5g硫酸钡所制备琼脂硫酸钡混合液50℃时抽取0.5ml琼脂液注射于37℃平板,7次顺利注射,3次堵针,凝固时间:18秒、20秒、18秒、21秒、19秒、20秒、22秒、20秒、19秒、19秒;
实验数据分析:
加入不同浓度硫酸钡凝固时间平均值:
①(23+21+22+22+24+20+21+23+20+22)÷10=21.8秒;
②(21+21+22+23+20+20+21+19+22+21)÷10=21秒;
③(22+20+18+22+24+19+20+21+21+23)÷10=21秒;
④(21+20+19+22+23+20+18+21+21+22)÷10=20.7秒;
⑤(19+20+21+22+23+20+22+21+20+22)÷10=21秒;
⑥(22+20+18+22+24+19+20+21+21+23)÷10=21秒;
⑦(21+19+18+21+23+19+19+22+21+20)÷10=20.3秒;
⑧(22+18+19+20+21+19+21+21+20+21)÷10=20.2秒;
⑨(20+20+19+20+19+21+18+19+20+22)÷10=19.8秒;
⑩(18+20+18+21+19+20+22+20+19+19)÷10=19.6秒。
实验结论:琼脂硫酸钡混合液中随着硫酸钡量增加,其溶液50℃时其流动性轻微下降,其溶液凝固时间轻微缩短。其硫酸钡浓度在1-1.5g较为适宜。
试验例3不同浓度硫酸钡所制备琼脂硫酸钡混合液凝固后所形成的琼脂硫酸钡凝胶颜色及在射线下显影实验
定量:50ml生理盐水、1.5g琼脂变量:硫酸钡(硫酸钡从0.25g开始,每次增加0.25g,增至2.5g);
实验设计:将硫酸钡、琼脂加入生理盐水中充分搅拌均匀后将液体加热制备成琼脂硫酸钡混合液,将琼脂硫酸钡混合液固定圆柱形器皿中,待冷却后制备成固定大小琼脂硫酸钡凝胶,将不同浓度硫酸钡所制备的凝胶放置于底片上,观测其颜色,然后将其放置于X射线下拍摄,观测其显影性。
实验结论:由图1A和图1B可知,随着硫酸钡浓度增加,所形成琼脂硫酸钡凝胶在自然光下颜色逐渐由透明变乳白色,放置于X射线下拍摄,其显影性轻微增强。
试验例4
实验原理:利用琼脂硫酸钡混合液在低于42℃可快速凝固为固体的原理,将液态琼脂硫酸钡混合液注射进入肺组织,由于肺组织温度低于42℃,可快速在肺组织内形成琼脂硫酸钡结节。
实验设计:选取18只新西兰兔,分为实验组、对照组。
对照组:2只新西兰兔,采取CT引导下双肺注射50℃0.1ml生理盐水,对其在注射前、注射1分钟后、注射2小时后、注射24小时后、注射72小时后、注射120小时后扫描CT,并于注射120小时扫描CT后解剖;
实验组:16只新西兰兔分为4组,每组4只,每组新西兰兔均编号1-4,1/2号新西兰兔左肺注射琼脂硫酸钡,右肺注射亚甲蓝对照;3/4号新西兰兔左肺注射琼脂硫酸钡,右肺注射医用胶对照。1组2小时后解剖,2组24小时后解剖,3组72小时后解剖,4组120小时后解剖。注射前、注射1分钟后,解剖前均需扫CT。(注射计量均为0.1ml,琼脂硫酸钡注射温度为50℃)。
实验数据分析:
1、由图2-9可知,琼脂硫酸钡混合液在注射入肺组织后可形成乳白色类圆形人工结节,同时不会随着时间推移形态等发生改变,其结节可在肺表面肉眼观测到并可触及到;
2、由图11、图13、图15和图17可知,琼脂硫酸钡混合液在注射入肺内后对周围组织无明显破坏,周围细胞组织可见轻微炎症改变,但无明显细胞损害;
3、由图12和图16可知,医用胶注射入肺组织后开始出现斑片状改变,随着时间推移逐渐扩大,并变为实变影,注射部位组织坏死变性,其注射部位细胞坏死;
4、由图10和图14可知,亚甲蓝注射入肺组织后开始出现斑片状改变,随着时间推移逐渐变为实影,大体标本注射部位可见蓝染,其注射部位细胞有明显红细胞聚集。
实验结论:与亚甲蓝和医用胶相比,本发明提供的琼脂硫酸钡混合液在注入肺部后能够形成乳白色类圆形人工结节,同时不会随着时间推移形态等发生改变,也不会对肺部造成明显的组织破坏,说明其定位准确,稳定性和安全性好,具有广阔的应用市场。
