光催化合成四氢苯-1-甲酰胺类化合物的方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于有机合成技术领域,具体涉及一种光催化合成四氢苯-1-甲酰胺类化合物的方法。
背景技术
四氢萘-1-甲酰胺是许多天然产物以及重要生物活性分子的核心结构,具有广泛的生理活性,如:镇静催眠药阿罗尼胺、C5aR拮抗剂W-54011、抗心律失常剂螺琥珀酰亚胺衍生物、HsFPPS抑制剂鼠尾草酸衍生物、20S蛋白酶体抑制剂硼替佐米类似物以及抗卵菌化合物双酰胺等活性分子(Org.Lett.2018,20,4499-4503;J.Biol.Chem.2002,277,49403;J.Med.Chem.1981,24,47;J.Med.Chem.2019,62,10867;J.Med.Chem.2009,52,4192;Bioorg.Med.Chem.2015,23,2129)。此外,在药物发现和设计过程中,四氢萘-1-甲酰胺骨架化合物是先导化合物合成中重要的中间体或合成砌块。其结构通式如下(IV):
四氢萘-1-甲酰胺的经典制备方法是依赖于四氢萘-1-羧酸和胺之间的酰胺键形成,而四氢萘-1-羧酸却需要通过多步化学合成才能获得。此外,亦有一些其他制备方法,例如:包括四氢萘-1-甲腈于H
发明内容
本发明目的是针对现有的四氢萘-1-甲酰胺类化合物制备方法存在的问题,提供一种操作简便、条件温和、反应高效、底物范围广以及官能团耐受性好,无金属和添加剂参与的四氢苯-1-甲酰胺类化合物合成方法。
本发明提供了一种光催化合成四氢苯-1-甲酰胺类化合物的方法,其包括以下步骤:将式I所示2-环A(环A为芳基或杂芳基)甲基-2-溴羰基类化合物、式II所示N-环B(环B为芳基或杂芳基)基丙烯酰胺类化合物和光催化剂置于有机溶剂中,在可见光照射和惰性气体保护下进行环化反应,反应结束后,经后处理,得到式Ⅲ所示四氢苯-1-甲酰胺类化合物;
其中,
环A选自6~14元芳基、5~10元杂芳基;环A中,所述5~10元杂芳基含有1个杂原子,杂原子选自N、NH、NC(O)OR
环B选自芳基、杂芳基;
R
R
R
本发明中,反应原理是光催化式I和式II进行[4+2]环化反应,在该反应中,对环A上的R
此外,环A具有四个反应位点,其选自如上所述6~14元芳基、5~10元杂芳基,最好采用6~14元芳基,以合成标准的四氢萘-1-甲酰胺类化合物;且R
其中,上述方法中,环A选自苯基、萘基、蒽基、菲基、吡咯基、吡啶基、吲哚基、喹啉基、异喹啉基;环A中,所述吡咯基、吲哚基上的N与H相连,或与C(O)OR
优选的,上述方法中,环A选自苯基、萘基、蒽基、菲基、吡咯基、吡啶基、吲哚基、喹啉基、异喹啉基;环A中,所述吡咯基、吲哚基上的N与H相连,或与C(O)OR
其中,上述方法中,R
优选的,上述方法中,R
其中,上述方法中,R
R
R
R
R
优选的,上述方法中,R
R
R
R
R
更优选的,上述方法中,R
最优选的,上述方法中,所述式I选自:
其中,上述方法中,环B选自6~14元芳基、5~10元杂芳基;环B中,所述5~10元杂芳基含有1个杂原子,杂原子选自N、NH、NC(O)OR
优选的,上述方法中,环B选自苯基、萘基、蒽基、菲基、吡咯基、吡啶基、吲哚基、喹啉基、异喹啉基;环B中,所述吡咯基、吲哚基上的N与H相连,或与C(O)OR
更优选的,上述方法中,环B选自苯基、萘基、蒽基、菲基、吡咯基、吡啶基、吲哚基、喹啉基、异喹啉基;环B中,所述吡咯基、吲哚基上的N与H相连,或与C(O)OR
其中,上述方法中,R
优选的,上述方法中,R
其中,上述方法中,R
R
R
R
R
优选的,上述方法中,R
R
R
R
R
更优选的,上述方法中,R
最优选的,上述方法中,所述式II选自:
最优选的,上述方法中,所述式III选自:
其中,上述方法中,所述2-苄基-2-溴羰基类化合物、N-芳基丙烯酰胺和光催化剂的摩尔比为1:1~2:0.01~0.05。
优选的,上述方法中,所述2-苄基-2-溴羰基类化合物、N-芳基丙烯酰胺和光催化剂的摩尔比为1:1.2~1.8:0.01~0.03。
其中,上述方法中,所述光催化剂选自3DPAFIPN、3DPA2FBN或4CzIPN。
优选的,上述方法中,所述光催化剂为3DPA2FBN。
其中,上述方法中,所述有机溶剂选自N,N-二甲基甲酰胺、1,4-二氧六环、乙醚、乙酸乙酯、甲醇、丙酮、乙二醇二甲醚、二氯甲烷、1,2-二氯乙烷、四氢呋喃、二甲基亚砜、乙腈中的至少一种。
优选的,上述方法中,所述有机溶剂为N,N-二甲基甲酰胺。
其中,上述方法中,所述有机溶剂的用量为5~30mL/mmol式I。
优选的,上述方法中,所述有机溶剂的用量为15~25mL/mmol式I。
其中,上述方法中,所述可见光照射采用的光源选自蓝光光源、绿光光源、紫外光光源或白光光源。
优选的,上述方法中,所述可见光照射采用的光源为蓝光光源。
其中,上述方法中,所述可见光照射采用的波长为455~465nm;
其中,上述方法中,所述环化反应的温度为0~80℃。
优选的,上述方法中,所述环化反应的温度为20~30℃。
其中,上述方法中,所述环化反应的时间为1~6小时。
优选的,上述方法中,所述环化反应的时间为1~2小时。
本发明中,反应结束后,后处理为本领域常规操作,即为:采用适量水淬灭反应并用适量的适当有机溶剂(如乙酸乙酯、二氯甲烷等)萃取,然后有机层经饱和盐水冲洗,并在Na
本发明的有益效果:本发明以2-(杂)芳甲基-2-溴羰基类化合物(如2-苄基-2-溴羰基类化合物)和N-(杂)芳基丙烯酰胺类化合物(如N-芳基丙烯酰胺)为原料,通过无金属和添加剂参与的可见光催化进行[4+2]环化反应,制备得到了一类结构新颖的四氢苯-1-甲酰胺类化合物,所得化合物经核磁共振波谱仪检测确证,突破了自然界中四氢萘-1-甲酰胺类化合物的结构限制,为四氢苯(萘)-1-甲酰胺类化合物的工业生产提供一条新途径;本发明方法操作简便,反应条件温和、工艺条件稳定、产品易纯化、底物范围广以及官能团耐受性好、生产成本低廉、适合大规模生产。
附图说明
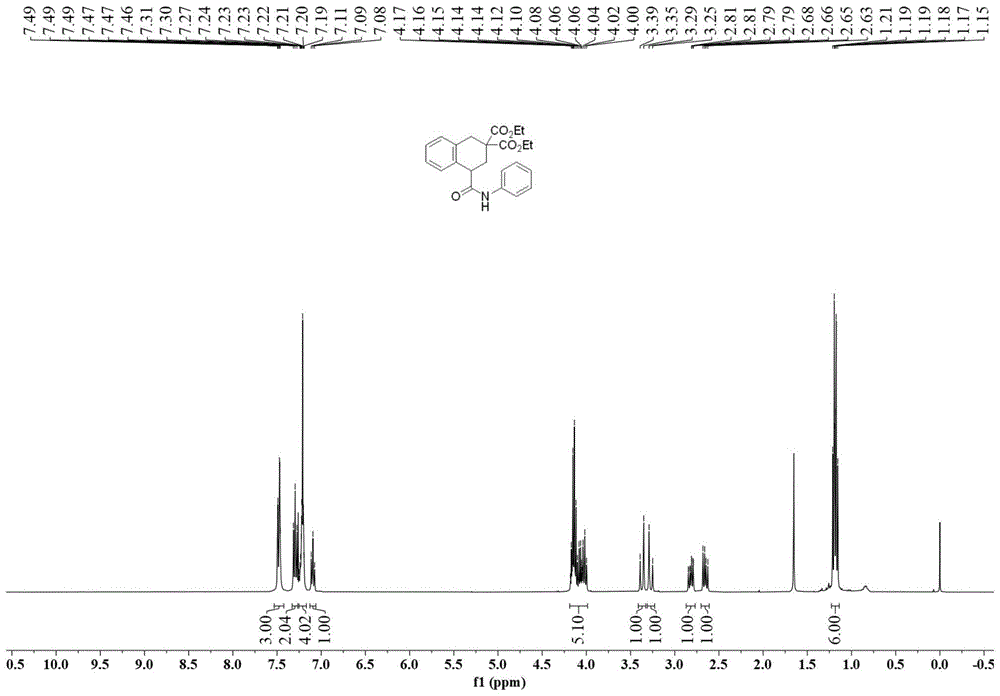
图1为本发明的实施例1制备得到的化合物的核磁共振
图2为本发明的实施例1制备得到的化合物的核磁共振
具体实施方式
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
实施例1:4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
在氩气条件下,依次将N-苯基丙烯酰胺(44.6mg,0.3mmol)、3DPA2FBN(2.6mg,0.004mmol)、2-苄基-2-溴丙二酸二乙酯(65.8mg,0.2mmol)和N,N-二甲基甲酰胺(4mL)加入干燥的Schlenk管(10mL)中,并用蓝色LED光源(波长455~465nm)照射,于25℃下反应1小时。反应结束后,用H
其他反应参数筛选结果如下表1所示:
表1反应参数筛选结果
实施例2:6-甲基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-甲基苄基)丙二酸二乙酯,所得产物为白色固体,熔点138.0-139.0℃,收率76%。产物表征:
实施例3:6-甲氧基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-甲氧基苄基)丙二酸二乙酯,所得产物为白色固体,熔点119.0-120.0℃,收率72%。产物表征:
实施例4:6-(叔丁基)-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-叔丁基苄基)丙二酸二乙酯,所得产物为白色固体,熔点148.0-149.0℃,收率68%。产物表征:
实施例5:6-氟-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-氟苄基)丙二酸二乙酯,所得产物为白色固体,熔点167.0-168.8℃,收率68%。产物表征:
实施例6:6-氯-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-氯苄基)丙二酸二乙酯,所得产物为白色固体,熔点151.0-152.8℃,收率65%。产物表征:
实施例7:6-溴-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-溴苄基)丙二酸二乙酯,所得产物为白色固体,熔点138.0-140.4℃,收率64%。产物表征:
实施例8:4-(苯基氨基甲酰基)-6-(三氟甲基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-(三氟甲基)苄基)丙二酸二乙酯,所得产物为白色固体,熔点157.0-158.0℃,收率63%。产物表征:
实施例9:6-乙酰基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-(4-乙酰基苄基)-2-溴丙二酸二乙酯,所得产物为白色固体,熔点133.0-134.0℃,收率66%。产物表征:
实施例10:6-氰基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-氰基苄基)丙二酸二乙酯,所得产物为白色固体,熔点137.0-138.0℃,收率75%。产物表征:
实施例11:8-甲基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(2-甲基苄基)丙二酸二乙酯,所得产物为白色固体,熔点137.0-138.0℃,收率75%。产物表征:
实施例12:8-氟-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(2-氟苄基)丙二酸二乙酯,所得产物为白色固体,熔点132.0-133.4℃,收率49%。产物表征:
实施例13:8-氯-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(2-氯苄基)丙二酸二乙酯,所得产物为白色固体,熔点128.0-133.0℃,收率61%。产物表征:
实施例14:8-溴-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(2-溴苄基)丙二酸二乙酯,所得产物为白色固体,熔点133.8-135.4℃,收率60%。产物表征:
实施例15:5-氟-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯和7-氟-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(3-氟苄基)丙二酸二乙酯,所得产物为白色固体,熔点123.0-125.0℃,收率73%,rr=2.1:1。产物表征:
实施例16:5-氯-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯和7-氯-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(3-氯苄基)丙二酸二乙酯,所得产物为白色固体,熔点118.5-120.0℃,收率72%,rr=1.5:1。产物表征:
实施例17:5-溴-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯和7-溴-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(3-溴苄基)丙二酸二乙酯,所得产物为白色固体,熔点139.0-141.0℃,收率67%,rr=2.3:1。产物表征:
实施例18:5,7-二甲基-4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(3,5-二甲基苄基)丙二酸二乙酯,所得产物为白色固体,熔点162.5-164.0℃,收率65%。产物表征:
实施例19:1-(苯基氨基甲酰基)-1,4-二氢菲-3,3(2H)-二甲酸二乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(萘-1-基甲基)丙二酸二乙酯,所得产物为白色固体,熔点162.0-164.0℃,收率65%。产物表征:
实施例20:9-(叔丁基)3,3-二乙基-1-(苯基氨基甲酰基)-1,4-二氢-3H-咔唑-3,3,9(2H)-三羧酸酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-((1-(叔丁氧羰基)-1H-吲哚-3-基)甲基)丙二酸二乙酯,所得产物为白色固体,熔点152.0-154.0℃,收率68%。产物表征:
实施例21:4-(苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二甲酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-苄基-2-溴丙二酸二甲酯所得产物为白色固体,熔点140.6-142.3℃,收率75%。产物表征:
实施例22:2-乙酰基-4-(苯基氨基甲酰基)-1,2,3,4-四氢萘-2-甲酸乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-苄基-2-溴-3-氧代丁酸乙酯所得产物为白色固体,熔点136.8-138.4℃,收率60%。产物表征:
实施例23:2-氰基-4-(苯基氨基甲酰基)-1,2,3,4-四氢萘-2-甲酸乙酯的制备
参照实施例1,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-氰基-3-苯基丙酸乙酯所得产物为白色固体,熔点149.5-151.4℃,收率23%。产物表征:
实施例24:4-(对甲苯基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对甲苯基)丙烯酰胺,所得产物为白色固体,熔点168.8-170.0℃,收率70%。产物表征:
实施例25:4-((4-甲氧基苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对甲氧苯基)丙烯酰胺,所得产物为白色固体,熔点143.0-144.0℃,收率72%。产物表征:
实施例26:4-((4-苄基苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对苄基苯基)丙烯酰胺,所得产物为白色固体,熔点129.7-130.7℃,收率72%。产物表征:
实施例27:4-((4-苯氧基苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对苯氧苯基)丙烯酰胺,所得产物为白色固体,熔点154.0-156.0℃,收率71%。产物表征:
实施例28:4-(4-氟苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对氟苯基)丙烯酰胺,所得产物为白色固体,熔点142.0-144.0℃,收率68%。产物表征:
实施例29:4-((4-氯苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对氯苯基)丙烯酰胺,所得产物为白色固体,熔点164.0-166.0℃,收率72%。产物表征:
实施例30:4-((4-溴苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对溴苯基)丙烯酰胺,所得产物为白色固体,熔点183.0-184.8℃,收率73%。产物表征:
实施例31:4-((4-苯甲酰苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(对苯甲酰苯基)丙烯酰胺,所得产物为白色固体,熔点149.0-150.3℃,收率68%。产物表征:
实施例32:4-(4-(N-乙酰氨基磺酰基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(4-(N-乙酰氨基磺酰基)苯基)丙烯酰胺,所得产物为白色固体,熔点127.0-128.5℃,收率63%。产物表征:
实施例33:4-(3-(三氟甲氧基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(3-(三氟甲氧基)苯基)丙烯酰胺,所得产物为白色固体,熔点118.8-119.6℃,收率71%。产物表征:
实施例34:4-(3-(甲硫基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)二甲酸二乙酯的制备
/>
参照实施例1,将N-苯基丙烯酰胺替换为N-(3-(甲硫基)苯基)丙烯酰胺,所得产物为白色固体,熔点141.0-142.5℃,收率67%。产物表征:
实施例35:4-(3-(叔丁基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(3-(叔丁基)苯基)丙烯酰胺,所得产物为白色固体,熔点152.7-154.5℃,收率70%。产物表征:
实施例36:4-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)丙烯酰胺,所得产物为白色固体,熔点148.0-149.0℃,收率69%。产物表征:
实施例37:4-((2-溴苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(2-溴苯基)丙烯酰胺,所得产物为白色固体,熔点78.9-79.3℃,收率68%。产物表征:
实施例38:4-((2-((叔丁氧羰基)氨基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为(2-丙烯酰胺苯基)氨基甲酸叔丁酯,所得产物为黄色油状液体,收率71%。产物表征:
实施例39:4-(萘-1-基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(1-萘基)丙烯酰胺,所得产物为白色固体,熔点143.0-145.0℃,收率59%。产物表征:
实施例40:4-(1H-吲哚-4-基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(1H-吲哚-4-基)丙烯酰胺,所得产物为白色固体,熔点57.0-58.0℃,收率65%。产物表征:
实施例41:4-(喹啉-3-基氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(喹啉-3-基)丙烯酰胺,所得产物为白色固体,熔点82.2-84.0℃,收率49%。产物表征:
实施例42:4-(甲基(苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-甲基-N-苯基丙烯酰胺,所得产物为白色固体,熔点84.6-86.2℃,收率61%。产物表征:
实施例43:6-氟-4-甲基(苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-甲基-N-苯基丙烯酰胺,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(4-氟苄基)丙二酸二乙酯,所得产物为白色固体,熔点124.9-126.0℃,收率51%。产物表征:
实施例44:8-氯-4-甲基氨基甲酰基-3,4-二氢萘-2,2(1H)二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-甲基-N-苯基丙烯酰胺,将2-苄基-2-溴丙二酸二乙酯替换为2-溴-2-(2-氯苄基)丙二酸二乙酯,所得产物为白色固体,熔点112.9-114.6℃,收率37%。产物表征:
实施例45:4-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚啉-4-基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(2-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚啉-4-基)丙烯酰胺,所得产物为白色固体,熔点236.0-238.0℃,收率33%。产物表征:
实施例46:4-(4-(3-乙基-2,6-二氧代哌啶-3-基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(4-(3-乙基-2,6-二氧代哌啶-3-基)苯基)丙烯酰胺,所得产物为白色固体,熔点139.0-141.0℃,收率69%。产物表征:
实施例47:4-((4-(乙氧羰基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为4-丙烯酰胺基苯甲酸乙酯,所得产物为白色固体,熔点136.0-137.0℃,收率68%。产物表征:
实施例48:4-(4-(N-(嘧啶-2-基)氨基磺酰基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(4-(N-(嘧啶-2-基)氨基磺酰基)苯基)丙烯酰胺,所得产物为白色固体,熔点148.0-150.0℃,收率55%。产物表征:
实施例49:4-((4-((2-乙酰氧基苯甲酰基)氧基)苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为4-丙烯酰胺基苯基2-乙酰氧基苯甲酸酯,所得产物为白色固体,熔点153.0-155.0℃,收率72%。产物表征:
实施例50:4-((4-羟基苯基)氨基甲酰基)-3,4-二氢萘-2,2(1H)-二甲酸二乙酯的制备
参照实施例1,将N-苯基丙烯酰胺替换为N-(4-羟基苯基)丙烯酰胺,所得产物为白色固体,熔点95.0-97.0℃,收率40%。产物表征:
