一种猫疱疹病毒I型HR-1毒株重组蛋白的抗原片段、截短体及其在疫苗上的应用
文献发布时间:2023-06-19 18:27:32
技术领域
本发明涉及疫苗技术领域,具体涉及一种猫疱疹病毒I型HR-1毒株重组蛋白的抗原片段、截短体及其在疫苗上的应用。
背景技术
猫疱疹病毒Ι型(Felineherpesvirus-1,FHV-1)是一种线型双链DNA包膜病毒,隶属于疱疹病毒科,α-疱疹病毒亚科。FHV-1作为引起猫科动物发生呼吸道及眼部疾病的主要病原体之一,对猫科动物的健康造成了严重危害,尤其是易感动物幼猫,其死亡率高达50%。
FHV-1感染幼猫后,在幼猫的鼻、气管及结膜等部位复制,经眼鼻分泌物向外界排毒,可引起幼猫的急性或慢性感染,引发上呼吸道和眼部炎症,眼鼻周围受其脓性分泌物的刺激引发脱毛导致结痂,病情严重的猫甚至会出现鼻甲骨萎缩变形、失明等症状。受感染的猫会建立潜伏期,FHV-1潜伏于康复猫的三叉神经节和视神经节内,在猫舍外界环境因素如种群密度大、周转率高、来源不同的影响下,极易引发反复感染,不利于该病的防控。
目前,FHV-1呈世界性流行,我国在多地区也曾分离出该病毒,并在致病机制、流行病学、诊断及检测等方面取得显著进展。疫苗是防控传染病的重要手段。然而到目前为止,鲜有FHV-1疫苗的报道,也无治疗FHV-1病的特效药。
疫苗接种为预防FHV-1感染的主要手段。现有研究支持在急性FHV-1感染的猫中使用灭活疫苗或FVRCP疫苗产品。现在市场上可以买到改良活疫苗 (mLV)和灭活疫苗,然而疫苗仅减少临床症状,不能防止病毒排出或建立野外病毒潜伏期。
gB糖蛋白即病毒感染细胞中的gp143/108,变性条件下为108、70、64和 58kDa。在这些蛋白中,108kDa的糖蛋白FHV-1gB的结构类似于杂二聚体,氨基酸序列分析表明其有2个胞内内切蛋白酶切位点(RTRR/S和RSRR/S),所以其中的1个位点或2个位点中间能被切割,这一酶切作用影响病毒在细胞间的扩散。gB蛋白由948个氨基酸编码,氮端含有10个糖基化位点,序列中含有10 个高度保守的半胱氨酸残基。纯化的gB在小鼠体内能诱导产生高滴度的病毒来中和抗体,表达gB的痘苗病毒在家兔体内也能刺激产生相当高滴度的病毒来中和抗体。Spatz等用表达FHV-lgB的质粒肌肉注射免疫小鼠,也能诱导产生gB 的特异性抗体。gB蛋白是疱疹病毒科中很保守的蛋白,在所有疱疹病毒的组成蛋白中具有很高的同源性。
gD蛋白是病毒囊膜的主要成分,存在于感染的细胞膜上,具有高度的保守性和抗原性,能够与细胞表面的分子特异性结合,诱导机体产生细胞免疫和体液免疫,在病毒穿入易感细胞中起重要作用,是宿主细胞免疫和体液免疫反应的主要靶细胞之一。Horimoto等使用ConA琼脂糖、离子交换和凝胶过滤层析技术,从FHV-1中纯化出大约为59kDa的能作为血凝素的gD糖蛋白。核酸序列分析表明,FHV-1病毒基因组长1125bp,由374个氨基酸编码,分子量为43.2kDa。FHV-1 的gD与其他疱疹病毒的gD基因产物比较发现,组成其二硫键的6个半胱氨酸骨架高度保守。抗gD的单克隆抗体有非依赖补体的病毒中和特性。在其他各类疱疹病毒中,虽然gD基因的生物学功能不同,但他们都是病毒在体内感染和体外复制的非必需基因。
gE蛋白是FHV-1重要的囊膜糖蛋白,影响着病毒的释放、在细胞间传递及毒力,因而被作为构建缺失标记疫苗的对象。同时,血清中gE抗体就成为免疫猫中是否存在FHV-1感染的可靠标志。
gC是一种多功能糖蛋白,尽管不是病毒增殖所必需的,但是在病毒的吸附、病毒粒子的释放、决定病毒的毒力以及影响病毒的稳定性等方面起着十分重要的作用。此外,gC还参与体液免疫、细胞免疫和病毒的免疫逃避机制等。
传统疫苗中,采用gB、gD蛋白制作疫苗,但该类疫苗效果一般,没有实现商业化。本发明采用gC、gD、gE三种蛋白的截短体作为新的重组蛋白,得到的疫苗不仅效果更佳,成本更低,同时,还易于实现商业化应用。
发明内容
本发明的目的在于提出一种猫疱疹病毒I型HR-1毒株重组蛋白的抗原片段、截短体及其在疫苗上的应用,在靶点的选择上,挑选了涉及病毒入侵宿主细胞非常关键的包膜糖蛋白gD,两个与病毒免疫逃脱有关的蛋白,gC和gE,选择了 gD,gC和gE三个靶点,分析结构并进行试验,将三个蛋白进行截短,组合得到了一种重组蛋白,做成了三价疫苗,能够提供高保护效率。疫苗质量优良,免疫效力高,免疫效果稳定,成本低、在较短的时间内产生免疫保护等优点。
本发明的技术方案是这样实现的:
本发明提供如下1)、2)或3)所示的蛋白质或其截短体,所述截短体为如下任一所示:
1)猫疱疹病毒苗I型入侵宿主细胞的包膜糖蛋白gD自N端起第25-288位氨基酸,其氨基酸序列如SEQ ID NO.1所示;
2)猫疱疹病毒苗I型免疫逃脱相关蛋白gC自N端起第29-487位氨基酸,其氨基酸序列如SEQ ID NO.2所示;
3)猫疱疹病毒苗I型免疫逃脱相关蛋白gE自N端起第20-365位氨基酸,其氨基酸序列如SEQ ID NO.3所示;
所述蛋白质为gD、gC和gE至少一种。
本发明进一步保护一种编码上述1)、2)或3)所示的蛋白质的基因,编码 1)猫疱疹病毒苗I型入侵宿主细胞的包膜糖蛋白gD截短体的基因的核苷酸序列如SEQ ID NO.4所示;编码2)猫疱疹病毒苗I型免疫逃脱相关蛋白gC截短体的基因的核苷酸序列如SEQ ID NO.5所示;编码3)猫疱疹病毒苗I型免疫逃脱相关蛋白gE截短体的基因的核苷酸序列如SEQ IDNO.6所示。
本发明进一步保护一种表达载体,包括上述的基因。
本发明进一步保护一种宿主细胞,其特征在于,含有上述的载体。
本发明进一步保护一种制备上述蛋白质的方法,包括诱导上述的宿主细胞进行蛋白表达的步骤。
作为本发明的进一步改进,所述表达载体为pcDNA3.1(+);所述宿主细胞为大肠杆菌。
本发明进一步保护一种用于预防猫疱疹病毒苗I型相关疾病的疫苗,其包含上述的蛋白质及医学上可接受的载体。
本发明进一步保护上述的蛋白质在制备猫疱疹病毒苗I型三价疫苗中的应用。
本发明进一步保护一种对猫科动物进行免疫的方法,包括向猫科动物施用上所述的疫苗。
作为本发明的进一步改进,所述疫苗通过肌内、皮内、皮下、口服或鼻内给药。
本发明进一步保护一种上述蛋白质或其截短体和/或上述编码基因和/或上述表达载体和/或上述宿主细胞作为抗原在制备针对猫疱疹病毒苗I型的抗体中的应用;
或,上述蛋白质或其截短体和/或上述编码基因和/或上述表达载体和/或上述宿主细胞在制备预防和/或治疗猫疱疹病毒苗I型引起的疾病的产品中的应用;
或,上述蛋白质或其截短体和/或上述编码基因和/或上述表达载体和/或上述宿主细胞在预防和/或治疗猫疱疹病毒苗I型引起的疾病中的应用。
本发明进一步保护一种上述蛋白质或其截短体和/或上述编码基因和/或上述表达载体和/或上述宿主细胞在如下a1)-a6)中任一种中的应用:
a1)抑制病毒感染;
a2)制备抑制病毒感染的产品;
a3)抑制病毒与宿主细胞结合;
a4)制备抑制病毒与宿主细胞结合的产品;
a5)抑制病毒入侵;
a6)制备抑制病毒入侵的产品;
或,所述病毒为猫疱疹病毒。
本发明进一步保护一种产品,其活性成分为上述蛋白质或其截短体;
所述产品的功能为如下b1)-b3)中任一种:
b1)抑制病毒感染;
b2)抑制病毒与宿主细胞结合;
b3)抑制病毒入侵;
或,所述产品为药物或疫苗;
或,所述病毒为猫疱疹病毒。
本发明进一步保护一种多抗,是以上述蛋白质或其截短体为免疫原制备得到的。
本发明具有如下有益效果:本发明猫疱疹病毒疫苗在靶点的选择上,挑选了涉及病毒入侵宿主细胞的关键包膜糖蛋白gD,两个与病毒免疫逃脱有关的蛋白, gC和gE,选择了gD,gC和gE三个靶点,做成了三价疫苗,一方面产生阻断病毒入侵宿主细胞的抗体,另外一方面产生防止病毒逃脱免疫系统攻击的抗体,从而能够提供一个非常高效的疫苗保护效率,传统疫苗中,采用gB、gD蛋白制作疫苗,本发明选择了gC、gD、gE组合物,并进行截短后得到重组蛋白,制得的疫苗质量优良,免疫效力高,免疫效果稳定,成本低、在较短的时间内产生免疫保护等优点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1制得的pcDNA3.1(+)-FHV-1_gD-trancation-8xHis (1)载体图;
图2为本发明实施例1制得的pcDNA3.1(+)-FHV-1_gC-trancation-8xHis(1) 载体图
图3为本发明实施例1制得的pcDNA3.1(+)-FHV-1_gE-trancation-8xHis(1) 载体图;
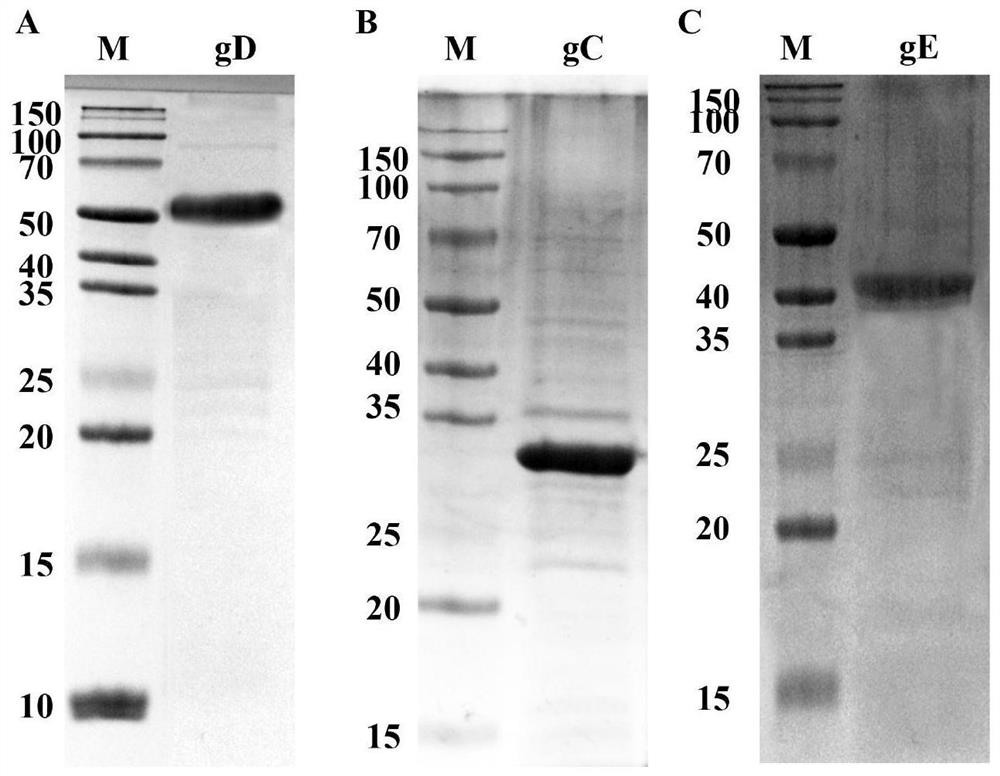
图4为本发明实施例2中重组gD、gC和gE蛋白的SDS-PAGE图;
图5为本发明实施例5中各组小猫体重变化图;
图6为本发明实施例5中各组小猫体温变化图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1gD、gC和gE蛋白表达载体的构建
包括如下1)、2)或3)所示的蛋白质或其截短体,所述截短体为如下任一所示:
1)猫疱疹病毒苗I型入侵宿主细胞的包膜糖蛋白gD自N端起第25-288位氨基酸,其氨基酸序列如SEQ ID NO.1所示;
2)猫疱疹病毒苗I型免疫逃脱相关蛋白gC自N端起第29-487位氨基酸,其氨基酸序列如SEQ ID NO.2所示;
3)猫疱疹病毒苗I型免疫逃脱相关蛋白gE自N端起第20-365位氨基酸,其氨基酸序列如SEQ ID NO.3所示;
所述蛋白质为gD、gC和gE至少一种。
本发明利用大肠杆菌作为表达系统,为了获得更高的表达效率和更高的表达量,在进行外源蛋白表达时进行了密码子优化,反翻译成核苷酸序列,得到的核苷酸序列分别为:
编码1)猫疱疹病毒苗I型入侵宿主细胞的包膜糖蛋白gD截短体的基因的核苷酸序列如SEQ ID NO.4所示;
编码2)猫疱疹病毒苗I型免疫逃脱相关蛋白gC截短体的基因的核苷酸序列如SEQID NO.5所示;
编码3)猫疱疹病毒苗I型免疫逃脱相关蛋白gE截短体的基因的核苷酸序列如SEQID NO.6所示。
由广州艾基生物技术有限公司合成基因序列,并与载体连接,载体名称为:pCDNA3.1(+),大小为5428bp,抗性:Amp,插入位点:5’端:EcoRI;3’端: XabI,分别得到gD、gC和gE的重组质粒。
得到的pcDNA3.1(+)-FHV-1_gD-trancation-8xHis(1),大小6223bp,其载体图如图1所示;
得到的pcDNA3.1(+)-FHV-1_gC-trancation-8xHis(1),大小6808bp,其载体图如图2所示;
得到的pcDNA3.1(+)-FHV-1_gE-trancation-8xHis(1),大小6460bp,其载体图如图3所示。
实施例2重组蛋白的表达及纯化
将实施例1制得三种重组表达载体分别转化至大肠杆菌DH5α中,涂布于含氨苄青霉素(终浓度100μg/mL)的LB平板上,37℃培养过夜。选取单克隆菌落,接种至100mL含氨苄青霉素(终浓度100μg/mL)的LB培养基37℃,220r/min,培养过夜。7000r/min离心3min,收集得到菌体,使用天根大规模质粒提取试剂盒提取质粒。所得质粒0.22μm过滤除菌,nano-drop核酸检测仪测取浓度后。-20℃保存备用。
将300μg目的质粒与1.2mL 0.5mg/mL PEI分别加入3750μL OTM中涡轮振荡3s混匀,静置10min后将二者混合,涡轮振荡3s混匀后静置10min。静置后将液体加入300mL细胞密度为1×10
用50mL缓冲液Buffer(500mM Tris-HCl,0.2M NaCl,pH=8.0)破碎细胞;175W超声破碎3s,间隔4s,共45min;最后4℃,转速10000r/min,离心30min,收集上清。上清液使用Ni柱分离,梯度咪唑溶液洗脱,SDS-PAGE电泳检测洗脱液中目的蛋白含量(图4)。目的蛋白所在洗脱液用10kDa超滤管、10kDa透析袋以及pH=7.4PBS溶液进行浓缩透析。浓缩得到gD、gC和gE目标蛋白通过 0.22μm滤膜过滤除菌后于-20℃保存备用。
实施例3不同浓度的猫疱疹病毒苗I型三价疫苗的配制
纯化的gD、gC和gE的蛋白质量比为1:1:1进行混合,获得各蛋白浓度均为 200μg/ml、400μg/ml和800μg/ml蛋白混合液。同时,配制未添加gD蛋白(对照组1)、未添加gC蛋白(对照组2)以及未添加gE蛋白(对照组3)的蛋白混合液作为对照。
ISA 201 VG佐剂:将ISA 201 VG佐剂输入乳化罐中,在搅拌条件下 (200r/min),缓慢输入(流速5~6L/min)等量(W∶W)配好的蛋白混合液。分别将不同待蛋白混合液加入后,提高搅拌速度至300r/min,继续搅拌20~30 分钟(整个乳化过程温度控制在30~32℃)。在搅拌过程中将容器冷却至15℃以下,停止搅拌,将乳液在15℃以下静置24小时。最终,获得100μg/ml(试验组1)、200μg/ml(试验组2)和400μg/ml(试验组3)的猫疱疹病毒苗I型三价疫苗以及3个对照组。
实施例4猫疱疹病毒I型疫苗免疫后血清抗体含量及效价
设立8组(表1),每组5只2-3月龄中华田园猫,检测FHV-1、FCV、FPV,结果均为阴性。采集外周血,检测FHV-1抗体,筛选出抗体阴性的宠物猫(40 只)进行实验。试验组1-3和对照组1-3组疫苗分别以0.05ml的剂量进行肌肉注射,阴性对照组注射等量PBS缓冲液,阳性对照组注射等量“妙三多”疫苗。7d 后进行第二次免疫,14d后进行第三次免疫。所有猫分别于免疫前以及免疫后7 日、14日、28日颈静脉采血,分离血清,利用ELISA测定抗体滴度变化。具体结果如表2所示。
表1疫苗分组
表2血清抗体含量变化
实施例5猫疱疹病毒I型疫苗免疫后临床情况
自免疫开始,每隔7天测定上述免疫的40只中华田园猫的体温和体重,观察每组免疫猫的采食、饮水、精神有无明显变化,有无全身不良反应,注射部位是否出现局部不良反应。如表3所示,每批试验猫均无不良症状出现,采食和饮水正常,注射部位无不良反应。每组猫体温稳定,体重持续增长(图5和6)。
表3各组试验猫临床观察结果
实施例6假病毒中和试验
HEK293T细胞以8×10
将293T细胞铺于96孔板,每孔10
表4各组疫苗假病毒抑制率
实施例7攻毒试验评价猫疱疹病毒I型疫苗的效力
(1)FHV-1病毒攻毒后临床变化
在首次免疫42d后,利用10
表5 FHV-1攻毒后临床评分方法
表6 FHV-1攻毒后试验组1临床症状及评分
表7 FHV-1攻毒后试验组2临床症状及评分
表8 FHV-1攻毒后试验组3临床症状及评分
表9 FHV-1攻毒后对照组1临床症状及评分
表10 FHV-1攻毒后对照组2临床症状及评分
表11 FHV-1攻毒后对照组3临床症状及评分
表12 FHV-1攻毒后阴性对照组临床症状及评分
表13 FHV-1攻毒后阳性对照组临床症状及评分
(2)FHV-1病毒攻毒后呼吸道病毒载量
攻毒后14天,采集所有猫的鼻拭子和咽拭子进行FHV-1的qPCR检测。首先测得FHV-1标准品浓度为8.30×10
表14 FHV-1攻毒所有猫情况
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
