具有受抑制的乙醇产生途径的耐酸酵母及使用其生产乳酸的方法
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及一种使用具有受抑制的乙醇产生途径的耐酸酵母来生产乳酸的方法,更具体地,涉及一种具有乳酸产生能力并且具有受抑制的乙醇产生途径的耐酸酵母,以及使用该耐酸酵母生产乳酸的方法。
背景技术
聚乳酸(PLA)是可生物降解的聚合物,其是通过将乳酸转化为丙交酯并在其上进行开环聚合反应而制备的。原料乳酸是通过发酵生产的。PLA广泛用于一次性食品容器中,并且具有可单独使用或在塑料中以组合物或共聚物的形式用于包括汽车行业在内的各种行业的优点。此外,它是近年来在3D打印中使用的代表性聚合物,并且是一种环保聚合物,当用于3D打印机时,它会产生较少量的有害气体和气味。这种可生物降解的聚合物是一种有前途的聚合物,它可以减少近年来已成为全球性问题的废塑料和塑料微粒对环境破坏的加速作用,并且在发达国家中其使用正在增加。为了以较低的成本生产PLA,正在努力提高乳酸作为单体的生产率。
传统的乳酸生产方法是使用乳酸菌进行的,包括进行发酵,同时使用各种形式的Ca盐或中和剂(例如氨水)保持6-8的中性pH,以防止由于产生的乳酸和乳酸菌的积累而导致细菌死亡或减慢其生长。当发酵完成时,分离微生物,并添加硫酸以将乳酸盐转化为乳酸并将乳酸转化为丙交酯,同时由于难以从水中分离盐而将Ca盐以CaSO
同时,乳酸具有L型旋光异构和D型旋光异构体。有各种各样的微生物群(microbial group),例如,主要产生L型旋光异构体的乳酸菌通常也产生约5-10%的D型旋光异构体,而主要产生D型旋光异构体的菌株包括同时产生D型旋光异构体和L型旋光异构体的菌株、同时产生D型旋光异构体和乙醇的菌株等(Ellen I.Garvie,MicrobiologicalReviews,106-139,1980)。
在这些光学异构乳酸中,D型主要仅用于医疗和药物递送,但是当应用于PLA时,随着由于D型丙交酯导致的结晶速率增加,观察到热性质的改善。当根据纯L型聚合物和纯D型聚合物的组合加工条件在结构上形成立构复合PLA时,发现了比PE/PP以及常规的PLA具有更高耐热性的新型聚合物。因此,关于由D型引起的结晶度增加以及通过其提高PLA的物理性能的研究和商业化正在积极进行,并且PLA的应用领域正在扩大。
通常,PLA通过发酵产生乳酸,然后将通过纯化工艺产生的乳酸转化为丙交酯。为了转化为丙交酯,需要将乳酸转化为氢化形式的工艺,并且中性发酵的pH通常为6-7,因此使用大量的硫酸将中性pH改变为酸性pH。在该工艺中,产生大量的中和盐,并且由于中和盐的价值低以及投资于去除这些中和盐的工艺的成本,经济可行性降低。
同时,就自然产生乳酸的乳酸杆菌(Lactobacillus)而言,为了工业化生产乳酸,必须使用大量昂贵的营养物作为培养基。营养成分的这种过度使用极大地阻碍了下游聚合工艺或丙交酯用作中间体的情况下的丙交酯转化工艺,为了获得高产率和高纯度的聚合物或其前体,需要进行纯化工艺(例如吸附、蒸馏和离子交换)的费用,因此进一步增加了生产成本。为了解决这些问题,已经提出了使用酵母的研究。众所周知即使使用廉价的营养物,酵母也能进行生长/发酵,并且对酸性条件具有高度的抵抗力。
当使用在酸中生长良好的酵母生产乳酸(以下称为“耐酸酵母”)时,在发酵工艺中无需使用中和剂将培养基的pH维持在6-7,因此简化了发酵过程,并且不需要用于去除中和剂的下游纯化工艺。此外,酵母本身会产生代谢所需的许多成分,因此与细菌(尤其是乳杆菌)相比,可以在营养物水平相对较低的培养基中进行培养,从而消除了下游纯化工艺,并显著降低了生产成本。
但是,使用酵母生产乳酸的技术存在先决条件。先决条件是,作为菌株发酵性能指标的乳酸的收率、生产率和浓度必须保持与乳酸菌性能相似的高水平才能使该技术商业化应用。
尽管许多文献要求开发使用酵母的耐酸乳酸技术(acid-resistant lactic acidtechnology),但实际上,在许多情况下,仅通过在发酵过程中进行中和反应,并在保持至少3.7的pH值(不小于乳酸的pKa值)的条件下进行发酵,才能获得高性能的发酵能力。因此,确定该技术为实现耐酸性的实用方法是不合理的,并且很难预期将其应用于工艺时降低生产成本的效果(Michael Sauer et al.,Biotechnology and Genetic EngineeringReviews,27:229-256,2010)。
因此,只有在耐酸酵母为能够在不超过pKa值的发酵液的pH值下无需使用中和剂或以最小量使用中和剂来完成发酵的耐酸酵母,并且三个主要的发酵指标达到了与乳酸菌相似的水平时,能够降低工艺成本的耐酸酵母才能实现商业应用。
通常,当葡萄糖发酵时,酵母代谢的主要产物是乙醇,几乎不产生乳酸。此外,由于从具有高耐酸性的微生物中选择产生乳酸的菌株的可能性非常低,因此,本发明人首先选择了具有优异的耐酸性的酵母菌株,并试图通过基因工程方法赋予所选菌株以乳酸产生能力。此外,所有产生乙醇的菌株均选自实际选择的耐酸菌株文库。
乳酸的生产的代谢途径是通过丙酮酸中的一步反应进行的。该步骤由乳酸脱氢酶产生,然后乳酸通过主动转运或扩散而排到细胞外部。为了发酵产生这种乳酸作为主要产物,必须引入乳酸产生能力,并且同时进行操作以去除现有的乙醇产生能力。通常,酵母中丙酮酸向乙醇的转化是通过乙醛以两步反应进行的,并且通常使用包括去除将丙酮酸转化为乙醛的PDC基因并引入LDH的方法。
然而,对于Crabtree阳性酵母(如酿酒酵母(Saccharomyces cerevisiae)),当丙酮酸脱羧酶(PDC)完全被阻断时,细胞中脂质合成所需的胞质乙酰辅酶A的供给就会被阻断,因此极大地抑制了生长。当PDC没有被完全阻断时,会出现由于与LDH竞争相同的底物丙酮酸而不能完全阻断乙醇产生的问题,因此不能将产率提高到乳酸菌的水平。
因此,本发明人付出了巨大的努力来选择耐酸酵母并赋予其乳酸产生能力。结果,本发明人发现,当耐酸酵母中用于乙醇产生的代谢途径的ADH(醇脱氢酶)基因被用于乳酸产生的代谢途径的LDH基因替换时,LDH的表达显著增加,因此产生乳酸的能力增加。基于该发现,完成了本发明。
发明内容
因此,鉴于上述问题提出了本发明,并且本发明的一个目的是提供一种具有降低的乙醇产生能力和改善的乳酸产生能力的重组耐酸酵母。
本发明的另一个目的是提供一种使用重组耐酸酵母生产乳酸的方法。
根据本发明的一个方面,上述和其他目的可以通过提供一种具有乳酸产生能力的重组菌株来实现,其中从耐酸酵母YBC菌株(KCTC13508BP)中缺失或减弱g4423基因,并将编码乳酸脱氢酶的基因引入该YBC菌株。
根据本发明的另一方面,提供了一种生产乳酸的方法,该方法包括(a)培养根据本发明的重组菌株以产生乳酸,和(b)获得所产生的乳酸。
根据本发明的另一方面,提供了一种基因构建体,其包括可操作地彼此连接的含有SEQ ID NO:2的核苷酸序列的启动子和编码乳酸脱氢酶的基因;以及包含该基因构建体的重组载体。
根据本发明的另一方面,提供了一种重组微生物,其中遗传结构或重组载体被引入其中。
根据本发明的另一方面,提供了一种生产乳酸的方法,该方法包括(a)培养根据本发明的重组菌株以产生乳酸,以及(b)获得所产生的乳酸。
附图说明
图1示出了在常规已知的酿酒酵母(S.cerevisiae)菌株和作为本发明中使用的耐酸菌株的YBC菌株之间比较对乳酸的抗性的结果。
图2示出了确认YBC菌株中ADH候选基因的表达水平的结果。
图3示出了确认野生型YBC菌株和G4423敲除菌株的乙醇产生能力的结果。
图4示出了在每个等位基因中表达LDH或去除靶基因的基因盒的实例,其中(a)为在g4423的等位基因1中表达LDH的盒(cassette),(b)为在g4423的等位基因2中表达LDH的盒,(c)为用于去除靶基因的盒的实例。
图5示出了确认引入有来自三种菌株的LDH的YBC重组菌株的乳酸产生能力的结果。
图6示出了确认重组菌株的乳酸产生能力的结果,其中在YBC菌株的g4423基因的位置处引入了两个拷贝的LDH基因。
图7示出了比较重组菌株在不同pH下的乳酸产生能力的结果,其中在YBC菌株的g4423基因的位置处引入了两个拷贝的LDH基因。
具体实施方式
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的技术人员所理解的相同的含义。通常,在此使用的术语在本领域中是众所周知的并且是通常使用的。
耐酸酵母的特征在于即使在酸性pH下也能快速消耗糖,表现出高生长速率,并且在发酵条件下将消耗的糖转化为所需的产物。在本发明中,通过几个酵母文库从具有这些特性的酵母中选择耐酸酵母,并且即使在40g/L至80g/L的乳酸浓度下,所选择的菌株也具有较高的生长率和较高的糖消耗率。使用基因工程对所选择的菌株进行代谢途径控制。
如上述控制代谢途径的方法所述,许多研究人员已经进行了通过在丙酮酸中的竞争性反应去除丙酮酸脱羧酶来减少乙醇的研究,并且以前由嘉吉(Cargill)、丰田(Toyota)、三星(Samsung)等进行的许多研究已经发表(US 7534597,US 7141410B2,US9353388B2,JP 4692173B2,JP 2001-204464A,JP 4095889B2,and KR 1686900B1)。通过去除PDC减少乙醇的作用是非常直接和有效的,但是由于去除PDC,酵母会引起严重的副作用。特别地,具有非常强的乙醇发酵的菌株,例如Crabtree阳性菌株,会引起更大的副作用(Yiming Zhang,et al.,Microbial Cell Factory,14:116,2015)。乙酰辅酶A是酵母中必需的代谢产物,由线粒体中的Pdh酶提供,但乙醛是通过PDC途径从细胞质中的糖代谢中产生的。因此,当去除PDC基因时,在细胞质中停止了乙酰辅酶A的供应,并且因此,停止了脂肪酸的产生并因此抑制了细胞生长。在与呼吸有关的基因被葡萄糖抑制且线粒体中的TCA循环减弱的Crabtree阳性菌株中,这种现象极大地增强了。这样的细胞质乙酰辅酶A可以通过其他副反应途径提供,但是由于严重的生长抑制而抑制了发酵产物的产生速率,因此失去了作为商业菌株的价值。为了减少这些副作用,应通过突变/进化产生具有增强的乙酰辅酶A间接供应途径的菌株,但是这种进化需要长期研究,每种菌株的作用可能有所不同,并且其确切机理尚未阐明。
另一种方法是通过阻断作为PDC的下一步的ADH来防止由乙醛转化为乙醇。这种阻断ADH的方法不会由于细胞质乙酰辅酶A的供应不足而抑制生长,而是通过阻断ADH通过乙醛的积累抑制生长,乙醛是乙醇和有毒物质的前体。通过引入要强表达的乳酸代谢途径,可以减少通过阻断ADH引起的乙醛积累。由于乳酸代谢是通过丙酮酸的转化而进行的,丙酮酸是乙醛的上游反应物,因此随着该途径的增强,通向PDC和ADH的通量自然降低,通量的这种自然降低可降低乙醛的累积浓度。在此背景下,本发明开发了一种阻断ADH并增加乳酸产生的酵母菌株。
因此,一方面,本发明涉及具有乳酸产生能力的重组菌株,其中从耐酸酵母YBC菌株(KCTC13508BP)中缺失或减弱g4423基因,并将编码乳酸脱氢酶的基因引入该YBC菌株。
酵母的乙醇产生能力非常强。特别地,即使在高糖浓度以及氧气的存在下,具有Crabtree作用的酵母在消耗糖的同时产生乙醇。这种强大的乙醇产生能力是由于酶的高活性和强烈表达酶的启动子的作用。因此,为了将这种乙醇产生能力转化为乳酸产生能力,应当将强启动子与强LDH酶一起使用。为此目的,本发明人进行了研究以使用酿酒酵母(Saccharomyces cerevisiae)的各种已知启动子来提高表达水平,但是未能得到表现出所需表达水平的启动子。
通常,启动子具有多种调节机制,因此通常专门用于某些菌株。因此,在本发明中,在靶菌株YBC菌株(KCTC13508BP)中检测与糖酵解和乙醇产生有关的基因的表达水平,并且鉴定出g4423基因是表达最强的ADH基因。认为可以通过用具有强活性的LDH基因替代所鉴定的ADH基因(g4423基因),然后通过g4423启动子表达LDH基因,从而用乳酸产生通量代替YBC菌株的乙醇产生通量。此外,引入到YBC菌株中的LDH基因产生的酶应具有强活性,但LDH基因应具有优异的丙酮酸选择性(即,Km值应低),因为它应与YBC菌株中的PDC基因竞争丙酮酸底物。然而,当在体外测量Km值时,优选基于体内结果来确定LDH的选择性,因为取决于测量条件的Km值的差异很大。因此,必须基于高活性和低Km值来选择能良好产生乳酸的LDH基因。为了可靠地分析(确定)这些特性,将各种已知的LDH基因直接引入YBC菌株的g4423基因位点,比较乳酸产生能力,并选择最佳基因。
在本发明中,引入了编码乳酸脱氢酶的基因,使得该基因的表达由g4434基因的启动子(SEQ ID NO:3或4)调节。
在本发明中,编码乳酸脱氢酶的基因可以源自植物乳杆菌(Lactobacillusplantarum),并且可以为编码SEQ ID NO:1所示的氨基酸序列的基因。
在本发明中,重组菌株的特征在于,由于g4423基因的缺失或减弱,与亲本菌株YBC菌株(KCTC13508BP)相比,乙醇产生能力降低。
在本发明的一个实施方案中,在引入来自植物乳杆菌的LDH代替g4423基因的YBC重组菌株中产生了57.1g/L的乳酸。
因此,另一方面,本发明涉及生产乳酸的方法,其包括(a)培养重组菌株以产生乳酸,和(b)获得所产生的乳酸。
通过本发明,可以获得表现出大大增加乳酸的产生和大大减少乙醇的产生的耐酸菌株。
另一方面,本发明提供了一种基因构建体,所述基因构建体包括:可操作地彼此连接的包含SEQ ID NO:3或SEQ ID NO:4的核苷酸序列的启动子和编码乳酸脱氢酶的基因;以及重组载体,其包含基因构建体。
在本发明中,基因构建体可以进一步包括具有SEQ ID NO:5或SEQ ID NO:6所示的核苷酸序列的终止子。
在本发明中,编码乳酸脱氢酶的基因可以为编码SEQ ID NO:1所示的氨基酸序列的基因。
另一方面,本发明提供了一种生产乳酸的方法,该方法包括(a)培养引入有基因构建体或重组载体的重组微生物,以及(b)获得所产生的乳酸。
g4423启动子优选具有与SEQ ID NO:3或SEQ ID NO:4所示序列具有至少90%、至少92%、至少93%、至少95%、至少97%、至少98%、至少99%或100%的序列同源性的序列。
在启动子与本发明的g4423启动子具有至少90%同源性并且表现出与其等效的表达效率的情况下,该启动子可以被认为是基本上等效的启动子。
在某些情况下,根据本发明的g4423启动子可以通过本领域已知的技术进行突变,以提高靶基因的表达效率。
在本发明中,重组酵母可以具有耐酸性,并且为了产生适用于本发明的耐酸重组酵母,可以优选使用对有机酸具有抗性的宿主酵母。
耐酸酵母可以为具有耐酸性的酵母,其选自由酵母属(genus Saccharomyces)、Kazachstania saccharomyces物种和假丝酵母属(genus Candida),并且例如选自酿酒酵母、Kazachstania exigua、Kazachstania bulderi,但不限于此。
术语“耐酸酵母”是指对有机酸例如3-HP或乳酸具有抗性的酵母,并且可以通过评估在包含各种浓度的有机酸的培养基中的生长来确定耐酸性。即,术语“耐酸酵母”是指在含有高浓度有机酸的培养基中比一般酵母表现出更高的生长速率和生物质消耗速率的酵母。
如本文所用,术语“耐酸酵母”被定义为与培养基不含有机酸的情况相比,当培养基中以至少1M的浓度包含有机酸(尤其是乳酸)时,在小于有机酸的pKa值的pH下,可以保持至少10%的生物质消耗率(例如糖消耗率)或至少10%的比生长速率的酵母。更具体地,术语“耐酸酵母”定义为与5以上的pH相比,在2-4的pH下,可以保持至少10%的生物质消耗率(例如糖消耗率)或至少10%的比生长速率的酵母。
根据本发明的重组酵母可以通过按照常规方法将基因插入宿主酵母的染色体中或通过将包括该基因的载体引入宿主酵母中来生产。
作为宿主酵母,通常使用具有高DNA引入效率和高表达效率的宿主细胞。在本发明的一个实施方案中,使用耐酸酵母,但是本发明不限于此,可以使用任何类型的酵母,只要其能够充分表达靶DNA即可。
重组酵母可以根据任何转化方法来制备。术语“转化”是指将DNA引入宿主以使DNA可作为染色体的因子而复制或通过染色体整合而复制的现象,并且是指通过将外部DNA引入细胞来人工诱导遗传变化的现象。通用的转化方法包括电穿孔、乙酸锂-PEG等。
此外,在本发明中,可以使用任何通常已知的基因工程方法作为将基因插入宿主微生物的染色体中的方法。例如,已有使用逆转录病毒载体、腺病毒载体、腺相关病毒载体、单纯疱疹病毒载体、痘病毒载体、慢病毒载体、非病毒载体等的方法。“载体”是指DNA产物,其包含与可在合适的宿主中表达DNA的合适的调节序列可操作地连接的DNA序列。载体可以是质粒、噬菌体颗粒或简单地潜在的基因组插入物。当转入合适的宿主时,载体可以被复制或执行独立于宿主基因组的功能,或者其中一些可以与基因组整合。质粒是目前最常用的载体形式,但是线性DNA也是酵母基因组整合的常用形式。
典型的质粒载体包括:(a)复制起点以有效地进行复制,以便每个宿主细胞包括预定量的质粒载体;(b)抗生素抗性基因或营养缺陷型标记基因,以筛选用质粒载体转化的宿主细胞;和(c)插入外源DNA片段的限制性酶切位点。即使不存在适当的限制酶切位点,也可以按照常规方法利用合成的寡核苷酸衔接子或接头容易地连接载体和外源DNA。
此外,当基于功能关系将核酸序列与另一个核酸序列成线性布置(align)时,其与之“可操作地连接”。这可以是以这样的方式连接的基因和控制序列,使得当合适的分子(例如,转录激活蛋白)与控制序列连接时能够表达基因。例如,当表达为涉及多肽分泌的前蛋白时,前序列或分泌前导序列的DNA可操作地连接至多肽的DNA;当启动子或增强子影响序列的转录时,启动子或增强子可操作地与编码序列连接;当核糖体结合位点影响序列的转录时,核糖体结合位点可操作地与编码序列连接;或当定位(positioned)以促进翻译时,核糖体结合位点可操作地连接至编码序列。
通常,术语“可操作地连接”是指连接的DNA序列与其接触,或分泌前导序列与其接触并存在于阅读框中。然而,增强子不必与其接触。这些序列的连接是通过在方便的(convenient)限制性酶切位点处进行连接(结合)来进行的。当不存在这样的位点时,使用根据常规方法的合成寡核苷酸衔接子或接头。
应当理解,并不是所有的载体在表达本发明的DNA序列时都具有相同的功能。同样,并非所有宿主对于同一表达系统都具有相同的功能。然而,本领域技术人员将能够从多种载体、表达控制序列和宿主中进行适当的选择,而没有过多的实验负担,也不会脱离本发明的范围。例如,载体的选择应考虑宿主,因为载体应在其中复制。还应考虑载体复制的次数、控制载体复制的次数的能力以及相应载体编码的其他蛋白的表达,例如抗生素标记的表达。
在本发明中,碳源可以包括但不限于选自葡萄糖、木糖、阿拉伯糖、蔗糖、果糖、纤维素、半乳糖、葡萄糖低聚物和甘油中的一种或多种。
在本发明中,可以在使得诸如大肠杆菌(E.coli)等微生物不再起作用(例如不能产生代谢物)的条件下进行培养。例如,可以在1.0-6.5的pH、优选1.0-6.0的pH、更优选2.6-4.0的pH下进行培养,但不限于此。
在下文中,将参考实施例更详细地描述本发明。然而,对本领域技术人员而言显而易见的是,提供这些实施例仅用于举例说明本发明,而不应解释为限制本发明的范围。
实施例1:耐酸菌株YBC的选择及其效果
本发明人通过对各种酵母菌株进行测试,选择了具有耐酸性的菌株群(韩国专利公开第2017-0025315号)。通过在酵母菌株培养开始时向培养基中添加乳酸,并监测微生物的生长和糖消耗速率,来确定具有最佳耐酸性的菌株。此时,接种的OD为4,并且本文所用的培养基是补充有3.5%葡萄糖的YP培养基(20g/L蛋白胨,10g/L酵母提取物),并且在50ml烧瓶培养物中以30℃和100rpm进行实验,并以60g/L的初始乳酸浓度进行培养。通过比较和分析结果,选择YBC菌株(Kazachstania exigua sB-018c)作为具有最佳耐酸性的菌株,并于2018年4月11日将其保存在韩国生物科学与生物技术研究所生物资源中心(BiologicalResource Center in the Korea Research Institute of Bioscience andBiotechnology),保藏号为KCTC13508BP。
系统发育(Phylogenetic)分析表明,YBC菌株为与酿酒酵母(S.cerevisiae)相似的菌株,是二倍体,并且是Crabtree阳性。
为了检测所选的耐酸YBC菌株的耐酸性,在与酿酒酵母(CEN.PK113-7D)菌株相同的条件下培养该菌株。将30g/L乳酸和60g/L乳酸分别添加到补充有40g/L葡萄糖的YP培养基中,然后在30℃和200rpm下温育50小时来比较培养液的OD值。如图1所示,对于YBC菌株,可以发现,即使在60g/L的高乳酸浓度下,YBC菌株也可以生长,而酿酒酵母CEN.PK菌株在60g/L的乳酸浓度下根本无法生长。
实施例2:通过检测YBC菌株中乙醇产生基因的表达率鉴定主要表达基因
在该实施例中,靶向ADH基因是为了在YBC菌株中选择在强烈表达过程中不影响生长的高效基因并将其用在糖存在下强烈表达的与糖酵解和乙醇产生相关的基因进行替换。特别是,应避免与糖酵解相关的基因,以免直接影响微生物的生长。其原因是,当与糖酵解相关的基因丢失或减少时,对微生物生长很重要的丙酮酸的产生受到抑制,或者发生链反应平衡的问题,从而影响微生物的生长,并因此降低发酵能力。因此,当目标菌株是产生乙醇的菌株时,选择PDC基因或ADH基因作为基因替换的内在基因,并考虑到PDC敲除(K/O)的负面影响来选择和去除ADH。
具有强大乙醇发酵能力的菌株(例如酵母)包含具有多种强度和功能的ADH,在YBC菌株的ADH中鉴定产生乙醇的主要ADH,并通过比较YBC的基因组信息和酿酒酵母的已知ADH基因信息,选择几个候选基因,以使用相应的启动子,并在其上进行qPCR。
利用酿酒酵母全基因组序列数据中的生物信息学信息选择YBC菌株基因组中存在的7种ADH基因候选物,并通过设计对所选基因特异的寡聚体进行RT-qPCR。
利用酿酒酵母全基因组序列数据中的生物信息学信息选择7种ADH基因候选物(表1),并通过设计对所选基因特异的寡聚物进行了RT-qPCR(表2)。
[表1]
*与酿酒酵母基因组相比,YBC中具有相似基因序列的基因
[表2]
qPCR的引物
结果,如图2所示,发现g4423基因的表达水平非常高,因此鉴定出g4423是主要的乙醇产生基因。
实施例3:当从YBC菌株中去除g4423时降低乙醇产生的作用的检测
通过敲除作为实施例2中鉴定的YBC菌株的主要ADH的g4423来产生重组菌株,并检测了ADH去除对菌株生长的影响。
基于g4423和UTR的信息产生类似于图4(c)的基因盒(其具有5'UTR和3'UTR和抗生素标记,并且已从其中去除了g4423 ORF),并将其用作供体DNA。如上所述,使用限制酶的克隆方法和使用Gibson组装的方法产生供体DNA。使用ORF引物(正向引物(SEQ ID NO:43):GAGATAGCACACCATTCACCA,反向引物(SEQ ID NO:44):CAACGTTAAGTACTCTGGTGTTTG)检测ORF的去除,以鉴定引入制备的供体DNA后在对应于标记基因的平板上生长的菌落中的g4423。
将产生的g4423敲除菌株在30℃和200rpm下在150ml的具有40g/L葡萄糖浓度的YP培养基中培养。
结果,如从图3中可以看出的,与野生型YBC菌株(图3A)相比,g4423敲除菌株(图3B)显示出显著降低的乙醇产生能力,由于ADH活性降低而具有降低的葡萄糖摄取能力,并因此限制了NADH氧化,从而表现出生长恶化和甘油产生量增加来弥补这一点。
实施例4:已知的LDH基因的表达和使用g4423启动子的最佳LDH的选择
根据文献(N.Ishida et.al.,Appl.Environ.Microbiol.,1964-1970,2005和M.Sauer et al.,Biotechnology and Genetic Engineering Reviews,27:1,229-256,2010)选择将要导入YBC菌株的LDH基因的候选基因,并选择总共三个基因,即源自瑞士乳杆菌(L.helveticus)的LDH基因、源自米根霉(R.oryzae)的LDH基因、和源自植物乳杆菌(L.plantarum)的LDH基因。
基于上述文献,选择在酵母中高水平表达并良好产生乳酸的LDH作为每种酶的基因,并且选择在pH
因此,使用g4423启动子将选择的三个基因中的每一个引入YBC菌株中以产生重组菌株,并确定每种重组菌株产生乳酸的能力。
根据g4423和UTR的信息产生图4(a)的基因盒(其中g4423 ORF已从其去除,并且存在5'UTR和3'UTR和抗生素标记),并且使用分别针对3种LDH进行酵母密码子优化的序列(SEQ ID NO:2、8和10的基因序列以及SEQ ID NO:1、7和9的氨基酸序列)合成植物乳杆菌、瑞士乳杆菌(Lactobacillus helveticus)和米根霉(Rhizopus oryzae)的LDH,然后使用限制酶将其引入g4423的ORF位点。
供体DNA在完成的盒中扩增并转化至YBC菌株中,并且存在引物以鉴定g4423 ORF(ORF内部正向引物(SEQ ID NO:45):CAACGTTAAGTACTCTGGTGTTTG,ORF内部反向引物(SEQID NO:46):GAGATAGCACACCATTCACCA,ORF外部正向引物(SEQ ID NO:47):5'GGATTCCTGTAATGACAACGCGAG,ORF外部反向引物(SEQ ID NO:48):3'TGGATACATTACAGATTCTCTATCCT),并且鉴定了生长菌落中每个LDH的ORF,因此发现使用以下引物将每个LDH以1个拷贝引入:
瑞士乳杆菌正向引物(SEQ ID NO:49):ATGAAAATTTTTGCTTATGG
瑞士乳杆菌反向引物(SEQ ID NO:50):TTAATATTCAACAGCAATAG;
米曲霉正向引物(SEQ ID NO:51):ATGGTTTTGCATTCTAAAGT
米曲霉反向引物(SEQ ID NO:52):TTAACAAGAAGATTTAGAAA
植物乳杆菌正向引物(SEQ ID NO:53):ATGTCTTCTATGCCAAATCA
植物乳杆菌反向引物(SEQ ID NO:54):TTATTTATTTTCCAATTCAG
由于YBC菌株是二倍体菌株,即使将一个LDH基因插入该菌株,另一个g4423基因也会发挥作用,因此乙醇的产生量不会像完全敲除(K/O)的菌株那样减少。
使用补充有4%葡萄糖和150mg/L尿嘧啶的YP培养基,将产生的重组菌株在30℃/100rpm的烧瓶中摇动培养24小时。
通过HPLC观察培养液中的乳酸和乙醇。使用安装在Waters 1525Binary HPLC泵上的Bio-Rad Aminex 87-H色谱柱分析培养液中葡萄糖、乙醇和L-乳酸的浓度。使用Waters2414折射率检测器分析葡萄糖和乙醇,使用Waters 2489UV/Visible检测器(210nm)分析L-乳酸,绘制峰面积标准曲线(取决于每种成分的浓度),计算出浓度,具体分析条件如下。
1.流动相条件:0.005M H
2.流速:0.6mL/分钟
3.运行时间:40分钟
4.柱温箱温度:60℃
5.检测器温度:40℃
6.进样量:10μL
7.自动进样器托盘温度:4℃
结果,如从图5和表3可以看出,所有取代的靶基因均表现出LDH活性,并且引入植物乳杆菌的LDH基因的菌株表现出最高的乳酸产生能力。
表3示出了相应LDH文献中报道的Km值。然而,该数字只能用于在相同条件下测试的酶之间的比较,并不意味着是一个固定值。在该实验中,还发现从源自植物乳杆菌的具有相对高的Km值的基因表达的LDH能够与菌株中的PDC基因竞争并且良好地产生乳酸。此外,上述结果表明,在耐酸菌株YBC中与PDC竞争并显示出最高的乳酸产生能力的基因是源自植物乳杆菌的LDH基因。
[表3]
①Kirsi savijoki and Airi Palva,Applied and EnvironmentalMicrobiology,2850-2856,1997
②Christopher D.S.et al.,Enzyme and Microbial Technology 44(2009)242-247,2009
③Anna Feldman-Salit et al.,
实施例5:确认乙醇产生被阻断和使用选择的LDH的乳酸产生能力
产生了重组菌株,其中引入了实施例4中选择的源自植物乳杆菌的LDH基因的2个拷贝代替YBC菌株的g4423基因,并且确定其产生乳酸的能力。
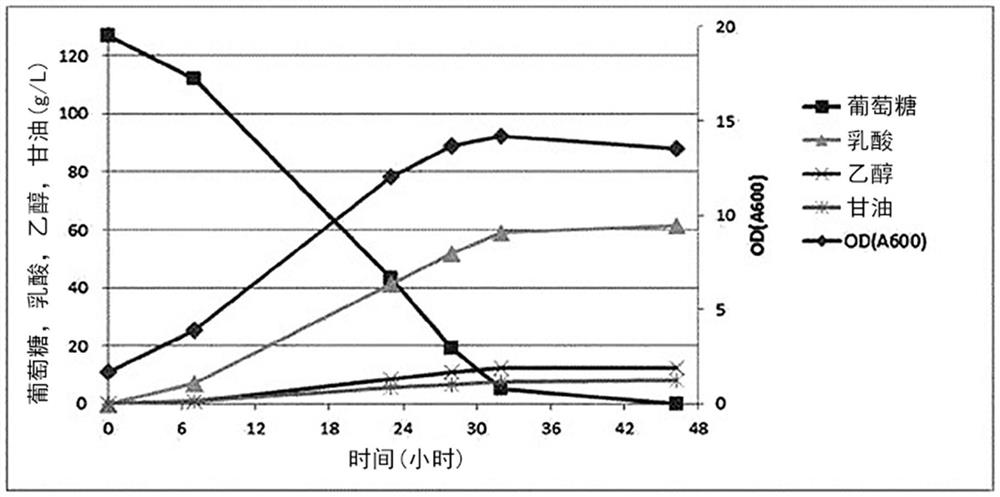
相应的YBC菌株具有二倍体基因组。本发明人通过实施例4的生产方法产生了为图4(a)和(b)所示的每个等位基因具有不同抗生素抗性基因的供体DNA,然后将供体DNA导入到YBC菌株中,每个等位基因两次。然后,使用g4423的ORF引物鉴定出g4423 ORF的完全去除,每个抗生素抗性基因的存在表明已引入该基因的2个拷贝。抗生素抗性基因的存在会在将来使基因操作失效,因此使用盒中引入的Cre-LoxP方法去除了每个抗生素抗性基因。
使用重组菌株在发酵罐中测定产生乳酸的能力。本文使用的培养基是Hestrinand Schramm培养基(葡萄糖120g/L、蛋白胨5g/L、酵母提取物5g/L、柠檬酸1.15g/L、K
结果,如从图6可以看出,未检测到在去除ADH的菌株中通常观察到的由乙醛造成的生长抑制,并且甘油产生量没有增加,这表明NADH的氧化发生得很好并且由于新表达的LDH酶,内部氧化还原平衡非常均衡。此外,当表达额外的LDH时,NADH的氧化速率进一步加速,并且乳酸的产生率和浓度可以进一步提高。
以上结果表示相对于使用先前已知的ADH阻断和相关的LDH表达的结果有很大的改进(Kenro Tokuhiro et al.,Applied Microbiology and Biotechnology,82:883-890,2009)。首先,可以看出,即使乙醇的产生大大减少,糖也很容易被消耗并转化为乳酸。低水平的甘油意味着NADH的氧化反应由强表达的LDH忠实地进行。从培养液的OD值可以看出,维持了对乳酸的耐酸性,并且乙醇阻断的中间产物乙醛的毒性很小。这些性能指标还表明,当通过阻断乙醇的产生进行向乳酸的转化时,收率、浓度和发酵速率这三个指标平稳地增加,并实现开发可商业应用菌株的目的。
将使用常规技术作为示例来给出更详细的描述。如上所述,当ADH被阻断时,乙醇的产量可能会减少,但是乙醇的前体丙酮酸和乙醛会按照下降的比例积累,从而导致对细胞的毒性增加。此外,阻断ADH抑制了通过ADH发生的NADH的氧化反应,大大降低了糖的消耗速率,并增加了另一种还原性物质甘油的产生量,为了解决这一问题,导致乳酸产生率下降,副产品的产生率提高的问题。在这种情况下,当LDH有效表达时,由于通过LDH的NADH氧化而减少了这种现象。然而,由于LDH的Km值与细胞中的PDC酶竞争,因此应充分表达该酶,同时可以平稳地产生乳酸,以氧化NADH的同时防止糖消耗率的降低和生长抑制,并解决由ADH阻断引起的问题。使用常规技术,尽管试图通过强曝气操作TCA循环以促进NADH的氧化来减轻这些问题,但是难以解决这些问题并且难以完全解决糖消耗率降低的问题。
相关实例示于下表4和表5中。
可以看出,当LDH在主要ADH被阻断的菌株(Adh1(pLdhA68X))中表达时,产量、产率和浓度都非常低,这意味着当相关技术未实现LDH的强表达和适当LDH的选择时,通过ADH阻断难以产生乳酸。此外,进一步难以在耐酸菌株中实现这样的技术以在低pH下平稳地产生乳酸。
可以看出,当在作为对比组的没有ADH阻断的菌株中使用ADH1启动子表达LDH时,由于LDH,乳酸的产生和菌株的生长进展良好(由于LDH和PDC之间的竞争性反应,乙醇的产生量减少),并且由于ADH的阻断产生上述负面影响。然而,显然,由于由丙酮酸产生乳酸和乙醇的产量的竞争,在不能阻断乙醇产生的菌株中不可能进一步提高产量。
此外,作为参考,一项研究描述了LDH负责NADH的氧化,并通过在与野生型菌株相比PDC活性保持在2%的水平的菌株中表达LDH来产生乳酸。如上所述,与野生型相比,菌株(YSH 4.123.-1C(pLdhA68X))保留了2%的PDC活性,以提供细胞质乙酰辅酶A。结果发现,乙醇的产量为10g/L,基于乳酸的产生,该值对应于10/92X90.08/46.07=0.21的产量损失,这意味着通过以这种方式使用knockdown控制PDC活性,难以在乳酸产生过程中阻止乙醇产生。此外,众所周知,如文献所报道,当完全去除PDC活性时,由于细胞溶质乙酰辅酶A的供应受到限制,细胞生长被严重抑制。
[表4]
菌株和质粒
[表5]
菌株的乳酸产生能力
通过本发明,获得了表现出大大增加的乳酸产生和大大减少的乙醇产生的优异的耐酸菌株。
为了确认本发明的重组菌株的耐酸性,通过用NaOH作为碱将发酵时的pH调节至pH4和pH 5来进行发酵,该pH大于或等于乳酸的pKa值。
结果,如从图7中可以看出的那样,即使在低于pKa的pH下,菌株的性能也与在高pH下的性能相似,这表明在低于pKa的pH下,性能没有劣化(在使用酵母的常规乳酸产生菌株中可观察到性能劣化),并充分支持了相应菌株具有耐酸性。此外,本发明的重组菌株表现出在pH 3、pH 4和pH 5下消耗120g/L的所有糖的性能,这也可以认为是充分显示出该菌株的耐酸性的结果。表6示出了根据使用普通酵母在乳酸产生菌株的发育中发生的取决于pH值的性能下降的实例。
[表6]
使用普通酵母的乳酸产生菌株的取决于pH的性能
[保藏信息]
保藏机构名称:韩国生物科学与技术研究所
登记号:KCTC13508BP
保藏日期:20180411
【工业实用性】
根据本发明的耐酸酵母可以有效地抑制乙醇的产生,以高水平和高效率表达LDH酶,并且即使在低pH下也可以以高产量产生乳酸而没有生长劣化。
尽管已经详细描述了本发明的具体配置,但是本领域技术人员将理解,提供该描述是为了说明性目的而提出的优选实施方案,并且不应解释为限制本发明的范围。因此,本发明的实质范围由所附权利要求及其等同物限定。
【序列表自由文本】
附有电子文件。
序列表
<110> SK新技术株式会社
<120> 具有受抑制的乙醇产生途径的耐酸酵母及使用其生产乳酸的方法
<130> KHP202112874.7
<140> PCT/KR2019/002433
<141> 2019-02-28
<150> 10-2018-0044509
<151> 2018-04-17
<160> 54
<170> PatentIn version 3.5
<210> 1
<211> 320
<212> PRT
<213> 植物乳杆菌(Lactobacillus plantarum)
<400> 1
Met Ser Ser Met Pro Asn His Gln Lys Val Val Leu Val Gly Asp Gly
1 5 10 15
Ala Val Gly Ser Ser Tyr Ala Phe Ala Met Ala Gln Gln Gly Ile Ala
20 25 30
Glu Glu Phe Val Ile Val Asp Val Val Lys Asp Arg Thr Lys Gly Asp
35 40 45
Ala Leu Asp Leu Glu Asp Ala Gln Ala Phe Thr Ala Pro Lys Lys Ile
50 55 60
Tyr Ser Gly Glu Tyr Ser Asp Cys Lys Asp Ala Asp Leu Val Val Ile
65 70 75 80
Thr Ala Gly Ala Pro Gln Lys Pro Gly Glu Ser Arg Leu Asp Leu Val
85 90 95
Asn Lys Asn Leu Asn Ile Leu Ser Ser Ile Val Lys Pro Val Val Asp
100 105 110
Ser Gly Phe Asp Gly Ile Phe Leu Val Ala Ala Asn Pro Val Asp Ile
115 120 125
Leu Thr Tyr Ala Thr Trp Lys Phe Ser Gly Phe Pro Lys Glu Arg Val
130 135 140
Ile Gly Ser Gly Thr Ser Leu Asp Ser Ser Arg Leu Arg Val Ala Leu
145 150 155 160
Gly Lys Gln Phe Asn Val Asp Pro Arg Ser Val Asp Ala Tyr Ile Met
165 170 175
Gly Glu His Gly Asp Ser Glu Phe Ala Ala Tyr Ser Thr Ala Thr Ile
180 185 190
Gly Thr Arg Pro Val Arg Asp Val Ala Lys Glu Gln Gly Val Ser Asp
195 200 205
Asp Asp Leu Ala Lys Leu Glu Asp Gly Val Arg Asn Lys Ala Tyr Asp
210 215 220
Ile Ile Asn Leu Lys Gly Ala Thr Phe Tyr Gly Ile Gly Thr Ala Leu
225 230 235 240
Met Arg Ile Ser Lys Ala Ile Leu Arg Asp Glu Asn Ala Val Leu Pro
245 250 255
Val Gly Ala Tyr Met Asp Gly Gln Tyr Gly Leu Asn Asp Ile Tyr Ile
260 265 270
Gly Thr Pro Ala Ile Ile Gly Gly Thr Gly Leu Lys Gln Ile Ile Glu
275 280 285
Ser Pro Leu Ser Ala Asp Glu Leu Lys Lys Met Gln Asp Ser Ala Ala
290 295 300
Thr Leu Lys Lys Val Leu Asn Asp Gly Leu Ala Glu Leu Glu Asn Lys
305 310 315 320
<210> 2
<211> 963
<212> DNA
<213> 植物乳杆菌(Lactobacillus plantarum)
<400> 2
atgtcttcta tgccaaatca tcaaaaagtt gttttggttg gtgatggtgc tgttggttct 60
tcttatgctt ttgctatggc tcaacaaggt attgctgaag aatttgttat tgttgatgtt 120
gttaaagata gaactaaagg tgatgctttg gatttggaag atgctcaagc ttttactgct 180
ccaaaaaaaa tttattctgg tgaatattct gattgtaaag atgctgattt ggttgttatt 240
actgctggtg ctccacaaaa accaggtgaa tctagattgg atttggttaa taaaaatttg 300
aatattttgt cttctattgt taaaccagtt gttgattctg gttttgatgg tatttttttg 360
gttgctgcta atccagttga tattttgact tatgctactt ggaaattttc tggttttcca 420
aaagaaagag ttattggttc tggtacttct ttggattctt ctagattgag agttgctttg 480
ggtaaacaat ttaatgttga tccaagatct gttgatgctt atattatggg tgaacatggt 540
gattctgaat ttgctgctta ttctactgct actattggta ctagaccagt tagagatgtt 600
gctaaagaac aaggtgtttc tgatgatgat ttggctaaat tggaagatgg tgttagaaat 660
aaagcttatg atattattaa tttgaaaggt gctacttttt atggtattgg tactgctttg 720
atgagaattt ctaaagctat tttgagagat gaaaatgctg ttttgccagt tggtgcttat 780
atggatggtc aatatggttt gaatgatatt tatattggta ctccagctat tattggtggt 840
actggtttga aacaaattat tgaatctcca ttgtctgctg atgaattgaa aaaaatgcaa 900
gattctgctg ctactttgaa aaaagttttg aatgatggtt tggctgaatt ggaaaataaa 960
taa 963
<210> 3
<211> 988
<212> DNA
<213> 人工序列
<220>
<223> g4423启动子区等位基因1
<400> 3
gttaactcag ttttctctct ttccctccac cccacgttac tctgcgaaca aaaatacgca 60
cagaatgaac atctgattga ttaatattta tatattactt agtggcaccc ctacaaacaa 120
accaattttg aatatttctc accatcatga tatttattta gggcaagaat ttcatgtaca 180
tacgtgcgtg tactgcatag ttttgttata tgtaaataac cagcaatata tcaccaatga 240
taaatgctca gtaatttatt tggaaccaaa atagtttcag taatcaaata atacaataac 300
taacaagtgc tgattataca acagctgtta acaacacaaa cacgctctct tctattctct 360
tccctgcttg ttcgtgtggt atattcccga atttgcaatt tagaaattat attttttaaa 420
agaattgttc tccattttct ggtagtcgta agtggcaaat tggatcataa gacacaatct 480
tgttagttcg actgctaaca ccagacaaga ccgaacgaaa acagaaaaaa aagataattt 540
tgttattctg ttcaattctc tctctctttt taaggtatct ttacattaca ttacatatcc 600
caaattacaa caagagcaag aaatgaagca caacaacacg ccatctttcg tgattatttt 660
atcatttcta tatcgtaact aaattaacaa atgctatgtt tcttaatttt taatgataaa 720
tctaactgct accttaattt ctcatggaaa gtggcaaata cagaaattat atattcttat 780
tcattttctt ataattttta tcaattacca aatatatata aatgcaatta attgattgtt 840
cctgtcacat aatttttttt gtttgttacc tttattcttt atccatttag tttagttctt 900
atatctttct tttctatttc tctttttcgt ttaatctcac cgtacacata tatatccata 960
tatcaataca aataaaaatc atttaaaa 988
<210> 4
<211> 961
<212> DNA
<213> 人工序列
<220>
<223> g4423启动子区等位基因2
<400> 4
gttaactcag ttttctctct ttccctccac cccacgttac tctgcgaaca aaaaatacgc 60
acagaatgaa catctgattg attaatattt atatattact cagtggcacc cctacaaaca 120
aaccaatttt gaatattgtt caccatcatg atatttattt agggcaagaa tttcatgtac 180
atacgtgcgt gtactgcata gttttgttat atgaaaataa ccagcaatat atcaccaatg 240
aataaattct caataattta tttggaacca aataatgcaa taactagcaa actaagtggt 300
gattatacaa cagctgttaa caacacaaac atacgctctc ttctattatc tcttccctgc 360
ttgttcgtgt ggtatattca cgaatttgca atttagaaat tatatttttt aaaagaattg 420
ttctccattt tctggtagtc gtaagtggca aattggatca taagacacaa tcttgttagt 480
tcgactgcta acaccagaca acaccgaacg aaaacaagaa aaaataatta ttctctctct 540
ttttaaggta tcttacatta catatcccaa attacaacaa gagcaagaaa tgaggcacaa 600
caacacacca tcatctttcg tgattatttt tatcatttct atcatgtaat taaattaaca 660
aatgttaagt ttattaattt ttaatgataa atctagttgc taccttaatt tctcatggaa 720
agtggcaaat actgaaatta tttaattcta ctttcatttt cttataattt ttatcaatta 780
ccaaatatat ataaatgcaa ttaattgatt gttcctgtca cataattttt tttgtttgtt 840
acctttattc tttatccatt taatttattt cttgtatctt tcttttctat ttctcttttc 900
tgtttaatct caccgtacac atatatatcc atatatcaat acaaataaaa atcatttaaa 960
a 961
<210> 5
<211> 1017
<212> DNA
<213> 人工序列
<220>
<223> g4423终止子区等位基因1
<400> 5
taagtcattt aatttattct tttagaatat atttattttg tctttatttt tgaaatgtta 60
atagtctttt ttttttactt tgaacaaaaa aaagtaaaat taaaacttat cttatatacg 120
cttttaaaca ttaaactcgt taacgaatta tataatgatt ttatcgaact actttatgtt 180
tttttaatag aataatcttc tttattaata taacttacta cttcttaatc ttgttgtcct 240
ccattcgaaa ctcgagtgga acattttctg agtatctctc gcgtctgttc gtaccgtttt 300
tccaatttct ttcgggaaac ggaactggac gcattttatt tgactgttga aagggagatt 360
taatatttat atagcgagat ataacaacta acttataagt ttacacaggc tgttatcaca 420
tatatatata tatatcaaca gaggactagc tcactagact aacattagat atgtcgatgc 480
tgaaccgttt gtttggtgtt agatccattt cacaatgtgc tactcgttta caacgttcta 540
cagggacaaa tatatcagaa ggtccactaa gaattattcc acaattacaa actttctatt 600
ctgctaatcc aatgcatgat aacaatatcg acaagctaga aaatcttcta cgtaaatata 660
tcaagttacc aagtacaaac aatttattga agacacatgg gaatacatct acagaaattg 720
atccaacaaa attattacaa tcacaaaatt cttcacgtcc tttatggtta tcattcaagg 780
attatacagt gattggaggt ggttcacgtt taaaacctac tcaatacacg gaacttttat 840
ttctattgaa taaactacat agtatcgatc cacaattaat gaatgatgat attaagaacg 900
aattagctca ttattataag aatacttcac aggaaactaa taaagtcacc atccctaaat 960
tggatgaatt cggtagaagt attggaatcg gtagaaggaa atccgcaact gcaaaag 1017
<210> 6
<211> 1018
<212> DNA
<213> 人工序列
<220>
<223> g4423终止子区等位基因2
<400> 6
taagtcattt aatttattct tttagaatat atttattttg tctttatttt tgaaatgtta 60
atagtctttt ttttactttg aaaaaaaaaa aaagtaaaat taaacttatc ttatatacgc 120
ttttaaacat taaactcgtt aacgaattat ataatgattt tatcgaacta ctttatgttt 180
ttttaataga ataatcttct ttattaatat aacttactac ttcttaatct tgttgtcctc 240
cattcgaaac tcgagaggaa caatttctga gtctctctcg caccctttcg tacgtaccgt 300
ttttccaatt tctttcggga aacggaactg gacgcatttt atttgactgt tgaaagggag 360
atttaatatt tatatagaga gatataacaa ctaacttata agtttataca ggctgttatc 420
acatatatat atatatcaac agaggactag ctcaatagaa taacattaga tatgtcgatg 480
ctgaaccgtt tgtttggtgt tagatccatt tcacaatgtg ctactcgttt acaacgttct 540
acagggacaa atatatcaga aggtccacta agaattattc cacaattaca aactttctat 600
tctgctaatc caatgcatga taacaatatc gacaagctag aaaatcttct acgtaaatat 660
atcaagttac caagtacaaa taacttattg aagacacatg ggaatacatc tacagaaatc 720
gatccaacaa aattattaca atcacaaaat tcttcacgtc ctttatggtt atcattcaag 780
gattatacag tgattggagg tggttcacgt ttaaaaccta ctcaatacac agaactttta 840
tttctattga ataaactaca tagtatcgat ccacaattaa tgaatgatga tattaagaac 900
gaattagctc attattataa gaatacttca caggaaacta ataaagtcac catccctaaa 960
ttggatgaat tcggtagaag tattggaatc ggtagaagga aatccgcaac tgcaaaag 1018
<210> 7
<211> 323
<212> PRT
<213> 瑞士乳杆菌(Lactobacillus helveticus)
<400> 7
Met Ala Arg Glu Glu Lys Pro Arg Lys Val Ile Leu Val Gly Asp Gly
1 5 10 15
Ala Val Gly Ser Thr Phe Ala Phe Ser Met Val Gln Gln Gly Ile Ala
20 25 30
Glu Glu Leu Gly Ile Ile Asp Ile Ala Lys Glu His Val Glu Gly Asp
35 40 45
Ala Ile Asp Leu Ala Asp Ala Thr Pro Trp Thr Ser Pro Lys Asn Ile
50 55 60
Tyr Ala Ala Asp Tyr Pro Asp Cys Lys Asp Ala Asp Leu Val Val Ile
65 70 75 80
Thr Ala Gly Ala Pro Gln Lys Pro Gly Glu Thr Arg Leu Asp Leu Val
85 90 95
Asn Lys Asn Leu Lys Ile Leu Ser Ser Ile Val Glu Pro Val Val Glu
100 105 110
Ser Gly Phe Glu Gly Ile Phe Leu Val Val Ala Asn Pro Val Asp Ile
115 120 125
Leu Thr His Ala Thr Trp Arg Met Ser Gly Phe Pro Lys Asp Arg Val
130 135 140
Ile Gly Ser Gly Thr Ser Leu Asp Thr Gly Arg Leu Gln Lys Val Ile
145 150 155 160
Gly Lys Met Glu Asn Val Asp Pro Ser Ser Val Asn Ala Tyr Met Leu
165 170 175
Gly Glu His Gly Asp Thr Glu Phe Pro Ala Trp Ser Tyr Asn Asn Val
180 185 190
Ala Gly Val Lys Val Ala Asp Trp Val Lys Ala His Asn Met Pro Glu
195 200 205
Ser Lys Leu Glu Asp Ile His Gln Glu Val Lys Asp Met Ala Tyr Asp
210 215 220
Ile Ile Asn Lys Lys Gly Ala Thr Phe Tyr Gly Ile Gly Thr Ala Ser
225 230 235 240
Ala Met Ile Ala Lys Ala Ile Leu Asn Asp Glu His Arg Val Leu Pro
245 250 255
Leu Ser Val Pro Met Asp Gly Glu Tyr Gly Leu His Asp Leu His Ile
260 265 270
Gly Thr Pro Ala Val Val Gly Arg Lys Gly Leu Glu Gln Val Ile Glu
275 280 285
Met Pro Leu Ser Asp Lys Glu Gln Glu Leu Met Thr Ala Ser Ala Asp
290 295 300
Gln Leu Lys Lys Val Met Asp Lys Ala Phe Lys Glu Thr Gly Val Lys
305 310 315 320
Val Arg Gln
<210> 8
<211> 972
<212> DNA
<213> 瑞士乳杆菌(Lactobacillus helveticus)
<400> 8
atggctagag aagaaaaacc aagaaaagtt attttggttg gtgatggtgc tgttggttct 60
acttttgctt tttctatggt tcaacaaggt attgctgaag aattgggtat tattgatatt 120
gctaaagaac atgttgaagg tgatgctatt gatttggctg atgctactcc atggacttct 180
ccaaaaaata tttatgctgc tgattatcca gattgtaaag atgctgattt ggttgttatt 240
actgctggtg ctccacaaaa accaggtgaa actagattgg atttggttaa taaaaatttg 300
aaaattttgt cttctattgt tgaaccagtt gttgaatctg gttttgaagg tatttttttg 360
gttgttgcta atccagttga tattttgact catgctactt ggagaatgtc tggttttcca 420
aaagatagag ttattggttc tggtacttct ttggatactg gtagattgca aaaagttatt 480
ggtaaaatgg aaaatgttga tccatcttct gttaatgctt atatgttggg tgaacatggt 540
gatactgaat ttccagcttg gtcttataat aatgttgctg gtgttaaagt tgctgattgg 600
gttaaagctc ataatatgcc agaatctaaa ttggaagata ttcatcaaga agttaaagat 660
atggcttatg atattattaa taaaaaaggt gctacttttt atggtattgg tactgcttct 720
gctatgattg ctaaagctat tttgaatgat gaacatagag ttttgccatt gtctgttcca 780
atggatggtg aatatggttt gcatgatttg catattggta ctccagctgt tgttggtaga 840
aaaggtttgg aacaagttat tgaaatgcca ttgtctgata aagaacaaga attgatgact 900
gcttctgctg atcaattgaa aaaagttatg gataaagctt ttaaagaaac tggtgttaaa 960
gttagacaat aa 972
<210> 9
<211> 320
<212> PRT
<213> 米根霉(Rhizopus oryzae)
<400> 9
Met Val Leu His Ser Lys Val Ala Ile Val Gly Ala Gly Ala Val Gly
1 5 10 15
Ala Ser Thr Ala Tyr Ala Leu Met Phe Lys Asn Ile Cys Thr Glu Ile
20 25 30
Ile Ile Val Asp Val Asn Pro Asp Ile Val Gln Ala Gln Val Leu Asp
35 40 45
Leu Ala Asp Ala Ala Ser Ile Ser His Thr Pro Ile Arg Ala Gly Ser
50 55 60
Ala Glu Glu Ala Gly Gln Ala Asp Ile Val Val Ile Thr Ala Gly Ala
65 70 75 80
Lys Gln Arg Glu Gly Glu Pro Arg Thr Lys Leu Ile Glu Arg Asn Phe
85 90 95
Arg Val Leu Gln Ser Ile Ile Gly Gly Met Gln Pro Ile Arg Pro Asp
100 105 110
Ala Val Ile Leu Val Val Ala Asn Pro Val Asp Ile Leu Thr His Ile
115 120 125
Ala Lys Thr Leu Ser Gly Leu Pro Pro Asn Gln Val Ile Gly Ser Gly
130 135 140
Thr Tyr Leu Asp Thr Thr Arg Leu Arg Val His Leu Gly Asp Val Phe
145 150 155 160
Asp Val Asn Pro Gln Ser Val His Ala Phe Val Leu Gly Glu His Gly
165 170 175
Asp Ser Gln Met Ile Ala Trp Glu Ala Ala Ser Ile Gly Gly Gln Pro
180 185 190
Leu Thr Ser Phe Pro Glu Phe Ala Lys Leu Asp Lys Thr Ala Ile Ser
195 200 205
Lys Ala Ile Ser Gly Lys Ala Met Glu Ile Ile Arg Leu Lys Gly Ala
210 215 220
Thr Phe Tyr Gly Ile Gly Ala Cys Ala Ala Asp Leu Val His Thr Ile
225 230 235 240
Met Leu Asn Arg Lys Ser Val His Pro Val Ser Val Tyr Val Glu Lys
245 250 255
Tyr Gly Ala Thr Phe Ser Met Pro Ala Lys Leu Gly Trp Arg Gly Val
260 265 270
Glu Gln Ile Tyr Glu Val Pro Leu Thr Glu Glu Glu Glu Ala Leu Leu
275 280 285
Val Lys Ser Val Glu Ala Leu Lys Ser Val Glu Tyr Ser Ser Thr Lys
290 295 300
Val Pro Glu Lys Lys Val His Ala Thr Ser Phe Ser Lys Ser Ser Cys
305 310 315 320
<210> 10
<211> 963
<212> DNA
<213> 米根霉(Rhizopus oryzae)
<400> 10
atggttttgc attctaaagt tgctattgtt ggtgctggtg ctgttggtgc ttctactgct 60
tatgctttga tgtttaaaaa tatttgtact gaaattatta ttgttgatgt taatccagat 120
attgttcaag ctcaagtttt ggatttggct gatgctgctt ctatttctca tactccaatt 180
agagctggtt ctgctgaaga agctggtcaa gctgatattg ttgttattac tgctggtgct 240
aaacaaagag aaggtgaacc aagaactaaa ttgattgaaa gaaattttag agttttgcaa 300
tctattattg gtggtatgca accaattaga ccagatgctg ttattttggt tgttgctaat 360
ccagttgata ttttgactca tattgctaaa actttgtctg gtttgccacc aaatcaagtt 420
attggttctg gtacttattt ggatactact agattgagag ttcatttggg tgatgttttt 480
gatgttaatc cacaatctgt tcatgctttt gttttgggtg aacatggtga ttctcaaatg 540
attgcttggg aagctgcttc tattggtggt caaccattga cttcttttcc agaatttgct 600
aaattggata aaactgctat ttctaaagct atttctggta aagctatgga aattattaga 660
ttgaaaggtg ctacttttta tggtattggt gcttgtgctg ctgatttggt tcatactatt 720
atgttgaata gaaaatctgt tcatccagtt tctgtttatg ttgaaaaata tggtgctact 780
ttttctatgc cagctaaatt gggttggaga ggtgttgaac aaatttatga agttccattg 840
actgaagaag aagaagcttt gttggttaaa tctgttgaag ctttgaaatc tgttgaatat 900
tcttctacta aagttccaga aaaaaaagtt catgctactt ctttttctaa atcttcttgt 960
taa 963
<210> 11
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 11
cggactttag agccttgtag ac 22
<210> 12
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 12
atctggttac actcacgatg g 21
<210> 13
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 13
ccaagtacgt tagagctaac gg 22
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 14
gagcttctct ggtatcagct 20
<210> 15
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 15
agctttagca aacattagac cc 22
<210> 16
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 16
attccatccg aatatgctgg t 21
<210> 17
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 17
ggaacctaaa tgactgttgg ca 22
<210> 18
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 18
aggatgttga tttcgactcg t 21
<210> 19
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 19
ttccaaaggg taccaattta gctg 24
<210> 20
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 20
gtaccgctaa tgaacctaaa cca 23
<210> 21
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 21
agagctgaca ctagagaagc c 21
<210> 22
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 22
gatgtgtcta cgacgtatct acc 23
<210> 23
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 23
gtactggtaa cgtccaagtc 20
<210> 24
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 24
gaacccttcc atactctacc a 21
<210> 25
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 25
ttcagttcgt gctactcaag g 21
<210> 26
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 26
tcaattgcaa cgacagagac 20
<210> 27
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 27
ccgtaccctg aagagtttac tg 22
<210> 28
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 28
caaccataga ttcacgaatt gctc 24
<210> 29
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 29
agtggatttg gattaatggg tg 22
<210> 30
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 30
gcttctgtaa cacctttaac ac 22
<210> 31
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 31
aaattggtga ccgtgttggt 20
<210> 32
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 32
aaccaccttt actacggtaa cca 23
<210> 33
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 33
tttagtcgtc atctgttcag gt 22
<210> 34
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 34
gagacaccta acaaaccaaa tgg 23
<210> 35
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 35
gattcaagct tcttctcgta tcgg 24
<210> 36
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 36
ggaaatgata ccattcacga cct 23
<210> 37
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 37
gttccgtcaa agaaatcaag ca 22
<210> 38
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 38
tggtaaacct gtatctgaca tcac 24
<210> 39
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 39
tttagttgtc atttgtgccg gt 22
<210> 40
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 40
gacacctaac aaaccaaacg ga 22
<210> 41
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 41
ctttgagtgc aagtatcgcc 20
<210> 42
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> qPCR的引物
<400> 42
tgtgtaattg ttcaccaaag cc 22
<210> 43
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 43
gagatagcac accattcacc a 21
<210> 44
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 44
caacgttaag tactctggtg tttg 24
<210> 45
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 45
caacgttaag tactctggtg tttg 24
<210> 46
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 46
gagatagcac accattcacc a 21
<210> 47
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 47
ggattcctgt aatgacaacg cgag 24
<210> 48
<211> 26
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 48
tggatacatt acagattctc tatcct 26
<210> 49
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 49
atgaaaattt ttgcttatgg 20
<210> 50
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 50
ttaatattca acagcaatag 20
<210> 51
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 51
atggttttgc attctaaagt 20
<210> 52
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 52
ttaacaagaa gatttagaaa 20
<210> 53
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 53
atgtcttcta tgccaaatca 20
<210> 54
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 54
ttatttattt tccaattcag 20
- 具有受抑制的乙醇产生途径的耐酸酵母及使用其生产乳酸的方法
- 抑制乙醇产生的重组耐酸酵母以及使用其制备乳酸的方法
