抑制植物中的靶DNA的甲基化的方法
文献发布时间:2023-06-19 10:32:14
技术领域
本发明涉及抑制植物中的靶DNA的甲基化的方法。
背景技术
植物的基因表达受到被称为表观遗传学控制的DNA甲基化、组蛋白的化学修饰的调控。这是由RNA沉默引起的现象,RNA沉默大致分为转录后型基因沉默(PTGS)和转录型基因沉默(TGS)这两种。植物依靠该表观遗传学控制来进行功能性成分的累积水平的调控,为了使植物高水平地累积这些有用成分,需要一种自如地操纵该表观遗传学的技术。但是,一般认为表观遗传学控制过于复杂、特异性地解除靶DNA的甲基化是不可能的。
截至目前,几乎不存在诱导DNA序列特异性地去甲基化的技术,仅在近年才报道了使用dCAS融合TET1诱导去甲基化的技术(非专利文献1)。但是,在使用dCAS融合TET1诱导去甲基化的情况下,需要重组技术,因此存在不能简便且迅速地诱导去甲基化的问题。
现有技术文献
专利文献
专利文献1:国际专利公报第WO2014/129560号
非专利文献
非专利文献1:Gallego-Bartolome J et al.,Proceedings of the NationalAcademy of Sciences of the United States of America 55,E2125-E2134(2018)
非专利文献2:Gallusci P et al.,Trends in Plant Science 22,610-623(2017)
非专利文献3:Matzke M.A and Mosher R.A,Nature Reviews Genetics 15,394-408(2014)
非专利文献4:Puerta-Fernandez E et al.,FEMS Microbiology Reviews 27,75-97(2003)
非专利文献5:Liu G et al.,Organic&Biomolecular Chemistry 15,4681-4685(2017)
非专利文献6:Bussiere F et al.,Plant Biotechnology Journal 1,423-435(2003)
非专利文献7:Otagaki S et al.,Plant Biotechnology 23,259-265(2006)
非专利文献8:Matsunaga W et al.,BMC Plant Biology 19,24(2019)
非专利文献9:Philips J.G et al.,PloS one,12,e0171311(2017)
发明内容
发明要解决的课题
本发明的目的在于,使用重组技术或不使用重组技术简便且迅速地抑制植物中的靶DNA的甲基化,由此制作具有期望性状的植物。
用于解决课题的手段
本发明人鉴于上述课题进行了深入研究,结果得到了下述令人惊讶的发现:在RNA指令型DNA甲基化机制中,切断通过上述靶DNA的转录而产生的支架RNA(scaffold RNA)、尤其是使上述支架RNA特异性的1种或多种核酶在上述植物细胞内表达而切断该支架RNA,由此能够特异性地抑制植物中靶DNA的甲基化。
即,本发明的主旨如下。
(1)一种抑制植物细胞中靶DNA的甲基化的方法,其包括:在RNA指令型DNA甲基化机制中,切断通过上述靶DNA的转录而产生的支架RNA。
(2)根据1所述的方法,其中,通过使上述支架RNA特异性的1种或多种核酶在上述植物细胞内表达而进行上述支架RNA的切断。
(3)根据2所述的方法,其中,上述1种或多种核酶的表达为瞬时性的。
(4)根据1~3中任一项所述的方法,其中,上述靶DNA为控制植物细胞中表现期望性状的基因的启动子。
(5)根据4所述的方法,其中,上述表现期望性状的基因为编码控制植物源的功能性成分的合成或累积的酶的氨基酸序列的基因。
(6)根据1~5中任一项所述的方法,其中,通过植物病毒载体法、农杆菌渗入法、magnICON(注册商标)系统、或粒子枪法进行上述1种或多种核酶在植物细胞内的表达。
(7)根据1~6中任一项所述的方法,其中,上述植物细胞为植物体的非分离细胞。
(8)根据1~6中任一项所述的方法,其中,上述植物细胞为培养细胞。
(9)一种制作具有期望性状的植物的方法,其包括:使用权利要求1~8中任一项所述的方法抑制参与植物中期望性状的表达的DNA的甲基化。
(10)一种制造植物源的功能性成分的方法,其包括:使用权利要求1~8中任一项所述的方法抑制参与植物源的功能性成分的合成或累积的DNA的甲基化,从而在上述植物细胞内累积功能性成分,并且从上述植物细胞回收上述功能性成分。
(11)一种表达系统,其为用于累积植物源的功能性成分的表达系统,其包括:
(A)产生支架RNA的植物体或植物细胞,所述支架RNA是在RNA指令型DNA甲基化机制中通过参与植物源的功能性成分的合成或累积的DNA的转录而产生的,和
(B)上述支架RNA特异性的1种或多种核酶。
(12)一种核酶表达载体,其包含编码1种或多种核酶的核苷酸序列,所述1种或多种核酶为在RNA指令型DNA甲基化机制中通过靶DNA的转录而产生的支架RNA特异性的1种或多种核酶。
(13)根据12所述的核酶表达载体,其中,编码能够自切断的其它核酶的核苷酸序列与编码上述支架RNA特异性的核酶的核苷酸序列的3’和5’末端邻接。
(14)根据13所述的核酶表达载体,其中,编码上述支架RNA特异性的核酶的核苷酸序列为反式型,且编码上述能够自切断的其它核酶的核苷酸序列为顺式型。
(15)一种权利要求12~14中任一项所述的核酶表达载体的应用,其用于制作具有期望性状的植物。
(16)一种权利要求12~14中任一项所述的核酶表达载体的应用,其用于制造植物源的功能性成分。
发明效果
根据本发明,能够通过抑制植物中的靶DNA的甲基化来简便且迅速地特异性地控制靶DNA的TGS。由此,能够得到具有期望性状的植物,例如大大有助于植物中的有用蛋白质的生产、功能性成分的累积水平的提高。
附图说明
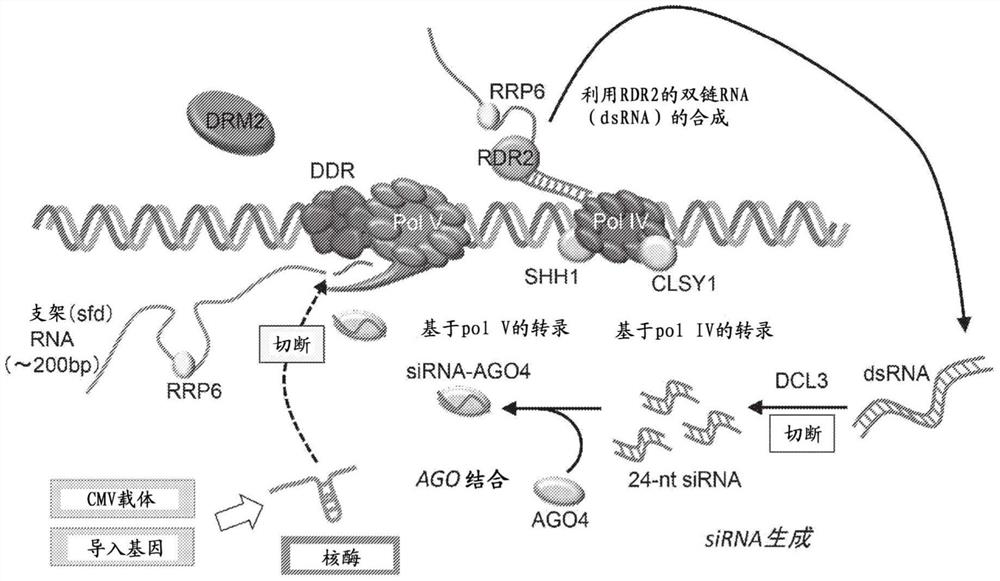
图1示出RdDM途径中的DNA甲基化模型。
图2示出核酶切断支架RNA介导的DNA甲基化解除模型。
图3示出包含35S启动子的序列的CMV-A1载体的构建方法及将其接种于烟草(benthamiana)GFP基因导入品系(16C)而得的后代(208S1)的35S启动子的DNA甲基化率。
图4示出35S启动子序列、及由35S启动子产生的支架RNA的检测结果。箭头所示的条带表示检测到的支架RNA。需要说明的是,在35S启动子序列中,单线及双线所示的序列分别表示对应于检测到的支架RNA的正链及负链的区域。
图5表示成为核酶的靶标的35S启动子(-链)的序列、及核酶的序列。
图6表示被核酶切断的支架RNA的5’末端的位置。黑色的箭头表示核酶表达个体(208S1 Rz)的切断位置,灰色的箭头表示对照(208S1)的切断位置。
图7表示利用CMV载体表达核酶的烟草后代中的GFP荧光和35S启动子区域的甲基化。图7C中,用矩形表示转录起始点附近的DNA甲基化尤其减少的区域。
图8表示拟南芥导入用核酶的靶序列。将35S启动子的支架RNA正链存在的3处GUC分别设为A、B及C。
图9表示拟南芥导入用核酶35S(+)A2BC盒的序列。
图10表示顺式-反式-顺式型核酶的结构和顺式型核酶的自切断部位。
图11表示拟南芥的转化中使用的表达载体pBGGN的结构。
图12表示调查拟南芥导入用核酶的体外的切断活性的结果。
图13表示用PCR检测导入到拟南芥Col-0 GFP-TGS品系的核酶A2BC盒的结果。电泳照片中,上段表示用于确认转化植物中有无核酶的整合的PCR引物的位置。下段的泳道表示各个重组个体。+这一记号表示确认到核酶。
图14表示导入了核酶的拟南芥Col-0 GFP-TGS品系中的GFP基因的表达变化。
具体实施方式
[1.序言]
植物的基因表达受到表观遗传学控制。“表观遗传学”是指:不会引起DNA序列的变化且经由细胞分裂而传达的基因功能的变化、其机制。作为表观遗传学之一,已知有DNA甲基化(非专利文献2)。一直认为,该反应中存在向胞嘧啶的嘧啶环的5位碳原子或腺嘌呤的嘌呤环的6位氮原子添加甲基的反应,植物中的基因表达主要受到胞嘧啶甲基化的控制。即,通过DNA的胞嘧啶的甲基化·去甲基化,在不改变碱基序列信息本身的情况下在基因表达的开放/关闭间进行切换。将这样的通过DNA甲基化来抑制基因表达的方式称为转录型基因沉默(TGS)。
本发明基于下述基本思想:通过对植物中的表观遗传学控制进行人工调控,从而能够在不进行基因重组的情况下改变期望的植物表型。
作为模式植物的拟南芥(Arabidopsis thaliana)中的DNA甲基化的解读正在大幅推进。植物中,CpG、CpHpG和CpHpH部位(H表示鸟嘌呤以外的核苷酸)会被甲基化,作为向DNA转移甲基且使其共价键合的主要的DNA甲基转移酶,已知有DRM2、MET1、CMT3和CMT2。目前,DNA甲基转移酶分为在DNA上形成新的甲基标记的从头酶(de novo enzyme)、和识别DNA母链的甲基化位置且将新的甲基化传递给DNA复制后的子链的维持酶这两种,其中,仅DRM2为从头DNA甲基转移酶。细胞如何决定从头DNA甲基化的位置这一点尚不清楚,目前的证据表明,在多个位置处有RNA指令型DNA甲基化(RNA-directed DNA methylation:RdDM)机制参与。
如上所述,本发明基于如下发现:在RNA指令型DNA甲基化机制中,切断通过上述靶DNA的转录而产生的支架RNA、尤其是使上述支架RNA特异性的1种或多种核酶在上述植物细胞内表达而切断该支架RNA,从而能够特异性地抑制植物中靶DNA的甲基化。因此,首先对成为本发明的前提的RNA指令型DNA甲基化机制和核酶进行说明。
[1-1.RdDM机制]
如图1所示,RdDM机制中,首先PolIV被募集到甲基化的靶基因组区域,转录靶区域的RNA。PolIV的转录产物当场被RNA-DEPENDENT RNA POLYMERASE 2(RDR2)变换为双链RNA,被作为RNaseIII样的酶的DICER-LIKE3(DCL3)切断为24个核苷酸的siRNA(非专利文献3)。该siRNA的3’末端被HUA ENHANCER1(HEN1)进行甲基化修饰后,被摄入ARGONAUT 4(AGO4),形成沉默效应复合体。被摄入沉默效应复合体的互补的siRNA与由DNA依赖性RNA聚合酶V(PolV)转录的RNA(此后称为“支架RNA”)形成碱基对而募集复合体。接着,介由该沉默效应复合体,在对应于siRNA的DNA区域募集作为从头甲基转移酶的DOMAINS REARRANGEDMETHYLTRANSFERASE(DRM2),对DNA进行甲基化。认为,具有与AGO4、DRM2和甲基化的DNA的结合能力的RNA-DIRECTED DNA METHYLATION 1(RDM1)、DEFECTIVE IN RNA-DIRECTED DNAMETHYLATION 1(DRD1)以及DEFECTIVE IN MERISTEM SILENCING 3(DMS3)在募集中发挥了重要作用。
利用PolIV、PolV从靶DNA转录的RNA(这些转录自相同区域,因此序列大体上相同,但是将利用PolV转录的RNA特别称为支架RNA)在RdDM途径中有生成siRNA和将甲基转移酶DRM2引导至靶DNA的作用。如图2所示,成为靶的DNA是受支架RNA和其所结合的siRNA的序列指定的,因此如果切断特定的支架RNA并使其离开途径,则仅对应于支架RNA的DNA的甲基化受到抑制,然后进入去甲基化的方向。与此相对地,抑制RdDM途径涉及的其他蛋白的功能的方式会破坏整个RdDM途径,因此对植物有害,不优选。
需要说明的是,根据序列的不同,支架RNA的切断位置存在限制,需要包含核酶的切断效率高的例如GUC、GUA、GUU等序列(非专利文献1),但是只要满足该条件则能够任意选择切断位置。
[1-2.核酶]
作为除去上述支架RNA的手段,考虑了将反义RNA大量送入核来捕捉支架RNA的方法。但是,反义RNA有可能与靶标形成双链而由此生成siRNA,很可能反而促进TGS。本发明人鉴于这样的问题而进行了深入研究,结果通过近年来在细胞内大量生产的被用于RNA病毒的切断等的核酶切断支架RNA,从而成功地抑制了植物中的靶DNA的甲基化。核酶仅与支架RNA的8个碱基具有互补性,因此不会形成双链,不生成siRNA。
核酶为具有位点特异性地切断核酸序列的酶活性的特殊的RNA分子,自1981年发现以来,对其结构、功能进行了广泛研究。其结果是,阐明了酶活性部位的结构(形状和核酸序列),目前已通过化学合成得到了能特异性切断任意的序列部位的核酶,已被用于多种领域。本发明中使用的核酶只要能够序列特异性地切断、降解通过靶DNA的转录而产生的支架RNA就没有特别限制。这样的核酶可通过本领域技术人员熟知的方法来设计。作为在生物体内切断靶RNA的核酶,已知锤头型核酶、发夹型核酶和假结型核酶,其中尤其是开发出以锤头型核酶为基础的功能性RNA。锤头型核酶能够切断特定部位的RNA磷酸二酯键,反式型的最小的锤头型核酶是以天然的锤头型核酶为基础制作的,被用于通过RNA介导的基因控制来抑制体内的靶基因表达。锤头型核酶由下述区域构成:中央部的保守的具有催化活性的核心序列构成的活性区域(螺旋II)、存在于该活性区域的3’侧和5’侧的识别靶序列的2个杂合子形成臂序列所构成的识别区域(螺旋III和螺旋I)(非专利文献4)。通过将针对靶RNA的上述杂合子形成臂序列按照符合单纯的沃森-克里克碱基配对规则进行变换,能够制作靶特异性的锤头型核酶。另外,可以对靶RNA设计具有各不相同的核心序列的锤头型核酶,使用夹着靶RNA的特定三联体的与杂合子形成序列存在互补关系的序列而结合于靶RNA,将存在于该三联体的3’侧的磷酸二酯键切断。
作为核酶的底物所需的序列,是第2位的核苷酸为U的三联体,DWH(D=A/U/G、W=A/U、H=A/U/C)尤其容易被切断(非专利文献5)。因此,若合成出在成为靶的RNA上寻找相当于DWH的序列、且与其两侧的序列互补的一方的一部分,则该部分成为将靶RNA在DWH的3’侧切断的RNA切断酶。从而,本领域技术人员能基于与支架RNA的靶序列的同源性自如地设计能够序列特异性地将其切断·降解的核酶。
因此,本发明中,设计了选择参与植物中的期望性状的表达且通过甲基化而被抑制的DNA序列作为切断位置、以其为靶的核酶。
[2.抑制植物细胞中靶DNA的甲基化的方法]
根据本发明的第1观点,提供一种抑制植物细胞中靶DNA的甲基化的方法,其包括:在RNA指令型DNA甲基化机制中切断通过上述靶DNA的转录而产生的支架RNA。
支架RNA在植物中为抑制期望性状的表达的DNA甲基化的诱因,通过特异性地切断支架RNA,针对对应于siRNA的DNA区域的DRM2的募集受到抑制,因此能够特异性地抑制植物中靶DNA的甲基化。例如,通过将上述支架RNA特异性的1种或多种核酶导入上述植物细胞、使上述1种或多种核酶在上述植物细胞内表达,由此可进行上述支架RNA的特异性切断。
上述靶DNA只要是参与植物中的期望性状的表达且由于甲基化而被抑制的DNA就没有特别限制,可列举例如植物细胞中控制表达期望性状的基因的启动子。期望性状包括例如:形状、颜色、大小等作为外观(形态)而观察到的性质、开花期等可观察到的生理性质以及对病原菌、温度的抵抗性等生理性质等,优选与植物内的功能性成分(代谢成分)的累积有关的性质。因此,上述表达期望性状的基因优选编码控制植物源的功能性成分的合成或累积的酶的氨基酸序列的基因。
植物源的功能性成分可列举例如乙炔、噻吩、糖苷、硫配糖体、嘌呤、嘧啶、生物碱、酚类(例如醌)、精油、维生素类、萜类(例如环烯醚萜、倍半萜、二萜类和三萜类)、木质素和类黄酮等。
植物细胞内的核酶的表达优选使用重组技术、或为了使其简便且迅速地进行而使用瞬时性表达系统。例如,通过植物病毒载体法、农杆菌渗入法、magnICON(注册商标)系统、粒子枪法、或这些的组合来进行。
植物病毒载体法为如下方法:使插入了目标DNA的植物病毒基因组的cDNA在试管内转录,将得到的RNA作为载体接种于植物而进行感染,利用病毒自身的增殖能力和整体迁移能力而使植物表达目标基因。该方法由于利用病毒的自我复制力来表达目标基因,因此如果使用基于增殖能力特别高的CMV、TMV的载体,则能够提高每个植物细胞的目标基因表达量。
农杆菌渗入法为如下方法:将用插入了目标基因的T-DNA载体进行了转化的农杆菌的培养液,通过物理方法(用注射器等注入、通过减压等使其渗透等方法)导入植物组织内,使其感染植物,由此使目标基因在植物中瞬时性表达。根据该方法,将感染能力强的农杆菌通过物理方法(注入或渗透)普遍迁移到植物体整体中而使其感染,能够在植物的全部组织中均等地表达目标基因。农杆菌(Agrobacterium)为属于革兰氏阴性菌的土壤细菌中的根瘤菌属(Rhizobium)中对植物具有致病性的菌类的总称,作为农杆菌的例子,可列举与根瘤病有关的根瘤农杆菌(Agrobacterium tumefaciens)。在利用农杆菌源载体使植物瞬时性表达外源基因时,通常将载体通过物理方法(利用注射器等注入、通过减压等使其渗透等方法)导入植物组织内而感染植物。农杆菌源载体由于T-DNA区域的作用而具有强感染能力,因此若通过物理方法(注入、渗透等)普遍地迁移植物体整体而进行感染,则能够使植物的全部组织没有偏差、均等地表达外源基因。
magnICON(注册商标)系统为如下方法:将插入了目标基因的TMV或PVX基因组的cDNA导入T-DNA载体内,用得到的T-DNA载体对农杆菌进行转化,将得到的农杆菌的培养液通过物理方法(利用注射器等注入、通过减压等使其渗透)导入植物组织内而感染植物,由此使目标基因在植物中瞬时性表达。即,可以通过物理方法(注入或渗透)使植物体整体普遍地感染载体,在植物的全部组织中表达目标基因。另外,由于利用病毒(TMV或PVX)的自我复制能力表达目标基因,因此能够提高每个植物细胞的目标基因的表达量。从而,本方法为兼具上述的植物病毒载体法和农杆菌渗入法的优点的方法。
另外,使相当于将编码2b蛋白的基因的一部分或全部置换为外源基因的黄瓜花叶病毒(CMV)的RNA2基因组的序列与农杆菌的T-DNA序列有功能地进行组合,将所得的核酸分子导入另外有功能地表达CMV的RNA1基因组和RNA3基因组以及蛋白2b的宿主植物,栽培该植物而表达外源基因,从而能够使外源基因普遍地迁移到植物体整体的细胞中而表达,并且能够提高外源基因在各细胞中的表达效率,实现植物体整体的高表达(专利文献1)。通过使用本方法,能够成为媲美使用TMV、PVX的上述magnICON(注册商标)系统的技术,能够提高宿主植物种类、可导入的外源基因尺寸的自由度。
粒子枪(基因枪;particle bombardment)法为如下方法:将涂布有DNA或载体的金、钨等金属的微粒高速射出,从而将目标DNA导入细胞内。
本发明中使用的核酶表达载体只要包含编码通过靶DNA的转录而产生的支架RNA特异性的1种或多种核酶的核苷酸序列、能够在植物细胞内表达核酶就没有特别限制,典型情况下,为植物病毒载体或T-DNA载体,特别优选植物病毒载体。植物病毒载体只要能够侵入植物细胞的核就没有特别限制,可列举烟草花叶病毒(TMV)、黄瓜花叶病毒(CMV)、马铃薯X病毒(PVX)、三叶草叶脉黄化病毒(ClYVV)等各种单链RNA病毒、菜豆黄矮病毒(Beanyellow dwarf virus)(BeYDV)、甜菜曲顶病毒(Beet curly top virus)(BCTV)、甘蓝卷叶病毒(Cabbage leaf-curl virus)(CaLCuV)、小麦矮缩病毒(Wheat dwarf virus)(WDV)、番茄黄化曲叶病毒(Tomato yellow leaf curl China virus)(TYLCCNV)等各种单链DNA病毒、以及菜花花叶病毒(CaMV)等双链DNA病毒来源的载体等。其中,特别优选作为RNA病毒的黄瓜花叶病毒(CMV)源载体,可列举例如CMV-A1载体等。
能够应用本发明的植物种属没有特别限制,典型情况下可列举禾本科、豆科、十字花科、菊科、茄科、蔷薇科、葫芦科、旋花科等的植物。作为优选的植物,可列举例如紫花苜蓿、大麦、芸豆、菜籽油菜、豇豆、棉花、玉米、三叶草、莲、扁豆、羽扇豆、黍子、燕麦、豌豆、花生、水稻、黑麦、草木犀、向日葵、麝香豌豆花、大豆、高粱、黑小麦、凉薯、毛毛豆、蚕豆、小麦、紫藤、坚果植物等;拟南芥、小糠草、葱、金鱼草、芹菜、花生、龙须菜、罂粟、燕麦、蓬莱竹、油菜、雀麦、布洛华丽(bush violet)、山茶、麻、辣椒、鹰嘴豆、藜(日语:ケノポジ)、菊苣、柑橘、咖啡树、川谷、黄瓜、南瓜、狗牙根、鸭茅、曼陀罗、洋地黄、薯蓣、油棕、牛筋草(日语:オオシバ)、细叶草(日语:フェスキュ)、草莓、老鹤草、大豆、向日葵、黄苜蓿、橡胶树、天仙子、甘薯、莴笋、扁豆、百合、亚麻、黑麦草、莲、番茄、牛至、苹果、芒果、木薯、苜蓿、南美海滨穿鱼柳、烟草、红豆草、天竺葵、狼尾草、矮牵牛、蜡烛草、早熟禾、樱、毛茛、小萝卜、醋栗、蓖麻、悬钩子、甘蔗、紫绒三七、银叶菊、狗尾草、白介、茄子、玉蜀黍、钝叶草、可可树、车轴草、零陵香、葡萄等。
植物细胞的形态是任意的,可以为存在于植物体内的非分离的细胞,也可以为分离自植物体的组织培养物等培养细胞。在为培养细胞的情况下,可以为分化状态的细胞,也可以为发生去分化的细胞,还可以为再分化的细胞。
[3.制作具有期望性状的植物的方法]
通过使用上述抑制靶DNA的甲基化的方法抑制植物中参与期望性状的表达的DNA的甲基化,从而能制作具有期望性状的植物。因此,本发明的第2观点提供制作具有期望性状的植物的方法,其包括:使用上述方法抑制植物中参与期望性状的表达的DNA的甲基化。
[4.制造植物源的功能性成分的方法]
另外,通过使用上述抑制靶DNA的甲基化的方法抑制参与植物源的功能性成分的合成·累积的DNA的甲基化,能够简便且迅速地制造植物源的功能性成分。因此,本发明的第3观点提供制造植物源的功能性成分的方法,其包括:使用上述方法抑制参与植物源的功能性成分的合成·累积的DNA的甲基化,从而在上述植物细胞内累积功能性成分,并且从上述植物细胞回收上述功能性成分;以及提供一种表达系统,其为用于合成·累积植物源的功能性成分的表达系统,其包括:(A)产生支架RNA的植物体或植物细胞,所述支架RNA是在RNA指令型DNA甲基化机制中通过参与植物源的功能性成分的合成·累积的DNA的转录而产生的;和(B)上述支架RNA特异性的1种或多种核酶。
[5.核酶表达载体]
根据本发明的第4观点,提供一种核酶表达载体,其包含编码1种或多种核酶的核苷酸序列,所述1种或多种核酶为在RNA指令型DNA甲基化机制中通过靶DNA的转录而产生的支架RNA特异性的1种或多种核酶。所述核酶表达载体如上所述可用于制作具有期望性状的植物、和/或用于制造植物源的功能性成分。
本发明中使用的核酶表达载体可具有如下结构:编码能够自切断的其它核酶的核苷酸序列与编码支架RNA特异性的核酶的核苷酸序列的3’和5’末端邻接。编码上述支架RNA特异性的核酶的核苷酸序列设为反式型、另外上述编码能够自切断的其它核酶的核苷酸序列设为顺式型,由此可通过自切断型核酶切出靶核酶单体(非专利文献6)。从而,能够将反式型的靶核酶夹在顺式型的核酶间而配置多个,由此增加同种靶核酶的表达量、同时表达异种靶核酶。
另外,上述核酶表达载体可包含以能工作的方式连接于编码支架RNA特异性的1种或多种核酶以及连接于其3’和5’末端的编码能够自切断的其它核酶的核苷酸序列的启动子和/或终止子。
上述启动子只要能够在植物细胞内表达核酶就没有特别限制,可列举例如U6启动子、菜花花叶病毒(CaMV)的35S启动子、木薯花叶病毒启动子、玄参花叶病毒启动子、Badnavirus启动子、草莓镶脉病毒(SVBV)启动子、花椰菜(Mirabilis)花叶病毒启动子(MMV)、Rubisco启动子、Actin启动子、ubiquitin启动子等。其中,优选U6启动子。
上述终止子只要能够在植物细胞内表达核酶就没有特别限制,可列举例如U6终止子、来自农杆菌的nos终止子以及热休克蛋白(hsp)终止子、菜花花叶病毒(CaMV)的35S终止子等。
以下示出实施例来更详细地说明本发明。但是,本发明不受以下的实施例限制,可适宜地加以变更而实施。
实施例
[实验1]利用包含35S启动子的部分序列的CMV-A1载体进行的DNA甲基化诱导
(1)包含35S启动子的部分序列的CMV-A1载体的构建
人工合成在转录起始点至其上游208bp的35S启动子的部分序列(35S-208)的末端添加有StuI和MluI限制酶位点的序列,按照常规方法将其整合到CMV-A1载体(参照非专利文献7)的感染性cDNA克隆质粒的克隆位点(StuI和MluI限制酶位点)(图3a)。35S-208是通过由pBI121(Clontech)进行PCR扩增、克隆而制作的。pBI121中的35S启动子的全长为345个碱基,从其中扩增、克隆包含as-1位点的208个碱基则为35S-208(参照非专利文献8)。
(2)整合有35S-208的CMV-A1向烟草16C品系的接种
使用T7 RNA聚合酶对整合有35S-208的CMV-A1载体(RNA2)进行体外转录。将其与由CMV-Y RNA1感染性克隆pCY1和RNA3感染性克隆pCY3进行体外转录而得的RNA1和RNA3混合,机械接种于本生烟(Nicotiana benthamiana)的GFP基因导入品系16C(参照非专利文献9)(图3b)。从CMV感染的16C个体中选择GFP荧光由于TGS而消失的个体,开花后采集种子。将来自该种子的个体设为208S1。
(3)208S1的35S启动子区域的DNA甲基化
使用illustra DNA Extraction Kit Nucleon Phytopure(GE Healthcare)从16C和208S1的叶提取DNA,对于提取出的DNA,用EZ DNA Methylation-Lightning Kit(ZymoResearch)进行亚硫酸氢盐处理,进行未甲基化的胞嘧啶向尿嘧啶的变换。使用TaKaRaEpiTaq HS for bisulfite-treated DNA(TaKaRa)由进行了亚硫酸氢盐处理的DNA通过PCR扩增35S启动子区域。作为PCR用的引物,使用35S-346F-bisuT(5’-ATTGAGAYTTTTYAAYAAAGGGTA-3’:序列号7)和35S+1A-bisuA(5’-CTCTCCAAATGAAATGAACTTC-3’:序列号8)。得到的PCR产物用Dyna Express TA PCR Cloning Kit(Bio DynamicsLaboratory)连接到pTAC1载体。将其转化E.coli JM109Competent Cells(TaKaRa),提取增殖后质粒。按照常规方法对提取出的质粒进行测序。基于测序结果,在16C和208S1之间按照CG、CHG(H=A/C/T)和CHH位点的类别来比较35S启动子区域的胞嘧啶的甲基化频度,结果确认,在任一位点处,208S1中均诱导了胞嘧啶的甲基化(图3c)。
[实验2]35S启动子的支架RNA的检测
为了检测由35S启动子转录的支架RNA,使用RNAzol RT(Molecular ResearchCenter)由208S1品系的叶提取RNA,对于提取出的总RNA,用SuperScript III FirstStrand Synthesis SuperMix(Invitrogen)进行以下的RT-PCR。首先,作为RNA的正链检测用,使用T7-35S-5-345(5’-ATTGAGACTTTTCAACAAAG-3’:序列号9)、作为负链检测用,使用35S+1R(5’-GTTCTCTCCAAATGAAATGAAC-3’:序列号10)引物RT反应,接着,作为正链检测用,使用T7-35S-5-345、35S-3-130(5’-GCAGAGGCATCTTCAACGATG-3’:序列号11)的引物对、作为负链检测用,使用35S-5-160(5’-CCACCCACGAGGAGCATCGTG-3’:序列号12)、35S+1R的引物对,进行PCR。RT-PCR的结果是,由正链、负链这两条链得到扩增产物,它们的测序与35S启动子的序列一致(图4),由此确认由35S启动子的正链、负链这两条链进行了转录。
[实验3]核酶表达CMV载体的构建
(1)核酶的设计
将核酶的靶序列和核酶的序列示于图5。根据实验2的结果可确认,由35S启动子区域转录了正链和负链的支架RNA,但是成为核酶的底物的三联体中最容易被切断的GUC多存在于负链的支架RNA中,因此以负链的支架RNA为对象进行核酶的设计。考虑核酶所结合的序列中的GC含量和有无重复序列,选择存在于转录起始点的上游79bp处的GUC作为靶的GUC,设计了切断该GUC的核酶。
(2)核酶表达CMV载体的制作
为了合成、克隆编码(1)中设计的核酶的双链DNA,合成了在5’末端分别添加有StuI和MluI限制酶位点的寡DNA 35S(-)-5RZ-45(5’-CGAGGCCTGATCTCCACTCTGATGAGTCCGTGAGGACGA AACGTA-3’:序列号13)和35S(-)-3RZ-32(5’-CGCACGCGTCCTTACGTTTCGTCCTCACGGAC-3’:序列号14),利用PCR使这些成为双链。按照常规方法使这些整合到CMV-A1载体的感染性cDNA克隆质粒的克隆位点(StuI和MluI限制酶位点)。
[实验4]核酶的支架RNA切断位置的确定
(1)整合有核酶的CMV-A1向208S1品系的接种
用T7 RNA聚合酶对整合有核酶的CMV-A1载体(RNA2)进行体外转录。将其与由CMV-Y RNA1感染性克隆pCY1和RNA3感染性克隆pCY3体外转录而得的RNA1和RNA3混合,机械接种于208S1品系。就208S1而言,对35S启动子诱导甲基化,稳定地发生GFP的TGS。S1是指TGS个体的自繁第1代。
(2)支架RNA负链的切断位置的确定
从健康的208S1个体(208S1)和感染了表达核酶的CMV-A1载体的208S1个体(208S1Rz(-))的叶,用RNAzol RT(Molecular Research Center)提取RNA,使用提取出的总RNA进行5’RACE,确定支架RNA负链的5’末端的序列。使用5’/3’RACE Kit,2nd Generation(Roche)进行5’RACE。关于作为对照使用的208S1的支架RNA负链的5’末端,17个克隆中的13个克隆中在GFP基因的转录起始点上游8bp处检测到,在4个克隆中在GFP转录起始点下游151bp处检测到(图6)。该结果表示,包含35S启动子区域的支架RNA负链的转录是从GFP基因中开始的。另一方面,在208S1 Rz(-)个体中,15个克隆中的6个克隆中在GFP转录起始点上游80bp处检测到5’末端,6个克隆中在上游83bp处检测到5’末端,3个克隆中在240bp的位置检测到5’末端(图6)。该位置相对于对照中的支架RNA负链的转录起始位置位于下游,因此认为208S1 Rz(-)个体中支架RNA负链被核酶切断。通过该支架RNA负链的切断,可期待208S1 Rz(-)个体中诱导了35S启动子的去甲基化。然后,从208S1 Rz(-)个体采集自繁种子,用未感染病毒的下一代(208Rz(-)S2)分析35S启动子区域的DNA甲基化(实验5)。
[实验5]通过CMV载体而表达核酶的本生烟16C品系的后代中的GFP荧光和35S启动子区域的甲基化
比较了208Rz(-)S2和对照的208S1的下一代(208S2)的GFP荧光,结果,在通过CMV载体而表达核酶的本生烟的后代中观察到GFP荧光的恢复(图7a)。与208S2相比,208Rz(-)S2中GFP荧光得以恢复,因此通过与实验1(3)中进行的方法相同的方法分析了35S启动子区域的胞嘧啶甲基化的频度。结果获知,与208S2相比,208Rz(-)S2中CG、CHG、和CHH任一位点处的甲基化频度均下降(图7b)。另外,观察35S启动子区域的甲基化图案,208Rz(-)S2中转录起始点附近的去甲基化尤其显著(图7c)。由这些结果可知,利用通过CMV载体而表达的核酶切断支架RNA,能够诱导35S启动子区域的去甲基化,增加GFP基因的表达,而且通过该方法诱导的35S启动子区域的去甲基化状态会稳定地遗传给下一代。
[实验6]拟南芥导入用核酶表达质粒载体的构建
(1)核酶的设计
将核酶的靶序列和核酶盒的序列示于图8和图9。为了同时切断35S启动子的支架RNA正链上存在的3处GUC(设为A、B和C),设计了顺式-反式-顺式型的核酶。将顺式-反式-顺式型的核酶示于图10,设为以反式来切断靶序列的核酶(反式型)被自切断的核酶(顺式型)夹住的结构,各个反式型核酶通过相邻顺式型核酶的自切断而成为单体、显示活性。这里,设计了将分别切断位于A、B和C的位置的GUC的反式型核酶各用1个顺式型夹着的盒(核酶35S(+)-A2BC)。
(2)核酶表达质粒载体的制作
人工合成了在(1)中设计的核酶35S(+)-A2BC的DNA序列5’侧添加有U6启动子、在3’侧添加有U6终止子、进一步在其两末端分别添加有HindIII和SacI限制酶位点的双链DNA(图9)。按照常规方法将其整合到表达载体pBGGN(Inplanta Innovations Inc.)的克隆位点(HindIII和SacI限制酶位点)(图11)。pBGGN载体中整合有作为选择标记之一的BASTA抗性基因(bar基因),向植物体喷射0.01%BASTA溶液,由此能够筛选出转化植物。
[实验7]拟南芥导入用核酶的体外切断活性
用分别添加了T7启动子序列的引物(35S启动子序列用正向引物:5’-CTAATACGACTCACTATAGGGAGACAGCTATGACCATGATT ACGCCAAGC-3’(序列号15);35S启动子序列用反向引物:5’-ACCATGGATCCTCTAGAGTCGACTG-3’(序列号16);核酶35S(+)-A2BC用正向引物:5’-CTAATACGACTCACTATAGGGAGAAGTAGTGATTGGGCGGA C-3’(序列号17);核酶35S(+)-A2BC用反向引物:5’-CGCCATTGGGATGAGCTCAA-3’(序列号18))通过PCR扩增35S启动子序列和核酶35S(+)-A2BC,以得到的PCR产物为模板利用T7 RNA聚合酶(CUGA7体外转录试剂盒)进行转录。将核酶的转录产物10μg在50μL的反应液中(50mM Tris-HCl)在95℃下进行2分钟变性处理,骤冷,接着添加MgCl2使终浓度达到50mM后,在37℃下孵育3小时,使顺式型核酶进行自切断。在添加Tris-HCl而使终浓度达到50mM的10μL的反应液中,对35S启动子RNA片段900ng加入单体化的核酶2.1μg,在95℃下进行2分钟变性处理,骤冷。添加MgCl2(终浓度50mM)而开始反应,在37℃下孵育3小时,由此利用反式型核酶进行35S启动子RNA片段的切断(图12)。
[实验8]导入核酶的拟南芥的制作
为了调查通过基因重组进行导入时的核酶切断支架RNA的效果,首先如下制作GFP基因的35S启动子区域被甲基化的品系。制作在表达载体pBE2113的35S启动子下游整合有GFP基因的构建体,利用农杆菌法将其导入拟南芥Col-0品系。在卡那霉素(50μg/ml)培养基上筛选转化体。接着,从转化后的个体(T1代)中,选择导入了3拷贝以上的GFP基因而表达量过量、结果诱导35S启动子的甲基化、T4代中GFP基因的表达几乎完全被抑制的品系(Col-0GFP-TGS)。向该Col-0GFP-TGS品系中,通过农杆菌法导入实验6中制作的核酶表达载体。在播种后的约第2周通过喷射0.01%BASTA来进行转化个体筛选。通过喷射BASTA的处理进行的筛选中,容易得到假阳性个体,因此按照常规方法从筛选出的个体中提取DNA,对于提取出的DNA用ribo-insert-check-F(5’-CCCCTAAGTGGGATATTAAGTCAAG-3’:序列号19)和ribo-insert-check-R(5’-TATCCCACTTAGGGGTTTGGAAAC-3’:序列号20)的引物对进行PCR,确认核酶35S-A2BC的导入(图13)。
[实验9]导入了核酶的Col-0 GFP-TGS个体中的GFP基因的表达分析
在实验8中得到的核酶35S-A2BC导入T1个体中,35S启动子的支架RNA正链被核酶切断,从而诱导了35S启动子区域的去甲基化,预测GFP基因的表达量增加。在核酶35S-A2BC导入个体和非导入个体之间比较GFP基因的表达量,结果确认,核酶35S-A2BC导入个体中GFP表达量与非导入个体相比最多增加了2倍程度(图14)。GFP基因的表达量是对使用RNAzol RT(Molecular Research Center)由叶提取的总RNA进行定量RT-PCR(GeXP表达分析系统、ABサイエックス)而测定的。作为内标使用的基因为UBQ10基因,RT-PCR中使用的GFP和UBQ10基因的引物对分别为GeXP-GFP-F(5’-AGGTGACACTATAGAATATATATCATGGCCGACAAGCA-3’:序列号21)、GeXP-GFP-R(5’-GTACGACTCACTATAGGGATGGGTGCTCAGGTAGTGGTT-3’:序列号22)和GeXP-Atubq10-F(5’-AGGTGACACTATAGAATATTGGCCGACTACAACATTCA-3’:序列号23)、GeXP-Atubq10-R(5’-GTACGACTCACTATAGGGAAAGTGATGGTCTTTCCGGTG-3’:序列号24)。
序列表
<110> 国立研究开发法人产业技术综合研究所;
国立大学法人北海道大学
<120> 抑制植物中的靶DNA的甲基化的方法
<130> P190386WO
<160> 24
<170> PatentIn version 3.5
<210> 1
<211> 362
<212> DNA
<213> 花椰菜花叶病毒(Cauliflower mosaic virus)
<400> 1
ccaaagggca attgagactt ttcaacaaag ggtaatatcc ggaaacctcc tcggattcca 60
ttgcccagct atctgtcact ttattgtgaa gatagtggaa aaggaaggtg gctcctacaa 120
atgccatcat tgcgataaag gaaaggccat cgttgaagat gcctctgccg acagtggtcc 180
caaagatgga cccccaccca cgaggagcat cgtggaaaaa gaagacgttc caaccacgtc 240
ttcaaagcaa gtggattgat gtgatatctc cactgacgta agggatgacg cacaatccca 300
ctatccttcg caagaccctt cctctatata aggaagttca tttcatttgg agagaacacg 360
gg 362
<210> 2
<211> 345
<212> DNA
<213> 花椰菜花叶病毒(Cauliflower mosaic virus)
<400> 2
tctctccaaa tgaaatgaac ttccttatat agaggaaggg tcttgcgaag gatagtggga 60
ttgtgcgtca tcccttacgt cagtggagat atcacatcaa tccacttgct ttgaagacgt 120
ggttggaacg tcttcttttt ccacgatgct cctcgtgggt gggggtccat ctttgggacc 180
actgtcggca gaggcatctt caacgatggc ctttccttta tcgcaatgat ggcatttgta 240
ggagccacct tccttttcca ctatcttcac aataaagtga cagatagctg ggcaatggaa 300
tccgaggagg tttccggata ttaccctttg ttgaaaagtc tcaat 345
<210> 3
<211> 57
<212> DNA
<213> 人工序列
<220>
<223> 用于35S启动子的核酶(反义)
<400> 3
cgaggcctga tctccactct gatgagtccg tgaggacgaa acgtaaggac gcgtgcg 57
<210> 4
<211> 1172
<212> DNA
<213> 本生烟16c(Nicotiana benthamiana 16c)
<400> 4
actctgaaaa gttgtttccc attataggcc tttggaggag cctaaggtaa cgggtcgata 60
gacagtgaaa taacacttct atcacctttt ccttccaccg aggatgttta cggtagtaac 120
gctatttcct ttccggtagc aacttctacg gagacggctg tcaccagggt ttctacctgg 180
gggtgggtgc tcctcgtagc acctttttct tctgcaaggt tggtgcagaa gtttcgttca 240
cctaactaca ctatagaggt gactgcattc cctactgcgt gttagggtga taggaagcgt 300
tctgggaagg agatatattc cttcaagtaa agtaaacctc tcttgtgccc cctgagatct 360
cctaggttcc tctatattgt tacttctgat tagaaaaaga gaaagagtag aaaagtgaag 420
aggatagtaa taggagccgg cttaagtcat ttcctcttct tgaaaagtga cctcaacagg 480
gttaagaaca acttaatcta ccactacaat tacccatgtt taaaagacag tcacctctcc 540
cacttccact acgttgtatg ccttttgaat gggaatttaa ataaacgtga tgaccttttg 600
atggacaagg taccggttgt gaacagtgat gaaagagaat accacaagtt acgaaaagtt 660
ctatgggtct agtatacttc gccgtgctga agaagttctc gcggtacgga ctccctatgc 720
acgtcctctc ctggtagaag aagttcctgc tgcccttgat gttctgtgca cgacttcagt 780
tcaaactccc tctgtgggag cagttgtcct agctcgaatt cccttagcta aagttcctcc 840
tgcctttgta ggagccggtg ttcaacctta tgttgatgtt gagggtgttg catatgtagt 900
accggctgtt cgttttcttg ccgtagtttc ggttgaagtt ctgggcggtg ttgtagcttc 960
tgccgccgca cgttgagcga ctagtaatag ttgttttatg aggttaaccg ctaccgggac 1020
aggaaaatgg tctgttggta atggacaggt gtgttagacg ggaaagcttt ctagggttgc 1080
ttttctctct ggtgtaccag gaagaactca aacattgtcg acgaccctaa tgtgtaccgt 1140
acctacttga tatgtttgta ctactcgaaa tt 1172
<210> 5
<211> 385
<212> DNA
<213> 花椰菜花叶病毒(Cauliflower mosaic virus)
<400> 5
ctctagagga tcccccctca gaagaccaga gggctattga gacttttcaa caaagggtaa 60
tatcgggaaa cctcctcgga ttccattgcc cagctatctg tcacttcatc gaaaggacag 120
tagaaaagga aggtggctcc tacaaatgcc atcattgcga taaaggaaag gctatcgttc 180
aagatgcctc taccgacagt ggtcccaaag atggaccccc acccacgagg aacatcgtgg 240
aaaaagaaga cgttccaacc acgtcttcaa agcaagtgga ttgatgtgat atctccactg 300
acgtaaggga tgacgcacaa tcccactatc cttcgcaaga cccttcctct atataaggaa 360
gttcatttca tttggagagg acagg 385
<210> 6
<211> 739
<212> DNA
<213> 人工序列
<220>
<223> 核酶35S(+)A 盒
<400> 6
aagcttcttt ttttcttctt cttcgttcat acagtttttt tttgtttatc agcttacatt 60
ttcttgaacc gtagctttcg ttttcttctt tttaactttc cattcggagt ttttgtatct 120
tgtttcatag tttgtcccag gattagaatg attaggcatc gaaccttcaa gaatttgatt 180
gaataaaaca tcttcattct taagatatga agataatctt caaaaggccc ctgggaatct 240
gaaagaagag aagcaggccc atttatatgg gaaagaacaa tagtatttct tatataggcc 300
catttaagtt gaaaacaatc ttcaaaagtc ccacatcgct tagataagaa aacgaagctg 360
agtttatata cagctagagt cgaagtagtg attgggcgga ccgttgacga aacgcgaaag 420
cgtctagcga aagctactga tgagtcgacc gatgaagtct gatgagtccg aaaggacgaa 480
acagatagcc ggaccgttga cgaaacgcga aagcgtctag cgaaagctac tgatgagtcg 540
acctttggct gatgagtccg aaaggacgaa accactgtcc ggaccgttga cgaaacgcga 600
aagcgtctag cgaaagctac tgatgagtcg acgctttgaa ctgatgagtc cgaaaggacg 660
aaacgtggtt gcggaccgtt gacgaaacgc gaaagcgtct agcgaaagct actgatgagt 720
cgaccttttt tttgagctc 739
<210> 7
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 35S-346F-bisuT 引物
<400> 7
attgagaytt ttyaayaaag ggta 24
<210> 8
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 35S+1A-bisuA引物
<400> 8
ctctccaaat gaaatgaact tc 22
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> T7-35S-5-345引物
<400> 9
attgagactt ttcaacaaag 20
<210> 10
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 35S+1R 引物
<400> 10
gttctctcca aatgaaatga ac 22
<210> 11
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 35S-3-130引物
<400> 11
gcagaggcat cttcaacgat g 21
<210> 12
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 35S-5-160 引物
<400> 12
ccacccacga ggagcatcgt g 21
<210> 13
<211> 45
<212> DNA
<213> 人工序列
<220>
<223> 35S(-)-5RZ-45
<400> 13
cgaggcctga tctccactct gatgagtccg tgaggacgaa acgta 45
<210> 14
<211> 32
<212> DNA
<213> 人工序列
<220>
<223> 35S(-)-3RZ-32
<400> 14
cgcacgcgtc cttacgtttc gtcctcacgg ac 32
<210> 15
<211> 50
<212> DNA
<213> 人工序列
<220>
<223> 35S-promoter-F 引物
<400> 15
ctaatacgac tcactatagg gagacagcta tgaccatgat tacgccaagc 50
<210> 16
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 35S-promoter-R 引物
<400> 16
accatggatc ctctagagtc gactg 25
<210> 17
<211> 42
<212> DNA
<213> 人工序列
<220>
<223> 35S(+)-A2BC-F 引物
<400> 17
ctaatacgac tcactatagg gagaagtagt gattgggcgg ac 42
<210> 18
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 35S(+)-A2BC-R 引物
<400> 18
cgccattggg atgagctcaa 20
<210> 19
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> ribo-insert-check-F 引物
<400> 19
cccctaagtg ggatattaag tcaag 25
<210> 20
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> ribo-insert-check-R引物
<400> 20
tatcccactt aggggtttgg aaac 24
<210> 21
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> GeXP-GFP-F引物
<400> 21
aggtgacact atagaatata tatcatggcc gacaagca 38
<210> 22
<211> 39
<212> DNA
<213> 人工序列
<220>
<223> GeXP-GFP-R 引物
<400> 22
gtacgactca ctatagggat gggtgctcag gtagtggtt 39
<210> 23
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> GeXP-Atubq10-F 引物
<400> 23
aggtgacact atagaatatt ggccgactac aacattca 38
<210> 24
<211> 39
<212> DNA
<213> 人工序列
<220>
<223> GeXP-Atubq10-R引物
<400> 24
gtacgactca ctatagggaa agtgatggtc tttccggtg 39
- 抑制植物中的靶DNA的甲基化的方法
- 一种利用DNA甲基化抑制剂构建植物群体的方法
