一种基于β-环糊精修饰的PAMAM靶向纳米给药载体及其制备方法
文献发布时间:2023-06-19 11:09:54
技术领域
本发明属于生物医药技术领域,具体涉及一种基于β-环糊精修饰的高效pH氧化还原双敏感的PAMAM靶向纳米给药载体的制备方法。
背景技术
近五六十年来,癌症已成为严重危害人类生命健康的最强杀手。根据统计,预计到2020年全球肿瘤新发病例将达2000万,死亡病例将达到1200万。全国肿瘤登记中心数据显示恶性肿瘤年轻化的趋势较明显,这与人们的生活方式密切相关。因此,预防和治疗癌症在当下有着十分重要的意义。现如今能够治疗癌症的临床手段主要包括放射性治疗、化学治疗和手术治疗,然而这些传统的治疗方式都存在一定的限制性。此外,溶解度、生物利用度和药物靶向性的限制都极大影响了药物的疗效与应用。医药学科相关研究人员试图将纳米载体应用到抗肿瘤药物递送系统中,以期提高药物靶向性、增大药物在肿瘤部位的蓄积量,并达到降低药物本身的毒副作用的效果。目前研究较为广泛新型递药系统主要有脂质体、树状大分子、纳米乳、聚合物胶束等,其中,聚酰胺-胺树状大分子(PAMAM)以其均匀的纳米级粒径,独特的超支化3D结构以及有效的载药空间越来越受到研究人员的关注与重视,并开发出了以PAMAM为基础的药物承载、靶向递送、以及易于药物释放的多功能抗肿瘤药物递送系统。
作为树形聚合物中主要一类大分子,聚酰胺—胺树枝状大分子(PAMAM)是目前为止研究最广泛深入的树枝状高分子。PAMAM主要由三个部分组成:位于中心的单原子或原子群组成的引发核(通常是乙二胺或者是氨)、表面功能基团以及连接二者的枝化结构。枝化链段通过反复的Micheal加成反应和酰胺化反应产生一系列同心层,即称为代数(G)。从第四代开始,PAMAM分子有了一定基数的表面功能基团使得其呈现高度枝化、对称、呈辐射状、封闭的三维球形结构。在树枝状分子的空隙中,形成了疏水性的灵活空间,为疏水性药物提供了有效的容器状载体,而且其表面结构是亲水性的可以用于增加药物的溶解性。同时,PAMAM有着良好的反应性和耐受性,可以在分子表面引入大量与伯氨基易于反应的官能团,也可以键合药物,靶向基团和各种修饰基团。
但是,先前的研究发现,具有NH2末端基团的高代PAMAM与细胞毒性、溶血和肝毒性相关,这限制了它们的生物医学应用。为了提高PAMAM-(NH2)n的生物相容性和降低毒性,已经提出了不同的方法来钝化NH2末端基团,包括乙酰化和PEG化。聚乙二醇化已被更广泛地研究,因为除了降低的细胞毒性外,聚乙二醇化还在空间上屏蔽纳米载体的调理作用,从而增加它们在血流中的循环时长,从而通过EPR效应增强治疗剂的体内肿瘤积累。
癌细胞超级强大的繁殖能力使得肿瘤部位无法供应相应的营养、能量与氧气,导致癌细胞无法完成有氧呼吸,无氧环境下糖酵解会产生大量的乳酸,致使肿瘤部位的pH值(5.0)相较于正常细胞pH值(7.4)低。针对肿瘤细胞的pH5.0的酸性环境与正常细pH7.4的中性环境这一生存环境的巨大差异,研究学者们设计并合成了基于酸碱值敏感的纳米递药系统,通过载体将包裹的抗肿瘤药物递送到特定的肿瘤部位,从而能够实现抗肿瘤的效果。比如聚酰胺-胺树状大分子外周含有很多伯氨基团,因此容易发生质子化而产“质子海绵效应”,引发细胞内溶酶体的肿胀,药物可以更加快速的释放到细胞中去。癌细胞的生存微环境与正常细胞的差异不仅表现在pH敏感上,其细胞质里的谷胱甘肽(GSH)的含量是正常细胞含量的4~5倍左右,因此,我们可以利用这种癌细胞与血液通路中谷胱甘肽的浓度差异设计还原敏感性质的药物递药系统。比如;PAMAM树状大分子上通过二硫键(-S-S-)间接键合上PEG进而合成PAMAM-S-S-PEG(PSSP)。
与树枝状聚合物(比如PAMAM)相关的另一个常见局限性就是其相对小的尺寸使得难以封装大量有效负载。同时,环糊精(CDs)已在受控药物输送领域得到广泛研究。环糊精是由α-D-葡萄糖单元组成的环状低聚糖,其通过(1→4)键连接,形成截短的锥形。由于这种独特的结构,环糊精具有的锥形腔,其本质上基本上是疏水的。空腔提供疏水微环境,吸引适当大小的疏水药物分子,并通过包合物的形成稳定药物,从而增加载药量,提高抗肿瘤效果。
因为肿瘤部位特殊的微环境可以通过EPR效应增强治疗剂的体内肿瘤积累,然而,单独通过被动肿瘤靶向的程度EPR效应通常是有限的。如果使用对癌细胞中过表达的受体特异的活性肿瘤靶向配体修饰的聚乙二醇化纳米载体可以进一步增强纳米载体的体内肿瘤积累,进而实现更加精准的靶向治疗。T7肽(序列HAIYPRH)可以专一性识别癌细胞表面的转铁蛋白受体,因此T7修饰后的药物递送系统能够实现抗癌药物的高度蓄积,并且提高细胞摄取效率。
发明内容
本发明目的是提供一种基于β-环糊精修饰的PAMAM靶向纳米给药载体及其制备方法。
本发明的一种技术方案是:
一种基于β-环糊精修饰的PAMAM靶向纳米给药载体,包括如下通式:T-PEG
其中,
T为肿瘤靶向配体;
PEG为聚乙二醇;
-SS-为桥键二硫键;
PAMAM为第0-10代的阳离子聚酰胺-胺树状大分子;
CD为羧甲基-β-环糊精;
m为1-4096;
n为1-4096。
进一步的,携载药物的基于β-环糊精修饰的PAMAM靶向纳米给药载体的通式为T-PEGm-SS-PAMAM-(CD)n/X,
其中,
T为肿瘤靶向配体;
PEG为聚乙二醇;
-SS-为桥键二硫键;
PAMAM为第0-10代的阳离子聚酰胺-胺树状大分子;
-CD为羧甲基-β-环糊精;
X为抗肿瘤药物;
m为1-4096;
n为1-4096。
进一步的,所述肿瘤靶向配体为T7肽。
进一步的,所述抗肿瘤药物为阿霉素。
进一步的,所述m为30。
进一步的,所述n为70。
进一步的,所述阳离子聚酰胺-胺树状大分子是以乙二胺为核的第5代聚酰胺-胺树状大分子。
本发明的另一技术方案是:
一种基于β-环糊精修饰的PAMAM靶向纳米给药载体的制备工艺,包括步骤:
1)以磷酸盐缓冲液(PBS)pH7.4为溶剂,以N-羟基丁二酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸为催化剂,使PAMAM与羧甲基-β-环糊精钠盐以摩尔比1:70进行反应制得PAMAM-CD;
2)以甲醇为溶剂,使所述PAMAM-CD、3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯和一端巯基化的PEG(HS-PEG-OCH
3)将所述PEG-SS-PAMAM-CD羧基化后与肿瘤靶向配体以摩尔比1:30反应24小时,超滤纯化,冷冻干燥得T-PEG
进一步的,一种携载药物的基于β-环糊精修饰的PAMAM靶向纳米给药载体的制备工艺,其特征在于,包括步骤:
1)称取X溶于DMSO溶液,加入三乙胺,室温避光搅拌4h中和盐酸,使X成为疏水性药物;
2)以DMSO和蒸馏水为溶剂,所述DMSO和蒸馏水的体积比为1:1,按照X和T-PEG
3)待反应结束后将反应液转移至超滤管中,在5000rpm的条件下离心20min除去未包封的X,取上清液冷冻干燥,即得T-PEG
本发明提供了一种基于β-环糊精修饰的PAMAM靶向纳米给药载体及其制备方法,其优点为:
(1)β-CD的修饰可以提高纳米载体的载药量,增加抗肿瘤效果;
(2)通过二硫键将PEG连接在PAMAM的表面,一方面可以显著降低PAMAM的溶血毒性,延长聚合物在血液中的循环时间;另一方面在复合物进入肿瘤细胞内后,在高还原性的胞浆环境是二硫键断裂,促进其包载的药物迅速释放,从而实现还原和pH双重敏感释药的目的;
(3)为了增加肿瘤细胞对聚合物的摄取,增加聚合物的主动靶向作用,本发明对聚合物载药系统的表面进行了T7肽修饰,通过T7与肿瘤细胞表面和肿瘤细胞表面高表达的TfR特异性的识别来促进细胞摄取,发挥其主动靶向作用,增加抗肿瘤效果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中,
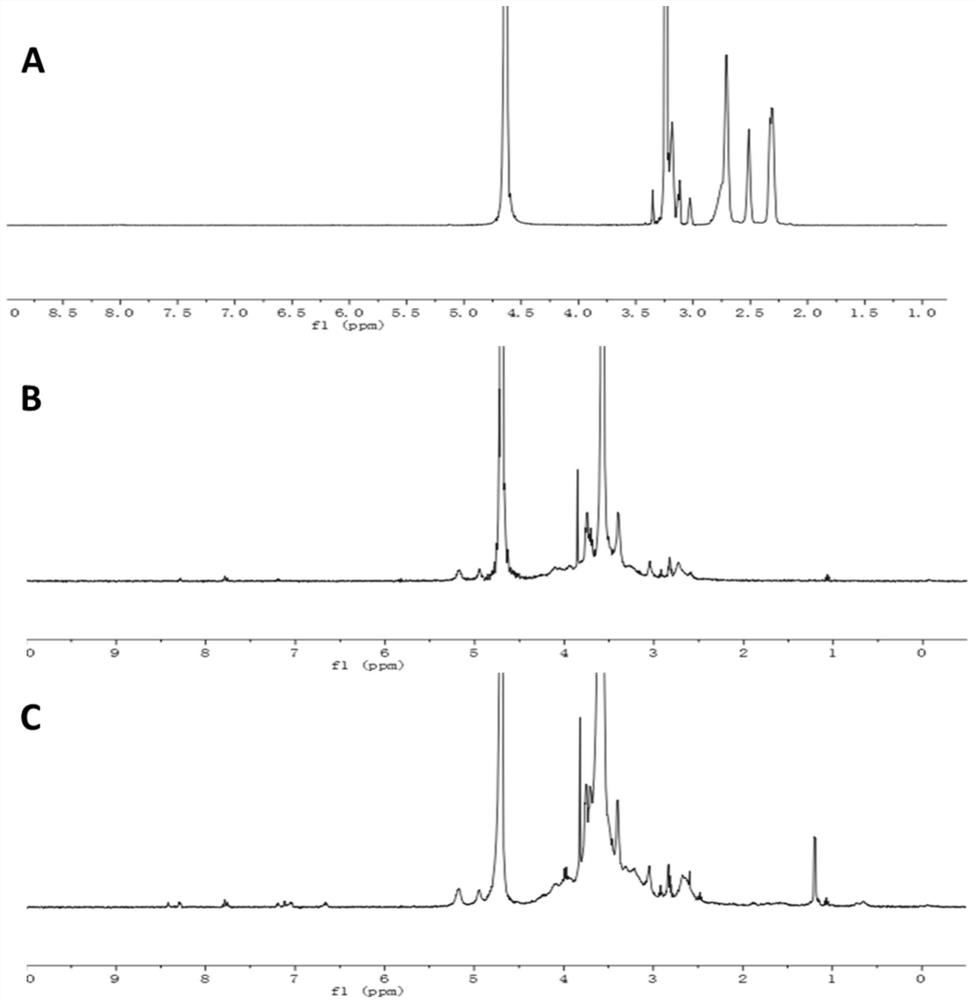
图1为PAMAM(A)、PEG-SS-PAMAM-CD(B)和T7-PEG-SS-PAMAM-CD(C)的
图2为PEG-SS-PAMAM-CD/DOX(图中缩写为PSSCD/DOX)和PEG-PAMAM-CD/DOX(图中缩写为PPCD/DOX)的体外释放图;
图3为PEG-SS-PAMAM-CD/DOX(PSSCD/DOX)、PEG-PAMAM-CD/DOX(PPCD/DOX)和DOX的体外抗MCF-7细胞实验的效果图;
图4为PEG-SS-PAMAM-CD/DOX(PSSPCD/DOX)和T7-PEG-SS-PAMAM-CD/DOX(T7-PSSPCD)的体外细胞摄取实验效果图。
具体实施方式
G5 PAMAM树状大分子(末端有128个氨基,相对分子质量为28826Da,美国Dendritech公司);羧甲基-β-环糊精(CM-β-CD,上海拓克化学科技有限公司);盐酸阿霉素(纯度≥98%,北京华奉联博科技有限公司);N-羟基丁二酰亚胺(NHS,萨恩化学技术(上海)有限公司);氯化钾、磷酸氢二钠、氯化钠、磷酸二氢钾、三乙胺(国药集团化学试剂有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC-HCl,东京化成工业株式会社);透析袋(截留分子量为8K~14KDa及3.5KDa,索莱宝);NHS-PEG
采用超导核磁共振谱仪(Unity Inova 400MHz)对聚合物的结构进行确证,采用Nicomp TM 380ZLS型激光纳米粒度/电位仪对聚合物粒径、电位进行表征,采用流式细胞仪(FC500,美国Beckman Coulter公司)进行细胞摄取的考察。
第0-10代的阳离子聚酰胺-胺树状大分子的结构如下:
在通式T-PEG
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和实施例进一步说明本发明的技术方案。但是本发明不限于所列出的实施例,还应包括在本发明所要求的权利范围内其他任何公知的改变。
首先,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
其次,本发明利用结构示意图等进行详细描述,在详述本发明实施例时,为便于说明,示意图会不依一般比例作局部放大,而且所述示意图只是实例,其在此不应限制本发明保护的范围。此外,在实际制作中应包含长度、宽度及深度的三维空间。
实施例1
以反应摩尔比分别为1:70:70:70的G5 PAMAM、β-环糊精、EDC和NHS为起始原料合成PCD(mol/mol,PAMAM/β-CD=1/30)聚合物。具体操作方法为:采用电子分析天平精密称取一定质量的β-环糊精溶解在5ml的磷酸盐缓冲液中(pH7.4),再把相同摩尔比例的EDC和NHS溶解在混合液中,室温条件下避光搅拌8小时,以活化β-环糊精的羧基,然后吸取G5 PAMAM加入到反应瓶中,氮气保护,室温条件下搅拌反应24h,最后去离子水透析2天后冷冻干燥2天,即得终产物PAMAM-CD。
将合成的产物PAMAM-CD与SPDP以1:30摩尔比加入甲醇溶液中和,加入三乙胺,氮气保护,在30℃避光搅拌5h,然后加入一定量的HS-PEG-OCH
将PEG-SS-PAMAM-CD溶于2mlPBS(0.1M,pH7.4)中,加入30倍摩尔量的1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),活化羧基1h后加入30倍摩尔量的T7肽,氮气保护,避光反应24h,最后去离子水透析后冻干即得T7-PEG-SS-PAMAM-CD(T7-PSSPCD)。
精密称取实施例1制得的PAMAM-CD和NHS-PEG
核磁分析
对PAMAM、实施例1中合成的产物的PAMAM-CD和PEG-SS-PAMAM-CD进行核磁分析,结果如图1所示,通过核磁氢谱对合成产物进行核磁分析,特征质子特征峰归属如下:其中有四个PAMAM的特征质子峰,它们分别是δ2.45、2.61、2.81和3.28ppm;β-CD的特征质子峰,它们分别是δ5.16、3.76和3.51ppm;同时HS-PEG
聚合物粒径和Zeta电位的测定
取上述合成的聚合物PAMAM-CD、PEG-PAMAM-CD、PEG-SS-PAMAM-CD和T7-PEG-SS-PAMAM-CD分别溶解在超纯水中,终浓度为3mg/ml,超声5min后,经0.22μm过滤器过滤,弃去初滤液,收集续滤液与测定池,用激光粒度分析仪测定粒径大小,每种样品平行测定3次。Zeta电位测定使用相同仪器,样品与上述同样的浓度与操作步骤测定,每种样品平行操作3次。
测得实施例1合成的T7-PEG-SS-PAMAM-CD聚合物的粒径为49.12±0.29nm,Zate电位为2.47±0.18mV。
实施例1合成的PEG-SS-PAMAM-CD聚合物的粒径为49.10±0.17nm,Zate电位为2.90±0.36mV。
PEG-PAMAM-CD聚合物的粒径为53.14±0.21nm,Zate电位为5.28±0.16mV。
上述合成的三种聚合物PEG-PAMAM-CD、PEG-SS-PAMAM-CD、T7-PEG-SS-PAMAM-CD,由于PEG链的引入,比PAMAM的粒径大,Zeta电位降低,可显著提高稳定性,降低毒性。
制备载药复合物
精密称取一定量的DOX·HCl溶于甲醇溶液中,加入适量的三乙胺中和盐酸,使DOX游离出来。随后按照DOX和上述合成聚合物PEG-SS-PAMAM-CD和PEG-PAMAM-CD的摩尔比40:1反应。称取定量的PEG-SS-PAMAM-CD聚合物加入甲醇溶液中,氮气保护,30℃避光搅拌24h,旋转蒸发除去甲醇溶液,加入适量的蒸馏水溶解复合物,5000rpm离心10min除去未包封的DOX,取上清液冷冻干燥即得上述合成聚合物的载药复合物PSSPCD/DOX和PPCD/DOX。
精密称取一定量的DOX·HCl溶于DMSO溶液中,加入适量的三乙胺,室温避光搅拌4h中和盐酸,使DOX游离出来。随后按照DOX和上述合成聚合物PAMAM-CD和T7-PEG-SS-PAMAM-CD的摩尔比40:1反应。称取定量的PAMAM-CD聚合物溶于1ml的蒸馏水中,然后一滴一滴加入上述不断搅拌的DMSO溶液中,氮气保护,30℃避光搅拌24h。反应结束后液体转移到超滤管中,5000rpm,离心10min除去未包封的DOX,取上清液冷冻干燥即得上述合成聚合物的载药复合物PAMAM-CD和T7-PEG-SS-PAMAM-CD。
载体复合物体外释放考察
采用透析袋法在不同释放条件下考察各个载药复合物的还原和pH敏感性,释放条件分别为:(1)含有10mM谷胱甘肽(GSH)的pH7.4的磷酸盐缓冲液,(2)不含有10mM谷胱甘肽(GSH)的pH7.4的磷酸盐缓冲液,(3)含有10mM谷胱甘肽(GSH)的pH5.0的磷酸盐缓冲液,(4)含有10mM谷胱甘肽(GSH)的pH5.0的磷酸盐缓冲液。其中pH7.4为正常组织非酸性pH生理条件,pH5.0为肿瘤细胞内酸性pH条件,GSH 10mM为肿瘤细胞内高还原性条件。精密称取同摩尔量各复合物溶于2mL缓冲液置于透析袋中(MWCO=3500Da),两端扎紧,随即投入装有20mL不同释放介质的锥形瓶中,在37℃,100rpm恒温摇床中振摇,分别于0.5、1、2、4、6、8、12和24h取样41mL,同时补充同体积同温度相应的新鲜释放介质。采用紫外分光光度计测定各介质中DOX的浓度,并按以下公式计算累计释放百分数。其中Er为DOX累积释放百分量;Ve为磷酸盐缓冲液的置换体积;V0为释放介质的总体积;mDOX为复合物中DOX的含量(即为200μg);Ci为第i次置换取样时释放出的药物浓度。
从图2中可以看出DOX从PSSPCD/DOX和PPCD/DOX载药复合物中的释放均具有明显pH敏感性,在pH 5.0的条件下,DOX的释放速度及累计释放率明显高于在pH 7.4条件下的释放。这种pH释药行为主要是由于PAMAM本身具有pH敏感性,在低pH的条件下,其构象会从高pH值时的“致密中心”向“致密外壳”转变,外部的支链缩紧,内部的空腔打开,DOX迅速从复合物中释放出来。
DOX从PSSPCD/DOX复合物中的释放均具有明显的还原敏感性。在释放介质pH条件相同,均为5.0,复合物在有高浓度GSH存在时的累积释放率比不含有GSH时高10%左右。同样,释放介质pH条件相同,均为7.4,复合物在有GSH存在时的累积释放率比不含有GSH时也高10%左右。主要原因可能是由于在高浓度GSH的刺激下,连接在PAMAM与PEG之间的二硫键发生断裂,导致PEG从PAMAM的表面脱落,消除了DOX从PAMAM的内核向外面的介质中释放时的空间位阻。
体外抗肿瘤实验
为了考察载药复合物PCD、PPCD/DOX、PSSPCD/DOX和T7-PSSPCD的体外抗肿瘤作用,取处于对数生长期的细胞4T1,用0.25%胰酶消化后使其形成单个细胞悬液,以1×104cells/mL的细胞浓度接种于96孔板中,每孔100μL,设置阴性组和空白对照组。将96孔板置于培养箱中培养24h后,弃去旧的培养液,用PBS洗涤两次后,分别加入100μL含有系列浓度PCD、PPCD/DOX、PSSPCD/DOX和T7-PSSPCD的载药复合物溶液及游离DOX溶液,每组设三个复孔,放置CO2培养箱中培养48小时。弃去板中的培养液,用PBS清洗两次,每空加入100μLMTT溶液(0.5mg/mL)。置于培养箱中继续培养4h后,弃去MTT溶液,每孔加入100μL DMSO,涡旋10min直至结晶溶解。比色:用酶标仪测量每孔在490nm处吸光度值(OD),并计算细胞存活率(cell viability)。
从图3可以看出,各复合物对4T1细胞具有一定的抗肿瘤作用。随着DOX浓度的增加,不同复合物对癌细胞的细胞毒性均呈依赖性上升。在相同的给药剂量下,PSSPCD/DOX载药复合物显现出最强的细胞毒性,说明二硫键存在能显著增强复合物的细胞毒作用。结果表明二硫键有助于药物的释放,从而发挥出明显的抗肿瘤作用。
体外细胞摄取实验
为了考察连接T7肽的复合物对4T1细胞的主动靶向作用,取对数生长期的4T1,用0.25%胰酶消化后使其形成单个细胞悬液,以1×10
从图4可以看出,T7肽靶向修饰使细胞对T7-PSSPCD/DOX纳米粒的摄取量显著增加,是未连接T7的PSSPCD/DOX纳米粒的1.8倍,说明T7的引入能显著增加纳米粒的主动靶向性,增加细胞的摄取量,从而提高药物在细胞内的有效浓度,进一步增强其体外抗肿瘤作用。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 一种基于β-环糊精修饰的PAMAM靶向纳米给药载体及其制备方法
- 一种基于PAMAM的靶向给药载体及其制备方法
