前端具有纳米结构的电极
文献发布时间:2023-06-19 11:26:00
技术领域
本发明涉及使用前端具有纳米结构的电极来测定和/或控制细胞内电位或电位变化的方法及用于该方法的电极。
背景技术
所有细胞在细胞内和细胞外具有不同的离子组成,通过保持其离子分布差异及其离子组成差异的转运蛋白(例如钠泵)来保持细胞内电位(膜电位)。在静息状态下,膜电位虽稳定(静息膜电位),但由于膜表面的离子通道被活化并打开,因膜内外的离子浓度差,离子一下子放出或流入,整个细胞内的电位发生变化(发生去极化或超极化),导致细胞内电位发生变化。其结果是,在心肌和神经中引起动作电位的产生/传递,引起激素和神经递质的释放等信息传递,在心肌、骨骼肌细胞中引起收缩。
一直以来,通过测定细胞的膜电位变动、与此相伴的通过离子通道的膜电流,可对细胞的状态变化和细胞对药物等的响应进行观察。特别是在药物发现筛选(創薬スクリーニング)时,将培养的心肌细胞、神经细胞等暴露于药物发现候选药物,测定膜电位的变化而对心脏毒性、神经毒性等进行评价正在广泛进行。
为了测定细胞内电位,以往在细胞内插入金属制电极或充满电解液的微玻璃电极,测定与细胞外的电极的电流或电压。最近,建立了基于膜片钳(Patch Clamp)法的测定法,并已成为主流。膜片钳法是指通过使充满细胞内电解液的玻璃移液管(ピペット)和细胞膜紧密贴附,使玻璃移液管和细胞电一体化,精确测定、控制细胞内电位变化的方法。
膜片钳法包括测定在整个细胞中表达的离子通道的动态的全细胞模式;测定仅在膜片移液管内径内的细胞膜中含有的离子通道的动态(单通道活性)的方法(细胞贴附(oncell)模式);还有从细胞中分离出其微细胞膜进行测定的方法(内膜片(inside patch)、外膜片(outside patch)模式)。
在全细胞模式中,通过刺破与玻璃移液管贴附的电极的内径上的细胞膜,测定细胞内电位变化、通过整个细胞中的离子通道的电流(离子通道的活性)的动态。由于上述技术是在显微镜下对单个细胞直接使用电极进行的记录法,因此需要高度熟练的技术以及较高的专业知识。
这些细胞内记录法(电压钳、电流钳)以膜片钳法(全细胞膜片)为代表,能够观察通过细胞膜中表达(存在)的离子通道的离子的动态。在电压钳模式中,通过包含在膜片钳放大器(増幅器)中的反馈功能可以有效地控制细胞内的电位,并且可以将由离子通道开闭引起的快速(以毫秒为单位的)现象记录为离子电流变化。在电流钳模式中,可以将因离子通道的活动对细胞的作用记录为(膜)电位变化。
膜片钳方法中包括手动(手动式)膜片钳法和自动膜片钳法,手动膜片钳法在电生理学测定中的数据可靠性高。然而,由于操作人员使用显微镜、操作操纵器(マニピュレーター)进行实验等的手法复杂且需要丰富的专业知识,因此效率非常差。这在医学生物学研究,特别是在药物发现领域中已经成为一大障碍。
另一方面,自动膜片钳法是自动化的电生理学测定仪器,近年来虽然性能显著提高,但在数据可靠性方面,还没有获得能够取代手动膜片钳法的程度的可靠性。此外,由于自动膜片钳试验仪器非常昂贵,其使用仅限于一些大制药企业。
此外,近年来,作为为了测定细胞内电位而使电极贯通细胞膜的方法,代替膜片钳法,开发了对细胞施加高电压进行电穿孔的方法(非专利文献3),据报道能够记录大鼠心肌细胞的细胞内电位。然而,在该方法中,由于被穿孔破坏的细胞膜被立即修复,电极进入细胞内的通路(アクセス)消失。电响应的可观察时间最多为10分钟左右,不能说是实用的方法。
相对于这样的细胞内记录法,近年来,在细胞外记录电变化的细胞外记录法的开发也有所进步并已广泛利用。细胞外记录法是以体外多点平面电极(多电极阵列)系统为代表,通过在细胞外与细胞接触放置的电极在细胞外记录电变化的方法(专利文献1~专利文献4)。
作为体外多点平面电极(多电极阵列,MEA)系统的应用,已开始用于培养神经细胞的可塑性研究和使用人iPS细胞来源的神经细胞、心肌细胞的药物安全性试验等。
然而,MEA由于是细胞外记录而容易进行细胞操作,但只能记录交流样的变化(膜电位的单位时间变化、微分波形),因此无法测定细胞内发生的缓慢的膜电位变化。因此,通过测定获得的信息有限,其应用有限。
作为用基于MEA的方法尝试细胞内记录的报道,虽然有通过在蘑菇形状的电极上接种细胞并对其施加高电压而成功破坏细胞膜的例子(非专利文献1),但保持细胞内电位的记录条件的时间极短,为3分钟以内,没有显示出作为记录方法的有效性。
因此,作为对细胞的侵入性小、准确且简单地测定、控制细胞内电位的方法,本发明人等最近开发了通过使用金涂覆磁性纳米粒子等导电性纳米粒子的细胞外的电极代替玻璃微电极来记录细胞内电位和电位变化的方法。具体而言,通过利用强力磁铁的作用使细胞内(或细胞表面)的导电性纳米粒子贯通细胞膜来使细胞内外的电极彼此连接,可以通过细胞外的测定装置来测定细胞内电位和电位变化。通过这种方法,得到了尽可能地抑制对细胞的损伤并且通过简便的方法就可以长时间持续观测生存细胞中的细胞内电位的变动这样的令人吃惊的效果,因此在2018年4月27日提交了国际专利申请(PCT/JP2018/017334)。
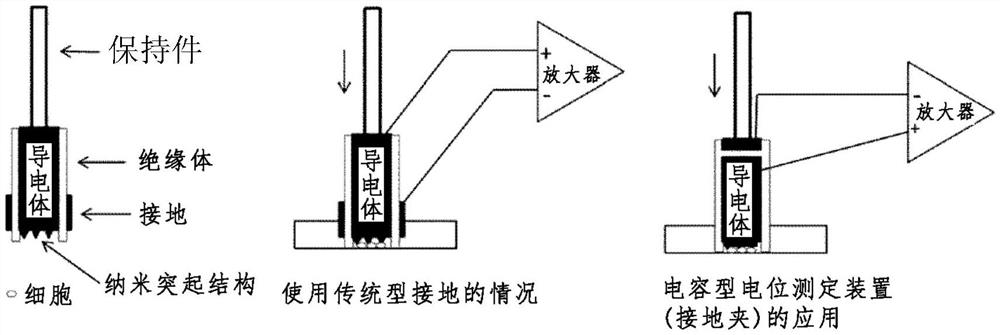
此外,本发明人等开发了“电容型电位测定装置法”作为新的细胞内电位测定方法。这里所说的电容器由接种细胞的导电性板和位于其下方的绝缘体以及第二导电体构成,测定这两个导电体之间的电位差。根据该方法,充当传感器的导电性板通过贯通细胞膜的导电性纳米粒子感应细胞内的电荷(チャージ)变化,进行电荷-电压转换,作为细胞内电位变化进行记录。因此,这是不需要在细胞外液中设置接地(アース)且导电性板可以在不与细胞接触的部分直接接触细胞外溶液的方法。
关于该方法的专利申请也于2018年4月27日提交了专利申请(日本特愿2018-87689)。
现有技术文献
专利文献
专利文献1:WO2012/043820
专利文献2:WO2013/061849
专利文献3:WO2014/098182
专利文献4:日本特表2005-505761号公报
非专利文献
非专利文献1:Anna Fendyur等,Frontiers in Neuroengineering,Dec.2011,Vol.4,Article14,p.1-14
非专利文献2:Raphael Levy等,NanoReviews 2010,1:4889-DOI:10.3402/nano.v1i0.4889
非专利文献3:Micha E.Spira等,Nature Nanotechnology Vol.8(Feb.2013)p.83-94/DOI:10.1038/NNANO.2012.265
发明内容
发明要解决的技术问题
上述本发明人等的使用导电性纳米粒子的细胞内电位测定法是通过使用导电性纳米粒子代替传统的玻璃微电极而对细胞的侵入性小、能够准确且简单地长期持续测定细胞内电位的方法;然而,不仅为了使导电性纳米粒子贯通细胞膜,还为了将电极固定在细胞表面,需要磁场,对测定用的装置有若干限制。
例如,在细胞下方形成细胞内记录电极的情况下,为了使预先导入细胞内的导电性纳米粒子贯通细胞膜,需要在细胞下方隔着导电性板设置磁铁。发现通过使用磁铁电极(Magele),可以从细胞的上方吸引细胞内的导电性纳米粒子而形成细胞内记录电极;而且发现即使不预先在细胞内导入导电性纳米粒子,也可以从细胞外将导电性纳米粒子压在细胞表面上而贯通细胞膜。然而,在前者的情况下为了将细胞上方的磁铁电极(Magele)固定在细胞表面,在后者的情况下为了吸引磁铁电极表面的导电性纳米粒子并固定磁铁电极,需要在细胞的下方设置铁板并利用与磁铁电极的磁场。即,这两种情况都是为了将电极固定在细胞表面来形成稳定的细胞内记录电极而必须利用磁力的方法。
本发明的目的在于提供这样的方法:该方法是用于不需要磁力而形成细胞的细胞内记录电极的方法,特别是从细胞的上方测定细胞内电位的方法的改良方法,是对细胞的侵入性小、能够准确地进行长期的细胞内电位测定并且纳米结构的细胞膜贯通工序更简便的测定方法。
解决技术问题的技术手段
本发明提供了一种改良方法,该改良方法不需要在本发明人等以前开发的使用磁铁电极(Magele)使导电性纳米粒子贯通目标细胞的细胞膜而形成细胞内记录电极并测定细胞内的电位和电位变化的方法中用于细胞膜的贯通工序和磁铁电极(Magele)的自立固定所必需的磁场的形成。
即,该方法是不需要在细胞的下方设置用于磁力产生的铁板或磁铁等,可以使用不具有磁力的导电体代替从细胞表面的上方贴附的磁铁电极(Magele)的方法。
具体而言,该方法是在细胞上方的细胞内记录电极上设置保持件(保持器)而使其固定的方法,优选是利用能够调整加压程度的操纵器将保持件固定的方法;此外,是代替导电性纳米粒子-磁铁电极,使用由前端具有10nm-50nm的金属等导电性的纳米结构(nanostructure)或纳米突起结构(nanoprotrusion)的导电体构成的电极(以下也简称为“前端具有导电性纳米结构的电极”)的方法。
另外,作为本发明的“前端具有导电性纳米结构的电极”,还包括前面的“前端吸附有导电性纳米粒子的磁铁电极(Magele)”。在该情况下,为了将导电性纳米粒子固定在电极的前端,必须通过磁力吸附导电性纳米粒子,然而其特征在于,为了将电极以固定位置设置在细胞表面的适当位置,不使用磁铁电极的磁力,而是设置保持件、进一步的固定保持件的操纵器等,通过机械均匀压力来设置电极。
在使用磁铁电极(Magele)在前端吸附导电性纳米粒子而成为由“磁铁电极-导电性纳米粒子”构成的细胞内电位记录电极时,作为用于使导电性纳米粒子贯通细胞膜的方法,在上述本发明人等的PCT申请说明书中,公开了以下两种方法:
(1)通过与细胞上面接触的磁铁电极(Magele)吸引预先导入细胞内的导电性纳米粒子而贯通细胞膜的方法(图1左);以及
(2)使导电性纳米粒子预先吸附在磁铁电极(Magele)表面,使该磁铁电极表面的导电性纳米粒子与细胞的上面接触并被设置在细胞贴附容器的下方的铁板吸引而使导电性纳米粒子贯通细胞膜的方法(图1右)。
在本发明中,代替磁铁电极(Magele),也可以使用不具有磁力的导电体;此外,代替使导电性纳米粒子吸附在磁铁电极上,可以使用在其前端形成(或结合)有纳米突起结构的导电体。本发明的方法是即使是这样的不具有磁力的导电体、即使是在前端具有存在导电性的各种形状的纳米突起结构的导电体,也能够使前端部分贯通细胞膜并且也能够在调节了对细胞表面的压力的状态下设置在固定位置的方法,本发明提供了使用通过该方法得到的前端具有导电性纳米突起结构的电极作为细胞内记录电极,准确且简便地测定目标细胞的细胞内电位的方法。
具体而言,在本发明中,使用设置在上方的操纵器等,使前端具有导电性纳米结构的导电体的前端部分从细胞的上面贯通,在调节了对细胞的压力的状态下固定(图2)。在本发明中,可以通过操纵器等使充当电极的导电体主体上下移动,从而调整对细胞的压力,因此不需要用于将电极固定在细胞上的磁力。因此,充当本发明的细胞内记录电极的导电体只要由前端具有纳米突起结构的导电性材料形成即可,无需使用磁铁电极(Magele)。此外,前端的纳米突起结构优选牢固地固定在电极主体的导电体上,但也可以是吸附在电极与细胞贴附的面上的状态。另外,在作为导电体使用磁铁电极(Magele)并在其前端形成导电性材料的纳米结构的情况下(包括使导电性纳米粒子吸附的情况),也可以与操纵器一起利用与放置在细胞下方的铁板的磁力来调节对细胞的压力。
并且,在本发明中,通过将“前端具有导电性纳米结构的电极”的外侧用绝缘体完全包覆而完全与外液绝缘,则接地点只要在外液中就可以任意设置。通过将绝缘体的外侧用接地点包覆,可以作为单个电极使用(图3)。
进而,应用上述本发明人等开发的“电容型电位测定装置法”(日本特愿2018-87689),可以制造紧凑型(コンパクトな)带保持件的“电容型电位测定装置”(图3右),也可作为“接地夹(Clip on ground)”使用。
在此,“接地夹”是指使用附加了电容型电位测定装置功能的磁铁电极(C-M电极)进行记录,是指磁铁电极(C-M电极)中磁铁电极(Magele)的细胞接触面以外的部分被封口膜(パラフィルム)覆盖,正极与磁铁电极直接连接,负极从封口膜上连接,由此使强磁性体的磁铁电极作为电容型电位测定装置而起作用。另外,在本发明中,由于不需要具有磁性,所以也可以代替磁铁电极(Magele)而使用导电体作为电极。
此外,通过在利用保持件保持的导电板上设置多个电容型电位测定装置型电极,能够同时操作多个电极(图4)。
另外,尽管在(图4)中标记为磁铁电极(Magele)和磁性纳米粒子,但也可以是在无磁性的导电体的前端形成有导电性纳米结构的电极。(图4)还可以是连接了与固定用磁铁组合的磁铁电极(或导电体)而成的连接电极(連結電極)。
在使用MagEle电极的情况下,该Magnet(磁铁)在吸附导电性纳米粒子的作用的同时,在将培养细胞配置在磁性金属上的情况下,MagEle具有吸引下方的磁性铁板、使MagEle自立的作用(图4、图25)。
通过使用配置有环型磁铁的圆环(ドーナツ)型电极来代替磁性金属,可以在没有磁性铁板的情况下使MagEle固定自立。在该方法中,通过利用环状磁铁支撑MagEle,能够确保从环中心直接观察的路径,能够直接将光投射到存在于MagEle下方的受试培养细胞(图25右、图26)。
作为该圆环型电极的利用方法,例如可以考虑以下这样的利用方法。
(1)能够对视紫红质通道蛋白(Channelrhodopsin)表达细胞进行光刺激(图26左);
(2)通过使用导入了荧光试剂的受试细胞,可以同时进行与细胞内电位测定并行的细胞内钙动力学、膜电位的变化等(图26右)。
即,本发明包含以下发明。
[1]一种细胞内记录电极,所述细胞内记录电极是在前端具有纳米突起结构并且前端的纳米突起结构部分贯通目标细胞的细胞膜的导电体,所述导电体通过来自上方的机械均匀压力而设置在细胞上面的固定位置。
[2]如上述[1]所述的细胞内记录电极,所述导电体是具有导电性纳米粒子作为前端的纳米突起结构的磁铁电极(Magele),或者是前端形成有纳米突起结构的包含不具有磁性的导电性物质的导电体。
[3]如上述[1]或[2]所述的细胞内记录电极,所述导电体与保持所述导电体的保持件一体化。
[4]如上述[3]所述的细胞内记录电极,所述保持件固定在能够调节对细胞表面的加压程度的操纵器上。
[5]如上述[1]~[4]中任一项所述的细胞内记录电极,所述导电体主体的整个侧面被绝缘体覆盖,在导电体主体上连接有一个或多个正极,并且导电体与细胞外溶液接触的区域被绝缘体覆盖,在不与细胞外溶液接触的区域连接有负极,形成电位记录电路。
[6]一种细胞内记录电极,所述细胞内记录电极是在前端具有纳米突起结构并且前端的纳米突起结构部分贯通目标细胞的细胞膜的磁铁电极(Magele),通过来自上方的机械均匀压力或者与容器下方的磁铁或磁性金属的磁力而设置在细胞上面的固定位置,所述磁铁电极的整个侧面被绝缘体覆盖,所述磁铁电极上连接有多个正极,并且正极表面与细胞外溶液接触的区域被绝缘体材料覆盖,在不与细胞外溶液接触的区域的绝缘体表面上连接有负极,电极本身形成构成电容器的多电极的电容型电位测定装置。
[7]一种细胞内记录电极,所述细胞内记录电极在导电性玻璃电极和导电性电极之间形成构成电容器的多电极的电容型电位测定装置,所述导电性玻璃电极是在培养预先导入有导电性纳米粒子的目标细胞的导电性玻璃表面具有正极的导电性玻璃电极;所述导电性电极是在导电性玻璃的无导电性的玻璃下面与负极连接的多个由金属箔构成的导电性电极。
另外,导电性玻璃仅在上面实施导电性处理,因此下面没有导电性。
[8]如上述[7]所述的细胞内记录电极,其特征在于,通过使与正极连接的导电性玻璃对应于多个与负极连接的导电性电极中的每一个并阻断各个分区的导电性的连续性,各自形成电极对。
[9]如上述[6]~[8]中任一项所述的细胞内记录电极,其特征在于,作为导电性玻璃,使用利用pH 10以上的碱性溶液对玻璃表面进行清洗后再通过ddH
[10]使用如上述[1]~[9]中任一项所述的细胞内记录电极测定目标细胞的细胞内电位或其电位变化的方法。
[11]一种玻璃表面的处理方法,其特征在于,所述处理方法是用于促进细胞贴附在玻璃表面上的处理方法,所述处理方法利用pH 10以上的碱性溶液对玻璃表面进行清洗后再通过ddH
[12]如上述[11]所述的方法,所述玻璃是FTO或ITO的导电玻璃。
另外,可以使用钛等导电性金属代替导电玻璃。
[13]一种在测定目标细胞的细胞内电位的同时测定光刺激引起的细胞内电位的变化的方法,其特征在于,将表达光刺激反应性物质的目标细胞贴附在导电性玻璃表面上,在前端具有纳米突起结构的磁铁电极(Magele)的前端的纳米突起结构部分贯通所述目标细胞的上方的细胞膜的细胞内记录电极中,在贴附有细胞的盖玻片(カバーグラス)下面的中心部设置确保光投射路径的环型磁铁,从所述光投射路径对所述目标细胞进行光刺激。
[14]一种方法,其特征在于,将表达荧光物质的目标细胞贴附在盖玻片表面上,在前端具有纳米突起结构的磁铁电极(Magele)的前端的纳米突起结构部分贯通所述目标细胞的上方的细胞膜的细胞内记录电极中,在盖玻片下面的中心部设置确保荧光观察路径的环型磁铁,在测定所述目标细胞的细胞内电位的同时从荧光观察用路径观察受试细胞发出的荧光并测定细胞内钙动力学或膜电位的变化。
有益效果
在本发明中,即使为了使导电性纳米粒子贯通细胞膜以及为了使电极自立固定在细胞表面也不需要磁力,能够更简便地测定细胞内电位和电位变化。
此外,在本发明中,与以前开发的方法相同,具有能够尽可能地抑制对细胞的损伤以及能够在使细胞长期持续在正常状态下生存的同时观测细胞内电位的变动的优点。此外,可以包含测定装置在内而紧凑地设计,特别是通过使用电容型电位测定装置型电极,能够作为“接地夹”使用。此外,通过使用配置有环型磁铁的圆环型电极,可以在没有磁性铁板的情况下使MagEle固定自立,还可以利用中央的孔直接将光投射到受试细胞来进行光刺激、光信号的观察。
附图说明
[图1]是通过磁力将金涂覆磁性纳米粒子吸引至磁铁电极(Magele)的前端,形成具有用于贯通细胞膜的前端导电性纳米突起结构的电极的方法的概念图。
[图2]是使用操纵器使本发明的前端具有导电性纳米突起结构的电极贯通细胞膜并固定的方法的概念图。
[图3]是本发明的前端具有导电性纳米突起结构的电极的结构。
[图4]示出了使用采用本发明的前端具有纳米突起结构的电极的电位测定装置的例子。在磁铁电极的直径短的情况下,由于仅靠磁力难以自立,所以配置强力的“增强磁铁”,帮助薄磁铁电极的自立。在这种情况下,增强磁铁既可以用作接地,也可以起到保持件的作用。
[图5]参考:使用磁铁电极的细胞内记录电极的概念图。
[图6]参考:具有钕磁铁电极的Nav1.5/Kir2.1表达HEK培养细胞中的细胞内动作电位的测定(通过膜电位变化诱导动作电位)。
[图7]参考:通过贯通在导电性板电极上培养的CHO细胞的细胞膜的导电性纳米粒子测定CHO细胞的内源性外向电流(内在性外向き電流)(通过膜电位固定法)。
[图8]参考:用于根据电荷放大器(チャージアンプ)原理测定细胞内电位的准备实验。
[图9]参考:示出了通过根据电荷变化测定电压变化(电荷放大器)的原理来测定细胞内电位的概念图。
[图10]参考:从导入有金涂覆磁性纳米粒子电极的iPS细胞来源的心肌样细胞使用电荷放大器原理测定自发性动作电位。
[图11]参考:对于被胶原格子状涂覆的导电性玻璃表面的心肌样细胞,通过利用导电性板感应细胞内的离子浓度变化作为电荷变化并将其作为电压变化进行测定的方法来测定由钠离子通道开放剂诱发的动作电位。
[图12A]参考:使用磁铁电极使导电性纳米粒子不导入细胞内而贯通细胞膜,利用电荷放大器原理记录细胞内电位的方法的概念图(使用了盖玻片的情况)。
[图12B]参考:使用磁铁电极使导电性纳米粒子不导入细胞内而贯通细胞膜,利用电荷放大器原理记录细胞内电位的方法的概念图(使用了插入式细胞培养器(セルカルチャーインサート)的情况)。
[图13A]参考:对培养神经细胞(NG108-15细胞)进行5天神经分化诱导来进行实验。通过将M-C电极配置在接种在盖玻片上的细胞上来记录自发性动作电位。
[图13B]参考:对培养神经细胞(NG108-15细胞)进行2天神经分化诱导来进行实验。向细胞外液给予谷氨酸(最终外液浓度800μM),记录谷氨酸受体介导的响应。另外,去除了图上的基线和谷氨酸响应假象(artifact)。
[图14]是通过10mM谷氨酸将NG108-15细胞活化并通过膜片钳所测定的数据。
[图15]是通过10mM谷氨酸将分化的NG108-15细胞活化,将前端吸附有金磁性纳米粒子的磁铁电极(Magele)插入硅管中而绝缘,将在其外侧具有因铝箔而带来的接地功能的一体化电极通过操纵器从细胞上方按压来记录动作电位的例子。
[图16]是通过藜芦定(Veratridine)将分化的NG108-15细胞活化,通过与贯通细胞膜的金涂覆磁性纳米粒子在细胞表面接触的磁铁电极(Magele)所测定的数据,以及将其中一部分放大后的数据。
[图17]是通过K
[图18]对未分化的NG108-15细胞通过操纵器从细胞上方按压(加压)前端粘附(凝着)有钛纳米结构的磁铁电极(Magele),同时测定静息膜电位。通过解除加压,记录的膜电位消失(上图)。在没有细胞的状态下进行同样的实验,则电位完全不会发生变化(下图)。
[图19]是通过维甲酸(レチノイン酸)(RA)分化的SH-SY5Y细胞的动作电位的测定。
[图20]是使用MagEle的多电极的结构。
[图21A]是使用导电性玻璃电极的多电极的结构-1。
[图21B]是使用导电性玻璃电极的多电极的结构-2。
[图22]是使用3电极MagEle的来自NG108-15神经细胞株的细胞内电位记录。
[图23]是利用2电极MagEle的iPS来源的心肌细胞中的细胞内电位的测定。
[图24]是使用3电极的导电性玻璃电极的Nav1.5、Kir2.1表达HEK细胞株中的细胞内电位的测定。
[图25]是通过利用环状磁铁使MagEle电极自立而确保的光投射路径。
[图26]能够在使用通过环状磁铁而自立的MagEle电极进行细胞内电位测定的同时进行记录的光刺激引起的细胞的活化的测定(左图)以及利用倒置显微镜的荧光信号观察(右图)。
具体实施方式
1.本发明的“前端具有导电性纳米结构的电极”
(1-1)电极的材料
在本发明的“前端具有导电性纳米结构的电极”中,只要导电体和前端的纳米突起一体化而形成电极即可,可以将两者一体成型,也可以分别成型后再将两者接合在一起。另外,导电性纳米突起结构优选完全固定在导电体的前端以便于操作,但也可以是吸附在前端的状态。
作为电极的材料,可以使用磁铁电极(MagEle),但也可以使用不具有磁性的无细胞毒性的导电体(例如,除了不锈钢材料、钛、金等各种金属以外,还有导电性肽、蛋白质或各种导电性聚合物)。
在此,在提及“磁铁电极(MagEle)”时,是指涂覆有导电性材料(例如镍、铝等导电性金属)的磁铁,典型的磁铁电极为钕磁铁,其同时具有磁力和导电性。
钕磁铁是永磁铁中磁力最高的磁铁,但由于容易生锈,因此通常实施镀镍。市售的直径1mm圆柱钕磁铁(ネオマグ株式会社)也涂覆有Ni-Cu-Ni,因此同时具有强大的磁力和高导电性,可以用作磁铁电极(MagEle)。另外,在涂覆铝的情况下,也可以用作磁铁电极(MagEle)。
(1-2)电极的结构
本发明中所使用的细胞内电位测定用电极在其与细胞接触的前端部分具有“导电性纳米突起结构”,“导电性纳米突起结构”通过贯通细胞膜,可以作为能够记录细胞内电位的电极发挥作用。
此外,由于需要将磁铁电极(MagEle)等导电体的表面中与细胞的接触部分以外的部分与细胞外溶液完全阻断,因此在与细胞的接触部分以外的部分上,至少将与细胞外溶液接触的区域预先通过硅橡胶、硅管等施加绝缘套(絶縁コート)。
此外,在设置接地的情况下,用接地材料(银线、银板、铝箔等)将绝缘套(封口膜、涂油(マニキュア)、绝缘涂料等)表面包覆,在导电体上设置正极,在接地材料表面上设置负极。
此外,在具有“导电性纳米突起结构”的前端的相对侧具有保持件(保持器),根据需要垂直地安装在操纵器上。此时,通过在利用保持件保持的导电板上设置多个具有导电性纳米突起结构的导电体并分别与接地连接,能够同时操作多个电极。
本发明的电极可以使用应用电容型电位测定装置的“接地夹”来进行记录,但此时,充当电极主体的磁铁电极(C-M电极)等导电体的细胞接触面以外的部分完全用封口膜等绝缘套覆盖,正极与导电体(磁铁电极)直接连接,负极从封口膜上连接(图3)。在这种情况下,不需要接地。此外,各个电容型电位测定装置单独或组合地经由导电板而具有保持件,根据需要安装在操纵器上。
(1-3)应用Magele的连接复合(多个)电极
作为本发明的电极,在固定用磁铁的两侧安装磁铁电极(Magele),使固定用磁铁在固定磁铁电极(Magele)的同时兼具接地作用,通过将周围用封口膜等绝缘套覆盖,可以充当连接电极(图4)。当固定磁铁不用作接地时,也可以用作电容型电位测定装置型。
除此之外,作为连接电极,还可以同时使用多个具有纳米突起结构的电极。连接电极的优点在于,例如在培养(脑)神经细胞并且突起从细胞体延伸而形成神经回路的情况下,通过在多个位置设置Magele,可以测定神经回路如何相互作用。在通常的Magele中,磁铁电极具有将金磁性纳米粒子固定在电极上的作用以及利用磁力吸引位于下方的铁板而使磁铁电极自身自立的作用。通过磁铁电极的直径大小(通常6mm)决定被电极覆盖的充当记录目标的细胞数。为了减少待记录的细胞数、提高实验精度,需要减小电极直径。此时,由于电极上安装有与放大器连接的缆线(ケーブル),因此磁铁电极的直径变小则磁力就会减少,仅靠与铁板的磁力无法自立。因此,配置强力磁铁(增强磁铁),通过磁力吸附于其上,帮助薄磁铁电极的自立。此时,增强磁铁可以兼作接地。
增强磁铁可以使用圆环型、板型、S字型等各种形状的物质。在该增强磁铁的各个位置配置磁铁电极或能吸附在磁铁上的前端纳米结构电极,能够从多个位置进行电位记录,在分析神经回路时有效。现在,神经回路体外分析仅限于使用多电极的细胞外记录或使用荧光试剂的记录,因此这是能够从多个位置同时进行细胞内记录的首个机制。另外,多个电极即使不使用增强磁铁,也可以将多个电极在上部固定在期望的位置处,通过操纵器作用于待记录的细胞。这也可以应用于大鼠脑切片标本(例如在海马体中由CA1和齿状回(dentate gyrus)同时记录)等。
使用环状磁铁作为增强磁铁,通过使设置在环的孔开口部分正上方的棒状磁铁电极(MagEle)在没有磁性铁板的情况下固定自立,利用环状磁铁中央的孔将光直接投射到受试细胞,还可进行光刺激、光信号的观察。
(1-4)前端的纳米突起结构的材料和形状
此外,只要前端部分的材料具有导电性,就不需要具有磁性。
可以与导电性的电极主体一体成型,但也可以分别成型再使其连接或吸附。在分别成型的情况下,可以是同一材料也可以是不同材料。只要是具有导电性、细胞毒性低的导电性材料即可为任何材料,然而作为优选的导电性材料,除了不锈钢材料、钛等各种金属以外,还举出导电性肽、蛋白质、各种导电性聚合物等。
此外,不需要用这些导电性材料均匀成型,充当核的材料即使没有导电性,也可以使用表面被上述导电性材料涂覆的粒子等。作为适合涂覆的材料,例如,除了金、铂等导电性金属(Yamada等(2015)WIREs Nanomed Nanobiotechnol 2015,7:428-445,doi:10.1002/wnan.1322)之外,还举出导电性肽、蛋白质或各种导电性聚合物等,但并不限于这些。本发明的“导电性纳米突起结构”虽不需要具有磁性,但可商购并容易地获得约50nm的柠檬酸或PEG金涂覆磁性纳米粒子(nanoimmunotech公司制造,NITmagold Cit或PEG50nm)等各种金涂覆磁性纳米粒子。这些磁性纳米粒子可以用作本发明的“导电性纳米突起结构”。作为导电性聚合物、肽类,作为“具有磁铁矿纳米粒子磁性以及AC和DC导电性的聚(邻氨基苯甲酸)”,可以使用“Ramesan和Jayakrishnan(2017)Polymer/magnetite nanocompositeswith electrical and magnetic conductivity.Plastic Research On line 10.2417/spepro.006898”中列举的导电性聚合物类、肽类。此外,一直以来用于生物成像染色的量子点(Qdot)粒子(O.O.Otelaja,D.-H.Ha,T.Ly,H.Zhang和R.D.Robinson,“HighlyConductive Cu2-xS Nanoparticle Films through Room Temperature Processing,andan Order of Magnitude Enhancement of Conductivity via ElectrophoreticDeposition”,ACS Applied Materials and Interfaces 6,18911-18920(2014))等也可以作为“导电性纳米突起结构”使用。
作为纳米尺寸的突起结构的形状也可以是球形、椭圆形、针状、棒状等适当的形状。这些有时也被称为“导电性纳米突起结构”。由于需要穿透细胞膜,纳米尺寸的突起结构的最大长度需要比细胞膜厚度(约20nm)更长,但为了将对细胞的损伤限制在最小限度,最好不要太长。
即,通常优选地,最大长度(球形的情况下为直径)为25~100nm,优选为30~80nm,较优选为35~70nm,进一步优选为40~60nm的数值范围。
本发明的前端具有纳米突起结构的电极可以在ALS和肌肉萎缩症的临床检查等中作为直接接触生物体的组织、器官等的端子(“in vivo prep”)来工作。在这种情况下,由于需要使前端纳米突起结构到达充当目标的生物体的组织、器官等,因此优选将最大长度设为100nm或其以上。如果是在病变部位切除等手术中的目标组织、器官裸露的状态下进行的测定,则可以在上述通常的数值范围内使用。
(1-5)在电极的前端形成“导电性纳米突起结构”的方法
以下,将描述在电极的前端形成“导电性纳米突起结构”的典型方法,但不限于这些方法。例如,与先前使用磁铁电极(Magele)压在细胞表面上的方法相同,还包括在导电体前端吸附“导电性纳米突起结构”,通过操纵器等一边调节加压程度一边施加压力的方法。
(A)将金涂覆纳米粒子(Gold coated nanoparticles)固定在电极的前端的方法
在本发明中,由于磁性有无没有影响,所以在此以使用市售的柠檬酸稳定化磁性金纳米粒子(nanoimmunotech公司制造)的情况为例进行说明。
将金纳米粒子和L(+)-抗坏血酸以1:1混合后滴到导电体前端上,并在加热的同时进行蒸镀(蒸着)。在纳米突起结构为板状的情况下将其横向放置,为棒状时则插入管内,在温度调节为75℃的热板上保持15分钟,进行蒸镀。然后用纯水进行清洗。
(B)将纳米尺寸的导电性聚合物、肽类固定在导电电极的前端的方法作为导电性聚合物,以使用聚苯胺纳米纤维的情况为例进行说明。
通过对Chiou等的“the dilute in situ deposition method方法”(NatureNanotechnology 2,no.6(June 2007):354-57)进行部分修改并加以使用,可以将聚苯胺纳米纤维作为电极前端的“导电性纳米突起结构”而形成50nm至65nm的纳米结构。
具体而言,以使苯胺相对于APS(过氧二硫酸铵)为1.5倍的比率([苯胺]/[APS]=1.5)的方式混合并使之反应,使聚苯胺纳米纤维形成在钛板上。将所得到的表面上具有聚苯胺纳米纤维的钛板直接作为电极或与电极前端连接。也可以用导电性玻璃、金涂覆玻璃板等代替钛板。
(C)在导电体前端部分形成同一材料的纳米尺寸突起结构的方法以下对在导电体是钛的情况下在前端形成钛晶体的方法进行描述。
对Suzuki等的方法(Journal of the ceramic society of Japan 117(3):381-384(2009))进行部分修改并加以使用。
Suzuki等的方法是这样的喷雾-LbL方法:在实施了KOH处理的钛表面上,包括水洗在内,交替地将溶液A的钛(IV)双(乳酸铵)二氢氧化物溶液和溶液B的TiO
另一方面,本发明的目的在于形成具有凹凸的晶体的纳米结构,因此,将喷雾的循环停止于5次至10次,在涂装表面上产生纳米结构的凹凸。该凹凸具有与金磁性纳米粒子(GMNP)相同的功能。这种方法的优点是循环的次数会影响晶体的形状、大小,因此可以根据进行电位记录的细胞、组织的形状来改变纳米结构。
(1-6)用于促进细胞膜贯通的涂覆材料
作为代表性转染试剂的聚乙烯亚胺(PEI)在本发明的导电性纳米突起结构中也可以促进细胞膜的贯通过程。可以预先用PEI涂覆电极前端的导电性纳米突起结构,也可以在贯通细胞膜时使PEI存在于细胞表面。
只要是具有作为细胞中的转染试剂的效果的物质,就可以同样地使用。例如,Superfect(Qiagen公司)、具有与细胞膜相同的电特性(20%负电荷)的植物性脂质(大豆磷脂)、或者以1:4混合的1,2-二油酰磷脂酰-甘油(负电荷DOPG,Avanti)和1,2-二油酰-sn-甘油-3-磷酸胆碱(中性DOPC,Avanti)等脂质类也具有同样的作用。
2.将本发明的电极的前端部分固定在所贯通的细胞表面的方法
本发明的电极前端的纳米突起结构部分需要贯通细胞膜并在这样的状态下固定在细胞表面。此时,由于无需通过磁力来固定电极,所以细胞下方不需要铁板和磁性板。
在本发明中,从细胞的上面按压电极前端的导电性纳米突起结构部分而贯通细胞膜,在调节了对细胞的压力的状态下固定。优选在细胞接触面的相对侧设置使得容易调节对细胞的压力的保持件等固定装置(图3)。
此时,由于需要以贯通细胞的细胞膜并且不压碎细胞本身的方式进行加压,因此为了进行手动操作需要格外小心。此时可以在施加的压力为1kg以下且250g以上左右的压力下得到细胞内记录。压力越大,电极面和细胞的密合度越高,对细胞内电位的记录越有利;然而,在iPS来源的心肌等的情况下,存在将细胞压碎、纳米突起贯通细胞自身的危险。为了避免这样的危险,优选在电极的上方设置操纵器等,一边调节加压的程度一边操作通过与电极之间的弹簧结构而安装的操纵器。
此外,在磁性纳米粒子等具有磁性的导电性纳米突起结构连接或吸附在磁铁电极(Magele)等磁性体的前端的情况下,也可以利用与置于细胞下方的铁板等金属板之间的磁力进行固定。
具体而言,在细胞的培养容器下设置铁板等磁铁吸引性金属板,与细胞上方接触的磁铁电极被培养容器下方的铁板吸引,由此固定在细胞上,同时电极前端部的纳米突起结构贯通细胞膜,使细胞内记录成为可能。
此外,通过使用上述(1-5)中所述的PEI等用于促进细胞膜贯通的物质来预先涂覆电极前端的纳米结构突起部分,或者通过使PEI等预先存在于与前端接触的细胞表面,促进细胞膜的贯通工序。
3.使用本发明的电极的细胞内电位的测定目标
在使用本发明的电极的测定方法中,可以通过从细胞的上面按压前端的导电性纳米突起结构部分来进行测定。因此,测定目标范围广泛,除了单细胞或其集合体的集落以外,还可以与生物体来源的组织、生物体的皮肤、肌肉、其它器官的一部分直接接触来直接测定细胞内电位或电位变化。
以下对培养细胞、生物体来源的细胞等从生物体分离的状态的细胞(包括细胞群)和构成生物体的组织、器官中的细胞、组织的情况进行描述。
(3-1)培养细胞和生物体来源的细胞
作为充当本发明的测定目标的细胞,可以是通过活检采集的细胞等生物体来源的细胞,也可以是培养的细胞。尽管主要以人等哺乳动物细胞为目标,但除了鸟类、鱼类、昆虫细胞以外,还可以是酵母等真核微生物和大肠杆菌等原核微生物。
特别优选从人iPS细胞等人干细胞分化诱导的心肌细胞、神经细胞、血管上皮细胞、肝细胞等或它们的细胞群。
此外,对于在作为转化宿主的普通的HEK、CHO细胞等哺乳动物细胞中导入了各种离子通道基因和各种转运蛋白基因等的转化培养细胞,由于可以作为从各种离子通道和转运蛋白摄取的药剂的毒性试验中的评价体系使用,因此是本发明中优选的目标细胞。
本发明的测定目标细胞虽然可以是单个细胞,但也可以将细胞培养后增殖或培养中形成的细胞集团(细胞群)作为目标。
在本发明中,由于不需要使用磁力,因此不需要用细胞覆盖整个测定容器底面。在电极与目标细胞的接触面以外的区域,通过利用包覆电极表面的绝缘体来与细胞外液阻断,也可以测定单细胞中的细胞内电位。另一方面,在对细胞群进行观察的情况下,需要在通过绝缘体而与细胞外液阻断的位置处进行接种。
在本发明中,当提及“细胞群”时,包括在贴壁培养(接着培養)用的培养皿(板、孔)表面形成的片状细胞的情况,同时也包括由来自iPS细胞等干细胞的心肌细胞、神经细胞等形成的细胞团的情况。
此外,作为本发明的目标细胞,也包括近年来作为模型细胞已被广泛使用的含有巨大脂质体的人工细胞(Moscho等(1996)P.N.A.S.93:11443-11447;Schlesinger Saito(2006),Cell Death and Differentiation 13,1403-1408;Aimon等(2011)PLoS ONE 6(10):e25529.doi:10.1371/journal.pone.0025529等)。
例如,可以使用通过如下方法等制备的人工细胞:将从表达离子通道的细胞分离的包含离子通道的细胞膜片与巨大脂质体融合的方法;以及将摄取有在大肠杆菌等中表达的重组离子通道蛋白的小脂质体与巨大脂质体融合的方法。
(3-2)对药物发现筛选有用的模型细胞
本发明在使用模型心肌细胞或神经细胞等的药物发现筛选中特别有用。
在药物发现筛选时,通过使用上述模型心肌细胞和模型神经细胞,由于能够迅速且准确地进行对受检物质对细胞功能的影响、电刺激引起的收缩活性、电生理学特性变化的分析等,因此能够迅速地评价受检物质的细胞毒性和药效,对于受检物质的评价是有效的。
作为心肌细胞模型,优选使用由人iPS细胞等干细胞分化诱导的心肌细胞或者将SCN5A(Nav1.5)、CACNα1C(Cav1.2)、KCNH2(hERG)、KCNQ1/KCNE1(LQT1)、KCNJ2(Kir2.1)基因等导入培养动物细胞(HEK293、BHK或CHO细胞)并在细胞膜上表达上述离子通道的细胞等。作为这样的细胞,例如可以使用WO2014/192312中记载的心肌模型细胞。
此外,也可以使用由iPS细胞等干细胞分化诱导的培养心肌细胞试样(WO2014/098182)来代替转化细胞。心肌样iPS细胞(iCell心肌细胞)也可以通过CDI公司等商购。
作为心肌细胞模型,通过使用哺乳动物细胞来源的形成心房或心室的心肌切片,还能够对引起心房颤动(心房細動)、心律不齐(不整脈)的原因进行调查。此外,可以使用从病变组织通过活检摘出的组织片等。
作为神经细胞模型,可以使用将光受体通道(光受容体チャネル)基因导入PC12细胞和大脑皮质细胞或者由iPS细胞等分化诱导的神经细胞中的光受体通道表达细胞,通过观察添加受检物质后对光刺激的电位响应,可以对神经细胞进行细胞毒性和药效评价。作为光敏感性模型神经细胞,也可以使用表达通道视蛋白2(チャネルオプシン2)的大脑皮质神经细胞(日本特开2006-217866号公报)等。
(3-3)构成生物体的组织、器官中的细胞
本发明的电极可以作为与生物体的组织、器官等直接接触的端子(“in vivoprep”)而发挥作用。特别是在皮肤的上皮细胞、肌肉组织等比较接近生物体表面的细胞、组织的测定中有用。主要可以作为针肌电图检查的替代试验方法来使用。
此外,也可以适用于来自活组织检查(活检)样品的组织的细胞。
例如,在临床试验中,优选适用于以下情况。
1.对于以重症肌无力症为代表的神经肌肉接头的疾病,连续刺激试验、单肌纤维肌电图;
2.在神经源性肌肉萎缩中,对反映任意收缩时运动单位脱落和随后的残余运动单位的代偿性扩大的运动单位动作电位放电频率的减少以及伴随而来的电位本身的增高和持续时间的延长的确认;
3.在损害前角细胞的运动神经元疾病中,静止时有无自发性放电;
4.在肌源性肌肉萎缩(即肌病)中,如果确认到运动单位动作电位的降低和持续时间的缩短,则可以怀疑肌纤维自身的萎缩和变性。
本发明在进行这样的疾病的原因调查时,通过将患者的肌肉的动作电位作为细胞内电位变化进行记录,具有适用于对疾病如何对构成动作电位的离子通道的表达、功能产生影响等进行诊断的临床基础试验中的精度(参考:筋肉の病気(東京都立神経病院松原四郎http://www.jsnp.jp/pdf/cerebral_19.pdf))。
这样,如肌肉组织那样,由于接近皮肤表面,因此能够将本发明的电极作为端子(“in vivo prep”)来对肌肉组织进行直接检查,从而能够应用于ALS、肌肉萎缩症的临床检查等中。
此外,通过直接测定手术中的心脏的表面的电位变化,可以鉴定因心肌梗塞中的梗塞而坏死的组织范围和引起功能不全的范围。此外,存在能够对疾病的进展以何种形式影响动作电位的形状、传递等进行现场检查的可能性。
4.使用本发明的电极的细胞内电位的测定方法及用于该测定方法的测定装置
在使用本发明的电极的测定方法中,在将前端的导电性纳米突起结构部分从细胞的上面按压而贯通细胞膜之后,与以往用于细胞内电位测定的常规测定装置连接,测定细胞内电位和电位变化。
(4-1)细胞内电位测定用容器
在本发明中,在使用培养细胞作为细胞内电位测定目标时,由于不需要磁力,因此测定用容器底面不需要是导电性板,可以直接使用用于培养的培养容器,但优选从用于培养的培养容器移植到更容易进行测定的其它细胞内电位测定用容器中。
此时,用生理盐水多次清洗培养液,替换成生理盐水。
(4-2)用于测定细胞内电位的装置:通常模式的情况-1
在本发明中,对于细胞内的自发电位、电流和诱发电位、电流,通过贯通细胞膜的导电性纳米粒子反映细胞内电位的导电性板电极或磁铁电极感应与设置在细胞外液内的接地电极之间流动的电流,并在细胞外进行记录。由于此时产生的电流、电位极其微弱,因此为了在细胞外进行细胞内电位的记录,需要具备电流、电压等的放大器(放大用的放大器(増幅アンプ))的装置。
作为这样的装置,可以使用以往用于测定细胞或细胞群的细胞内电位或细胞外电位的装置中的任一种。
具体而言,如果是膜片钳放大器细胞内记录用放大器,则可以使用输入电阻为最低10
此外,如果是MEA系统,只要是能够测定直流信号而不是交流信号的装置,就可以使用。
(4-3)膜电流的测定方法及用于该测定方法的装置:通常模式的情况-2
为了测定膜电流(流过存在于细胞膜中的离子通道的电流)而使用膜片钳放大器,但在使用多个人工脂质双层膜的实验中,由于总膜容量变大,与(4-2)的情况不同,使用Axopatch-1D膜片钳放大器(Axon Instruments)。然后,在记录细胞膜电位的情况下使用电压钳模式,而不使用电流钳模式。
通常的膜片钳放大器Axopatch 200A(电压钳)特别适用于控制通常的单个细胞的膜电位的实验的情况。在用于大量细胞的情况下,由于细胞膜-脂质双层膜的合计面积大,因此需要控制大量膜电位,因此,使用可以使用人工脂质双层膜实验测定用的CV-4前级探头(Head stage)的Axopatch-1D。人工脂质双层膜实验测定用的前级探头由于能够流过大电流,因此具有能够对大量细胞的脂质双层膜进行快速充电这样的优点。另外,也可以使用双层钳放大器(Bilayer Clamp Amplifier)(BC-535)(Warner Instruments)等代替Axopatch-1D膜片钳放大器。
(4-4)“电容型电位测定装置”的使用:高灵敏度模式的情况
作为本发明的电极,在使用“电容型电位测定装置”(电容器形成)的情况下,具体而言,将具有前端的导电性纳米突起结构的电极的细胞接触面以外的部分完全用封口膜覆盖,正极与电极直接连接,负极从封口膜上连接而使用。由于该负极发挥通常的接地(グランド)的作用,所以在本发明中也称为“接地夹”(图3)。
在本发明中,“电容型电位测定装置”是指将细胞内产生的动作电位等的细胞内电位的变化捕捉为将离子浓度的变化作为离子电荷合计的变化。通过应用电荷放大器原理将该电荷的变化转换为电压信号(细胞内膜电位)来进行测定,不需要在测定电路内设置接地(此时,使用具有非常高阻抗和皮法(ピコファラッド)级电容的电容器。由于高阻抗电容器作为电荷-电压转换器(电荷放大器)起作用,因此将在耦合到导电性纳米粒子电极的电容器的一端发生的电位变化(荷电离子对于细胞的进出)检测为电压)。
该装置的特征是在电容器的两端连接放大器的正极和负极而直接测定电位变化,由于装置内的负极作为测定电路的接地而工作,因此不会成为开路(open circuit),可以进行稳定测定。
此外,在本发明中,在提及“利用电荷放大器原理的方法”时,是指“通过与贯通细胞膜的电极前端的导电性纳米突起结构接触的导电性板等导电体将通过细胞膜的阳离子、阴离子的出入引起的细胞内离子浓度的变化作为电荷的变化而感应,并将其作为电压变化进行测定的方法”。
另外,作为导电性板可以使用导电玻璃或钛板;作为负电极可以使用铝箔、银板、铂板等。
本发明的测定方法与现有的细胞内或细胞外电位测定方法大不相同,不是直接测定放大器的正极(细胞内)、放置在细胞外液中的负极之间发生的电位变化,而是将接种细胞的电容器(导电性板)作为传感器进行电荷-电压转换,作为细胞内电位变化记录,因此不需要在细胞外液中设定接地。作为传感器的导电性板能够通过贯通细胞膜的导电性纳米粒子感应细胞内的电荷(charge)变化即可,所以导电性板也可以在没有被细胞覆盖的部分直接接触细胞外溶液。因此,特别适合于不能形成片状的培养神经细胞等单细胞中的细胞内电位的测定。
为了进行用于控制目标细胞内的细胞内电位的电刺激,需要设置与电容型电位测定装置不同的具有接地的电刺激电路,或者使视紫红质通道蛋白等表达,从而进行刺激。
对于本发明的电容型电位测定装置型的典型电极,如(图2右图)所示,将除了与细胞接触的前端部分以外的外侧用绝缘体完全包覆,并且是具备支撑部(保持件)的结构,正极与电极主体直接连接,负极从封口膜上连接。
(4-5)基于“in vivo prep”的生物体的组织或器官中的细胞的细胞内电位测定方法
用于生物体的组织或器官中的细胞的细胞内电位测定的“in vivo prep”是应用了借助导电性纳米粒子的细胞内电位记录装置的装置,具体而言,将本发明的(图3右图)所示的导电体中除了与细胞接触的前端部的端子以外的外侧用封口膜等绝缘体完全包覆,通过在其外侧覆盖有接地电极的单一电极(模式1)以及利用由夹持电极记录部分和绝缘体的第二导电体形成的电容器作为电容型电位测定装置的能够记录细胞内电位的(模式2)进行记录。
如模式1和模式2共同在(图4)中所示的,可以将多个电极作为电位测定装置与多个放大器连接,可以同时进行多个细胞内电位的记录。
原则上,使“in vivo prep”与构成生物体的组织、器官中的细胞或来自活组织检查(活检)样本的细胞直接接触来测定细胞内电位。如果是皮肤的上皮细胞、肌肉组织等比较接近生物体表面的组织,则通过将前端部分的导电性纳米突起的长度调节为100nm以上等,可以穿透上皮细胞、筋膜等来进行测定。
此外,如果是手术中的经开胸的心脏等,则可以直接测定心脏表面的细胞内的电位变化。
(4-6)通过环状磁铁自立固定的MagEle电极的利用方法
使用MagEle电极测定细胞内电位时,Magnet(磁铁)在发挥吸附贯通培养细胞细胞膜的导电性纳米粒子的作用的同时,还具有吸引设置在培养细胞的下方的磁性金属(磁性铁板)、使MagEle自立的作用。
通过配置环型磁铁来代替磁性金属,同样可以使MagEle自立固定,并且可以确保从环型磁铁的中心直接观察存在于MagEle下方的受试培养细胞的路径,可以直接将光投射到细胞。
利用这一点,例如可以预先在受试细胞中表达视紫红质通道蛋白,对细胞进行光刺激来记录细胞内电位变化。此外,通过向受试细胞中导入荧光试剂,可以与使用MagEle电极的电测定平行地进行细胞内钙动力学、膜电位的变化等。
另外,在能够在可以确保光照射路径的台子上设置培养容器的情况下,即使不在容器下方设置环状磁铁,也可以使用上述HandyNano技术、通过使用操纵器等固定电极、与上述HandyNano组合、通过使用操纵器等固定电极,能够进行光刺激或荧光观察。
实施例
以下示出实施例具体说明本发明,但本发明并不限定于这些实施例。
本发明中的其它术语和概念基于本领域中惯常使用的术语的含义;特别是除了明示其出处的技术以外,就用于实施本发明而使用的各种技术而言,只要是本领域技术人员,就能够基于公知文献等容易且可靠地实施。此外,各种分析等应用所使用的分析仪器或试剂、试剂盒的使用说明书、商品目录等中记载的方法进行。
另外,将本说明书中引用的技术文献、专利公报以及专利申请说明书中的记载内容作为本发明的记载内容来参照。
(参考例1)稳定表达Nav1.5/Kir2.1的HEK细胞中细胞内电位的测定
该实验中示出了可以使用自发产生动作电位的稳定表达Nav1.5/Kir2.1的HEK细胞通过贯通细胞膜的导电性纳米粒子进行细胞内电位的测定。
(参1-1)Nav1.5/Kir2.1的稳定表达HEK细胞的制作
使用载体将Nav1.5/Kir2.1基因转化HEK细胞(JCRB细胞库),制作稳定表达Nav1.5/Kir2.1的HEK细胞。
具体而言,首先从人Na+通道(Nav1.5)的α亚基(SCNA5,BC140813:SourceBioscience公司)切出Nav1.5基因,插入pcDNA3.1(-)潮霉素(hygromycin)(Invitrogen)中。
BC140813是胚胎型Nav1.5基因,因此使用人心脏cDNA(Zymogen)通过PCR法等替换成在人成人心肌中表达的Nav1.5基因。
对于Kir2.1(NM_000891,KCNJ2)基因(1284bp),在从iPS细胞来源的心肌细胞(CDI,Cellular Dynamics International)中提取的总RNA中,利用下述引物应用了巢式PCR法。
Kir2.1 1st正义:CCAAAGCAGAAGCACTGGAG(序列编号1)
Kir2.1 1st A/S:CTTTGAAACCATTGTGCTTGCC(序列编号2)
在使用上述引物的第一轮PCR中不能确认PCR产物,因此稀释100倍再进行PCR,取得Kir2.1基因。
Kir2.1 ICR HindIII正义:CACTATAGGGAAGCTACC atgggcagtgtgcgaaccaac(序列编号3)
Kir2.1 ICR HindIII A/S:ATAGAATAGGAAGCT tcatatctccgactctcgccg(序列编号4)
将得到的Kir2.1 PCR产物插入pD608(灭瘟素,DNA2.0)的HindIII位点中。
将Kir2.1基因(Kir2.1 2μg/mL灭瘟素)与上述Nav1.5基因(50μg/mL潮霉素)一起导入HEK293细胞(培养液,DMEM,Sigma-Aldrich,10%FBS),制作Nav1.5/Kir2.1的稳定表达细胞株。
(参1-2)将金涂覆磁性纳米粒子导入细胞内
针对(参1-1)中制作的“Nav1.5/Kir2.1的稳定表达HEK细胞”,使用聚乙烯亚胺(PEI,P3143 Sigma-Aldrich),根据以下URL按照改良的方案进行金涂覆磁性纳米粒子的导入。
(https://labs.fccc.edu/yen/docs/PEI%20preparation.pdf)
具体而言,预先使用0.2μm过滤器(Minisart,Sartorius stedim)调整10mg/mLPEI溶液(pH7)后,在-80℃下储存,仅将使用的部份在即将使用前用ddH
然后,用含有不含血清的DMEM(Sigma-Aldrich公司制造)或者OptiMEM I(Invitrogen公司制造)的缓冲液(PBS)洗涤(参1-1)中制作的培养的Nav1.5/Kir2.1的稳定表达HEK细胞,与上述金涂覆磁性纳米粒子溶液置换,在37℃培养箱中孵育15分钟。
将得到的导入金涂覆磁性纳米粒子的“Nav1.5/Kir2.1的稳定表达HEK细胞”在通常的培养皿中培养(DMEM,Sigma-Aldrich,10%FBS)。
(参1-3)用上方的磁铁电极(MagEle)吸引细胞内的导电性纳米粒子而贯通细胞膜的方法
该实验中示出了可以将涂覆有Ni-Cu-Ni的直径1mm圆柱钕磁铁(ネオマグ株式会社)作为钕磁铁电极(MagEle)使用,构建细胞内记录电极。
使用(参1-2)中制作的导入金涂覆磁性纳米粒子的“Nav1.5/Kir2.1的稳定表达HEK细胞”,通过配置在细胞上方的钕磁铁电极(MagEle)将细胞内的金涂覆磁性纳米粒子吸引至磁铁电极,贯通细胞膜,构建细胞内记录电极(图5)。通过所得到的细胞内记录电极记录“Nav1.5/Kir2.1的稳定表达HEK细胞”的细胞内电位变化(图6)。
(参1-4)使吸附在磁铁电极上的导电性纳米粒子贯通细胞膜的方法
该实验中示出了即使没有预先将导电性纳米粒子导入细胞内,通过利用磁铁电极的磁力,也能够从细胞的外表面将其贯通并能够构建细胞内记录电极。
将与PEI混合的金涂覆磁性纳米粒子(nanoimmunotech公司制造,NITmagold Cit)添加到侧面包覆有绝缘体的磁铁电极表面上,并在约30分钟内将该纳米粒子吸附到磁铁电极上。
在设置于铁板上的培养皿内,从Nav1.5/Kir2.1 HEK细胞和培养心肌样细胞(iCell心肌细胞)的上方使上述磁铁电极在导电性纳米粒子的吸附面向下的状态下直接接触。磁铁电极被培养皿下方的铁板吸引而固定在细胞上方,观察到导电性纳米粒子经由PEI贯通细胞膜,并且由于来自磁铁的磁力而留在细胞膜内(图7)。
进而,在任何细胞中,都可以利用得到的细胞内记录电极,与(参1-3)的情况同样地记录细胞内电位变化。
即,确认了即使没有预先将导电性纳米粒子导入细胞内的工序,通过使导电性纳米粒子和PEI的混合物吸附于磁铁电极并压在细胞上的工序,也可以通过侵入性非常小的方法构建细胞内记录电极并可以记录细胞内电位变化。
(参考例2)应用电荷放大器原理进行测定的方法
(参2-1)用于电荷放大器原理应用的准备实验
该实验是为了表明以下内容的实验:在进行生物电位的测定时,通过将电荷放大器与导入细胞内的纳米粒子组合,该测定系统有效(图12)。
电路A是在用于记录的电流钳模式(Current-clamp mode)的膜片钳放大器Axopatch 200A中将模型细胞(细胞等效电路:500MΩ电阻和33pF电容器)并联连接的电路中施加矩形电流脉冲(20ms,120pA),测定通过该等效电路的电位变化(图8电路A)。
接着,在等效电路和放大器的负输入之间连接充当电荷放大器的传感器的导电玻璃。为了使该导电玻璃作为电容器起作用,在未施用导电涂覆的玻璃下方配置铝箔(图8电路B)。
计算电路A与电路B之间的差并评价导电玻璃-铝箔电容器插入对电压输出的影响。从分别进行的同样的实验可知,发现对波形振幅有3.3%、5.7%减少这样的误差,但除此之外,发现波形本身不受滤波效应等影响。
由此判断出,导电玻璃-铝箔电容器作为电荷放大器的传感器是有效的,可以应用于在导电玻璃上培养的细胞的电活动(细胞内外的荷电离子的运动)的测定。
图12的电路C示出了使用实际细胞时的配置电路。作为样品,使用与上述(参考例1)中使用的相同的细胞(Nav1.5/Kir2.1 HEK细胞),使用电荷放大器测定细胞的自发性动作电位,并确认了可以应用电荷放大器原理利用细胞外记录装置测定细胞内膜电位(图8电路C)。
(参2-2)使用电荷放大器的心肌样细胞
该实验中示出了使用心肌样细胞,可以通过导电性纳米粒子将由细胞内的动作电位等引起的细胞内膜电位的变化捕捉为电荷的变化,将该电荷信号变化(与动作电位产生相伴的荷电离子(Na
具体而言,将心肌样细胞(iCell心肌细胞:CDI公司)接种在导电玻璃(厚度2mm)上,作为培养液使用“iCell Cardiomyocytes Maintenance Medium”进行培养。通过以下方法,使用链球菌溶血素O(SLO,和光纯药)将金涂覆磁性纳米粒子导入心肌样细胞内。
即,用PBS8-(-)清洗一次,用纳米粒子-SLO混合物(20μL PEG-金涂覆磁性纳米粒子,5μL 5×HBPS,1μL(1U)活性化的SLO)进行置换,在培养器(37℃)中保持15分钟。接着,将溶液置换成iCell Cardiomyocytes Maintenance Medium(由血清引起SLO失活),在第二天以后进行实验。
与上述(参2-1)的电路C一样,将导入有金涂覆磁性纳米粒子的心肌样细胞覆盖的导电玻璃上面连接到放大器的输入端,并且将配置在玻璃下面的铝箔连接到接地。通过具有导电性的玻璃的上面和下面的铝箔形成电容器,测定在上面培养的细胞的电活动(细胞内外的荷电离子的运动)(图14)。
以这样的方式,可以证明可以利用电荷放大器原理通过导电性纳米粒子测定细胞的自发性动作电位。
(参考例3)贴附力弱的细胞的电荷放大器模式(CHargeAmpLifier(CHAMPL)模式)记录
该实验示出了可以将心肌细胞和HEK细胞等贴附力弱的细胞有效地贴附在导电玻璃表面,通过从细胞下方用磁铁吸引预先导入细胞内的导电性纳米粒子使其贯通细胞膜,可以测定细胞内的自发性动作电位。
(参3-1)对导电玻璃表面的贴附力弱的细胞的制备
虽然CHO细胞等通常的动物细胞有效地贴附在导电玻璃表面,但也有心肌细胞和HEK细胞等细胞是对导电玻璃表面的贴附效率显著低的细胞。在将这样的细胞直接接种于导电玻璃表面的情况下,将细胞培养至覆盖形成培养容器底面的导电玻璃的整个表面是极其困难的。
因此,预先在导电玻璃表面上格子状地涂布胶原(Collagen),从其上进行细胞的接种,培养至覆盖整面。在没有胶原涂膜的部位,贯通细胞膜的导电性纳米粒子能够与导电性玻璃直接接触。
胶原导电性低,但由于细胞贴附性和对导电玻璃的贴附性都高,因此可以提高胶原涂膜部位的细胞贴附率。作为这样的物质,还有纤连蛋白、聚-L-赖氨酸等,可以代替胶原使用。
在该实验中,使用典型的心肌样细胞(iCell心肌细胞2)作为对导电玻璃表面的贴附效率低的细胞,在预先格子状地涂布胶原(Collagen)的导电玻璃表面上培养后,导入金涂覆磁性纳米粒子,通过磁场使其贯通细胞膜后,针对藜芦定那样的钠通道开放剂的作用而诱发记录了动作电位。本实验在室温下进行。
具体而言,首先将调整成凝胶状的胶原(去端胶原(アテロコラーゲン),(株)高研)在导电玻璃表面中心部的直径约5mm的圆内以线状进行涂布后,使用尖端熔化的微电极拉伸成格子状,形成约0.5μm间隔的格子状胶原涂膜。
接着,在该导电性玻璃表面接种心肌样细胞(iCell心肌细胞2),在心肌样细胞专用培养基(iCell Cardiomyocytes Maintenance Medium)中培养约6天,形成心肌细胞片(心筋細胞シート)。
接着,使用SLO导入金涂覆磁性纳米粒子,在导电性玻璃下部磁铁的磁场作用下,该纳米粒子贯通细胞膜,成为导电性玻璃电极,将覆盖细胞的培养液置换成生理盐水,2天后使用电荷放大器模式(CHargeAmpLifier(CHAMPL)模式)在室温下进行细胞的动作电位的记录(图10)。
然而,由于该样本中无法观察到自发性动作电位(数据未示出),因此在生理盐水内将作为钠通道开放剂工作的藜芦定(Sigma-Aldrich)以最终浓度100μM的方式给予,以诱发记录动作电位。在给予藜芦定40秒后观察到缓慢的去极化(脱分極),接着记录了自发性动作电位(图11)。
(参考例4)培养神经细胞中细胞内电位的测定
该实验中示出了就根据(参考例1)的方法在细胞膜中贯通有金涂覆磁性纳米粒子的培养神经细胞而言,通过使用附加了电容型电位测定功能的磁铁电极的测定方法可以测定细胞内电位。
(参4-1)培养神经细胞的制备
作为培养神经细胞,使用NG108-15细胞(成神经细胞瘤-神经胶质瘤杂交细胞),用包含DMEM(Sigma-Aldrich)、HAT补充剂(Thermofisher)和10%FBS(Biowest)的培养液进行培养。在包被有0.1%聚乙烯亚胺(pH 8.4,150mM四硼酸钠(Wako))的盖玻片上接种NG108-15,培养液是将上述培养液的FBS设为5%,向其中添加500μM布洛芬(Ibuprofen,Wako),由此进行神经诱导。神经诱导5天后进行以下实验。
(参4-2)基于磁铁电极法的金涂覆磁性纳米粒子的细胞膜贯通
将PEI-PEG-金涂覆磁性纳米粒子混合并放置3小时。将该混合液移至钕磁铁的细胞贴附面上,再放置15分钟,通过磁性将金纳米粒子结合到钕磁铁电极上。
把这个电极放置于设置在铁板上的培养细胞上。由于细胞下方的铁板和磁铁电极通过磁力互相吸引,所以磁铁电极在细胞上自立固定,磁铁电极表面的金纳米粒子在PEI作用下以一端暴露于细胞内的方式贯通。
磁铁电极使用磁力220毫特斯拉、直径6mm的钕磁铁。将除细胞接触面以外被封口膜覆盖的磁铁电极连接到正极,负极是由从封口膜上吸附的强磁性体构成的作为电容型电位测定装置起作用的磁铁电极(MagEle)。此时,强磁性体和磁铁电极之间的封口膜加厚,确认完全绝缘(图12A)。
在此,使用附加了电容型电位测定装置功能的磁铁电极(C-M电极)进行记录。
(参4-3)使用聚碳酸酯插入式细胞培养器制备细胞
在此,除了代替(参4-1)中使用的盖玻片而在聚碳酸酯插入式细胞培养器(孔径0.4μm,Thermo Scientific)内对培养神经细胞(NG108-15细胞)进行接种、培养之外,通过与(3-1)和(3-2)相同的方法制备并接着使导电性纳米粒子(金纳米粒子)贯通细胞膜(图12B)。
使用插入式细胞培养器的优点在于,由于在孔径为0.4μm(Thermo Scientific)的聚碳酸酯透过膜上培养细胞,因此即使细胞的上表面被磁铁覆盖,也可以从插入物下方的间隙用不同的溶液进行置换。这也可以用于观察药物的作用,给予激动剂,进行配体门控通道活性的测定。
(参4-4)培养神经细胞的细胞内电位的记录
对NG108-15细胞进行5天神经分化诱导后,将培养液置换成细胞外液(生理盐水),进行动作电位记录的实验。通过将C-M电极配置于接种在盖玻片上的细胞上来记录自发性动作电位。该方法强烈依赖于细胞的自发性活性,因此神经分化程度对实验的成功有很大影响(图13A)。
除了自发性动作电位之外,为了确认是否能够记录由作为神经递质的谷氨酸引起的神经活性而进行以下实验。对NG108-15细胞进行2天神经分化诱导来进行实验。与上述实验一样,将C-M电极配置在细胞上,进行实验记录。向细胞外液给予谷氨酸(最终外液浓度800μM),记录谷氨酸受体介导的响应。通过谷氨酸激活了内源性谷氨酸受体,并将其记录为膜电位的去极化(向上变化(上向きの変化))响应。由谷氨酸诱发的膜电位变化由于脱敏作用而慢慢衰减,约90秒后回到基线。去除了图上的基线和谷氨酸响应假象(图13B)。
由于能够记录持续数秒的缓慢的膜电位的变化,因此也能够用该方法记录由神经递质活化的离子通道引起的膜电位变化、G蛋白介导的离子通道的活性等。
(实施例1)NG108-15分化细胞的细胞内电位的测定
(1-1)NG108-15分化细胞的制备
如下制备该实验中使用的NG108-15分化细胞。
本实验中使用的分化的NG108-15细胞(名古屋大学,由古家先生分发:FURUYA等,(1983)Developmental Time Courses of Na and Ca Spikes in Neuroblastoma xGlioma Hybrid Cells.Developmental Brain Research,11 229-234)在大多数细胞中不显示自发的动作电位,但是可以通过电刺激诱导动作电位。进一步进行兴奋性神经递质谷氨酸(10mM)给予时,可以连续诱导动作电位。
根据古家等的方法进行NG108-15细胞的培养。
具体而言,将在含有10%FBS(Biowest)的DMEM(Sigma-Aldrich)中加入2%H.A.T.的溶液作为培养液使用。为了使NG108-15细胞神经样分化,将FBS减少至2%,为了使细胞内cAMP浓度上升,文献中使用了膜透过性cAMP(二丁酰-cAMP),但替换为10μM毛喉素(forskolin)进行。以2天至3天的间隔更换培养液。
(1-2)进行使用膜片钳法的细胞内电位测定实验来验证NG108-15分化细胞分化为神经并获得对电刺激、兴奋性神经递质谷氨酸的响应性。
该实验使用作为传统方法的膜片钳法验证了在(1-1)中制备的NG108-15分化细胞中通过谷氨酸诱发了细胞内电位。
具体而言,针对分化的NG108-15细胞,使用充满了添加有10mM谷氨酸的细胞内电解液的玻璃移液管,使其与细胞膜紧密贴附,使玻璃移液管与细胞电一体化。然后,记录由向细胞内给予的谷氨酸诱发的缓慢的去极化和动作电位(图14)。
(1-3)前端具有纳米突起结构的一体化电极的制作
使用磁铁电极(Magele)作为电极,并使用市售的柠檬酸稳定化磁性金纳米粒子(nanoimmunotech公司制造)作为导电性纳米粒子。
具体而言,将0.5μl PEI(10mg/ml)和20μl金涂覆磁性纳米粒子(nanoimmunotech公司制造,NITmagold Cit)、5μl的5倍浓度的HBPS(钙、镁的最终浓度为1mM)混合,在室温下保持30分钟以上。将磁铁电极的记录面朝上固定,将该混合液滴到记录面上,通过磁力使其吸附,使该溶液在室温下蒸发(Magele)。
如(图3中央)所示,将电极的整个侧面插入绝缘体的硅管(Tygon)中进行包覆,用接地材料的铝箔进一步包覆与细胞外液接触的区域,制作本发明的一体化电极。
(1-4)使用前端具有纳米突起结构的电极的细胞内记录
该实验示出了使用(1-3)中制作的将导电性纳米突起结构在前端一体化的电极可以测定分化的NG108-15细胞的细胞内电位。
在分化的NG108-15细胞上使用操纵器按压上述一体化电极(图2),确认前端的纳米突起贯通细胞膜并且细胞处于未被压碎的状态,固定一体化电极。另外,根据实际按压在重量计上进行测定的结果,此时的操纵器中的压力约为280g/cm
通过10mM谷氨酸对分化的NG108-15细胞进行活化后,通过用操纵器固定的一体化电极测定细胞内电位。
与上述(1-2)中通过膜片钳获得的记录相同,记录了动作电位、缓慢的去极化(图15)。
(实施例2)通过藜芦定活化的NG108-15细胞的细胞内电位的测定
该实验是用作为钠通道开放剂(sodium channel opener)的藜芦定将分化的NG108-15细胞活化并测定其细胞内电位的实验。
(2-1)基于Magele测定细胞内电位
在此,将培养分化的NG108-15细胞的培养皿配置在铁板上,使用与参考例(1-3)相同的方法,将前端吸附有金涂覆磁性纳米粒子的磁铁电极(Magele)作为细胞内记录电极使用,测定通过藜芦定活化的NG108-15细胞的细胞内电位。
具体而言,通过与培养皿下方的铁板的磁力将该Magele自立固定在分化的NG108-15细胞上。Magele前端的纳米粒子在PEI的帮助下贯通细胞膜,测定细胞内记录。通过向细胞外液给予的藜芦定使NG108-15细胞活化,并测定由此产生的动作电位作为细胞内电位变化(图16)。
(2-2)使用在表面蒸镀(蒸着)导电性金纳米粒子的一体化电极进行的NG108-15细胞的细胞内电位的测定
在本发明中,由于磁性有无没有影响,因此使用磁铁电极(Magele)作为电极,使用市售的柠檬酸稳定化磁性金纳米粒子(nanoimmunotech公司制造)作为导电性纳米粒子。将金纳米粒子和L(+)-抗坏血酸(10mg/ml,和光纯药)以1:1混合并将约20μl滴到磁铁电极(Magele)(或导电性玻璃)的前端上,在75℃下加热15分钟,进行蒸镀,由此在磁铁电极前端形成粒子状的“导电性纳米突起结构”。蒸镀后,用纯水清洗。形成电极。
在此,使磁性金纳米粒子吸附在磁铁电极(Magele)表面,从细胞外通过操纵器压在细胞表面上。
具体而言,首先,将设置有保持件的电极插入绝缘体硅管(Tygon)中以包覆整个侧面,用接地材料的铝箔进一步包覆与细胞外液接触的区域(一体化电极)。接着,在与一体化电极的保持件相对侧的表面上,吸附与聚乙烯亚胺(PEI)混合的金涂覆磁性纳米粒子,从分化的NG108-15细胞的上方通过操纵器压在细胞表面上,使前端部的金纳米粒子贯通细胞膜并且固定在细胞表面上。
通过10mM谷氨酸将NG108-15细胞活化,测定其细胞内记录电位。其结果是,得到与上述(图15)相同的数据(数据未示出)。
(实施例3)通过K
在该实验中,使用通过与上述(2-2)相同的方法制作的前端具有导电性纳米突起结构的电极(聚乙烯亚胺(PEI)涂覆),测定通过K
具体而言,与上述(2-2)相同,将表面吸附有磁性金纳米粒子的磁铁电极从细胞外通过操纵器压在细胞表面上,使前端部的金纳米粒子贯通细胞膜,在固定于细胞表面的状态下,通过K
(实施例4)未分化的NG108-15细胞的细胞内电位的测定
该实验示出了在导电体和其前端的纳米突起结构均为钛的情况下,前端具有导电性纳米突起结构的电极也能够测定目标细胞的细胞内记录电位。
(4-1)前端具有导电性纳米突起结构的电极的制作(将钛胶体粘附(凝着)在镍-铜切片的前端的钛电极)
对Suzuki等的方法(Journal of the ceramic society of Japan 117(3):381-384(2009))进行部分修改并加以使用,在镍-铜(直径6mm)切片的前端部分上产生纳米结构的凹凸。
具体而言,首先为了形成亲水性表面,用1%KOH处理5分钟,并用ddH
作为溶液A,使用1%钛(IV)双(乳酸铵)二氢氧化物(TALH,50%Aldrich公司);作为溶液B,对于0.1wt%TiO
接着,包括水洗在内,交替地将溶液A和溶液B喷雾在钛表面上,使钛结晶成长,重复10个循环的喷雾循环,在涂装表面还残留有纳米结构的凹凸的时候停止,制作前端部分具有钛的纳米结构的电极。
(4-2)未分化的NG108-15细胞的静息膜电位的测定
将通过上述(4-1)的方法制作的前端部分具有钛的纳米结构的钛电极以与上述(1-3)相同的方式用绝缘体和接地包覆,设置保持件,安装在操纵器上,通过操纵器压在未分化的NG108-15细胞上而使其贯通细胞膜,一边加压一边测定静息膜电位。
通过解除加压,记录的膜电位消失(成为加压前的状态)(图18上图)。
当在没有细胞的状态下进行同样的实验的情况下,电位完全不会发生变化(图18下图),因此判断记录的膜电位来自于细胞。
(4-3)在钛的前端部分作为纳米结构使用SKILTITAN(スキルチタン)的方法
代替上述(4-1)的将肽胶体粘附在钛切片的前端,通过将SKILTITAN(スキルチタン,株式会社キン.ダイ)喷涂在电极面上,在钛切片的前端部分制作纳米结构,制作与上述(4-1)相同的钛电极。
使用该钛电极,用与上述(4-2)相同的方法测定未分化的NG108-15细胞的细胞内静息膜电位时,得到与(图18上图)相同的数据(数据未示出)。
(实施例5)在导电体的前端形成“导电性纳米突起结构”的其它方法的研究
在此,示出了能够在电极(例如钛切片)的前端形成基于导电性聚合物的纳米结构的聚苯胺纳米纤维。
通过对Chiou等的方法(Nature Nanotechnology 2,no.6(June 2007):354-57.)进行部分修改并加以使用,可以将聚苯胺纳米纤维作为电极前端的“导电性纳米突起结构”而形成50nm至65nm的纳米结构。
具体而言,在以下条件下使用苯胺(和光纯药)形成聚苯胺纳米突起。用1M高氯酸(HClO
(实施例6)带保持件的“电容型电位测定装置”的制造
应用上述本发明人等开发的“电容型电位测定装置法”(日本特愿2018-87689),制造紧凑型带保持件的“电容型电位测定装置”(图3右)。在此,如(图3右)所示,带保持件的“电容型电位测定装置”的接地(基准电极)与测定器的负极侧或接地端子连接(参照上述4.(4-4)的“接地夹”的说明),与电极一体化。就该带保持件的“电容型电位测定装置”而言,贯通细胞膜的前端的导电性纳米(粒子)结构通过使检测细胞内的电位变化的导电性纳米(粒子)结构所接触的导电体(磁铁电极等)带电,从而作为电位变化量来进行检测。因此,贯通细胞膜的前端导电性纳米(粒子)结构的每细胞数量强烈影响细胞膜和导电性玻璃的接入电阻(アクセス抵抗),决定所记录的电位变化的大小。
具体而言,将电位变化作为前端导电性纳米(粒子)结构的电荷变化(Q)来检测。Q由下式导出。
Q=CV(式中,C为电容器的电容,V为电位的变化量)
因此,作为变量的V的值基于作为常数的C的大小而与Q的值成比例关系。根据以上内容,在电容型电位测定装置法中,不使用毫伏这样的表示绝对值的单位,而是使用作为相对膜电位的变化的相对电压单位(Relative Voltage Unit,RVU)。
(实施例7)用于确保细胞对导电性玻璃的附着的处理方法
该实验中描述了当需要将细胞贴附到导电性玻璃表面时的关于贴附促进法的研究。
通常,作为用于使细胞附着在玻璃表面、促进培养的方法,需要如下方法等:用胶原等细胞外基质涂布玻璃表面的方法;或者为了抑制均带负电的玻璃表面与细胞膜脂质的排斥,为了使玻璃表面带正电而进行聚-L-赖氨酸处理的方法。在本发明的纳米接触法(ナノタッチ法)中,由于需要使细胞直接贴附在未进行涂覆的导电性玻璃上,因此需要对导电玻璃表面进行特别的清洗处理。
首先,由于在通常的玻璃表面的清洗中使用采用强酸的清洗或利用有机溶剂的清洗,因此同样地对导电性玻璃(FTO、ITO)表面实施强酸清洗、有机溶剂清洗。然而,强酸清洗和利用丙酮、异丙醇等有机溶剂的清洗不促进细胞对导电性玻璃的贴附。
在尝试了各种溶剂后,最终确认用碱性溶液对导电性玻璃(FTO、ITO)表面进行的清洗可以最有效地清洗导电性玻璃表面,使得能够再现性良好地进行细胞的贴附、培养。
具体而言,上述方法是这样的方法:与用碱性洗涤剂(>pH 10)除去导电性玻璃表面的通常的油污相同,在导电玻璃表面涂布碱性溶液,直到能够确认玻璃表面不排斥水为止,反复进行用刷子刷擦等处理的清洗,最后用ddH
该方法并不限于导电性玻璃,对玻璃盖玻片上的细胞培养通常都有效。特别是在进行SH-SY5Y等神经母细胞的分化诱导时、培养iPS心肌细胞时等,通常需要用胶原、纤连蛋白等细胞外基质进行涂覆,但碱性溶液处理在这种情况下也有效。不仅对HEK细胞、CHO细胞有效,该方法对以往难以贴附在玻璃表面的细胞株也特别有效;在NG108-15细胞、SH-SY5Y细胞、iPS心肌细胞等中确认了其有效性(数据未示出)。
(实施例8)通过维甲酸(Retionic acid:RA)分化的SH-SY5Y细胞的动作电位的测定(图19)
(7-1)SH-SY5Y细胞的基于RA的分化和培养
在该实验中,使用在磁铁电极上附着有PEI和金涂覆磁性纳米粒子的混合液的磁铁电极,将磁铁电极固定在操纵器上,使用通过操纵器从上方加压而制作的电极(Handynano电极),测定通过维甲酸(RA;フジフィルム,182-01111)分化的人神经母细胞株SH-SY5Y细胞的细胞内电位。
具体而言,首先将SH-SY5Y细胞接种在直径12mm的圆形盖玻片上,使用培养液DMEM:F12=1:1(DMEM(Sigma Aldrich,D5796)、Ham's F-12(sigma-Aldrich,N4888))、5%FBS(BioWest公司)、NEAA(MEM非必需氨基酸溶液(100X)(Sigma-Aldrich,M7145))进行培养。从接种次日起使10μM RA作用10天,使SH-SY5Y细胞分化成神经样细胞。
如(实施例6)中记载的那样,对上述盖玻片表面预先利用碱性洗涤剂进行清洗。通过碱性溶液洗涤法,即使是作为难以贴附在玻璃面上的细胞的人神经母细胞株,也可以在不进行通常培养中所需的利用胶原等细胞外基质进行的玻璃面的表面处理的情况下进行贴附、培养。
(7-2)通过藜芦定活化的分化SH-SY5Y细胞的细胞内电位的测定
将培养分化的SH-SY5Y细胞的圆形盖玻片配置在铁板上,将在(1-3)中制作的通过磁力而在前端附着有PEI-金涂覆纳米粒子混合液的磁铁电极通过操纵器进行按压(Handynano电极)而作为细胞内记录电极使用,测定通过藜芦定活化的分化SH-SY5Y细胞的细胞内电位。
具体而言,使用该Handynano法,在分化的SH-SY5Y细胞上,使用培养皿上方的操纵器进行固定,并施加适当压力(300g左右)。通过向细胞外液给予的藜芦定使SH-SY5Y细胞活化,并测定由此产生的动作电位作为细胞内电位变化(图19)。
其结果是,能够使用电容型电位测定法来验证SH-SY5Y分化细胞分化为神经样细胞并获得对藜芦定刺激的响应性。
(实施例8)使用nanoCharge多电极进行的分化的神经细胞株中的细胞内电位的测定
(8-1)使用MagEle的多电极的制作
在制作使用MagEle的多电极的情况下,使用固定磁铁和电极磁铁这两种磁铁。将固定电极用封口膜等非导电性材料包覆,粘贴由2~4张铝箔等形成的条状的电极。
从下方用磁力将该铝箔电极固定在电极磁铁上,将电极磁铁的面对细胞以外的侧面用封口膜等非导电性材料包覆而绝缘,在固定磁铁上方安装接地夹,安装操纵器固定用的保持件(图20)。
(8-2)使用导电性玻璃电极的nanoCharge多电极的制作(1)
代替MagEle,使用导电性玻璃电极制作多电极记录。
在通常的电容型电位测定装置法中,使用在培养细胞的导电性表面和设置在该导电性玻璃下表面的铝箔等形成的导电性区域之间形成的电容器作为电荷放大器的检测器。在多电极结构中,也将同样制作的多个铝箔电极作为多个电容器,使用0.7~1mm厚度的ITO导电玻璃制造nanoCharge多电极(图21A)。另外,通过在导电玻璃(ITO)上使用粘接剂固定塑料环并用培养液充满,可以培养受试细胞(图21A、图21B)。
在此,由于导电性玻璃的厚度对记录信号的大小、向横向的扩散有影响,所以如果能够确保导电性玻璃的强度,则期望尽可能薄。
(8-3)使用导电性玻璃电极的nanoCharge多电极的制作(2)
在电容型电位测定装置法中,由表面的导电玻璃和下方的导电性金属箔形成电容器,测定其电极间的电位差,因此在使用多电极的情况下,形成一个导电玻璃电极和多个下方电极的(+)(-)电极对,存在记录的基线变得不稳定的倾向。
作为其改善方法之一,在一个玻璃上制作多个导电性玻璃。具体而言,为了阻断导电性的持续性,在导电玻璃上造成划伤。例如通过进行十字划伤,能够在一片玻璃上形成四片导电性玻璃电极。这样的多个导电性玻璃能够形成一个导电玻璃(图21B)。由此,分别形成与下方电极对应的导电性玻璃和电极的对,因此基线稳定,能够得到稳定的记录信号。在本实施例中,通过划伤导电性玻璃来实现在一片玻璃上形成多个导电性玻璃,但是通过形成ITO、FTO涂覆的图案来实现,还能够扩展至MEA(多电极阵列(MultiElectrode Array))。
(8-4)通过毛喉素处理的分化的NG108-15细胞的动作电位的记录
使用上述(8-1)中制作的3电极MagEle,从通过2%FBS、10μM毛喉素处理的分化的NG108-15神经细胞进行记录(图22)。
3个通道各自显示出不同的动作模式,由此可知3个通道各自记录了来自不同细胞群的信号。观察到通过使10μM Ach发挥作用,增加了所有通道中的神经细胞的活性。
(实施例9)基于2电极MagEle的iPS来源心肌细胞中细胞内电位的测定
从(株)マイオリッジ购买iPS来源的冷冻心肌细胞,按照(株)マイオリッジ公司的手册进行培养。在测定细胞内电位之前,在显微镜下观察,确认至少一部分细胞定期收缩。
使用根据上述(8-1)制作的2电极MagEle,记录iPS来源心肌细胞的细胞内电位。在通道1和通道2中记录了显著不同的响应。通道2记录了大约0.5Hz左右的自发性动作电位(图23,下图)。
(实施例10)使用3电极的导电性玻璃电极进行的Nav1.5、Kir2.1表达HEK细胞株中细胞内电位的测定
将上述(8-2)中制作的3电极的导电性玻璃电极用作3电极电容型电位测定装置,在培养于ITO导电性玻璃上的表达Nav1.5、Kir2.1的HEK细胞株中进行细胞内记录(图24)。另外,将在此使用的Nav1.5、Kir2.1表达HEK细胞株在ITO导电性玻璃上进行培养,使用PEI将导电性纳米粒子(金涂覆磁性纳米粒子)导入细胞中。
(实施例11)使用通过环状磁铁自立的MagEle电极进行的细胞内电位的测定
(11-1)从下方向穿过环状磁铁中心的光刺激引起的神经母细胞内的电位变化的测定(图26左)
在测定细胞内电位时,当使用在培养细胞上方吸引导电性纳米粒子而贯通细胞的MagEle电极时,通常通过设置在培养细胞下方的磁性金属(磁性铁板)使MagEle自立,但通过配置环型磁铁代替磁性金属,同样可以使MagEle固定自立,并且能够确保从环型磁铁中心直接观察存在于MagEle下方的受试培养细胞的路径,因此能够直接将光投射到细胞(图25)。
利用该光投射路径,可以测定光刺激引起的细胞内电位变化。
具体而言,在分化的神经母细胞(NG108-15或SH-SY5Y细胞)中导入ChRWD(脱敏减弱的视紫红质通道蛋白1和2的嵌合体,Wang等)的表达载体,使ChRWD表达,成为蓝光刺激敏感性的细胞株来使用。蓝光刺激使用LED驱动器,470nm M470F1(Thorlabs)。
将神经母细胞在12mm直径的盖玻片上培养,对NG108-15细胞进行2%FBS、10μM毛喉素处理,或者对SH-SY5Y细胞进行10μM维甲酸处理,培养1周至10天使其分化。将蓝光刺激敏感性的神经母细胞株设置在容器中,从上方配置具有通过磁力吸附的PEI混合的导电性纳米粒子的磁铁电极,通过配置在容器下方的环型磁铁将磁铁电极直立固定。
在此,环型磁铁必须具有足够的内径,不能妨碍蓝色光线的照射。在将LED缆线插入环型磁铁内的情况下,由于所使用的蓝色LED缆线直径为2mm,因此需要内径为最低2mm以上。同时环型磁铁需要支撑上述磁铁电极,因此内径不宜过大。为了确保利用足够的磁力来固定,需要确保磁铁电极和环型磁铁可靠地重叠的区域。即,如果磁铁电极的直径为6mm,则期望环型磁铁的内径在4mm以内。
对分化的蓝光刺激敏感性神经母细胞株进行蓝光刺激,观测细胞内电位的变化。
(11-2)细胞内电位和细胞内钙动力学的同时记录(图26右)
在使用环型磁铁和磁铁电极的培养细胞的细胞内电位记录法中,也同时进行使用荧光试剂的细胞内钙测定。此时,由于在细胞的上方设置了磁铁电极,因此使用倒置显微镜。由于限定了细胞容器和位于下方的透镜之间的距离,所以尽可能抑制环型磁铁的厚度(2mm以下)很重要。
接着,由于492nm光通过物镜垂直地照射在磁铁电极上,所以为了减少直接反射引起的误差(假象(Artifact)),用黑色的导电性涂料预先处理磁铁电极的表面。由于贯通细胞膜表面的金涂覆磁性纳米粒子(NanoImmunotech)的峰SPR波长为539±5nm,为避免干涉,细胞内钙测定荧光试剂采用Cal-590 AM(Ex/Em(nm)573/587,AAT Bioquest)。
具体而言,将50μg Cal-590溶解于10μl DMSO中,将该1μl Cal-590与100μl分析缓冲液和1mL HEPES混合,制成溶液。
使该溶液作用于培养细胞,在37℃下保持30分钟至1小时,在室温下进行实验。
此外,应用该方法,除细胞内钙动力学外,也可以将膜电位的变化等与细胞内电位同时并行地进行。
工业实用性
由于本发明能够简便且准确地测定细胞内电位,因此在药物发现筛选中特别有用。预期不仅在培养心肌细胞中而且在培养神经细胞等中会对体外电生理学研究做出重大贡献。
此外,由于本发明的电极能够作为与生物体的组织、器官等直接接触的端子(“invivo prep”)发挥作用,因此能够期待在临床上的应用。
序列表
<110> Ion Chat Research Corporation
Saito, Mitsuyoshi
<120> 通过纳米结构(纳米突起)电极进行的细胞内记录
<130> SJW9971921WO
<150> JP 2018-203171
<151> 2018-10-29
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> KIR2.1 1st正义
<400> 1
ccaaagcaga agcactggag 20
<210> 2
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> KIR2.1 1st A/S
<400> 2
ctttgaaacc attgtgcttg cc 22
<210> 3
<211> 39
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> KIR2.1 ICR HindIII正义
<400> 3
cactataggg aagctaccat gggcagtgtg cgaaccaac 39
<210> 4
<211> 36
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> KIR2.1 ICR HindIII A/S
<400> 4
atagaatagg aagcttcata tctccgactc tcgccg 36
- 前端具有纳米结构的电极
- 具有纳米间隙长度的电极结构的制作方法、通过该方法得到的具有纳米间隙长度的电极结构和纳米器件
