癌症治疗或预防用细胞组合物、及其制造方法
文献发布时间:2023-06-19 11:30:53
技术领域
本发明涉及癌症治疗或预防用细胞组合物、及其制造方法。此外,本发明还涉及使用癌症治疗或预防用细胞组合物的癌症治疗或预防方法。
发明背景
树突状细胞(Dendritic cell:DC)是强大的抗原呈递细胞。存在于血液、组织、淋巴器官等,吞噬微生物、癌细胞等异物,在DC上的主要组织相容性复合体(MHC)I类和II类分子上呈递抗原肽,分别使CD4T细胞和CD8T细胞活化。由此抗原特异性诱导生物体内的免疫反应,将异物排除。
使用DC的癌症免疫疗法在临床研究(试验)、自由诊疗中大量配置实施,但并未确认到期待的临床效果。这被认为是因为,DC无法得到用于获得抗原呈递能力的充分成熟化、DC的数量少、或者作为一般的给药途径的皮内或皮下接种的DC不向作为对幼稚T细胞进行抗原呈递的位置的淋巴结移动。
在这样的情况下,本发明人等实施了用由从癌患者采集的外周血单核细胞(PBMC)诱导成熟化DC和树突状细胞诱导杀伤性淋巴细胞,将其与抗癌剂(环磷酰胺)并用的临床试验,发现获得了一定程度的癌症治疗效果(非专利文献1)。
现有技术文献
非专利文献
非专利文献1:Hi jikata Y.,等,PLoS One,2018年1月2日,13(1):e0187878
发明概述
发明所要解决的课题
本发明的课题在于,提供制造能够用于癌症治疗或预防的含有成熟化树突状细胞和/或树突状细胞诱导杀伤性淋巴细胞的癌症治疗或预防用细胞组合物的方法、通过该方法得到的癌症治疗或预防用细胞组合物、以及使用癌症治疗或预防用细胞组合物的癌症治疗或预防方法。
用于解决课题的方法
为了解决上述课题,本发明人等进行了深入研究,结果完成了本发明的开发。即,本发明具有以下特征。
[1]一种制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法,包括:
(1)将树突状细胞前体细胞在含有GM-CSF和IL-4的培养基中培养72~144小时的工序,
(2)将前述工序(1)中得到的细胞在含有GM-CSF、TNF-α和钥孔血蓝蛋白(KLH)的培养基中培养6小时~48小时的工序,
(3)在前述工序(2)中添加溶链菌制剂,进一步培养3小时~36小时的工序,以及
(4)将前述工序(3)中得到的细胞在肿瘤/老化相关抗原存在下温育30分钟~240分钟,诱导成熟树突状细胞的工序。
[2]根据[1]所述的方法,在前述工序(3)中进一步添加前列腺素E2。
[3]一种制造含有树突状细胞诱导杀伤性淋巴细胞的癌症治疗或预防用细胞组合物的方法,包括:
(1)将树突状细胞前体细胞在含有GM-CSF和IL-4的培养基中培养72~144小时的工序,
(2)将前述工序(1)中得到的细胞在含有GM-CSF、TNF-α和钥孔血蓝蛋白(KLH)的培养基中培养6小时~48小时的工序,
(3)在前述工序(2)中添加溶链菌制剂,进一步培养3小时~36小时的工序,
(4)将前述工序(3)中得到的细胞在肿瘤/老化相关抗原存在下温育30分钟~240分钟,诱导成熟树突状细胞的工序,以及
(5)将含有前述工序(4)中得到的前述成熟树突状细胞和淋巴细胞的第1细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,对树突状细胞诱导杀伤性淋巴细胞进行诱导的工序。
[4]根据[3]所述的方法,在前述工序(3)中进一步添加前列腺素E2。
[5]根据[3]或[4]所述的方法,前述工序(5)为:
(5-1)将含有前述工序(4)中得到的前述成熟树突状细胞和淋巴细胞的第1细胞群在含有IL-2和IL-12的培养基中培养6~36小时的工序,和
(5-2)将前述工序(5-1)中得到的前述第1细胞群在含有IL-2、IL-12、IL-7和IL-15的培养基中培养12~168小时,对树突状细胞诱导杀伤性淋巴细胞进行诱导的工序。
[6]根据[3]~[5]中任一项所述的方法,进一步包括:(6)将含有通过前述工序(5)得到的前述第1细胞群和前述工序(4)中得到的前述成熟树突状细胞的第2细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,对树突状细胞诱导杀伤性淋巴细胞进行诱导的工序。
[7]根据[6]所述的方法,进一步包括:(7)将含有通过前述工序(6)得到的前述第2细胞群和前述工序(4)中得到的前述成熟树突状细胞的第3细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,对树突状细胞诱导杀伤性淋巴细胞进行诱导的工序。
[8]根据[1]~[7]中任一项所述的方法,培养是使用刺激响应性培养基材实施的。
[9]通过[1]~[8]中任一项所述的方法得到的癌症治疗或预防用细胞组合物。
[10]通过[3]~[7]中任一项所述的方法得到的癌症治疗或预防用细胞组合物,其与前述工序(4)中得到的成熟树突状细胞并用。
[11]根据[9]或[10]所述的癌症治疗或预防用细胞组合物,其与抗癌剂并用。
[12]使用[9]或[10]所述的癌症治疗或预防用细胞组合物的癌症治疗或预防方法,包括对需要进行癌症治疗或预防的对象用前述癌症治疗或预防用细胞组合物进行给药的工序。
[13]根据[12]所述的方法,前述进行给药的工序实施2次以上。
[14]根据[12]或[13]所述的方法,前述进行给药的工序是用前述癌症治疗或预防用细胞组合物对前述对象的淋巴结直接给药的工序。
[15]根据[12]~[14]中任一项所述的方法,前述对象是用抗癌剂给药的、应用放射线疗法和/或手术的对象。
发明效果
根据本发明,能够有效地制作比以往的治疗效果好的癌症治疗或预防用细胞组合物。此外,通过使用本发明的癌症治疗或预防用细胞组合物,能够提供治疗效果好的癌症治疗。
附图说明
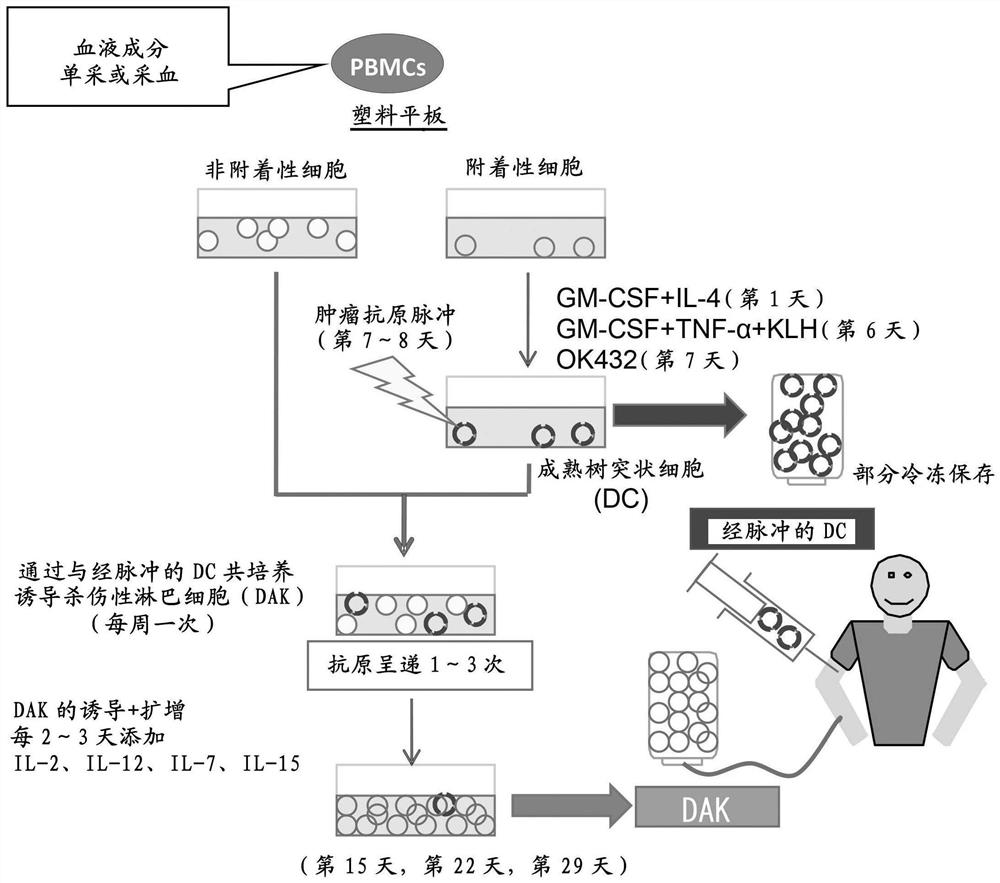
图1为显示由外周血向成熟树突状细胞(成熟DC)和树突状细胞诱导杀伤性淋巴细胞(DAK)分化的方法的概要图。
图2为对成熟树突状细胞的细胞表面分子CD40、CD80、CD83、CD86、HLA-ABC和HLA-DR各自的表达进行分析的图。各板块表示用特异性抗体对作为分析对象的分子实施染色的荧光强度。纵轴表示树突状细胞标记CD11c的荧光强度,横轴表示各细胞表面分子的荧光强度。
图3显示的是由10例癌患者外周血单核细胞制作的成熟DC的细胞表面分子的阳性率。
图4显示的是10例癌患者树突状细胞诱导杀伤性淋巴细胞(DAK)的细胞表面分子CD3、CD8、CD45RA和CD62L的表达率。
图5显示的是使用成熟树突状细胞(成熟DC)和树突状细胞诱导杀伤性淋巴细胞(DAK)的临床试验的时间表。
图6显示的是治疗前后患者外周血中RNF43肽特异性细胞的变化。(A)显示的是患者治疗前后患者外周血中RNF43肽特异性CD107a/b阳性CD3+CD8+细胞的比例的变化。(B)显示的是患者治疗后患者外周血中RNF43肽特异性IFN-γ阳性CD3+CD8+细胞的比例的变化。SD=stable disease(稳定的疾病),PD=progressive disease(进行性疾病)(基于RECIST基准)。实线:SD病例(有效例);虚线:PD病例(无效例)。
图7显示的是用流式细胞仪对通过实施例1所述的方法得到的成熟DC第6天和第8天细胞表面分子的表达进行分析的结果。
图8显示的是通过实施例1所述的方法得到的12例癌患者成熟DC的细胞表面分子的表达率。SD:stable disease,PD:progressive disease(基于RECIST基准)。
图9显示的是,添加OK432或OK432+前列腺素E2(PGE2)后,培养3小时、6小时、12小时或24小时后,成熟DC的细胞表面分子的表达量(平均荧光强度:MFI)。
图10显示的是,添加OK432或OK432+前列腺素E2(PGE2)后,培养3小时、6小时、12小时或24小时后,表达各种细胞表面标记的成熟DC的比例。显示的是SSC和FSC设门且将DC级分中CD11c阳性细胞的数量设为100%时,表达各种细胞表面标记的细胞的比例。
图11显示的是,在OK432的基础上,不添加(-)或添加(+)前列腺素E2(PGE2),在以往的细胞培养基材(Standard)或温度响应性培养基材(UpCell)上诱导的DC的诱导效率(CD11c的表达)。“DC#1”和“DC#2”分别表示来自不同受试者的DC。
图12显示的是,在OK432的基础上,不添加(-)或添加(+)前列腺素E2(PGE2),在以往的细胞培养基材(Standard)或温度响应性培养基材(UpCell)上诱导的成熟DC的CD80的表达量(平均荧光强度:MFI)。“DC#1”和“DC#2”分别表示来自不同受试者的DC。
图13显示的是,在OK432的基础上,不添加(-)或添加(+)前列腺素E2(PGE2),在以往的细胞培养基材(Standard)或温度响应性培养基材(UpCell)上诱导的成熟DC的CCR7的表达量(平均荧光强度:MFI)。“DC#1”和“DC#2”分别表示来自不同受试者的DC。
图14显示的是,在OK432的基础上,添加前列腺素E2(PGE2),在以往的细胞培养基材(Standard)或温度响应性培养基材(UpCell)上诱导的成熟DC的显微镜照片。“DC#1”和“DC#2”分别表示来自不同受试者的DC。
图15显示的是,添加OK432或OK432+前列腺素E2(PGE2)后,培养3小时、6小时、12小时或24小时后成熟DC的IL-12分泌量(pg/mL)。IL-12的量通过ELISA来测定。
图16显示的是,由外周血制成成熟树突状细胞(成熟DC),用多种癌抗原、新抗原肽分别以20~50ug/ml浓度进行脉冲(パルス;pulse)的方法的概要图。
具体实施方式
以下详细地对本发明进行说明,但并不意味着本发明的技术范围仅限定为下述形态。
本说明书中,“第1”、“第2”、“第3”等术语是为了对1个要素与另1个要素进行区别而使用的,例如也可以将第1要素表述为第2要素、同样地将第2要素表述为第1要素,不会因此脱离本发明的范围。
只要没有特殊定义,本说明书中使用的术语(技术术语和科学术语)均具有与本领域技术人员一般理解的术语相同的意思。
需说明的是,以下的“制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法”、“制造含有树突状细胞诱导杀伤性淋巴细胞的癌症治疗或预防用细胞组合物的方法”、“癌症治疗或预防用细胞组合物”和“使用癌症治疗或预防用细胞组合物的癌症治疗或预防方法”中说明的事项可以相互适用。
<制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法>
一个实施方式中,本发明提供一种制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法,包括:
(1)将树突状细胞前体细胞在含有GM-CSF和IL-4的培养基中培养72~144小时的工序,
(2)将前述工序(1)中得到的细胞在含有GM-CSF、TNF-α和钥孔血蓝蛋白(KLH)的培养基中培养6小时~48小时的工序,
(3)在前述工序(2)中添加溶链菌制剂,进一步培养3小时~36小时的工序,以及
(4)将前述工序(3)中得到的细胞在肿瘤/老化相关抗原存在下温育30分钟~240分钟,诱导成熟树突状细胞的工序。
本说明书中,“树突状细胞(Dendritic cell,DC)”是指,成熟状态下呈树枝状形态、具有将抗原肽向I类和/或II类MHC呈递而使T细胞活化的能力的细胞,作为表面标记,例如人的树突状细胞中,为CD11c和MHC-class II(特别是HLA-DR)阳性的细胞,小鼠的树突状细胞中,已知CD11c、MHC class II、CD24和CD45阳性以及Siglec-F阴性的细胞。
本说明书中,“树突状细胞前体细胞”是指在适当因子(例如G-CSF、GM-CSF、TNF-α、IL-4、IL-13、SCF(c-kit配体)、Flt-3配体、或它们的组合等)存在下分化成DC的细胞。树突状细胞前体细胞可列举单核细胞、CD34
一个实施方式中,本发明中使用的树突状细胞前体细胞例如可以将外周血单核细胞(PBMC:Peripheral blood mononuclear cell)接种在培养容器中,在37℃5%CO
本说明书中,PBMC是包括单核细胞、淋巴细胞(T细胞、NK细胞、NKT细胞和B细胞)的细胞集团,意思是颗粒细胞、红血球和血小板等几乎全部被除去的细胞集团。PBMC例如可以利用比重离心分离法等公知的方法,由从患者采集的试样获得。作为从患者采集的试样,可列举外周血、骨髓液、脐带血等。
本说明书中,“未成熟树突状细胞”是指与成熟状态相比T细胞活化能力明显低的树突状细胞。而“成熟树突状细胞”是指与未成熟状态相比T细胞活化能力明显高的树突状细胞。成熟树突状细胞、特别是人成熟树突状细胞是选自由CD40、CD80、CD83、CD86和MHC-class II(HLA-ABC和HLA-DR)组成的组的表面标记表达为阳性的细胞。因此,例如可以基于选自由CD40、CD80、CD83、CD86和MHC-class I和II(HLA-ABC和HLA-DR)组成的组的表面标记的表达来区分未成熟树突状细胞和成熟树突状细胞。未成熟树突状细胞中这些标记的表达弱或者为阴性。
已知未成熟树突状细胞具有使抗原特异性细胞毒性T细胞呈无反应性(anergy)的功能。因此,未成熟树突状细胞比例大的细胞组合物不仅使癌抗原特异性细胞毒性T细胞活化的能力低,而且还带来抑制癌抗原特异性细胞毒性T细胞的活化的负的效果。结果,不仅癌症治疗效果差,而且反而存在使癌恶化的可能性。
利用本发明,能够获得使未成熟树突状细胞的比例降低、另一方面有效地诱导成熟树突状细胞、特别是CD83阳性成熟树突状细胞的癌症治疗或预防用细胞组合物。因此,能够提供含有与以往的免疫疗法中使用的树突状细胞、特别是未成熟树突状细胞比例高的细胞组合物相比使癌抗原特异性细胞毒性T细胞活化的能力高、治疗效果好的成熟树突状细胞的癌症治疗或预防用细胞组合物。
一个实施方式中,本发明的工序(1)是在含有GM-CSF和IL-4的培养基中培养72~144小时、优选为96~132小时(例如约120小时)的工序。通过本工序(1),树突状细胞前体细胞能够有效地向未熟树突状细胞分化。
一个实施方式中,本发明的工序(2)是将工序(1)中得到的细胞在含有GM-CSF、TNF-α和钥孔血蓝蛋白(KLH)的培养基中培养6小时~48小时、优选为12小时~36小时(例如约24小时)的工序。本说明书中,“钥孔血蓝蛋白(KLH)”是免疫调节剂的一种,作为促进免疫反应的物质是已知的。通过本工序(2),未熟树突状细胞能够有效地向成熟树突状细胞分化。
一个实施方式中,本发明的工序(3)是在前述工序(2)中添加溶链菌制剂,进一步培养3小时~36小时、例如10小时~30小时的工序。本说明书中,“溶链菌制剂”是别称为“OK432(OK-432)”、以链球菌的干燥菌体为有效成分的抗恶性肿瘤剂或淋巴管瘤治疗剂。通过本工序(3),能够使后续工序(4)中添加的肿瘤/老化相关抗原有效地对成熟树突状细胞进行脉冲。此外,通过本工序(3),工序(2)中得到的细胞中细胞毒性T细胞的诱导所必需的IL-12的产生被促进。在本工序(3)中不添加后述前列腺素E2(PGE2)的情况下,如果培养超过18小时,则工序(2)中得到的细胞中CCR7的表达降低。因此,不添加前列腺素E2(PGE2)的情况下,工序(3)中培养时间可以为3小时~18小时、优选为8小时~14小时、更优选为10小时~14小时(例如约12小时)。
另一方式中,本发明的工序(3)可以为在前述工序(2)中除了溶链菌制剂以外还添加前列腺素E2(PGE2),培养3小时~36小时的工序。工序(3)中,通过在添加溶链菌制剂的基础上进一步添加前列腺素E2(PGE2),作为树突状细胞的成熟化标记的CD80的表达、CD83的表达不会下降,而作为迁移能力的标记的CCR7的表达上升。在本工序(3)中除了溶链菌制剂以外还添加前列腺素E2(PGE2)的情况下,培养时间可以为3小时~36小时、优选为8小时~36小时、更优选为10小时~30小时(例如约24小时)。
一个实施方式中,本发明的工序(4)是将前述工序(3)中得到的细胞在肿瘤/老化相关抗原存在下温育30分钟~240分钟、优选为60分钟~180分钟(例如约120分钟),诱导成熟树突状细胞的工序。
本说明书中,“肿瘤/老化相关抗原”是指癌细胞中特异性表达的蛋白质或其片段、或者癌细胞中表达比正常细胞显著多的蛋白质或其片段、或者作为细胞老化相关抗原(senescence-associated antigen)的蛋白质或其片段,可列举例如CEA(Carcinoembryonic Antigen,癌胚抗原)、PSA(Prostate Specific Antigen,前列腺特异性抗原)、EGFR(Epidermal Growth Factor Receptor,表皮生长因子受体)、Her2(HumanEpidermal Growth Factor Receptor Type 2,人表皮生长因子受体-2)、hTERT(HumanTelomerase Reverse Transcriptase,人端粒酶逆转录酶)、MAGE(Melanoma AssociatedAntigen,人黑色素瘤相关抗原)、MUC1(Mucin 1)、WT1(Wilms Tumor 1,Wilms肿瘤1)和RNF43(Ring finger protein 43,锌指蛋白43)等,但不限于此。此外,肿瘤/老化相关抗原中也可包括VEGFR1(Vascular Endothelial Growth Factor Receptor 1,血管内皮生长因子受体1)和VEGFR2(Vascular Endothelial Growth Factor Receptor 2,血管内皮生长因子受体2)等肿瘤血管新生相关蛋白质。此外,肿瘤/老化相关抗原可以为作为老化细胞中特异性表达的细胞老化相关抗原(senescence-associated antigen)的uPAR(Urokinase-type plasminogen activator receptor,尿激酶型纤溶酶原激活物受体)、CD153、BRD4或Bcl2等在老化细胞中特异性表达的蛋白质或其片段(例如参照Amor等Nature 583,第127-132页,2020;Shota Yoshida等Nat Commun.11,2482.2020;Nilgun Tasdemir等CancerDiscov.6,612-29.2016;Chang J等Nat Med,22:78-83.2016等。)。
本发明中使用的肿瘤/老化相关抗原可以为新抗原(neoant igen)。本说明书中,“新抗原”是也被称为新生抗原、新的抗原、肿瘤特异性变异抗原等的伴随癌细胞特有的基因变异新产生的变异抗原,是在正常细胞中不表达、仅在癌细胞中特异性表达的抗原。
已知在生物体中,细胞老化对抑癌机制有影响,与癌的发生或转移相关。发生细胞老化的细胞(老化细胞)被认为是仅失去了增殖能力的细胞,但近年来已明确,可以从老化细胞分泌各种生理活性物质,对周围正常细胞的功能产生影响。这样的老化细胞特异性分泌表型被称为SASP(senescence-associated secretory phenotype,衰老相关的分泌表型),借助SASP的细胞非自律性老化细胞的功能被认为与组织的老龄性变化、老龄性疾病的发病、例如癌的发病等相关。此外,SASP释放血管内皮生长因子(vascular endothelialgrowth factor,VEGF)、白细胞介素(IL)6等炎症分子,诱发慢性炎症疾病、组织功能障碍,成为癌的发源地,因此将其排除则能够预防癌症(Childs,B.G.等,Nat.Rev.DrugDiscov.16,718-735.2017)。因此,靶向老化细胞的细胞老化相关抗原(例如uPAR、CD153、BRD4、Bcl2等)、p38、细胞老化特异性β半乳糖苷酶(Senescence-associated β-galactosidase)也可以作为本发明中能够使用的肿瘤/老化相关抗原。
本说明书中,“肿瘤/老化相关抗原来源肽”是指包含肿瘤/老化相关抗原的一部分的、氨基酸数8~12的肽及其类似物。氨基酸数例如为8个、9个、10个、11个或12个。
一个实施方式中,本发明中能够使用的候选肿瘤/老化相关抗原来源肽和肿瘤/老化相关抗原来源肽可以使用市售产品,或者,也可以使用基于HLA型、肿瘤/老化相关抗原的氨基酸序列等、利用例如BIMAS、SYFPEITHI等电脑程序设计而合成的物质。
包含肿瘤/老化相关抗原的一部分的、氨基酸数8~12的肽的类似物是指,基本上不改变该肽的功能特性、在肽的一个或两个末端或内部有1或数个(例如两个或3个)氨基酸的替换、缺失或添加的肽的表位。可以是在肿瘤/老化相关抗原来源肽中的一个或两个末端结合有为了与该肽的生成、纯化、稳定化、结合或检测等相关的目的而添加的1个或2个以上氨基酸。
本发明中,使用的培养基例如可以使用Eagle最小必需培养基(MEM培养基)、Dulbecco’s Modified Eagle Medium(DMEM培养基)、Iscove’s Modified Dulbecco’sMedium(IMDM培养基)、RPMI-1640培养基、α-MEM培养基、F-12培养基、AIM-V培养基、CellGro(注册商标)DC、X-VIVO(商标)10、X-VIVO(商标)15等市售培养基。培养基中可以根据需要添加牛血清、胎牛血清和人血清等血清。此外,培养基中可以根据需要加入各种添加剂。
<制造含有树突状细胞诱导杀伤性淋巴细胞的癌症治疗或预防用细胞组合物的方法>
一个实施方式中,本发明提供一种制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法,包括:
(1)将树突状细胞前体细胞在含有GM-CSF和IL-4的培养基中培养72~144小时的工序,
(2)将前述工序(1)中得到的细胞在含有GM-CSF、TNF-α和钥孔血蓝蛋白(KLH)的培养基中培养6小时~48小时的工序,
(3)在前述工序(2)中添加溶链菌制剂,进一步培养3小时~36小时的工序,
(4)将前述工序(3)中得到的细胞在肿瘤/老化相关抗原存在下温育30分钟~240分钟,诱导成熟树突状细胞的工序,以及
(5)将含有前述工序(4)中得到的前述成熟树突状细胞和淋巴细胞的第1细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,诱导树突状细胞诱导杀伤性淋巴细胞的工序。
一个实施方式中,本发明的工序(1)~(4)与上述“制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法”是通用的。
一个实施方式中,本发明的工序(5)是将含有前述工序(4)中得到的前述成熟树突状细胞和淋巴细胞的第1细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,诱导树突状细胞诱导杀伤性淋巴细胞的工序。
本说明书中,“淋巴细胞”是指包括T细胞、NK细胞、NKT细胞和B细胞的细胞集团。一个实施方式中,本发明中使用的淋巴细胞例如可以通过下述方法获得:将从患者采集的PBMC接种在培养容器中,在37℃5%CO
本说明书中,“树突状细胞诱导杀伤性淋巴细胞(DAK)”是指受到通过前述工序(1)~(4)的工序得到的成熟树突状细胞的刺激而活化的淋巴细胞。DAK含有加起来90%以上、优选为95%以上的CD3+CD4+T细胞和CD3+CD8+T细胞。根据本发明,可提供癌症治疗效果比以往的免疫疗法中使用的淋巴细胞好的淋巴细胞。尤其是通过本发明制作的DAK不是以往那样癌特异性杀伤效果持续时间短的耗竭(exhausted)T细胞,而是大量含有分化度低的记忆性T细胞,癌特异性杀伤效果长时间持续。
一个实施方式中,前述工序(5)是:
(5-1)将含有前述工序(4)中得到的前述成熟树突状细胞和淋巴细胞的第1细胞群在含有IL-2和IL-12的培养基中培养6~36小时、优选为12小时~30小时(例如约24小时)的工序,和
(5-2)将前述工序(5-1)中得到的前述第1细胞群在含有IL-2、IL-12、IL-7和IL-15的培养基中培养12~168小时、优选为24小时~108小时(例如约96小时),诱导树突状细胞诱导杀伤性淋巴细胞的工序。
一个实施方式中,为了使上述工序(5)中得到的DAK进一步活化,本发明可以进一步包括:
(6)将含有通过前述工序(5)得到的前述第1细胞群和前述工序(4)中得到的前述成熟树突状细胞的第2细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,诱导树突状细胞诱导杀伤性淋巴细胞的工序。
一个实施方式中,为了使上述工序(6)中得到的DAK进一步活化,本发明可以进一步包括:
(7)将含有通过前述工序(6)得到的前述第2细胞群和前述工序(4)中得到的前述成熟树突状细胞的第3细胞群在含有选自由IL-2、IL-12、IL-7和IL-15组成的组的细胞因子的培养基中培养,诱导树突状细胞诱导杀伤性淋巴细胞的工序。
另一实施方式中,上述工序(6)和(7)可以进一步重复任意的次数。
需说明的是,上述培养优选使用刺激响应性培养基材(例如温度响应性培养基材)实施。由此,在回收细胞时能够使附着的细胞非侵入性地剥离,能够获得损伤少的细胞。
<癌症治疗或预防用细胞组合物>
利用上述“制造含有成熟树突状细胞的癌症治疗或预防用细胞组合物的方法”和“制造含有树突状细胞诱导杀伤性淋巴细胞的癌症治疗或预防用细胞组合物的方法”,得到癌症治疗或预防用细胞组合物。本发明的癌症治疗或预防用细胞组合物例如可以含有灭菌水、生理盐水、植物油、乳化剂、悬浮剂、表面活性剂、稳定剂、赋形剂、药物媒介、防腐剂、粘合剂、免疫促进剂和佐剂等医药上允许的载体或溶剂等。
<使用癌症治疗或预防用细胞组合物的癌症治疗或预防方法>
一个实施方式中,本发明提供一种使用癌症治疗或预防用细胞组合物的癌症治疗或预防方法,包括:
对需要进行癌症治疗或预防的对象用前述癌症治疗或预防用细胞组合物进行给药的工序。
本说明书中,“对象”是需要癌症治疗或预防的包括人的哺乳类。本说明书中,“癌症治疗或预防”是指发生肿瘤大小的缩小(延缓或停止)、肿瘤转移的抑制、肿瘤生长的抑制(延缓或停止)和与癌相关的一种或多种症状的缓解中的至少1种。
作为本发明涉及的癌症治疗或预防用细胞组合物能够治疗或预防的癌症,例如包括但不限于肺癌、胃癌、大肠癌、肝癌、胆管癌、子宫癌、乳腺癌、胰腺癌、卵巢癌、食道癌、前列腺癌、膀胱癌、肉瘤、恶性淋巴瘤、咽癌、喉癌、癌性胸膜炎和腹膜炎、以及骨转移和转移性癌症。
一个实施方式中,用癌症治疗或预防用细胞组合物进行给药的工序可以实施2次以上。
一个实施方式中,用癌症治疗或预防用细胞组合物进行给药的工序包括通过本领域技术人员公知的方法对对象进行给药。例如可以对患病部位直接给药,也可以对静脉内、肌肉内、腹腔内或皮下注射以及淋巴结直接注入,可以根据应用对象的状态适当选择。例如对于浅表淋巴结肿大、能够回声穿刺的对象,可以用癌症治疗或预防用细胞组合物在淋巴结内直接给药。例如对于对象中浅表淋巴结小、无法穿刺注入的对象,可以通过用含有在工序(3)中添加PGE2而提高了迁移能力的DC的癌症治疗或预防用细胞组合物进行皮下注射来给药。癌症治疗或预防用细胞组合物的给药量根据疾病、患者体质、年龄、性别、症状、给药目的、给药方法等的不同而不同,本领域技术人员可以适当决定。
一个实施方式中,对象是用抗癌剂给药的、应用放射线疗法和/或手术(例如外科手术)的对象。与本发明的癌症治疗或预防用细胞组合物并用的抗癌剂可以根据对象所患疾病使用公知的抗癌剂。作为可在本发明中使用的抗癌剂没有特别限定,可列举例如分子靶向药、烷基化剂、代谢拮抗剂、铂制剂、激素制剂、拓扑异构酶抑制剂、微管作用抗癌剂、免疫赋活剂、抗癌性抗生素等,也可以将它们组合使用。作为分子靶向药,例如可以为低分子化合物、抗体等,例如可以为免疫检查点抑制剂(例如PD-1抑制剂、PD-L1抑制剂、CTLA-1抑制剂、KIR抑制剂、LAG3抑制剂、CD137抑制剂、CCR4抑制剂等)、EGFR抑制剂(例如抗EGFR抗体)、VEGFR抑制剂(例如抗VEGFR抗体)、GD2抑制剂(例如GD2抗体)。作为分子靶向药,可列举例如替伊莫单抗、纳武利尤单抗、易普利单抗、派姆单抗、德瓦鲁单抗、阿维单抗、阿特朱单抗、替西木单抗、Lirilumab、BMS986016、Utomilumab、伊马替尼、依维莫司、埃罗替尼、吉非替尼、舒尼替尼、西妥昔单抗、索拉非尼、达沙替尼、他米巴罗汀、曲妥珠单抗、曲妥珠单抗-美坦新偶联物、维甲酸、帕尼单抗、贝伐单抗、硼替佐米、拉帕替尼、利妥昔单抗、威罗菲尼、阿来替尼等。作为烷基化剂,可列举例如异环磷酰胺、卡波昆、环磷酰胺、氮烯咪胺、塞替派、替莫唑胺、尼莫司汀、白消安、普鲁苄肼、米尔法兰、雷莫司汀等。作为代谢拮抗剂,可列举例如依诺他滨、卡培他滨、卡莫氟、克拉屈滨、吉西他滨、阿糖胞苷、阿糖胞苷十八烷基磷酸盐、替加氟、替加氟-尿嘧啶、替加氟-吉美拉西·奥替拉西钾、去氧氟尿苷、奈拉滨、羟基脲、氟尿嘧啶、氟达拉滨、培美曲塞、喷司他丁、巯嘌呤、甲胺喋呤等。作为铂制剂,可列举例如奥沙利铂、卡铂、顺氯氨铂、奈达铂等。作为激素制剂,可列举例如阿那曲唑、依西美坦、雌氮芥、炔雌醇、氯地孕酮、戈舍瑞林、三苯氧胺、地塞米松、托瑞米芬、比卡鲁胺、氟他胺、氢化泼尼松、磷雌酚、米托坦、甲睾酮、安宫黄体酮、美雄烷、亮丙瑞林、来曲唑等。作为拓扑异构酶抑制剂,可列举例如伊立替康、依托泊苷、诺吉替康等。作为微管作用抗癌剂,可列举例如艾日布林、多西他赛、诺吉替康、紫杉醇、长春瑞滨、长春新碱、长春地辛、长春花碱等。作为免疫赋活剂,可列举例如干扰素-α、干扰素-β、干扰素-γ、白细胞介素、乌苯美司、蘑菇多糖、干燥BCG等。作为抗癌性抗生素,可列举例如放线菌素D、阿柔比星、氨柔比星、依达比星、表柔比星、净司他丁斯酯、道诺红菌素、阿霉素、吡柔比星、博来霉素、培洛霉素、丝裂霉素C、米托蒽醌、脂质体阿霉素等。
此外,与本发明的癌症治疗或预防用细胞组合物并用的放射线疗法可以应用本领域技术人员公知的放射线疗法。
实施例
以下,基于实施例进一步详细地对本发明进行说明,但这些实施例不对本发明进行任何限制。需说明的是,本实施例中临床试验方案是经九州大学医院的临床试验伦理审查委员会批准实施的,是在从全部患者获得书面知情同意后实施的。
[实施例1]
树突状细胞(DC)、树突状细胞诱导杀伤性淋巴细胞(DAK)的前体细胞是从外周血单核细胞采集的。具体地,也可以采用进行从红血球分离有核细胞的方法。一般使用利用Ficoll分层即菲科帕克(Ficoll-Paque,GE Healthcare,England)密度梯度或洗脱的方法。图1中显示的是从人外周血单核细胞向DC、DAK分化诱导培养的方法的概要图。需说明的是,以下的“第x天”的记载表示的是将从各受试者采血的日期作为“第1天”时的天数。
[第1天]
(1)将从各受试者采集的外周血单核细胞悬浮在X-VIVO(商标)15(Lonza,MD,美国)中,放入T-175烧瓶或T175烧瓶型UpCell(注册商标)(CellSeed,日本)。
(2)在37℃5%CO
(3)将T-175烧瓶从培养箱取出,通过轻敲和吹吸回收非附着细胞(淋巴细胞),以1~5×10
(4)在数个除去了非附着细胞的前述T-175烧瓶中,加入含有以下的:
·1000IU/ml GM-CSF(Bayer HealthCare,德国),和
·1000IU/ml IL-4(CellGenix,德国)的DC培养用培养基(CellGro(注册商标)DC,CellGenix,德国)。
(5)用37℃5%CO
[第6天:细胞因子、KLH补加]
(6)将含有以下的:
·1000IU/ml GM-CSF(Bayer HealthCare,德国)
·50ng/μl TNF-α(CellGenix,德国),和
·25μg/ml Keyhole Limpet Hemocyanin(KLH)(Merck Milliopore Darmstadt,德国)的DC培养用培养基(CellGro(注册商标)DC,CellGenix,德国)加入前述T-175烧瓶。
(7)用37℃5%CO
[第7天:OK432添加]
(8)在各T-175培养烧瓶中分别加入0.1KE/ml溶链菌制剂(OK432,中外制药,日本)。
(9)用37℃5%CO
[第7~8天:成熟化DC的回收]
(10)从前述T-175培养烧瓶回收附着细胞。
(11)对数根含有回收的细胞悬浮液的锥底离心管进行离心,用移液器吸取上清。用PBS或者CellGro(注册商标)DC将各锥底离心管的沉淀悬浮,移至50ml锥底离心管,用PBS或者CellGro(注册商标)DC定容至40ml。
(12)将细胞悬浮液用100μm细胞过滤器过滤,离心(300g,4℃,5分钟)。
(13)在225ml锥底离心管中加入CellGro(注册商标)DC进行悬浮。
(14)根据回收的细胞的HLA,添加以下任一肿瘤抗原肽(20μg/ml)(由PolyPeptideLaboratories(San Diego,CA,美国)合成),放入37℃培养箱,温育120分钟。
·HLA-A*24:02阳性受试者用:
HLA-A*24:02限制性RNF43肽(RNF43-A24-9-721,氨基酸序列:NSQPVWLCL)
·HLA-A*02:01阳性受试者用:
HLA-A*02:01限制性RNF43肽(RNF43-A02-10-11,氨基酸序列:ALWPWLLMAT)
(15)将前述225ml锥底离心管从培养箱取出,离心,舍弃上清。
(16-1)将通过(15)得到的细胞的一部分(5×10
[第7~8天]
(16-2)制备将以下物质混合的培养基:
·X-VIVO(商标)10(Lonza,MD,美国)19ml,
·自身血清1ml,
·IL-2(100IU/μl)(Novartis,瑞士)20μl,和
·IL-12(500pg/μl)(R&D Systems,Minneapolis,美国)16μl
使上述第1天保存的淋巴细胞(非附着细胞)融化,洗涤,将1×10
[第9~10天]
(17)进一步将以下的:
·X-VIVO(商标)10 19ml,
·自身血清1ml,
·IL-2(100IU/μl)40μl,
·IL-12(500pg/μl)16μl,
·IL-7(50ng/μl)(R&D Systems,Minneapolis,美国)20μl,和
·IL-15(50ng/μl)(Thermo Fisher Scientific,MA,美国)20μl
加入(19)的T75培养烧瓶,用37℃、5%CO
[第13~14天]
(18)从前述T75培养烧瓶将40ml细胞悬浮液回收于50ml锥底离心管,进行离心(300×g,4℃,5分钟)。将上清除去,加入含有以下组成的培养基:
·X-VIVO(商标)10 19ml
·自身血清1ml
·IL-2(100IU/μl)40μl
·IL-12(500pg/μl)16μl
·IL-7(50ng/μl)10μl
·IL-15(50ng/μl)10μl
并悬浮,放回原来的T75烧瓶,用培养箱培养。
[第14~15天]
(19)对前述T-75培养烧瓶充分进行轻敲和吹吸后,将细胞悬浮液回收于50ml锥底离心管。用10ml X-VIVO(商标)10冲洗先前的T75培养烧瓶,回收于先前的锥底离心管。离心(300×g,4℃,5分钟),舍弃上清。
(20-1)悬浮在30ml生理盐水中,离心(300×g,4℃,5分钟)。将该操作重复两次。制作添加有2mL自身血清的100mL生理盐水瓶(2%自身血清/生理盐水)。用20mL制作的2%自身血清/生理盐水悬浮上述沉淀,用100μm细胞过滤器过滤。将经过过滤的细胞悬浮液放入先前的100ml生理盐水瓶,制备给药用DAK。
(20-2)将(19)的沉淀用10ml X-VIVO10悬浮,加入至新的T75烧瓶。将5×10
(21)进一步在T-75烧瓶中加入8.5ml X-VIVO(商标)10+1.5ml自身血清+30μlIL-2(100IU/μl)+24μl IL-12(500pg/μl)+7.5μl IL-7(50ng/μl)+7.5μl IL-15(50ng/μl),用37℃、5%CO
[第16~17天]
(22)制作47.5ml X-VIVO(商标)10+2.5ml自身血清+80μl IL-2(100IU/μl)+32μl IL-12(500pg/μl)+20μl IL-7(50ng/μl)+20μl IL-15(50ng/μl)。对前述T-75培养烧瓶充分进行轻敲和吹吸后,将细胞移入新的T-175烧瓶。将先前的T-75培养烧瓶用10ml先前的培养基洗涤后,加入至前述新的T-175烧瓶。将该操作再重复一次。加入剩下的30ml培养基,用37℃、5%CO
[第19~20天]
(23)从前述T-175培养烧瓶将50ml细胞混悬液(尽可能为上清)回收于50ml锥底离心管,离心(300×g,4℃,5分钟)。舍弃上清,加入28.5ml X-VIVO(商标)10+1.5ml自身血清+60μl IL-2(100IU/μl)+24μl IL-12(500pg/μl)+15μl IL-7(50ng/μl)+15μl IL-15(50ng/μl)并悬浮,放回原来的T-175培养烧瓶,用37℃、5%CO
[第21~22天]
(24)对前述T-175培养烧瓶充分进行轻敲和吹吸后,将细胞悬浮液回收于50ml锥底离心管。用20ml X-VIVO(商标)10冲洗先前的T175培养烧瓶,回收于先前的锥底离心管,离心(300×g,4℃,5分钟),舍弃上清。
(25-1)悬浮在30ml生理盐水中,离心(300×g,4℃,5分钟)。将该操作重复两次。用20mL制作的2%自身血清/生理盐水将上述沉淀悬浮,用100μm细胞过滤器过滤。将经过过滤的细胞悬浮液放入先前的100ml生理盐水瓶,制备给药用DAK。
(25-2)将(24)的沉淀用10ml X-VIVO(商标)10悬浮,分装在两个新的T75烧瓶中(如有可能,优选淋巴细胞数为0.8~1.2×10
(26)在(25-2)的T-75烧瓶的细胞悬浮液中加入8.5ml X-VIVO(商标)10+1.5ml自身血清+30μl IL-2(100IU/μl)+24μl IL-12(500pg/μl)+7.5μl IL-7(50ng/μl)+7.5μl IL-15(50ng/μl),用37℃、5%CO
[第23~24天]
(27)将T-75烧瓶的细胞悬浮液分别移至T-175烧瓶,加入47.5ml X-VIVO10+2.5ml自身血清+80μl IL-2(100IU/μl)+32μl IL-12(500pg/μl)+20μl IL-7(50ng/μl)+20μl IL-15(50ng/μl)。
[第25~26天]
(28)从前述两个T-175培养烧瓶将40ml细胞悬浮液回收于50ml锥底离心管,离心(300×g,4℃,5分钟)。用38ml培养基X-VIVO(商标)10+2ml自身血清+80μl IL-2(100IU/μl)+32μl IL-12(500pg/μl)+20μl IL-7(50ng/μl)+20μl IL-15(50ng/μl)悬浮,放回原来的T-175培养烧瓶。
[第28~29天]
(29)对前述两个T-175培养烧瓶充分进行轻敲和吹吸后,将细胞悬浮液回收于6个50ml锥底离心管。用20ml X-VIVO(商标)10冲洗先前的T175培养烧瓶,回收于先前的锥底离心管。离心(300×g,4℃,5分钟),舍弃上清,将沉淀用30ml生理盐水悬浮,将6份细胞合并为2份,离心(300×g,4℃,5分钟),舍弃上清。再次用30ml生理盐水悬浮,离心(300×g,4℃,5分钟),舍弃上清。
(30)制作添加有2mL自身血清的100mL生理盐水瓶(2%自身血清/生理盐水)。用20mL制作的2%自身血清/生理盐水将上述沉淀悬浮,用100μm细胞过滤器过滤。将经过过滤的细胞悬浮液放入先前的100ml生理盐水瓶,制备给药用DAK。
对于上述1的(16-1)中得到的成熟树突状细胞的细胞表面分子的表达,通过Hijikata Y.等(PLoS One.2018年1月2日,13(1):e0187878)记载的使用流式细胞仪的方法进行分析。
图2为对作为最终细胞加工物的成熟树突状细胞的细胞表面分子CD40、CD80、CD83、CD86、HLA-ABC和HLA-DR各自的表达进行分析的图。各板块显示的是用特异性抗体对作为分析对象的分子实施染色的荧光强度。纵轴表示树突状细胞标记CD11c的荧光强度,横轴表示各细胞表面分子的荧光强度。
图3是将由10例癌症患者外周血单核细胞制成的成熟DC的细胞表面分子阳性率用条形图表示。显示成熟标记的表达高。
图4显示的是10例癌症患者DAK的细胞表面分子CD3、CD8、CD45RA和CD62L的表达率。90%以上为T细胞,其中耗竭型效应T细胞少量存在,记忆性T细胞大量存在。
利用上述1的方法,对于由分别从10例癌患者(直肠结肠癌、肺小细胞癌、食道癌、宫颈癌)获得的外周血单核细胞制作的成熟DC和DAK按照图5的时间表给药。具体地,按以下的时间表实施。
(1)第1天:用低用量的环磷酰胺(300mg/m
(2)第6天:用DAK静脉内给药
(3)第6、13、20天:用1×10
结果,SD(有效)病例中,与治疗前相比,显示出治疗后患者外周血中的RNF43肽特异性CD107a/b阳性CD3+CD8+细胞的增加比PD病例高的倾向(p=0.057)(图6(A))。此外,与治疗前相比,SD病例中与PD病例相比治疗后患者外周血中RNF43肽特异性IFN-γ阳性CD3+CD8+细胞的比例显著增加(p=0.046)(图6(B))。
[实施例2]
实施除了以下记载的步骤以外基本上与实施例1同样的步骤。
[第7天:OK432+前列腺素E2添加]
(8)在各T-175培养烧瓶中加入2ml(0.1KE/ml)溶链菌制剂(OK432,中外制药,日本),进一步添加前列腺素E2(PGE2,Nakarai Tesk,日本),使终浓度为1μg/mL。
(9)用37℃ 5%CO
通过实施例1的方法制作的成熟DC中,表示迁移能力的表面标记CCR7的表达低(图7和8)。通过作为一般的成熟DC给药途径的皮下接种可以移动至附属淋巴结的DC仅为数%左右,效率低。因此采取的是下述方法:通过血液成分单采进行大量成分采血,使DC细胞数极端增加(平均1×10
因此,我们通过对实施例1的方法进行改良,获得了不阻碍成熟化但增强作为迁移能力标记的CCR7的表达的成功。即,第7天添加OK-432和1μg/ml前列腺素E2(PGE2)后,12~24小时(实施例1的方法是仅添加OK-432后24小时)后回收DC(图9和图10)。
使用定制的UpCell(注册商标)(温度响应性细胞培养盘)对外周血单核细胞进行培养则DC的诱导效率高(图11)。进一步添加PGE2则成熟化标记CD80不会减少,CCR7的表达也上升(图12和13)。
2个例子中,UpCell的树突状细胞标记CD11c诱导效率均比现有的细胞培养盘高。此外,即使添加PGE2,效率也不会变低。
显微镜照片中也确认到,用UpCell(注册商标)培养时,呈树状的细胞(DC)比细胞培养盘多(图14)。
在DC中添加OK-432则IL-12分泌能力在24小时时最高(图15)。但24小时时作为DC迁移能力指标的CCR7的表达下降(图10)。如果在OK-432中补加PEG2,IL-12分泌能力与单独的OK432相比虽然会下降,但在某种程度上维持分泌能力的状态下,CCR7的表达增加(图10和图15)。基于上述情况,可以根据患者的状态应用以下两个治疗策略。
1).对于浅表淋巴结肿大、可以回声穿刺的患者,用通过实施例1记载的DC制造方法得到的成熟DC(抗原呈递能力高,迁移能力低)进行淋巴结内给药。
2).对于浅表淋巴结小、无法穿刺注入的患者,添加PGE2提高迁移能力,用DC进行皮下接种,以能够移动至附属淋巴结。
以往,作为癌症疫苗,是以在所谓正常细胞中也有表达、但在肿瘤细胞中过量表达的肿瘤相关抗原(tumor associatedantigens:TAA)为靶标的(HER2、MART-1、MUC1、酪氨酸酶、MAGE、NY-ESO-1等)。但几乎所有临床试验结果均没有显示出与标准疗法相比时具有持久性的结果。另一方面,典型地,作为产生体细胞DNA变异(非同义点突变、插入-缺失(所谓“indel”)、基因融合和/或移码变异)的结果的肿瘤特异性抗原的新抗原与MHC具有高预测结合亲和性,靶向正常细胞中没有的蛋白序列,能够避免胸腺的中枢性免疫耐受导致的克隆消失,可以期待高的有效性和安全性。实际上,免疫检查点抑制剂的有效性显示了与肿瘤细胞中体细胞变异负荷的相关性。
实施例1和2中得到的成熟DC也可以通过以下步骤用鉴定的新抗原肽脉冲,用于癌症治疗。
从患者肿瘤组织提取DNA、RNA,用第二代测序仪进行分析(全外显子组测序和RNA测序),进行变异蛋白质的鉴定和HLA分型。
预测新抗原―MHC结合亲和性。通过使用NetMHCpan等的方法,选择前10个亲和性高的候选肽。
各肽与DC的HLA亲和性不同,因而如果混合脉冲则发生竞争,在抗原呈递时会发生竞争。因此,第8天用选择的各肽分别对分配的成熟DC进行脉冲(图16)。
将经2小时肽脉冲的各DC再次收集在一个烧瓶中,与淋巴细胞共培养(DAK的制造)。
- 癌症治疗或预防用细胞组合物、及其制造方法
- 诱导单核细胞的树突状细胞样分化并提高抗癌免疫活性的用于癌症治疗或预防的医药组合物
