一种靶向PSMA的荧光分子探针及其制备方法和应用
文献发布时间:2023-06-19 11:54:11
技术领域
本发明属于荧光分子探针技术领域,特别涉及一种靶向PSMA的荧光分子探针及其制备方法和应用。
背景技术
前列腺癌(PCa)是男性最常见的恶性肿瘤,世界范围内男性癌症相关死亡原因的第三位。据统计,目前约有1-2%的男性死于前列腺癌。随着人类进入老龄化社会,这一威胁全球男性健康的疾病将日益严重。虽然近年来前列腺癌的早期诊断和治疗技术发展迅速,仍有较多的患者经初次治疗后再次出现血清前列腺特异性抗原(prostate specificantigen, PSA)升高或影像学进展。前列腺癌的治疗方法包括手术、放射治疗及内分泌治疗。确诊为早期局灶性前列腺癌的患者通常是能够治愈的,但确诊为或病情进展至去势抵抗性前列腺癌(mCRPC)的患者,在临床上尚无治愈的选择。初步筛查中发现超过90%的前列腺肿瘤在临床上是局部的,这些患者适合进行根治性前列腺切除术。根治性前列腺切除术的主要挑战是,肿瘤的浸润程度只能通过术后对切除组织的病理学评估确定,而术中外科医生很难发现和评估肿瘤细胞的侵袭。因此,约有20%的前列腺切除术未实现完全切除(术后病理证实阳性切缘),导致这些患者的疾病复发超过60%。前列腺癌诊断和治疗领域存在严重未满足的需求。
现有的诊断技术如
目前,靶向PSMA的分子探针主要有核素探针、荧光探针和多模态探针三大类。核素探针将与PSMA具有高亲和力的分子进行核素标记用于前列腺癌的诊断、分期、再分期和治疗,是临床上前列腺癌显像和治疗的主要策略。基于尿素的PSMA抑制剂在核素探针的研发和PET成像中起到了重要作用。FDA批准的唯一靶向PSMA的前列腺癌成像剂是ProstaScint,由
因核素探针具有放射性,目前临床上仅将其应用于前列腺癌的术前显像和治疗,未用于术中实时成像。前列腺癌手术超过手术边缘的肿瘤浸润程度只能在术后确定,因此需要一种成像方式可以在手术期间改进组织的可视化以帮助定义肿瘤边缘。荧光引导手术(FGS)是一种使用荧光来突出癌细胞并指导外科医生实时切除肿瘤的技术,能够满足这一需求。实现这一技术,需开发出优异的PSMA靶向荧光探针。这些探针应能够选择性地在前列腺肿瘤中蓄积,并且具有改善的肿瘤背景比率(TBR)。PSMA靶向荧光探针是本领域一个新的研发方向,但开发进展缓慢,尚无产品进入临床研究阶段。而且,目前的相关报道也相对较少,如经过检索,仅检索到专利CN 111362971 A公开了一种靶向PSMA 的双苯并噻二唑类化合物,其结构如下式(I)或式(II)所示:
该专利提供的苯并噻二唑类衍生物对PSMA蛋白具有高亲和力,可用于制备靶向PSMA蛋白的荧光分子探针(前列腺癌近红外二区光学成像的荧光探针、光声成像探针、光动力治疗探针),以实现对前列腺癌的早期诊断,也可用于前列腺癌切除术中的荧光术中导航或清扫。但截止目前,在研的荧光分子探针具有诸多局限之处,如:
1)小分子荧光探针半衰期较短,代谢快,在肿瘤中停留时间短,难以实现理想的TBR;
2)基于抗体的荧光探针半衰期长、清除缓慢,抗体的大分子量导致肿瘤组织渗透性差,注射后需要延迟显像(延迟2-4天)才能达到理想的TBR,造成护理费用和难度的增加。此外,单克隆抗体具有潜在的免疫原性,易产生安全性问题;
3)不能很好地满足术中肿瘤特异性成像的要求,在灵敏度和特异性上存在着较大的提升空间。
所以,开发一种新的具有优异光学、药代动力学和生物学特征的PSMA靶向荧光探针具有重要意义。
发明内容
有鉴于此,本发明的目的之一是提供一种靶向PSMA的荧光分子探针。该荧光分子探针增加了靶向探针在肿瘤组织中的积累;增强了探针与PSMA结合能力,增加了由PSMA 介导的内化;增强了信噪比。
本发明的另一个目的是提供所述靶向PSMA的荧光分子探针的制备方法。
本发明的又一个目的是提供所述靶向PSMA的荧光分子探针在制备前列腺癌诊疗药物中的应用。
为了实现上述发明目的,本发明提供以下技术方案:
一种靶向PSMA的荧光分子探针,具有以下结构:
靶头—接头1—负载
所述靶头为PSMA小分子抑制剂或寡肽底物;
所述负载为荧光基团;
所述接头1为-CH
中的一种,或其重复单元;
其中,R为-H或-CH
对于靶向荧光探针,要达到足够的TBR(肿瘤背景比,T/B),需要探针分子与靶点有足够的结合时间。研究表明,结合时间在很大程度上取决于探针-靶标复合物的解离速率,即k
本发明的目的旨在设计出新的荧光分子探针,提高TBR(肿瘤背景比,T/B)要提高TBR,增大T,或减小B,增大T的有效方法是延长探针与靶点的作用时间,延长探针与靶点的作用时间的有效方法是减小k
优选地,靶头为
优选地,接头1为:
中的一种,或其重复单元;
优选地,负载为:
进一步优选地,所述负载为:
作为一种优选实施方式,荧光分子探针的结构如式Ⅰ所示:
本发明还提供了一种所述荧光分子探针的制备方法,其包括如下步骤:
通过接头1将靶头与负载连接,得到具有所述荧光分子探针。
本发明还提供了一种如图15所示的荧光分子探针:
所述靶头为PSMA小分子抑制剂或寡肽底物;
所述负载为荧光基团;
所述白蛋白结合基团为十八烷二酸、4-(对甲苯基)丁酸中的一种;
所述接头1同所述结构1中限定;
接头2为-CH
中的一种,或其重复单元;
其中,接头1和接头2可以相同或不同。
优选地,接头2为:
中的一种,或其重复单元;
作为一种优选实施方式,荧光分子探针的结构如式Ⅱ所示:
作为一种优选实施方式,荧光分子探针的结构如式III所示:
本发明还提供了所述荧光分子探针的制备方法,包括如下步骤:通过接头1将靶头与负载连接,得到靶头-接头1-负载复合物;通过接头2将白蛋白结合基团连接至靶头-接头1-负载复合物的接头1位置,得到具有以下结构的荧光分子探针。
本发明还提供了所述荧光分子探针在制备前列腺癌诊疗药物中的应用。
本发明还提供了一种组合物,包括上述荧光分子探针和药学上可接受的载体。所述载体,本领域技术人员可根据需要进行常规选择,例如可选自磷酸二氢钠、磷酸氢二钠、氯化钠、柠檬酸、柠檬酸钠、聚山梨酯20、聚山梨酯80、注射用水等。
本发明还提供了一种药物制剂,其包括所述靶向PSMA的荧光分子探针。
本发明与现有技术相比,具有如下有益效果:
1)本发明荧光分子探针具有白蛋白结合基团,可与白蛋白结合成为复合物,体积显著增大,易形成EPR效应(enhancedpermeability and retention effect),使探针更多地沉积到肿瘤组织中,故增强了探针与PSMA结合能力,增加了由PSMA 介导的内化;
2)本发明荧光分子探针半衰期长,肿瘤富集时间长,增加了靶向探针在前列腺肿瘤组织中的积累;肿瘤荧光信号在较长时间内显著且稳定;
3)本发明荧光分子探针在体内外成像均呈现出优异的TBR。
附图说明
图1单价PSMA靶向探针与白蛋白结合形成多价探针示意图;
图2化合物5HPLC图谱;
图3化合物5MS图谱;
图4化合物9HPLC图谱;
图5化合物9MS图谱;
图6化合物10HPLC图谱;
图7化合物10MS图谱;
图8化合物11MS图谱;
图9化合物12MS图谱;
图10化合物6LnCaP皮下瘤模型活体成像;
图11化合物6离体组织和肿瘤荧光成像;
图12化合物12-HSA 22Rv1皮下瘤模型活体成像;
图13化合物11-HSA 22Rv1皮下瘤模型活体成像;
图14化合物12-HSA和化合物11-HSA离体组织和肿瘤荧光成像;
图15为本发明其中一个荧光探针分子的结构示意图。
具体实施方式
本发明公开了靶向PSMA的荧光分子探针及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供了一种荧光分子探针,具有以下结构:
靶头—接头1—负载或如图15所示的结构
“靶头”把“负载”(荧光基团)带到“靶点”。
其中靶头包括PSMA小分子抑制剂或寡肽底物。
“接头”可以是链状、环状、饱和、不饱和、芳香环或芳香杂环(含有1-4个N、O或S 原子)的一部分,由0-500个碳、氮、氧、硫或氢原子组成,构成“接头”单元可以是:-CH
中的一种,或其重复单元;
其中R可为-H或-CH
“接头1”与“接头2”可以相同或不同。
“负载”为荧光基团(近红外荧光基团和近红外二区NIR-II荧光基团):
负载为:
接头为:
中的一种。
靶头为:
“白蛋白结合基团”可以但不局限于由十八烷二酸、4-(对甲苯基)丁酸与“接头1”上的自由氨基反应而引入(1.Alessandro Zorzi,Simon J.Middendorp,Jonas Wilbs,Kaycie Deyle& Christian Heinis“Acylated heptapeptide binds albumin with highaffinity and application as tag furnishes long-acting peptides”NATURECOMMUNICATIONS|8:16092|DOI: 10.1038/ncomms16092;2.Cassandra E.Callmann等,Antitumor Activity of 1,18-Octadecanedioic Acid-Paclitaxel Complexed withHuman Serum Albumin, 10.1021/jacs.9b04272 J.Am.Chem.Soc.),增强分子的循环稳定性。
优选分子探针结构(化合物6)为:
更优选地,荧光分子探针的结构如式I所示:
含接头2和白蛋白结合基团的优选分子探针结构(化合物12)为:
含接头2和白蛋白结合基团的优选分子探针结构(化合物11)为:
本技术发明设计合成的靶向荧光分子探针用于但不限于:(1)前列腺癌的实体肿瘤识别、边界识别及淋巴结显影;(2)膀胱癌的实体肿瘤识别、边界识别及淋巴结显影; (3)肾肿瘤实体及边界的识别;(4)肾上腺肿瘤的识别;(5)阴茎癌前哨淋巴结显影。
本发明提供的靶向PSMA的荧光分子探针及其制备方法和应用中所用试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1荧光分子探针(化合物6)的合成方法
化合物2:
树脂活化:将化合物1(Fmoc-Lys(Dde)-Wang resin,购于南京肽业生物科技有限公司,R61124,0.3-0.8mmol/g,100-200mesh,1g)首先用六氢吡啶/DMF混合溶剂I(体积比25%:75%)去除N端Fmoc保护基使N端成为自由氨基。
接入氨基酸:将N,N二琥珀酰亚胺基碳酸酯(3.2mmol)和DIPEA(10mmol)和 H-Glu(OtBu)-OtBu(3.2mmol)溶于20ml DMF,加入到上述经12小时的树脂(脱Fmoc 保护的化合物1),反应24小时得化合物2。
化合物3、4、5采用同上类似的接枝操作:
化合物3:用2%水合肼/DMF溶液(水合肼:DMF=2%:98%)去除树脂(即化合物 2)上Lys的侧链Dde保护基后,加入3倍当量Fmoc-2-Nal-OH/HOBt/DIC(即 Fmoc-2-Nal-OH、HOBt和DIC的用量均为树脂的摩尔量的3倍)常温下反应24小时,进行接枝反应引入2-Nal氨基酸残基。
化合物4:用25%六氢吡啶/DMF(六氢吡啶/DMF体积比25%:75%)去除树脂(即化合物3)上Fmoc保护基使2-Nal的N端成为自由氨基,加入3倍当量N-Boc-反-4-氨甲基环己烷羧酸/HOBt/DIC(即N-Boc-反-4-氨甲基环己烷羧酸:HOBt:DIC的用量均为树脂的摩尔量的3倍)常温下反应24小时,进行接枝反应引入反-4-氨甲基环己烷羧酸。
化合物5:使用切割试剂(三氟乙酸:H
采用反相高效液相色谱仪对粗品进行纯化(纯度95%,收率65%)。色谱柱型号:Agela C18(10μm,
化合物6:向化合物5的水溶液(浓度:0.01mg/μL)50μL中加入0.01M Na
实施例2荧光分子探针(化合物11和12)的合成方法
化合物7:用25%六氢吡啶/DMF(体积比,含义同上)去除化合物3中Fmoc保护基使2-Nal的N端成为自由氨基,加入3倍当量N-Fmoc-反-4-氨甲基环己烷羧酸/HOBt/DIC (即指N-Fmoc-反-4-氨甲基环己烷羧酸、HOBt、DIC的用量均为树脂摩尔量的3倍)常温下反应24小时,进行接枝反应引入反-4-氨甲基环己烷羧酸。
化合物8:用25%六氢吡啶/DMF(体积比)去除化合物7上Fmoc保护基,加入3倍当量N-Fmoc-N'-[1-(4,4-二甲基-2,6-二氧代环己亚基)乙基]-赖氨酸/HOBt/DIC(即指 N-Fmoc-N'-[1-(4,4-二甲基-2,6-二氧代环己亚基)乙基]-赖氨酸/HOBt/DIC的用量均为树脂摩尔量的3倍)常温下反应24小时,进行接枝反应引入赖氨酸残基。
化合物9:首先,用2%水合肼/DMF(水合肼:DMF=2%:98%)溶液去除化合物8 上Lys的侧链Dde保护基后,加入10倍当量1,18-Octadecanedioic Acid/HOBt/DIC(即指 1,18-Octadecanedioic Acid、HOBt、DIC的用量均为树脂摩尔量的10倍)常温下反应24小时,进行接枝反应引入2-Nal氨基酸残基。
其次,用25%六氢吡啶/DMF(体积比)去除化合物9末端的Fmoc保护基。
使用切割试剂(三氟乙酸:H
采用反相高效液相色谱仪对粗品进行纯化(纯度95%,收率54%)。色谱柱型号:Agela C18(10μm,
化合物10:首先,用2%水合肼/DMF(水合肼:DMF体积比为2%:98%)溶液去除化合物8上Lys的侧链Dde保护基后,加入10倍当量4-(p-Tolyl)butyric acid/HOBt/DIC(即 4-(p-Tolyl)butyric acid、HOBt、DIC的用量均为树脂摩尔量的10倍)常温下反应24小时进行接枝反应,引入2-Nal氨基酸残基。
其次,用25%六氢吡啶/DMF(体积比25%:75%)去除末端的Fmoc保护基。
使用切割试剂(三氟乙酸:H
采用反相高效液相色谱仪对粗品进行纯化(纯度95%,收率47%)。色谱柱型号:Agela C18(10μm,
化合物11:向化合物9的水溶液(浓度:0.01mg/μL)50μL中加入0.01M Na
化合物12:向化合物10的水溶液(浓度:0.01mg/μL)50μL中加入0.01M Na
化合物11-HSA和化合物12-HSA:
1.将化合物11溶于去离子水中。将浓度为0.03M的HSA(Sigma A1887)溶解在去离子水中。向5mL离心管中添加20μL(0.06M)的11的水溶液,然后快速添加 200μL的HSA溶液以产生5:1摩尔比的11-HSA溶液。冻干后得到白色粉末。
2.将化合物12溶于去离子水中。将浓度为0.03M的HSA(Sigma A1887)溶解在去离子水中。向5mL离心管中添加20μL(0.06M)的12的水溶液,然后快速添加 200μL的HSA溶液以产生5:1摩尔比的12-HSA溶液。冻干后得到白色粉末。
试验例
1、建立肿瘤模型
所有动物实验操作均在苏州大学实验动物中心和苏州大学动物保护及使用委员会批准下进行。为了建立荷LNCaP/22Rv1皮下肿瘤模型,实验使用健康的雄性Balb/C裸鼠(18~22g),在小鼠右侧腋下注射50μL的LNCaP/22Rv1细胞悬浮液(1×10
2、配制注射液
通过称重称取化合物6固体粉末,溶于生理盐水中,配置成0.24μmol/mL的溶液,取其中部分溶液通过生理盐水稀释配置成0.12μmol/mL和0.012μmol/mL的溶液。
通过称重称取化合物11和12固体粉末,溶于生理盐水中,配置成0.06μmol/mL的溶液,取其中部分溶液通过生理盐水稀释配置成0.03mol/mL的溶液。
3、给药并成像
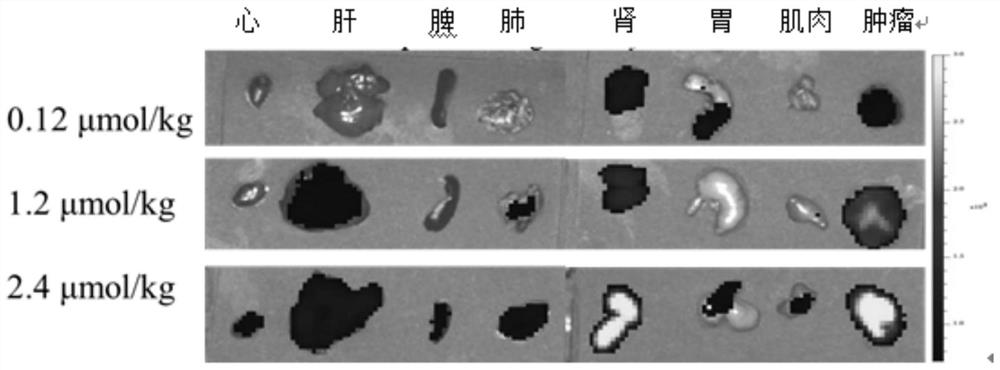
6只LNCaP皮下瘤模型的裸鼠随机分成3组,每组2只。通过尾静脉给药,将配制好的3组不同浓度(0.012μmol/kg、0.12μmol/kg、0.24μmol/kg)的化合物6溶液注射到小鼠体内,每只200μL。12只22Rv1皮下瘤模型的裸鼠随机分成4组,每组3只。通过尾静脉给药,将配制好的11和12各两组不同浓度(0.03μmol/mL、0.06μmol/mL)的溶液注射到小鼠体内,每只200μL。用异氟烷麻醉,使用小动物近红外成像系统(IVIS Lumina II)扫描拍摄并分析(Ex.740nm和Em.820nm)。在成像过程中,一直通3%的异氟烷来通过鼻锥系统麻醉小鼠。48小时后,将小鼠颈椎脱臼法处死后,收集肿瘤及心、肝、脾、肺、肾、胃、肌肉和肿瘤,清洗、干燥。通过IVIS Lumina II成像系统获取荧光图片。
小鼠成像图见图8-12。
结果显示,化合物6在注射24小时后开始在肿瘤部位有明显富集,48小时后肿瘤与背景的对比更为强烈。化合物12-HSA在注射4小时后开始在肿瘤部位有明显富集,化合物11-HSA在低浓度0.3μmol/kg下注射4小时后也有明显富集,表明以上3个优选化合物对PSMA阳性肿瘤均具有靶向性,可用于肿瘤近红外光学成像,其中化合物12-HSA和化合物11-HSA可显著缩短肿瘤成像时间。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种靶向PSMA的荧光分子探针及其制备方法和应用
- 一种PSMA靶向核素/荧光双模态配体和分子探针与应用
