用于制备混合的过敏原组合物的方法
文献发布时间:2023-06-19 11:57:35
相关申请的交叉引用
本申请要求于2018年11月30日提交的美国临时专利申请号62/773,643的权益和优先权,该临时申请的公开内容出于所有目的通过引用整体并入本文。
背景技术
过敏是免疫系统的病症,其特征在于对通常非致病性环境物质发生过敏反应。过敏是由过敏原引起的,这些过敏原可能存在于多种来源中,包括但不限于花粉或其他植物组分,粉尘,霉菌或真菌,食品,添加剂,乳胶,输血反应,动物或鸟毛屑,昆虫毒液,放射性造影剂,药物或化学品。常见的过敏反应包括湿疹、荨麻疹、花粉症和哮喘。诸如花粉症的轻度过敏在人群中非常普遍,并引起诸如过敏性结膜炎、发痒和流鼻涕的症状。在某些人中,如果不及时治疗,对饮食过敏原、环境过敏原或药物的严重过敏可能导致危及生命的过敏反应。
食物过敏是对食物例如食物蛋白质的不良免疫反应。常见的食物过敏原存在于贝类、花生、坚果、鱼、牛乳、鸡蛋、大豆和新鲜水果(例如草莓、芒果、香蕉和苹果)中。免疫球蛋白E(IgE)介导的食物过敏分类为I型立即超敏反应。这些过敏反应有急性发作(早至几秒),并且伴随的症状可能包括:血管性水肿(眼睑、面部、嘴唇、舌头、喉和气管的软组织肿胀);荨麻疹;口腔、喉咙、眼睛或皮肤的发痒;胃肠道症状,例如恶心,呕吐,腹泻,胃痉挛或腹痛;鼻漏或鼻塞;喘息;气短;吞咽困难;和过敏症,这是一种严重的全身过敏反应,其可能导致死亡。据估计,在21岁以下的儿童中,每12名儿童中就有1名被诊断出食物过敏,并且每年用于食物过敏反应的医疗保健费用超过240亿美元,这在很大程度上是由于仅对于食物引起的过敏症,美国每年约有90,000名急诊室就诊。此外,由于致命的食物过敏,每年都有死亡发生。
因此,需要能够预防和/或治疗过敏以及在意外暴露于食物过敏原时减少过敏反应的过敏原组合物,以及制备过敏原组合物以预防和/或治疗过敏的方法。
发明内容
本公开内容至少部分涉及一种制备可用于口服免疫疗法的具有一致的身份和效能的无菌混合过敏原药物产品的方法,该产品基本上不含可复制的生物体。例如,在某些实施方案中,所述方法包括:分别辐照2至20种不同的原始完全食物过敏原物质中的每一种,其中辐照包括对每种单独的原始完全食物过敏原物质施加电离辐射,从而产生2至20种单独的过敏原药物物质,其各自基本上不含可复制的生物体,并且其中每种单独的过敏原药物物质保留基本上完整的过敏原蛋白;和将2至20种单独的过敏原药物物质混合在一起,从而获得混合过敏原药物产品。
在某些实施方案中,本公开内容提供了一种方法,其中单独的原始完全食物过敏原物质选自榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。
在另一个实施方案中,本公开内容提供了一种方法,其中混合还包括将2至20种单独的过敏原药物物质与一种或多种填充剂和/或药学上可接受的赋形剂混合。
在某些实施方案中,所述方法提供施加电离辐射,其中该电离辐射为β辐射、γ辐射、α辐射、X辐射或其组合。在一些实施方案中,以约0.15千戈瑞至约30千戈瑞的一个或多个剂量施加电离辐射。在某些实施方案中,施加电离辐射使原始完全食物过敏原物质的温度每千戈瑞剂量升高0.25℃至约0.5℃。在进一步的实施方案中,电离辐射由具有约0.5MeV至约10MeV的能量的粒子发射器产生。在电离辐射是β辐射的实施方案中,β辐射是单面或双面的。在电离辐射是γ辐射的实施方案中,γ辐射由钴60或铯137产生。在电离辐射是X辐射的实施方案中,使用钨或钽产生X辐射。在某些实施方案中,以5.0、7.5或15千戈瑞或更大的剂量施加β辐射,并且可以一次或多于一次施加β辐射。
在某些实施方案中,本公开内容的方法还提供了研磨混合过敏原药物产品以获得基本上一致的粒度。在其他实施方案中,所述方法进一步包括研磨一种或多于一种原始完全食物过敏原物质。在其他实施方案中,所述方法进一步包括研磨一种或多于一种单独的过敏原药物物质。
在其他实施方案中,本公开内容的方法还包括在辐照之前将2至20种原始完全食物过敏原物质中的每一种独立包装到单独的辐照相容包装中。
在本公开内容的其他实施方案中,2至20种单独的过敏原药物物质中的每一种具有小于约1000CFU/g、小于约100CFU/g或小于约10CFU/g的需氧细菌生物体。在一些实施方案中,2至20种单独的过敏原药物物质中的每一种具有小于约10CFU/g的肠杆菌科(Enterobacteriaceae)生物体。在其他实施方案中,2至20种单独的过敏原药物物质中的每一种具有小于约100CFU/g或小于约10CFU/g的酵母和/或霉菌。
在当前公开的方法的某些实施方案中,2至20种单独的过敏原药物物质中的每一种具有约1%至约10%的水分。在一些实施方案中,2至20种单独的过敏原药物物质中的至少一种具有约4%至约7%的水分。在其他实施方案中,2至20种单独的过敏原药物物质中的每一种均具有约0.2至约0.6的水活度。
在本公开内容的其他实施方案中,与相应的原始完全食物过敏原物质相比,每种单独的过敏原药物物质具有基本上相同的蛋白质完整性,其中所述蛋白质完整性通过SDS-PAGE或ELISA测量。
在某些实施方案中,通过ELISA测试每种原始完全食物过敏原物质的蛋白质含量/效能和/或身份。
在其他实施方案中,每种单独的过敏原药物物质在施用给患者时具有与基本上相同蛋白质量的相应的原始完全食物过敏原物质的施用基本上相似的过敏原作用,其中通过患者中的免疫反应来测量过敏原作用。
在本公开内容的方法的某些实施方案中,混合过敏原药物产品包含6至20种单独的过敏原药物物质。
在某些实施方案中,本公开内容的方法提供了混合过敏原药物产品,其包含按蛋白质质量计约0.1mg至约500mg的每种单独的过敏原药物物质。在一些实施方案中,混合过敏原药物产品包含15或16种单独的过敏原药物物质,其中每种单独的过敏原药物物质以与另一种单独的过敏原药物物质的按蛋白质重量计约2:1至约1:2的比例存在。在其他实施方案中,混合过敏原药物产品包含以总蛋白重量计基本上相等量的单独的过敏原药物物质。
在本公开内容的一些实施方案中,单独的过敏原药物物质稳定至少6个月。在进一步的实施方案中,单独的过敏原药物物质稳定至少一年。在其他实施方案中,混合过敏原药物产品稳定至少6个月。在另外的实施方案中,混合过敏原药物产品稳定至少一年。
在某些实施方案中,本公开内容提供了一种制备基本上不含可复制的生物体的无菌混合过敏原药物产品的方法,所述方法包括:提供2至20种经辐照的单独的过敏原药物物质,其各自基本上不含可复制的生物体,并且其中每种单独的过敏原药物物质保留基本上完整的过敏原蛋白;和将2至20种单独的过敏原药物物质混合在一起,从而获得混合过敏原药物产品。在另一个实施方案中,本公开内容提供了一种制备基本上不含可复制的生物体的混合过敏原药物产品的方法,所述方法包括:提供6至20种不同的原始完全食物过敏原物质;将6至20种不同的原始完全食物过敏原物质混合在一起以产生大块物质(bulksubstance);用电离辐射辐照所述大块物质,从而获得混合过敏原药物产品。
还公开了一种通过本文公开的任何一种方法制备的基本上不含可复制的生物体的混合过敏原药物产品。还考虑了通过本文公开的任何一种方法制备的混合过敏原药物产品,其用于儿童或成人的食物过敏的口服免疫治疗。在另一个实施方案中,本文公开的混合过敏原药物产品用于与儿童或成人不过敏的食物混合。
在另一个实施方案中,本公开内容提供了一种制备基本上不含可复制的生物体的无菌过敏原药物产品的方法,所述方法包括:辐照原始完全食物过敏原物质,其中辐照包括将电离辐射施加至原始完全食物过敏原物质,从而产生基本不含可复制的生物体的单独的过敏原药物物质,并且其中每种过敏原药物物质保留基本上完整的过敏原蛋白质。在某些实施方案中,原始完全食物过敏原物质选自榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。
附图简要说明
图1A显示了未辐照和β辐照(电子束辐照)的榛子粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的榛子粉(7.5kGy);泳道3=未辐照的榛子粉。图1B显示了图1A的SDS-PAGE的光密度测定法。
图2A显示了未辐照和β辐照(电子束辐照)的腰果粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的腰果粉(7.5kGy);泳道3=未辐照的腰果粉。图2B显示了图2A的SDS-PAGE的光密度测定法。
图3A显示了未辐照和β辐照(电子束辐照)的开心果粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的开心果粉(7.5kGy);泳道3=未辐照的开心果粉。图3B显示了图3A的SDS-PAGE的光密度测定法。
图4A显示了未辐照和β辐照(电子束辐照)的胡桃粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的胡桃粉(7.5kGy);泳道3=未辐照的胡桃粉。图4B显示了图4A的SDS-PAGE的光密度测定法。
图5A显示了未辐照和β辐照(电子束辐照)的山核桃粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的山核桃粉(7.5kGy);泳道3=未辐照的山核桃粉。图5B显示了图5A的SDS-PAGE的光密度测定法。
图6A显示了未辐照和β辐照(电子束辐照)的杏仁粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的杏仁粉(7.5kGy);泳道3=未辐照的杏仁粉。图6B显示了图6A的SDS-PAGE的光密度测定法。
图7A显示了未辐照和β辐照(电子束辐照)的花生粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的花生粉(7.5kGy);泳道3=未辐照的花生粉。图7B显示了图7A的SDS-PAGE的光密度测定法。
图8A显示了未辐照和β辐照(电子束辐照)的芝麻粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的芝麻粉(7.5kGy);泳道3=未辐照的芝麻粉。图8B显示了图8A的SDS-PAGE的光密度测定法。
图9A显示了未辐照和β辐照(电子束辐照)的大豆蛋白粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的大豆蛋白粉(7.5kGy);泳道3=未辐照的大豆蛋白粉。图9B显示了图9A的SDS-PAGE的光密度测定法。
图10A是未辐照和电子束辐照的鸡蛋粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2和3=未辐照的鸡蛋粉;泳道4和5=电子束辐照的鸡蛋粉(7.5kGy);以及泳道6和7=电子束辐照的鸡蛋粉(15kGy)。图10B显示了图10A的SDS-PAGE的光密度测定法。
图11A是未辐照和β辐照(电子束辐照)的牛乳蛋白分离物的SDS-PAGE。泳道1和8=蛋白质阶梯标准物;泳道2和3=未辐照的牛乳蛋白分离物;泳道4和5=电子束辐照的牛乳分离蛋白分离物(7.5kGy);以及泳道6和7=电子束辐照的牛乳蛋白分离物(15kGy)。图11B显示了图11A的SDS-PAGE的光密度测定法。
图12A显示了未辐照和β辐照(电子束辐照)的小麦蛋白粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的小麦蛋白粉(7.5kGy);泳道3=未辐照的大豆粉。图12B显示了图12A的SDS-PAGE的光密度测定法。
图13A显示了未辐照和β辐照(电子束辐照)的鲑鱼蛋白质粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的鲑鱼蛋白粉(7.5kGy);泳道3=未辐照的鲑鱼蛋白粉。图13B显示了图13A的SDS-PAGE的光密度测定法。
图14A显示了未辐照和β辐照(电子束辐照)的鳕鱼粉的SDS-PAGE。泳道1=蛋白质阶梯标准物;泳道2=电子束辐照的鳕鱼粉(7.5kGy);泳道3=未辐照的鳕鱼粉。图14B显示了图14A的SDS-PAGE的光密度测定法。
图15A显示了未辐照和β辐照(电子束辐照)的虾蛋白粉的SDS-PAGE。泳道1和4=蛋白质阶梯标准物;泳道2=电子束辐照的虾蛋白粉(7.5kGy);泳道3=未辐照的虾蛋白粉。图15B显示了图15A的SDS-PAGE的光密度测定法。
图16是显示未辐照的榛子粉(空心圆)和电子束辐照的榛子粉(7.5kGy,实心三角形)的粒度分布的线图。
图17是显示未辐照的腰果粉(空心圆)和电子束辐照的腰果粉(7.5kGy,实心三角形)的粒度分布的线图。
图18是显示未辐照的开心果粉(空心圆)和电子束辐照的开心果粉(7.5kGy,实心三角形)的粒度分布的线图。
图19是显示未辐照的胡桃粉(空心圆)和电子束辐照的胡桃粉(7.5kGy,实心三角形)的粒度分布的线图。
图20是显示未辐照的山核桃粉(空心圆)和电子束辐照的山核桃粉(7.5kGy,实心三角形)的粒度分布的线图。
图21是显示未辐照的杏仁粉(空心圆)和电子束辐照的杏仁粉(7.5kGy,实心三角形)的粒度分布的线图。
图22是显示未辐照的花生粉(空心圆)和电子束辐照的花生粉(7.5kGy,实心三角形)的粒度分布的线图。
图23是显示未辐照的芝麻粉(空心圆)和电子束辐照的芝麻粉(7.5kGy,实心三角形)的粒度分布的线图。
图24是显示未辐照的大豆蛋白粉(空心圆)和电子束辐照的大豆蛋白粉(7.5kGy,实心三角形)的粒度分布的线图。
图25是显示未辐照的鸡蛋粉(空心圆),电子束辐照的鸡蛋粉(7.5kGy,实心三角形)和电子束辐照的鸡蛋粉(15kGy,实心正方形)的粒度分布的线图。
图26是显示未辐照的牛乳蛋白分离物(空心圆),电子束辐照的牛乳蛋白分离物(7.5kGy,实心三角形)和电子束辐照的牛乳蛋白分离物(15kGy,实心正方形)的粒度分布的线图。
图27是显示未辐照的小麦蛋白粉(空心圆)和电子束辐照的小麦蛋白粉(7.5kGy,实心三角形)的粒度分布的线图。
图28是显示未辐照的鲑鱼蛋白粉(空心圆)和电子束辐照的鲑鱼蛋白粉(7.5kGy,实心三角形)的粒度分布的线图。
图29是显示未辐照的鳕鱼粉(空心圆)和电子束辐照的鳕鱼粉(7.5kGy,实心三角形)的粒度分布的线图。
图30是显示未辐照的虾蛋白粉(空心圆)和电子束辐照的虾蛋白粉(7.5kGy,实心三角形)的粒度分布的线图。
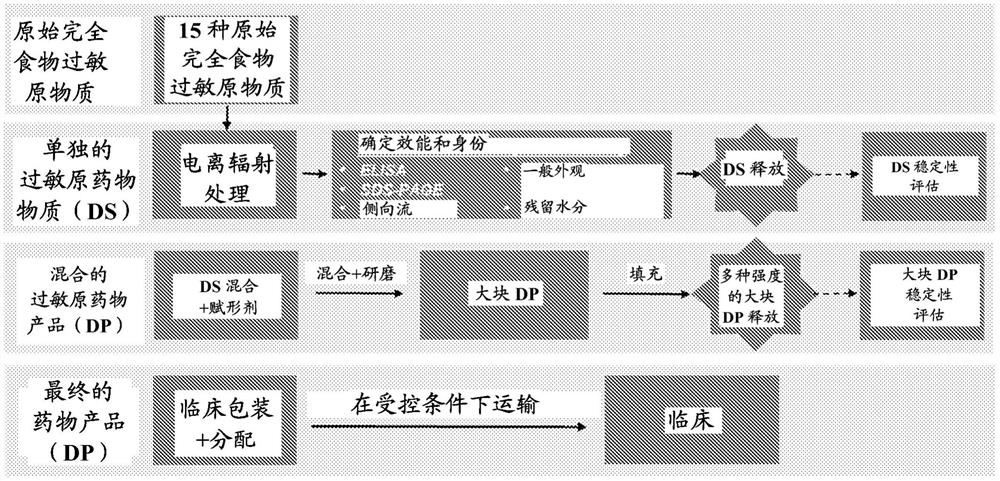
图31是显示用于产生临床级混合过敏原药物产品的制造过程的流程图。
图32是显示杏仁粉药物物质与杏仁粉参考标准品、非特异性食物过敏原物质(虾粉)和赋形剂对照(异麦芽酮糖醇(isomalt))相比的代表性ELISA曲线的线图。
发明详述
本文公开了制备基本上不含可复制的生物体的无菌混合过敏原药物产品的方法。
如本文所用,“原始完全食物过敏原物质”是指含有所有可能的抗原组分(例如,过敏原蛋白)的食物物质。原始完全食物过敏原物质可以包括但不限于未加工或加工的食物物质、浓缩的食物物质和分离的食物物质。
如本文所用,“过敏原蛋白”是食物过敏原物质的抗原组分,当施用至患者时,其直接或间接地负责引起生物致敏反应。过敏原蛋白可以包括但不限于坚果蛋白,例如榛子蛋白(例如Cor a 1,Cor a 2,Cor a 6,Cor a 8,Cor a 9,Cor a 10,Cor a 11,Cor a 12,Cora 13和Cor a 14),腰果蛋白(例如Ana o 1,Ana o 2和Ana o 3),开心果蛋白(例如Pis v1,Pis v 2,Pis v 3,Pis v 4和Pis v 5),胡桃蛋白(例如Jug r 1,Jug r 2,Jug r 3,Jugr 4,Jug r 5,Jug r 6,Jug r7和Jug r 8,Jug n1,Jug n 2和Jug n 4),山核桃蛋白(例如Car i 1,Car i 2和Car i 4),杏仁蛋白(例如Pru du 3,Pru du 4,Pru du 5,Pru du 6和Pru du 8)和花生蛋白(例如Ara h 1,Ara h 2,Ara h 3,Ara h 4,Ara h 5,Ara h 6,Ara h7,Ara h 8,Ara h 9,Ara h 10,Ara h 11,Ara h 12,Ara h 13,Ara h 14,Ara h 15,Ara h16和Ara h 17)。过敏原蛋白还可包括但不限于动物蛋白,例如卵蛋白(例如,Gal d 1,Gald 2,Gal d 3,Gal d 4,Gal d 5,Gal d 6,Gal d 7,Gal d d 8,Gal d 9,Gal d 10),牛乳蛋白(例如Bos d 2,Bos d 3,Bos d4,Bos d 5,Bos d 6,Bos d 7,Bos d 8,Bos d 9,Bos d10,Bos d 11和Bos d 12),鲑鱼蛋白(例如Onc k 5,Sal s 1,Sal s 2和Sal s 3),鳕鱼蛋白(例如pGad c 1,Gad m 1,Gad m 2和Gad m 3)和虾蛋白(例如,Cra c 1,Cra c 2,Cra c4,Cra c 5,Cra c 6,Cra c 8,Lit v1,Lit v 2,Lig v 3,Lit v 4,Met e 1,Pan b 1,Pena 1,Pen i 1,Pen m 1,Pen m 2,Pen m 3,Pen m 4和Pen m 6)。过敏原蛋白可进一步包括但不限于非坚果植物蛋白,例如小麦蛋白(例如,Tri a 12,Tri a 14,Tri a 15,Tri a 17,Tri a 18,Tri a 19,Tri a 20,Tri a 21,Tri a 25,Tri a 26,Tri a 27,Tri a 28,Tri a29,Tri a 30,Tri a 31,Tri a 32,Tri a 33,Tri a 34,Tri a 35,Tri a 36,Tri a 37,Tri a 39,Tri a 40,Tri a 41,Tri a 42,Tri a 43,Tri a 44和Tri a 45),大豆蛋白(例如Gly m 1,Gly m 1.0101,Gly m 2,Gly m 3,Gly m 4,Gly m 5,Gly m 6,Gly m 7和Gly m8),芝麻籽蛋白(例如,Ses i 1,Ses i 2,Ses i 3,Ses i 4,Ses i 5,Ses i 6和Ses i 7),猕猴桃蛋白(例如,Act c 1,Act c 5,Act c 8,Act c 10,Act d 1,Act d 2,Act d 3,Actd 4,Act d 5,Act d 6,Act d 7,Act d 8,Act d 9,Act d 10,Act d 11,Act d 12和Act d13),胡萝卜蛋白(例如Dau c 1,Dau c 4和Dau c 5),芹菜蛋白(例如Api q 1,Api q 2,Apiq 3,Api q 4,Api q 5和Api q 6),核果蛋白(例如Pru ar 1,Pru ar 3,Pru av 1,Pru av2,P ru av 3,Pru av 4,Pru p 1,Pru p 2,Pru p 3,Pru p 4,Pru p 7和Pru d 3)和燕麦蛋白。
术语“电离辐射”是指具有足够能量以从原子或分子去除电子从而对其进行电离的辐射。在本公开内容的上下文中,“电离辐射”特别是指具有足够的能量以电离和破坏微生物的DNA的辐射。
如本文所用,“单独的过敏原药物物质”是指已经经受足够的一个或多个剂量的电离辐射以使其基本上不含可复制的生物体的完全食物过敏原物质。
“可复制的生物体”是指能够在平板培养物中繁殖/复制/繁衍并产生菌落形成单位(CFU)的生物体。
例如,目前公开的是一种制备基本上不含可复制的生物体的无菌混合过敏原药物产品的方法,所述方法包括:分别辐照2至20种不同的原始完全食物过敏原物质中的每一种,其中辐照包括将电离辐射施加至每种单独的原始完全食物过敏原物质,从而产生2至20种单独的过敏原药物物质,其各自基本上不含可复制的生物体,并且其中每种单独的过敏原药物物质保留基本上完整的过敏原蛋白;和将2至20种单独的过敏原药物物质混合在一起,从而获得混合过敏原药物产品。
在某些实施方案中,所公开的方法包括分别辐照2至20,例如,4至20、6至20、8至20、10至20、12至20、14至20、16至20、18至20、2至18、4至18、6至18、8至18、10至18、12至18、14至18、16至18、2至16、4至16、6至16、8至16、10至16、12至16或14至16种不同的原始完全食物过敏原物质中的每一种。例如,辐照2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种不同的原始完全食物过敏原物质。在某些实施方案中,辐照2种不同的原始完全食物过敏原物质。在特定的实施方案中,辐照15或16种不同的原始完全食物过敏原物质。应当理解,在辐照之前可以组合两种或更多种原始完全食物过敏原物质。例如在辐照之前可以组合4至20、8至20、10至20、12至20、14至20、16至20、18至20、2至18、4至18、6至18、8至18、10至18、12至18、14至18、16至18、2至16、4至16、6至16、8至16、10至16、12至16或14至16种不同的原始完全食物过敏原物质。在另一实例中,在辐照之前可以组合2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种不同的原始完全食物过敏原物质。
本公开内容的方法可以包括分别辐照本文所述的任何原始完全过敏原药物物质。例如,在某些实施方案中,原始完全食物过敏原物质选自坚果、种子、豆类、蛋、乳制品、谷物、鱼和甲壳类。在特定的实施方案中,原始完全食物过敏原物质选自榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。在某些实施方案中,原始完全过敏原药物物质是榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。在其他实施方案中,原始完全过敏原药物物质是蛋和牛乳。应当理解,本文考虑的单独的原始完全食物过敏原物质可以各自以膳食、面粉、粉末和/或蛋白质浓缩物形式存在。
如本公开内容中所设想的,分别辐照2至20种不同的原始完全食物过敏原物质(例如4至20、6至20、8至20、10至20、12至20、14至20、16至20、18至20、2至18、4至18、6至18、8至18、10至18、12至18、14至18、16至18、2至16、4至16、6至16、8至16、10至16、12至16或14至16种原始完全食物过敏原物质)包括对每种单独的原始完全食物过敏原物质施加电离辐射。在某些实施方案中,施加电离辐射包括施加β辐射,也称为电子辐射或电子束辐射。例如,β辐射以单面或双面方式施加。在本公开内容的其他实施方案中,施加电离辐射包括施加例如由钴60或铯137产生的γ辐射。在其他实施方案中,施加电离辐射包括施加α辐射。在另一个实施方案中,施加电离辐射包括施加例如使用钨或钽产生的X辐射。在又一个实施方案中,可以将选自β辐射、γ辐射、α辐射和X辐射的任何两种或更多种电离辐射组合施加至2至20种不同的原始完全食物过敏原物质。
在某些实施方案中,通过具有约0.5MeV至约10MeV的能量的粒子发射器来产生施加至2至20种不同的原始完全食物过敏原物质中的每一种的电离辐射。
本文公开的进一步预期的方法可以包括分别辐照2至20种不同的原始完全食物过敏原物质中的每一种,以使单独的原始完全食物过敏原物质上或单独的原始完全食物过敏原物质中的任何微生物不可复制。本公开内容中预期的辐射剂量为约0.15千戈瑞至约30千戈瑞。例如,在特定实施方案中,电离辐射是以5.0kGy、7.5kGy、15kGy或更大的剂量施加的β辐射。在另一个实施方案中,电离辐射是一次或多次施加的β辐射。应当理解的是,这样的预期剂量足以使单独的原始完全食物过敏原物质上或单独的原始完全食物过敏原物质中的任何微生物都不可复制,并且在美国联邦药品管理局设定的食品辐照应用设定的最大允许剂量之内。此外,将理解的是,施加电离辐射使原始完全食物过敏原物质中的温度每千戈瑞剂量辐射升高约0.25℃至约0.5℃。
在某些实施方案中,在施加电离辐射之前,将2至20种原始完全食物过敏原物质中的每一种独立地包装在辐照相容包装中。“辐照相容”应理解为是指对包装材料施加与同时对包装在其中的单独的原始完全食物过敏原物质中的每一种所施加的相同的电离辐射不会导致包装材料发生影响其作为化学或微生物污染的屏障的完整性和功能性的变化。此外,“辐照相容”应理解为是指暴露于电离辐射不会改变包装以导致将包装中的化学物质被添加到包装在其中的单独的原始完全食物过敏原物质中。例如,可以将2至20种原始完全食物过敏原物质中的每一种包装在辐照相容包装中,其中将10kGy的电离辐射同时施加至辐照相容包装和包装在其中的单独的原始完全食物过敏原物质。进一步预想了,只要将每种单独的过敏原药物物质保持包装在辐照相容包装中并且不损害辐照相容包装的完整性,就可以保持在施加电离辐射之后每种单独的过敏原药物物质的无菌性。
在本公开内容的方法中,用电离辐射分别辐照2至20种不同的原始完全食物过敏原物质中的每一种产生2至20种单独的过敏原药物物质,其各自基本上不含可复制的生物体。在某些实施方案中,本公开内容的单独的过敏原药物物质基本上不含可复制的细菌、酵母和/或霉菌。例如,2至20种单独的过敏原药物物质中的每一种具有小于约1000CFU/g、小于约100CFU/g或小于约10CFU/g的需氧细菌生物。在另一个实例中,2至20种单独的过敏原药物物质中的每一种具有小于约10CFU/g的肠杆菌科生物体。在又一个实例中,2至20种单独的过敏原药物物质中的每一种具有小于约100CFU/g或小于约10CFU/g的酵母。在另一个实例中,2至20种单独的过敏原药物物质中的每一种具有小于约100CFU/g或小于约10CFU/g的霉菌。
预期将电离辐射施加至2至20种不同的原始完全食物过敏原物质中的每一种将基本上不会改变蛋白质的完整性。例如,在某些实施方案中,与通过SDS-PAGE测量的相应的原始完全食物过敏原物质相比,每种单独的过敏原药物物质具有基本上相同的蛋白质完整性。在另外的实施方案中,预期通过ELISA和/或侧向流动测定法来测试每种原始完全食物过敏原物质和/或每种单独的过敏原药物物质的蛋白质含量、效能和/或身份。如本文所用,“效能”是指原始完全食物过敏原物质或单独的过敏原药物物质与对所述原始完全食物过敏原物质或单独的过敏原药物物质具有结合特异性的抗体反应的能力。在一些实施方案中,可以对效能进行定量以在临床试验期间以及在药物产品商业化期间在临床试验之外提供混合过敏原药物产品中单独的过敏原药物物质的一致浓度。如本文所用,“侧向流动测定法”是指用于检测样品中原始完全食物过敏原物质或单独的过敏原药物物质的存在的免疫色谱测定法。
还可以预期的是,向2至20种不同的原始完全食物过敏原物质中的每一种施加电离辐射基本上不会影响每种单独的过敏原药物物质在施用至患者时引起过敏原作用的能力。在某些实施方案中,每种单独的过敏原药物物质在施用给患者时具有与基本上相同蛋白质量的相应的原始完全食物过敏原物质的施用基本上相似的过敏原作用。在某些实施方案中,通过患者中的免疫反应来测量过敏原作用,例如,测量IgE或细胞因子的产生,或测量响应于每种单独的过敏原药物物质的施用的免疫细胞活化。在其他实施方案中,通过体外免疫反应来测量过敏原作用,例如,测量免疫细胞活化后IgE或细胞因子的产生,或测量免疫细胞培养物的活化。
在某些实施方案中,2至20种经辐照的单独的过敏原药物物质中的每一种具有约1%至约10%的水分。例如,2至20种单独的过敏原药物物质中的至少一种可具有约4%至约7%的水分。在另一个实例中,2至20种经辐照的单独的过敏原药物物质中的每一种具有约4%至约7%的水分。在其他实施方案中,2至20种经辐照的单独的过敏原药物物质中的每一种具有约0.2至约0.6的水活度。“水活度”应理解为在相同条件下每种单独的过敏原药物物质的蒸气压与蒸馏水的蒸气压之间的比率。将理解的是,水活度是不与每种单独的过敏原药物物质的分子结合并因此能够支持细菌、酵母和霉菌的生长的水的量度。此外,将理解的是,可以使用诸如水分计、水分-湿度计、湿度表和相对湿度系统的合适的电子仪器来测量水活度。
预期2至20种单独的过敏原药物物质中的每一种稳定至少1周、2周、1个月、2个月、3个月、4个月、5个月、6个月、一年、2年、5年或更长时间。进一步预期,混合过敏原药物产品稳定至少1周、2周、1个月、2个月、3个月、4个月、5个月、6个月、一年、2年、5年或更长时间。
在其他实施方案中,2至20种不同的原始完全食物过敏原物质中的每一种被提供为基本不含可复制的生物体的2至20种单独的经辐照的过敏原药物物质,并且其中每种单独的过敏原药物物质保留基本上完整的过敏原蛋白。
在某些实施方案中,当前公开的制备无菌混合过敏原药物产品的方法还包括将2至20种单独的过敏原药物物质混合在一起。在特定的实施方案中,当前公开的方法还包括混合6至20种单独的过敏原药物物质。无菌混合过敏原药物产品中每种单独的过敏原药物物质的量可以根据需要变化。在某些实施方案中,混合过敏原药物产品包含按蛋白质质量计约0.1mg至约500mg的每种单独的过敏原药物物质。在另外的实施方案中,混合过敏原药物产品包含15或16种单独的过敏原药物物质,其中每种单独的过敏原药物物质以与另一种单独的过敏原药物物质的按蛋白质重量计约2:1至约1:2的比例存在。例如,按总蛋白重量计,混合过敏原药物产品可包含基本上相等量的单独的过敏原药物物质。
在特定实施方案中,当前公开的方法包括混合过敏原药物产品,其包含选自以下的单独的过敏原药物物质:榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。应当理解,本文预期的单独的过敏原药物物质可以各自以膳食、面粉、粉末和/或蛋白质浓缩物的形式存在。
在某些实施方案中,本公开内容的方法还包括将2至20种单独的过敏原药物物质与一种或多种填充剂混合。预期的填充剂可包括本文所述的任何填充剂。在某些实施方案中,填充剂包括糖或糖醇,例如蔗糖、麦芽糖糊精、海藻糖、脱水海藻糖、甘露醇、乳糖、右旋糖、果糖、棉子糖、醛糖、酮糖、葡萄糖、蔗糖、木糖醇、山梨糖醇、异麦芽酮糖醇、赤藓糖醇、戊糖醇、己糖醇、malitol、乙酰氨基磺酸钾、踝蛋白、甘草甜素、三氯蔗糖、阿斯巴甜、糖精、糖精钠、麦芽糖糊精、新橙皮苷二氢查耳酮、甘草酸单铵、环己氨基磺酸钠或其任何组合。在某些实施方案中,填充剂包括麦芽糖糊精或蔗糖或其组合。在某些实施方案中,填充剂包含重量比为约3:1的麦芽糖糊精和蔗糖。不希望受到理论的束缚,据信填充剂降低混合过敏原药物产品的脂肪含量以帮助下游加工(例如,研磨)。
在某些实施方案中,本公开内容中公开的方法可以包括将2至20种单独的过敏原药物物质与药学上可接受的赋形剂混合。预期的赋形剂可包括本文所述的任何药学上可接受的赋形剂。在某些实施方案中,药学上可接受的赋形剂包括例如食品安全油,多糖(例如结冷胶),调味剂,食品安全盐(例如磷酸氢二钾)和/或天然化合物(例如,香草精或肉桂)。
在另一个实施方案中,本公开内容提供了一种制备基本上不含可复制的生物体的混合过敏原药物产品的方法,所述方法包括:提供2至20种不同的原始完全食物过敏原物质;将2至20种原始完全食物过敏原物质混合在一起以产生大块物质;以及用电离辐射辐照所述大块物质,从而产生基本不含可复制的生物体的混合过敏原药物产品,并且其中所述混合过敏原药物产品保留基本上完整的过敏原蛋白质。
在某些实施方案中,本文公开的预期的方法还包括例如在锥形研磨机中研磨混合过敏原药物产品。研磨可以例如包括使用约9000RPM的转子速度,或者可以进一步包括通过锥形研磨机施加真空抽吸。研磨可以例如包括使混合过敏原药物产品通过具有约0.033英寸的开口尺寸的筛网。不希望受到理论的束缚,据信研磨降低了砂性和大颗粒尺寸并增加了混合均匀性。
还预期了制备混合过敏原药物产品的方法,其中将混合过敏原药物产品进一步与生理上可接受的递送媒介物混合以产生生理上可接受的组合物。混合过敏原药物产品可以进一步掺入多种制剂中用于向受试者施用。更具体地,可以通过与适当的生理上可接受的承载体或稀释剂(例如植物油)组合来将混合过敏原药物产品配制成生理上可接受的组合物。在某些实施方案中,公开的混合过敏原药物产品被设计用于儿童或成人的食物过敏的口服免疫治疗,例如,作为可分散的粉末或颗粒、食物、片剂、锭剂、糖锭、乳剂等。可以根据用于制造药物组合物的任何方便的方案来制备用于口服使用的组合物,并且这样的组合物可以包含一种或多种选自甜味剂(例如甘油、丙二醇、山梨糖醇或蔗糖)、调味剂、着色剂和防腐剂的试剂以提供可口的制剂。
还预期了制备混合过敏原药物产品的方法,其中将混合过敏原药物产品与儿童或成人不过敏的食物混合。例如,食物可以包括但不限于:幼儿或婴儿配方食品,婴儿食品(例如适合婴儿或学步儿童食用的泥状食品(pureed food)),薯片,饼干,面包,涂抹酱,奶油,酸奶,液体饮料,含巧克力的产品,糖果,冰淇淋,谷物,咖啡,泥状食品等。
在又一个实施方案中,本公开内容提供了一种制备基本上不含可复制的生物体的无菌过敏原药物产品的方法,所述方法包括:辐照原始完全食物过敏原物质,其中辐照包括将电离辐射施加至原始完全食物过敏原物质,从而产生基本上不含可复制的生物体的无菌过敏原药物产品,并且其中无菌过敏原药物产品保留了基本上完整的过敏原蛋白。例如,原始完全食物过敏原物质选自榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾。
在整个说明书中,在装置、设备和系统被描述为具有、包括或包含特定组件,或者在过程和方法被描述为具有、包括或包含特定步骤时,预期另外地存在基本上由所列举的组件组成或者由所列举的组件组成的装置、设备和系统,并且存在基本上由所列举的处理步骤组成或由所列举的处理步骤组成的过程和方法。
本文给出的前述示例仅出于举例说明性目的,而不应以任何方式解释为是限制性的。
实施例
实施例1
一系列代表性测试可以确定用于产生示例性的干粉混合过敏原药物产品的15种不同的原始完全食物过敏原物质(例如,榛子、腰果、开心果、胡桃、山核桃、杏仁、花生、芝麻、大豆、鸡蛋、牛乳、小麦、鲑鱼、鳕鱼和虾)中的每一种的身份、强度、品质和纯度(参见表1)。
对于每种单独的原始完全食物过敏原,记录宏观外观(例如,粉末粒度,颜色),并与相应的原始完全食物过敏原标准品进行比较。
表1–分析食物过敏原物质和药物过敏原物质的测定的概述
使用Trimetric方法/共沸方法/重量法测定每种单独的原始完全食物过敏原的残留水分(参见实施例4)。
通过Lowry蛋白测定法测量每种单独的原始完全食物过敏原和单独的过敏原药物物质的可提取蛋白质总含量。提取效率是通过将预期的理论浓度(由原始完全食物过敏原物质供应商的总氮含量确定)与观察到的浓度进行比较而计算出的。表2显示了15种原始完全食物过敏原物质的提取效率。
表2–15种原始完全食物过敏原物质的提取效率
*由每种原始完全食物过敏原物质供应商提供的总氮含量值确定。
**如果100%的蛋白质是可提取的,基于在2.5mL提取缓冲液中50mg原始完全食物过敏原物质的标准提取。
通过ELISA测量与过敏原特异性抗体反应的每种单独的原始完全食物过敏原中的过敏原蛋白的量。如图32所示,与杏仁粉参考标准品(空心正方形)相比,杏仁粉药物物质(空心圆)在杏仁蛋白特异性ELISA中具有相似的反应性。非特异性食物过敏原物质(虾粉,空心菱形)和赋形剂对照(异麦芽酮糖醇,空心三角形)在ELISA中不反应,表明ELISA对特定的原始完全食物过敏原物质(即杏仁)的特异性。表3显示了使用食物过敏原特异性ELISA测定的15种食物过敏原物质的EC
表3–15种原始完全食物过敏原物质的EC
*鳕鱼和鲑鱼均使用相同的可商购获得的ELISA进行测试
通过SDS-PAGE(实施例2中所述),通过比较每种单独的原始完全食物过敏原的条带图谱与相应的原始完全食物过敏原标准品来分析每种单独的原始完全食物过敏原的蛋白质谱。
实施例2
将15种过敏原药物物质的蛋白质完整性与15种相应的原始完全食物过敏原物质进行比较。Fonterra牛乳蛋白分离物4900和Michael Foods的鸡蛋粉各自分别用7.5kGy和15kGy的两个剂量的β辐射进行辐照(在SADEX Corporation,Sioux City,Iowa进行电子束辐照)。榛子粉、腰果粉、开心果粉、胡桃粉、山核桃粉、杏仁粉、花生粉、芝麻粉、大豆蛋白粉、小麦蛋白粉、鲑鱼粉、鳕鱼粉和虾粉各自分别用7.5kGy的β辐射进行辐照(在Steri-Tek,Fremont,California进行电子束辐照)。通过SDS-PAGE解析原始完全食物过敏原物质样品和经辐照的过敏原药物物质样品中存在的所有蛋白质来评估蛋白质完整性。简而言之,使用十二烷基硫酸锂溶解确定量的15种不同的原始完全食物过敏原物质中的每一种和单独的过敏原药物物质,并短暂加热几分钟,然后进行离心。然后在还原条件下使上清液经受在4-12%Bis-Tris聚丙烯酰胺凝胶上的电泳,然后用考马斯亮蓝染色。
图1A显示了未辐照的原始完全榛子过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的榛子过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图1B显示了图1A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的榛子过敏原药物物质样品(图1A的泳道2)和未辐照的原始完全榛子过敏原物质样品(图1A的泳道3)中均定量了15种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图2A显示了未辐照的原始完全腰果过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的腰果过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图2B显示了图2A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的腰果过敏原药物物质样品(图2A的泳道2)和未辐照的原始完全腰果过敏原物质样品(图2A的泳道3)中均定量了18种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图3A显示了未辐照的原始完全开心果过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的开心果过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图3B显示了图3A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的开心果过敏原药物物质样品(图3A的泳道2)和未辐照的原始完全开心果过敏原物质样品(图3A的泳道3)中均定量了14种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图4A显示了未辐照的原始完全胡桃过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的腰果过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图4B显示了图4A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的胡桃过敏原药物物质样品(图4A的泳道2)和未辐照的原始完全胡桃过敏原物质样品(图4A的泳道3)中均定量了12种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图5A显示了未辐照的原始完全山核桃过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的山核桃过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图5B显示了图5A的SDS-PAGE的光密度分析。在7.5kGyβ辐射的山核桃过敏原药物物质样品(图5A的泳道2)和未辐照的原始完全山核桃过敏原物质样品(图5A的泳道3)中均定量了15种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图6A显示了未辐照的原始完全杏仁过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的杏仁过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图6B显示了图6A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的杏仁过敏原药物物质样品(图6A的泳道2)和未辐照的原始完全杏仁过敏原物质样品(图6A的泳道3)中均定量了18种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图7A显示了未辐照的原始完全花生过敏原物质样品(泳道3)通过SDS-PAGE具有良好的条带分离度,并且表现出与7.5kGyβ辐照的花生过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图7B显示了图7A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的花生过敏原药物物质(图7A的泳道2)和未辐照的原始完全花生过敏原物质样品(图7A的泳道3)中均定量了16种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图8A显示了未辐照的原始完全芝麻过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的芝麻过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图8B显示了图8A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的芝麻过敏原药物物质样品(图8A的泳道2)和未辐照的原始完全芝麻过敏原物质样品(图8A的泳道3)中均定量了16种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图9A显示了未辐照的原始完全大豆过敏原物质样品(泳道3)通过SDS-PAGE具有相对低的条带分离度,并且表现出与7.5kGyβ辐照的大豆过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图9B显示了图9A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的大豆过敏原药物物质样品(图9A的泳道2)和未辐照的原始完全大豆过敏原物质样品(图9A的泳道3)中均定量了12种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图10A显示了未辐照的原始完全鸡蛋过敏原物质样品(泳道2和3)通过SDS-PAGE具有良好的条带分离度,并且表现出与7.5kGyβ辐照的鸡蛋过敏原药物物质样品(泳道4和5)和15kGyβ辐照的鸡蛋过敏原药物物质样品(泳道6和7)相似的蛋白条带构型。
图10B显示了图10A的SDS-PAGE的光密度分析。在未辐照的原始完全鸡蛋过敏原样品中定量了16种蛋白条带峰(图10A的泳道2和3)。7.5kGyβ辐照的鸡蛋过敏原药物物质样品(图2A的泳道4和5)和15kGyβ辐照的鸡蛋过敏原药物物质样品(图2A的泳道6和7)表现出非常相似的峰强度和位置,表明在7.5kGy和15kGy的β辐射处理后,蛋白质完整性是高度保守的。
如图11A所示,未辐照的原始完全牛乳过敏原物质样品(泳道2和3)通过SDS-PAGE具有良好的条带分离度,并且表现出与7.5kGyβ辐照的牛乳过敏原药物物质样品(泳道4和5)以及15kGyβ辐照的牛乳过敏原药物物质样品(泳道6和7)相似的蛋白条带构型。
图11B显示了图11A的SDS-PAGE的光密度分析。在未辐照的原始完全牛乳过敏原物质样品中定量了12种蛋白条带峰(图11A的泳道2和3)。7.5kGyβ辐照的牛乳过敏原药物物质样品(图11A的泳道4和5)和15kGyβ辐照的牛乳过敏原药物物质样品(图11A的泳道6和7)表现出非常相似的峰强度和位置,表明在7.5kGy和15kGy的β辐射处理后,蛋白质完整性是高度保守的。
图12A显示了未辐照的原始完全小麦过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的小麦过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图12B显示了图12A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的小麦过敏原药物物质样品(图12A的泳道2)和未辐照的原始完全小麦过敏原物质样品(图12A的泳道3)中均定量了13种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图13A显示了未辐照的原始完全鲑鱼过敏原物质样品(泳道3)通过SDS-PAGE具有非常好的条带分离度,并且表现出与7.5kGyβ辐照的鲑鱼过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图13B显示了图13A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的鲑鱼过敏原药物物质样品(图13A的泳道2)和未辐照的原始完全鲑鱼过敏原物质样品(图13A的泳道3)中均定量了18种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图14A显示了未辐照的原始完全鳕鱼过敏原物质样品(泳道3)通过SDS-PAGE具有良好的条带分离度,并且表现出与7.5kGyβ辐照的鳕鱼过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图14B显示了图14A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的鳕鱼过敏原药物物质样品(图14A的泳道2)和未辐照的原始完全鳕鱼过敏原物质样品(图14A的泳道3)中均定量了18种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
图15A显示了未辐照的原始完全虾过敏原物质样品(泳道3)通过SDS-PAGE具有相对较低的条带分离度,并且表现出与7.5kGyβ辐照的虾过敏原药物物质样品(泳道2)相似的蛋白条带构型。
图15B显示了图15A的SDS-PAGE的光密度分析。在7.5kGyβ辐照的虾过敏原药物物质样品(图15A的泳道2)和未辐照的原始虾过敏原样品(图15A的泳道3)中均定量了11种蛋白条带峰,表明在7.5kGy的β辐射处理后,蛋白质完整性是高度保守的。
实施例3
将15种代表性过敏原药物物质的粒度分布与15种相应的原始完全食物过敏原物质进行比较。
如图16所示,与未辐照的原始完全榛子过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全榛子过敏原物质(实心三角形)没有导致粒度分布的显著差异。
如图17所示,与未辐照的原始完全腰果过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全腰果过敏原物质(实心三角形)没有导致粒度分布的显著差异。
如图18所示,与未辐照的原始完全开心果过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全开心果过敏原物质(实心三角形)没有导致粒度分布的显著差异。
与未辐照的原始完全胡桃过敏原物质(图19;空心圆)相比,用7.5kGy的β辐射处理原始完全胡桃过敏原物质(图19;实心三角形)没有导致粒度分布的显著差异。
如图20所示,与未辐照的原始完全山核桃过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全山核桃过敏原物质(实心三角形)没有导致粒度分布的显著差异。
如图21所示,与未辐照的原始完全杏仁过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全杏仁过敏原物质(实心三角形)没有导致粒径分布的显著差异。
如图22所示,与未辐照的原始完全花生过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全花生过敏原物质(实心三角形)没有导致粒度分布的显著差异。在辐照后测量到更高群体的500μm至750μm的颗粒。
如图23所示,与未辐照的原始完全芝麻过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全芝麻过敏原物质(实心三角形)没有导致粒度分布的显著差异。
如图24所示,与未辐照的原始完全大豆过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全大豆过敏原物质(实心三角形)没有导致粒度分布的显著差异。
类似地,如图25所示,未辐照的原始完全鸡蛋过敏原物质(空心圆)、7.5kGyβ辐照的鸡蛋过敏原药物物质(实心三角形)和15kGyβ辐照的鸡蛋过敏原药物物质(实心正方形)在粒度分布上没有表现出显著差异。
如图26所示,与未辐照的原始完全牛乳过敏原物质(空心圆)相比,用7.5kGy(实心三角形)或15kGy(实心正方形)的β辐射处理原始完全牛乳过敏原物质没有导致粒度分布的显著差异。
如图27所示,与未辐照的原始完全小麦过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全小麦过敏原物质(实心三角形)没有导致粒度分布的显著差异。
如图28所示,与未辐照的原始完全鲑鱼过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全鲑鱼过敏原物质(实心三角形)没有导致粒度分布的显著差异。
与未辐照的原始完全鳕鱼过敏原物质(图29;空心圆)相比,用7.5kGy的β辐射处理原始完全鳕鱼过敏原物质(图29;实心三角形)没有导致粒度分布的显著差异。
如图30所示,与未辐照的原始完全虾过敏原物质(空心圆)相比,用7.5kGy的β辐射处理原始完全虾过敏原物质(实心三角形)没有导致粒度分布的显著差异。
因此,即使在高剂量(例如对于某些过敏原物质为15kGy)的β辐射之后,在辐照的过敏原药物物质中也不会出现系统性团聚。
实施例4
还测量了15种代表性过敏原药物物质的水分含量和水活度,并与15种相应的原始完全食物过敏原物质的水分含量和水活度进行了比较。
如表4所示,原始完全榛子过敏原物质的水分含量(使用AquaLab4TE和Computract1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表4
如表5所示,原始完全腰果过敏原物质的水分含量(使用AquaLab4TE和Computract1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表5
如表6所示,原始完全开心果过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的(两者均为8%)。
表6
如表7所示,原始完全胡桃过敏原物质的水分含量(使用AquaLab4TE和Computract1000XL测量)和水活度(使用Rotronic HygroLab测量)没有受到β辐射处理的系统性影响。
表7
如表8所示,原始完全山核桃过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理后是相似的(分别为5%和4%)。
表8
如表9所示,原始完全杏仁过敏原物质的水分含量(使用AquaLab4TE和Computract1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的(分别为5%和11%)。
表9
如表10所示,原始完全花生过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表10
如表11所示,原始完全芝麻过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表11
如表12所示,原始完全大豆过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表12
表13中的结果类似地显示,在7.5kGy或15kGy剂量下,β辐射处理未系统性影响原始完全鸡蛋过敏原物质的水分含量和水活度。
表13
如表14所示,在7.5kGy或15kGy剂量下,β辐射处理未系统性影响原始完全牛乳过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)。
表14
如表15所示,与β辐射处理前相比,原始完全小麦过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理后稍高。
表15
如表16所示,原始完全鲑鱼过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表16
如表17所示,原始完全鳕鱼过敏原物质的水分含量(使用AquaLab 4TE和Computract 1000XL测量)和水活度(使用Rotronic HygroLab测量)没有受到7.5kGy的β辐射处理的系统性影响。
表17
如表18所示,原始完全虾过敏原物质的水分含量(使用AquaLab4TE和Computract1000XL测量)和水活度(使用Rotronic HygroLab测量)在β辐射处理前和β辐射处理后是相似的。
表18
实施例5
测量了15种代表性过敏原药物物质的微生物生长,并将其与15种相应的原始完全食物过敏原物质的微生物生长进行比较。
测量了未辐照和辐照的牛乳过敏原物质和鸡蛋过敏原物质样品的总需氧微生物。另外,测量样品的总肠杆菌科、酵母菌和霉菌计数。
对于总需氧菌平板计数和肠杆菌科计数,将样品稀释并铺在普通回收培养基的培养皿上,以测量每克产品的菌落形成单位(CFU/g)。对于酵母菌和霉菌平板计数,按照制造商的说明将样品稀释并铺在3M Petrifilm
表19示出了未辐照的原始完全榛子过敏原物质和7.5kGyβ辐照的榛子过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌和酵母计数的显著减少(低于检测限)。
表19
表20示出了未辐照的原始完全腰果过敏原物质和7.5kGyβ辐照的腰果过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌和霉菌计数的显著减少(低于检测限)。
表20
表21示出了未辐照的原始完全开心果过敏原物质和7.5kGyβ辐照的开心果过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数的显著减少。
表21
表22示出了未辐照的原始完全胡桃过敏原物质和7.5kGyβ辐照的胡桃过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表22
表23示出了未辐照的原始完全山核桃过敏原物质和7.5kGyβ辐照的山核桃过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数、酵母计数和霉菌计数的显著减少。
表23
表24示出了未辐照的原始完全杏仁过敏原物质和7.5kGyβ辐照的杏仁过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表24
表25示出了未辐照的原始完全花生过敏原物质和7.5kGyβ辐照的花生过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数的显著减少。
表25
表26示出了未辐照的原始完全芝麻过敏原物质和7.5kGyβ辐照的芝麻过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表26
表27示出了未辐照的原始完全大豆过敏原物质和7.5kGyβ辐照的大豆过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表27
表28示出了未辐照的原始完全花生过敏原物质和7.5kGyβ辐照的花生过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表28
表29显示了未辐照的原始完全鸡蛋过敏原物质、7.5kGyβ辐照的鸡蛋过敏原药物物质以及15kGyβ辐射的鸡蛋过敏原药物物质的总需氧生物平板计数、总屎肠球菌(E.faecium)计数、总酵母计数和总霉菌计数。使用7.5kGy和15kGy的辐照导致总需氧菌平板计数和霉菌计数的显著减少。
表29
表30示出了未辐照的原始完全牛乳过敏原物质、7.5kGyβ辐照的牛乳过敏原药物物质和15kGyβ辐照的牛乳过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。使用7.5kGy的辐照导致总需氧菌平板计数的显著减少。
表30
表31示出了未辐照的原始完全小麦过敏原物质和7.5kGyβ辐照的小麦过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数显著减少。
表31
表32示出了未辐照的原始完全鳕鱼过敏原物质和7.5kGyβ辐照的鳕鱼过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数和肠杆菌科计数显著减少。
表32
表33示出了未辐照的原始完全虾过敏原物质和7.5kGyβ辐照的虾过敏原药物物质的总需氧生物平板计数、总肠杆菌科计数、总酵母计数和总霉菌计数。用7.5kGy辐照导致总需氧菌平板计数减少。
表33
在进行β辐射处理之前,还可以用指示性营养生物(屎肠球菌NRRL B-2354)接种单独的样品,并且可以在辐照前和辐照后对接种的未辐照和辐照的牛乳过敏原物质和鸡蛋过敏原物质样品的总屎肠球菌进行测量。对于未接种屎肠球菌的样品,所述方法的检测极限对于1:10稀释度为1CFU/g。对于接种屎肠球菌的样品,将检测极限设定为第一系列稀释度,在该稀释度下,未接种屎肠球菌的样品中没有观察到背景微生物群的生长。
实施例6
如图31的制造工作流程示意图所示,可以将原始完全食物过敏原物质加工成最终的药物产品以用于临床包装和分配。简而言之,对15种完全食物过敏原物质进行电离辐射处理以产生单独的过敏原药物物质,然后对其进行分析以确定效能和身份。将单独的过敏原药物物质与赋形剂混合并研磨,以形成大块的混合过敏原药物产品。包装大块的混合过敏原药物产品以形成最终的混合过敏原药物产品以用于在受控运输条件下进行临床分配。在产生单独的过敏原药物物质和大块的混合过敏原药物产品后,将样品释放以用于稳定性评估。
通过引用并入
出于所有目的,本文中提及的所有出版物和专利,包括下面列出的那些项目,均通过引用全文并入本文,就好像每个单独的出版物或专利均被具体地和单独地通过引用并入。在有冲突的情况下,以本申请(包括本文的任何定义)为准。
等同物
尽管已经讨论了本发明的特定实施方案,但是以上说明书是举例说明性的而不是限制性的。通过阅读本说明书,本发明的许多变化对于本领域技术人员将变得明显。本发明的全部范围应该通过参考权利要求书连同其等同物的全部范围以及说明书连同这样的变化来确定。
除非另有说明,否则在本说明书和权利要求书中使用的表示成分的量、反应条件等的所有数字均应理解为在所有情况下均被术语“约”修饰。因此,除非有相反的指示,否则本说明书和所附权利要求书中列出的数字参数是近似值,其可以根据本发明试图获得的所需特性而变化。
- 用于制备混合的过敏原组合物的方法
- 用于混合动力汽车变速箱油的组合物及制备方法以及包含该组合物的变速箱油及制备方法
