一种产气荚膜梭菌的分离方法
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及菌种的提取分离技术领域,具体涉及一种产气荚膜梭菌的分离方法。
背景技术
产气荚膜梭菌又名魏氏梭菌,是广泛分布于自然界中的一种条件致病菌,也是动物肠道正常菌群的成员之一,它可以引产气荚膜梭菌能引起羔羊痢疾和羔羊、牛犊、仔猪、家兔、雏鸡等的坏死性肠炎,对畜牧养殖业的影响很大。
目前,在进行实验室分离病原时,常用的方法有血琼脂平板法、TSC-卵黄平板法、CW平板法、SPS平板法等,由于产气荚膜梭菌是厌氧菌,且对培养基的要求很高,产气荚膜梭菌在上述4种方法的培养基上表现出不同的生长特性。
其中,在1%葡萄糖血平板上可观察到其特征性的溶血现象,但该培养基无选择性,不利于从污染的病料或肠内容物中分离产气荚膜梭菌。SPS平板可对某些厌氧菌或兼性厌氧菌有抑制作用而具有一定的选择性,这种培养基含铁和亚硫酸盐,产气荚膜梭菌可使亚硫酸盐还原成硫化物,产生黑色菌落,然而,少数产气荚膜梭菌不能在SPS平板上生长。CW平板的营养较为丰富,产气荚膜梭菌生长较茂盛,可对某些厌氧菌或兼性厌氧菌有抑制作用而具有一定的选择性,但是对梭状芽孢梭菌属的细菌和其他部分革兰氏阳性菌无抑制作用。
实验室分离产气荚膜梭菌最常用的就是TSC-卵黄平板法,大量试验研究表明,使用单层的TSC-卵黄平板法分离产气荚膜梭菌,可对某些厌氧菌或兼性厌氧菌有抑制作用而具有一定的选择性;TSC-卵黄培养基含铁和亚硫酸盐,产气荚膜梭菌可使亚硫酸盐还原成硫化物,后者与铁发生反应,形成一种黑色的硫化铁沉淀即黑色菌落;然而产气荚膜梭菌产生的卵磷脂酶水解卵黄卵磷脂,使黑色菌落的周围形成一个不透明的白晕,但容易在卵黄平板上蔓延生长,造成菌落融合,不易辨认。
因此,开发一种简便迅速最大限度地分离出产气荚膜梭菌的方法是本领域的研究重点。
发明内容
针对现有技术存在的不足,本发明的目的在于提供一种产气荚膜梭菌的分离方法。所述分离方法增加了双层分离技术,会使细菌生长在严格厌氧的环境中,菌落相对独立,单菌落形态显而易见,细菌生长较好且很少出现各个菌落相连交错的现象,为后期挑取单菌落奠定了基础。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将病料部位进行增菌培养,得到产气荚膜梭菌菌液;
(2)将步骤(1)得到的产气荚膜梭菌菌液稀释后,涂布于卵黄琼脂培养基,再覆盖上琼脂培养基后,进行培养基培养,得到产气荚膜梭菌落。
在本发明中,在卵黄琼脂培养基(即TSC-卵黄平板)上进行细菌涂布后再盖上一层TSC,即双层TSC法,就会使细菌生长在严格厌氧的环境中,此时菌落相对独立,单菌落形态显而易见,细菌生长较好且很少出现各个菌落相连交错的现象。
同时,由于细菌在单层卵黄琼脂培养基中生长时,菌落融合,不利于生长,分离率低,在空气中放置很短一段时间形成的亚硫酸盐的黑色菌落就会消失,不利于下一步的分离。而本发明加了再覆盖上琼脂培养基后(上层TSC)之后,菌落的蔓延受到了限制,菌落较独立,且在空气中放置很久形成的亚硫酸盐的黑色菌落也不会消失,方便下一步的细菌分离。
因此,本发明选定双层TSC-卵黄平板法作为分离产气荚膜梭菌的最佳选择性培养基,以简便迅速最大限度地分离出产气荚膜梭菌。
优选地,步骤(1)中,所述病料部位包括盲肠、卵黄蒂前后、病变严重部位内容物、粪样中的任意一种或至少两种的组合。
优选地,所述卵黄蒂前后为以卵黄蒂为中心前后各截取1~5cm(例如可以是1cm、1.5cm、2cm、2.5cm、3cm、3.5cm、4cm、4.5cm、5cm等)的病料部位。
优选地,所述病料部位来自于坏死性肠炎病鸡和/或疑似病鸡。
优选地,步骤(1)中,所述增菌培养后得到的产气荚膜梭菌菌液的活菌数为4.5×10
优选地,步骤(1)中,所述增菌培养具体包括以下步骤:
(a)将病料部位置于缓冲溶液中,漩涡震荡后静置,得到上清液;
(b)将步骤(a)得到的上清液置于FT液体培养基中,进行厌氧培养,得到产气荚膜梭菌菌液。
优选地,所述病料部位和缓冲溶液的质量体积比为(1-10)g:(10-50)mL;
其中,“1-10”例如可以是1、2、3、4、5、6、7、8、9、10等;
其中,“10-50”例如可以是10、15、20、25、30、35、40、45、50等。
优选地,步骤(a)中,所述漩涡震荡的转速为800-1000rpm,例如可以是800rpm、850rpm、900rpm、950rpm、1000rpm等,所述漩涡震荡的时间为0.5-1min,例如可以是0.5min、0.6min、0.7min、0.8min、0.9min、1min等。
优选地,步骤(a)中,所述静置的时间为3-10min,例如可以是3min、4min、5min、6min、7min、8min、9min、10min等。
优选地,步骤(a)中,所述缓冲溶液为PBS溶液。
优选地,步骤(b)中,所述上清液和FT培养基的体积比为0.1:(4-6),例如可以是0.1:4、0.1:4.5、0.1:5、0.1:5.5、0.1:6等。
优选地,步骤(b)中,所述FT液体培养基包括:FT、环丝氨酸和水。
优选地,步骤(b)中,所述FT液体培养基按重量份数计包括:10-20份的FT、0.5-2份的环丝氨酸液、400-600份的水。
所述FT液体培养基中,FT含量为10-20份,例如可以是10份、12份、14份、16份、18份、20份等。
所述FT液体培养基中,环丝氨酸液含量为0.5-2份,例如可以是0.5份、0.6份、0.8份、1份、1.2份、1.4份、1.6份、1.8份、2份等。
所述FT液体培养基中,水含量为400-600份,例如可以是400份、450份、500份、550份、600份等。
优选地,所述环丝氨酸液为环丝氨酸的生理盐水溶液,其中环丝氨酸的浓度为30-50mg/mL,例如可以是30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL等。
优选地,步骤(b)中,所述厌氧培养的温度为38-42℃,例如可以是38℃、39℃、40℃、41℃、42℃等,所述厌氧培养的时间为16-24h,例如可以是16h、17h、18h、19h、20h、21h、22h、23h、24h等。
优选地,步骤(2)中,每1mL稀释后得到的菌液中含10
优选地,步骤(2)中,所述涂布的涂布量为5-10μL/cm
优选地,步骤(2)中,所述卵黄琼脂培养基包括:TSC、卵黄液、环丝氨酸和水。
优选地,步骤(2)中,所述卵黄琼脂培养基按重量份数计包括:10-20份的TSC、50-150份的卵黄液、0.5-2份的环丝氨酸液和300-500份的水。
所卵黄琼脂培养基中,TSC含量为10-20份,例如可以是10份、12份、14份、16份、18份、20份等。
所卵黄琼脂培养基中,卵黄液含量为50-150份,例如可以是50份、60份、70份、80份、90份、100份、110份、120份、130份、140份、150份等。
所述卵黄琼脂培养基中,环丝氨酸液含量为0.5-2份,例如可以是0.5份、0.6份、0.8份、1份、1.2份、1.4份、1.6份、1.8份、2份等。
所述卵黄琼脂培养基中,水含量为300-400份,例如可以是300份、320份、340份、360份、380份、400份等。
优选地,所述环丝氨酸液为环丝氨酸的生理盐水溶液,其中环丝氨酸的浓度为30-50mg/mL,例如可以是30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL等。
优选地,所述卵黄液包括卵黄和FT液体培养基。
优选地,所述卵黄和所述FT液体培养基的体积比为(0.5-2):1,例如可以是0.5:1、0.6:1、0.8:1、1:1、1.2:1、1.4:1、1.6:1、1.8:1、2:1等。
优选地,步骤(2)中,所述琼脂培养基包括:TSC和水;
优选地,步骤(2)中,所述琼脂培养基按重量份数计包括:10-30份的TSC和400-600份的水。
所述琼脂培养基中,TSC含量为10-30份,例如可以是10份、12份、14份、16份、18份、20份、22份、24份、26份、28份、30份等。
所述琼脂培养基中,水含量为400-600份,例如可以是400份、450份、500份、550份、600份等。
优选地,步骤(2)中,所述培养基培养的温度为38-42℃,例如可以是38℃、39℃、40℃、41℃、42℃等,所述培养基培养的时间为16-24h,,例如可以是16h、17h、18h、19h、20h、21h、22h、23h、24h等。
与现有技术相比,本发明具有以下有益效果:
(1)本发明所述分离方法取在下层TSC-卵黄平板上加盖上层TSC覆盖,此时会使细菌生长在严格厌氧的环境中,菌落相对独立,单菌落形态显而易见,细菌生长较好且很少出现各个菌落相连交错的现象,为后期挑取单菌落奠定了基础。
(2)本发明所述分离方法在原有的TSC-卵黄平板的基础上,增加了双层分离技术。只采用实验室常规的试剂和耗材即可完成,操作简便、实用。
附图说明
图1为坏死性肠炎病鸡的肠道的示意图。
图2为坏死性肠炎病鸡的粪样的示意图。
图3为本发明进行增菌培养得到产气荚膜梭菌菌液的示意图。
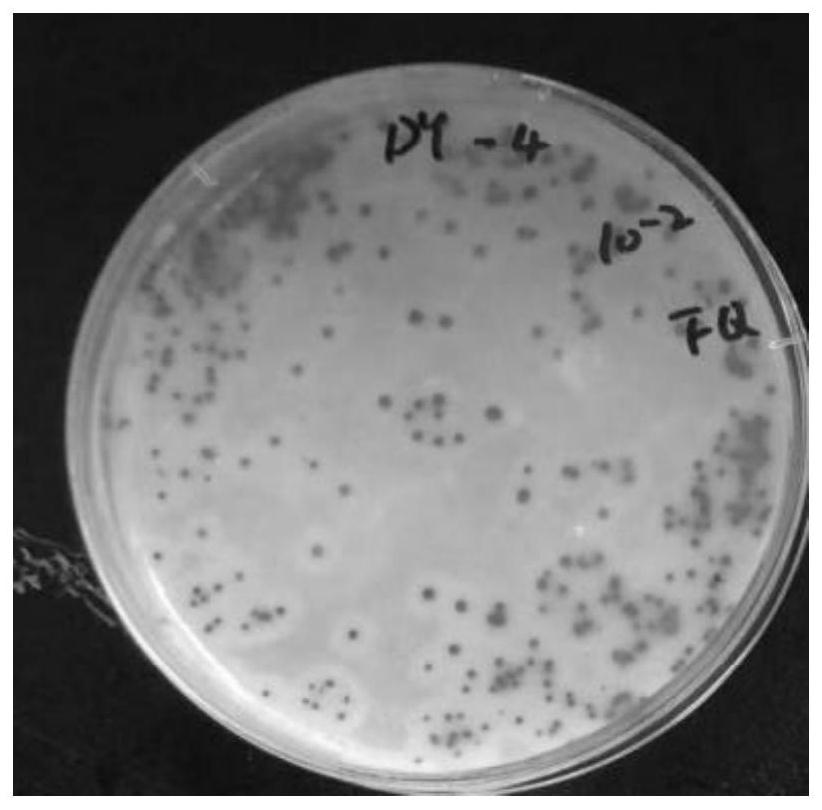
图4为实施例1(10
图5为实施例2(10
图6为实施例3(10
图7为实施例4(10
图8为实施例5(10
图9为实施例6(10
图10为对比例1(10
图11为对比例2(10
图12为对比例3(10
图13为对比例4(10
图14为对比例5(10
图15为对比例6(10
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述具体实施方式仅仅是帮助理解本发明,不应视为对本发明的具体限制。
以下各例各组分来源如下所示:
其中,收集到的样品,分别用药勺取盲肠或者粪便,具体如图1(肠道,样品1)和图2(粪便,样品2)所示。
制备例1
本制备例提供一种FT液体培养基,所述FT液体培养基由以下制备方法制备得到:取14.65g的FT和500mL的蒸馏水混合,高压灭菌后放置室温,加入1mL环丝氨酸,放入4℃冰箱保存。
其中,环丝氨酸为40mg的环丝氨酸和1mL的灭菌生理盐水的混合液(浓度为0.9wt%的氯化钠水溶液;FT培养基制备时,全程不能摇晃。
制备例2
本制备例提供一种卵黄琼脂培养基(含环丝氨酸,含卵黄),所述卵黄琼脂培养基由以下制备方法制备得到:
(1)用新鲜鸡蛋配置,鸡蛋在75%酒精中浸泡25min灭菌,4个鸡蛋的卵黄约50mL,再加入50mL的制备例1提供的FT液体培养基,即为100mL的50%的卵黄液;
(2)取16.8g的TSC和400mL的蒸馏水,全部溶解后高压灭菌,待温度降至50℃,加入100mL的50%卵黄液摇匀,再加入1mL环丝氨酸(40mg的环丝氨酸和1mL的灭菌生理盐水的混合液)摇匀,倒板,每个平板倾倒15-20mL,静置冷却至凝固。4℃冰箱保存备用。
制备例3
本制备例提供一种琼脂培养基(不含环丝氨酸,不含卵黄),所述琼脂培养基由以下制备方法制备得到:取21g的TSC和500mL的蒸馏水,全部溶解后,高压灭菌,待温度降至约50℃时,倒于平板之上,静置冷却至凝固。
制备例4
本制备例提供一种琼脂培养基(含环丝氨酸,不含卵黄),所述琼脂培养基由以下制备方法制备得到:取21g的TSC和500mL的蒸馏水,全部溶解后,高压灭菌,待温度降至约50℃时,加入1mL的环丝氨酸摇匀,倒板,每个平板倾倒15-20mL的,静置冷却至凝固。4℃冰箱保存备用。
实施例1
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
图3为本发明进行增菌培养得到产气荚膜梭菌菌液的示意图,如图3所示,所述分离方法步骤(1)中,培养物为浑浊有气泡的絮状;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
实施例2
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
实施例3
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
实施例4
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
图3为本发明进行增菌培养得到产气荚膜梭菌菌液的示意图,如图3所示,所述分离方法步骤(1)中,培养物为浑浊有气泡的絮状;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
实施例5
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
实施例6
本实施例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例1
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
图3为本发明进行增菌培养得到产气荚膜梭菌菌液的示意图,如图3所示,所述分离方法步骤(1)中,培养物为浑浊有气泡的絮状;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例2
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例3
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品1放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例4
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
图3为本发明进行增菌培养得到产气荚膜梭菌菌液的示意图,如图3所示,所述分离方法步骤(1)中,培养物为浑浊有气泡的絮状;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例5
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
对比例6
本对比例提供一种产气荚膜梭菌的分离方法,所述产气荚膜梭菌的分离方法包括以下步骤:
(1)将5g的样品2放入50mL的离心管内;每一个离心管中加入20mL的PBS溶液,漩涡震荡混匀,静置5min后,取上清液;取10mL离心管,每管中加入5mL的制备例1提供的FT液体培养基,取上清液100μL加入离心管中。表面覆盖1mL的灭菌过的石蜡油,封口膜封好后,放置于40℃恒温箱内培养20h,得到产气荚膜梭菌菌液;
(2)将10mL离心管中的培养物吹打均匀,取100μL加入1.5mL离心管中,加入900μL的超纯水进行稀释至10
性能测试
分别对上述实施例1-6和对比例1-6最后得到的荚膜梭菌菌落进行计数;
其中,图4-15为不同产气荚膜梭菌菌落示意图,如图所示,在相同浓度梯度下未盖上层TSC封层的平板,菌与菌之间相互粘连在一起,界限模糊且不好辨认,而盖了上层TSC封层的平板,无论菌液浓度高或者低,都能清晰的看到单菌落,且菌落与菌落之间没有相互粘连,菌落形态清晰可辨。
实施例1-6采用本发明在卵黄琼脂培养基(即TSC-卵黄平板)上进行细菌涂布后再盖上一层TSC,即双层TSC法,就会使细菌生长在严格厌氧的环境中,此时菌落相对独立,不同培养时间下单菌落形态均显而易见,细菌生长较好且很少出现各个菌落相连交错的现象。且本发明放置出现菌落不会出现融合,说明本发明在空气中放置很久形成的亚硫酸盐的黑色菌落也不会消失,方便下一步的细菌分离。
申请人声明,本发明通过上述实施例来说明所述产气荚膜梭菌的分离方法,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 一种产气荚膜梭菌的分离方法
- 一种防治禽产气荚膜梭菌的研发方法
