具有改进的表型特性的T细胞组合物
文献发布时间:2023-06-19 12:07:15
优先权
本申请要求2018年11月8日提交的美国临时申请号62/757,467、2019年3月20日提交的美国临时申请号62/821,031以及2019年6月27日提交的美国临时申请号62/867,499的权益,所述临时申请各自以引用的方式整体并入本文。
背景技术
免疫治疗已成为癌症治疗的基石,其包括旨在通过对扩增的天然循环或遗传工程化的细胞毒性淋巴细胞的过继转移来释放、指导和增强患者自身的免疫系统的多种策略。尽管在所述领域中有最新进展,但是当前的过继免疫治疗仍面临若干挑战。例如,许多过继免疫治疗不能从外周血产生足够水平的具有临床或治疗价值的工程化的细胞毒性淋巴细胞,或者不能均匀地工程化效应细胞,或者不能为患者提供持续、持久的治疗效果,从而导致肿瘤复发和其他并发症。因此,对于提供更有效、持久且更安全的过继免疫治疗选择(包括以供患有白血病或淋巴瘤(包括急性或慢性白血病)的患者以及可从过继免疫治疗中获益的其他患者使用)的细胞组合物存在显著需求。在各个方面和实施方案中,本发明解决了这些需要。
发明内容
在各个方面和实施方案中,本发明提供了一种分离的细胞组合物,所述分离的细胞组合物适合于过继免疫治疗和/或T细胞的遗传工程化。本发明进一步提供了制造所述细胞组合物的方法和利用所述细胞组合物治疗的方法。所述组合物包含在药学上可接受的载体中的至少约10
在各种实施方案中,所述细胞组合物包含至少1%或至少15%的T记忆干细胞和约10
在各种实施方案中,所述细胞组合物包含约1%至约50%的T记忆干细胞,或约5%至约25%的T记忆干细胞。在各种实施方案中,所述T细胞是至少5%的T记忆干细胞,或者所述T细胞是至少约10%的T记忆干细胞,或者所述T细胞是至少20%的T记忆干细胞或至少25%的T记忆干细胞,其提供具有显著增殖潜力以及免疫重建能力和寿命的过继免疫治疗组合物。
在各种实施方案中,所述组合物中大于95%的CD8+T细胞包含记忆表型。在各种实施方案中,除T
在各种实施方案中,除T
在一些实施方案中,所述细胞组合物包含少于约20%或少于约10%的终末分化记忆T细胞(例如,T
在各种实施方案中,所述细胞组合物是至少约70%、或至少约80%、或至少约90%的CD8+或CD4-T细胞(例如,CD3+CD8+或CD3+CD4-细胞)。例如,所述分离的细胞组合物的特征可以是具有少于约10%或少于约5%的CD4+T细胞。当离体扩增CD8+T细胞时,CD4+细胞具有使CD8+细胞过度生长并竞争生长信号的趋势,并且外源性CD4+细胞对于稳健且持久的体内应答而言不是必需的。
在各种实施方案中,所述抗原特异性T细胞在激活后显示出多功能性表型。在一些实施方案中,至少10%的CD8+T细胞、或者在一些实施方案中至少20%的CD8+T细胞、或者在一些实施方案中至少40%的CD8+T细胞在激活后显示出多功能性表型。例如,T细胞在激活后对以下的两者或更多者呈阳性:针对IL-2、IFN-γ产生、TNF-α产生和CD107A的细胞内染色。在各种实施方案中,至少20%的抗原特异性T细胞显示出这些标志物中的至少两者。在各种实施方案中,至少20%的抗原特异性T细胞显示出这些标志物中的至少三者,或者在一些实施方案中,显示出这些标志物中的全部四者。在各种实施方案中,至少5%的CD8+T细胞是多抗原性的,这意味着CD8+T细胞能够在体外或体内针对多种肿瘤或病毒抗原产生应答。
在各种实施方案中,所述细胞组合物还包含γδT细胞。γδT细胞在其表面上具有独特的T细胞受体(TCR)。γδT细胞可在识别脂质抗原和磷酸抗原中起作用,并且可提供非HLA依赖性的抗病原体和抗肿瘤机制。此外,γδT细胞可为CD8+细胞提供帮助。已经观察到造血干细胞移植(HSCT)背景下γδT细胞的临床意义,并且特别是移植后γδT细胞的较高频率与有利的结果相关。
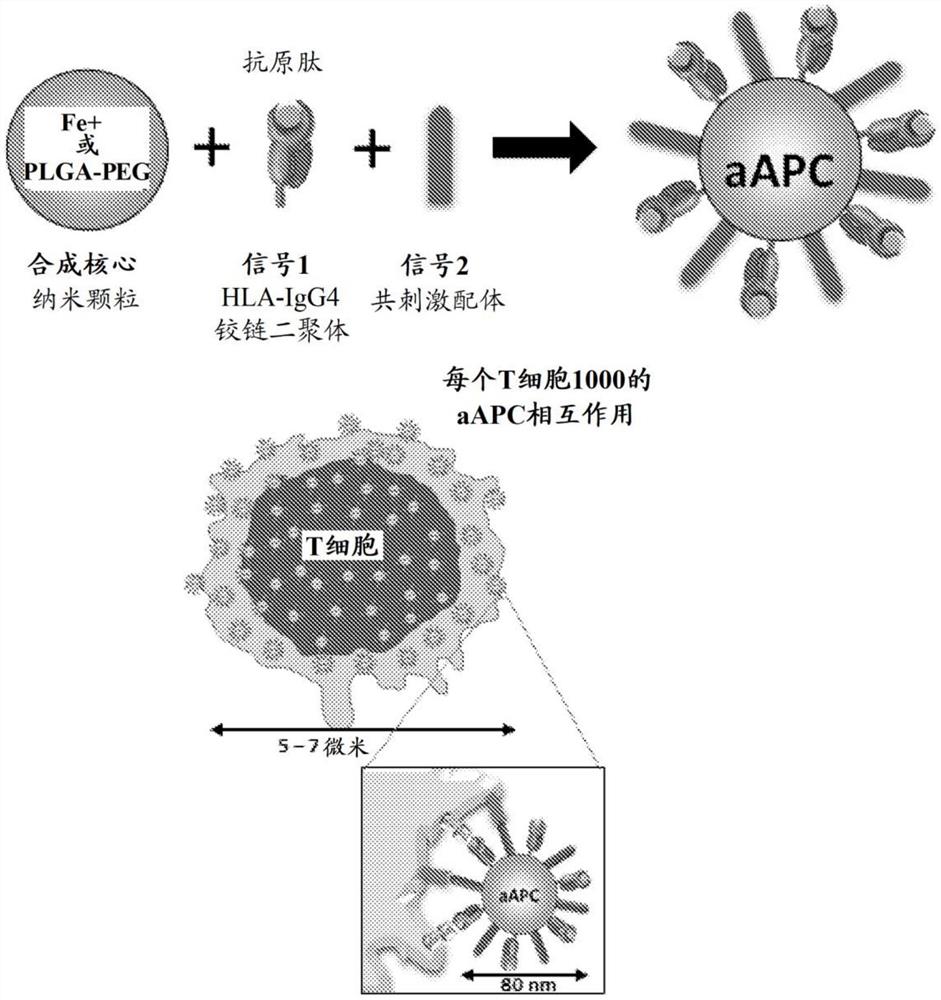
根据各种实施方案的细胞组合物可通过富集和扩增过程进行制备。在一些实施方案中,对一种或多种靶抗原(例如肿瘤相关抗原或病毒相关抗原)具有特异性的CD8+细胞被富集。即使当源淋巴细胞中主要为初始细胞时,这种细胞群体也能够在培养中快速扩增,以达到本文中所述的细胞组成。富集可使用顺磁性珠进行以主动选择细胞群体,并且由于T细胞表面受体的强效磁聚集,它可具有激活初始细胞和其他T细胞群体的额外优势。例如,顺磁性珠或纳米颗粒可含有呈递肽抗原的单体或多聚的(例如,二聚的)HLA配体,以及在相同或不同颗粒上的共刺激信号,如CD28的激动剂(例如,CD28的抗体激动剂)。在一些实施方案中,CD28+细胞也被富集,其可与抗原特异性富集同时进行。
在各种实施方案中,所述靶肽抗原是肿瘤或癌症相关抗原,包括肿瘤来源的、肿瘤特异性抗原和新生抗原。对肿瘤相关抗原具有特异性的T细胞常常非常罕见,并且在许多情况下在健康个体的外周血中检测不到。这常常是在病毒特异性T细胞与肿瘤抗原特异性T细胞之间观察到的区别。
在一些实施方案中,所述靶肽抗原包括至少一种与病原体相关或来源于病原体的抗原,所述病原体如病毒性、细菌性、真菌性或寄生性病原体。例如,至少一种肽抗原可与HIV、肝炎(例如,乙型、丙型或丁型)CMV、EB病毒(EBV)、流感、疱疹病毒(例如,HSV 1或2或水痘带状疱疹)和腺病毒相关。例如,CMV是在器官移植患者中发现的最常见的病毒性病原体,并且是接受骨髓或外周血干细胞移植的患者发病率和死亡率的主要原因。已知病毒激活与癌症生物学有牵连。
在其他实施方案中,所述细胞组合物包含对肿瘤相关抗原具有特异性的T细胞,其中病原体相关的抗原特异性T细胞作为旁观者细胞提供。其他旁观者细胞包括γδT细胞。特别地,通过富集HLA肽和抗CD28,旁观者细胞将被富集并被扩增,特别是当使用能够在不存在抗原特异性激活的情况下驱动这些细胞的一些非特异性扩增的T细胞生长因子混合物时。在这些实施方案中,虽然所述组合物中大部分是对靶肽具有特异性的T细胞(例如,从5%到75%),但其余的T细胞(从约0.25%到约25%)提供了一些针对常见病原体的免疫系统重建,这在移植后特别有益或在具有病毒病因学的癌症中是有益的。
一些实施方案在扩增期间采用影响T细胞的增殖和/或分化的T细胞生长因子。特别有用的细胞因子包括MIP-1β、IL-1β、IL-2、IL-4、IL-6、IL-7、IL-10、IL-21和INF-γ。在这些或其他实施方案中,所述细胞是在包含选自MIP-1β、IL-1β和IL-6的一种、两种或三种细胞因子的细胞因子混合物存在下在培养中扩增的。在一些实施方案中,所述细胞因子进一步包含IL-10。在一些实施方案中,所述生长因子包含IL-2、IL-4、IL-6、INF-γ和IL-1β或者基本上由IL-2、IL-4、IL-6、INF-γ和IL-1β组成。细胞可在培养中扩增1至4周,如约10天至约21天。
在其他方面中,本发明提供了用于制造细胞组合物的方法,所述方法包括通过用如本文中所述的aAPC富集和扩增。特别地,在从源淋巴细胞(例如,来自健康供体或来自需要过继免疫治疗的患者)中耗减CD4+细胞后,针对对靶肽抗原具有特异性的T细胞、以及在一些实施方案中针对CD28+细胞富集抗原特异性CD8+T细胞。靶细胞可利用纳米颗粒或微颗粒aAPC(如通过磁场诱导的细胞表面受体聚集离体激活T细胞的超顺磁性纳米颗粒)进行富集。包括乳胶或其他基于聚合物的纳米颗粒在内的其他材料也可用于使细胞表面受体聚集(无磁性诱导的聚集)。然后,可将富集的T细胞快速地离体扩增,包括使用重建的T细胞生长因子(例如,包含选自MIP-1β、IL-1β、IL-2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-15、IL-21、IFN-γ的因子)。在一些实施方案中,所述细胞是在选自MIP-1β、IL-1β、IL-6和IL-10的一种、两种或三种细胞因子存在下在培养中扩增的。在一些实施方案中,所述生长因子包含IL-2、IL-4、IL-6、INF-γ和IL-1β或者基本上由IL-2、IL-4、IL-6、INF-γ和IL-1β组成。在各种实施方案中,这些细胞因子与人工或天然抗原呈递细胞结合使用以扩增抗原特异性T细胞。
在其他方面中,本发明提供了用于过继细胞治疗的方法,包括用于治疗患有癌症的患者和/或经历了同种异体干细胞移植的患者的方法,所述患者接受了或未接受淋巴细胞耗减治疗、减瘤治疗、免疫调节治疗(在施用细胞治疗之前)。所述细胞治疗可在治疗后进一步提供或不提供细胞因子支持。在一些实施方案中,所述患者患有血液系统癌症,所述血液系统癌症在一些实施方案中在同种异体干细胞移植后复发。在一些实施方案中,所述患者患有急性髓性白血病(AML)或骨髓增生异常综合征。例如,在一些实施方案中,所述细胞组合物包含对WT1、PRAME、生存素和细胞周期蛋白A1肽抗原具有特异性的T细胞。然而,在其他实施方案中,癌症包括各种类型的实体瘤,包括癌、肉瘤和淋巴瘤。本文中描述了示例性靶肽抗原。
在一些实施方案中,所述患者患有感染性疾病或处于感染性疾病的风险中。例如,经历了HSCT的患者因免疫受损状态而处于感染性疾病的特定风险中。可被治疗或预防的感染性疾病包括由细菌、病毒、朊病毒、真菌、寄生虫、蠕虫等引起的感染性疾病。此类疾病包括AIDS、乙型/丙型肝炎、CMV感染、EB病毒(EBV)感染、流感、疱疹病毒感染(包括带状疱疹)和腺病毒感染。
在其他实施方案中,本发明提供了一种用于制备γδT细胞群体的方法。所述方法包括在IL-2、IL-4、IL-6、INF-γ和IL-1β中的两者或更多者存在下扩增包含γδT细胞的细胞群体。在扩增之前,所述细胞群体包含少于约20%或少于约10%或少于约8%的γδT细胞。在一些实施方案中,所述细胞群体是CD28富集的。在一些实施方案中,所述细胞群体是CD4+耗减的。如本文所述可进行培养中细胞的扩增,如1-4周。γδT细胞可使用诸如细胞分选的已知方法与其他细胞分离,并且可作为细胞组合物提供用于过继转移或研究用途,并且可替代地可进行修饰以表达一种或多种异源或工程化的基因,如异源或工程化的T细胞受体(例如,αβTCR),包括嵌合抗原受体(CAR)。
其他方面和实施方案将根据以下具体实施方式而是显而易见的。
附图说明
图1是示出用于产生CD8+抗原特异性T细胞的人工免疫调节(AIM)平台的图像。
图2是示出AIM ACT(过继细胞治疗)以及富集和扩增(E+E)细胞扩增系统的图像,所述系统实现抗原特异性T细胞的快速体外富集和扩增。
图3具有两个图,其示出用于AIM ACT平台的富集和扩增的抗原特异性细胞产物。左侧的图示出在使T细胞针对AML特异性抗原WT1
图4A和图4B示出由AIM ACT平台产生的CD8+T细胞包含记忆T细胞。图4A示出富集之后但在第0天扩增之前(顶部)和在第14天扩增之后(底部)的AML抗原特异性CD8+T细胞群体。T
图5A和图5B示出,离体富集和扩增的AML特异性T细胞具有高度多功能性表型,包括对IL-2(增殖和记忆)、IFN-γ(激活其他T细胞、记忆、MHC上调)、TNF-α(促炎性)和CD107A(颗粒酶释放、细胞毒性活性)的细胞内染色。绝大多数AML特异性T细胞(即,约62%)在非特异性刺激下表现出3-4种效应子功能(图5A,顶部)。在图5A(底部)中,所述图示出表达IL-2、TNF-α、IFN-γ和CD107A的T细胞的百分比。在图5A中,通过肽脉冲的T2细胞的非特异性刺激来刺激T细胞。在图5B中,示出使用从具有AML特异性抗原WT1
图6由四个图组成,所述图比较黑素瘤患者来源的PBMC(顶部)与健康供体来源的PBMC(底部)之间通过富集和扩增过程产生的Mart-1特异性T细胞的特异性。无论供体来源如何,富集和扩增过程都产生一致的细胞组成。此实验中的数据是从冷冻的PBMC产生的。
图7是示出基于AIM ACT的E+E过程产生了模拟天然免疫应答的TCR库,从而从经历了自然选择的天然T细胞库中提供稳健的过继治疗。多克隆TCR库的广度实现天然且持久的免疫应答。
图8具有示出E+E过程产生大量多发性骨髓瘤抗原特异性T记忆干细胞(T
图9A示出来自健康供体leucopak的多发性骨髓瘤抗原特异性T细胞的离体分批富集和扩增的T细胞的表型。所述图示出,E+E过程产生了大量抗原特异性CD8+T细胞(基于铰链二聚体染色,约1.6x10
图10示出γδT细胞的产生,包括Vδ1和Vδ2TCR亚型。
图11示出在扩增各种抗原特异性T细胞(AML、MM、EBV、MART-1)后第14天的γδT细胞百分比。第14天的γδT细胞百分比与第0天的γδT细胞的数量广泛相关。
具体实施方式
T细胞记忆在组成上是异质的,由能够在刺激后产生独特功能性应答的表面标志物的稳定、静息、表型上不同的子集组成。通过分化相关的子集包括中枢记忆T细胞(T
本文公开了分离的细胞组合物,所述分离的细胞组合物具有至少约10
在各种方面和实施方案中,本发明提供了分离的细胞组合物,以及制造所述细胞组合物的方法和利用细胞组合物治疗的方法。在一些实施方案中,所述细胞组合物用于过继细胞治疗。所述组合物包含在药学上可接受的载体中的至少约10
如本文中所用,术语“一种或多种靶肽抗原”或“靶抗原”指的是离体用于例如结合人工抗原呈递细胞(aAPC)或专职抗原呈递细胞(pAPC)平台(例如树突细胞)来富集和/或扩增所需CD8+细胞群体的肽抗原。采用aAPC或pAPC激活和扩增来自供体或患者淋巴细胞的CTL。在一些实施方案中,靶肽抗原是负载至aAPC上的用于离体富集和扩增特异性CD8+T细胞的肽表位。因此,术语“对靶肽抗原具有特异性”意指T细胞是与靶抗原一起经历的抗原。
在各种实施方案中,所述细胞组合物包含至少约10
本文公开了包含CD8+细胞毒性淋巴细胞(CTL)和记忆T细胞的细胞组合物。本公开的CTL包括以下T细胞群体:初始细胞、T记忆干细胞、中枢记忆细胞、效应记忆细胞和终末分化记忆细胞。根据本发明的实施方案,对靶抗原具有特异性的T细胞包括大量T
初始T细胞已在骨髓中分化,并成功地经历了胸腺中正负中枢选择过程。初始T细胞被认为是成熟的,并且与激活的或记忆T细胞不同,没有遇到其同源抗原。初始T细胞可根据L-选择素(CD62L)的表面表达和激活表面标志物的缺失进行表征。在初始状态中,T细胞一般是静止的,不分裂的。根据本公开,初始T细胞被定义为CD62L+和CD45RA+。
记忆T细胞包括T记忆干细胞(T
T记忆干细胞(T
根据本公开,中枢记忆T细胞(T
T中枢记忆细胞(T
各种实施方案中的组合物包含基本上由T
在各种实施方案中,所述组合物中的T细胞是至少约30%的中枢记忆细胞和效应记忆细胞、或至少约40%的中枢记忆细胞或效应记忆细胞、或至少约50%的中枢记忆T细胞或效应记忆T细胞,或者在一些实施方案中是至少约70%的中枢记忆细胞或效应记忆细胞、或至少约80%的中枢记忆T细胞或效应记忆T细胞或至少约90%的中枢记忆T细胞或效应记忆T细胞。
在一些实施方案中,所述细胞组合物包含少于约20%的终末分化记忆T细胞(例如,T
在各种实施方案中,CD8+T细胞含有约1%至约100%的T记忆干细胞,或者在一些实施方案中,约1%至约50%的T记忆干细胞,或者在一些实施方案中,约1%至约25%的T记忆干细胞、或约5%至约25%的T记忆干细胞、或约5%至约15%的T记忆干细胞(即,初始、T
在一些实施方案中,T
在各种实施方案中,对靶抗原具有特异性的T细胞是至少约30%的中枢记忆细胞和效应记忆细胞、或至少约40%的中枢记忆细胞或效应记忆细胞或至少约50%的中枢记忆T细胞或效应记忆T细胞,或者在一些实施方案中是至少约70%的中枢记忆细胞或效应记忆细胞、或至少约80%的中枢记忆T细胞或效应记忆T细胞或至少约90%的中枢记忆T细胞或效应记忆T细胞。在一些实施方案中,这些记忆细胞是约10:90至约90:10的中枢记忆细胞和效应记忆细胞。在一些实施方案中,这些记忆细胞是约25:75至约75:25的中枢记忆细胞和效应记忆细胞。在一些实施方案中,所述记忆T细胞是约40:60至约60:40的中枢记忆细胞和效应记忆T细胞。对一种或多种靶抗原具有特异性的T细胞是少于约20%的终末分化记忆T细胞(例如,TEMRA细胞),或少于约10%或少于约5%或少于约4%的终末分化记忆T细胞。在各种实施方案中,对靶抗原具有特异性的T细胞含有不超过约30%的初始细胞,或者在一些实施方案中不超过约20%的初始细胞,或者在一些实施方案中不超过约15%的初始细胞、或不超过约10%的初始细胞、或不超过约5%的初始细胞或不超过约2%或1.5%或1%的初始细胞。在各种实施方案中,抗原特异性T细胞含有约1%至约100%的T记忆干细胞,或者在一些实施方案中,约1%至约50%的T记忆干细胞,或者在一些实施方案中,约5%至约25%的T记忆干细胞或约5%至约15%的T记忆干细胞。这些记忆T细胞可通过利用顺磁性人工抗原呈递细胞(aAPC)的富集和扩增过程构建。可产生主要含有T
在各种实施方案中,所述细胞组合物是至少90%的T细胞、或至少95%的T细胞或至少98%或至少99%的T细胞。就本公开而言,T细胞的特征在于CD3+细胞。T细胞一般为CD8+或CD4-。如本文所用,除非另有说明,否则术语“CD8+”和“CD4-”是可互换的。例如,所述分离的细胞组合物的特征可为具有少于约10%或少于约5%的CD4+T细胞,或者在一些实施方案中,少于约2%、少于约1.5%或少于约1%的CD4+T细胞。当离体扩增CD8+T细胞时,CD4+细胞具有使CD8+细胞过度生长并竞争生长信号的趋势,并且外源性CD4+T细胞对于过继转移后的稳健且持久的应答而言不是必需的。
据描述,多功能性CD4+和CD8+T细胞的存在与对采用肽新生抗原的癌症疫苗治疗的应答相关。Ott PA等人,
在各种实施方案中,所述细胞组合物基本上为CD28+。例如,在各种实施方案中,所述细胞组合物为至少约25%、或至少约50%、或至少约75%或至少约90%CD28+。
在各种实施方案中,抗原特异性T细胞在激活后显示出多功能性表型。例如,在激活后,T细胞对以下中的两者或更多者呈阳性:针对作为增殖和记忆的标志物的IL-2;激活其他T细胞并诱导MHC的记忆与上调的IFN-γ产生;促炎性标志物TNF-α的产生;以及作为粒酶释放和细胞毒性活性的标志物的CD107A的胞内染色。在各种实施方案中,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%或至少80%的抗原特异性T细胞显示出这些标志物中的至少三者。在各种实施方案中,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%或至少80%的抗原特异性T细胞显示出这些标志物中的至少四者。在一些实施方案中,多功能性是使用靶杀伤测定进行评估或定量的,所述靶杀伤测定评估了CD8+细胞毒性T细胞溶解呈递与MHC复合的靶抗原的靶细胞的能力。
在各种实施方案中,所述细胞组合物还包含γδT细胞。γδT细胞在其表面上具有独特的T细胞受体(TCR)。与αβT细胞相比,γδT细胞具有由一条γ链和一条δ链组成的TCR。认为γδT细胞不需要抗原加工和肽表位的主要组织相容性复合物(MHC)呈递来激活。γδT细胞可在识别脂质抗原和磷酸抗原中起作用,并且可在抗病毒和抗肿瘤保护中起作用。参见Kalyan和Kabelitz,
在各种实施方案中,所述细胞组合物包含至少约2%的γδT细胞或至少约5%的γδT细胞。在一些实施方案中,所述细胞组合物包含至少约10%的γδT细胞或至少约20%的γδT细胞。在一些实施方案中,所述细胞组合物包含至少约25%的γδT细胞、或至少约30%或至少约35%或至少约40%的γδT细胞或至少约45%的γδT细胞。在这些实施方案中,γδT细胞可包含Vδ1和Vδ2细胞中的一者或两者。在一些实施方案中,一部分γδT细胞为CD8+。在各种实施方案中,γδT细胞主要为CD28+。
根据各种实施方案的细胞组合物可通过富集对一种或多种靶抗原(例如,肿瘤相关抗原或病毒相关抗原)具有特异性的CD8+细胞来制备。即使当源淋巴细胞中主要为初始细胞时,这种细胞群体也能够在培养中快速扩增,以达到本文中所述的细胞组成。可使用CD4+细胞耗减微珠将CD4+细胞从淋巴细胞中耗减(在抗原特异性富集前或抗原特异性富集后)。
CD8+细胞的抗原特异性富集可使用顺磁性珠进行以主动选择细胞群体,并且由于T细胞表面受体的强效磁聚集,它可具有激活初始细胞的额外优势。例如,顺磁性珠或纳米颗粒可含有呈递肽抗原的单体或多聚的(例如,二聚的)HLA配体以及共刺激信号,在一些实施方案中,如CD28的激动剂(例如,CD28的抗体激动剂)。在WO 2016/044530、PCT/US2017/22663和US 10,908,939(均以引用的方式整体并入本文)中描述了根据这些实施方案的示例性方法。
在一些实施方案中,CD28+细胞也被富集,其可与抗原特异性富集同时进行。CD28在T细胞上表达,并且是T细胞激活和存活所需的共刺激信号。CD28是在初始T细胞上组成性表达的唯一B7受体。在不存在CD28共刺激的情况下初始T细胞的TCR与MHC-抗原复合物的结合可得到无反应性的T细胞。在一些实施方案中,CD28+细胞未被富集,但CD28激动剂在富集过程中以可溶解的形式添加,或者以与非顺磁性珠缀合的形式添加。在一些实施方案中,在抗原特异性富集之后将CD28(以缀合形式或非缀合形式)添加至细胞中,目的是激活细胞用于扩增期。
在各种实施方案中,对靶抗原具有特异性的T细胞(例如,凭借由aAPC或pAPC展示的肽)对1至约100种靶抗原,或1至约75种靶抗原,或1至约50种靶抗原,或1至约25种靶抗原,或1至约20种靶抗原,或1至约15种靶抗原,或1至10种靶抗原,或1至5种靶抗原具有特异性。在各种实施方案中,存在至少3种或至少4种或至少5种靶抗原。在一些实施方案中,不同的靶抗原可包括重叠的肽表位。对这些肽抗原具有特异性的T细胞可被分批富集和扩增,从而允许进行细胞组合物的快速、平行生产。在一些实施方案中,所述组合物含有对5至15种或5至10种肽抗原具有特异性的T细胞。针对所述组合物中靶肽抗原的T细胞特异性是通过本领域中众所周知的MHC多聚体染色(例如,二聚体或四聚体染色)来界定的。
例如,纳米aAPC的混合物(每种aAPC均可呈递不同的独特靶抗原)可用于同时富集针对多种抗原的T细胞。例如,可从淋巴细胞源同时富集对2至10种抗原具有特异性的T细胞。在所述实施方案中,将合并许多不同的纳米aAPC批次(每批携带不同的MHC肽),并用于同时富集针对每种感兴趣的抗原的T细胞。将产生的T细胞汇集物针对这些抗原中的每种抗原来激活,并在培养中一起扩增。这些抗原可与单一治疗干预相关;例如,单一肿瘤或恶性细胞上存在的多种抗原。
靶肽抗原通常适合于由HLA-A、B或C分子复合物呈递,并且在一些实施方案中适合于由HLA-A2分子复合物呈递。
在各种实施方案中,所述靶肽抗原为肿瘤或癌症相关抗原,包括肿瘤衍生的抗原或肿瘤特异性抗原。对肿瘤相关抗原具有特异性的T细胞常常非常罕见,并且在许多情况下在健康个体的外周血中检测不到。进一步地,所述细胞常常为初始表型,特别是当使用供体T淋巴细胞时。参阅Quintarelli等人,
“肿瘤相关抗原”或“癌症特异性抗原”包括由作为其来源的肿瘤或恶性细胞专一性地表达的独特肿瘤或癌症抗原、在许多肿瘤中表达但在正常成人组织中不表达的共有肿瘤抗原(癌胚抗原),以及也由产生肿瘤的正常组织表达的组织特异性抗原。肿瘤相关抗原可为例如胚胎抗原、具有异常翻译后修饰的抗原、分化抗原、突变致癌基因或肿瘤抑制基因的产物、融合蛋白,或致癌病毒蛋白。
在一些实施方案中,所述靶肽抗原包括一种或多种与血液癌症相关或来源于血液癌症的抗原,所述血液癌例如白血病、淋巴瘤或骨髓瘤。例如,血液系统恶性肿瘤可为急性髓性白血病、慢性髓性白血病、儿童急性白血病、非霍奇金淋巴瘤、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生异常综合征、恶性皮肤T细胞、蕈样肉芽肿、非MF皮肤T细胞淋巴瘤、淋巴瘤样丘疹病和富含T细胞的皮肤淋巴样增生。在其他实施方案中,所述靶肽抗原包括一种或多种与实体瘤相关或来源于实体瘤的抗原,所述实体瘤包括黑素瘤、结肠癌、十二指肠癌、前列腺癌、乳腺癌、卵巢癌、导管癌、肝癌、胰腺癌、肾癌、子宫内膜癌、睾丸癌、胃癌、口腔粘膜异常增生、息肉病、头颈部癌、侵袭性口腔癌、非小细胞肺癌、小细胞肺癌、间皮瘤、移行和鳞状细胞尿道癌、脑癌、神经母细胞瘤和胶质瘤。
多种肿瘤相关抗原是本领域中已知的。癌胎抗原和胚胎抗原包括癌胚抗原和甲胎蛋白(通常仅在发育中的胚胎中高度表达,但经常分别被肝脏和结肠的肿瘤高度表达)、MAGE-1和MAGE-3(在黑素瘤、乳腺癌和胶质瘤中表达)、胎盘碱性磷酸酶唾液酸化-路易斯X(在腺癌中表达)、CA-125和CA-19(在胃肠道肿瘤、肝脏肿瘤和妇科肿瘤中表达)、TAG-72(在结直肠肿瘤中表达)、上皮糖蛋白2(在很多癌中表达)、胰癌胚抗原、5T4(在胃癌中表达)、甲胎蛋白受体(在多种肿瘤类型(特别是乳腺肿瘤)中表达)和M2A(在生殖细胞瘤变中表达)。
肿瘤相关分化抗原包括酪氨酸酶(在黑素瘤中表达)和特定的表面免疫球蛋白(在淋巴瘤中表达)。
突变致癌基因或肿瘤抑制基因产物包括Ras和p53(这二者在许多肿瘤类型中表达)、Her-2/neu(在乳腺癌和妇科癌症中表达)、EGF-R、雌激素受体、孕激素受体、视网膜母细胞瘤基因产物、myc(与肺癌相关)、ras、p53、与乳腺肿瘤相关的非突变体、MAGE-1和MAGE-3(与黑素瘤、肺癌和其他癌症相关)。融合蛋白包括BCR-ABL,其是在慢性髓系白血病中表达的。致癌病毒蛋白包括在宫颈癌中发现的HPV16、E6和E7型。
组织特异性抗原包括黑素转铁蛋白和MUC1(在胰腺癌和乳腺癌中表达);CD10(先前称为常见的急性淋巴母细胞白血病抗原或CALLA)或表面免疫球蛋白(在B细胞白血病和淋巴瘤中表达);IL-2受体、T细胞受体、CD45R、CD4+/CD8+的α链(在T细胞白血病和淋巴瘤中表达);前列腺特异性抗原和前列腺酸性磷酸酶(在前列腺癌中表达);GP 100、MelanA/Mart-1、酪氨酸酶、gp75/棕色、BAGE和S-100(在黑素瘤中表达);细胞角蛋白(在各种癌中表达);以及CD19、CD20和CD37(在淋巴瘤中表达)。
肿瘤相关抗原还包括改变的糖脂和糖蛋白抗原,例如含神经氨酸的鞘糖脂(例如,在黑素瘤和一些脑肿瘤中表达的GM2和GD2);可在癌中异常表达的血型抗原,特别是T和唾液酸化的Tn抗原;以及粘蛋白,如CA-125和CA-19-9(在卵巢癌上表达)或低糖基化MUC-1(在乳腺癌和胰腺癌上表达)。
例如,在一些实施方案中,一种或多种靶抗原与膀胱癌相关,例如NY-ESO-1、MAGE-A10和MUC-1抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与脑癌相关,并且可包括NY-ESO-1、生存素和CMV抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与乳腺癌相关,并且可包括MUC-1、生存素、WT-1、HER-2和CEA抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与宫颈癌相关,并且可包括HPV抗原。在一些实施方案中,一种或多种靶抗原与结直肠癌相关,并且可包括NY-ESO-1、生存素、WT-1、MUC-1和CEA抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与食管癌相关,并且可包括NY-ESO-1抗原。在一些实施方案中,一种或多种靶抗原可与头颈癌相关,并且可包括HPV抗原。在一些实施方案中,所述靶抗原与肾癌或肝癌相关,并且可包括NY-ESO-1抗原。在一些实施方案中,所述靶抗原与肺癌相关,并且可包括NY-ESO-1、生存素、WT-1、MAGE-A10和MUC-1抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与黑素瘤相关,并且可包括NY-ESO-1、生存素、MAGE-A10、MART-1和GP-100中的一种或多种。在一些实施方案中,一种或多种肽抗原与卵巢癌相关,并且可包括NY-ESO-1、WT-1和间皮素抗原中的一种或多种。在一些实施方案中,一种或多种靶抗原与前列腺癌相关,并且可包括生存素、hTERT、PSA、PAP和PSMA抗原中的一种或多种。在一些实施方案中,所述靶抗原与肉瘤相关,并且可包括NY-ESO-1抗原。在一些实施方案中,一种或多种靶抗原与淋巴瘤相关,并且可包括EBV抗原。在一些实施方案中,一种或多种靶抗原与多发性骨髓瘤相关,并且可包括NY-ESO-1、WT-1、XBP1-US、XBP1-SP、CD138、CS1(SLAMF7)和SOX2抗原中的一者或多者。在一些实施方案中,与多发性骨髓瘤相关的靶抗原是US 9,096,681中公开的肽抗原中的两者或更多者(或三者、四者、五者或六者),所述专利特此以引用的方式整体并入本文。包含抗原表位的示例性肽包括XBP1未剪接的(UN)
在一些实施方案中,一种或多种靶抗原与急性髓性白血病或骨髓增生异常综合征相关,并且可包括生存素、WT-1、PRAME、RHAMM、PR3和细胞周期蛋白A1抗原中的一者或多者(包括1、2、3、4或5者)。在一些实施方案中,所述靶抗原包括来自下文表1的至少1、2、3、4、5、6、7、8、9、10种或全部靶抗原。
在一些实施方案中,一种或多种靶抗原可包括
XBP1-US、XBP1-SP、CD138、CS1、NY-ESO1、SOX2、EBV、流感、CMV、RHAMM、PR3、Mart-1/Melan A、gp100、CMVpp65和流感基质蛋白M1抗原中的一者或多者。在一些实施方案中,靶抗原包括来自以下表2的至少1、2、3、4、5、6、7、8、9或10种靶抗原,所述靶抗原可用于靶向多发性骨髓瘤、黑素瘤或各种病毒性或感染性疾病。
在一些实施方案中,一种或多种靶肽抗原是新生抗原。例如,在一些实施方案中,鉴定出对患者具有特异性的新生抗原并合成所述新生抗原用于负载aAPC。在一些实施方案中,通过对患者恶性肿瘤的遗传分析(例如,通过对恶性细胞的核酸测序),然后通过预测性生物信息学来鉴定3至10种新生抗原。在一些实施方案中,所述抗原为自然的非突变的癌症抗原,其中很多是已知的。
在各种实施方案中,通过低频前体T细胞识别出至少一种靶肽抗原。根据这些实施方案,本发明使得这些细胞能够被快速地激活和扩增用于过继治疗。
在一些实施方案中,所述靶肽抗原包括至少一种与病原体相关或来源于病原体的抗原,所述病原体如病毒性、细菌性、真菌性或寄生性病原体。例如,至少一种肽抗原可与HIV、肝炎(例如,甲型、乙型、丙型或丁型)CMV、EB病毒(EBV)、流感、疱疹病毒(例如,HSV1或2或水痘带状疱疹)和腺病毒相关。例如,CMV是在器官移植患者中发现的最常见的病毒性病原体,并且是接受骨髓或外周血干细胞移植的患者发病率和死亡率的主要原因。这是由于这些患者的免疫受损状况所致,所述免疫受损状况允许血清阳性患者中的潜伏病毒再激活或血清阴性个体中出现机会性感染。在这些实施方案中,患者可接受包含对病原体抗原具有特异性的T细胞的过继性免疫治疗。所述方法可需要在移植手术开始前产生源自患者或适当的供体的病毒特异性CTL。
在一些实施方案中,至少一种靶抗原为病原体相关抗原,包括与原生动物、细菌、真菌(单细胞和多细胞)、病毒、朊病毒、胞内寄生虫、蠕虫和其他感染因子相关的抗原。
细菌抗原包括革兰氏阳性球菌、革兰氏阳性杆菌、革兰氏阴性菌、厌氧菌的抗原,例如放线菌科、芽孢杆菌科、巴尔通体科、博德特菌科(Bordetellae)、噬纤维菌科(Captophagaceae)、棒杆菌科、肠杆菌科、军团菌科、微球菌科、分枝杆菌科、诺卡尔菌科、巴斯德菌科、假单胞菌科、螺旋体科、弧菌科的生物以及不动杆菌属、布鲁杆菌属、弯曲杆菌属、丹毒丝菌属、爱文菌属(Ewingella)、弗朗西丝菌属、加德纳菌属、螺杆菌属、雷夫癣菌属(Levinea)、李斯特菌属(Listeria)、链杆菌属和吸收障碍菌属(Tropheryma)的生物。
原生动物感染因子的抗原包括三日疟原虫(malarial plasmodia)、利什曼原虫属物种、锥虫属物种和血吸虫属物种的抗原。
真菌抗原包括曲霉菌属、芽生菌属、念珠菌属、球孢菌属、隐球菌属、组织胞浆菌属、副球孢子菌属(Paracoccicioides)、孢子丝菌属、毛霉菌目的生物、诱发产色霉菌病(choromycosis)和足分支菌病的生物,以及发癣菌属、小孢子菌属、表皮癣菌属和马拉色菌属的生物的抗原。
病毒肽抗原包括但不限于腺病毒、单纯疱疹病毒、乳头状瘤病毒、呼吸道合胞病毒、痘病毒、HIV、流感病毒、EBV、肝炎和CMV的抗原。特别有用的病毒肽抗原包括HIV蛋白,例如HIV gag蛋白(包括但不限于膜锚定(MA)蛋白、核心衣壳(CA)蛋白和核衣壳(NC)蛋白)、HIV聚合酶、流感病毒基质(M1)蛋白和流感病毒核衣壳(NP)蛋白、乙型肝炎表面抗原(HBsAg)、乙型肝炎核心蛋白(HBcAg)、戊型肝炎蛋白(HBeAg)、乙型肝炎DNA聚合酶、丙型肝炎抗原等。
在一些实施方案中,所述靶肽抗原包括一种或多种肿瘤相关抗原以及一种或多种病毒相关抗原(例如CMV、EBV、流感或腺病毒),以便提供抗肿瘤应答,同时抵御使HSCT后恢复复杂化的常见病原体。
经历了HSCT的患者因免疫受损状态而处于感染性疾病的特定风险中。这些患者的免疫受损状况允许血清阳性患者中潜伏病毒再激活或血清阴性个体中出现机会性感染。例如,移植后淋巴组织增生性疾病(PTLD)发生在相当一部分移植患者中,并且是由EB病毒(EBV)感染所致的。据认为,美国约90%的成人群体中存在EBV感染。活跃的病毒复制和感染受免疫系统的控制,但与CMV的情况一样,因移植治疗而免疫受损的个体失去对T细胞群的控制,这允许病毒再激活。这代表了移植方案的严重阻碍。EBV还可参与了多种血液和非血液癌症的肿瘤促进。
在另外的其他实施方案中,所述细胞组合物包含对肿瘤相关抗原具有特异性的T细胞,其中病原体相关T细胞作为旁观者细胞提供。特别地,通过基于利用HLA肽复合物和抗CD28选择来对CD8+T细胞进行富集,旁观者细胞将被富集并被扩增,特别是当使用能够在不存在抗原特异性激活的情况下驱动这些细胞的一些非特异性扩增的T细胞生长因子混合物时。在这些实施方案中,虽然所述组合物中大部分是对靶肽具有特异性的T细胞(例如,5%到75%,或10%到50%),但剩余的T细胞提供了一些针对常见病原体的免疫系统重建,这在移植后特别有益。例如,所述组合物可包含对CMV、EBV、流感和腺病毒具有特异性的T细胞。在每种情况下,病原体特异性T细胞可以所述组合物的0.1%至约4%存在。
在各种实施方案中,本发明涉及通过富集和扩增抗原特异性CD8+T细胞制备的组合物。前体T细胞可从患者或从合适的HLA匹配的供体获得。源T细胞可为新鲜样品或冷冻样品。前体T细胞可从包含WBC的许多来源获取,包括外周血单核细胞(PBMC)、骨髓、淋巴结组织、脾脏组织、血沉棕黄层级分和肿瘤。在一些实施方案中,前体T细胞是使用本领域的人员或技术人员已知的任何数量的技术从受试者收集的血液单位中获取的。例如,来自个体的循环血的前体T细胞可通过单采或白细胞单采获得。单采产品通常含有淋巴细胞,包括T细胞和前体T细胞、单核细胞、粒细胞、B细胞、其他有核白细胞、红细胞和血小板。白细胞单采是一种从血样中分离白细胞的实验室程序。
可对通过单采收集的细胞进行洗涤,以除去血浆成分并将细胞置于适当的缓冲液或培养基中用于后续处理步骤。洗涤步骤可通过本领域技术人员已知的方法,例如通过使用半自动“流通式”离心机来完成。洗涤后,可将细胞再混悬于各种生物相容的缓冲液,例如不含钙不含镁的PBS中。可替代地,可除去单采样品中的不需要的组分,并将细胞直接再混悬于培养基中。
如果需要,可通过溶解红细胞并耗减单核细胞(例如,通过经PERCOLL
在某些实施方案中,通过白细胞单采收集白细胞,随后可例如通过耗减样品中的CD4+细胞和/或正富集CD8+细胞来富集CD8+T细胞。在一些实施方案中,耗减其他细胞类型,例如NK细胞。然后,可对富含CD8的细胞进一步进行抗原特异性T细胞的富集。
在各种实施方案中,使包含免疫细胞(例如CD8+T细胞)的样品与具有磁特性的人工抗原提呈细胞(aAPC)接触。顺磁性材料对磁场具有小的正磁化率。这些材料受磁场吸引,当除去外场时,材料不保留磁性。示例性顺磁性材料包括但不限于镁、钼、锂、钽和铁氧化物。适合磁性富集的顺磁性珠可从市场上获取(DYNABEADS
抗原呈递复合物包含抗原结合槽,并且一般为MHC I类,其可被连接或栓接以提供二聚的或多聚的MHC。在一些实施方案中,所述MHC为单体的,但它们在纳米颗粒上的密切缔合足以进行亲合与激活。在一些实施方案中,所述MHC为二聚的。二聚的MHC I类配体可通过与免疫球蛋白重链序列融合来进行构建,所述免疫球蛋白重链序列然后通过一个或多个二硫键进行缔合(与相关的轻链缔合或不与相关的轻链缔合)。MHC多聚体可通过经由肽或化学接头的直接栓接而产生,或者可通过经由生物素部分与抗生蛋白链菌素缔合而形成多聚体。在一些实施方案中,所述抗原呈递复合物为涉及与免疫球蛋白序列的融合的MHC I类复合物。
美国专利6,268,411(其通过引用的方式整体纳入本文)中描述了具有免疫球蛋白序列的MHC I类分子复合物。这些MHC I类分子复合物可在免疫球蛋白重链的末端以构象完整的方式形成。与抗原肽结合的MHC I类分子复合物能够稳定地与抗原特异性淋巴细胞受体(例如,T细胞受体)结合。在各种实施方案中,所述免疫球蛋白重链序列不是全长的,但是包含Ig铰链区以及CH1、CH2和/或CH3结构域中的一个或多个。Ig序列可包含或可不包含可变区,但在存在可变区序列的情况下,可变区可以是完整的或部分的。所述复合物还可包含免疫球蛋白轻链。如WO 2016/105542(其以引用的方式整体并入本文)中所述的,缺乏可变链序列(并且缺乏任何轻链)的MHC I类配体(例如,HLA-Ig)以与颗粒定点缀合的方式被采用。
示例性MHC I类分子复合物包含至少两种融合蛋白。第一融合蛋白包含第一MHC I类α链和第一免疫球蛋白重链(或其包含铰链区的部分),并且第二融合蛋白包含第二MHC I类α链和第二免疫球蛋白重链(或其包含铰链区的部分)。第一和第二免疫球蛋白重链结合形成MHC I类分子复合物,其包含两个MHC I类肽结合槽。所述免疫球蛋白重链可为IgM、IgD、IgG1、IgG3、IgG2β、IgG2α、IgG4、IgE或IgA的重链。在一些实施方案中,使用IgG重链形成MHC I类分子复合物。如果需要多价MHC I类分子复合物,可使用IgM或IgG重链来分别提供五价或四价分子。
示例性I类分子包括HLA-A、HLA-B、HLA-C、HLA-E,并且这些分子可单独或以任何组合使用。在一些实施方案中,所述抗原呈递复合物为HLA-A2配体。如本文中使用的术语MHC在每个例子中均可用HLA替代。
一些实施方案中的免疫球蛋白序列为人源化单克隆抗体序列。
aAPC可含有“信号2”,例如抗-CD28配体。信号2一般为影响分子的T细胞,即对前体T细胞或抗原特异性T细胞具有生物影响的分子。在某些实施方案中,信号2是T细胞共刺激分子。T细胞共刺激分子有助于激活抗原特异性T细胞。此类分子包括但不限于与CD28(包括抗体)、CD80(B7-1)、CD86(B7-2)、B7-H3、4-1BB、4-1BBL、CD27、CD30、CD134(OX-40L)、B7h(B7RP-1)、CD40、LIGHT特异性结合的分子,与HVEM特异性结合的抗体,与CD40L特异性结合的抗体以及与OX40特异性结合的抗体。在一些实施方案中,所述共刺激分子(信号2)是抗体(例如,单克隆抗体)或其一部分,例如F(ab’)2、Fab、scFv或单链抗体或其他抗原结合片段。在一些实施方案中,所述抗体是人源化单克隆抗体或其具有抗原结合活性的部分,或者是全人抗体或其具有抗原结合活性的部分。
可采用的共刺激配体的组合(在相同或不同的纳米颗粒上)包括抗CD28/抗CD27和抗CD28/抗41BB。这些共刺激配体的比例可改变以影响扩增。
WO 2014/209868中描述了示例性信号1和信号2配体,所述专利描述了这样的配体,其具有游离巯基(例如,未配对的半胱氨酸),使得恒定区可与具有适当化学官能团的纳米颗粒载体偶联。
对纳米aAPC有用的粘附分子可用于介导纳米aAPC与T细胞或与T细胞前体的粘附。有用的粘附分子包括例如ICAM-1和LFA-3。
在一些实施方案中,信号1是由肽-HLA-A2复合物提供,信号2是由B7.1-Ig或抗CD28提供。示例性抗CD28单克隆抗体为9.3mAb(Tan等人,J.Exp.Med.1993 177:165),其在某些实施方案中可被人源化,并且/或者以完全的完整抗体或其抗原结合片段的形式与珠缀合。
磁激活可发生2分钟至5小时,或5分钟至至2小时,随后在培养中扩增至少5天,并且在一些实施方案中可达2周或达3周。在一些实施方案中,磁激活发生至少2分钟,但短于30分钟或短于15分钟(例如,约5或10分钟)。可对所得CD8+T细胞进行表型表征,以确认T记忆干细胞(T
一些实施方案在扩增期间采用影响T细胞的增殖和/或分化的T细胞生长因子。T细胞生长因子的实例包括细胞因子(例如,白介素、干扰素)和超抗原。如果需要,细胞因子可存在于包含融合蛋白的分子复合物中,或者可被aAPC包裹,或者以可溶解形式提供。特别有用的细胞因子包括MIP-1β、IL-1β、IL-2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-15、IL-21、IFN-γ和CXCL10。在一些实施方案中,生长因子包括来自MIP-1β、IL-1β、IL-2、IL-4、IL-6、IL-7、IL-10、IL-15、IL-21和INF-γ的3、4、5或6种。在这些或其他实施方案中,所述细胞在包括选自MIP-1β、IL-1β、IL-6和IL-10的一种、两种、三种细胞因子的细胞因子存在下在培养中扩增。在一些实施方案中,所述细胞未在IL-7和/或IL-21和/或IL-15存在下进行培养。细胞可在培养中扩增1至4周,例如约2周(约14天)或约3周。
在一些实施方案中,将所述细胞在4至8种细胞因子存在下在培养中进行扩增,以达到T细胞扩增(包括抗原特异性T细胞扩增)、激活和记忆表型间之间的平衡。在一些实施方案中,所述细胞在IL-4存在下扩增。在一些实施方案中,所述细胞在IL-4和IL-6存在下扩增。在一些实施方案中,所述细胞未在IL-4和IL-1β存在下扩增。在一些实施方案中,所述细胞在IL-4、IL-6和IL-1β存在下扩增。在一些实施方案中,所述细胞在IL-2、IL-4和IL-6存在下扩增。在一些实施方案中,所述细胞在IL-2、IL-4、IL-6、INF-γ和IL-1β存在下扩增。在一些实施方案中,所述细胞在IL-10存在下进一步扩增。在各种实施方案中,这些细胞因子与人工或天然抗原呈递细胞结合使用以扩增抗原特异性T细胞。
在一些实施方案中,生长因子由或基本上由IL-2、IL-4、IL-6、INF-γ、IL-1β以及任选的IL-10组成。
在一些实施方案中,IL-2在培养开始时以10至200国际单位(IU)/ml,如约20至约100IU/ml,或约20至约60IU/ml存在。在一些实施方案中,IL-2在培养开始时以约30至约50IU/ml(例如,约40IU/ml)存在。IL-2IU(86/500NIBSC)可用增殖测定(例如,使用CTLL-2细胞系)进行测定,如例如Gearing和Bird(1987)在
在这些或独立的实施方案中,IL-4在培养开始时以0.2至25国际单位(IU)/ml,如约0.5至约10IU/ml,或约0.5至约5IU/ml存在。在一些实施方案中,IL-4在培养开始时以约1IU/ml存在。IL-4IU(88/656NIBSC)可使用增殖测定(例如,使用TF-1细胞系)进行界定,如例如Kitamura T.等人(1991)
在这些或独立的实施方案中,IL-6可在培养开始时以10至200国际单位(IU)/ml,例如约25至约100IU/ml,例如从25至75IU/ml存在。在一些实施方案中,IL-6在培养开始时以约40至约60IU/ml(例如,约50IU/ml)存在。IL-6IU(89/548NIBSC)可使用增殖测定(例如,使用B9细胞系)来界定,如例如Gaines-Das RE和Poole S.(1993)在
在这些或独立的实施方案中,干扰素γ(INF-γ)可在培养开始时以10至200国际单位(IU)/ml,如约20至约100IU/ml,如20至60IU/ml存在。在一些实施方案中,INF-γ在培养开始时以约30至约50IU/ml(例如,约40IU/ml)存在。INF-γIU(87/586NIBSC)可使用抗病毒测定(例如,使用被EMC感染的Hela细胞)进行界定,如例如在Meager A.(1987)
IL-1β可在培养开始时以5至100国际单位(IU)/ml,如约10至约50IU/ml,如10至约30IU/ml存在。在一些实施方案中,IL-1β在培养开始时以约10至约20IU/ml(例如,约15IU/ml)存在。IL-1βIU(86/680NIBSC)可使用增殖测定(例如,使用D.10.G4.1细胞)进行界定,如例如由Poole,S.和Gaines-Das,RE(1991)
在各种实施方案中,所述细胞是在包含IL-2、IL-4、IL-6、INF-γ和IL-1β或由IL-2、IL-4、IL-6、INF-γ和IL-1β组成的生长因子混合物存在下培养的。在一些实施方案中,IL-2和INF-γ的相对活性(按相应的IU界定)为约0.5:1至约1:0.5(例如,约1:1)。在这些或独立的实施方案中,IL-2和IL-6的相对活性(按相应的IU界定)为约0.5:1至1:0.5。在这些或独立的实施方案中,IL-1β相对于IL-2、IL-6和/或IFN-γ的相对活性(按相应的IU界定)是1:4至1:2(例如,1:3)。在这些或独立的实施方案中,IL-4相对于IL-2、IL-6和/或IFN-γ的相对活性(按相应的IU界定)是1:30至1:60。在这些或独立的实施方案中,IL-4相对于IL-1β的相对活性(按相应的IU界定)是约1:5至约1:25,例如约1:10至约1:20。
在一些实施方案中,培养开始时每种生长因子(IL-2、IL-4、IL-6、INF-γ和IL-1β)的比活性(IU),可表示为当培养物中所有生长因子的总IU被视为100%时的百分比。例如,在一些实施方案中,培养物中每种生长因子的百分比可如下:
20%至40%IL-2(例如,20至30%IL-2);
0.5%至5%IL-4(例如,1至3%IL-4);
25%至50%IL-6(例如,30至40%IL-6);
20%至40%IFN-γ(例如,20至30%IFN-γ);以及
5%至20%IL-1β(例如,5至15%IL-1β)。
aAPC纳米颗粒可由任何材料制成,并且材料可根据所需的磁特性适当选择,并且可包括例如金属,如铁、镍、钴或稀土金属的合金。顺磁性材料还包括镁、钼、锂、钽和铁氧化物。适合于富集材料(包括细胞)的顺磁性珠可从市场上获取,并且包括右旋糖酐铁珠,例如右旋糖酐包被的氧化铁珠。在不需要磁特性的本发明的方面中,纳米颗粒也可由非金属或有机(例如,高分子)材料,例如纤维素、陶瓷、玻璃、尼龙、聚苯乙烯、橡胶、塑料或乳胶制成。用于制备纳米颗粒的示例性材料是聚(乳酸-乙醇酸)共聚物(PLGA)或PLA及其共聚物,其可与这些实施方案结合使用。可采用的包括聚合物和共聚物在内的其他材料包括PCT/US2014/25889(其以引用的方式整体并入本文)中所述的材料。
在各种实施方案中,颗粒的大小(例如,平均直径)在约10至约500nm范围内,或在约40至约400nm范围内,或在约40nm至约200nm范围内。对于磁聚集而言,在一些实施方案中优选纳米颗粒的大小(平均直径)在10至250nm、或50至200nm、或80至200nm或20至100nm范围内。在细胞-纳米颗粒界面处的受体-配体相互作用尚不清楚。但是,纳米颗粒结合和细胞激活对膜空间组织敏感,所述膜空间组织组织在T细胞激活过程中特别重要,并且磁场可用于操控被簇结合的纳米颗粒以提高激活。例如,T细胞激活诱导持续增强的纳米级TCR聚集状态,纳米颗粒对这种聚集敏感,而较大颗粒则不会。
此外,纳米颗粒与TCR簇的相互作用可用于增强受体触发。T细胞激活受信号转导蛋白的团聚介导,其中“信号转导簇”跨越数百纳米,在T细胞-APC接触位点的边缘初步形成并向内迁移。如本文所述,外部磁场可用于富集抗原特异性T细胞(包括罕见的初始细胞)并用于驱动与TCR结合的磁性纳米aAPC的团聚,从而导致TCR簇团聚和初始T细胞激活增强。磁场可对顺磁性颗粒施加适当的强大作用力,但在其他方面是生物惰性的,这使它们成为控制颗粒行为的有力工具。与顺磁性纳米aAPC结合的T细胞在外部施加的磁场存在下被激活。纳米aAPC本身被磁化,并被场源和场中附近的纳米颗粒吸引,从而诱导珠并且因此诱导TCR团聚以提升aAPC介导的激活。
激活化学可用于实现分子与纳米颗粒表面的特异性稳定连接。有多种方法可用于使蛋白质连接至官能团。例如,在一个两步的工艺中,可使用常见的交联剂戊二醛将蛋白质胺基团连接至胺化的纳米颗粒表面。由此得到的连接键在水解上是稳定的。其他方法包括使用含有N-羟基琥珀酰亚胺(NHS)酯(其与蛋白质上的胺反应)的交联剂、含有活性卤素(其与含胺、巯基或组氨酸的蛋白质反应)的交联剂、含有环氧化物(其与胺或巯基反应)的交联剂、马来酰亚胺基团与巯基基团之间的缀合,以及蛋白醛基的形成(其通过用高碘酸盐氧化侧接糖部分,接着还原胺化来进行)。
当在相同或不同的颗粒上同时使用时,特定配体的比例可改变,以增加纳米颗粒在抗原或共刺激配体呈递中的有效性。例如,纳米颗粒可与HLA-A2-Ig和抗CD28(或其他信号2配体)以多种比率,例如约30:1、约25:1、约20:1、约15:1、约10:1、约5:1、约3:1、约2:1、约1:1、约0.5:1、约0.3:1、约0.2:1、约0.1:1或约0.03:1进行偶联。在一些实施方案中,所述比率是2:1至1:2。与载体偶联的蛋白质总量可为例如约250mg/ml、约200mg/ml、约150mg/ml、约100mg/ml,或约50mg/ml颗粒。由于诸如细胞因子释放和生长的效应子功能与T细胞激活和分化相比,对信号1与信号2有不同要求,因此这些功能可单独测定。
在某些实施方案中,所述aAPC是50至150nm范围内的顺磁性颗粒,其中PDI(大小分布)低于0.2,或在一些实施方案中低于0.1。aAPC可具有0至-10mV,例如约-2至-6mV的表面电荷。aAPC每个颗粒可具有10至120个配体,例如每个颗粒约25至约100个配体,其中配体通过在免疫球蛋白序列的Fc区中引入的游离半胱氨酸而与颗粒缀合。颗粒可含有约1:1比率的HLA二聚体:抗CD28,其可存在于相同或不同的颗粒群上。纳米颗粒提供了同源T细胞的强有力的扩增,同时表现出对非同源TCR无刺激,即使在被动加载肽抗原的情况下也是如此。颗粒在冻干形式下可稳定至少两年或三年。
在富集和扩增后,样品的抗原特异性T细胞组分将是至少约5%、或至少约10%、或至少约15%、或至少约20%或至少约25%的抗原特异性T细胞。此外,这些T细胞包括T记忆干细胞,并且还可包括中枢记忆T细胞和效应记忆T细胞。根据从患者分离的原始样品,将各种实施方案中的抗原特性T细胞从约100倍扩增(在约7天中)至约10,000倍,例如至少约100倍,或至少约200倍。在2周后,抗原特异性T细胞在各种实施方案中扩增了至少1,000倍或至少约2,000倍、至少约3,000倍、至少约4,000倍或至少约,5000倍。在一些实施方案中,两周后抗原特异性T细胞扩增了大于5,000倍或大于10,000倍。在扩增一周或两周后,得到至少约10
合适的孵育条件(培养基、温度等)包括用于培养T细胞或T细胞前体的条件,以及用于使用DC或人工抗原呈递细胞诱导抗原特异性T细胞形成的本领域已知的条件。
所述细胞组合物可通过包括静脉输注、动脉内施用、淋巴管内施用和肿瘤内施用在内的任何适当的途径施用于患者。
在一些实施方案中,患者在通过过继转移接受细胞组合物之前(或者任选地在通过过继转移接受细胞组合物之后)接受或开始一种或多种检查点抑制剂的免疫治疗。在各种实施方案中,一种或多种检查点抑制剂靶向CTLA-4或PD-1/PD-L1中的一者或多者,它们可包括针对此类靶标的抗体,例如单克隆抗体或其部分或其人源化或完全人源化的型式。在一些实施方案中,所述检查点抑制剂治疗包含伊匹单抗或可瑞达(帕博利珠单抗),或可比的单克隆抗体。在一些实施方案中,患者先前接受了PD1阻断疗法,并且对所述治疗是难治性的或仅对所述治疗有部分应答。在此类实施方案中,本文所述的细胞组合物可任选地与第二轮免疫疗法(例如,抗CTLA4或PD-1阻断疗法)组合来恢复稳健的T细胞应答。
在一些实施方案中,所述患者接受约1至5轮过继免疫治疗(例如,一轮、两轮、三轮、四轮或五轮过继免疫治疗)。在一些实施方案中,过继免疫治疗的每次施用与一轮检查点抑制剂治疗同时进行或在一轮检查点抑制剂治疗之后(例如,在一轮检查点抑制剂治疗之后约1天至约1周)进行。在一些实施方案中,在给予检查点抑制剂剂量后约1天、约2天、约3天、约4天、约5天、约6天或约1周提供过继免疫治疗。在一些实施方案中,所述患者仅接受细胞组合物的单次施用。
在一些方面中,本发明提供了个体化癌症免疫治疗的方法。所述方法是通过使用aAPC来鉴定患者将对其作出应答的抗原,并然后向患者施用适当的载肽aAPC,或随后离体富集和扩增抗原特异性T细胞来完成的。
全基因组测序极大地改变了我们对癌症生物学的理解。癌症测序已经产生关于许多人类癌症发展所涉及的分子过程的重要数据。已在参与调节以下三个主要细胞过程的途径的主要基因中鉴定出驱动突变:(1)细胞命运;(2)细胞存活;(3)基因组维持。Vogelstein等人,Science 339,1546-58(2013)。
全基因组测序也有可彻底改变我们的癌症免疫治疗途径。测序数据可提供有关癌症免疫治疗的共享靶标以及个性化靶标的信息。原则上,突变蛋白是免疫系统的外来物,是推定的肿瘤特异性抗原。实际上,测序工作已经定义了数百个,甚至数千个潜在相关的免疫靶标。有限的研究已经证明,针对这些新表位的T细胞应答可在癌症患者中发现或由癌症疫苗诱导。但是,此类针对特定癌症的应答的频率和患者之间共享此类应答的程度尚不清楚。我们对肿瘤特异性免疫应答的了解有限的一个主要原因是,目前验证潜在免疫相关靶标的途径繁琐且耗时。
尽管中枢耐受消除了T细胞对自身蛋白的应答,但致癌突变诱导了针对其可形成T细胞应答的新表位。来源于全外显子测序的突变目录提供了用于鉴定此类新表位的起点。使用HLA结合预测算法(Srivastava,PLoS One 4,e6094(2009)),预测每种癌症可具有达7至10个新表位。一种相似的途径预测了数百种肿瘤新表位。然而,此类算法预测T细胞应答的准确度可能很低,预计仅10%的预测HLA结合表位在HLA的背景下结合(Lundegaard C,Immunology 130,309-18(2010))。因此,预测的表位必须针对是否存在对抗这些潜在新表位的T细胞应答来进行验证。
在某些实施方案中,使用纳米aAPC系统筛选用于在多种癌症中或在特定患者癌症中诱导T细胞应答的新表位。可例如通过全外显子测序对癌症进行基因分析。
候选肽列表可由突变蛋白中重叠的九个氨基酸窗口生成。将选择含有突变氨基酸的全部九个AA窗口和每种蛋白质的2个非突变“对照品”。将使用包括Net MHC和稳定基质方法(SMM)在内的MHC结合预测算法的共识,对这些候选肽的MHC结合进行计算评估。纳米-aAPC和MHC结合算法是主要针对HLA-A2等位基因开发的。可调节共识预测的灵敏度截止值,直至鉴定出可处理数量的含突变的肽(约500)和非突变对照肽(约50)。
在一个示例性实施方案中,所述细胞组合物在药学上可接受的载体中包含:至少70%、至少80%或至少90%的CD8+或CD4-T细胞和少于5%的CD4+T细胞;和至少5%的T
在各种实施方案中,所述细胞组合物还包含γδT细胞。例如,所述细胞组合物可包含至少约2%的γδT细胞或至少约5%的γδT细胞。在一些实施方案中,所述细胞组合物包含至少约10%的γδT细胞或至少约20%的γδT细胞。在一些实施方案中,所述细胞组合物包含至少约25%的γδT细胞、或至少约30%或至少约35%或至少约40%的γδT细胞。在这些实施方案中,γδT细胞可包含Vδ1和Vδ2细胞中的一者或两者。在一些实施方案中,γδT细胞主要是Vδ2(例如,至少约60%或至少约75%)。在一些实施方案中,一部分γδT细胞为CD8+。在各种实施方案中,γδT细胞主要为CD28+。
在一些实施方案中,所述细胞组合物还包含适合静脉输注并且可适合作为冷冻保护剂的药学上可接受的载体。示例性载体是DMSO(例如,约10%)。细胞组合物可在单位小瓶或袋中提供,并且冷冻储存至使用。单位剂量可包含约5x10
在一些方面中,本发明提供了治疗患有癌症的患者的方法,其包括向有需要的患者施用本文所述的细胞组合物。
在一些实施方案中,所述患者患有血液系统癌症,所述血液系统癌症在一些实施方案中在同种异体干细胞移植后复发。在一些实施方案中,所述患者患有急性髓性白血病(AML)或骨髓增生异常综合征。
可根据本公开治疗的其他癌症包括在历史上引发不良免疫应答或具有高复发率的癌症。示例性癌症包括各种类型的实体瘤,包括癌、肉瘤和淋巴瘤。在各种实施方案中,所述癌症是黑素瘤(包括转移性黑素瘤)、结肠癌、十二指肠癌、前列腺癌、乳腺癌、卵巢癌、导管癌、肝癌、胰腺癌、肾癌、子宫内膜癌、睾丸癌、胃癌、口腔粘膜异常增生、息肉病、头颈部癌、侵袭性口腔癌、非小细胞肺癌、小细胞肺癌、间皮瘤、移行和鳞状细胞尿道癌、脑癌、神经母细胞瘤和胶质瘤。在各种实施方案中,所述癌症是I期、II期、III期或IV期癌症。在一些实施方案中,所述癌症是转移性的和/或复发性的,和/或是不可切除的。
在一些实施方案中,所述患者是化疗和/或检查点抑制剂疗法难治性的。
在一些实施方案中,所述患者还接受低剂量细胞因子治疗,所述治疗可提高持久性和体内应答。
在一些实施方案中,所述癌症是血液系统恶性肿瘤,包括白血病、淋巴瘤或骨髓瘤。例如,血液系统恶性肿瘤可为急性髓性白血病、慢性髓性白血病、儿童急性白血病、非霍奇金淋巴瘤、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生异常综合征、恶性皮肤T细胞、蕈样肉芽肿、非MF皮肤T细胞淋巴瘤、淋巴瘤样丘疹病和富含T细胞的皮肤淋巴样增生。在示例性实施方案中,所述患者患有血液系统癌症,例如急性髓性白血病(AML)或骨髓增生异常综合征,并且在一些实施方案中,所述患者在同种异体干细胞移植后复发。在一些实施方案中,所述治疗不会诱导GVHD。
在一些实施方案中,所述患者除了接受过同种异体干细胞移植外还接受过淋巴细胞清除治疗、细胞减灭治疗或免疫调节治疗(在施用细胞治疗之前)。在一些实施方案中,所述细胞治疗可在治疗后进一步具有或不具有细胞因子支持。
在一些实施方案中,所述患者患有感染性疾病或处于感染性疾病的风险中。例如,经历了HSCT的患者因免疫受损状态而处于感染性疾病的特定风险中。可被治疗或预防的感染性疾病包括由细菌、病毒、朊病毒、真菌、寄生虫、蠕虫等引起的感染性疾病。此类疾病包括AIDS、乙型/丙型肝炎、CMV感染、EB病毒(EBV)感染、流感、疱疹病毒感染(包括带状疱疹)和腺病毒感染。例如,CMV是在器官移植患者中发现的最常见的病毒性病原体,并且是接受骨髓或外周血干细胞移植的患者发病率和死亡率的主要原因。这是由于这些患者的免疫受损状况所致,所述免疫受损状况允许血清阳性患者中的潜伏病毒再激活或血清阴性个体中出现机会性感染。在这些实施方案中,患者可接受包含对病原体抗原具有特异性的T细胞的过继性免疫治疗。所述方法可能需要在移植手术开始前产生源自患者或适当的供体的病毒特异性CTL。
PTLD发生在很大一部分移植患者中,且由EB病毒(EBV)感染所致。据认为,美国约90%的成人群体中存在EBV感染。活跃的病毒复制和感染受免疫系统的控制,但与CMV的情况一样,因移植治疗而免疫受损的个体失去对T细胞群的控制,这允许病毒再激活。这代表了移植方案的严重阻碍。EBV还可参与了多种血液和非血液癌症的肿瘤促进。
在其他实施方案中,本发明提供了一种用于制备γδT细胞群体的方法。所述方法包括在IL-2、IL-4、IL-6、INF-γ和IL-1β中的两者或更多者存在下扩增T细胞群体。所述T细胞群体可富集CD28+富集的细胞,例如可用含有抗CD28的珠或颗粒(包括如本文所述的aAPC)进行阳性选择。在一些实施方案中,所述细胞群体是CD4+耗减的或CD8+选择的。在各种实施方案中,起始组合物包含少于约20%或少于约10%或少于约8%或少于约5%的γδT细胞。在一些实施方案中,源细胞来自外周血。
在各种实施方案中,所述T细胞群体在IL-4存在下扩增,或者在IL-4和IL-6存在下扩增。在一些实施方案中,所述细胞未在IL-4和IL-1β存在下扩增。在一些实施方案中,所述细胞在IL-4、IL-6和IL-1β存在下扩增。在一些实施方案中,所述细胞在IL-2、IL-4和IL-6存在下扩增。在一些实施方案中,所述细胞在IL-2、IL-4、IL-6、INF-γ和IL-1β存在下扩增。培养中细胞的扩增可如本文所述进行如1-4周。在扩增期之后,γδ细胞的百分比可介于约5%与约60%之间,如介于约10%与约60%之间,或约15%至约60%,其中γδT细胞的数量与起始细胞群体相比扩增可至少约100或至少约1000或至少约10,000。
可使用已知方法(如FACS或磁性细胞分选)将γδT细胞与其他细胞分离。γδT细胞可被提供为细胞组合物用于过继转移或研究用途,或者可替代地可工程化以表达一种或多种异源基因,如T细胞受体,所述T细胞受体任选的是αβTCR。在一些实施方案中,将γδT细胞工程化以异源表达嵌合抗原受体(CAR)。
本发明的其他方面和实施方案对熟练的技术人员来说将是显而易见的。
为了产生抗原特异性的CD8+T细胞,如图2中示意性地所示,通过白细胞单采从供体获得新鲜PBMC。通过用抗CD4微珠进行阴性选择,使细胞中的CD4+细胞耗减。通过将所得细胞与顺磁性纳米颗粒(即,右旋糖酐包被的氧化铁纳米颗粒或PLGA-PEG纳米颗粒,直径在约80-200nm大小的范围内)共同孵育,以使所得细胞富集抗原特异性T细胞。如图1所示,纳米颗粒具有与表面缀合的二聚的HLA配体(呈递靶肽抗原),其可并入多种肿瘤特异性抗原肽。二聚的HLA配体含有两个包含肽结合槽的HLA-A2结构域,每个结构域均融合至Ig铰链区的臂。将二聚的HLA-Ig与β
将细胞在顺磁性aAPC存在下孵育,然后在磁场存在下孵育约5分钟。然后,回收与颗粒结合的细胞并离体扩增不同时长(一般1至2周)。在生长因子存在下进行扩增。对于两周的培养期,在第1天和第7天添加生长因子。在第7天用纳米-aAPC重新刺激细胞。从供体细胞分离两周内观察到肿瘤特异性CD8+T细胞扩增至治疗水平。在一些实施方案中,富集和扩增过程可在封闭的自动细胞扩增系统中进行。这样的系统可提供简单、可扩展且具有成本效益的制造,以及使用不同的抗原肽混合物(即,源自患者或供体PBMC)进行抗原特异性CD8+T细胞的一致且快速的产生。
表3示出用于扩增的细胞因子的组成。
表3:
使用富集和扩增过程的细胞表型(包括与扩增期细胞因子一起)公开于PCT/US2018/051971(标题为CELL COMPOSITIONS COMPRISING ANTIGEN-SPECIFIC T CELLS FORADOPTIVE THERAPY)中。PCT/US2018/051971特此以引用的方式整体并入。
使用本公开的方法富集和扩增急性髓性白血病(AML)特异性T细胞在图3中示出。图3左侧的图示出在使T细胞针对AML特异性抗原WT1
然后在图4A和图4B中针对对细胞的表型,包括初始T细胞(T
图5A和图5B示出,离体富集和扩增的AML特异性T细胞具有高度多功能性表型,包括对IL-2(增殖和记忆)、IFN-γ(激活其他T细胞、记忆、MHC上调)、TNF-α(促炎性)和CD107A(颗粒酶释放、细胞毒性活性)的细胞内染色。绝大多数AML特异性T细胞(即,约62%)在非特异性刺激下表现出3-4种效应子功能(图5A,顶部)。在图5A(底部)中,所述图示出表达IL-2、TNF-α、IFN-γ和CD107A的T细胞的百分比。在图5A中,通过肽脉冲的T2细胞的非特异性刺激来产生T细胞。这一实验的结果表明,对于大多数E+E产生的AML特异性CD8+T细胞,观察到至少3或4种细胞因子效应子功能。在图5B中,示出来自AML特异性抗原的健康供体的新鲜PBMC的两种效应物与靶标(E:T)比率10:1(左条形)和20:1(右条形)的AML细胞系U266的T细胞介导的肿瘤特异性杀伤。这一实验的结果表明,来自健康供体的E+E产生的CD8+T细胞组合物在多种E:T比率内均具有稳健的杀伤活性。
图6由四个图组成,所述图比较黑素瘤患者来源的PBMC(顶部)与健康供体来源的PBMC(底部)之间通过本文公开的富集和扩增过程产生的Mart-1特异性T细胞的特异性。无论供体来源如何,富集和扩增过程都产生一致的细胞组成。此实验中的数据是从冷冻的PBMC产生的。
图7是示出基于AIM ACT的E+E过程产生了模拟天然免疫应答的TCR库,从而从经历了自然选择的天然T细胞库中提供稳健的过继治疗。多克隆TCR库的广度实现天然且持久的免疫应答。
图8示出E+E过程产生大量多发性骨髓瘤抗原特异性T记忆干细胞(TSCM)((CD62L+,CD45RA+,CD95+)。所述图示出从健康供体leucopak扩增前和扩增后多发性骨髓瘤特异性抗原T细胞的表型。图9A示出来自健康供体leucopak的多发性骨髓瘤抗原特异性T细胞的离体分批富集和扩增的T细胞的表型。所述图示出,E+E过程产生了大量抗原特异性CD8+T细胞(基于铰链二聚体染色,约1.6x10
图10示出使用E+E过程产生γδT细胞。观察到Vδ1和Vδ2TCR亚型。已经报告了造血干细胞移植(HSCT)背景下γδT细胞的临床意义,并且特别是其中移植后γδT细胞的较高频率与有利的结果相关。参见Berglund等人,
在以下实验中,根据身份、纯度、表型和特异性评估扩增的T细胞的特征。富含抗多发性骨髓瘤(MM)抗原肽的批次和富含抗白血病抗原肽的批次的总结特征如下所示。
*CD3
在以下实验中,表型是记忆T细胞相对于CD3
表5表型的批次间比较:T初始、Tscm、Tcm、Tem、Temra
如上述实验所证明的,本文公开的CD8+T细胞组合物直接与初始和记忆T细胞上的T细胞受体接合以触发所需的免疫应答。通过富集和扩增过程产生的CD8+T细胞组合物由来自内源库的多抗原特异性CD8+限制的T细胞组成。抗原特异性CD8+T细胞组合物包含T记忆干细胞。T记忆干细胞和中枢记忆T细胞对于初始和长期临床应答均是有帮助的且关键的。如通过效应细胞因子产生和靶细胞杀伤所评估,抗原特异性CD8+T细胞组合物具有多功能性表型。E+E过程还产生了由不同TCR库驱动的天然免疫应答。除了稳健的αβT细胞群体外,在扩增的群体中还存在显著γδT细胞群体,所述γδT细胞群体包括Vδ1细胞和Vδ2细胞两者。γδT细胞被认为提供病原体或癌细胞杀伤的另外机制,所述机制不是HLA依赖性的。
- 具有改进的表型特性的T细胞组合物
- 具有改进的储存特性和溶解度特性的包含3-β-羟基-5-α-孕烷-20-酮的药物组合物
