电穿孔装置以及外来物质导入细胞的制造方法
文献发布时间:2023-06-19 12:11:54
技术领域
本发明涉及一种能够通过电穿孔将外来物质导入到细胞悬浮液中包含的细胞的电穿孔装置以及导入了外来物质的外来物质导入细胞的制造方法。
背景技术
研究了一种在绝缘性油中的液滴内进行电穿孔的电穿孔装置(例如,参照专利文献1)。电穿孔是将DNA及RNA等核酸分子、蛋白质等生物体物质、以及成为药剂的有效成分的化合物等作为外来物质来将外来物质导入到靶细胞内的方法之一。在一般的电穿孔中,通过高电压的特殊脉冲发生器对靶细胞提供高电压的脉冲状的电流,在细胞膜上瞬时地制作出能够供外来物质通过的小孔,来将外来物质收进靶细胞。在专利文献1所记载的装置中,绝缘性油中的液滴在电极之间往复运动时与电极接触,由此,靶细胞被提供与以往的电穿孔装置相比电功率低的脉冲电流,从而进行电穿孔。据报告,专利文献1所记载的装置能够使靶细胞的试样量比以往的电穿孔装置的靶细胞的试样量少,相比于以往的电穿孔装置,能够提高靶细胞的生存率。
现有技术文献
专利文献
专利文献1:日本专利第6269968号公报
发明内容
若是以往的在油中的液滴内进行电穿孔的装置,则从油中回收反应后的试样的操作较为烦杂。
本发明的目的在于提供一种与通过使含有外来物质和细胞的溶液(液滴)在油中往复运动来进行电穿孔的装置相比使回收反应后的试样的操作变得简单的电穿孔装置以及外来物质导入细胞的制造方法。
本发明的第一方式所涉及的电穿孔装置具备:保持部,其保持含有外来物质和细胞的溶液;放电发生部,其具有以规定间隔配置的一对电极,在所述一对电极之间发生电弧放电;导电部,其将所述保持部与所述放电发生部电连接,将通过在所述放电发生部中发生的所述电弧放电而得到的脉冲电流提供到所述保持部;以及电功率控制部,其控制向所述保持部提供的所述脉冲电流的电功率。
第一方式的电穿孔装置能够以不使含有外来物质和细胞的溶液(液滴)在油中往复运动的方式向溶液赋予短时间的脉冲状的高电压电流。因而,该电穿孔装置无需从油中回收试样,与在油中的液滴内进行电穿孔的装置相比,能够使回收反应后的试样的操作变得简单。
也可以是,第一方式所涉及的电穿孔装置的所述电功率控制部具备电容器,所述电容器与电源部及所述放电发生部电连接,通过被所述电源部施加电压而蓄电,并将所蓄积的电荷放出到所述放电发生部。该电穿孔装置能够通过电容器的静电容量来规定向保持部提供的脉冲电流的电功率。
也可以是,第一方式所涉及的电穿孔装置的所述放电发生部与电源部电连接,所述电功率控制部具备电容器,所述电容器与所述保持部电连接,对提供到所述保持部的所述脉冲电流进行蓄电。该电穿孔装置能够通过电容器的静电容量来规定向保持部提供的脉冲电流的电功率。
也可以是,第一方式所涉及的电穿孔装置还具备能够提供3kV以上的直流高电压的所述电源部。该电穿孔装置无需另外准备电源部。
也可以是,第一方式所涉及的电穿孔装置的所述放电发生部能够变更所述规定间隔。该电穿孔装置能够简单地变更要向保持部提供的脉冲电流的大小等条件。因此,在该电穿孔装置中,易于设定适于试样的反应条件。
也可以是,第一方式所涉及的电穿孔装置的所述放电发生部的所述一对电极的前端形成为球状。与具有其它形状的电极的情况相比,该电穿孔装置能够使放电发生部稳定地发生电弧放电。
也可以是,第一方式所涉及的电穿孔装置的所述电功率控制部还具备暗流控制部,所述暗流控制部控制所述放电发生部所产生的暗流。即使在放电发生部产生暗流的情况下,该电穿孔装置也能够稳定地使放电发生部发生电弧放电。
也可以是,第一方式所涉及的电穿孔装置还具备以规定的时间间隔周期性地向所述放电发生部施加电压的周期调整部。该电穿孔装置能够简单地变更时间间隔的长度和重复次数的条件。因此,在该电穿孔装置中,易于设定适于试样的反应条件。
也可以是,在第一方式所涉及的电穿孔装置中,所述电功率控制部具备与所述保持部及所述电容器并联连接的电感器。该情况下的电穿孔装置能够通过电感器的作用来经由保持部向靶细胞施加正反双方向的电压。
也可以是,在第一方式所涉及的电穿孔装置中,所述电功率控制部具备二极管,所述二极管与所述保持部并联连接,使从所述电容器放出的电流流动的方向为正方向。该情况下的电穿孔装置能够使向保持部施加的脉冲电流的波形为通过二极管的整流作用来删除衰减振动波的脉冲电流中的负电荷部分后的波形。
第二方式所涉及的外来物质导入细胞的制造方法包括以下工序:保持工序,使第一方式的电穿孔装置的保持部保持含有外来物质和细胞的溶液;提供工序,通过电弧放电产生脉冲电流,将所产生的所述脉冲电流提供到所述保持部;以及回收工序,从所述保持部回收经过所述提供工序后的所述溶液。根据第二方式所涉及的外来物质导入细胞的制造方法,起到与第一方式的电穿孔装置同样的效果。
附图说明
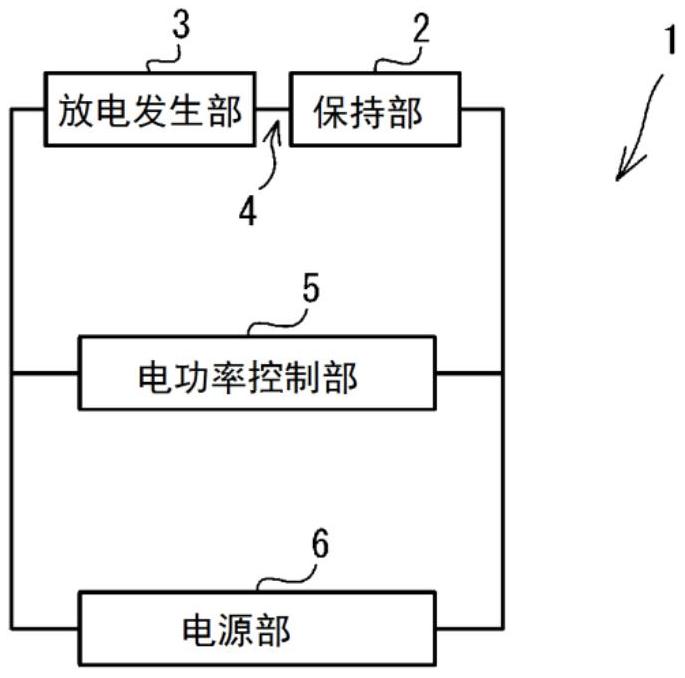
图1是电穿孔装置1的概念图。
图2是表示电穿孔装置1的电路的一例的图。
图3是表示电穿孔装置1的电路的一例的图。
图4是电穿孔装置10的概念图。
图5是表示电穿孔装置10的电路的一例的图。
图6是表示电穿孔装置10的电路的一例的图。
图7是表示电穿孔装置10的电路的一例的图。
图8是表示电穿孔装置10的电路的一例的图。
图9是实施例1的电穿孔装置1的保持部2、放电发生部3以及导电部4的示意图。
图10是组装前的实施例1的电穿孔装置1的保持部2、放电发生部3以及导电部4的照片。
图11是组装后的实施例1的电穿孔装置1的保持部2和放电发生部3的照片。
图12是组装后的实施例1的电穿孔装置1的照片。
图13是表示通过实施例1的电穿孔装置1在条件1~3下导入荧光蛋白编码基因的7天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率,物镜20倍)、荧光视场下的荧光图像(观察倍率20倍)、以及将明视场的图像与荧光视场的荧光图像进行重叠所得到的重叠图像。
图14是实施例2的电穿孔装置1的保持部2、放电发生部3以及导电部4的示意图。
图15是组装后的实施例2的电穿孔装置1的保持部2和放电发生部3的照片。
图16是表示使用实施例2的电穿孔装置1进行基因导入操作后的靶细胞(条件4)的导入操作的第二天的荧光观察结果以及使用Lipofectamine3000试剂进行基因导入操作后的靶细胞(阳性对照)的荧光观察结果的图。
图17是变形例的电穿孔装置1的保持部2、放电发生部3以及导电部4的示意图。
图18是变形例的电穿孔装置1的保持部2、放电发生部37以及导电部4的示意图。
图19是组装后的实施例3的电穿孔装置10的照片。
图20是表示从通过实施例3的电穿孔装置10在条件6~8中的各条件下导入荧光蛋白编码基因的操作起4天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率20倍)和荧光视场下的荧光图像(观察倍率20倍)。
图21是表示从通过实施例3的电穿孔装置10在条件9~11中的各条件下导入荧光蛋白编码基因的操作起9天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率20倍)和荧光视场下的荧光图像(观察倍率20倍)。
图22是组装后的实施例4的电穿孔装置10的照片。
图23是实施例4的电穿孔装置10的保持部2的示意图。
图24是表示从通过实施例4的电穿孔装置10在条件12、13中的各条件下导入荧光蛋白编码基因的操作起1天后、3天后、13天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率20倍)和荧光视场下的荧光图像(观察倍率20倍)。
图25是表示从通过比较例和实施例5的电穿孔装置10中的各方式导入荧光蛋白编码基因的操作起2天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率20倍)和荧光视场下的荧光图像(观察倍率20倍)。
图26是表示基于作为从通过比较例、实施例5的电穿孔装置10以及阴性对照中的各方式导入荧光蛋白编码基因的操作起2天后的观察图像的、明视场下的显微镜观察图像来将相对于所有细胞的死亡细胞数即细胞的死亡率进行比较所得到的结果的图表。
图27是表示从通过实施例6的电穿孔装置10在阴性对照、条件14、15中的各条件下向血液的淋巴T细胞导入山中因子基因以及EOS-EGFP载体的操作起16天后的观察图像的图,其中示出了明视场下的显微镜观察图像(观察倍率20倍)和荧光视场下的荧光图像(观察倍率20倍),该EOS-EGFP载体是当山中因子基因被导入到细胞后变为未分化时会表达绿色荧光蛋白质(EGFP)的载体。
图28是根据从通过实施例7的电穿孔装置10在条件16~18中的各条件下导入荧光蛋白编码基因的操作起2天后的观察图像来制作出的图像,是将明视场下的显微镜观察图像(观察倍率20倍)与GFP及RFP的荧光视场下的荧光图像(观察倍率20倍)进行重叠所得到的重叠图像。
图29是从通过实施例8的电穿孔装置10在条件19及条件20中的各条件下导入荧光蛋白编码基因的操作起1天后和5天后的、明视场下的显微镜观察图像(观察倍率20倍)以及GFP的荧光视场下的荧光图像(观察倍率20倍)。
图30是组装后的变形例的电穿孔装置10的照片。
图31是变形例的电穿孔装置10的保持部2的示意图。
图32是组装后的变形例的电穿孔装置10的照片。
图33是变形例的电穿孔装置10的示意图。
图34是外来物质导入细胞的制造工序的流程图。
具体实施方式
1.电穿孔装置1、10
下面,参照附图来说明本发明的优选实施方式。参照图1~图8来说明本发明的电穿孔装置1、10。电穿孔装置1、10(下面也称为装置1、10。)是构成为通过电气作用向靶细胞内导入作为目标的外来物质的装置。靶细胞是成为导入外来物质的对象的细胞。在装置1、10中,不需要具备按照程序输出矩形形状的脉冲电流的功能的昂贵的脉冲发生器。装置1、10构成为能够极大地减少1次处理所需的试样的容量(靶细胞数和外来物质量)。
如图1~图8所示,装置1、10分别具备保持部2、放电发生部3、导电部4、电功率控制部5以及电源部6。保持部2保持含有外来物质和细胞的溶液(例如,细胞悬浮液)。溶液是使外来物质和靶细胞悬浮于水系的溶液中所得到的液体。作为外来物质,包括在现有的电穿孔法中能够导入到靶细胞中的物质,例如能够例示出在通常的状态下无法透过靶细胞的细胞膜的各种生理活性物质、药剂、治疗药、核酸物质、肽以及蛋白质等。核酸物质例如可以是DNA分子、RNA分子(包括siRNA和向导RNA),病毒DNA、质粒DNA、寡核苷酸(反义寡核苷酸、适体)、以及肽核酸。作为DNA,适当地选择具备希望导入到靶细胞内的核酸序列的DNA,例如能够使用根据目的设计了基因的全长序列(cDNA序列、基因组序列)、部分序列、调节区、间隔区、以及添加了变异的序列等的DNA。DNA编码的多肽能够由导入了该DNA的靶细胞来产生。溶液中含有的外来物质的量只要是能够实施以往的电穿孔法的量即可。从靶细胞的生存率和外来物质的导入效率的观点出发,细胞悬浮液中的外来物质的浓度优选为0.05(μg/μL)~3(μg/μL),更优选为0.2(μg/μL)~3(μg/μL),能够根据外来物质来适当调整。溶液中包含的外来物质不限于一种,溶液中也可以包含多种外来物质。
靶细胞的种类没有特别限制,能够将各种细胞用作靶细胞。作为靶细胞,例如能够例示出植物细胞、包含人源细胞的动物细胞、以及细菌等。装置1、10能够向可通过以往的电穿孔法导入外来物质的细胞导入外来物质。作为可通过以往的电穿孔法导入外来物质的细胞,例如能够例示出人源和人以外的动物来源的体细胞、胚胎细胞(ES细胞)、受精卵、动物胎儿组织细胞等组织细胞、以及脏器细胞。处理所需的靶细胞的数量只要是使保持部2保持的溶液中包含的数量就足够了,例如,在溶液的体积是2(μL)~5(μL)的情况下,靶细胞的数量只要是1×10
溶液是水系的溶液,例如是磷酸缓冲生理盐水(Phosphate buffered salin e,下面简略为“PBS缓冲液”)、HEPES缓冲液(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid)等能够在通常的电穿孔法中使用的缓冲液、以及通常的缓冲液。只要根据靶细胞来适当调整溶液即可。在靶细胞是动物细胞的情况下,作为溶液,能够使用可在动物细胞的培养中使用的液体培养基(例如,MEM培养基、DMEM培养基、Opti-MEM培养基、α-MEM培养基、RPMI-1640培养基、DMEM/F-12培养基、Williams培养基、ES培养基等)。与血清浓度高的情况相比,在血清浓度低的情况下,从导入效率的观点出发,这些液体培养基更为优选,特别期望是无血清培养基。一般来说,不包含抗生物质的液体培养基作为溶液而言更为优选。在利用装置1进行导入外来物质的处理之后,可以向液体培养基自由添加血清或抗生物质。从导入效率和对细胞的影响的观点出发,作为溶液,优选使用PBS缓冲液。考虑到对细胞的影响,优选的是对溶液pH进行调制,例如优选调制为pH7.0~7.6。
保持部2可以具备经由导电部4来与放电发生部3电连接的一对电极21、22,并构成为在一对电极21、22之间保持溶液。保持部2也可以具备容器23以及经由导电部4来与放电发生部3电连接的一对电极21、22,并构成为在一对电极21、22之间保持溶液。容器23由塑料、玻璃以及陶瓷等绝缘性的原材料形成,用于收容溶液。保持部2的形状只要是能够保持溶液的形状即可,可以是任何形状。保持部2的容器形状例如可以是圆柱状、方柱状、多边形柱状以及半球状等。根据保持部2所保持的溶液的体积来设定保持部2的大小。保持部2的体积例如具有溶液的体积的0.3倍~50倍的体积,优选的是具有溶液的体积的0.5倍~20倍的体积,更优选的是具有溶液的体积的0.8倍~10倍的体积。溶液的体积例如是0.1(μL)~1(mL)。溶液的体积可以是能够形成液滴的量,例如能够从0.1(μL)~50(μL)中选择,优选的是0.5(μL)~10(μL)的范围,更优选的是1.0(μL)~5.0(μL)的范围。期望的是,在溶液被保持部2所保持的状态下,容器23的上端被设定成比溶液的上端靠上。期望的是,一对电极21、22隔开适度的间隔且被配置为能够与溶液接触,一对电极21、22的间隔例如是0.2(mm)~10(mm),优选的是0.3(mm)~5.0(mm),更优选的是从0.5(mm)~2.0(mm)中选择。一对电极21、22的形状只要适当设定即可,例如可以是棒状、板状以及前端为半球状的形状等。一对电极21、22相对于容器23的配置只要适当设定即可,一对电极21、22可以分别沿着在与容器23的底面交叉的方向上延伸的壁部配置。一对电极21、22可以从容器23的开口延伸设置至底部,一对电极21、22也可以与容器23的底部相离。一对电极21、22的厚度只要适当设定即可,例如是0.1(mm)~10(mm),优选的是0.2(mm)~5.0(mm),更优选的是从0.5(mm)~2.0(mm)中选择。一对电极21、22的材料只要是具有导电性的材料即可,例如能够例示出铝、铜等与碳相比导电性好的金属。
在溶液的量比较少(例如,1.0(μL))的情况下,当保持部2中保持的溶液被施加通过在放电发生部3中发生的电弧放电而得到的脉冲电流时,溶液有可能会蒸发。考虑到此,保持部2也可以具备用于以用于将溶液与外部大气隔离的油(oil)来覆盖该溶液的油槽,以防止溶液的蒸发。油槽只要是由绝缘性的材料形成的、能够贮存覆盖溶液的油的结构即可。油槽中贮存的油优选是与水相分离、比溶液(水)更疏水的物质,在常温附近为液体,且具有绝缘性的性质。作为油,例如能够例示出作为石油衍生的烷烃类的矿物油、以烷基苯为主成分的绝缘油、以聚丁烯为主成分的绝缘油、以烷基萘为主成分的绝缘油、以烷基二苯基烷烃为主成分的绝缘油、以及硅油等。作为油,这些油可以以一种或混合多种的方式来使用。油只要是绝缘且不与溶液混和的疏水性液体即可,不限于这些例示。油也可以是氟系惰性液体等绝缘性惰性液体。在本发明中,溶液被保持部2保持,溶液的沿着容器23的底部的方向(水平方向)上的移动被限制。因此,在保持部2具备油槽的情况下,保持部2中保持的溶液也位于容器23中,保持部2中保持的溶液不会由于一对电极21、22被施加电压而在油槽中移动。考虑到使用所导致的劣化,一对电极21、22和容器23中的至少一部分也可以被设置成能够更换。
放电发生部3构成为通过电弧放电来产生脉冲电流,将所产生的脉冲电流经由导电部4提供到保持部2。放电发生部3具有隔开规定间隔地配置的一对电极31、32。规定间隔只要考虑放电发生部3的设置环境、要向保持部2提供的脉冲电流的大小、时间间隔以及次数等来适当调整即可,例如是0.2(mm)~15(mm),优选的是0.3(mm)~5.0(mm),更优选的是从0.5(mm)~2.0(mm)中选择。一对电极31、32的厚度(宽度)只要适当设定即可,例如是0.1(mm)~10(mm),优选的是0.2(mm)~5.0(mm),更优选的是从0.5(mm)~2.0(mm)中选择。也可以是,一对电极31、32的间隔能够变更。在一对电极31、32的距离能够变更的情况下,可以使一对电极31、32中的至少一方能够相对于另一方滑动,也可以准备电极31、32间的距离互不相同的多组电极对,将多组电极对中的一组电极对利用螺丝等以能够拆卸的方式进行固定。电极31、32的形状只要适当设定即可,也可以是前端为曲面状、球状、针状等的形状。一对电极31、32的材料只要是与碳相比导电性好的材料即可,例如能够例示出铂、金、铝、铜等导电性金属。考虑到使用所导致的劣化,一对电极31、32也可以被设置成能够更换。
有时会由于一对电极31、32周围的离子粒子而在一对电极31、32之间产生暗流。放电发生部3发生电弧放电的条件容易受到暗流影响。考虑到这一点,也可以将装置1、10中的至少放电发生部3所具备的一对电极31、32例如配置在氩等稀有气体中。
导电部4将保持部2与放电发生部3电连接,将在放电发生部3中产生的脉冲电流提供到保持部2。导电部4只要由具有导电性的材料形成即可,例如由铝、铜等与碳相比导电性好的金属形成。导电部4的宽度、长度、形状等只要适当设定即可,例如是形成放电发生部3的一对电极31、32的规定间隔的5倍~500倍的长度。导电部4也可以与放电发生部3的电极32及保持部2的电极21形成为一体。
电功率控制部5控制向保持部2提供的脉冲电流的电功率。电功率控制部5具备电容器51。如图2和图3所示,装置1的电容器51与电源部6及放电发生部3电连接,通过被电源部6施加电压而蓄电,并将所蓄积的电荷放出到放电发生部3。装置1的电容器51相对于电源部6而言与放电发生部3及保持部2并联连接。如图5所示,装置10的电容器51与保持部2电连接,将提供到保持部2的脉冲电流进行蓄积。装置10的电容器51相对于电源部6而言与放电发生部3及保持部2串联连接。装置1、10的电容器51的静电容量分别规定了向保持部2提供的脉冲电流的电功率。因而,考虑施加于保持部2所保持的溶液的静电容量来设定电容器51的静电容量。例如,电容器51的静电容量被设定为硅油中的液滴3μL所具有的静电容量的1.0倍~500倍,优选的是,电容器51的静电容量被设定为硅油中的液滴3μL所具有的静电容量的1.2倍~5.0倍,更优选的是被设定为2.5倍~3.5倍。
施加于保持部2中保持的溶液的静电容量例如能够使用式(1)来计算。在假定溶液的体积V为3.0(μL)且溶液是半径r的球状的情况下,能够根据式(1)将溶液的静电容量C计算为7.76(pF)。其中,将真空的介电常数ε
C=4πε
=4πε
=4×π×8.854×10
≈7.76(pF)
在溶液的体积V是3.0(μL)的情况下,电容器51的静电容量优选被设定为9.31(pF)~38.8(pF),更优选被设定为19.4(pF)~27.2(pF)。
也可以是,如图2、图5以及图6所示,电功率控制部5还具备暗流控制部52。暗流控制部52将由电源部6提供的电流限制为经由空气中的离子等荷电物质在一对电极31、32之间产生的暗流以及对用于向保持部2供给电力的电容器51进行蓄电的电流这样的仅两种电流,由此抑制暗流带来的影响。并且,暗流控制部52还能够控制用于对电容器51进行蓄电的电流。到电容器51的蓄电完成为止的时间与向电容器51提供的电流成正比,因此通过利用暗流控制部52来控制向电容器51提供的电流,具备暗流控制部52的装置1、10能够调整利用一对电极31、32发生的电弧放电的时间间隔。图2所示的装置1的暗流控制部52设置于电源部6与放电发生部3之间。另一方面,图5所示的装置10的暗流控制部52相对于保持部2而言与电容器51并联连接。图6所示的装置10的暗流控制部52相对于放电发生部3而言与电容器51并联连接。
暗流控制部52例如是公知的电阻。电阻R的大小能够根据式(2)来计算。其中,将电源部6施加的电压的大小设为E,将电容器51的静电容量设为C,将暗流的大小设为I
R=E/(C×dV/dt+I
考虑到研究用于在放电发生部3中发生电弧放电的最佳电阻值,暗流控制部52也可以具备可变电阻器。
也可以是,如图7所示,电功率控制部5设置相对于放电发生部3而言与保持部2及电容器51并联的用于施加反电动势的电感器(线圈)53。在放电发生部3中发生放电之前,流过电感器53的电流在理论上来说只是暗流的量的电流。当放电发生部3的一对电极之间的电压超过放电发生部3的一对电极距离(例如1(mm))下的空气的绝缘击穿电压时,在放电发生部3的一对电极之间发生放电,放电发生部3的一对电极导通。电感器53试图将电流保持为固定(楞次定律),因此在放电发生部3发生急剧的电流变化的情况下,电感器53以避免电流流过电感器53的方式发挥作用。因此,在放电发生部3刚发生放电后电流不流向电感器53,电荷经由保持部2被充入电容器51。与电荷未被累积到电容器51的情况相比,当电荷被累积到电容器51时,电容器51的两端电压(与电容器51连接的2条布线之间的电位差)变高。因此,与电容器51连接的布线中的、连接于保持部2的一方的布线的电位与直流电源装置的正侧的电位之差变小,放电发生部3中的放电停止。电感器53具有妨碍电流变化的性质,但是当经过一定的时间(电感的时间常数)时,电流开始流过电感器53,因此当放电发生部3中的放电停止时,电容器51的累积电荷通过电感器53被放出。此时的电流的方向与通过从电源装置提供而施加的电压的方向相反,因此施加于保持部2的电压变为反向。当累积到电容器51的电荷被放出时,放电发生部3与保持部2之间的布线的电位下降,因此放电发生部3的一对电极之间的电压再次上升。
电感器53的电感值是考虑到以下两方的情况来设定的:在电容器51累积与静电容量相当的电荷之前妨碍电流流过电感器53;以及在电容器51中累积了与静电容量相当的电荷之后电流流过电感器53。也就是说,电感器53的电感值被设定为能够使电容器51充电和放电的电感值。电感器53中产生的电动势表示为电流变化与电感值之积。也就是说,线圈中产生的电动势表示为式(3)。
线圈中产生的电动势=电感值×(电流变化的大小/电流变化所需的时间)…式(3)
有可能能够使用装置10的电感器53的电感值来调整为了向溶液中的靶细胞导入基因等外来物质而施加的脉冲电流的能量。
也可以是,如图8所示,电功率控制部5设置相对于放电发生部3而言与保持部2及电容器51并联的电感器53,且设置相对于放电发生部3而言与保持部2并联的二极管54。二极管54将从电容器51发出的电流流动的方向作为正方向。二极管54的种类只要适当设定即可,优选的是适于超高速开关动作和高频的整流的二极管,例如,将肖特基势垒二极管用作二极管54。在图7所示的不具备二极管54的装置10中,施加于保持部2的脉冲电流的波形示出衰减振动波状,与此相对,在图8所示的具备二极管54的装置10中,施加于保持部2的脉冲电流的波形成为通过二极管54的作用而删除了衰减振动波状的脉冲电流中的负部分(从电容器51流向电感器53的方向的电流部分)的波形。
电源部6构成为对放电发生部3施加电压。电源部6只要能够施加可使放电发生部3发生电弧放电的电压即可,例如是3kV以上的直流高电压电源。电源部6的最大输出电压例如为5kV以上,电源部6的最大输出电流为1.0mA以上。虽然未图示,但是电源部6也可以具备用于将电压施加切换为开启或关闭的开关、用于调整所提供的电压的刻度盘、以及用于设置任意的时间的计时器。在该情况下,装置1也可以构成为:当由作业者利用刻度盘设定了所提供的电压且在计时器中设置了任意的时间时,开关变为接通后开始施加电压,当计时器中设置的时间结束时开关变为断开,电压输出停止。装置1、10中的各装置也可以例如将公知的逆变器电路(例如,冷阴极管逆变器(CCFL电路))和高电压发生电路(例如,科克罗夫特-沃尔顿电路(CCW电路))等适当组合来用作用于将直流高电压施加于放电发生部3的结构。也可以是,如图8所示,电源部6设置与放电发生部3及保持部2串联的电容器60。在这样的情况下,电源部6能够通过电容器60的值来变更放电发生部3中的放电周期。
从电源部6施加于放电发生部3的电压的条件可以适当调整。装置1例如也可以还具备用于如图3中例示的装置1那样以规定的时间间隔周期性地对放电发生部3施加电压的周期调整部9,来以规定周期对放电发生部3施加电压。规定周期只要适当设定即可,例如可以设定150(ms)~300(ms)的周期且将开启(ON)时间设定得比关闭(OFF)时间短,可以将开启时间设定为关闭时间的1/30~1/3左右。以规定周期对放电发生部3施加电压的次数与在放电发生部3中通过电弧放电来产生脉冲电流的次数对应。考虑兼顾外来物质的导入效率和靶细胞的生存率这两方来适当设定在放电发生部3中产生脉冲电流的次数。在放电发生部3中产生脉冲电流的次数例如是1次~500次,优选的是3次~200次,更优选的是5次~100次。
2.使用了装置1的外来物质导入细胞的制造方法
如图34所示,作业者使保持部2保持含有外来物质和细胞的溶液(保持工序,S1)。当通过电源部6对电功率控制部5施加了直流高电压时,电容器51被蓄电。在电容器51的电压达到规定电压之前,放电发生部3的一对电极31、32中没有电流流动。当电容器51的电压达到了规定电压时,电容器51将所蓄积的电荷放出到放电发生部3,使放电发生部3发生电弧放电。通过电弧放电而产生的脉冲电流经由导电部4被提供到保持部2(提供工序,S2)。提供到保持部2的脉冲电流在保持部2的一对电极21、22之间流动。在通过放电发生部3发生了规定次数的电弧放电的情况下,结束处理。作业者回收保持部2中保持的溶液(回收工序,S3)。
3.使用了装置10的外来物质导入细胞的制造方法
如图34所示,作业者使保持部2保持含有外来物质和细胞的溶液(保持工序,S1)。当通过电源部6对放电发生部3施加了直流高电压时,在电容器51的两端的电位差大于规定值的情况下,放电发生部3发生电弧放电。通过电弧放电而产生的脉冲电流经由导电部4被提供到保持部2(提供工序,S2)。提供到保持部2的脉冲电流在保持部2的一对电极21、22之间流动。电功率控制部5的电容器51将提供到保持部2的脉冲电流进行蓄积。当电容器51中蓄积的电荷达到电容器51的静电容量时,电容器51的两端的电位差变得与电源部6的提供电压相等,放电发生部3中的电弧放电停止。因此,能够经由保持部2流动的电荷量仅为与保持部2串联连接的电容器51所能够蓄积的电荷量。当放电发生部3的电弧放电停止时,通过电功率控制部5的暗流控制部52累积到电容器51的电荷被放出,电容器51的两端电压下降,放电发生部3的电极31、32之间的电位差上升。当放电发生部3的电极31、32之间的电位差再次变得大于规定值时,发生电弧放电。如图7和图8所示,在装置10具备电感器53的情况下,与保持部2及电容器51并联连接的电感器53放出电容器51中累积的电荷。在电感器53放电时,经由保持部2流动的电流(通过保持部2中保持的溶液的电荷量)也仅为电容器51中累积的电荷量,因此也完成了放电时的电功率控制。在通过放电发生部3发生了规定次数的电弧放电的情况下,结束处理。作业者回收保持部2中保持的溶液(回收工序,S3)。
在使用了装置1、10的外来物质导入细胞的制造方法中,认为在放电发生部3中发生电弧放电的瞬间,在配置于保持部2的一对电极之间的液滴W处形成脉冲状的强电场。可估计到的是,通过在液滴W处形成的强电场的作用,在靶细胞的细胞膜上瞬时地形成微小的孔,外来物质从所形成的孔被导入到靶细胞。与在以往的脉冲发生器中产生的脉冲电流的开启时间相比,通过电弧放电而产生的脉冲电流流过保持部2的时间足够短。更具体地说,装置1、10能够产生施加时间短到在以往的脉冲发生器中不可能产生的程度的脉冲电流。因而,认为与以往的电穿孔装置相比,施加于保持部2中保持的溶液中的靶细胞的电功率小,能够使给靶细胞带来的损伤小。
4.实施例1
制作图2、图9~图12所示的装置1,使用制作出的装置1来制造出外来物质导入细胞。如图2所示,实施例1的装置1具备保持部2、放电发生部3、导电部4、电功率控制部5以及电源部6。保持部2具备一对电极21、22和容器23。放电发生部3具备一对电极31、32。如图9所示,一对电极21、22、导电部4以及一对电极31、32是对厚度为1.0(mm)的铝板(A1000系、纯铝系)进行加工来制作出的。一对电极21、22形成为沿铅直方向延伸的矩形形状。一对电极31、32的侧面形状形成为随着去向面对面的端部而变细的三角形形状。如图10所示,在厚度5.0(mm)的绝缘性树脂板(亚克力板)8上,与一对电极21、22及一对电极31、32的形状、配置相配合地形成有沿铅直方向延伸的狭缝。如图11所示,一对电极21、22以及一对电极31、32被配置于所形成的狭缝。配置于狭缝的一对电极21、22以沿铅直方向延伸且隔开1.6(mm)的间隔D2的方式配置。一对电极31、32以沿铅直方向延伸且隔开1.0(mm)的间隔D1的方式配置。电功率控制部5具备电容器51和暗流控制部52。设电容器51的静电容量为22(pF),暗流控制部52为45(MΩ)的电阻。电源部6使用了3kV以上的直流高电压电源。如图12所示,考虑到安全性,作为高电压发生部件的电容器51、暗流控制部52、电源部6被收纳到塑料外壳中。收纳到塑料外壳中的部件通过导电性的夹具电连接到电极31的端部11以及电极22的端部12。装置1整体上纵、横、高度分别为10(cm)、10(cm)、10(cm)左右的大小,能够放在手掌上。
关于溶液(细胞悬浮液),设靶细胞为HEK293细胞,外来物质为Fortissimo荧光素酶(ffLuc)基因,水系的溶液为培养基OPTI-MEM或PBS缓冲液。ffLuc基因是在质粒DNA上具有将黄色荧光蛋白质Venus(来自墨绿多管水母(Aequorea coerulescens))与发光蛋白荧光素酶(来自萤火虫)的融合蛋白编码基因通过重组技术连结到巨细胞病毒(CMV)的启动子区域的下游而成的重组序列的基因。通过将该重组基因导入到靶细胞,靶细胞携带荧光信号。
HEK293细胞以1.5×10
对与保持部2直连的放电发生部3施加电压的时间被设定为15秒或30秒。具体地说,在条件1下对放电发生部3施加30秒的电压,在条件2下对放电发生部3施加15秒的电压,在条件3下对放电发生部3施加30秒的电压。在放电发生部3被施加了电压的情况下,理论上来说发生3kV的电弧放电。在利用电源部6对放电发生部3施加电压的期间,断续地发生了高电压和短时间(几微秒)的电弧放电。作为阴性对照,同样准备了不对保持部2施加电压的条件的试样。
在对保持部2施加电压之后,回收保持部2中保持的溶液。回收得到的溶液被添加到注入有调制培养基的6孔~24孔塑料底板,在37℃、5%的CO
收集在荧光观察中使用的细胞,通过图像细胞仪(Tali,赛默飞世尔科技(ThermoFisher Scientific)公司制)来测量细胞总数和发出阈值以上的荧光信号的细胞数。作为荧光信号的阈值,使用了背景信号的平均值加上标准偏差的2倍的值所得到的值(Mean+2SD)。设背景信号为阴性对照的自身荧光信号。计算出具有上述阈值以上的荧光信号的细胞相对于细胞总数的比例来作为传导效率。条件2的传导效率为17.67%,条件3的传导效率为12.42%。
如以上所说明的那样,得到确认的是,根据装置1,能够通过电气作用来以良好的导入效率将外来物质导入到靶细胞。装置1利用了电气作用,因此不需要特别的试剂,与化学手法相比能够抑制运行成本。并且,装置1不像使用病毒的生物学手法那样需要担心对靶细胞的毒性和抗原性所导致的癌化等,装置1能够以良好的生存率得到导入细胞。在装置1中,不需要通用的电穿孔装置所必需的具备按照程序输出矩形形状的脉冲电流的功能的昂贵的脉冲发生器。装置1的结构简单,因此能够以低成本制造装置1。装置1不需要使用油,因此也能够应用于优选不使用油的试样。
5.实施例2
实施例1的装置1是在无限面积的平行平板中设计绝缘击穿电压的装置。因此,若是具有前端变尖的形状的一对电极31、32,则可以想到绝缘击穿电压有可能低于设想的电压。因此,在实施例2中,如图3、图14以及图15所示,制作将放电发生部3的一对电极31、32的前端形状设计为半圆状的装置1,使用制作出的装置1来制造外来物质导入细胞。实施例2的装置1具备保持部2、放电发生部3、导电部4、电功率控制部5以及电源部6。如图14、图15所示,保持部2具备一对电极21、22、容器23以及油槽27。放电发生部3具备一对电极31、32。一对电极21、22、导电部4以及一对电极31、32是通过对厚度1.0(mm)的铝板(A1000系、纯铝系)进行加工来制作出的。
通过对绝缘性树脂板(亚克力板)8进行加工,来形成直径D4为1.6(mm)、深度H1为2.0(mm)的圆柱状的容器23。油槽27形成为以容器23的上端为底面的高度的、直径D5为10(mm)~12(mm)、深度H2为6(mm)~10(mm)的圆柱状。容器23设置于油槽27的底部的大致中心。一对电极21、22的收容在容器23中的部分沿铅直方向延伸,一对电极21、22的收容在油槽27中的部分形成为在上下方向上越远离容器23(越靠上侧)越彼此分离的圆弧状。一对电极31、32形成为彼此相向的侧的面凸起的半球状。在厚度10(mm)的绝缘性树脂板8上,与一对电极21、22及一对电极31、32的形状、配置及形状相配合地形成有狭缝。如图15所示,一对电极21、22以及一对电极31、32被配置于所形成的狭缝。一对电极21、22以沿铅直方向延伸且隔开1.0(mm)的间隔D4的方式配置。一对电极31、32以沿铅直方向延伸且隔开1.0(mm)的间隔D3的方式配置。电功率控制部5具备电容器51。设电容器51的静电容量为200(pF)。与实施例1的装置1同样地,考虑到安全性,作为高电压发生部件的电容器51收纳到塑料外壳中。收纳到塑料外壳中的部件被导电性的夹具电连接到电极31的端部11以及电极22的端部12。
实施例2的装置1还具备用于制作对放电发生部3施加电压的时间间隔期间的周期调整部9。周期调整部9包括控制系统(Arduino(注册商标))。周期调整部9将周期设定为200(ms),作为时间间隔设定190(ms)(条件4)、180(ms)(条件5)这2个条件。
关于溶液(细胞悬浮液),设靶细胞为HEK293细胞,外来物质为pCXLE-EGFP基因,水系的溶液为培养基OPTI-MEM缓冲液。pCXLE-EGFP基因是在质粒DNA上具有将绿色荧光蛋白质EGFP编码基因通过重组技术连结到CMV(巨细胞病毒)的启动子区域的下游而成的重组序列的基因。通过将该重组基因导入到细胞,细胞携带荧光信号。
HEK293细胞以1.5×10
通过胰蛋白酶处理将培养后的HEK293细胞从培养皿取出,在使HEK293细胞的浓度为1×10
以上述条件4、5的周期对经由导电部4来与保持部2电连接的放电发生部3施加10次电压。作为阴性对照,准备了不施加电压的细胞悬浮液。作为阳性对照,准备了通过将lipofectamine3000(Invitogen)用作脂质体的脂质转染法传导pCXLE-EGFP基因的细胞。
针对在各条件下处理得到的试样,在摄氏37度的温度、5%的CO
6.实施例3
在实施例3中,如图7、图19所示,制作将市售的具有1(mm)的间隙的比色皿用作放电发生部3的装置10,使用制作出的装置10来制造外来物质导入细胞。实施例3的装置10具备保持部2、放电发生部3、导电部4、电功率控制部5以及电源部6。作为保持部2,使用与图14和图15所示的实施例2同样的保持部2(图19的照片中央下部)。作为放电发生部3,使用一对电极之间的距离为1(mm)的NEPA GENE株式会社产品EC-001S。比色皿电极被收容在比色皿电极用腔室中(图19的照片左上部)。电功率控制部5具备电容器51和电感器53。电感器53与保持部2及电容器51并联地设置。与实施例1的装置1同样地,考虑到安全性,作为高电压发生部件的电源部6和电功率控制部5被收纳到塑料外壳中(图19的照片右上部)。作为电源部6,使用将冷阴极管逆变器(CCFL)与科克罗夫特-沃尔顿电路(CCW电路)进行组合从而能够产生3kV以上的电压的直流电源装置。
在电容器51的静电容量、施加时间以及电感器53的电感互不相同的条件6~条件11中的各条件中,设靶细胞为HEK293细胞,外来物质为pCXLE-EGFP基因,水系的溶液为培养基OPTI-MEM缓冲液,以与实施例2同样的过程进行了基因导入实验。在条件6下,电容器51的静电容量为7.3(pF),施加时间为30(s),电感器53的电感为1000(μH)。在条件7下,电容器51的静电容量为22(pF),施加时间为30(s),电感器53的电感为470(μH)。在条件8下,电容器51的静电容量为11(pF),施加时间为30(s),电感器53的电感为470(μH)。在条件9下,电容器51的静电容量为7.3(pF),施加时间为2(min),电感器53的电感为1000(μH)。在条件10下,电容器51的静电容量为7.3(pF),施加时间为30(s),电感器53的电感为470(μH)。在条件11下,电容器51的静电容量为7.3(pF),施加时间为2(min),电感器53的电感为470(μH)。
当在条件6~11中的各条件下在从基因导入操作起4天后或9天后确认是否表达了荧光蛋白质时,在阴性对照中,没有从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,如图20和图21所示,在条件6~11中的各条件下,从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,确认表达了荧光蛋白质。使用实施例3的装置10的情况下的基因导入效率为13~27%(n=12)。据此确认了,通过使用实施例3的装置10,能够向靶细胞的核内导入基因。
7.实施例4
在实施例4~8中,如图8、图22、图23所示,制作将具有1(mm)的间隙的市售的比色皿用作放电发生部3的装置10,使用制作出的装置10,以与实施例2同样的过程(但是,没有通过周期调整部9调整放电周期)制造出外来物质导入细胞。实施例4的装置10具备保持部2、放电发生部3、导电部4、电功率控制部5以及电源部6。如图23所示,保持部2具备一对电极21、22和载置部24。一对电极21、22是通过对厚度1.0(mm)的铝板(A1000系、纯铝系)进行加工来制作出的。一对电极21、22隔开规定的间隔D2地保持于绝缘性树脂板(亚克力板)8(图22的照片左下部)。载置部24为绝缘性树脂板8的上表面中的一对电极21、22之间的部分。作为放电发生部3,使用一对电极之间的距离为1(mm)的NEPAGENE股份公司产品EC-001S。比色皿电极被收容在比色皿电极用腔室中(图22的照片右下部)。电功率控制部5具备电容器51、电感器53以及二极管54。电感器53与保持部2及电容器51并联地设置。与保持部2并联地、且以从电容器51去向电感器53的方向为正方向地设置有二极管54。二极管54使用适于超高速开关动作和高频的整流的肖特基势垒二极管(罗姆公司制,SCS205KGC)。与实施例1的装置1同样地,考虑到安全性,作为高电压发生部件的电源部6和电功率控制部5收纳到塑料外壳中(图22的照片上部)。作为电源部6,使用将冷阴极管逆变器(CCFL)与科克罗夫特-沃尔顿电路(CCW电路)进行组合从而能够产生3kV以上的电压的直流电源装置。
在电容器51的静电容量互不相同、电容器60的静电容量、施加时间以及电感器53的电感彼此相同的条件12、条件13中的各条件中,设靶细胞为HEK293细胞,设外来物质为pCXLE-EGFP基因,设水系的溶液为培养基OPTI-MEM缓冲液,以与实施例2同样的过程进行了基因导入实验。4(μL)的细胞悬浮液的液滴W被载置于一对电极21、22之间的载置部24。在条件12、条件13下,电容器60的静电容量为0(pF),施加时间为30(s),电感器53的电感为5(μH)。在条件12下,电容器51的静电容量为3000(pF),在条件13下,电容器51的静电容量为1000(pF)。作为比较例,使用作为以往的基因导入装置的NEPA21(NEPA GENE公司)来进行了同样的实验。
当在条件12、13中的各条件下在从基因导入操作起1天后、3天后以及13天后分别确认是否表达了荧光蛋白质时,在不施加电压的阴性对照中,没有从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,如图24所示,在条件12、13中的各条件下,在基因导入操作后,从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,确认表达了荧光蛋白质。在条件12和条件13下,在从基因导入操作起1天后观察到导入基因的表达。在使用比较例的装置的情况和使用实施例4的装置10的情况下,当利用荧光显微镜观察从基因导入操作起2天后的荧光信号时,比较例的装置的情况下的基因导入效率与实施例4的装置10的情况下的基因导入效率几乎一致。在实施例4的装置10的情况下,即使在从基因导入操作起2天以后,液体培养基的pH指示剂的颜色也变成了被认为是因细胞增殖和偏向酸性而导致的颜色,认为即使在基因导入操作后,细胞也增殖了。与此相对,在比较例的装置的情况下,从基因导入操作起2天以后的液体培养基的颜色仅稍微变化,认为在基因导入操作后细胞没有增殖。据此,认为与比较例的装置的情况相比,在实施例4的装置10的情况下,细胞毒性非常低,细胞的状态好,这暗示着其例如也能够适当应用于向植物细胞的基因导入等,该向植物细胞的基因导入要求基因导入操作所引起的细胞毒性低。
8.实施例5
在实施例5中,使用与实施例4同样的装置10,制造出外来物质导入细胞。设靶细胞为悬浮型的人HL60细胞株,设外来物质为pCXLE-EGFP基因,设水系的溶液为培养基OPTI-MEM缓冲液,以与实施例2同样的过程进行了基因导入实验。4(μL)的细胞悬浮液的液滴W被载置于一对电极21、22之间的载置部24。设电容器60的静电容量为0(pF),电容器51的静电容量为2000(pF),施加时间为30(s),电感器53的电感为5(μH)。作为比较例,使用作为以往的基因导入装置的NEPA21(NEPA GENE公司)来进行了同样的实验。
如图25所示,在使用比较例的装置的情况和使用实施例5的装置10的情况下,当利用荧光显微镜观察从基因导入操作起2天后的荧光信号时,在比较例和实施例5中,均从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,确认表达了荧光蛋白质。在不施加电压的阴性对照中,没有从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号。在使用比较例的装置的情况和使用实施例5的装置10的情况下,当利用荧光显微镜观察从基因导入操作起2天后的荧光信号时,比较例的装置的基因导入效率与实施例5的装置10的基因导入效率几乎一致。然而,利用台盼蓝将死亡细胞染色后、使用明视场图像将相对于所有细胞的死亡细胞数即细胞的死亡率进行比较所得到结果是,两者呈现很大差异。具体地说,如图26所示,在比较例的装置的情况下,细胞的死亡率为15.8%(±6.5),与此相对,在实施例5的装置10的情况下,细胞的死亡率为3.4%(±0.8),认为与比较例的装置的情况相比,在实施例5的装置10的情况下,细胞毒性非常低,细胞的状态好。实施例5的装置10的情况下的细胞的死亡率与不对细胞悬浮液施加电压的阴性对照的细胞的死亡率即4.4%(±0.1)是同等的(n=3)。
9.实施例6
在实施例6中,使用与实施例4同样的装置10,制造出iPS细胞。设靶细胞为血液的淋巴T细胞,外来物质为山中因子基因(OCT-3/4、SOX2、KLF4、L-MYC)和EOS-EGFP载体,该EOS-EGFP载体是当山中因子基因被导入到细胞后变为未分化时会表达绿色荧光蛋白质(EGFP)的标记物,水系的溶液为培养基OPTI-MEM缓冲液。进行调制使得在4(μL)的细胞悬浮液的液滴W内有约8万个靶细胞,以与实施例2同样的过程进行了基因导入实验。4(μL)的细胞悬浮液的液滴W被载置于一对电极21、22之间的载置部24。在条件14下,设电容器60的静电容量为4000(pF),电容器51的静电容量为1000(pF),施加时间为15(s),电感器53的电感为5(μH)。在条件15下,设电容器60的静电容量为1500(pF),电容器51的静电容量为500(pF),施加时间为15(s),电感器53的电感为10(μH)。将不对细胞悬浮液施加电压的条件作为阴性对照。
如图27所示,当在各条件下利用荧光显微镜观察从基因导入操作起16天后的荧光信号时,在实施例6的条件14和条件15中的各条件下,从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,确认表达了基因导入后荧光蛋白质。在不施加电压的阴性对照中,没有从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号。根据实施例6的结果,确认了实施例6的装置10也能够适当利用于iPS细胞的制造。
10.实施例7
在实施例7中,确认使用与实施例4同样的装置10是否能够进行基因组编辑和多基因导入。设靶细胞为HEK293细胞,外来物质为用于进行基因组编辑的CAS9酶、红色荧光蛋白质(RFP)所表达的Cas9-RFP Lenti Plasmid(Sigma-Aldrich公司制)、在进行了基因组编辑的情况下GFP所表达的两种plasmidDNA即pX330-Cetn1/1和pCAG-EGxxFP-Cetn1(Addgene公司制,大阪大学井川研究室提供),水系的溶液为培养基OPTI-MEM缓冲液,以与实施例2同样的过程进行了基因导入实验。4(μL)的细胞悬浮液的液滴W被载置于一对电极21、22之间的载置部24。在条件16下,设电容器60的静电容量为0(pF),电容器51的静电容量为3000(pF),施加时间为60(s),电感器53的电感为5(μH)。在条件17下,设电容器60的静电容量为0(pF),电容器51的静电容量为2000(pF),施加时间为60(s),电感器53的电感为5(μH)。在条件18下,设电容器60的静电容量为4000(pF),电容器51的静电容量为1000(pF),施加时间为60(s),电感器53的电感为5(μH)。将不对细胞悬浮液施加电压的条件作为阴性对照。
在条件16~18下,利用荧光显微镜观察从基因导入操作起2天后的荧光信号。对于GFP的荧光信号,以汞灯光源为光源,借助滤光片照射490nm波长附近的激励光,借助滤光片观察510nm波长附近的绿荧光信号。对于RFP的荧光信号,以汞灯光源为光源,借助滤光片照射590nm波长附近的激励光,借助滤光片观察610nm波长附近的红荧光信号。在条件16~18中的各条件下,均确认了呈现出GFP的荧光信号的靶细胞。在不施加电压的阴性对照中,没有从靶细胞检测到通过表达GFP而产生的荧光信号。据此确认了,使用实施例7的装置10能够进行HEK293细胞的基因组编辑。并且,在1个靶细胞中,确认了既呈现出GFP的荧光信号也呈现出RFP的荧光信号的细胞。图28的最右侧的列的图像是将明视场图像、荧光GFP图像以及荧光RFP图像进行重叠所得到的重叠图像,呈现出黄色的信号的靶细胞表示导入了三种plasmidDNA,该黄色的信号在图28的重叠图像中表示为白色。如图28所示,在条件16~18中的各条件下,从重叠图像中确认了呈现出黄色的信号的细胞。据此确认了,使用实施例7的装置10,能够通过一次基因操作向HEK293细胞导入多个外来物质(也就是说,能够进行多基因导入)。
11.实施例8
在实施例8中,使用与实施例4同样的装置10,制造出外来物质导入细胞,确认哺乳类HEK细胞中的基因导入成功率。设靶细胞为哺乳类HEK细胞,外来物质为pCMV-EGFP基因,水系的溶液为培养基OPTI-MEM缓冲液,以与实施例2同样的过程进行了基因导入实验。4(μL)的细胞悬浮液的液滴W被载置于一对电极21、22之间的载置部24。在条件19下,设电容器60的静电容量为4000(pF),电容器51的静电容量为1000(pF),施加时间为15(s),电感器53的电感为5(μH)。在条件20下,设电容器60的静电容量为4000(pF),电容器51的静电容量为1000(pF),施加时间为30(s),电感器53的电感为5(μH)。在条件21下,设电容器60的静电容量为0(pF),电容器51的静电容量为3000(pF),施加时间为15(s),电感器53的电感为5(μH)。在条件22下,设电容器60的静电容量为0(pF),电容器51的静电容量为3000(pF),施加时间为30(s),电感器53的电感为5(μH)。
当在条件19~22中的各条件下利用荧光显微镜观察从基因导入操作起2天后的荧光信号时,在实施例8的各条件下,确认表达了基因导入后荧光蛋白质,基因导入效率为0.02%~0.13%。各条件下的基因导入成功率为100%。基因导入成功率是指:将1个细胞悬浮液作为1个样本,按每个样本来统计基因导入是否成功,相对于观察到的所有样本而言的基因导入成功的样本数即为基因导入成功率。在以往的在油中的液滴内进行电穿孔的装置中,由于在基因导入过程中装置发生短路等,回收一个液滴时的基因导入成功率为50%左右。另外,在使用以往的在油中的液滴内进行电穿孔的装置的情况下,在基因导入操作后2天内几乎观察不到导入基因的表达,在从基因导入操作起3天后,确认表达了导入基因。与此相对,在装置10中,实施例8中的基因导入成功率为100%。并且,如图29所示,在使用实施例8的装置10的情况下,在从基因导入操作起1天后,从靶细胞检测到通过表达荧光蛋白质而产生的荧光信号,确认表达了导入基因。据此可以说,与以往的在油中的液滴内进行电穿孔的装置相比,在使用装置10的情况下,基因导入成功率稳定。
在上述实施方式的装置1、10和外来物质导入细胞的制造方法中,得到以下的效果。装置1、10能够以不使含有外来物质和细胞的溶液在油中往复运动的方式向溶液赋予短时间的脉冲状的高电压电流。因而,装置1、10无需从油中回收试样,与在油中的液滴内进行电穿孔的装置相比,能够使回收反应后的试样的操作变得简单。装置1、10不需要通用的电穿孔装置所必需的能够按照程序输出矩形形状的脉冲电流的昂贵的脉冲发生器。装置1、10的结构简单,因此能够以低成本制造装置1、10。放电发生部3具有以规定间隔配置的一对电极31、32,在一对电极31、32之间产生电弧放电。因此,装置1、10能够以比较简单的结构向保持部2提供与以往相比开启时间短的脉冲状的高电压电流。
在装置1、10中,电穿孔和基因导入的反应是在静置的溶液中进行的,不受溶液的往复运动的状态所影响,能够稳定地实施。装置1、10利用了施加于保持部2中保持的溶液的电气作用,因此不需要特别的试剂,与通过化学手法向靶细胞导入外来物质的情况相比能够抑制运行成本。并且,装置1、10不像使用病毒的生物学手法那样需要担心对靶细胞的毒性和抗原性所导致的靶细胞的癌化等。装置1、10利用电弧放电来产生脉冲电流,由此与以往装置相比,能够使施加于靶细胞的脉冲电流的开启时间短(几微秒左右)。因此,装置1、10能够使提供给靶细胞的瞬间电力比以往装置大,且使施加于靶细胞的总电功率比以往装置小,因此认为与以往装置相比能够抑制对靶细胞造成的损伤,能够以良好的生存率得到传导细胞。装置1、10不需要使用油,因此也能够应用于优选不使用油的靶细胞。关于优选不使用油的靶细胞,例如能够列举出特定的植物细胞。
图3所示的装置1的电功率控制部5具备电容器51,该电容器51与电源部6及放电发生部3电连接,通过被电源部6施加电压而蓄电,并将所蓄积的电荷放出到放电发生部3。图3所示的装置1能够通过电容器51的静电容量来规定向保持部2提供的脉冲电流的电功率。图5~图8所示的装置10的放电发生部3与电源部6电连接。电功率控制部5具备电容器51,该电容器51与保持部2电连接,将提供到保持部2的脉冲电流进行蓄积。图5~图8所示的装置10能够通过电容器51的静电容量来规定向保持部2提供的脉冲电流的电功率。装置1、10具备能够提供3kV以上的直流高电压的电源部6。装置1、10无需另外准备电源部6。
实施例2的装置1的放电发生部3的一对电极31、32的前端形成为球状。与具有其它形状的电极的情况相比,实施例2的装置1能够使放电发生部3以更高的放电电压发生电弧放电。
实施例1的装置1的电功率控制部5具备暗流控制部52,该暗流控制部52用于抑制在放电发生部3中产生的暗流的影响。即使在放电发生部3的一对电极31、32之间产生暗流的情况下,实施例1的装置1也能够稳定地使放电发生部3发生电弧放电。
实施例2的装置1具有周期调整部9,以规定的时间间隔周期性地向放电发生部3施加电压。装置1能够简单地变更时间间隔的长度和重复次数的条件。因此,在实施例2的装置1中,易于设定适于试样的反应条件。实施例3的装置10的电功率控制部5具备电感器53,该电感器53与保持部2及电容器51并联连接,用于对放电发生部3施加反电动势。该装置10能够通过电感器53的作用来经由保持部2向靶细胞施加正反双方向的电压。
实施例4的装置10的电功率控制部5具备二极管54,该二极管54与保持部2并联连接,使从电容器51放出的电流流动的方向为正方向。在实施例4的装置10中,能够使施加于保持部2的脉冲的波形为通过二极管54的整流作用来删除衰减振动波状的脉冲中的负部分后的波形。在不具备二极管54的实施例3的装置10中,在从基因导入操作起10天后确认表达了导入基因,与此相对,在具备二极管54的实施例4的装置10中,在从基因导入操作起1天后确认表达了导入基因。据此可以认为,与不具备二极管54的装置10相比,具备二极管54的实施例4的装置10能够使基因导入操作对靶细胞造成的损伤小。
以往的在油中的液滴内进行电穿孔的装置如下:当液滴在电极之间往复运动时,对与电极接触的液滴提供电荷,由此对液滴内的靶细胞进行电穿孔(例如,参照专利第6269968号公报)。因此,该装置利用绝缘油切断电路,与以往的装置相比,能够以低的细胞毒性对极少量的试样导入基因。然而,上述以往的装置存在以下问题:液滴的往复运动经常变得不稳定,从而基因导入不稳定。与此相对,装置1、10使得以下情况成为可能:在将作为反应场的溶液(细胞悬浮液)静置的状态下,在与利用油中液滴进行传导的情况类似的条件下,向溶液提供电荷。也就是说,装置1、10以无需使液滴在油中往复运动的方式成功地再现了以往的使用油中液滴的装置的反应条件。装置1、10能够在无绝缘油的状态下赋予溶液电荷,因此能够使油对靶细胞的影响消失。并且,在装置1、10中,能够自由地设定电弧放电的各种条件(向保持部2提供的脉冲电流的电功率、电压的大小、以及对放电发生部3施加电压的周期等),能够系统地搜索最适于试样的条件。因此,与以往的装置相比,装置1、10的通用性更高。而且,装置1、10整体能够收敛至10(cm)×10(cm)×10(cm)左右的大小,能够携带。
本发明的电穿孔装置和外来物质导入细胞的制造方法不限定于上述的实施方式,也可以在不脱离本发明的宗旨的范围内施加各种变更。电穿孔装置只要具备保持部、放电发生部、导电部以及电功率控制部即可,可以适当变更、省略其它结构。实施例1~8中示出的技术的电路形态及放电发生部的形状等各不相同,但是也能够将装置的一部分或全部适当组合来使用。也可以是,在放电发生部与保持部之间设置电阻、用于分压的电容器或限制静电容量的电容器中的至少任一者,以抑制向靶细胞提供的电功率的升高所导致的细胞毒性的升高。可以根据作为处理对象的溶液的体积等来适当变更电穿孔装置的大小。电穿孔装置的保持部、放电发生部、导电部以及电功率控制部的数量可以适当变更。例如,电穿孔装置也可以对1个放电发生部串联或并联地连接多个保持部。
放电发生部3也可以形成为能够变更一对电极的规定间隔。装置1例如也可以使放电发生部3的一对电极中的至少一方能够相对于另一方滑动。具体地说,也可以如图17所示的变形例那样变更图9所示的装置1的结构。图17所示的变形例的放电发生部3配合电极35的可滑动范围来形成用于配置电极31的狭缝81的左右方向上的长度,由此使一对电极31、32中的一方的电极31能够相对于另一方的电极32滑动。同样地,保持部2也可以形成为能够变更一对电极21、22的间隔。例如,也可以如图17所示那样变更图9所示的装置10的结构。图17所示的变形例的保持部2配合电极22的可滑动范围来形成用于配置电极22的狭缝82的左右方向上的长度,由此使一对电极21、22中的一方的电极22能够相对于另一方的电极21滑动。电穿孔装置也可以使保持部和放电发生部中的至少任一者所具备的一对电极的双方能够在变更电极之间的距离的方向上滑动。
在其它例中,也可以是,准备放电发生部所具备的一对电极之间的距离互不相同的多组电极对,将多组电极对中的一组电极对利用螺丝等以能够拆卸的方式进行固定,由此形成为能够变更一对电极的规定间隔。例如,也可以如图18所示那样变更图14所示的装置1的结构。变形例的放电发生部37具备电线39、安装部63、电极32、多个电极35、36、安装板61,将从多个电极35、36中选择出的1个电极以能够拆卸的方式固定于安装部63,来作为产生电弧放电的一对电极中的一方的电极。安装部63设置于电线39的附近。多个电极35、36分别固定于安装板61。多个电极的数量可以适当变更。安装板61被螺丝64固定于安装部63。在安装板61固定于安装部63的状态下,多个电极35、36中的各电极与电线39电连接。在安装板61固定于安装部63的状态下,多个电极35、36中的各电极与电极32之间的距离D1互不相同。作业者从多个电极35、36中选择使放电发生部37所具备的一对电极之间的规定距离成为期望的长度的电极,将其固定于安装部63。可以容易地决定一方的电极的位置,以使得在将安装板61固定到安装部63的情况下,相对于电极32而言电极之间的距离为期望的距离。电穿孔装置也可以将放电发生部所具备的一对电极的双方构成为能够相对于与该一对电极电连接的电线拆卸。在图17和图18所示的变形例中,放电发生部的电极的前端形状、大小及配置以及保持部的电极的形状、大小及配置可以适当变更。
放电发生部的一对电极发生电弧放电的条件受到周围存在的气体的组成、湿度等所影响。因此,为了减少周围环境的影响来使电弧放电稳定地发生,放电发生部也可以配置于密闭容器,配置于干燥空气、氩等稀有气体环境中。在该情况下,例如,如图18所示那样,电穿孔装置也可以具备能够密闭包围放电发生部37的空间的容器85,并用干燥空气、稀有气体等将容器85内充满。为了将放电发生部与外界的环境尽可能分离,放电发生部也可以是具备一对电极的市售的电穿孔用比色皿、以及切断了灯丝的灯泡等。
电穿孔装置也可以构成为使保持部、放电发生部、导电部以及电功率控制部中的至少任一者能够装卸。电穿孔装置例如也可以如图18所示那样变更图14所示的装置1的结构,使保持部2的容器23和一对电极21、22能够装卸。在图18所示的变形例中,电穿孔装置的保持部2具有能够装卸的容器23和一对电极21、22。容器23利用绝缘性构件形成为有底圆筒状。一对电极21、22沿着容器23的侧面在上下方向上延伸。如图18下所示,容器23以能够装卸的方式收容于凹部25。在容器23收容于凹部25的情况下,一对电极21、22各自与导电部4电连接。在电穿孔装置具备能够装卸的保持部的情况下,例如,考虑到其它试样的污染等,也能够用完保持部就舍弃。电穿孔装置能够根据保持部的劣化等来更换保持部。在使放电发生部能够更换的情况下,即使在发生劣化的情况下、如在放电发生部的一对电极的表面产生氧化皮膜等的情况下,也能够通过更换为新的部件来在排除了放电发生部的劣化的影响后的同样的条件下使一对电极之间发生电弧放电。电穿孔装置也可以省略电源部。在该情况下,只要准备独立于电穿孔装置的电源部且将该电源部与电穿孔装置连接即可。
在电穿孔装置中,保持部、放电发生部、导电部以及电功率控制部的配置可以适当变更。例如,也可以是,如图30和图31所示的变形例的电穿孔装置那样,在实施例4的装置10中,保持部2、导电部4以及电功率控制部5固定于包围放电发生部3的周围的、沿上下方向延伸的壁面。在该情况下,也可以是,保持部2具备一对电极21、22和载置部24,一对电极21、22以在上下方向上隔开规定的间隔D2的方式保持于绝缘性树脂板8(图30的照片中央下部)。也可以是,如图31所示,载置规定量的细胞悬浮液的液滴W的载置部24为一对电极21、22中的配置于下侧的电极21的上表面。在图30和图31所示的变形例的装置10中,将保持部2、导电部4以及电功率控制部5配置于放电发生部3的近处,由此与实施例4的装置10相比能够使导电部4的电阻小,能够使施加于保持部2的脉冲电流稳定。在实施例4的装置10中,电容器60可以适当省略。也可以是,如图32和图33所示的变形例的装置10所示,装置10由具备保持部2、电容器51及电感器53的液滴保持单元41、具备电容器60的追加电容器单元42、以及具备包括电源SW的电源部6、放电发生部3及二极管54的主体单元43这3个单元构成。也可以是,液滴保持单元41和追加电容器单元42利用磁体等以能够拆卸的方式固定于主体单元43。装置10也可以在主体单元43的上表面具备弹簧针电极等以用于各单元41~43之间的电连接,也可以借助弹簧针电极来与液滴保持单元41的底面所具备的电极以及追加电容器单元42的底面所具备的电极中的各电极连接。在图32和图33所示的变形例的装置10中,制作多个变更了电容器51、电感器53的条件的液滴保持单元41以及变更了电容器60的静电容量的条件的追加电容器单元42,由此条件的变更变得容易。
附图标记说明
1、10:电穿孔装置;2:保持部;3、37:放电发生部;4:导电部;5:电功率控制部;6:电源部;8:绝缘性树脂板;9:周期调整部;21、22、31、32、35、36:电极;23:容器;27:油槽;39:电线;51、60:电容器;52:暗流控制部;54:二极管。
- 电穿孔装置以及外来物质导入细胞的制造方法
- 向具有细胞壁的细胞导入外来物质的方法
