一种发光大环TADF化合物及其制备方法和应用
文献发布时间:2023-06-19 13:48:08
技术领域
本发明属于有机发光材料技术领域。更具体地,涉及一种发光大环TADF化合物及其制备方法和应用。
背景技术
根据发光机制,目前的发光材料主要有:荧光材料、磷光材料、三线态-三线态湮灭(TTA)和热活化延迟荧光(TADF)材料。其中荧光材料的量子产率低,其OLED器件的外量子效率(EQE)不超过5%;磷光材料的OLED器件的外量子效率可以达到20%,但其往往要与重金属配合,生产成本较高,存在严重的效率滚降现象,且稳定性不好;TTA材料两个三线态激子产生一个单线态激子,理论最大内量子产率达到62.5%,需要调控浓度防止产生较大效率滚降现象;TADF可同时利用75%的三线态激子和25%的单线态激子,理论上最大内量子产率可达到100%,且材料主要为有机化合物,不需要重金属,生产成本低,可通过多种方法进行化学修饰,是目前各性能都较好的发光材料。
π-共轭大环化合物是制备TADF材料之一,有机π-共轭大环化合物是一种具有独特功能的有机材料,与线性π-共轭低聚物和聚合物相比,具有更少的末端,通过对其结构、电子偏置和共轭长度的精细修饰,它们的光物理性质可以进行微调。但现有大环TADF化合物的研究被合成困难、种类稀缺等问题所困扰。如Izumi S等人报道的用于有机发光二极管的热激活延迟荧光供体-受体-供体-受体的发光大环TADF化合物,该发光大环TADF化合物是第一个用于制作OLED的纯有机大环TADF发射体,但其发光大环TADF化合物受体单一,可选择范围小(Izumi S,Higginbotham H.F.,Nyga A.,et.al.Thermally Activated DelayedFluorescent Donor-Acceptor-Donor-Acceptorπ-Conjugated Macrocycle for OrganicLight-Emitting Diodes[J].J.Am.Chem.Soc.,2020,142,1482.)。
发明内容
本发明要解决的技术问题是克服现有发光大环热活化延迟荧光(TADF)化合物受体单一、可选择范围小、种类稀缺的缺陷和不足,提供一种受体种类多、可以进行多元化合成的发光大环热活化延迟荧光化合物。
本发明的目的是提供一种发光大环热活化延迟荧光化合物的制备方法。
本发明另一目的是提供发光大环热活化延迟荧光化合物在有机光电材料方面的应用。
本发明上述目的通过以下技术方案实现:
一种发光大环热活化延迟荧光化合物,其特征在于,结构如式(Ⅰ)所示,
其中,R
A
中的一种。
优选地,所述R
更优选地,所述R
最优选地,所述R
优选地,所述发光大环热活化延迟荧光化合物的结构为以下结构中的一种:
本发明进一步保护一种发光大环热活化延迟荧光化合物的制备方法,包括以下步骤:
S1、N-苯基对苯二胺、二苯甲酮在碱性催化剂存在的条件下进行氨基保护反应,所得产物再依次与二碳酸二叔丁酯、缩合剂进行缩合反应,与碳酸氢铵在过渡金属催化剂条件下进行脱保护反应,与化合物R-X在碱性催化剂、过渡金属催化剂与磷配体存在的条件下进行取代反应,得到给体;
S2、步骤S1所得给体和受体溶解于有机溶剂中,加入碱性催化剂、过渡金属催化剂反应完全,后处理,所得产物再与受体溶解于有机溶剂中,加入碱性催化剂、过渡金属催化剂反应完全,后处理,即得;
其中,所述给体的结构为:
所述受体为化合物X-A
所述R
本发明发光大环热活化延迟荧光(TADF)化合物以双连接位点给体(D)和双位点受体基团(A)为构筑核心,在此基础上通过对给体氨基上保护、脱保护的方法以较高产率得到了大环发光化合物,使基于该苯胺类给体的分子具备明显的光学性质。
基于合理的分子设计,本发明发光大环TADF化合物中的D-A-D-A连续共轭的大环分子内形成给受体之间的大二面角来减少前线分子轨道的重叠,从而减小了单-三线态能级差,有效促进了反向系间窜越进程,使其具有热激活延迟荧光的性能。并且,通过引入酮类电子受体使得酮类羰基能引发分子产生振动,进而产生聚集诱导发光(AIE)效应,可以有效地抑制激子湮灭,使分子在高浓度聚集态下比低浓度下有更强的荧光发射,从而具有较高的发光强度,提高光致发光量子产率。
优选地,在步骤S1中,所述氨基保护反应条件为:反应温度为80~120℃,反应时间为8~20h。
优选地,在步骤S1中,所述缩合反应的条件为:反应温度为60~70℃,反应时间为8~16h。
更优选地,在步骤S1中,所述缩合剂为DMAP或HOBT。
优选地,在步骤S1中,所述脱保护反应的条件为:反应温度为60~70℃,反应时间为6~12h。
优选地,在步骤S1中,所述取代反应的条件为:反应温度为80~120℃,反应时间为10~16h。
优选地,在步骤S2中,所述给体与受体的摩尔比为2:1~5:1,所述产物与受体的摩尔比为1:1~1:2。
优选地,在步骤S2中,所述有机溶剂为甲苯或1,4-二氧六环。
优选地,在步骤S2中,所述受体的化学结构如下:
其中,X为卤素。
优选地,所述卤素为F、Cl、Br或I。
优选地,在步骤S2中,所述受体的合成步骤为:
受体C
将(5-溴-2-氯苯甲酸或4-溴-2-氯苯甲酸)与(对/间溴苯酚或对/间溴苯硫酚)溶解在N,N-二甲基甲酰胺中,加入碱性催化剂和铜粉在80~150℃加热反应10~20h后用1mol/L盐酸洗涤,干燥后溶解在浓硫酸中于80~100℃反应以及后处理即得。
受体C
分别将受体C
受体C
将噻蒽溶解在乙酸中,依次与溴水在100~120℃反应、与过氧化氢在二氯甲烷与乙酸的混合溶剂中、80~100℃条件下反应8~12h后处理即得。
优选地,所述二氯甲烷与乙酸的体积比为1:2~1:5。
受体C
将苯乙酸和4-溴苄脒盐酸盐溶解在N,N-二甲基甲酰胺,在碳酸钾作用下于120~150℃反应10~16h以及后处理即得。
受体C
将3,6-二溴菲醌与二氨基马来腈、4,5-二氨基邻苯二甲腈或4,5-二氨基对苯二甲腈溶解在乙酸中于100~120℃反应10~16h后处理即得。
受体C
吖啶酮与溴苯共溶于甲苯或1,4-二氧六环中依次在加入过渡金属催化剂、碱性催化剂100~120℃的条件下反应、与溴水在乙酸溶液中100~120℃反应10~16h后处理即得。
优选地,所述过渡金属催化剂为钯炭催化剂、碳酸铯或三-(二苄基丙酮)二钯中的一种,所述碱性催化剂为蒙脱石或碳酸钾,所述磷配体为三叔丁基膦。
本发明还保护发光大环热活化延迟荧光化合物在有机光电材料方面的应用。
优选地,所述有机光电材料方面的应用包括在防伪标识、发光器件或生物成像材料方面的应用。
与现有技术相比,本发明具有以下有益效果:
本发明提供了的化合物以苯胺衍生物为给体基团,具有众多可替换的受体结构,可以通过改变电子受体(Acceptor,A)和电子给体(Donor,D)来改变化合物的发光颜色以及发光性质,为构造种类多样的发光大环TADF分子提供了新的思路。并且,实验证明该大环化合物发光强度大,光致发光量子产率也得到了显著的提升,可以应用于有机光电材料领域。
附图说明
图1为本发明实施例1制备的化合物B1的核磁共振氢谱图。
图2为本发明实施例1制备的化合物B1的质谱图。
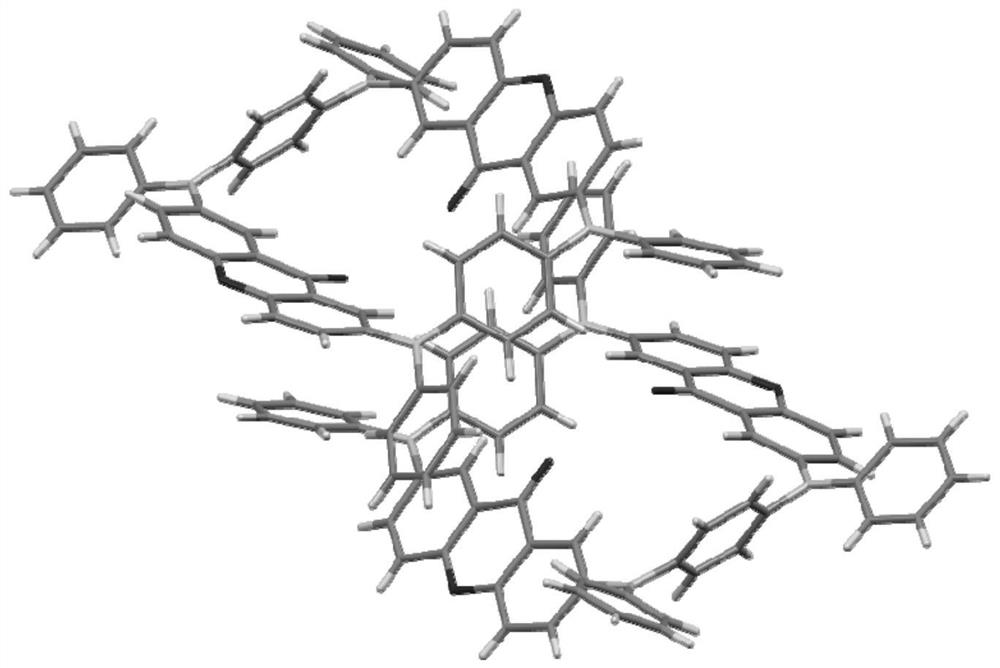
图3为本发明实施例1制备的化合物B1单晶图。
图4为本发明实施例1制备的化合物B1在1.0×10
图5为本发明实施例1制备的化合物B1在薄膜状态下的荧光光谱和磷光光谱图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1:给体D
在200mL圆底烧瓶中按摩尔比1:1加入对氨基二苯胺(9.21g,50mmol)、二苯甲酮(9.11g,50mmol)以及4g蒙脱石,在氮气保护的条件下,将上述反应物加热至120℃并反应16h。待反应结束后,将反应液冷却至室温,用乙酸乙酯和饱和食盐水萃取反应液3次。取有机相,减压蒸发乙酸乙酯后得到粗产物。再通过硅胶柱色谱层析法,以乙酸乙酯/正己烷(体积比1:8)为洗脱剂,进行分离纯化,得到化合物H
在200mL圆底烧瓶中加入12.20g、化合物H
在200mL圆底烧瓶中加入3.14g、化合物H
在200mL圆底烧瓶中加入1.59g、化合物H
实施例2发光大环B1的制备
将2.35g 5-溴-2-氯苯甲酸与3.46g对溴苯酚溶解在N,N-二甲基甲酰胺中,在3.5g碳酸钾以及0.2g铜粉催化下在150℃加热反应10h,将反应液冷却至室温,过滤除去无机盐。滤液加入2mol/L盐酸搅拌5h,过滤所得产物再通过硅胶柱色谱层析法,以乙酸乙酯/正己烷(体积比1:8)为洗脱剂,进行分离纯化得到化合物H
在100mL圆底烧瓶中加入化合物H
将720mg给体D
将600mg三聚体前体E
将356mg三聚体J
实施例3发光大环B2的制备
将2.35g 4-溴-2-氯苯甲酸与3.46g间溴苯酚溶解在N,N-二甲基甲酰胺中,在3.5g碳酸钾以及0.2g铜粉催化下在150℃加热反应10h,将反应液冷却至室温,过滤除去无机盐。滤液加入2mol/L盐酸搅拌5h,过滤所得产物再通过硅胶柱色谱层析法,以乙酸乙酯/正己烷(体积比1:8)为洗脱剂,进行分离纯化得到化合物H
在100mL圆底烧瓶中加入化合物H
将720mg给体D
将600mg三聚体前体E
将356mg三聚体J
实施例4发光大环B3的制备
将720mg给体D
将600mg三聚体前体E
将356mg三聚体J
实施例5发光大环B4的制备
在200mL圆底烧瓶中加入2.35g 5-溴-2-氯苯甲酸与3.46g对溴苯硫酚溶解在N,N-二甲基甲酰胺中,在3.5g碳酸钾以及0.2g铜粉的催化下在150℃加热反应10h,将反应液冷却至室温,过滤除去无机盐。滤液加入2mol/L盐酸搅拌5h,过滤,将所得产物再通过硅胶柱色谱层析法,以乙酸乙酯/正己烷(体积比1:8)为洗脱剂,进行分离纯化得到化合物H
在100mL圆底烧瓶中加入H
将720mg给体D
将600mg三聚体前体E
将356mg三聚体J
实施例6发光大环B5的制备
在200mL圆底烧瓶中加入2.35g 4-溴-2-氯苯甲酸与3.46g间溴苯硫酚溶解在N,N-二甲基甲酰胺中,在3.5g碳酸钾以及0.2g铜粉催化下在150℃反应(,10h,将反应液冷却至室温,过滤除去无机盐。滤液加入2mol/L盐酸搅拌5h,过滤,所得产物再通过硅胶柱色谱层析法,以乙酸乙酯/正己烷(体积比1:8)为洗脱剂,进行分离纯化得到化合物H
在100mL圆底烧瓶中加入化合物H
将720mg给体D
将600mg三聚体前体E
将356mg三聚体J
性能测试
本申请以实施例2制备的化合物为例进行性能测试。其他实施例制备的化合物均具有D-A-D-A连续共轭的大环分子结构,其分子内形成给受体之间的大二面角来减少前线分子轨道的重叠,从而减小了单-三线态能级差,有效促进了反向系间窜越进程,使其具有热激活延迟荧光的性能,均具有实施例2所得化合物相同的效果。
核磁共振氢谱检测:使用布鲁克400MHz超导核磁共振仪、溶剂为氘代甲苯进行核磁共振氢谱检测,如图1所示,分子氢谱波峰能与目标产物一一对应,数量合理。
质谱检测:将实施例2制得的B1溶于甲苯,配成浓度为1mg/mL的溶液,采用液质联用仪LCMS-2020,进行质谱测试。如图2所示,图中相对分子质量为905.30,减去一个H,与所合成的B1的相对分子质量一致,且927.20峰为B1分子质量加上钠离子的特征结合以上核磁和质谱的结果可知,实施例2制得的产物为结构为B1所示。
XRD单晶衍射分析:使用布鲁克*/D8 ADVANCE X射线分析仪对单晶进行衍射分析,其晶体结构如图3所示。结果证明了所得到的衍射结构符合由给体和受体组成的目标大环分子,可以观察得到目标产物分子在结构上呈现出高度对称的特性。
紫外吸收光谱检测:使用岛津紫外可见分光光度计UV-2700,扫描范围为250~700nm,将实施例2制得的化合物B1溶于四氢呋喃(THF)中配成1×10
荧光发射光谱检测:使用稳态/瞬态荧光光谱仪(FLS980),激发波长为350nm,在氮气保护下,测试温度为77K,300K;
使用该发光材料制备掺杂薄膜,制备方法如下:
称量3mg样品,使用3~5mL氯苯溶解进行配样,利用旋涂蒸发溶剂方法即可制备薄膜。
对该发光材料薄膜进行发光性能测试,结果如图5所示。图5为发光材料旋涂薄膜在氮气保护下归一化温度依赖稳态光谱。从图5中看出,B1的发射波长为550nm,荧光光谱和磷光光谱的起峰位置分别为485nm,530nm。由此计算可得的单-三线态能隙为0.24eV,小于0.3eV,可实现更高的反向系间窜越速率和更高的能量利用率。可证明B1具有热激活延迟荧光性能。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种发光大环TADF化合物及其制备方法和应用
- 一种具有TADF特性的双受体型多取代咔唑类化合物及其制备方法和应用
