基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的试剂盒及方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医药技术领域,具体涉及一种自动基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的试剂盒及方法。
背景技术
痛风(Gout)是由嘌呤代谢紊乱和肾小管源性的尿酸排泄障碍而引起关节及某些器官损害的一种代谢疾病。高血酸尿症(Hyperur icemia,HUA)、饮酒、代谢综合征、高血压、肥胖、利尿剂的服用等危险因素都与痛风的发生发展有关。痛风,高尿酸血症患者并发症发生率非常高,例如心血管疾病、2型糖尿病、代谢综合征、慢性肾脏疾病、癌症和过早衰老。目前关于痛风的发病机制尚不清楚,但大量研究表明是痛风是一种由环境和遗传因素共同作用引起的多基因遗传病,目前已知的痛风相关基因有SLC2A9、URAT1、ABCG2等。鉴于痛风对患者引起的严重危害和沉重的负担,对痛风易感基因的筛查和研究日益受到人们的关注。
人体内调节尿酸盐的分泌和再吸收是在肾小管和肠道中发生,肾脏排泄约占尿酸盐总排泄量的三分之二,其余三分之一主要通过肠道排泄。执行这类工作的蛋白质称为尿酸盐转运蛋白,其中一些有缺陷的尿酸盐转运蛋白是目前临床使用降尿酸盐药物的治疗靶点。在所有转运蛋白中,ABCG2是目前被称为最重要肾脏尿酸盐排泄转运体。
ABCG2介导的尿酸盐转运受损导致痛风或高尿酸血症,因此,ABCG2中的特异性突变和多态性存在遗传风险,这个基因多态与尿酸盐水平和痛风具有相关性,而最新研究发现rs2231142基因多态T/T基因型频率与汉族男性和女性的痛风发生均有显著的相关性。ABCG2在机体内具有重要的生理功能,其遗传变异可能具有重要的临床意义。ABCG2基因突变后,会导致肾脏处理尿酸的功能异常,导致尿酸排泄能力下降。由于ABCG2对药物和外源性物质的外排作用,ABCG2基因多态性及ABCG2表达和功能的差异可导致不同群体或个体对某些疾病存在不同的易感性,是影响药物耐药及药物个体间差异的重要因素之一,将为临床合理用药提供理论和实践依据。研究人员通过扫描了中国汉族人最小等位基因频率(minimum a l le le frequency,MAF)较高的10个位点,提示ABCG2可能是中国汉族人群发生痛风性关节炎的一个预测基因,而且携带该突变(T/T基因型)的痛风患者具有发病早、病程早期即表现出频繁发作和多关节受累的临床特点。T等位基因携带者发病风险比正常G等位基因携带者患病风险提高,TG、TT型可能为高风险基因型,携带痛风易感基因位点的可能具有较高的合并糖尿病、高血压、高血糖、三酰甘油等疾病的机率。
SNP(单核苷酸多态性)在人类基因组中的发生频率比较高,大约平均每1000个碱基中就有一个多态位点。有些SNP位点还会影响基因的功能,导致生物性状改变甚至致病。单核苷酸多态性是研究人类家族和动植物品系遗传变异的重要依据,因此被广泛用于群体遗传学研究(如生物的起源、进化及迁移等方面)和疾病相关基因的研究,在药物基因组学、诊断学和生物医学研究中起重要作用。
目前大规模SNP基因分型的黄金标准包括SNP微阵列,TaqMan SNP基因分型或二代测序方法。尽管这些技术具有高通量优点,但是目前大多数SNP分型检测方法都需要先提取样品DNA,都需要DNA扩增,从而获得足量的含SNP位点区域片段进行进一步的检测。目前对SNP的检测及与疾病的相关性研究多在相关实验室进行。由于临床样品需要在各临床治疗单位采集,要将这些样品集中到相关实验室,其保存和运输均需要较高的要求如低温等,这无形中增加了SNP检测的工作量和成本,目前虽已有直接针对血样进行PCR扩增的技术,但是这些技术多需要电泳检测,对于大样本检测而言工作量依然很大,而且很多凝胶染料如溴化乙啶(EB)等对操作人员有潜在的危害,极大地限制了SNP检测分析技术在临床领域的研究与应用,因此也无法大规模推广应用。
CRISPR-Cas是新型分子检测技术,主要原理是利用Cas蛋白接触并结合靶向片段后,本身的无差别反式切割功能被激活,会切割附近一切核酸序列的特点,通过检测体系中添加探针序列被切割情况从而判断靶向片段是否存在的一种检测方法。
张锋等利用cr i spr-cas13a具有“旁路活性”(co l l atera l effect)的特点,即cas13a结合特异性靶标RNA后随机切割其他RNA(这里设计成RNA荧光报告系统),与等温扩增技术Recombinase po lymerase amp l ificat ion(rpa)相结合,把这种检测方法称为Sher lock(specific h igh sens it ivity enzymat ic reporter un locking)。该探针信号分子是预先加入的两端分别带有荧光基团和淬灭基团的RNA,或寡核苷酸探针两端分别带有荧光基团Fam和生物素。RNA被剪切后,荧光基团就会发出荧光。当复合体识别切割靶序列之后,可以触发对于非特异性单链的切割活性,检测体系中的单链报告分子被切割,发出荧光,从而确认靶序列(SNP)的存在。
目前,对ABCG2的研究主要集中在对痛风的早期诊断、更安全更有效的治疗方面;而上述基因多态性将可能成为突破点。Matsuo等进行基因分型研究发现,ABCG2常见的功能障碍是早发性痛风的主要原因,这将有利于痛风早期诊断,提高高危人群的早期预防和治疗比率。目前尚无基于CRISPR-Cas13快速检测痛风ABCG2基因型来快速诊断痛风高危位点及作为指导痛风精准化用药依据的报道。
发明内容
本发明提供一种基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的试剂盒及检测方法,分别设计识别ABCG2高危位点rs2231142的G和T SNP单核酸多态crRNA(向导序列):负责与待检靶标RNA的G或U进行互补配对,形成双链从而激活结合的Cas13蛋白,以快速诊断痛风高危位点。
为了达到上述目的,本发明所采用的技术方案是:一种基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的试剂盒,包括用于特异扩增ABCG2基因rs2231142(SNP)的引物,向导RNA、cas蛋白、缓冲液和荧光报告分子Fam-ssRNA-Biot in,所述引物序列为:
上游引物5’-GAAATTAATACGACTCACTATAGGG GGAAAGTCCT ACTTATGCTGATCATGATGC-3’;
下游引物5’-GTTATGTATACTAAACAGTCATGGTCTTAG-3’;
向导RNA包括crRNAG和crRNAT,其序列分别为
5’-GAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACUACACUUCUCAGCAGCUCUUCGGCUUGC-3’、
5’-GAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACUAAACUUCUCAGCAGCUCUUCGGCUUGC-3’;
cas蛋白为Cas13a蛋白;
缓冲液包括PEG、海藻糖、磷酸肌酸二钠盐以及醋酸镁
荧光报告分子Fam-ssRNA-Biot in序列为5’-Fam-UUUUUUUUUUUUUU-3’Biotin。
优选的,cas13a蛋白为LwaCas13a蛋白。
优选的,试剂盒还包括侧向流胶体金试纸条。
本发明还涉及一种基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的检测方法,用于检测rs2231142基因型,所述方法包括:将含有待检靶标样品加入到前述试剂盒的反应体系中,试剂盒包括crRNAT、cas蛋白、缓冲液和荧光报告分子Fam-ssRNA-Biot in,在所述反应体系中一步完成等温扩增及靶位点信号识别,然后对其进行侧向流双抗原夹心法检测,当检测到ABCG2 rs2231142T等位基因时,试纸条显示检测线、质检线,当检测不到ABCG2 rs2231142T等位基因时,试纸条显示质检线,从而达到快速筛查出样品中是否携带突变等位基因T,为无症状。
优选的,所述样品为唾液或口咽拭子。
优选的,所述样品同时加入到含crRNAG、cas蛋白、缓冲液和荧光报告分子Fam-ssRNA-Biot in的试剂盒反应体系中,进一步确定基因型,为无症状高尿酸血症患者痛风发病风险的预判,并进行早期干预。
优选的,等温扩增的温度为22℃-42℃,扩增的时间为15-40mins。
优选的,向导RNA是指引导cas蛋白特异性结合靶标RNA的RNA(crRNA),所述特异性crRNA的制备方法包括:针对ABCG2基因,寻找包含单核苷酸多态位点序列(G/T),设计包含此序列的靶向序列,19-30nt长度的crRNA,设计完成后,合成o l igo,构建到载体pUC57,通过体外转录获得目的crRNA。
本发明的有益效果:
本发明采用上述技术方案,设计识别ABCG2高危位点rs2231142的G和T SNP单核酸多态crRNA,以快速诊断痛风高危位点,摆脱了传统方法对qPCR仪等精密仪器的依赖,通过确定基因型实现对痛风患者个体化精准用药,使得CRISPR-Cas技术在痛风病的基因型诊断方面具有广阔的应用前景。
附图说明
为了更清楚地说明本发明实施方式或现有技术中的技术方案以及本发明的有益效果,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的结构。
图1为rs211342RPA引物设计原理图,采用上游引物设计3条(F1-F3),下游引物设计3条(R1-R3),一共9个引物组合。挑选扩增产物以确定和引导序列crRNA的组合,Cas13a产生更快、更高的侧支活性为最佳引物。
图2为rs211342RPA扩增产物的凝胶电泳图,第1和第11泳道为DNA分子量Marker(100~2000bp),第2泳道-第10泳道为不同引物组合的RPA扩增产物,选定第7泳道的引物组合作为RPA效率最高的扩增引物组合。
图3为Cas13核酸检测试纸条原理图。
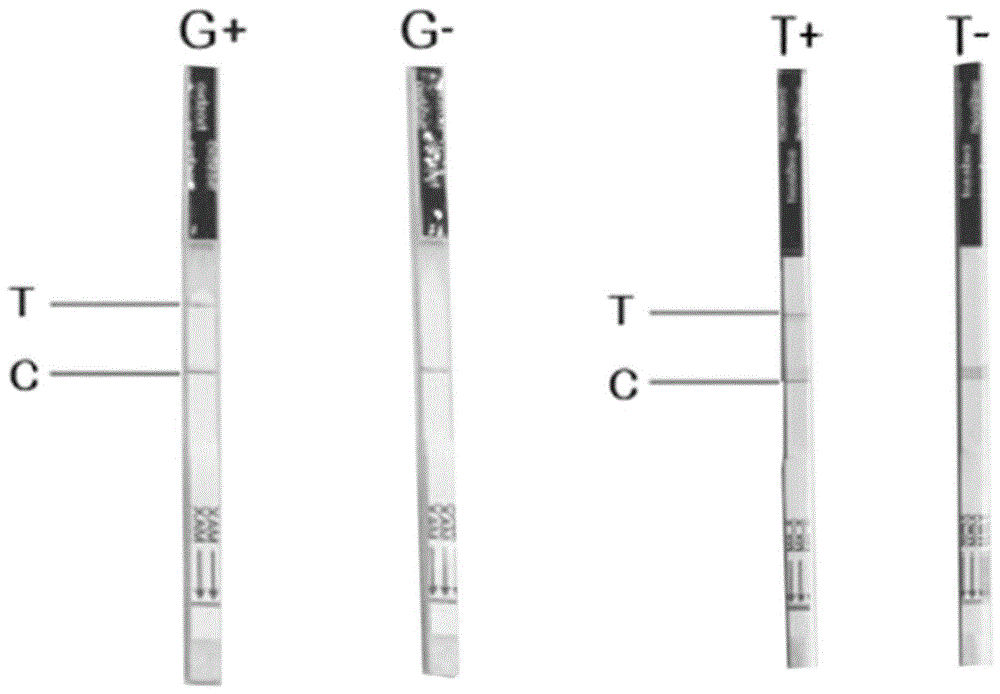
图4为试纸条报告结果图。
具体实施方式
本发明的具体实施例:
本实施例基于CRISPR-Cas13快速检测痛风ABCG2 SNP基因型的试剂盒,包括用于特异扩增ABCG2基因rs2231142(SNP)的引物,向导RNA、cas蛋白、缓冲液和荧光报告分子Fam-ssRNA-Biot in,所述引物序列为:
上游引物5’-GAAATTAATACGACTCACTATAGGG GGAAAGTCCT ACTTATGCTGATCATGATGC-3’;
下游引物5’-GTTATGTATACTAAACAGTCATGGTCTTAG-3’;
向导RNA序列,包括crRNAG和crRNAT,其序列分别为
crRNAG:
5’-GAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACUACACUUCUCAGCAGCUCUUCGGCUUGC-3’;
crRNAT:
5’-GAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACUAAACUUCUCAGCAGCUCUUCGGCUUGC-3’;
cas蛋白为LwaCas13a蛋白,购自广州美格生物科技有限公司;
缓冲液包括:PEG,海藻糖,磷酸肌酸二钠盐,醋酸镁;
荧光报告分子Fam-ssRNA-Biot in序列为5’-Fam-UUUUUUUUUUUUUU-3’
Biot in;
试剂盒还包括侧向流胶体金试纸条,购自北京宝盈同汇。
本实施例中所涉及的实验材料如无特殊说明均可从市售渠道获得。所用引物和所用序列合成及测序工作均由生工生物工程(上海)股份有限公司完成。
采用上述实施例中的试剂盒进行基于CRI SPR-Cas13快速检测痛风ABCG2rs2231142SNP GG、GT、TT基因型的检测,包括以下步骤,步骤1,DNA样本处理,DNA样本处理具体包括:rs2231142野生型和突变型SNP DNA检测先建立Cr i spr-cas13检测分析方法,制备检测所需的阳性和阴性对照,合成包含CRISPR-Cas体系设计两种针对突变位点的crRNA,以野生型为碱基G、突变型为碱基T,分别设计了crRNAG和crRNAT形成两种反应体系。
其中,rs2231142(c.421C>A)位点的野生型和纯合突变型DNA序列,利用基因重组技术将其克隆到pUC57载体中,构建出pUT57-rs2231142的野生型和纯合突变型重组质粒,并进行相应的PCR鉴定和测序鉴定,最后经定量后作为待建立方法的标准品,为下一步的方法及评估奠定基础。
所述合成rs2231142(c.421C>A)野生型和纯合突变型DNA序列,本实施例合成的序列401bp(如SEQ I D No.1),序列如下:
(1)野生型序列(SEQ ID No.1)
(2)纯合突变型序列(SEQ I D No.2)
本实施例口咽喉拭子采样后,插入含有1mL核酸释放剂的采集管中(购自深圳依贝澳),于折断点处折断。旋转管盖,确保,完全一次性采样棉签浸入溶液中,室温静置1-5分钟。如果是唾液样本,取150u l核酸释放剂(购自深圳依贝澳)置于1.5ml离心管内,再取唾液样本50u l,充分混匀,室温静置1-5分钟。
步骤2,等温扩增及信号识别
具体包括以下步骤:
配制反应体系,RPA反应包括DNA重组酶、DNA聚合酶冻干微球(安普未来)、T7转录酶、NTP、RPA正向引物、RPA反向引物、Cas13a、crRNA、探针RNA,滴入5u l上述样本裂解液,混合,最后加入300mM醋酸镁缓冲液得到所述反应体系,以50u l的反应体系为准,所述RPA正向引物的工作浓度为0.05~0.5μM,且所述RPA正向引物上包含T7启动子序列;所述RPA反向引物的工作浓度为0.05~0.5μM;所述Cas13a的工作浓度为50-200nM,优选100nM;所述crRNA的工作浓度为50~160nM,优选50nM;所述探针RNA的工作浓度为0.5~1μM,优选0.5μM。
分别建立两套上述反应体系,唯一区别是加入crRNA的不同,分别是探测靶序列中G和T(即crRNAG、crRNAT)
反应体系见下表1。反应在PCR仪上37℃孵育30分钟。核酸扩增采用天隆公司荧光定量PCR扩增仪进行。反应完成后,将上述反应液(50u l)加入含150u l ddH2O的1.5ml离心管中,混匀后进行试纸条(宝盈同汇)检测。
表1
其中,所述crRNA制备采用如下方法:首先,通过含有T7转录启动子的引物T7-F分别与合成的寡核苷酸T7-G-R,T7-T-R,进行退火来制备转录模板。具体是,将配对的寡核苷酸(5μM)在1×pcr缓冲液(上海生工公司)中退火,总体积为50μl,退火程序:在95℃初始变性5分钟,然后从95℃冷却至4℃,使用热循环仪每分钟降低1℃。退火后产物分别作为体外转录crRNAG,crRNAT的DNA模板,使用诺维赞t7高产量转录试剂盒合成crRNA,并且反应在37℃下进行过夜(约16h)。然后使用RNA纯化与浓缩试剂盒纯化crRNA(上海生工公司),并用nanodrop2000c(thermofi sher scient ific)定量,稀释为10μm浓度并保存到-80℃冰箱中。
T7-F为:5'-GAAATTAATACGACTCACTATAGGG-3C
T7-G-R为:
5'-GCAAGCCGAAGAGCTGCTGAGAAGTGTAGTTTTAGTCCCCTTCGTTTTTGGGGTAGTCTAAATCCCCTATA GTGAGTCGTATTAATTTC-3'
T7-T-R为:
5'-GCAAGCCGAAGAGCTGCTGAGAAGTTTAGTTTTAGTCCCCTTCGTTTTTGGGGTAGTCTAAATCCCCTATAGTGAGTCGTATTAATTTC-3'
反应体系如表2所示。
表2
步骤3,使用侧向流试纸条检测,将侧向流试纸条分别插入上述分别含有crRNAG、crRNAT的稀释后的反应体系中,被胶体金标的鼠抗Fam抗体会与5
‘Fam-3’Biot in标记的寡核苷酸(ssRNA)报告系统结合,复合物随液流方向从质控线走向检测线;质控线链霉亲和素饱和抓获标记有生物素标的寡核苷酸ssRNA报告系统,从而显示条带;当CRISPR/Cas13a检测到突变型的ABCG2基因时(T等位基因),会将标记有Fam和生物素ssRNA寡核苷酸报告系统切割断开,从而会有Fam标记的ssRNA片段被检测线抓获显色,在侧向流试纸条上显示检测线和质控线。当CRISPR/Cas13a检测不到突变型的ABCG2基因序列时(G等位基因),不能将标记有Fam和生物素ssRNA报告系统切割断开,从而不会产生Fam标记的ssRNA片段被检测线抓获的显色,从而在试纸条上只显示质控线一条线。
参见图3,本发明Cas13核酸检测试纸条原理说明:
1)阳性(+)
试纸条质控线(C线)和检测线(T线)均出现红色条带;试纸条质控线(C线)不显色,检测线(T线)出现红色条带。上述两种情况均说明Cas13发生了有效切割,并激活报告基团显色,结果均可判定为阳性。
2)阴性(-)
试纸条质控线(C线)出现一条红色条带,检测线(T线)不显色,判定为阴性结果。该结果表明Cas13未能切割报告分子,未能激活报告基团显色。
3)无效
试纸条质控线(C线)和检测线(T线)均未出现条带,提示所用的试纸条或扩增试剂可能已经损坏、失效或操作有误。
试纸条检测:
吸上述反应液(50u l)加入含150u l纯净水的1.5ml离心管中,混匀后进行试纸条(宝盈同汇)检测,得到检测结果如图4所示。
结果显示,含靶标分子T的实验组含有T等位基因(T+)显示为两条带,不含靶标分子的T等位基因(T-)显示为一条带。同样含G等位基因(G+)显示为两条线,不含G等位基因的(G-),线是一条线。说明本方法可通过试纸条检测明确区分是否有靶标分子T等位基因的存在,从而判断出从左到右检测者的基因型是G/G,G/T,T/T,G/T,见图4。通过RPA结合CRISPR-Cas13a胶体金试纸条能够实现对口腔拭子中痛风突变基因ABCG2靶位点基因型的灵敏、快速、准确检测、不依赖大型复杂仪器检测。
本实施例采用胶体金试纸条完成上述检测方法,本检测方法也可以通过利用6-羧基荧光素(6-FAM)和荧光淬灭剂(BHQ1)标记的单链RNA报告系统:5
‘-FAM-UUUUUUU-3’BHQ1,结合酶标仪荧光检测,根据荧光报告分子在切割与未切割时产生荧光信号强弱,达到快速检测痛风ABCG2 rs2231142基因型,酶标仪荧光检测为常规方法,在这不再赘述。
本发明提供了一种痛突变基因SNP分型检测方法,结合CRISPR-Cas体系,对待测DNA进行检测,快速准确地完成SNP分型,实现对痛风的不同患者针对患者痛风基因型的个性化用药指导,对痛风,高尿酸血症患者发病风险进行预判,以便及时预防,及时治疗,该方法灵敏度高,特异性好,检测迅速,成本可控,结果可视化,不需要昂贵的试剂和特殊仪器,操作简单,不需要专业检测技术人员,最终检测让病人在家完成具有普适性,适用于大规模推广使用。
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
