吞噬检查点CD24介导蛋白酶活化受体2在结直肠癌肝转移中的应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于疾病诊治和分子生物学技术领域,具体涉及吞噬检查点CD24介导蛋白酶活化受体2在结直肠癌肝转移中的应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
结直肠癌(CRC)是全球第三大最常见的癌症死亡原因,每年有超过185万病例和85万人死亡。在我国其发病率呈明显的上升趋势。在新诊断的患者中,20%同时伴有转移,另外25%会发展为转移性疾病。在被诊断为转移性结直肠癌的患者中,低于20%的患者存活超过5年。不能切除的转移性结直肠癌的主要治疗方法是全身治疗(例如化疗)。随着靶向治疗以及免疫检查点抑制剂(ICB)的发展,多种癌症患者的预后有了很大的改善。然而,结直肠癌患者的获益却是非常有限。例如,目前仅在KRAS/NRAS/BRAF野生型(约占50%)晚期CRC患者中使用的靶向EGFR的单克隆抗体(西妥昔单抗和帕尼单抗),与单独化疗相比,其联合化疗仅将中位生存期延长2至4个月。然而,对于近40%的KRAS或NRAS序列变异的CRC患者,目前还没有有效的靶向治疗。而以PD-1或PD-L1抗体为代表的ICB,仅在占比不到10%的MSI-H结直肠癌患者中有效,即使在这群具有较高突变负荷的患者中其反应率也不足50%。因此,寻找新的干预策略和方法、显著提高目前治疗方法的疗效,都将使大量晚期结直肠癌患者获益。
肿瘤转移是癌细胞从原发部位向远处器官的定植,肝脏是最常见的结直肠癌远端转移器官。肝转移是一个多步骤的过程,包括:脱离原发灶、经脉管到达转移灶、在转移组织的存活定植、以及增殖形成转移灶等。同时,转移也是一个低效率的过程。首先,在肿瘤细胞的长途奔袭中会遇到重重阻碍,例如脉管中的剪切力、营养匮乏以及免疫细胞的攻击等等,只有最后能够活着到达转移器官的肿瘤细胞-“种子”-才有机会形成转移灶。肿瘤细胞的转移受到免疫系统的严密监控。尤其是在转移灶形成的初期,作为第一道防线的天然免疫细胞清除转移器官中的“种子”肿瘤细胞是限制转移灶形成的关键步骤。
巨噬细胞是肝脏免疫微环境中占比最高的天然免疫细胞,包括居留巨噬细胞(Kuffer细胞)和单核来源的巨噬细胞。巨噬细胞被报道在肝转移发生的起始阶段通过吞噬和杀伤肿瘤细胞发挥抗瘤作用。巨噬细胞吞噬也是一个多步骤的过程,包括靶细胞的识别、吞噬和溶酶体降解。吞噬过程一方面依赖于肿瘤特异性抗体和巨噬细胞表面的FcγR的结合,另一方面,该过程又被肿瘤细胞表达的吞噬检查点分子所抑制。这两种作用相反的信号分别被称为“吃我”和“不吃我”信号。肿瘤细胞常常通过上调“不吃我”信号逃避免疫系统的清除。目前已经报道的“不吃我”信号主要包括:SIRPα/CD47、PD/PD-L1、LILRB1/B2M和SIGLEC10/CD24等。阻断“不吃我”信号与肿瘤细胞特异性抗体的联合应用,增强巨噬细胞的吞噬是一种非常有潜力的治疗实体肿瘤的新方案。目前临床上治疗效果最好的例子是anti-CD47单抗与利妥昔单抗(anti-CD20 mAb)在B细胞淋巴瘤中的应用。
CD24,也被称为热稳定抗原(heat stable antigen,HSA),是一种高度糖基化的蛋白,具有16个潜在的O-糖基化和N-糖基化位点,通过糖基磷-脂肪基肌醇(GPI)锚定附着在细胞表面。CD24广泛参与多种生理和病理过程,包括适应性免疫、炎症、自身免疫性疾病和癌症等。虽然CD24主要由免疫细胞表达,但近期发现肿瘤细胞经常过度表达。在癌症中,高表达的CD24与肿瘤细胞的发生发展、侵袭和迁移有关。目前,CD24在多种肿瘤中被作为肿瘤干细胞的标志物。在结直肠癌中,有报道提示CD44
蛋白酶活化受体2(Protease-activated receptor 2,PAR2,由F2RL1基因编码)是G蛋白偶联受体(GPCRs)的一个成员,通过细胞外丝氨酸蛋白酶,如胰蛋白酶激活。其编码基因在结直肠癌中的突变表明在结肠癌发生中起关键作用。此外,PAR2的表达与CRC患者的不良预后高度相关,并通过细胞增殖和细胞迁移发挥促肿瘤作用。我们最近发现,肿瘤干细胞表现出高水平的PAR2,这增加了对称分裂,促进了肿瘤干细胞的自我更新,增加了CRC的肝转移。然而,PAR2信号通路是否以及如何调控巨噬细胞尚不清楚。
发明内容
针对现有技术存在的不足,本发明提供吞噬检查点CD24介导蛋白酶活化受体2在结直肠癌肝转移中的应用。具体的,本发明通过研究证实,在CRC细胞中抑制PAR2可促进巨噬细胞的浸润和类M1型极化,增强其吞瘤作用。CD24在结直肠癌中发挥吞噬检查点的作用,阻断肿瘤细胞的PAR2可以降低CD24的表达,从而促进巨噬细胞的吞噬。PAR2小分子抑制剂与西妥昔单抗的联合使用,从而靶向吞噬检查点,是非常有潜力及有效的治疗策略。基于上述研究成果,从而完成本发明。
具体的,本发明涉及以下技术方案:
本发明的第一个方面,提供抑制PAR2编码基因及其表达产物的表达和/或使其活性降低的物质在如下(a1)-(a7)中至少一种的应用;
(a1)促进M1型巨噬细胞的极化和招募或制备促进M1型巨噬细胞的极化和招募的产品;
(a2)促进巨噬细胞吞噬或制备促进巨噬细胞吞噬的产品;
(a3)下调CD24的表达或制备下调CD24的表达的产品;
(a4)增强EGFR抗体抗肿瘤作用或制备增强EGFR抗体抗肿瘤作用的产品。
(a5)降低肿瘤细胞存活率或制备降低肿瘤细胞存活率的产品;
(a6)抑制肿瘤肝转移或制备抑制肿瘤肝转移的产品。
(a7)肿瘤治疗或制备肿瘤治疗的产品。
本发明的第二个方面,提供一种组合物,所述组合物其活性成分至少包括抑制PAR2编码基因及其表达产物的表达和/或使其活性降低的物质,以及EGFR抗体。
本发明的第三个方面,提供上述组合物在制备治疗结直肠癌药物中的应用。
以上一个或多个技术方案的有益技术效果:
上述技术方案研究首次发现CD24在结直肠癌中发挥吞噬检查点的作用,阻断肿瘤细胞的PAR2可以降低CD24的表达,从而促进巨噬细胞的吞噬。同时PAR2小分子抑制剂的使用可以降低吞噬检查点的直接阻断带来的潜在的副作用。
同时,PAR2小分子抑制剂与西妥昔单抗的联合使用,无论在体内还是体外都获得了最大的吞噬效率。因此PAR2抑制剂和西妥昔单抗联合使用,是非常有潜力及有效的治疗策略,具有良好的实际应用之价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1.肿瘤上的PAR2信号调节巨噬细胞浸润。(A)UMAP图显示了GEO数据库中来自结直肠癌肝转移患者的原发肿瘤和转移性肿瘤组织的细胞聚类,GSE178318。(B)F2RL1在所有细胞类型中的表达情况。(C)GO富集分析显示F2RL1低表达肿瘤细胞中上调的基因富集到的通路。(D-G)HT-29细胞(shCtrl或shPAR2)诱导的小鼠CRC肝转移模型。(D)对转移性肝肿瘤病变的代表性宏观观察(左)进行定量(右)(n=5)。活切片进行H&E染色。比例尺,2毫米。(E-F)流式细胞术分析第1-3天小鼠肝脏中CD11b
图2.PAR2缺失增加M1型巨噬细胞的极化和招募。(A)迁移实验中THP-1巨噬细胞向着HT-29和SW620细胞(shCtrl和shPAR2)的条件性培养基迁移的代表性图片(左)。比例尺,100μm。对迁移后的细胞进行定量分析(右)。(B)热图显示HT-29细胞(shCtrl和shPAR2)之间的DEGs(前25)。(C)采用RT-qPCR方法检测CSF1和CXCL1基因mRNA的表达水平。(D)ELISA分析HT-29细胞(shCtrl或shPAR2)的CSF1和CXCL1的的表达。(E)共培养实验的流程说明。(F)采用RT-qPCR检测共培养后THP-1巨噬细胞中细胞因子的相对mRNA表达水平。(G)用细胞因子微阵列检测共培养系统培养基中的细胞因子浓度。(H-I)流式细胞术定量显示与HT-29细胞共培养后的M1-TAMs(CD11b
图3.癌细胞PAR2缺失可促进巨噬细胞吞噬,抑制肝转移。(A)GSEA分析显示,THP-1巨噬细胞与HT-29-shPAR2细胞共培养过程中,上调基因的富集途径。NES,标准化富集分数。(B)具有代表性的流式细胞术图,描述了巨噬细胞对HT-29和SW620细胞(shCtrl和shPAR2)的吞噬作用。(C)活细胞显微镜下THP-1巨噬细胞吞噬pHrodo Deep Red+HT-29细胞(shCtrl和shPAR2)的代表性图像(左)。定量测定吞噬作用指数(右)。(D)对HT-29细胞(shCtrl和shPAR2)诱导肝转移第2天小鼠的肝组织切片的F4/80进行免疫荧光染色。代表性图像显示F4/80(绿色)、pHrodo Deep Red+HT-29细胞(粉色)和DAPI(蓝色)(左)。定量测定吞噬作用指数(右)。(E)具有代表性的流式细胞术图,描述了小鼠前3天肝脏中巨噬细胞对HT-29细胞的吞噬作用(左)。定量测定吞噬作用指数(右)。(F)移植HT-29细胞(shCtrl和shPAR2)的小鼠第2天肝脏的代表性生物发光图像(左)。用生物发光法测定小鼠肝脏中的肿瘤细胞数量(右)。所有数据均显示为三个独立实验的平均±SEM。
图4.在CRC癌细胞中,PAR2缺失通过miR-146a和miR-34a下调CD24的表达。(A)小提琴图显示了CD24在所有细胞类型中的表达水平(上)和SIGLEC10在所有不同免疫细胞中的表达水平(下)。(B)热图显示F2RL1高表达组和F2RL1低表达组癌细胞之间的DEGs(前25)。(C)采用RT-qPCR方法检测HT-29和SW620(shCtrl和shPAR2)细胞中CD24的相对mRNA表达水平。(D)HT-29和SW620细胞(shCtrl和shPAR2)表达CD24的代表性直方图(从流式细胞术结果获得)(左)。CD24
图5.CD24介导PAR2调控的巨噬细胞在体内外的吞噬作用。(A)转染CD24 siRNA或对照siRNA的HT-29和SW620细胞。RT-qPCR检测细胞中CD24的相对mRNA表达水平。(B)具有代表性的流式细胞术图描述了巨噬细胞对HT-29和SW620细胞(siNC和siCD24)的吞噬作用。(C)具有代表性的流式细胞术图,描述了巨噬细胞对使用抗CD24单抗或IgG对照抗体处理的HT-29和SW620细胞的吞噬作用。(D)活细胞显微镜吞噬实验的代表性图像,检测pHrodo Red
图6.PAR2的缺失增强了EGFR抗体的抗癌作用。(A)代表性的流式细胞术图描述了抗CD24单抗、抗EGFR单抗单独使用或联合使用,对HT-29和SW620细胞的吞噬作用。(B)具有代表性的流式细胞术图,描述了在抗EGFR单抗或IgG对照的存在下,巨噬细胞对HT-29和SW620细胞(shCtrl和shPAR2)的吞噬作用。(C)具有代表性的流式细胞术图,描述了小鼠接受GB88和西妥昔单抗治疗后第2天肝脏中巨噬细胞对HT-29细胞的吞噬作用(左)。定量测定吞噬作用指数(右)。n=3(D)灌胃GB88连续2天,或腹腔注射(i.p.)西妥昔单抗一次后,在第二天时的小鼠肝脏的代表性生物发光图像(左)。用生物发光法测定小鼠肝脏中各组肿瘤细胞数(右)(对照组和GB88组,n=6;CTX和GB88+CTX组,n=4)。(E)小鼠灌胃GB88连续5天或腹腔注射(i.p.)一次西妥昔单抗。量化转移性肝肿瘤结节的代表性宏观观察(左)和统计数据(右)(n=5)。所有数据显示为三个独立实验的平均±SEM。
图7.人结直肠癌中PAR2、CD68、CD24的相关性。(A)在TCGA-COAD(n=455)和READ(n=167)患者的M0-低(n=311)和M0-高(n=311)组(左)或M2-低(n=311)和M2-高(n=311)组(右)中,F2RL1的表达。(B-D)CRC患者肿瘤组织中F2RL1和TAMs标记物(CD68、MRC1)、CD24、miR-34a和miR-146a的mRNA水平之间的相关性。双尾皮尔逊检验。n=37。(E)人结直肠癌肿瘤组织中的CD24、CD68和PAR2免疫荧光染色。比例尺:100μm。(F)CRC患者中PAR2
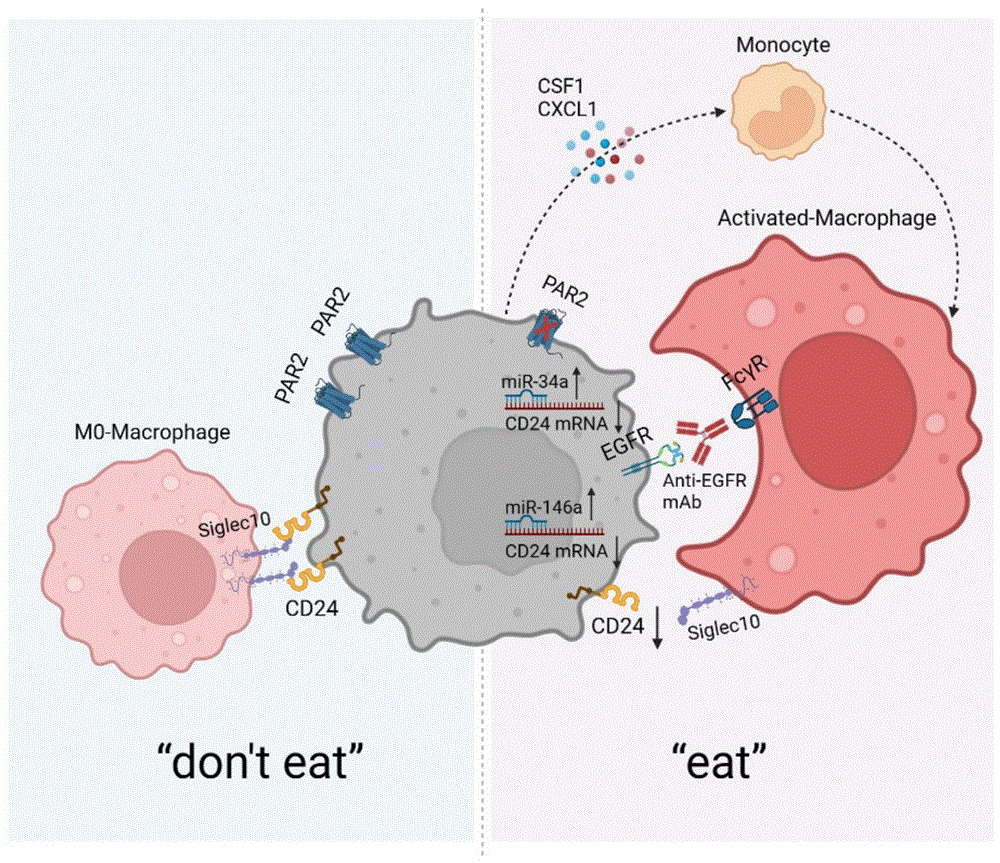
图8.PAR2缺失抑制结直肠癌转移的机制示意图。肿瘤细胞上的PAR2敲低通过产生CSF1和CXCL 1来招募并激活巨噬细胞。同时,PAR2敲低通过上调miR-34a和miR-146来降解CD24。同时使用西妥昔单抗(anti-EGFR单抗)可以增强巨噬细胞的吞噬能力。
图9.PAR2在癌细胞中的表达与结直肠癌中巨噬细胞的浸润和功能有关。(A)小提琴图展示人类CRC单细胞测序数据中F2RL1基因在不同类型细胞中的表达情况。(B)癌细胞亚群的再聚类分析,根据图1A的分群聚类产生。(C)F2RL1在癌细胞亚群中的表达。(D)显示各癌细胞聚类中F2RL1的表达水平的点图。(E)所有癌细胞被分为F2RL1高表达组和F2RL1低表达组。(F)GO分析显示F2RL1高表达组中上调基因的富集通路。(G)在TCGA数据库中,F2RL1高表达的CRC样本(n=161)和F2RL1低表达的结直肠癌样本(n=162)中巨噬细胞的浸润水平。(H-I)采用RT-qPCR或western blot检测稳定转染的HT-29和SW620细胞(shCtrl和shPAR2)中PAR2的mRNA(H)和蛋白(I)水平。(J-N)HT-29(shCtrl和shPAR2)细胞诱导的小鼠皮下移植瘤模型。(J)在第28天时的肿瘤的代表性图像。(K)肿瘤体积的生长曲线。(L)第28天时的肿瘤重量。n=5。(M)肿瘤的F4/80(红)免疫荧光染色的代表性图像(左),F4/80
图10.PAR2敲低对趋化因子表达和巨噬细胞极化的影响。(A)利用RNA-seq数据对HT-29-shPAR2细胞中差异表达基因进行的GO富集通路分析。(B)采用RT-qPCR方法检测SW620细胞(shCtrl和shPAR2)中CSF1和CXCL1的mRNA的表达水平。(C)ELISA分析SW620细胞(shCtrl和shPAR2)中CSF1和CXCL1的水平。(D)共培养实验的流程说明。(E)采用RT-qPCR检测与SW620(shCtrl和shPAR2)细胞共培养后的THP-1巨噬细胞中细胞因子的mRNA相对表达水平。(F)用细胞因子微阵列检测THP-1巨噬细胞与SW620(shCtrl和shPAR2)细胞共培养系统的培养基中细胞因子的浓度。(G-H)采用RT-qPCR检测与THP-1巨噬细胞共培养后的HT-29和SW620(shCtrl和shPAR2)细胞的细胞因子的mRNA相对表达水平。(I)THP-1巨噬细胞的流式圈门策略。流式细胞术定量分析与SW620细胞共培养后的M1巨噬细胞(CD11b
图11.PAR2缺失对巨噬细胞吞噬作用的影响。(A)使用RNA-seq数据分析,在与HT-29-shPAR2细胞共培养的THP-1巨噬细胞中,差异上调基因的GO富集通路。(B)使用scRNA-seq数据的GSEA分析显示,与F2RL1-高表达组癌细胞相比,F2RL1-低表达组上调基因的吞噬通路特征。NES,标准化富集分数。(C)体外吞噬实验的门控策略。在碎片去除后,吞噬作用被评估为7AAD
图12.PAR2缺失对CRC细胞吞噬检查点分子的影响。(A)UMAP图显示了来自人类CRC的scRNA-seq数据的所有细胞聚类CD24(蓝色)、CD274(蓝色)、B2M(蓝色)、CD47(蓝色)的表达(上)。免疫细胞上SIGLEC10(蓝色)、PDCD1(蓝色)、LILRB1(蓝色)、SIRPA(蓝色)的表达覆盖在UMAP空间上(下)。(B)采用RT-qPCR方法检测HT-29和SW620细胞(shCtrl和shPAR2)中CD47的相对mRNA表达水平。(C)HT-29和SW620细胞(shCtrl和shPAR2)表达CD47蛋白的代表性直方图(从流式细胞术结果获得)(左)。CD47
图13.CD24在HT-29和SW620细胞中的表达。(A)转染CD24的siRNA或对照siRNA的HT-29和SW620细胞。HT-29和SW620细胞(shCtrl和shPAR2)表达CD24的代表性直方图(从流式细胞术结果获得)(左)。CD24
图14.小鼠体内GB88和西妥昔单抗联合治疗。HT-29-luciferease细胞或HT-29野生型细胞诱导的小鼠结直肠癌肝转移模型。在脾脏注射肿瘤细胞的当天,小鼠灌胃5mg/kg/day的GB88或腹腔注射(i.p.)25mg/kg西妥昔单抗,单独或联合使用。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。参见例如Sambrook等人,《分子克隆:实验手册》中所述的技术和条件,或按照制造厂商所建议的条件。
结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照销售公司所推荐的条件;实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径购买得到。
本发明的一个典型具体实施方式中,提供抑制PAR2编码基因及其表达产物的表达和/或使其活性降低的物质在如下(a1)-(a7)中至少一种的应用;
(a1)促进M1型巨噬细胞的极化和招募或制备促进促进M1型巨噬细胞的极化和招募的产品;
(a2)促进巨噬细胞吞噬或制备促进巨噬细胞吞噬的产品;
(a3)下调CD24的表达或制备下调CD24的表达的产品;
(a4)增强EGFR抗体抗肿瘤作用或制备增强EGFR抗体抗肿瘤作用的产品。
(a5)降低肿瘤细胞存活率或制备降低肿瘤细胞存活率的产品;
(a6)抑制肿瘤肝转移或制备抑制肿瘤肝转移的产品。
(a7)肿瘤治疗或制备肿瘤治疗的产品。
其中,所述抑制PAR2编码基因(即F2RL1)及其表达产物和/或使其活性降低的物质包括但不限于针对F2RL1的RNA干扰分子或反义寡核苷酸、小分子抑制剂(如GB-88,CAS:1416435-96-5)、shRNA(小发夹RNA)、小干扰RNA(siRNA),实施慢病毒感染或基因敲除的物质以及针对PAR2本身或其上下游分子的特异性抗体,包括抗PAR2抗体。
所述产品可以为药物或者实验试剂,所述实验试剂可供基础研究使用,比如该产品可用于在体外诱导调控巨噬细胞极化和招募,从而建立高效经济的巨噬细胞极化招募实验模型;进一步的,所述肿瘤为实体瘤,进一步为结直肠癌,
因此,本发明的又一具体实施方式中,所述(a1)应用具体可以为:抑制F2RL1基因及其表达产物和/或使其活性降低的物质在制备用于肿瘤细胞-巨噬细胞共培养体系中促进M1型巨噬细胞的极化和招募的产品中的应用。
所述(a3)中,下调CD24的表达具体为在结直肠癌细胞中,PAR2缺失通过miR-146a和miR-34a下调CD24的表达。
所述(a5)中,所述EGFR抗体可以为抗EGFR多克隆抗体或抗EGFR单克隆抗体,优选为抗EGFR单克隆抗体;在本发明的一个具体实施方式中,所述抗EGFR单克隆抗体可以为西妥昔单抗(Cetuximab)、帕尼单抗(Panitumumab)和耐昔妥珠单抗(Necitumumab),优选为西妥昔单抗。
本发明的又一具体实施方式中,提供一种组合物,所述组合物其活性成分至少包括抑制PAR2编码基因及其表达产物的表达和/或使其活性降低的物质,以及EGFR抗体。
其中,所述抑制PAR2编码基因(即F2RL1)及其表达产物和/或使其活性降低的物质包括但不限于针对F2RL1的RNA干扰分子或反义寡核苷酸、小分子抑制剂(如GB-88,CAS:1416435-96-5)、shRNA(小发夹RNA)、小干扰RNA(siRNA),实施慢病毒感染或基因敲除的物质以及针对PAR2本身或其上下游分子的特异性抗体,包括抗PAR2抗体。
所述EGFR抗体可以为抗EGFR多克隆抗体或抗EGFR单克隆抗体,优选为抗EGFR单克隆抗体;具体的,所述抗EGFR单克隆抗体可以为西妥昔单抗、帕尼单抗和耐昔妥珠单抗,优选为西妥昔单抗。
所述组合物由GB-88和西妥昔单抗组成。本发明的一个具体实施方式中,所述GB-88和西妥昔单抗的质量比为0.1-1:1,如0.2:1、0.5:1、1:1。本发明通过研究证明,PAR2的抑制剂GB88和西妥昔单抗的联合使用增强了肝转移早期阶段巨噬细胞的吞瘤能力,并大大抑制了结直肠癌肿瘤转移,证明二者联用能够产生协同效应。
因此,本发明的又一具体实施方式中,提供上述组合物在制备治疗结直肠癌药物中的应用。具体的,本发明通过研究首次发现CD24在结直肠癌中发挥吞噬检查点的作用,阻断肿瘤细胞的PAR2可以降低CD24的表达,从而促进巨噬细胞的吞噬。PAR2小分子抑制剂与西妥昔单抗的联合使用,从而靶向吞噬检查点,因此是非常有潜力及有效的治疗策略。
本发明的又一具体实施方式中,所述药物还可包含一种或多种药学上或食品学上可接受的辅料。所用辅料可为固态或液态。固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂。粉剂及片剂可包含约0.1%至约99.9%的活性成分。适当的固体辅料可以是碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖。片剂、粉剂、药丸及胶囊为适于口服用的固态剂型。液态形式的制剂包括溶液、悬浮液及乳液,其实施例为非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液。此外,还可制成注射用小水针、注射用冻干粉针、大输液或小输液。
本发明的又一具体实施方式中,提供一种治疗肿瘤的方法,所述方法包括向受试者施用有效量的上述抑制PAR2编码基因及其表达产物的表达和/或使其活性降低的物质或上述组合物。
所述肿瘤为实体瘤,具体为结直肠癌,所述结直肠癌可以为已经发生或潜在发生(肝)转移的结直肠癌。
所述受试者是指已经是治疗、观察或实验的对象的动物,可以是人和非人哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猴、猩猩等,优选指人。所述“有效量”是指包括本发明化合物在内的活性化合物或药剂的量,该量可引起研究者、兽医、医生或其他医疗人员所追求的组织系统、动物或人的生物学或医学响应,这包括减轻或部分减轻受治疗的疾病、综合征、病症或障碍的症状。必须认识到,本发明所述活性成分的最佳给药剂量和间隔是由其性质和诸如给药的形式、路径和部位以及所治疗的特定哺乳动物等外部条件决定的,而这一最佳给药剂量可用常规的技术确定。同时也必须认识到,最佳的疗程,即同时化合物在额定的时间内每日的剂量,可用本领域内公知的方法确定。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例
一、实验方法
1.肿瘤细胞的PAR2与巨噬细胞,CD24等的相关性分析
(1)基于TCGA的数据分析。TCGA数据库中下载647例结肠癌COAD和直肠癌READ的肿瘤组织的数据及患者的临床信息。采用R包提取PAR2编码基因-F2RL1基因,计算该基因在647例组织中的表达水平。将647例组织按照F2RL1基因表达水平被平均分成4份。前1/4的组织定义为F2RL1基因低表达组(161例组织),后1/4的组织定义为F2RL1基因高表达组(162例组织)。之后,对这323例组织进行免疫细胞浸润的可视化,采用CIBERSORT的算法计算F2RL1基因与22种免疫细胞浸润的相关性。为了评估不同免疫浸润特征中的肿瘤样本中的F2RL1的表达情况。使用GDC下载了622个来自TCGA数据库的结肠癌(COAD,n=455)和结肠癌(READ,n=167)肿瘤样本的基因表达数据,将622个结直肠癌样本根据M0-TAM和M2-TAM特征分成M0-低和M0-高,M2-低和M2-高的组。然后分析每组各样本中F2RL1的表达情况。
(2)基于单细胞测序数据的数据分析。GEO数据库中下载3例结直肠癌肝转移患者的单细胞测序数据(GSE178318),该数据集是一个细胞-基因矩阵,该矩阵是6例组织(3例原发肿瘤组织和3例肝转移灶)进行的10X单细胞测序数据。通过质控过滤掉部分细胞(<200转录本/细胞,>10%线粒体基因),得到52,260个细胞。将该矩阵导入到R包Seurat(v 3.1.2)中,以进行后续的分析。对基因表达水平进行归一化处理和PCA降维,并采用无差别监督聚类的方式对所有细胞进行聚类,之后利用t-SNE和UMAP的方法可视化单细胞聚类。然后,计算每个细胞聚类的差异表达基因,根据其特异性高表达基因和InferCNV的方法识别肿瘤细胞。接着对F2RL1基因进行可视化,观察其在哪种细胞类型中高表达。之后将所有肿瘤细胞提取出来再次降维聚类,肿瘤细胞被分成12个聚类。可视化F2RL1基因并统计不同肿瘤细胞聚类中该基因的表达水平,从而确定高表达F2RL1基因的肿瘤细胞和低表达F2RL1基因的肿瘤细胞,由此将所有肿瘤细胞分成F2RL1基因高低表达两组。计算两组肿瘤细胞的差异表达基因,并通过GO和GSEA富集通路分析,计算两组肿瘤细胞富集到的通路。
(3)基于组织芯片的相关性研究。于上海芯超公司购买的人的结直肠癌组织芯片(HColA060CD01),包含42例病人(临床1期2期3期4期)的正常结肠黏膜、结肠腺瘤、远端/癌旁/结肠癌原发灶、转移灶、阴性淋巴结和阳性淋巴结组织。利用多标记免疫荧光染色技术,对PAR2,CD24和巨噬细胞标志物(CD68)进行染色,之后分析各组分的表达情况,统计不同组织中或者同一组织的不同部位中,PAR2和CD68以及PAR2和CD24之间表达量的相关性。
(4)基于肿瘤组织RNA的相关性研究。在中国医学科学院肿瘤医院收集的37例结直肠癌患者的肿瘤组织,提取组织RNA,采用RT-qPCR的方法验证PAR2分别与巨噬细胞标志物CD68,CD206(又称为MRC1),CD24,miR-34a和miR-146a的相关性。所有患者均获得知情同意。人体样本采集和使用的程序已获得中国医学科学院肿瘤医院伦理委员会的批准(批准号为No.NCC2023C-459)。
2.肿瘤细胞PAR2水平与巨噬细胞浸润、表型和功能的研究
(1)细胞模型:
利用慢病毒构建shRNA载体,感染结直肠癌细胞系(HT-29,SW620),从而构建稳定敲降PAR2的结直肠癌细胞系。人外周血单核细胞系THP-1经过100ng/ml的PMA刺激10h,诱导成为贴壁的巨噬细胞。
①将PAR2敲降的结直肠癌细胞系和对照组细胞(shPAR2和shCtrl)用无血清RPMI-1640培养基培养24-48h,收集培养上清,0.45μm滤器过滤,制备条件性培养基;用该条件性培养基培养THP-1巨噬细胞24h,将其诱导为肿瘤相关巨噬细胞。
②采用24孔板,孔径为8μm的Transwell细胞共培养小室,下室为600μl的肿瘤细胞来源的条件性培养基,上室为1*10
③PAR2敲降的结直肠癌细胞系和对照组细胞(shPAR2和shCtrl)与THP-1诱导的巨噬细胞在6孔板中,采用孔径为0.4μm的细胞共培养小室进行共培养24-48h。收集共培养体系的细胞培养上清,进行细胞因子微阵列的检测,共检测40种与巨噬细胞极化表型有关的炎性细胞因子和趋化因子。共培养小室中的巨噬细胞收集起来,提RNA,进行RNA-seq测序和RT-qPCR的检测,以验证细胞因子微阵列的结果。同时,收集共培养后的巨噬细胞,进行抗体染色(CD11b,CD86,CD206),流式检测巨噬细胞的M1/M2表型。
(2)体外巨噬细胞吞噬实验模型:
①基于流式细胞术的吞噬实验:
6孔板中的THP-1诱导的巨噬细胞经过PAR2敲降的结直肠癌细胞系(HT-29,SW620)和对照组细胞的条件性培养基处理24h,诱导为肿瘤相关巨噬细胞,并饥饿处理2h。将PAR2敲降的结直肠癌细胞系(HT-29,SW620)和对照组细胞收集起来,用CFSE染色30min,按照与巨噬细胞数量为2:1的比例加入6孔板中,在37℃培养箱中共培养2h,诱导巨噬细胞对肿瘤细胞的吞噬。之后,洗去上清中未被吞噬的肿瘤细胞,消化收集贴壁的巨噬细胞,并进行CD11b的染色,流式检测流式细胞术检测CD11b/CFSE双阳性的细胞比例,统计与两组肿瘤细胞共培养的巨噬细胞的吞噬指数。
②基于延时活细胞显微镜的细胞吞噬实验:
在24孔板中对THP-1巨噬细胞进行肿瘤细胞来源的条件性培养基的刺激,并饥饿处理2h。PAR2敲降肿瘤细胞和对照组细胞用pHrodo-Deep Red染料进行染色,2小时后计数肿瘤细胞数量,将其按照2倍于巨噬细胞的数量种植入24孔板中,在37℃的细胞培养箱中共培养,并在Incucyte活细胞成像系统下对细胞共培养体系进行拍照,每半小时捕获一次图像。最后利用pHrodo-Deep Red染料在巨噬细胞溶酶体中发光的原理,观察巨噬细胞中红色荧光的数量,可评估被吞噬的肿瘤细胞的数量,因此可计算与两组肿瘤细胞共培养的巨噬细胞的吞噬指数。
(3)小鼠结直肠癌肝转移模型的构建和体内吞噬模型:
6-8周龄的Bal/Bc-nude雄鼠分成两组,分别经脾脏注射1*10
②一部分小鼠肝脏组织使用美天旎小鼠肝脏解离试剂盒进行消化,并使用70μm的细胞筛网进行过滤,得到的细胞悬液经过红细胞裂解液处理去除红细胞,并使用40%的percoll溶液进行密度梯度离心,保留下层沉淀,即得到肝脏中的单个核细胞。分离到的单个核细胞使用CD45,CD11b,F4/80的抗体进行染色,流式检测CD45
(4)小鼠皮下移植瘤模型的构建:
6-8周龄的Bal/Bc-nude雄鼠分成两组,分别经背部皮下注射1*10
所有动物研究均遵循《实验室动物护理使用指南》,并获得了中国医学科学院肿瘤医院伦理委员会的批准(批准号No.NCC2023A126)。
3.PAR2调控CD24表达的机制研究:
(1)3例结直肠癌肝转移病人的单细胞中对CD274,B2M,CD47,CD24基因进行可视化。之后将所有免疫细胞降维聚类,对它们的受体基因PDCD1,LILRB1,SIRPA,SIGLEC10进行可视化。计算F2RL1高表达和F2RL1低表达肿瘤细胞的差异基因识别CD24。
(2)采用RT-qPCR和流式细胞术的方法检测PAR2敲降肿瘤细胞(HT-29,SW620)和对照组细胞的CD24的表达。
(3)敲降或过表达CD24。使用siRNA干扰野生型HT-29细胞的CD24,设计两条siRNA(序列如下sense 5’-3’):siRNA-CD24-1:UCAAGUAACUCCUCCCAGATT;siRNA-CD24-2:CCAGAGUACUUCCAACUCUTT。使用pcDNA3.1(+)系统构建CD24过表达质粒,并经过lipo2000脂质体转染PAR2敲降肿瘤细胞和对照组细胞;经RT-qPCR,和流式细胞术的方法验证CD24的敲降和过表达效果。之后采用上述基于流式的细胞吞噬实验的方法,检测巨噬细胞的吞噬能力的变化。
(4)PAR2调控CD24表达的分子机制:
通过微阵列分析和RT-qPCR筛选PAR2敲降肿瘤细胞(HT-29,SW620)和对照组细胞中差异表达的miRNAs(例如miR-34a和miR-146a),通过外源向转入miRNAs的模拟物(mimics)和抑制剂(inhibitor),验证PAR2是否通过这些miRNAs调控CD24的表达水平。通过在PAR2敲降的肿瘤细胞中抑制miRNAs检测CD24表达等方法验证PAR2是否通过它们调控CD24。
4.吞噬检查点阻断和西妥昔单抗联合治疗的研究
(1)体外检测CD24抗体和西妥昔单抗(anti-EGFR mAb)对巨噬细胞吞噬的影响:
6孔板中的THP-1诱导的巨噬细胞经过结直肠癌细胞系(HT-29,SW620)的条件性培养基处理24h,诱导为肿瘤相关巨噬细胞,并饥饿处理2h。将野生型结直肠癌细胞(HT-29,SW620)或PAR2敲降的结直肠癌细胞系(shCtrl和shPAR2),用CFSE染色30min,按照与巨噬细胞数量为2:1的比例加入6孔板中,同时加入10ug/ml的CD24抗体或者西妥昔单抗,以及它们的同型对照IgG抗体,在37℃培养箱中共培养2h,诱导巨噬细胞对肿瘤细胞的吞噬。之后,洗去上清中未被吞噬的肿瘤细胞,消化收集贴壁的巨噬细胞,并进行CD11b的染色,流式检测流式细胞术检测CD11b/CFSE双阳性的细胞比例,统计与两组肿瘤细胞共培养的巨噬细胞的吞噬指数。
(2)体内检测PAR2抑制剂和西妥昔单抗的抗转移效果:
6-8周龄的Bal/Bc-nude雄鼠分成四组,分别经脾脏注射1*10
二、实验结果
1.肿瘤细胞通过PAR2信号调节巨噬细胞浸润
为了研究PAR2表达和巨噬细胞的相关性,我们首先使用了6例来自3位结直肠癌肝转移患者的原发灶和转移灶的肿瘤样本的单细胞测序数据(GSE178318),对PAR2的编码基因F2RL1进行可视化。结果发现F2RL1主要在结直肠癌细胞中表达,在其他类型的细胞中表达较少(图1A,B图9A)。之后对所有癌细胞进行再聚类,并根据F2RL1的表达水平和表达百分比将癌细胞分成F2RL1高表达组和低表达组(图9B-E)。计算两组细胞的差异基因,并根据差异基因进行GO富集通路分析。发现,F2RL1低表达的肿瘤细胞富集到多种与免疫应答有关的通路上,例如单核细胞分化,髓系细胞活化以及吞噬相关通路(图1C)。这说明了F2RL1低表达的肿瘤细胞对固有免疫应答的激活和诱导巨噬细胞吞噬的潜能。而F2RL1高表达的肿瘤细胞富集到与维持细胞正常功能的通路上(图9F)。此外,使用CIBERSORT的算法对TCGA数据中下载的COAD和READ数据进行分析,发现F2RL1低表达组的结直肠癌肿瘤样本中的M0-TAM浸润数量高于F2RL1高表达组的结直肠癌肿瘤样本(图9G)。
为证实肿瘤微环境(TME)中癌细胞PAR2表达与巨噬细胞的负相关,我们采用脾注射肝转移模型。我们使用一种特定的shRNA建立了稳定敲除PAR2的不同癌细胞系(补充图H-I)。如之前的报道,PAR2降低了肝转移的结节数量(图1D)。由于免疫微环境的形成在癌细胞到达转移器官后就开始了,我们在癌细胞被注射到脾脏后的头几天监测了肝巨噬细胞的变化。流式细胞术和免疫荧光染色显示,在第2天时,巨噬细胞浸润明显增加(图1E-G)。在皮下异种移植模型中,也观察到PAR2缺陷癌细胞诱导的肿瘤微环境中巨噬细胞浸润的增加(图9J-N)。这些结果强烈表明,癌细胞在体内通过高表达PAR2来抑制巨噬细胞的募集。
2.PAR2缺失增加M1型巨噬细胞的极化和招募
为了研究癌细胞对巨噬细胞的直接影响,我们首先采用了Transwell的体外迁移实验。我们证实,PAR2下调的癌细胞的条件培养基(CM)显著增加了THP-1巨噬细胞的募集(图2A)。RNA-seq数据分析显示,PAR2敲除后上调的基因在先天免疫应答中显著富集,包括CSF1和CXCL1基因,这两个基因都编码最重要的巨噬细胞趋化因子(图2B和图10A)。RT-qPCR和ELISA在PAR2下调的HT-29和SW620细胞中验证了CSF1和CXCL1的上调(图2C-D和图10B-C)。为探讨癌细胞对巨噬细胞极化的影响,将THP-1来源的巨噬细胞与HT-29或SW620细胞共培养48h(图2E和图10D),收集共培养后的细胞和上清液进行细胞因子分析。RNA-seq和RT-qPCR分析显示,与shCtrl组相比,PAR2缺失癌细胞(shPAR2)诱导的TAMs表达了更高水平的IL-12mRNA(M1标记物),而不是IL-10mRNA(M2标记物)(图2F和图10E)。在与PAR2下调的癌细胞共培养后,TAMs产生了相对较高水平的促炎细胞因子,如IL-12、IL-1α、IL-1β、TNF-α和IL-8,而不是IL-10(图2G,图10F-H)。此外,流式细胞术分析显示,与PAR2缺陷癌细胞共培养后,CD11b
3.肿瘤细胞PAR2缺失促进巨噬细胞吞噬,抑制肝转移
为了探索TAMs的功能,我们首先进行了RNA-seq的实验。基因集富集分析(GSEA)显示,与PAR2敲低细胞共培养的TAMs中,上调的基因在吞噬途径中显著富集(图3A和图11A)。这与CRC的scRNA-seq数据中F2RL1低表达的癌细胞的特征基因一致(图11B)。为了评估癌细胞对巨噬细胞吞噬作用的影响,我们使用流式细胞术检测巨噬细胞吞噬CFSE标记的肿瘤细胞的能力。如图3B所示,shPAR2组中CD11b
为了检测PAR2在体内对巨噬细胞吞噬作用的影响,我们使用pHrodo-Deep Red标记的HT-29细胞(shCtrl和shPAR2)建立肝转移模型。流式细胞术和免疫荧光染色均显示,在脾脏接种后的前两天,PAR2基因下调组被巨噬细胞吞噬的癌细胞数量逐渐上升(图3D-E和图11D)。
为了确定这种吞噬作用是否与早期转移性肿瘤细胞的存活有关,我们使用HT-29-luciferease细胞来确定肝转移。我们发现了当使用siRNA(图11E)或特异性抑制剂(GB88)对PAR2进行阻断时,显著降低了脾脏注射后第2天肝脏的荧光强度(图3F和图11F)。结果表明,癌细胞PAR2缺失促进巨噬细胞吞噬,降低肿瘤细胞的存活率,抑制体内肝转移。
4.在CRC细胞中,PAR2缺失通过miR-146a和miR-34a下调CD24的表达
由于PAR2的高表达在体内外都能保护癌细胞免受巨噬细胞的吞噬作用,因此下一个问题是PAR2如何调节巨噬细胞的吞噬作用。靶细胞可能通过上调检查点分子来抑制吞噬作用,包括CD47、程序性细胞死亡配体1(PD-L1,也称为CD274)、CD24和主要组织相容性I类复合体的β-2微球蛋白亚基(B2M)。为了检测检查点分子的过表达是否是PAR2信号通路的吞噬逃避机制,我们首先利用CRC scRNA-seq数据在单细胞水平上筛选了癌细胞中的检查点分子。肿瘤细胞和免疫细胞之间CD274、CD47和B2M的表达无差异(图12A)。值得注意的是,CD24在癌细胞中较高表达,而其受体Siglec-10在TAM簇中高表达(图4A)。此外,CD24在PAR2低表达的癌细胞中高表达(图2B和图4B),而其他分子没有发生变化(图12B-C)(数据未显示)。PAR2的下调显著降低了不同CRC细胞中CD24mRNA的表达(图4C)和细胞表面CD24蛋白的表达(图4D)。与巨噬细胞共培养后,CD24的差异更加显著。(图12D)。值得一提的是,与癌细胞共培养后,TAMs中SIGLEC10的表达没有受到影响(图12E)。这些结果表明,CD24介导了由PAR2信号通路调控的吞噬作用。
由于CD24已被报道为miR-34a和miR-146a的直接靶点,我们推测miRNAs可能介导PAR2对CD24的调控。首先,我们发现miRNA阵列检测PAR2敲低后,miR-34a和miR-146a显著上调(图4E),RT-qPCR在不同的细胞中验证了这一点(图4F)。此外,异位的miR-34a和miR-146a的表达确实降低了CD24的mRNA,而它们的抑制则增加了CD24的表达(图4G-H)。此外,在不同的细胞中,单独抑制miR-34a或miR-146a可部分逆转PAR2缺失导致的CD24的减少(图4I),而联合抑制则几乎完全恢复(图4J和图12H-I)。这些结果表明,PAR2缺失通过miR-146a和miR-34a在CRC癌细胞中下调了CD24的表达。
5.CD24介导PAR2调控的巨噬细胞在体外的吞噬作用
下一个问题是CD24是否在CRC中作为吞噬检查点。为了验证它,我们在HT-29和SW620细胞中敲除CD24(图5A和图13A)。与预期的一样,CD24敲低癌细胞显著增加了巨噬细胞的吞噬能力(图5B)。与IgG对照组相比,抗CD24阻断单克隆抗体(克隆号SN3)的处理也显著刺激了基于流式的检测和自动活细胞显微镜检测的吞噬作用(图5C-D)。重要的是,尽管过表达CD24仅部分补偿了细胞表面的CD24(图13B-E),但是它完全阻断了PAR2缺失引起的吞噬作用的增加(图5E)。结果表明,CD24在结直肠癌中作为检查点分子,并介导了PAR2调控的巨噬细胞的体外吞噬作用。
6.PAR2的缺失增强了EGFR抗体的抗癌作用
抗体依赖性细胞吞噬作用(ADCP)不仅是巨噬细胞免疫防御的重要机制,而且有助于单抗治疗中的抗肿瘤免疫。抗EGFR单抗(西妥昔单抗)用于临床晚期结直肠癌患者,已被报道也可以作为调理抗体增强巨噬细胞的吞噬作用。由于PAR2在CRC中由癌症干细胞高表达,我们推测PAR2是否是增强西妥昔单抗治疗效果的潜在靶点。首先,与预期的那样,单独使用西妥昔单抗提高了吞噬作用(图6A)。与任何一种单抗相比,抗CD24单抗和西妥昔单抗联合使用显著增强了巨噬细胞的吞噬能力(图6A)。此外,PAR2的缺失与西妥昔单抗协同增强了吞噬作用(图6B)。这表明PAR2抑制确实增强了抗EGFR单抗的体外抗肿瘤作用。
为了确定联合治疗是否以肝转移的早期阶段为靶点,小鼠在脾脏注射HT-29细胞后,立即用PAR2抑制剂GB88和单剂西妥昔单抗(CTX)治疗(图14)。我们发现,与单独治疗两种方法相比,联合治疗显著增强了巨噬细胞的吞噬作用并且抑制了接种后第2天癌细胞的存活(图6C-D)和实验结束时肝脏中转移性结节的形成(图6E)。这些结果表明,CRC癌细胞到达肝脏后,通过PAR2信号通路上调CD24,从而逃脱巨噬细胞的吞噬,从而促进肝转移。
7.PAR2在人结直肠癌中与巨噬细胞和CD24相关
为了检测癌细胞通过PAR2信号对巨噬细胞的负调控,我们首先使用TCGA Colon(COAD)和Rectum(READ)数据评估免疫浸润。在M0-TAM浸润程度较高的患者中,PAR2的表达明显低于M0-TAM浸润程度较低的患者。相反,在M2-TAM浸润程度较高的患者中,PAR2的表达量要高得多(图7A)。此外,我们用37对CRC标本来验证PAR2表达与TAM标记物在mRNA水平上的相关性。结果显示,F2RL1基因(编码PAR2)mRNA水平与CD68基因(编码巨噬细胞标记)mRNA水平呈负相关,与MRC1基因(编码CD206,与M2标记)mRNA水平呈正相关(图7B)。此外,CD24mRNA的表达与PAR2显著相关(图7C)。在CRC样本中,miR-34a和miR-146a的水平与PAR2呈负相关(图7D)。此外,在CRC组织芯片中对PAR2、CD24和CD68进行多标记免疫荧光(MIF)检测。结果显示,肿瘤中的PAR2的表达与间质中CD68+TAM的浸润呈负相关,与CD24的表达呈正相关(图7E-F)。
最后,对一组CRC的PDX样本进行免疫组化染色,这些样本之前使用GB88进行了处理。IHC染色显示,GB88处理组的异种移植物中CD24的表达明显受到抑制,但是F4/80阳性的巨噬细胞数量明显增加(图7G-H)。综上所述,癌细胞通过PAR2信号通路在CRC中调控巨噬细胞的浸润和CD24的表达。
在我们的研究中,首先对TCGA和单细胞RNA测序数据进行分析,表明PAR2的表达与CRC中的巨噬细胞呈负相关。下调PAR2在不同的异种移植小鼠模型中促进了M1样巨噬细胞的浸润。重要的是,在脾接种癌细胞后第2天,PAR2消耗显著增强了肝脏中巨噬细胞对癌细胞的吞噬和清除,并抑制了小鼠的转移。在机制上,吞噬作用被CD24“不吃我信号”所抑制,该信号被PAR2通过miR-34a和miR-146a正调控。还用小分子抑制剂阻断PAR2联合抗EGFR抗体(西妥昔单抗)具有协同作用,增强巨噬细胞的吞噬能力,抑制体内肝转移(图8)。
总之,我们的研究首次发现CD24在结直肠癌中发挥吞噬检查点的作用,阻断肿瘤细胞的PAR2可以降低CD24的表达,从而促进巨噬细胞的吞噬。同时PAR2小分子抑制剂的使用可以降低吞噬检查点的直接阻断带来的潜在的副作用。PAR2小分子抑制剂与西妥昔单抗的联合使用,无论在体内还是体外都获得了最大的吞噬效率。因此PAR2抑制剂和西妥昔单抗联合使用,是非常有潜力及有效的治疗策略。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 环二核苷酸cGAMP在抗结直肠癌肝转移中的应用
- β-细辛醚在制备治疗或预防结直肠癌肝转移药物中的应用
