具有超高pH响应性的多肽复合物及其制备方法与应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物医药技术领域,尤其涉及具有超高pH响应性的多肽复合物及其制备方法与应用。
背景技术
癌症,泛指恶性肿瘤,包括癌、肉瘤和癌肉瘤三类。为细胞恶性增生所致,有侵袭性,可转移,表现为身体局部肿块持续生长,破坏正常组织结构并转移到其他部位。癌症是导致人类死亡的重要原因之一,寻找高效可行的癌症治疗方法一直是医学研究的重要课题。
目前,以手术、化学疗法(化疗)及放射疗法(放疗)为代表的各种常规的癌症治疗手段已步入一个平台期,难以取得更令人满意的疗效。并且传统的放疗、化疗手段对正常细胞的杀伤以及其带来的脱发、骨髓移植、食欲不振等毒副作用也限制了其应用。随着人们对癌症研究和基因组学认识的不断深入及分子生物学技术的不断发展,基因治疗被开发出来用于治疗癌症,并在临床试验中得到验证。基因治疗具有低毒、靶向性高等优点,旨在通过修复或替换患者体内缺陷或异常基因,以恢复正常的基因功能。然而,由于导入的核酸药物(siRNA、mRNA、pDNA、miRNA等)体积大且带高负电荷,难以跨越细胞内和细胞外屏障,并且进入细胞区内的裸核酸在内含体-溶酶体转运过程中易被快速降解,所以需要开发高效的核酸递送载体使其能够成功包裹核酸将其递送至细胞的有效位点,提高靶组织中药物的浓度和生物利用度。目前常用的核酸药物载体分为病毒载体和非病毒载体两大类。病毒载体递送效率高且可以保证基因的长期表达,包括逆转录病毒、腺病毒、腺相关病毒和慢病毒载体等。但病毒载体在临床上暴露出的免疫原性大、难以精确调控基因表达、致癌性等缺陷限制了其发展。因此近年来,非病毒载体逐渐成为核酸药物载体的研究热点。在过去30年中,人们设计和合成了许多不同种类的非病毒载体,比如阳离子脂质、聚合物、树枝状聚合物、无机材料等。其中,多肽因其具有独特的生物学特性,如易于修饰、低毒性、膜渗透性、细胞表面靶向性等,为核酸药物的递送提供了一个极具前景的平台。各种具有不同大小和结构特征的天然衍生、合成或杂合肽已被用于多种核酸药物的转染以治疗癌症。然而,多肽作为核酸递送载体仍存在诸多问题,比如递送效率低、难以精确控制药物释放等。
为了解决这一问题,研究人员通常会根据肿瘤细胞因旺盛的代谢需求而表现出的肿瘤微环境独特的病理特征来赋予多肽刺激响应特性。一旦受到外部刺激,多肽就会发生化学或物理变化,从而精确识别病灶部位,实现其靶向递送及精确释放功能,减少副作用。常见的刺激响应包括酶、pH和谷胱甘肽(GSH)、温度、ROS等,其中pH响应是最主要的策略。与正常组织的中性环境(pH 7.4)相比,实体瘤内部缺氧的微环境会促使肿瘤通过糖酵解产生大量乳酸,从而使肿瘤微环境呈现微酸性,其pH值约为6.5-6.8。由于空泡质子ATP酶介导的质子流入,内溶酶体中的pH进一步下降至5.0-6.0,表现出更强的酸性。研究人员利用这种差异设计了多种pH响应性多肽。然而,大多数报道的用于转染基因药物的pH响应性多肽通常是对肿瘤细胞外环境或溶酶体酸性环境的单一响应,并且多肽不能高效转染多种基因药物。例如,现有的多肽载体的缺点包括但不限于:1.现有的用于治疗肿瘤的pH响应性多肽纳米载体都是针对肿瘤外部酸性微环境和溶酶体酸性环境的单一响应。2.现有的单组份多肽纳米载体大都存在转染效率低、溶酶体逃逸能力差等问题。可见,尽管“正常组织—肿瘤外部微环境”及“肿瘤外部微环境—溶酶体”的天然双重生理pH梯度使得设计药物释放系统在肿瘤细胞特定部位释放药物成为可能,但得到能够动态精确响应这种双重pH的单组份多肽转染试剂以实现稳定性、转染效率、响应性的平衡仍然是一个挑战。
发明内容
有鉴于此,本发明要解决的技术问题在于提供具有超高pH响应性的多肽复合物及其制备方法与应用。
本发明提供的多肽(说明书中记作KD-n)包括顺序连接的:片段A、片段B和片段C;
其中:
片段A为阳离子片段,包含2~5个带正电荷的氨基酸残基;
片段B为(X1n1-X2n2)m、Y-(X1n1-X2n2)m、X1n1-Y-X2n2或(X1n1-X2n2)m-Y;其中:
X1和X2表示氨基酸残基,X1和X2独立地选自L、V或H;
Y为
n1为X1的数量,n1为0~10的整数,n2为X2的数量,n2为0~10的整数,且n1、n2不同时为0,m=1~5的整数;
片段C为亲水性片段,其氨基酸序列为GSPD或GCPD。
本发明所述的多肽中,片段A为阳离子片段,包括带正电荷的氨基酸,能够与带有负电荷的核酸发生非共价结合,片段B中含有pH响应的氨基酸残基疏水性氨基酸,能够通过疏水相互作用增强多肽在水溶液中自组装的功能,还含有Y基团,Y基团为所述多肽的各模块之间提供了柔性连接过渡,同时也增强了多肽的自组装倾向。片段C为亲水片段,赋予多肽亲水性特征。
本发明提供的多肽具有超高pH响应性,具有较好的生物相容性和生物可降解性。使用该多肽作为核酸药物的递送载体可以减少对机体的毒副作用和免疫反应。该多肽在生理环境(pH 7.4)下可与核酸药物通过静电作用和疏水相互作用共同组装成纳米囊泡,当pH值降低到肿瘤微环境的酸度(pH 6.5-6.8)时,复合物囊泡会启动第一级pH响应,囊泡表面的正电荷增加,与靶向序列协同增加肿瘤细胞对复合物囊泡的摄取,同时静电作用导致复合物囊泡部分解体。当内化到肿瘤细胞后,溶酶体酸度(pH 5.0-6.0)的进一步降低刺激复合物囊泡启动第二级pH响应,含有pH响应性的氨基酸的质子化增强了多肽和基因药物之间的静电互斥作用,导致复合物囊泡自组装结构的破坏,从而使基因药物得以成功释放。
本发明中,片段A可以由一种氨基酸偶联形成,也可以由多种带正电荷的氨基酸偶联形成,也可以由部分带有正电荷的氨基酸与其他氨基酸偶联形成。本发明对此不做限定。所述带正电荷的氨基酸为赖氨酸、精氨酸或组氨酸。本发明实施例中,片段A中所述带正电荷的氨基酸残基为赖氨酸残基。具体的,片段A包括2~5个赖氨酸残基。一些具体实施例中,片段A为KK、KKK、KKKK或KKKKK。
本发明中,X1和X2独立地选自L或H。例如,X1和X2同时为L;X1和X2同时为H;或者X1为H,X2为L;或者X1为L,X2为H。
本发明实施例中,片段B为Y-(Ln1-Hn2)m、Ln1-Y-Hn2、(Ln1-Hn2)m-Y、Y-(Hn1-Ln2)m、Hn1-Y-Ln2或(Hn1-Ln2)m-Y;Y为
一些实施例中,片段B的结构如下所示::
Y-L1、Y-L2、Y-L3、Y-L4、Y-L5、Y-L6、Y-L7、Y-L8、Y-H1、Y-H2、Y-H3、Y-H4、Y-H5、Y-H6、Y-H7、Y-H8、L1-Y、L2-Y、L3-Y、L4-Y、L5-Y、L6-Y、L7-Y、L8-Y、H1-Y、H2-Y、H3-Y、H4-Y、H5-Y、H6-Y、H7-Y、H8-Y、Y-L1H1、Y-L1H2、Y-L1H3、Y-L1H4、Y-L1H5、Y-L1H6、Y-L1H7、Y-L1H8、Y-(L1H1)
可选择的。如上所示结构中,Y为
且片段B为如上结构时,片段A为KKK,片段C为GSPD。
在一些实施例中,本发明所述的多肽中还包括片段D,所述片段D靶向细胞或组织的多肽,其氨基酸残基的数量为3~15。所述靶向模块根据所靶向细胞或组织的不同可进行调整,从而实现靶向功能的特异性,进一步获得更准确的技术效果。本发明中,以肿瘤细胞靶向作用为例,所述片段D为RGD。
一些具体实施例中,本发明所述多肽的氨基酸序列如SEQ ID NO:5~8任一项所示。
本发明中,所述多肽的制备可采用基因工程的方法,也可采用化学合成的方式进行,本发明对此不做限定。所述化学合成可采用固相合成、液相合成或固液结合的方式进行,本发明对此亦不做限定。本发明中,R为直链烷基,当多肽中含有Y或Y时,以原料为NH
本发明提供的多肽通过简单混合的方式与多种核酸药物可以组装成纳米级具有抗癌作用的复合物囊泡,其作为单组分多肽转染试剂是多种核酸药物的良好载体。它可以通过对肿瘤外部微环境(pH6.5-6.8)和溶酶体酸性环境(pH 5.0)的双重响应高效转染多种核酸药物。其中siRNA转染效率最高为96%,mRNA转染效率最高为74.9%,pDNA的最高转染效率为87.1%。可以有效抑制癌细胞的生长,导致癌细胞最高96%的死亡率。
进一步的,本发明提供了如前所述多肽在制备核酸药物的载体中的应用。
更进一步的,本发明还提供了一种复合物,其包括如前所述的多肽和核酸;所述核酸包括siRNA、mRNA和pDNA中的至少一种。
本发明所述的复合物由如前所述的多肽和核酸组装而成,核酸与多肽通过静电相互作用连接。
一些具体实施中,所述核酸为核酸药物,或编码目的蛋白的核酸或编码标签的核酸。所述标签包括荧光标签,例如,编码绿色荧光蛋白的核酸或编码红色荧光蛋白的核酸。所述核酸药物为治疗癌症的药物,所述癌症包括:膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肺癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌和/或甲状腺癌。
本发明还提供了所述复合物制备方法,其包括将所述核酸与所述的多肽混合,经组装制得。所述组装在室温下进行,所述室温为18~35℃。所述组装的时间为0.1~1h,优选的组装时间为30min。所述组装的体系的pH值为7.0~8.0,优选为7.4。所述核酸与多肽的摩尔比为1:(2~15),优选为1:15。
更进一步的,本发明还提供了如下(1)~(3)中至少一项在制备核酸转染试剂、试剂盒和/或治疗癌症的的药物中的应用:
(1)、如前所述的多肽;
(2)、如前所述的复合物;
(3)、如前所述的制备方法制得的复合物。
更进一步的本发明还提供了核酸转染试剂、试剂盒和/或治疗癌症的药物,其包括如下(1)~(3)中至少一项:
(1)、如前所述的多肽;
(2)、如前所述的复合物;
(3)、如前所述的制备方法制得的复合物。
本发明还提供了治疗癌症的方法,其包括给予本发明所述的药物。所述给予的方式包括口服和注射。
发明提供的多肽由片段A、B、C组成,并且可选择的含有具有靶向作用的片段D。该多肽在生理环境(pH 7.4)下可与核酸药物通过静电作用和疏水相互作用共同组装成纳米囊泡,当pH值降低到肿瘤微环境的酸度(pH 6.5-6.8)时,复合物囊泡会启动第一级pH响应,囊泡表面的正电荷增加,与靶向序列协同增加肿瘤细胞对复合物囊泡的摄取,同时静电作用导致复合物囊泡部分解体。当内化到肿瘤细胞后,溶酶体酸度(pH 5.0-6.0)的进一步降低刺激复合物囊泡启动第二级pH响应,含有pH响应性的氨基酸的质子化增强了多肽和基因药物之间的静电互斥作用,导致复合物囊泡自组装结构的破坏,从而使基因药物得以成功释放。通过这种超高pH响应的策略,复合物囊泡可以携带siRNA、pDNA和mRNA高效转染肿瘤细胞。pDNA的最高转染效率为87.1%,mRNA的最高转染效率为74.9%,超过了大多数利用单组份多肽转染核酸大分子的转染效率。此外,携带siRNA的多肽纳米载体可杀死96%的癌细胞。因此,本发明涉及的具有超高pH响应性多肽是癌症基因药物的良好载体。
附图说明
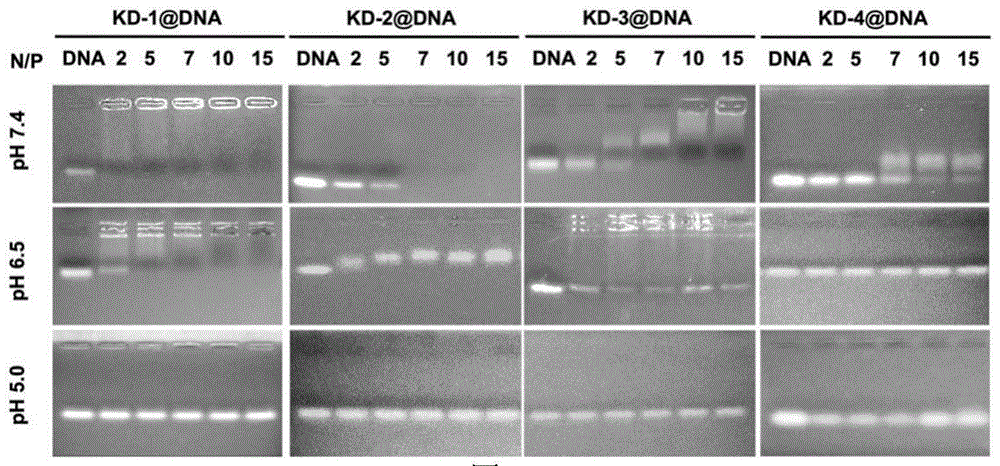
图1为实施例2中不同pH下(pH 7.4,pH 6.5和pH 5.0)DNA与具有超高pH响应性的多肽形成的复合物囊泡的核酸凝胶电泳图;
图2为实施例3中利用圆二色光谱表征不同pH下(pH 7.4,pH 6.5和pH 5.0)DNA与具有超高pH响应性的多肽形成的复合物囊泡的二级结构图;
图3为实施例3中利用傅立叶变换红外光谱仪表征不同pH下(pH 7.4,pH 6.5和pH5.0)DNA与具有超高pH响应性的多肽形成的复合物囊泡的二级结构图;
图4为实施例3中不同pH下(pH 7.4,pH 6.5和pH 5.0)DNA与具有超高pH响应性的多肽形成的复合物囊泡的透射电子显微镜(TEM)图;
图5为实施例4中复合物囊泡KD-1@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图6为实施例4中复合物囊泡KD-2@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图7为实施例4中复合物囊泡KD-3@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图8为实施例4中复合物囊泡KD-4@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图9为实施例4中复合物囊泡KD-n@FAM-siRNA转染Hela细胞的流式细胞图(图中流式结果图右上角数字代表转染效率);
图10为实施例4中复合物囊泡对Hela细胞目标基因的基因沉默结果图;
图11为实施例4中复合物囊泡KD-n@GFP-mRNA转染Hela细胞的倒置荧光显微镜图;
图12为实施例4中复合物囊泡KD-n@GFP-mRNA转染Hela细胞的流式细胞图(图中流式结果图右上角数字代表转染效率);
图13为实施例4中复合物囊泡KD-n@GFP-pDNA转染Hela细胞的倒置荧光显微镜图;
图14为实施例4中复合物囊泡KD-n@GFP-pDNA转染Hela细胞的流式细胞细胞图(图中流式结果图右上角数字代表转染效率);
图15为实施例5中复合物囊泡KD-1@siRNA对Hela细胞的细胞毒性图。
具体实施方式
本发明提供了具有超高pH响应性的多肽复合物及其制备方法与应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明的具有超高pH响应性的多肽复合物囊泡(简称复合物囊泡)通过动态、精确地响应肿瘤微环境和溶酶体环境的酸度梯度,将siRNA、mRNA和pDNA高效地递送到癌细胞中。在中性条件下,具有超高pH响应性的多肽和核酸药物共同组装成稳定的复合物囊泡。到达肿瘤组织的微酸性环境后,第一级pH响应使得组氨酸质子化从而导致多肽和核酸药物部分解体,并增加了复合物囊泡表面的正电荷,提高癌细胞对复合物囊泡的摄取。内化到癌细胞后,通过第二级pH响应,复合物囊泡通过质子海绵效应成功进行溶酶体逃逸,成功释放核酸药物。释放的核酸药物通过发挥作用扰乱细胞周期,从而抑制癌细胞生长。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
合成如下多肽:
KD-1:Lys-Lys-Lys-His-His-His-His-Acp(C6烷基)-Leu-Leu-Leu-Leu-Leu-Leu-Leu-Leu-Gly-Ser-Pro-Asp-Arg-Gly-Asp(SEQ ID NO.5)
KD-2:Lys-Lys-Lys-Acp(C6烷基)-Leu-Leu-His-Leu-Leu-His-Leu-Leu-His-Gly-Ser-Pro-Asp-Arg-Gly-Asp(SEQ ID NO.6)
KD-3:Lys-Lys-Lys-His-His-His-His-Acp(C6烷基)-Leu-Leu-Leu-Leu-Gly-Ser-Pro-Asp-Arg-Gly-Asp(SEQ ID NO.7)
KD-4:Lys-Lys-Lys-His-His-His-His-Acp(C6烷基)-Gly-Ser-Pro-Asp-Arg-Gly-Asp(SEQ ID NO.8)
多肽委托天津北洋康肽生物科技有限公司生产制备。
实施例2
具有超高pH响应性的多肽复合物囊泡的制备方法,包括如下步骤:
(1)将实施例1制备的多肽分别放入pH 7.4的缓冲溶液中,用枪头吹吸使其分散均匀,超声使溶解,制备获得浓度为1mg/mL的溶液为溶液一;
(2)将1OD的DNA在4000转/分钟的转速下离心1分钟,缓慢打开后加入33μL的无核酸酶水振荡溶解,得到1mg/mL溶液备用;
(3)将步骤(2)获得的溶液加入到溶液一中,使质子化氮与磷酸基团的摩尔比为15,在室温下组装30min,得到具有超高pH响应性的多肽复合物囊泡。
DNA购自苏州金唯智生物科技有限公司,在表征测试中用作模型DNA。
DNA的正义链核苷酸序列为SEQ ID NO.1;
DNA的反义链核苷酸序列为SEQ ID NO.2;
SEQ ID NO.1:
5’-TCAAGTTGCCGAATCAAGGCAGCACCCCACGCACCTAATTGGCGAGGTGTCT CTG-3’
SEQ ID NO.2:
5’-CAGAGACACCTCGCCAATTAGGTGCGTGGGGTGCTGCCTTGATTCGGCAACTT GA-3’
分别用N/P(多肽中氨基酸的质子氮与核苷酸中磷酸的比值)摩尔比为0、2、5、7、10;替找本实施例的N/P摩尔比为15;分别用pH 6.5,pH 5.0的缓冲溶液;替找本实施例的pH7.4缓冲溶液,其它同本实施例,分别得到不同的多肽复合物囊泡。
其中N/P摩尔比分别为0、2、5、7、10、15时在室温下组装30min,得到具有超高pH响应性多肽复合物囊泡的核酸凝胶电泳图见图1。
从图1中可以看出在pH 7.4和pH 6.5条件下,当N/P大于2时,DNA的迁移受阻。在pH5.0时,在所有N/P条件下,DNA能完全从多肽复合物囊泡中释放出来。证明具有超高pH响应性的多肽KD-1在正常组织环境(pH 7.4)和肿瘤微环境(pH 6.5-6.8)中都能有效保护DNA,只有在溶酶体酸性环境(pH 5.0-6.0)中,才会释放DNA。在pH 7.4时,KD-2和KD-3能够分别在N/P大于7和N/P大于10时有效地包裹DNA。在pH 6.5时,KD-2和KD-3封装DNA的效率降低。而KD-4无法形成对DNA的有效包裹。
实施例3
实施例2制备的具有超高pH响应性多肽复合物囊泡的表征:使用JASCO公司的jasco-810型圆二色谱仪测定具有超高pH响应性多肽复合物囊泡(以下表示为KD-n@DNA,N/P=15)的圆二色谱,样品池光程0.1mm,波长范围180-350nm,扫描速度100nm/min,带宽1nm,测试温度25℃。
图2中结果表明,随着pH值的降低,KD-n@DNA都有从反β片状结构逐渐转变为无规线圈的趋势。具体来说,在pH 7.4时,KD-n@DNA的CD光谱在193-197nm处有较强的正峰,在215-220nm处有负峰,表明存在反β片。然而,在酸性环境中,这两个峰的强度逐渐降低,在200nm处出现了一个强烈的负峰,表明反β片减少,无规线圈含量增加。
利用Vertex-70傅立叶变换红外光谱仪(美国)对KD-n@DNA的二级结构进行表征:平均扫描16次,分辨率为4cm
图3中KD-n@DNA(n=1、2、3、4)的反β片含量分别为83%、82%、73%、55%。
另外,利用场发射透射电子显微JEM-2100F原位观察形成复合物囊泡的形貌结构。使用移液枪吸取10μL组装的复合物囊泡,滴在300目铜网(碳膜载网)表面,静置2min,然后用滤纸除去铜网表面粘附的复合物,在25℃下自然干燥。用1%的磷钨酸水溶液负染处理后,在加速电压为80kV的透射电子显微镜下观察,从图4中可以看到pH 7.4时,KD-1@DNA可以形成直径约为150nm的均匀且规则的囊泡。在pH 6.5时,复合物囊泡的球形结构被破坏,结构变得松散,直径增加到约300nm。在pH 5.0时,KD-1@DNA结构的松散程度进一步增加,呈现出无序的团块。同样,随着pH值的降低,KD-n@DNA(n=2、3)的结构也由规则变为不规则。这是因为组氨酸的质子化导致分子间和分子内氢键的变化以及肽与核酸之间静电排斥的增加,从而破坏了KD-n@DNA(n=1,2,3)稳定有序的自组装结构。相比之下,KD-4在不同的pH值下都无法保持高度有序的组装结构,这表明中心疏水残基对于驱动多肽组装至关重要。
实施例4
具有超高pH响应性的多肽复合物囊泡(表示为KD-n@核酸,n=1,2,3,4)制备核酸转染试剂中的应用:
(1)将Hela细胞(市售)用含10%胎牛血清和1%双抗(青链霉素混合液)的DMEM培养基、在5%CO
(2)FAM(羧基荧光素)标记的siRNA转染方法如下:
①将实施例1制备的多肽放入pH 7.4缓冲溶液中,用枪头吹吸使其分散均匀,超声使溶解,制备获得浓度为1mg/mL的溶液为溶液一;
②将1OD的FAM(羧基荧光素)标记的siRNA(表示为FAM-siRNA)在4000转/分钟的转速下离心1分钟,缓慢打开后加入150μL的无核酸酶水振荡溶解,得到20μM溶液备用;
siRNA正义链核苷酸序列如SEQ ID NO.3所示;siRNA正义链核苷酸序列如SEQ IDNO.4所示。
SEQ ID NO.3:
5’-CUAGUACAGGUUCAAAUGATT-3’
SEQ ID NO.4:
5’-UCAUUUGAACCUGUACUAGTT-3’
③将步骤②获得的溶液加入到溶液一中,使质子化氮与磷酸基团的摩尔比(N/P摩尔比)分别为5,10,15,20,30,在室温下组装30min,得到FAM标记的具有超高pH响应性的多肽复合物囊泡。
分别取10μL带有FAM标记的具有超高pH响应性的多肽复合物囊泡;加pH 7.4缓冲溶液稀释到终体积为100μL,加入到含900μL Opti-MEM培养基的培养孔中,轻轻摇动细胞培养板,使具有超高pH响应性的多肽复合物囊泡与孔中的培养基充分混合。4h后将Opti-MEM培养基置换为含10%胎牛血清和1%双抗(青链霉素混合液)的DMEM培养基,在倒置荧光显微镜下观察。见图5、图6、图7、图8。
图5为本实施例中复合物囊泡KD-1@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图6为本实施例中复合物囊泡KD-2@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图7为本实施例中复合物囊泡KD-3@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
图8为本实施例中复合物囊泡KD-4@FAM-siRNA转染Hela细胞的倒置荧光显微镜图;
(3)流式细胞术测定转染效率方法如下:设置空白组与实验组,空白组细胞无处理,实验组细胞(Hela)用N/P=15的复合物囊泡(KD-n@FAM-siRNA)转染,转染方法与本实施例的步骤(2)中相同。用PBS反复洗涤三次之后,进行细胞处理计数,用细胞洗液(含2%BSA的PBS)重悬细胞,使细胞浓度为1×10
(4)实时荧光定量实验方法如下:
优选地,用具有抗癌作用的siRNA替代本实施例步骤(2)中的带有FAM(羧基荧光素)标记的siRNA。具有超高pH响应性的且具有抗癌作用的多肽复合物囊泡的制备如下:
①将实施例1制备的多肽放入pH 7.4缓冲溶液中,用枪头吹吸使其分散均匀,超声使溶解,制备获得浓度为1mg/mL的溶液为溶液一;
②将1OD的具有抗癌作用的siRNA在4000转/分钟的转速下离心1分钟,缓慢打开后加入150μL的无核酸酶水振荡溶解,得到20μM溶液备用;
③将步骤②获得的溶液加入到溶液一中,使质子化氮与磷酸基团的摩尔比(N/P摩尔比)分别为15,在室温下组装30min,得到具有超高pH响应性的且具有抗癌作用的多肽复合物囊泡。
设置空白组和实验组。空白组为未处理的Hela细胞。将Hela细胞按照本实施例的步骤(1)的方法接种于12孔板内,取10μL具有超高pH响应性的且具有抗癌作用的多肽复合物囊泡溶液;加pH7.4缓冲液稀释到终体积为100μL,加入到含900μL Opti-MEM培养基的培养孔中,轻轻摇动细胞培养板,使稀释后的溶液一与孔中的培养基充分混合,4h后将Opti-MEM培养基置换为含10%胎牛血清和1%双抗(青链霉素混合液)的DMEM培养基,此方法处理得到的细胞为复合物囊泡组,转染方法与本实施例步骤(2)中相同。放置48h。利用Trizol试剂(Invitrogen公司)提取Hela细胞总mRNA。将等量的RNA与Moloney Murine LeukemiaVirus逆转录酶、三磷酸脱氧核苷(dNTP)和寡核苷酸(dT)混合,逆转录为互补DNA(cDNA)。然后,将引物、cDNA、dNTP和DNA聚合酶混合进行实时荧光定量实验。
图10中与复合物囊泡共培养的Hela细胞中调控细胞周期的基因水平显著降低,其中KD-1下调目标基因的能力最强,效率高达90%,可以显著抑制癌细胞的生长。
优选地,用绿色荧光蛋白mRNA或绿色荧光蛋白pDNA替找本实施例中步骤(2)中的带有FAM(羧基荧光素)标记的siRNA(表示为KD-n@GFP-mRNA或KD-n@GFP-pDNA)。N/P比优选为15。转染方法与步骤(2)相同,放置48h。流式细胞术测定转染效率方法与步骤(3)相同。实验结果如图11、图12、图13、图14所示。
图11为本实施例中复合物囊泡KD-n@GFP-mRNA转染Hela细胞的倒置荧光显微镜图;
图12为本实施例中复合物囊泡KD-n@GFP-mRNA转染Hela细胞的流式细胞术结果图;
图13为本实施例中复合物囊泡KD-n@GFP-pDNA转染Hela细胞的倒置荧光显微镜图;
图14为本实施例中复合物囊泡KD-n@GFP-pDNA转染Hela细胞的流式细胞术结果图。
实施例5
具有超高pH响应性的多肽复合物囊泡在制备抗癌药物中的应用:
优选具有超高pH响应性的多肽复合物囊泡KD-1@siRNA进行细胞毒性实验,实验方法如下:
设置空白组和实验组。未处理的细胞为空白组。将Hela细胞用含10%胎牛血清和1%双抗(青链霉素混合液)的DMEM培养基、在5%CO
从图15可以看出,随着具有抗癌作用的siRNA浓度的增加,癌细胞的存活率逐渐下降。当具有抗癌作用的siRNA浓度为500nM,N/P比为10时,癌细胞存活率仅为4%。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种具有pH响应性的两亲性白及多糖衍生物纳米颗粒及其制备方法和应用
- 一种具有pH响应性的席夫碱共聚物包覆的介孔二氧化硅载药纳米粒子及其制备方法和应用
- 一种具有pH响应性的木质素磁性纳米颗粒及其制备方法和在纤维素酶回收中的应用
- 一种具有pH响应性的超双疏材料的制备方法及其应用
- 一种具有光响应、还原响应以及pH响应的嵌段共聚物的制备方法
- 一种pH响应性Cecropin B抗菌多肽的制备方法与应用
- 具有高转染效率的pH响应性多肽及其应用
