一种靶向CD28的三特异性抗体构建方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物技术领域,具体涉及一种基于结构优化蛋白活性的三特异性抗体制备方法。
背景技术
近年来,肿瘤免疫治疗已逐渐在多种癌症治疗方面取得极大成效,如免疫检验点阻断和工程化T细胞以增强T细胞活化与杀伤能力。目前获批的免疫治疗药物不断增加,并且临床和临床前开发了多种治疗方法。然而,广泛应用癌症免疫治疗的一个关键挑战是免疫系统的反应性与安全性,因为这些疗法具有严重的不良反应,如自身免疫和非特异性炎症(Riley RS,et al.Delivery technologies for cancer immunotherapy.Nat Rev DrugDiscov.2019Mar;18(3):175-196.)。尽管CTLA-4与PD-1/PD-L1的抑制剂在临床方面取得了一定的效果,仅有部分人群对此疗效持久,大多数恶性肿瘤对免疫治疗依旧没有反应,因此急需开发新的更有效的免疫治疗方法(Chen DS,et al.Elements of cancer immunityand the cancer-immune set point.Nature.2017Jan 18;541(7637):321-330.doi:10.1038/nature21349.PMID:28102259.;O'Donnell JS,et al.Cancer immunoeditingand resistance to T cell-based immunotherapy.Nat Rev Clin Oncol.2019Mar;16(3):151-167.)。了解如何提高对免疫疗法的反应率与安全性是提高疗效和控制免疫疗法不良反应与克服免疫逃逸的关键。其中,增强免疫系统反应性与安全性的较好策略是通过辅助分子提供共刺激信号来维持抗原特异性T细胞对肿瘤的杀伤能力和功能持久性。
近些年抗体疗法在癌症免疫治疗中不断的展露头角。工程化抗体即为抗体疗法探索中的重要部分,蛋白质工程技术推动了双特异性抗体(Bispecific antibodies,BsAbs)的产生,BsAbs的一端可以与癌细胞表面的抗原结合,另一端与T细胞表面的T细胞受体结合,招募并激活T细胞杀伤肿瘤细胞。BsAbs为代表的免疫治疗可以打破上述局限,为癌症患者带来新的契机。自1985年Brennan等人将2个单克隆抗体用化学偶联的方式构建了第一个双特异性抗体后(Brennan M,et al.Preparation of bispecific antibodies bychemical recombination of monoclonal immunoglobulin G1fragments.Science.1985Jul 5;229(4708):81-3.),不同靶点、不同形式的双特异性抗体迅速发展。随着基因工程技术的广泛应用,人们可以通过重组DNA等手段控制双特异性抗体的大小、亲和力、半衰期、稳定性、溶解性等特性,并且可以构建嵌合的或人源化的Abs,以满足不同需求(Du J,et al.Engineering Bifunctional Antibodies with ConstantRegion Fusion Architectures.J Am Chem Soc.2017Dec27;139(51):18607-18615.;Hollander N.Bispecific antibodies for cancer therapy.Immunotherapy.2009Mar;1(2):211-22.)。靶向CD3/CD19的Blinatumomab和靶向CD3/EpCAM的Catumaxomab是目前仅有的被批准上市用于肿瘤免疫治疗的BsAbs,分别用于治疗急性淋巴细胞白血病和恶性腹水(May MB,et al.Blinatumomab:Anovel,bispecific,T-cell engaging antibody.Am JHealth Syst Pharm.2016Jan 1;73(1):e6-e13.;Bokemeyer C.Catumaxomab--trifunctional anti-EpCAM antibody used to treat malignant ascites.Expert OpinBiol Ther.2010Aug;10(8):1259-69.)。但是由于重链错配、抗体失活、T细胞激活不充分和非人类相关免疫原性等问题,限制了BsAbs更广泛的临床应用(Thakur A,etal.Bispecific antibody based therapeutics:Strengths and challenges.BloodRev.2018Jul;32(4):339-347.)。BsAbs可以通过直接将免疫细胞靶向肿瘤来降低耐药性与严重的不良反应,但相比于液体瘤,BsAbs对于实体瘤的治疗则仍然困难,液体肿瘤通常更分散,因此更容易接近循环免疫细胞,而对于实体瘤的治疗则难以突破肿瘤微环境屏障以及T细胞耗竭引发的免疫逃逸等问题(Staerz UD,et al.Hybrid antibodies can targetsites for attack by T cells.Nature.1985Apr 18-24;314(6012):628-31.doi:10.1038/314628a0.PMID:2859527.;Thakur A,et al.Bispecific antibody-basedtherapeutics:Strengths and challenges.Blood Rev.2018Jul;32(4):339-347.doi:10.1016/j.blre.2018.02.004.Epub 2018Feb 20.PMID:29482895.)。其中T细胞耗竭与惰性问题则需要通过引入共刺激域以维持抗原特异性T细胞对肿瘤的杀伤能力和功能持久性。
近年来,共刺激信号的研究方面取得了极大进展,主要有CD28,CD2,CD5,CD30,OX40,inducible costimulator(ICOS),LFA-1和4-1BB。作为共刺激第二信号,最重要的是来自T细胞表面的CD28与APC表面的B7家族分子CD80/CD86的结合。CD28是T淋巴细胞表面表达的共刺激分子,在人体免疫系统中,它表达在大约80%的CD4
T细胞共刺激信号的缺乏则会导致T细胞活化能力降低以及肿瘤细胞免疫逃逸的发生。因此,CD28抗体逐渐得到广泛应用,成为恶性肿瘤、移植排斥、自身免疫和传染病以及一系列新适应症的靶向疗法。但在2010年Hansel等人发现CD28单抗TGN1412在首次人体研究期间发生了危及生命的细胞因子释放综合征,因此需要对CD28抗体在安全性、特异性、对免疫逃逸的抑制性等方面进行进一步研究(Hansel TT,Kropshofer H,Singer T,MitchellJA,George AJ.The safety and side effects of monoclonal antibodies.Nat RevDrug Discov.2010Apr;9(4):325-38.doi:10.1038/nrd3003.Epub 2010Mar 22.PMID:20305665.)。为解决上述问题,进一步开发出CD28双特异性抗体与三特异性抗体。
T细胞结合三特异性抗体(T cell-engaging trispecific antibodies,TsAbs)代表了一种特异性靶向肿瘤激活细胞毒性T细胞的治疗方式(Runcie K,et al.Bi-specificand tri-specific antibodies-the next big thing in solid tumortherapeutics.Mol Med.2018Sep 24;24(1):50.;Mullard A.Trispecific antibodiestake to the clinic.Nat Rev Drug Discov.2020Oct;19(10):657-658.)。2017年报道的一种三特异性抗体SAR441236能够独立地结合HIV包膜的3种不同表位,并在动物模型上验证有一定的抗病毒能力(Mullard A.Trispecific antibodies take to the clinic.NatRev Drug Discov.2020Oct;19(10):657-658.)。TsAbs经过工程化改造,具有三个特异性结合位点,既可以激活T细胞同时也可以靶向多个肿瘤表面抗原以实现对肿瘤细胞的特异性杀伤。
目前对于CD28双特异性抗体与三特异性抗体的开发与应用已受到广泛关注,CD28与肿瘤特异性抗原(tumor-specific antigen,TSA)特异性靶点设计的CD28双特异性抗体(TSA×CD28)可以增强CD3双特异性抗体抗肿瘤活性,使用人IgG4全抗体结构,且在人源化免疫活性小鼠模型或灵长类动物中单独使用时活性较低无毒副作用(Skokos D,etal.Aclass of costimulatory CD28-bispecific antibodies that enhance theantitumor activity of CD3-bispecific antibodies.Sci Transl Med.2020Jan 8;12(525):eaaw7888.doi:10.1126/scitranslmed.aaw7888.PMID:31915305.);2022年,Nature发表一种针对Her2、CD3和CD28的TsAbs,使用CODV-Ig抗体结构,利用消除与Fcγ受体的结合并减少非特异性炎症的突变,建立了一种不活跃的人IgG4 Fc区域。通过涉及CD4依赖性抑制肿瘤细胞周期进展的机制,实现刺激人源化小鼠模型中乳腺癌的消退。(Seung E,XingZ,Wu L,Rao E,Cortez-Retamozo V,Ospina B,Chen L,Beil C,Song Z,Zhang B,Levit M,Deng G,Hebert A,Kirby P,Li A,Poulton EJ,Vicente R,Garrigou A,Piepenhagen P,Ulinski G,Sanicola-Nadel M,Bangari DS,Qiu H,Pao L,Wiederschain D,Wei R,YangZY,Nabel GJ.Atrispecific antibody targeting Her2 and T cells inhibits breastcancer growth via CD4 cells.Nature.2022Mar;603(7900):328-334.)。在多发性骨髓瘤的治疗中,CD38/CD28/CD3三特异性抗体表现出良好的效果,与已经获得批准的CD38单克隆抗体daratumumab相比,裂解的癌细胞比例提高了3-4倍。而且在小鼠的多发性骨髓瘤模型中,这个TsAbs也能够剂量依赖性减小移植到小鼠体内的肿瘤大小(Wu,et al.Trispecificantibodies enhance the therapeutic efficacy of tumor-directed T cells throughT cell receptor co-stimulation.Nat Cancer 1,86–98(2020).)。
随着蛋白质工程技术的不断进步,多特异性抗体结构类型也越发多样,如将不同抗原结合位点(如scFv或Fab)与其他蛋白结构域融合生产,从而进一步功能化(KontermannRE,Brinkmann U.Bispecific antibodies.Drug Discov Today.2015Jul;20(7):838-47.)。如今,临床试验中大多数候选药物都是BiTE、DART、“杵臼结构”("knob-in-hole")抗体或三功能性多特异性抗体(Sedykh SE,Prinz VV,Buneva VN,Nevinsky GA.Bispecificantibodies:design,therapy,perspectives.Drug Des Devel Ther.2018Jan 22;12:195-208.)。但是现有的CD28 TsAbs仍然存在结构固化、全抗体Fc片段介导的毒性问题以及靶点识别区效价单一等问题。
由于TsAbs所涉及的靶点不同,其结合抗原表位所在细胞表面的位置不同,意味着其结构设计需要根据抗体与靶细胞的互作情况进行调整。通常来说,TsAbs介导T细胞和肿瘤细胞的结合涉及到免疫突触的形成,免疫突触是在T细胞活化过程中,T细胞与肿瘤细胞或者抗原呈递细胞之间形成的一个高度复杂,有序的超分子结构域,是被一圈整合素家族的黏附分子所包围的中心簇TCR与抗原复合物结合的一种特殊结构(Wu L,etal.Trispecific antibodies enhance the therapeutic efficacy of tumor-directedT cells through T cell receptor co-stimulation.Nature Cancer 1,86–98.;Yokosuka T,et al.The immunological synapse,TCR microclusters,and T cellactivation.Curr Top Microbiol Immunol.2010;340:81-107.)。在免疫突触形成过程中,由于TCR和抗原复合物的结构缘故,T细胞和靶细胞之间的距离约在15nm。磷酸化酶CD45和CD148由于具有远长于15nm的外功能区而被排挤在突触外,从而使无负调控因子情况下的TCR诱导的酪氨酸磷酸化过程顺利进行。研究表明具有更短的外功能区的突变型CD45蛋白削弱了T细胞相关信号,这也验证了上述的分子排挤作用在T细胞信号中的重要性(Basu R,et al.Cytotoxic T Cells Use Mechanical Force to Potentiate Target CellKilling.Cell.2016Mar 24;165(1):100-110.;Basu R,et al.Mechanical Communicationat the Immunological Synapse.Trends Cell Biol.2017Apr;27(4):241-254.)。TsAbs与不同抗原之间的空间距离对于相应的T细胞免疫突触形成和T细胞信号传导激活也可能同样重要,但这种空间距离取决于完全不同的结构因素,包括抗原表位、抗体和T细胞之间的互作区域。
综上所述,为了实现增强TsAbs对T细胞活化能力以及介导T细胞对抗原表达肿瘤细胞的杀伤效果,需要对不同的抗体连接方式与位置选择进行考察,通过结构设计的优化和筛选,建立一种基于增强T细胞活化能力与介导T细胞靶向肿瘤杀伤的优化TsAbs设计方案,从而实现抗体结构优化,减弱药物代谢时间与Fc介导的毒性,以及靶点识别区的多效价构建靶向广谱抗原分子的最优TsAbs分子设计。
发明内容
多靶点抗体药物成为解决上述类似问题的关键,因此,为寻找更有效的治疗手段,本发明提供了一种新型三特异性抗体的构建方法,这将给患者提供更多的用药选择。
本发明采用位点特异性生物嵌合技术,将不同的功能性抗体融合表达在另外抗体骨架的不同位置,进一步通过不同结构设计与功效关系的比较,建立了一种高效筛选功能最优的三特异性抗体设计构建策略。
本发明第一个方面,提供了一种三特异性抗体分子的构建方法。所述三特异性抗体的构建方法是以第一结构域—单克隆抗体的Fab作为结构基础,同时增加了靶向肿瘤特异性或相关抗原的抗体片段以及T细胞活化共刺激结构域,分别为第二结构域和第三结构域,第二结构域与第三结构域通过连接肽(Linker)可连接至Fab片段。
具体地,所述构建方法包括:
(1)以CD3单克隆抗体Fab为第一结构域;
(2)将第二结构域或第二结构域/第三结构域连接于第一结构域Fab的重链结构域;
(3)将第三结构域连接于第一结构域Fab的轻链结构域或轻链结构域不作任何修饰;
(4)重链和轻链通过CH1和CL中的二硫键结合形成异源二聚体的三特异性抗体。
所述步骤(2)可按照以下方式进行构建或连接:
(a)通过连接肽将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域;或
(b)通过连接肽将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过连接肽将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端1E;或
(c)通过连接肽将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过连接肽将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端,再通过连接肽将第三结构域依次串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域N端;或
(d)通过连接肽将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过连接肽将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端,再通过连接肽将第三结构域依次串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域区域,再次通过连接肽将第三结构域依次串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域区域,从N端至C端依次形成结构为—第三结构域—212 Linker—第三结构域—218 Linker—第三结构域—PD Linker—重链可变区—重链恒定区—(G4S)3 Linker—第二结构域的重组重链。
所述步骤(3)可通过以下方式进行构建或连接:
(a)通过连接肽将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端1Q;或
(b)通过连接肽将第三结构域嵌合于CD3 Fab轻链恒定区(CL)结构域171S-173D之间,并缺失172K;或
(c)通过连接肽将第三结构域连接于CD3 Fab轻链恒定区(CL)结构域C端217C;或
(d)通过连接肽将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端,再通过连接肽将第三结构域串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域;或
(e)通过连接肽将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端,再通过连接肽将第三结构域依次串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域,再次通过连接肽将第三结构域依次串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域,从N端至C端依次形成结构为第三结构域—连接肽—第三结构域—连接肽—第三结构域—连接肽—轻链可变区—轻链恒定区的重组轻链。
步骤(1)、步骤(2)、步骤(3)所述第一结构域、第二结构域、第三结构域各自独立地具有针对选择Her2、VEGFR1/2、CD3、CD19、CD22、EGFR、EGFRvIII、HER3、HER4、IGF1R、c-Met、MUC-1、MUC-16、IL13R、Trop-2、GPC2、GPC3、GD2、CEA、PSMA、PSCA、EpCAM、CD79、ROR1、AXL、CD133、CD171、BCMA、CD20、CD123、Claudin6、Claudin 18.2、CD38、CD30、CD33、CD138、CD56、CS1、CLL1、CD7、CD4、CD8、Lewis Y、ALK、KRAS突变体、MYD88突变体、IDH1突变体、P53突变体、NY-ESO-1、NKG2D、CD16、CD56、CD64、PD-1、PD-L1、B7-H3、B7-H4、TGF-beta、CTLA-4、LAG-3、TIM-3、TIGHT、VISTA、ICOS、GITR、CD28、4-1BB、OX40、CSD27、CD24、CD47、CXCR4、DLL3、Integrin等等相关靶点抗原的结合特异性。
步骤(2)与步骤(3)所述第二结构域、第三结构域可以为Adnectin(人纤连蛋白)、亲和体、anticalin(抗运载蛋白)、双环肽、DARPin(天然锚蛋白重复序列)、E7免疫蛋白、淋巴细胞受体可变区、单域抗体、全抗体、抗体片段、单链抗体以及核酸适配体等形式。
所述第一结构域Fab片段可以来源包括但不局限于抗CD3单克隆抗体。
优选地,步骤(1)所述第一结构域为抗CD3单克隆抗体;步骤(2)、步骤(3)所述第二结构域、第三结构域各自独立地具有针对选择Her2、CD19、ROR1、CD28抗原的结合特异性。
本发明所述连接肽选自柔性连接肽、刚性连接肽或螺旋卷曲连接肽的一种或多种;
所述柔性连接肽选自(G4S)3 Linker、218 Linker或212 Linker的一种或多种;
所述刚性连接肽选自PD Linker;
所述螺旋卷曲连接肽选自Coiled Coil Linker;
进一步地,所述步骤(2)可按照以下方式进行构建或连接:
(a)通过柔性连接肽(G4S)3 Linker将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域;或
(b)通过柔性连接肽(G4S)3 Linker将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端1E;或
(c)通过柔性连接肽(G4S)3 Linker将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将第三结构域串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域区域,从N端至C端依次形成结构为第三结构域—218Linker—第三结构域—PD Linker—重链可变区—重链恒定区—(G4S)3 Linker—第二结构域的重组重链;或
(d)通过柔性连接肽(G4S)3 Linker将第二结构域连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将第三结构域串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域区域,再次通过柔性连接肽212 Linker将第三结构域串联至CD3 Fab重链可变区(VH)结构域N端的第三结构域区域,从N端至C端依次形成结构为第三结构域—212 Linker—第三结构域—218 Linker—第三结构域—PD Linker—重链可变区—重链恒定区—(G4S)3 Linker—第二结构域的重组重链。
进一步地,所述步骤(3)可按照以下方式进行构建或连接:
(a)通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端1Q;或
(b)通过螺旋卷曲连接肽Coiled Coil Linker将第三结构域嵌合于CD3 Fab轻链恒定区(CL)结构域171S-173D之间,并缺失172K;或
(c)通过柔性连接肽(G4S)3 Linker将第三结构域连接于CD3 Fab轻链恒定区(CL)结构域C端217C;或
(d)通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将第三结构域串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域;或
(e)通过刚性连接肽PD Linker将第三结构域连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将第三结构域串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域,再通过柔性连接肽212linker第三结构域串联至CD3 Fab轻链可变区(VL)结构域N端的第三结构域区域从N端至C端依次形成结构为第三结构域—212linker—第三结构域—218 Linker—第三结构域—PD Linker—轻链可变区—轻链恒定区的重组轻链。
本发明第二个方面,公开了一种靶向免疫效应T细胞抗原CD3的介导T细胞重定位到肿瘤细胞的二聚体型三特异性抗体分子的构建方法。所述三特异性抗体的构建方法是以第一结构域——抗CD3单克隆抗体(克隆SP34)的Fab作为结构基础,第二结构域为针对Her2阳性靶点的纳米抗体(克隆2Rs15d)、针对CD19阳性靶点的scFv和针对ROR1阳性靶点的scFv,第三结构域为T细胞表面共刺激CD28分子的纳米抗体(克隆P2-6G),两者分别通过Linker连接至CD3 Fab片段。
构建方法以Her2靶点为例,包括以下步骤:
(1)以CD3单克隆抗体Fab为第一结构域;
(2)抗Her2-VHH或抗Her2-VHH/CD28-VHH连接于CD3 Fab结构的重链结构域。
(3)抗CD28-VHH连接于CD3 Fab结构的轻链不同部位或轻链结构域不作任何修饰。
(4)步骤(2)和步骤(3)所得重组重链和轻链通过CD3 Fab中CH1和CL中的二硫键结合形成异源二聚体,即抗Her2/CD3/CD28三特异性抗体。
在优选实施例中,所述步骤(2)可按照以下方式进行构建或连接:
(a)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域;或
(b)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端1E;或
(c)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3Fab重链可变区(VH)结构域N端的抗CD28-VHH区域;或
(d)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,再次通过柔性连接肽212 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,该重组重链从N端至C端依次形成抗CD28-VHH—212 Linker—抗CD28-VHH—218 Linker—抗CD28-VHH—PD Linker—CD3Fab重链可变区—CD3 Fab重链恒定区(CH1)—(G4S)3Linker—抗Her2-VHH的结构域。
在优选实施例中,所述步骤(3)可按照以下方式进行构建或连接:
(a)通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端1Q;或
(b)通过螺旋卷曲连接肽Coiled Coil Linker将抗CD28-VHH嵌合于CD3 Fab轻链恒定区(CL)结构域171S-173D之间,并缺失172K;或
(c)通过柔性连接肽(G4S)3 Linker将抗CD28-VHH连接于CD3 Fab轻链恒定区(CL)结构域C端217C;或
(d)通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域;或
(e)通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212linker抗CD28-VHH串联至CD3Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,该重组轻链从N端至C端依次形成抗CD28-VHH—212Linker—抗CD28-VHH—218 Linker—抗CD28-VHH—PD Linker—CD3 Fab轻链可变区—CD3Fab轻链恒定区的结构域。
在优选实施例中,步骤(4)所述Her2/CD3/CD28三特异性抗体是以抗CD3 Fab结构作为骨架,在步骤(2)的构建基础上,组合步骤(3)所示的构建方法进行构建,得到CD28单效价Her2/CD3/CD28三特异性抗体,具体如下所示:
(1)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,标记为Her2/CD3/CD28 LN;
(2)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过螺旋卷曲连接肽Coiled Coil Linker将抗CD28-VHH嵌合于CD3Fab轻链恒定区(CL)结构域171S-173D之间,并缺失172K,标记为Her2/CD3/CD28 LG;
(3)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过柔性连接肽(G4S)3 Linker将抗CD28-VHH连接于CD3 Fab轻链恒定区(CL)结构域C端,标记为Her2/CD3/CD28 LC;
在优选实施例中,步骤(4)所述Her2/CD3/CD28三特异性抗体是以抗CD3 Fab结构作为骨架,在步骤(2)的构建基础上,组合步骤(3)所示的构建方法进行构建,得到Her2/CD3/CD28双效价三特异性抗体,具体如下所示:
(4)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端以及CD3 Fab轻链可变区(VL)结构域N端,标记为Her2/CD3/CD28HLN;
(5)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,标记为Her2/CD3/CD28 LDN;
(6)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,标记为Her2/CD3/CD28 HDN;
在优选实施例中,步骤(4)所述Her2/CD3/CD28三特异性抗体是以抗CD3 Fab结构作为骨架,在步骤(2)的构建基础上,组合步骤(3)所示的构建方法进行构建,得到Her2/CD3/CD28三效价三特异性抗体,具体如下所示:
(7)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端,通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端;通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,标记为Her2/CD3/CD28 HNLDN;
(8)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端,通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域;通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,标记为Her2/CD3/CD28 HDNLN;
(9)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH结构域N端,标记为Her2/CD3/CD28 HTN;
(10)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VH)结构域N端的抗CD28-VHH结构域N端,标记为Her2/CD3/CD28 LTN;
在优选实施例中,步骤(4)所述Her2/CD3/CD28三特异性抗体是以抗CD3 Fab结构作为骨架,在步骤(2)的构建基础上,组合步骤(3)所示的构建方法进行构建,得到Her2/CD3/CD28四效价三特异性抗体,具体如下所示:
(11)通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端;通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,标记为Her2/CD3/CD28HDNLDN。
在优选实施例中,利用所述方法,基于结构优化设计构建了三特异性抗体,所述CD3-HC氨基酸序列如SEQ ID NO:1所示;CD3-LC氨基酸序列如SEQ ID NO:2所示;Her2-VHH序列如SEQ ID NO:3所示;CD28-VHH序列如SEQ ID NO:4所示。
在优选实施例中,所述连接肽氨基酸序列如表1所示:
表1
在优选实施例中,利用所述方法,基于结构优化设计构建了Her2/CD3/CD28三特异性抗体,所述的Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10-13所示的重链氨基酸序列,和如SEQ ID NO:2、14-18所示的轻链氨基酸序列。
更优选地,所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10所示的重链氨基酸序列,和如SEQ ID NO:14所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10所示的重链氨基酸序列,和如SEQ ID NO:15所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10所示的重链氨基酸序列,和如SEQ ID NO:16所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10所示的重链氨基酸序列,和如SEQ ID NO:17所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:10所示的重链氨基酸序列,和如SEQ ID NO:18所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:11所示的重链氨基酸序列,和如SEQ ID NO:14所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:11所示的重链氨基酸序列,和如SEQ ID NO:17所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:12所示的重链氨基酸序列,和如SEQ ID NO:2所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:12所示的重链氨基酸序列,和如SEQ ID NO:14所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:12所示的重链氨基酸序列,和如SEQ ID NO:17所示的轻链氨基酸序列;和/或
所述Her2/CD3/CD28三特异性抗体包含如SEQ ID NO:13所示的重链氨基酸序列,和如SEQ ID NO:2所示的轻链氨基酸序列。
本发明第三个方面,公开了一种CD19/CD3/CD28三特异性抗体分子的构建方法。
构建方法包括以下步骤:
(1)通过柔性连接肽(G4S)3 Linker将抗CD19 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,标记为CD19/CD3/CD28 LN;
(2)通过柔性连接肽(G4S)3 Linker将抗CD19 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,标记为CD19/CD3/CD28 LDN;
(3)通过柔性连接肽(G4S)3 Linker将抗CD19 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH结构域N端,标记为CD19/CD3/CD28 LTN。
在优选实施例中,利用所述方法,基于结构优化设计构建了三特异性抗体,所述CD3-HC氨基酸序列如SEQ ID NO:1所示;CD3-LC氨基酸序列如SEQ ID NO:2所示;CD19scFv氨基酸序列如SEQ ID NO:20所示;CD28-VHH氨基酸序列如SEQ ID NO:4所示。
在优选实施例中,所述(G4S)3 Linker氨基酸序列如SEQ ID NO:5所示;所述218Linker氨基酸序列如SEQ ID NO:6所示;所述212 Linker氨基酸序列如SEQ ID NO:7所示;所述PD Linker氨基酸序列如SEQ ID NO:8所示。
在优选实施例中,利用所述方法,基于结构优化设计构建了CD19/CD3/CD28三特异性抗体,所述CD19/CD3/CD28三特异性抗体包含如SEQ ID NO:22所示的重链氨基酸序列,和如SEQ ID NO:14、17-18所示的轻链氨基酸序列。
更优选地,所述CD19/CD3/CD28三特异性抗体包含如SEQ ID NO:22所示的重链氨基酸序列,和如SEQ ID NO:14所示的轻链氨基酸序列;和/或
所述CD19/CD3/CD28三特异性抗体包含如SEQ ID NO:22所示的重链氨基酸序列,和如SEQ ID NO:17所示的轻链氨基酸序列;和/或
所述CD19/CD3/CD28三特异性抗体包含如SEQ ID NO:22所示的重链氨基酸序列,和如SEQ ID NO:18所示的轻链氨基酸序列。
本发明第四个方面,公开了一种ROR1/CD3/CD28三特异性抗体分子的构建方法。
构建方法包括以下步骤:
(1)通过柔性连接肽(G4S)3 Linker将抗ROR1 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,标记为ROR1/CD3/CD28 LN;
(2)通过柔性连接肽(G4S)3 Linker将抗ROR1 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH结构域N端,标记为ROR1/CD3/CD28 LDN;
(3)通过柔性连接肽(G4S)3 Linker将抗ROR1 scFv连接于CD3 Fab重链恒定区(CH1)结构域C端;并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,以柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH结构域N端,标记为ROR1/CD3/CD28 LTN。
在优选实施例中,利用所述方法,基于结构优化设计构建了三特异性抗体,所述CD3-HC氨基酸序列如SEQ ID NO:1所示;CD3-LC氨基酸序列如SEQ ID NO:2所示;ROR1-scFv氨基酸序列如SEQ ID NO:21所示;CD28-VHH氨基酸序列如SEQ ID NO:4所示。
在优选实施例中,所述(G4S)3 Linker氨基酸序列如SEQ ID NO:5所示;所述218Linker氨基酸序列如SEQ ID NO:6所示;所述212 Linker氨基酸序列如SEQ ID NO:7所示;所述PD Linker氨基酸序列如SEQ ID NO:8所示。
在优选实施例中,利用所述方法,基于结构优化设计构建了ROR1/CD3/CD28三特异性抗体,所述ROR1/CD3/CD28三特异性抗体包含如SEQ ID NO:23所示的重链氨基酸序列,和如SEQ ID NO:14、17-18所示的轻链氨基酸序列。
更优选地,所述ROR1/CD3/CD28三特异性抗体包含如SEQ ID NO:23所示的重链氨基酸序列,和如SEQ ID NO:14所示的轻链氨基酸序列;和/或
所述ROR1/CD3/CD28三特异性抗体包含如SEQ ID NO:23所示的重链氨基酸序列,和如SEQ ID NO:17所示的轻链氨基酸序列;和/或
所述ROR1/CD3/CD28三特异性抗体包含如SEQ ID NO:23所示的重链氨基酸序列,和如SEQ ID NO:18所示的轻链氨基酸序列。
本发明的第五个方面,还提供了本发明制备所述三特异性抗体的方法。其包括:
(1)获得三特异性抗体的融合基因,构建三特异性抗体的表达载体;
(2)通过基因工程方法将上述表达载体转染至宿主细胞中;
(3)在允许产生所述三特异性抗体的条件下培养上述宿主细胞;
(4)分离纯化产生的所述抗体蛋白。
步骤(1)所述表达载体可以为真核细胞表达载体pFuse、pSeqtag、pCMV、pcDNA、pFastBac1、pPIC9K、pCAGGS等和原核表达载体pET、pGEX、pMAL、pQE、pTrc、pBV、pTXB,优选真核表达载体。
步骤(2)所述宿主细胞可以为大肠杆菌、苏云金芽孢杆菌、毕赤酵母、昆虫细胞、293悬浮细胞以及中国昆虫卵巢细胞,优选293悬浮细胞。
本发明的第六个方面,提供了所述抗体在制造用于治疗癌症的药物中的应用。所述癌症包括但不限于乳腺癌、结肠直肠癌、肛门癌、胰腺癌、胆囊癌、胆管癌、头颈癌、鼻咽癌、皮肤癌、黑素瘤、卵巢癌、前列腺癌、尿道癌、肺癌、非小细胞肺癌、小细胞肺癌、脑肿瘤、神经胶质瘤、成神经细胞瘤、食道癌、胃癌、肝癌、肾癌、膀胱癌、宫颈癌、子宫内膜癌、甲状腺癌、眼癌、肉瘤、骨癌、白血病、骨髓瘤或淋巴瘤。
在一个实施例中,可用于治疗表达Her2阳性肿瘤的用途。Her2/CD3/CD28三特异性抗体分子在体外能够显著杀伤Her2阳性肿瘤细胞,对Her2阴性细胞没有非特异性杀伤效果。同时体外的肿瘤杀伤效果也显著高于同类型的双特异性抗体及其组合。
在一个实施例中,可用于治疗表达CD19阳性肿瘤的用途。CD19/CD3/CD28三特异性抗体分子在体外能够有效杀伤CD19阳性肿瘤细胞,同时体外和体内的肿瘤杀伤效果也显著高于同类型的双特异性抗体。
在一个实施例中,可用于治疗表达ROR1阳性肿瘤的用途。ROR1/CD3/CD28三特异性抗体分子在体外能够有效杀伤ROR1阳性肿瘤细胞,同时体外的肿瘤杀伤效果也显著高于同类型的双特异性抗体。
本发明的第七个方面,提供了用于治疗肿瘤的方法,其包括以有效治疗所述肿瘤的用量,向有此需要的受试者施用本申请的三特异性抗体。
本发明的技术方案,取得了有益的技术效果:
1、将VHH或者scFv抗体分子通过不同连接肽Linker连接于Fab的不同位置有着不同的作用效果:在构建本发明中所述三特异性抗体时,将结构域之间的连接和功能区分需经过综合考虑。在Fab的N端添加结构域时,需要重视的是Fab结构域本身的靶向性,为了有效隔离两个不同结构域,本发明使用的是刚性连接肽Linker,保证了两端抗体的靶向性;在Fab的C端添加结构域时,需要重视的是添加的结构域能够正常表达,同时保证结构域的独立性,因此本发明使用的是柔性连接肽Linker;本发明中也提供了将结构域通过螺旋卷曲连接肽(Coiled Coil Linker)嵌合于轻/重链恒定区内的方法,更能有效保证3个结构域之间的独立性和靶向性。通过在Fab不同位置引入VHH或者scFv,可以有效调整靶向肿瘤细胞和T细胞之间的距离,从而调整形成有效免疫突触,避免免疫抑制信号对T细胞发挥活化杀伤效果的影响。基于此,我们发现了在CD3靶向Fab引入Her2、CD19、CD22和ROR1靶向抗体的最佳位点是Fab的C端,引入CD28靶向抗体的最佳位点是Fab的N端。
2、本发明所述三特异性抗体药物,实现了同时靶向T细胞和肿瘤细胞的靶点治疗,基于Fab和VHH结构基础的三特异性抗体,相比于带Fc区域的抗体表达纯化更加简便,在实体肿瘤微环境中穿透能力更强,基于Fab和VHH结构基础的三特异性抗体,相比于普通的单链抗体串联结构,其在体内的半衰期更长,更有利于减少给药次数及剂量。
3、通过文献总结和前期试验成果,成功选择靶向Her2、CD28、4-1BB、CD19、CD22、ROR1和CD3的抗体克隆,并且通过分子克隆技术在真核表达系统中分别进行了表达,经过体外验证,确认所选抗体均可以和目的抗原具有很好的结合特异性和亲和力。
4、选择了合适的表达系统并成功表达了不同结构的双特异性抗体,以抗CD3抗体片段Fab为基础支架,通过结构优化和活性比较,确认这些双特异性抗体能够表现出良好的结合稳定性以及介导T细胞免疫杀伤靶细胞效果。
5、通过结构优化和活性验证,明确三特异性抗体的优化分子结构,进一步通过真核表达体系获得结构稳定的蛋白,在体外展现出稳定的靶点结合特异性和亲和力,同时能够有效介导T细胞对靶细胞的杀伤,促进T细胞增殖和细胞因子释放以及维持线粒体的稳态和健康。相比于目前有疗效的双特异性抗体,所述三特异性抗体除了对Her2、CD19、CD22、ROR1等阳性肿瘤可以有效杀伤,还能够有效提高T细胞抗凋亡能力,具有有效防止肿瘤抗原免疫逃逸,增强对实体肿瘤微环境调控的协同免疫治疗效果。
6、选择了合适的表达系统并成功表达了不同结构的三特异性抗体,通过结构优化和活性比较,确认这些三特异性抗体能够表现出良好的结合稳定性和提高T细胞功能活性以及免疫杀伤靶细胞效果,这些有益效果依托于CD3靶向抗体的骨架基础对于T细胞的激活作用,说明了以CD3 Fab进行三特异性抗体设计具有独特的优势;此外,基于CD3靶向抗体作为骨架,对于引入多效价CD28的靶向活化抗体,以及引入不同肿瘤相关抗原靶向抗体的替换,具有较好的操作简便性和功能稳定性,该优势是以其他靶点抗体作为骨架进行此类三特异性抗体的优化设计所无法替代的。
附图说明
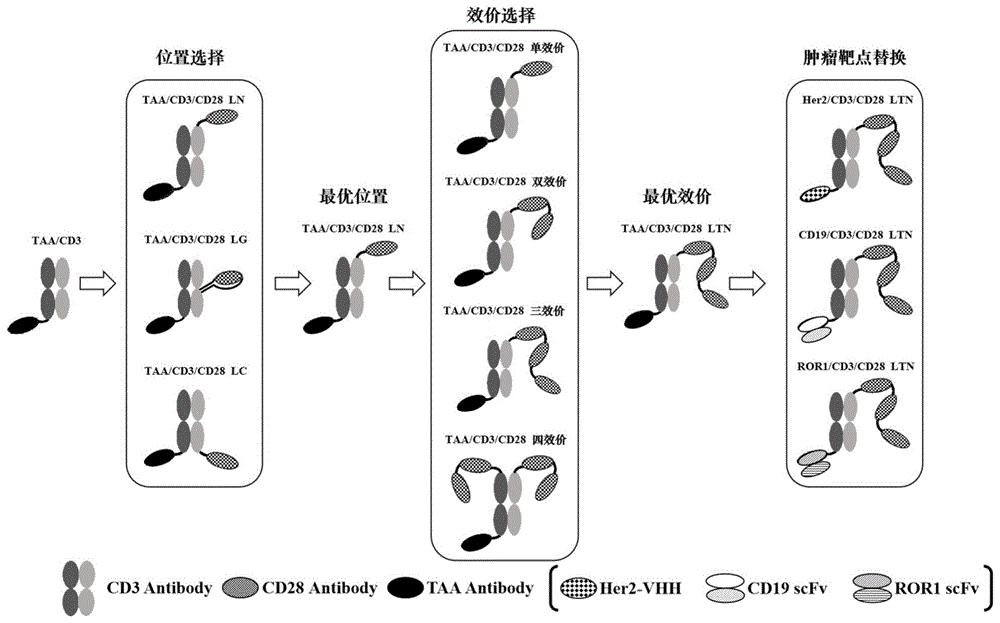
图1基于结构优化活性设计的靶向CD28三特异性抗体设计图;
图2基于结构优化活性设计的靶向CD28三特异性抗体结构示意图;
图3不同结构单效价Her2/CD3/CD28三特异性抗体与Her2抗原结合功能验证;
图4不同结构单效价Her2/CD3/CD28三特异性抗体与CD28抗原结合功能验证;
图5不同结构单效价Her2/CD3/CD28三特异性抗体与CD3抗原结合功能验证;
图6不同结构单效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育细胞因子释放能力验证;
图7不同结构单效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育对CD8
图8不同结构双效价Her2/CD3/CD28三特异性抗体与Her2抗原结合功能验证;
图9不同结构双效价Her2/CD3/CD28三特异性抗体与CD28抗原结合功能验证;
图10不同结构双效价Her2/CD3/CD28三特异性抗体与CD3抗原结合功能验证;
图11不同结构双效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育细胞因子释放能力验证;
图12不同结构双效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育后增强T细胞抗凋亡能力比较;
图13不同结构三效价与四效价Her2/CD3/CD28三特异性抗体与Her2抗原结合功能验证;
图14不同结构三效价与四效价Her2/CD3/CD28三特异性抗体与CD28抗原结合功能验证;
图15不同结构三效价与四效价Her2/CD3/CD28三特异性抗体与CD3抗原结合功能验证;图16不同结构三效价与四效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育细胞因子释放能力验证;
图17不同结构三效价与四效价Her2/CD3/CD28三特异性抗体对CD8
图18不同效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育细胞因子释放能力验证;
图19不同效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性HCC1954肿瘤细胞孵育后增强T细胞抗凋亡能力比较;
图20不同效价Her2/CD3/CD28三特异性抗体对CD8
图21不同效价Her2/CD3/CD28三特异性抗体对肿瘤细胞杀伤能力比较;
图22不同效价Her2/CD3/CD28三特异性抗体对促进PBMC增殖能力比较;
图23Her2/CD3/CD28 LTN与SAR443216在PBMC与Her2阳性HCC1954肿瘤细胞孵育细胞因子释放能力比较;
图24Her2/CD3/CD28 LTN与SAR443216在PBMC与Her2阳性HCC1954肿瘤细胞孵育对CD8
图25Her2/CD3/CD28 LTN与SAR443216在PBMC与Her2阳性HCC1954肿瘤细胞孵育后增强T细胞抗凋亡能力比较;
图26最优结构Her2/CD3/CD28 LTN与SAR443216对肿瘤细胞杀伤能力比较;
图27不同效价CD19/CD3/CD28三特异性抗体与K562-CD19细胞结合功能验证;
图28不同效价CD19/CD3/CD28三特异性抗体与CD28抗原结合功能验证;
图29不同效价CD19/CD3/CD28三特异性抗体与CD3抗原的结合功能验证;
图30不同效价CD19/CD3/CD28三特异性抗体在PBMC与CD19阳性肿瘤细胞孵育细胞因子释放能力验证;
图31不同效价CD19/CD3/CD28三特异性抗体在PBMC与CD19阳性肿瘤细胞孵育对CD8
图32不同效价CD19/CD3/CD28三特异性抗体在PBMC与CD19阳性肿瘤细胞孵育后增强T细胞抗凋亡能力比较;
图33不同效价CD19/CD3/CD28三特异性抗体对肿瘤细胞杀伤能力比较;
图34 CD19/CD3/CD28 LTN三特异性抗体在Nalm6负荷小鼠的体内抗肿瘤效果活体成像图;
图35 CD19/CD3/CD28 LTN三特异性抗体在Nalm6负荷小鼠的体内抗肿瘤效果平均荧光强度统计;
图36不同效价ROR1/CD3/CD28三特异性抗体与ROR1抗原结合功能验证;
图37不同效价ROR1/CD3/CD28三特异性抗体与CD28抗原结合功能验证;
图38不同效价ROR1/CD3/CD28三特异性抗体与CD3抗原结合功能验证;
图39不同效价ROR1/CD3/CD28三特异性抗体在PBMC与ROR1阳性肿瘤细胞孵育细胞因子释放能力验证;
图40不同效价ROR1/CD3/CD28三特异性抗体在PBMC与ROR1阳性肿瘤细胞孵育对CD8
图41不同效价ROR1/CD3/CD28三特异性抗体在PBMC与ROR1阳性肿瘤细胞孵育后增强T细胞抗凋亡能力比较;
图42不同效价ROR1/CD3/CD28三特异性抗体对肿瘤细胞杀伤能力比较。
具体实施方式
下面结合实施例对本发明做进一步的解释与说明,应当理解为以下实施例仅用于说明本发明,不用来限制本发明的保护范围。
以下各实施例中,实验所用材料均可购买,也可参照现有公开的技术制备;未标明来源和规格的均为市售可得;未详细描述的各种过程和方法是本领域中公知的常规方法。
实施例1双/三特异性抗体的构建和真核表达
1.1载体构建
CD3-HC-Her2-VHH、CD3-HC-CD19-scFv、CD3-HC-ROR1-scFv与CD3-LC表达载体的构建:
Her2/CD3双特异性抗体、CD19/CD3双特异性抗体和ROR1/CD3双特异性抗体的重链由CD3-HC和Her2-VHH、CD19 scFv、ROR1 scFv分别按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将Her2-VHH、CD19 scFv、ROR1 scFv分别连接于CD3-HC恒定区(CH1)结构域C端;轻链CD3-LC不做任何修饰。按常规分子生物学方法分别合成上述CD3-HC-Her2-VHH、CD3-HC-CD19 scFv、CD3-HC-ROR1 scFv以及CD3-LC的编码基因,并将获得的合成基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据连接方式,表达的双特异性抗体分别标记为Her2/CD3、CD19/CD3、ROR1/CD3。除通过本实验选择的(G4S)3 Linker连接于在CD3-HC,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。
相关序列如表2所示:
表2
CD28单效价Her2/CD3/CD28三特异性抗体表达载体的构建:
Her2/CD3/CD28三特异性抗体的重链由CD3-HC和Her2-VHH按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将Her2-VHH连接于CD3-HC恒定区(CH1)结构域C端;Her2/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将CD28-VHH连接于CD3-LC可变区(VL)结构域N端;或者通过螺旋卷曲连接肽Coiled Coil Linker将CD28-VHH嵌合于CD3-LC恒定区(CL)结构域171S-173D之间,并且缺失172K;或者通过柔性连接肽(G4S)3 Linker将CD28-VHH连接于CD3-LC恒定区(CL)结构域C端。并将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据Her2/CD3/CD28三特异性抗体轻链的连接方式,即CD3-LC和CD28-VHH的连接方式,将表达的CD28单效价Her2/CD3/CD28三特异性抗体分别标记为Her2/CD3/CD28 LN、Her2/CD3/CD28 LG、Her2/CD3/CD28 LC。其中Her2-VHH、CD28-VHH除通过本实验选择的PDLinker、(G4S)3 Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表3所示:
表3
CD28双效价Her2/CD3/CD28三特异性抗体表达载体的构建:
双效价Her2/CD3/CD28三特异性抗体的重链与轻链由CD3-HC、CD28-VHH和Her2-VHH按照以下方式进行连接:(1)重链为通过柔性连接肽(G4S)3 Linker将Her2-VHH连接于CD3-HC恒定区(CH1)结构域C端228C区域;轻链为通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域;(2)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端;轻链为通过刚性连接肽PD Linker将CD28-VHH连接于CD3-LC可变区(VL)结构域N端;(3)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域;轻链CD3-LC不做任何修饰。
并将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据Her2/CD3/CD28三特异性抗体轻重链的组合方式,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将后期表达的三特异性抗体标记为双效价Her2/CD3/CD28,分别为Her2/CD3/CD28 LDN、Her2/CD3/CD28 HLN、Her2/CD3/CD28 HDN;其中Her2-VHH、CD28-VHH除通过本实验选择的(G4S)3 Linker、PD Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表4所示:
表4
CD28三效价和四效价Her2/CD3/CD28三特异性抗体表达载体的构建:
三效价和四效价Her2/CD3/CD28三特异性抗体的重链与轻链由CD3-HC、CD28-VHH和Her2-VHH按照以下方式进行连接:(1)重链为通过柔性连接肽(G4S)3 Linker将Her2-VHH连接于CD3-HC恒定区(CH1)结构域C端228C区域;轻链为通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH区域,再通过柔性连接肽212 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH结构域N端;(2)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端;轻链为通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH区域;(3)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PDLinker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域;轻链为通过刚性连接肽PD Linker将CD28-VHH连接于CD3-LC可变区(VL)结构域N端;(4)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3Fab重链可变区(VH)结构域N端,通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域,再通过柔性连接肽212 Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH结构域N端;轻链CD3-LC不做任何修饰;(5)重链为通过柔性连接肽(G4S)3 Linker将抗Her2-VHH连接于CD3 Fab重链恒定区(CH1)结构域C端228C区域,并通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab重链可变区(VH)结构域N端,再通过柔性连接肽218Linker将抗CD28-VHH串联至CD3 Fab重链可变区(VH)结构域N端的抗CD28-VHH区域;轻链为通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH区域。
将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据以上Her2/CD3/CD28三特异性抗体轻重链的组合方式编号顺序,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将(1)-(4)表达的三特异性抗体标记为三效价Her2/CD3/CD28,依次命名为Her2/CD3/CD28 LTN、Her2/CD3/CD28 HNLDN、Her2/CD3/CD28 HDNLN、Her2/CD3/CD28 HTN,将(5)表达的三特异抗体标记为四效价Her2/CD3/CD28,命名为Her2/CD3/CD28HDNLDN;其中Her2-VHH、CD28-VHH除通过本实验选择的(G4S)3 Linker、PD Linker和CoiledCoil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表5所示:
表5
CD28单效价CD19/CD3/CD28三特异性抗体表达载体的构建:
单效价CD19/CD3/CD28三特异性抗体的重链由CD3-HC和CD19 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将CD19 scFv连接于CD3-HC恒定区(CH1)结构域C端;CD19/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将CD28-VHH连接于CD3-LC可变区(VL)结构域N端。并将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据CD19/CD3/CD28三特异性抗体轻链的连接方式,即CD3-LC和CD28-VHH的连接方式,将表达的CD28单效价CD19/CD3/CD28三特异性抗体标记为CD19/CD3/CD28 LN。其中CD19 scFv、CD28-VHH除通过本实验选择的PD Linker、(G4S)3 Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表6所示:
表6
CD28双效价CD19/CD3/CD28三特异性抗体表达载体的构建:
双效价CD19/CD3/CD28三特异性抗体的重链由CD3-HC和CD19 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将CD19 scFv连接于CD3-HC恒定区(CH1)结构域C端;双效价CD19/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域。将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据CD19/CD3/CD28三特异性抗体轻重链的组合方式,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将后期表达的三特异性抗体标记为双效价CD19/CD3/CD28 LDN;其中CD19scFv、CD28-VHH除通过本实验选择的(G4S)3 Linker、PD Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表7所示:
表7
CD28三效价CD19/CD3/CD28三特异性抗体表达载体的构建:
三效价CD19/CD3/CD28三特异性抗体的重链由CD3-HC和CD19 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将CD19 scFv连接于CD3-HC恒定区(CH1)结构域C端;三效价CD19/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH区域,再通过柔性连接肽212 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH结构域N端。将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据CD19/CD3/CD28三特异性抗体轻重链的组合方式,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将表达的三特异性抗体标记为三效价CD19/CD3/CD28,为CD19/CD3/CD28 LTN;其中CD19 scFv、CD28-VHH除通过本实验选择的(G4S)3 Linker、PDLinker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表8所示:
表8
/>
CD28单效价ROR1/CD3/CD28三特异性抗体表达载体的构建:
单效价ROR1/CD3/CD28三特异性抗体的重链由CD3-HC和ROR1 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将ROR1 scFv连接于CD3-HC恒定区(CH1)结构域C端;ROR1/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将CD28-VHH连接于CD3-LC可变区(VL)结构域N端。并将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据ROR1/CD3/CD28三特异性抗体轻链的连接方式,即CD3-LC和CD28-VHH的连接方式,将表达的CD28单效价ROR1/CD3/CD28三特异性抗体标记为ROR1/CD3/CD28LN。其中ROR1 scFv、CD28-VHH除通过本实验选择的PD Linker、(G4S)3 Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表9所示:
表9
CD28双效价ROR1/CD3/CD28三特异性抗体表达载体的构建:
双效价ROR1/CD3/CD28三特异性抗体的重链由CD3-HC和ROR1 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将ROR1 scFv连接于CD3-HC恒定区(CH1)结构域C端;双效价ROR1/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,再通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的抗CD28-VHH区域。将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据ROR1/CD3/CD28三特异性抗体轻重链的组合方式,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将后期表达的三特异性抗体标记为双效价ROR1/CD3/CD28 LDN;其中ROR1scFv、CD28-VHH除通过本实验选择的(G4S)3 Linker、PD Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表10所示:
表10
CD28三效价ROR1/CD3/CD28表达载体的构建:
三效价ROR1/CD3/CD28三特异性抗体的重链由CD3-HC和ROR1 scFv按照以下方式进行连接:通过柔性连接肽(G4S)3 Linker将ROR1 scFv连接于CD3-HC恒定区(CH1)结构域C端;三效价ROR1/CD3/CD28三特异性抗体的轻链由CD3-LC和CD28-VHH按照以下方式进行连接:通过刚性连接肽PD Linker将抗CD28-VHH连接于CD3 Fab轻链可变区(VL)结构域N端,通过柔性连接肽218 Linker将抗CD28-VHH串联至CD3 Fab轻链可变区(VL)结构域N端的CD28-VHH区域,再通过柔性连接肽212 Linker将抗CD28-VHH串联至抗CD28-VHH结构域N端。将获得的基因通过同源重组方法插入到具有Amp抗性的pCAGGS真核表达载体上。根据ROR1/CD3/CD28三特异性抗体轻重链的组合方式,即CD3-LC和CD3-HC,以及CD28-VHH的连接方式,将表达的三特异性抗体标记为三效价ROR1/CD3/CD28,为ROR1/CD3/CD28 LTN;其中ROR1 scFv、CD28-VHH除通过本实验选择的(G4S)3 Linker、PD Linker和Coiled Coil Linker连接于CD3-HC或者CD3-LC外,也可以采用本领域技术人员公知的连接肽Linker进行替换连接。相关序列如表11所示:
表11
本发明基于结构优化活性设计的三特异性抗体结构设计图如图1所示,三特异性抗体示意图如图2所示。
1.2蛋白的真核表达
接种1.5×10
实施例2三特异性抗体的纯化
2.1Protein G亲和纯化
取上述实施例1中1.2的细胞上清液400mL,15000rpm,4℃离心30min,收取上清液,0.45μm滤膜过滤,置于冰上备用。取4mL Protein G(20%乙醇/Protein G 1:1)于层析柱内,用Binding buffer冲洗3次后,使用垫片压住resin表面。用20mL Binding buffer平衡Protein G柱。每10mL上样一次,使样品匀速(约0.5mL/min)通过Protein G柱。40mLBinding buffer匀速(约1mL/min)清洗Protein G柱。首先在洗脱管收集管中加入10%洗脱液体积的中和缓冲液,柱中加入Elution buffer,5mL洗脱一次,直到无法定量蛋白浓度,定量所有蛋白浓度。
实施例3Her2/CD3/CD28三特异性抗体生物学功能评价
3.1单效价Her2/CD3/CD28三特异性抗体抗原结合验证
将Her2 ECD-Fc、CD28 ECD-Fc、CD3 ECD-Fc抗原用PBS稀释至10μg/mL包被于96孔ELISA板中,100μL/孔,4℃包被过夜。弃去板中液体,PBST洗板2次后加入5%脱脂奶的PBST溶液200μL/孔,室温封闭2h,将孔内封闭液排干。将待测抗体用封闭液10倍稀释6个梯度,起始抗体浓度为200nM,每个浓度梯度3个复孔,100μL/孔加入孔板内,室温孵育2h。用PBST洗板3次后排干,将HRP标记的抗kappa链抗体用5%脱脂奶的PBST进行1:5000稀释后加入孔板内,100μL/孔,室温孵育1h。用PBST洗板3次后排干,每孔加入TMB显色液100μL,室温避光显色10min,然后每孔加入50μL 2M H
结果如表12和图3所示,通过对EC50的比较发现,不同结构Her2/CD3/CD28抗体保留了其对Her2抗原的结合亲和力和特异性。
如表13和图4所示,通过对EC50的比较发现,不同结构Her2/CD3/CD28三特异性抗体对CD28有着高亲和力与特异性。
如表14和图5所示,通过对EC50的比较发现,Her2/CD3/CD28三特异性抗体与CD3抗原的结合能力无明显差异,Her2/CD3/CD28三特异性抗体保留了其对CD3抗原的结合亲和力和特异性。
表12单效价Her2/CD3/CD28三特异性抗体对Her2抗原结合能力
表13单效价Her2/CD3/CD28三特异性抗体对CD28抗原结合能力
表14单效价Her2/CD3/CD28三特异性抗体对CD3抗原结合能力
3.2单效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性肿瘤细胞孵育细胞因子释放能力验证
从液氮中解冻PBMC,调整细胞密度为(1million/mL),消化HCC1954肿瘤细胞,调整密度为(0.2million/mL),等体积混合后将1mL/孔铺回24孔板中,按1nM浓度加入不同结构的Her2/CD3/CD28三特异性抗体,24小时后收集上清。
采用IL-2,IFN-γ和TNF-αELISA检测试剂盒用于细胞因子的检测,具体如下:将Capture Antibody包被酶标板,室温放置4h或者4℃过夜;使用Wash Buffer清洗3次后,采用ELISA/ELISAPOT Diluent(1×)对酶标板进行室温2h或4℃封闭过夜。配制并且加入IL-2,IFN-γ和TNF-α标准品,同时对细胞上清液进行稀释并加入酶标板,37℃反应2小时后,用Wash Buffer清洗板5次。稀释并加入Detection Antibody溶液,室温孵育1-2h;继续采用Wash Buffer清洗板5次,并加入Streptavidin-HRP溶液,室温30min-1h后,洗板5次。加入1×TMD溶液显色,并采用Stop Solution终止反应,使用酶标仪分别检测450nm波长处吸光度。
结果如图6(图6A、图6B、图6C)所示,与Her2/CD3双特异性抗体相比,三特异性抗体Her2/CD3/CD28对Her2阳性细胞HCC1954(Her2 3+)共孵育的T细胞具有更高的细胞因子释放水平。其中,单效价Her2/CD3/CD28 LN结构具有更高的细胞因子释放水平,进一步证明Her2/CD3/CD28 LN具有更强的T细胞活化能力。
3.3单效价Her2/CD3/CD28三特异性抗体对CD8
具体实施步骤同3.2,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti humanCD4;Pacific blue anti-human CD8;APC anti-human CD69;FITC anti-human CD25染色,通过流式细胞仪分析CD8
活化结果如图7(图7A、图7B)所示,相比于Her2/CD3双特异性抗体,不同结构Her2/CD3/CD28三特异性抗体均有明显的对于CD8
3.4双效价Her2/CD3/CD28三特异性抗体抗原结合验证
步骤同3.1,结果如表15和图8所示,通过对EC50的比较发现,不同结构的Her2/CD3/CD28与Her2抗原的结合能力无明显差异,Her2/CD3/CD28抗体保留了其对Her2抗原的结合亲和力和特异性。
如表16和图9所示,通过对EC50的比较发现,不同结构Her2/CD3/CD28三特异性抗体对CD28有着高亲和力与特异性。
如表17和图10所示,通过对EC50的比较发现,Her2/CD3/CD28三特异性抗体与CD3抗原的结合能力无明显差异,说明Her2/CD3/CD28保留了其对CD3抗原的结合亲和力和特异性。
表15双效价Her2/CD3/CD28三特异性抗体对Her2抗原结合能力
表16双效价Her2/CD3/CD28三特异性抗体对CD28抗原结合能力
表17双效价Her2/CD3/CD28三特异性抗体对CD3抗原结合能力
3.5双效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性肿瘤细胞孵育细胞因子释放能力验证
具体实施步骤同3.2,样品浓度100pM,结果如图11(图11A、图11B)所示,与Her2/CD3双特异性抗体相比,三特异性抗体Her2/CD3/CD28对Her2阳性细胞HCC1954(Her2 3+)共孵育的T细胞具有更高的促进细胞因子释放能力。其中,双效价Her2/CD3/CD28 LDN结构具有更高的细胞因子释放水平,进一步证明Her2/CD3/CD28 LDN具有更强的T细胞活化能力。
3.6双效价Her2/CD3/CD28三特异性抗体对增强T细胞抗凋亡能力比较
具体实施步骤同3.2,样品浓度100pM,24小时后离心收集细胞,流式抗体PerCPcy5.5-anti human CD4;Pacific blue anti-human CD8冰上染色1h,固定液室温30min,渗透液配置3μg/mL FITC anti-human BCL-xL重悬细胞室温静置30min,FACS洗一遍,通过流式细胞仪分析BCL-xL
结果如图12(图12A、图12B)所示,相比于Her2/CD3双特异性抗体,不同结构Her2/CD3/CD28三特异性抗体均有明显的T细胞抗凋亡能力增强效果,其中,双效价中Her2/CD3/CD28 LDN具有较好的增强CD4
3.7三效价与四效价Her2/CD3/CD28三特异性抗体抗原结合验证
步骤同3.1,结果如表18和图13所示,通过对EC50的比较发现,不同结构的Her2/CD3/CD28抗体保留了其对Her2抗原的结合亲和力和特异性。
如表19和图14所示,通过对EC50的比较发现,不同结构Her2/CD3/CD28三特异性抗体对CD28有着高亲和力与特异性。
如表20和图15所示,通过对EC50的比较发现,不同结构Her2/CD3/CD28保留了其对CD3抗原的结合亲和力和特异性。
表18三效价与四效价Her2/CD3/CD28三特异性抗体对Her2抗原结合能力
表19三效价与四效价Her2/CD3/CD28三特异性抗体对CD28抗原结合能力
表20三效价与四效价Her2/CD3/CD28三特异性抗体对CD3抗原结合能力
3.8三效价与四效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性肿瘤细胞孵育细胞因子释放能力验证
具体实施步骤同3.2,样品浓度10pM,结果如图16(图16A、图16B、图16C)所示,不同结构三特异性抗体Her2/CD3/CD28对Her2阳性细胞HCC1954(Her2 3+)共孵育的T细胞具有更高的细胞因子释放能力。其中,三效价Her2/CD3/CD28 LTN结构具有更高的细胞因子释放水平,进一步证明Her2/CD3/CD28 LTN具有更强的T细胞活化能力。
3.9三效价与四效价Her2/CD3/CD28三特异性抗体对CD8
具体实施步骤同3.2,样品浓度10pM,结果如图17(图17A、图17B)所示,不同结构Her2/CD3/CD28三特异性抗体具有明显的对于CD8
3.10不同效价Her2/CD3/CD28三特异性抗体在PBMC与Her2阳性肿瘤细胞孵育细胞因子释放能力验证
具体实施步骤同3.2,样品浓度10pM,结果如图18(图18A、图18B、图18C)所示,与Her2/CD3双特异性抗体相比,三特异性抗体Her2/CD3/CD28对Her2阳性细胞HCC1954(Her23+)共孵育的T细胞具有更高的细胞因子释放能力。其中,三效价Her2/CD3/CD28LTN结构具有最高释放水平和显著性优势,进一步证明Her2/CD3/CD28 LTN具有更强的T细胞活化能力。
3.11不同效价Her2/CD3/CD28三特异性抗体对增强T细胞抗凋亡能力比较
具体实施步骤同3.2,样品浓度10pM,24小时后离心收集细胞,流式抗体PerCPcy5.5-anti human CD4;Pacific blue anti-human CD8冰上染色1h,固定液室温30min,渗透液配置3μg/mL FITC anti-human BCL-xL重悬细胞室温静置30min,FACS洗一遍,通过流式细胞仪分析BCL-xL
结果如图19(图19A、图19B)所示,相比于Her2/CD3双特异性抗体,不同效价Her2/CD3/CD28三特异性抗体均有明显的T细胞抗凋亡能力增强效果,其中,三效价中Her2/CD3/CD28 LTN具有较好的增强CD4
3.12不同效价Her2/CD3/CD28三特异性抗体对CD8
具体实施步骤同3.2,样品浓度10pM,结果如图20(图20A、图20B)所示,相比于Her2/CD3双特异性抗体,不同结构Her2/CD3/CD28三特异性抗体具有明显的对于CD8
3.13不同效价Her2/CD3/CD28三特异性抗体体外肿瘤杀伤活性
将PBMC细胞从液氮中取出,放入37℃水浴中快速解冻;使用RPMI 1640培养基稀释解冻细胞(培养基:细胞>10:1);离心1000rpm 5min,去上清液,培养基重悬PBMC细胞;重复上述离心一次;细胞计数,调整PBMC细胞密度;消化肿瘤细胞调整密度,使用CFSE标记K562-Her2,调整PBMC与K562-Her2效靶比为5:1和2:1,并配置K562-Her2与等体积培养基混合阳性对照组。在U型板中配置200μL 100nM抗体,10倍稀释6个浓度梯度,10μL/孔转移至96孔板后将调好密度的PBMC与肿瘤细胞100μL/孔加入,K562-Her2与等体积培养基混合作为阳性对照组孵育100μL/孔,孵育24h,检测活细胞数量。通过7AAD阴性细胞中CFSE阳性细胞的数量与阴性组对照计算肿瘤细胞杀伤百分比。
结果如图21所示,通过对杀伤百分比的比较发现,与Her2/CD3双特异性抗体相比,三特异性抗体Her2/CD3/CD28对Her2阳性细胞K562-Her2具有较好的细胞毒性,特别是三效价Her2/CD3/CD28 LTN具有较高的Her2阳性细胞杀伤能力,展现了更强的肿瘤抑制效果;因此可以比较出不同效价之间肿瘤细胞毒性较高的优势结构。
3.14不同效价Her2/CD3/CD28三特异性抗体促进PBMC增殖能力比较
使用含(Ca
实施例4Her2/CD3/CD28 LTN与SAR443216能力比较
SAR443216是赛诺菲在研的一款HER2/CD3/CD28三特异性T细胞接合剂,正在海外开展1期临床研究,它有望为HER2表达的实体瘤(包括HER2低表达实体瘤)患者提供一种新的治疗方法。
4.1Her2/CD3/CD28 LTN与SAR443216在PBMC与Her2阳性肿瘤细胞孵育细胞因子释放能力比较
具体实施步骤同3.2,样品浓度100pM,PBMC与HCC1954效靶比为5:1和3:1,结果如图23(图23A、图23B、图23C)所示,与SAR443216相比,Her2/CD3/CD28 LTN对Her2阳性细胞HCC1954(Her2 3+)共孵育的T细胞具有更高的促进细胞因子释放能力。并且,三效价Her2/CD3/CD28 LTN具有最高释放水平和显著性优势,进一步证明与现有技术相比,Her2/CD3/CD28 LTN具有更强的T细胞活化能力。
4.2Her2/CD3/CD28 LTN与SAR443216对CD8
具体实施步骤同3.2,样品浓度100pM,PBMC与HCC1954效靶比为5:1、3:1和1:1,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti human CD4;Pacific blue anti-humanCD8;APC anti-human CD69;FITC anti-human CD25染色,通过流式细胞仪分析CD8
活化结果如图24(图24A、图24B)所示,相比于SAR443216,Her2/CD3/CD28 LTN三特异性抗体具有明显的对于CD8
4.3Her2/CD3/CD28 LTN与SAR443216对增强T细胞抗凋亡能力比较
具体实施步骤同3.2,样品浓度100pM,PBMC与HCC1954效靶比为5:1、3:1和1:1,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti human CD4;Pacific blue anti-humanCD8冰上染色1h,固定液室温30min,渗透液配置3μg/mL FITC anti-human BCL-xL重悬细胞室温静置30min,FACS洗一遍,通过流式细胞仪分析BCL-xL
结果如图25(图25A、图25B)所示,相比于SAR443216,Her2/CD3/CD28 LTN三特异性抗体具有明显的CD8
4.4Her2/CD3/CD28 LTN与SAR443216体外肿瘤杀伤活性比较
具体实施步骤同3.13,结果如图26所示,通过对杀伤百分比的比较发现,相比于SAR443216,Her2/CD3/CD28 LTN三特异性抗体对Her2阳性细胞K562-Her2具有较好的细胞毒性和较高的Her2阳性细胞杀伤能力,展现了更强的肿瘤抑制效果;并且证明与现有技术相比,Her2/CD3/CD28 LTN对肿瘤细胞杀伤能力具有显著性优势。
实施例5CD19/CD3/CD28三特异性抗体生物学功能评价
5.1不同效价CD19/CD3/CD28三特异性抗体对K562-CD19细胞结合验证
将K562-CD19计数调整密度至则浓度调为3million/mL,每孔100μL细胞加入96孔U型孔板;托盘离心2000rpm 5min,吸走上清,将抗体梯度稀释:在EP管中配置200nM的初始浓度,五倍梯度稀释7次,配置好后均分到U型孔中,各取100μL重悬上述细胞,冰上孵育1h,托盘离心2000rpm 5min吸上清,用FACS洗两次。用稀释好的Goat anti-human kappa-AF467100μL/孔,吹打重悬细胞置于冰上避光孵育1h。托盘离心2000rpm 5min加入200μL FACS重悬细胞,清洗掉多余的游离抗体,再用200μL FACS缓冲液重悬进行流式检测结合百分率。
结果如表21和图27所示,通过对EC50的比较发现,不同结构的CD19/CD3/CD28与CD19/CD3双特异性抗体相比,都具有与K562-CD19细胞的高度结合能力,说明CD19/CD3/CD28抗体保留了其对CD19抗原的结合亲和力和特异性。
表21不同效价CD19/CD3/CD28三特异性抗体对K562-CD19细胞结合能力
5.2不同效价CD19/CD3/CD28三特异性抗体抗原结合验证
将CD28 ECD-Fc、CD3 ECD-Fc抗原用PBS稀释至10μg/mL包被于96孔ELISA板中,100μL/孔,4℃包被过夜。弃去板中液体,PBST洗板2次后加入5%脱脂奶的PBST溶液200μL/孔,室温封闭2h,将孔内封闭液排干。将待测抗体用封闭液10倍稀释6个梯度,起始抗体浓度为200nM,每个浓度梯度3个复孔,100μL/孔加入孔板内,室温孵育2h。用PBST洗板3次后排干,将HRP标记的抗kappa链抗体用5%脱脂奶的PBST进行1:5000稀释后加入孔板内,100μL/孔,室温孵育1h。用PBST洗板3次后排干,每孔加入TMB显色液100μL,室温避光显色10min,然后每孔加入50μL 2M H
如表22和图28所示,通过对EC50的比较发现,不同结构CD19/CD3/CD28三特异性抗体对CD28有着高亲和力与特异性。
如表23和图29所示,通过对EC50的比较发现,CD19/CD3/CD28三特异性抗体与CD19/CD3双特异性抗体相比,与CD3抗原的结合能力有所提高,说明CD19/CD3/CD28三特异性抗体保留了其对CD3抗原的结合亲和力和特异性。
表22不同效价CD19/CD3/CD28三特异性抗体对CD28抗原结合能力
表23不同效价CD19/CD3/CD28三特异性抗体对CD3抗原结合能力
5.3不同效价CD19/CD3/CD28三特异性抗体在PBMC与CD19阳性肿瘤细胞孵育细胞因子释放能力验证
从液氮中解冻PBMC,调整细胞密度为(1million/mL),取K562-CD19肿瘤细胞,调整密度为(0.2million/mL),等体积混合后将1mL/孔铺回24孔板中,按100pM浓度加入不同效价的CD19/CD3/CD28三特异性抗体与CD19/CD3双特异性抗体,24小时后收集上清。
采用IL-2,IFN-γ和TNF-αELISA检测试剂盒用于细胞因子的检测,具体如下:将Capture Antibody包被酶标板,室温放置4h或者4℃过夜;使用Wash Buffer清洗3次后,采用ELISA/ELISAPOT Diluent(1×)对酶标板进行室温2h或4℃封闭过夜。配制并且加入IL-2,IFN-γ和TNF-α标准品,同时对细胞上清液进行稀释并加入酶标板,37℃反应2小时后,用Wash Buffer清洗板5次。稀释并加入Detection Antibody溶液,室温孵育1-2h;继续采用Wash Buffer清洗板5次,并加入Streptavidin-HRP溶液,室温30min-1h后,洗板5次。加入1×TMD溶液显色,并采用Stop Solution终止反应,使用酶标仪分别检测450nm波长处吸光度。
结果如图30(图30A、图30B、图30C)所示,与CD19/CD3双特异性抗体相比,三特异性抗体CD19/CD3/CD28对CD19阳性细胞K562-CD19共孵育的PBMC具有更高的细胞因子释放水平。其中,三效价CD19/CD3/CD28 LTN结构具有最高释放水平和显著性优势,进一步证明CD19/CD3/CD28 LTN具有更强的T细胞活化能力。
5.4不同效价CD19/CD3/CD28三特异性抗体对CD8
具体实施步骤同5.3,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti humanCD4;Pacific blue anti-human CD8;APC anti-human CD69;FITC anti-human CD25染色,通过流式细胞仪分析CD8
活化结果如图31(图31A、图31B)所示,相比于CD19/CD3双特异性抗体,不同结构CD19/CD3/CD28三特异性抗体均有明显的对于CD8
5.5不同效价CD19/CD3/CD28三特异性抗体对增强T细胞抗凋亡能力比较
具体实施步骤同5.3,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti humanCD4;Pacific blue anti-human CD8冰上染色1h,固定液室温30min,渗透液配置3μg/mLFITC anti-human BCL-xL重悬细胞室温静置30min,FACS洗一遍,通过流式细胞仪分析BCL-xL
结果如图32(图32A、图32B)所示,相比于CD19/CD3双特异性抗体,不同结构CD19/CD3/CD28三特异性抗体均有明显的T细胞抗凋亡能力增强效果,其中,CD19/CD3/CD28 LTN具有较好的增强CD4
5.6不同效价CD19/CD3/CD28三特异性抗体体外肿瘤杀伤活性
收T细胞,离心1000rpm 5min,去上清液,培养基重悬PBMC细胞;重复上述离心一次;细胞计数,调整T细胞密度;消化肿瘤细胞调整密度,使用CFSE标记K562-CD19,调整T细胞与K562-CD19效靶比为3:1和1:2,并配置K562-CD19与等体积培养基混合阳性对照组。在U型板中配置200μL 100nM抗体,10倍稀释6个浓度梯度,10μL/孔转移至96孔板后将调好密度的T细胞与肿瘤细胞100μL/孔加入,K562-CD19与等体积培养基混合作为阳性对照组孵育100μL/孔,孵育24h,检测活细胞数量。通过7AAD阴性细胞中CFSE阳性细胞的数量与阴性组对照计算肿瘤细胞杀伤百分比。
结果如图33所示,通过对杀伤百分比的比较发现,与CD19/CD3双特异性抗体相比,三特异性抗体CD19/CD3/CD28对CD19阳性细胞K562-CD19具有较好的细胞毒性,特别是三效价CD19/CD3/CD28 LTN具有较高的CD19阳性细胞杀伤能力,展现了更强的肿瘤抑制效果;因此可以比较出不同效价之间肿瘤细胞毒性较高的优势结构。
5.7CD19/CD3/CD28 LTN三特异性抗体在Nalm6负荷小鼠的体内抗肿瘤活性
将Nalm6细胞从液氮中取出,放入37℃水浴中快速解冻。使用RPMI 1640培养基培养至足够数量后,调整细胞密度后,尾静脉注射到6周龄NCG小鼠体内,每只小鼠0.5million肿瘤细胞。3天后,将PBMC细胞从液氮中取出,放入37℃水浴中快速解冻,调整细胞密度,尾静脉注射10million/只到小鼠体内。使用5.33nmol/kg药物浓度的CD19/CD3和CD19/CD3/CD28 LTN 200μL/只/天给药,共十次。每3天使用小动物活体成像仪统计小鼠体内Nalm6肿瘤细胞荧光强度。通过计算平均荧光强度来估算肿瘤治疗效果,结果如图34和图35所示,CD19/CD3/CD28 LTN在体内治疗效果相较CD19/CD3展现了显著性优势,有较好的抑制肿瘤生长能力,显著延长了小鼠生存期。
实施例6ROR1/CD3/CD28三特异性抗体生物学功能评价
6.1不同效价ROR1/CD3/CD28三特异性抗体抗原结合验证
将ROR1 ECD-Fc、CD28 ECD-Fc、CD3 ECD-Fc抗原用PBS稀释至10μg/mL包被于96孔ELISA板中,100μL/孔,4℃包被过夜。弃去板中液体,PBST洗板2次后加入5%脱脂奶的PBST溶液200μL/孔,室温封闭2h,将孔内封闭液排干。将待测抗体用封闭液10倍稀释6个梯度,起始抗体浓度为200nM,每个浓度梯度3个复孔,100μL/孔加入孔板内,室温孵育2h。用PBST洗板3次后排干,将HRP标记的抗kappa链抗体用5%脱脂奶的PBST进行1:5000稀释后加入孔板内,100μL/孔,室温孵育1h。用PBST洗板3次后排干,每孔加入TMB显色液100μL,室温避光显色10min,然后每孔加入50μL 2M H
结果如表24和图36所示,通过对EC50的比较发现,不同结构的ROR1/CD3/CD28三特异性抗体与ROR1/CD3双特异性抗体相比,与ROR1抗原的结合能力有所提高,说明ROR1/CD3/CD28抗体保留了其对ROR1抗原的结合亲和力和特异性。
如表25和图37所示,通过对EC50的比较发现,不同结构ROR1/CD3/CD28三特异性抗体对CD28有着高亲和力与特异性。
如表26和图38所示,通过对EC50的比较发现,ROR1/CD3/CD28三特异性抗体与ROR1/CD3双特异性抗体相比,与CD3抗原的结合能力无明显差异,说明ROR1/CD3/CD28三特异抗体保留了其对CD3抗原的结合亲和力和特异性。
表24不同效价ROR1/CD3/CD28三特异性抗体对ROR1抗原结合能力
表25不同效价ROR1/CD3/CD28三特异性抗体对CD28抗原结合能力
表26不同效价ROR1/CD3/CD28三特异性抗体对CD3抗原结合能力
6.2不同效价ROR1/CD3/CD28三特异性抗体在PBMC与ROR1阳性肿瘤细胞孵育细胞因子释放能力验证
从液氮中解冻PBMC,调整细胞密度为(1million/mL),取MEC1-ROR1肿瘤细胞,调整密度为(0.2million/mL),等体积混合后将1mL/孔铺回24孔板中,按100pM浓度加入不同效价的ROR1/CD3/CD28三特异性抗体与ROR1/CD3双特异性抗体,24小时后收集上清。
采用IL-2,IFN-γ和TNF-αELISA检测试剂盒用于细胞因子的检测,具体如下:将Capture Antibody包被酶标板,室温放置4h或者4℃过夜;使用Wash Buffer清洗3次后,采用ELISA/ELISAPOT Diluent(1×)对酶标板进行室温2h或4℃封闭过夜。配制并且加入IL-2,IFN-γ和TNF-α标准品,同时对细胞上清液进行稀释并加入酶标板,37℃反应2小时后,用Wash Buffer清洗板5次。稀释并加入Detection Antibody溶液,室温孵育1-2h;继续采用Wash Buffer清洗板5次,并加入Streptavidin-HRP溶液,室温30min-1h后,洗板5次。加入1×TMD溶液显色,并采用Stop Solution终止反应,使用酶标仪分别检测450nm波长处吸光度。
结果如图39(图39A、图39B)所示,与ROR1/CD3双特异性抗体相比,三特异性抗体ROR1/CD3/CD28对ROR1阳性细胞MEC1-ROR1共孵育的T细胞具有更高的细胞因子释放水平。其中,三效价ROR1/CD3/CD28 LTN结构具有最高释放水平和显著性优势,进一步证明ROR1/CD3/CD28 LTN具有更强的T细胞活化能力。
6.3不同效价ROR1/CD3/CD28三特异性抗体对CD8
具体实施步骤同6.2,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti humanCD4;Pacific blue anti-human CD8;APC anti-human CD69;FITC anti-human CD25染色,通过流式细胞仪分析CD8
活化结果如图40(图40A、图40B)所示,相比于ROR1/CD3双特异性抗体,不同结构ROR1/CD3/CD28三特异性抗体均有明显的对于CD8
6.4不同效价ROR1/CD3/CD28三特异性抗体对增强T细胞抗凋亡能力比较
具体实施步骤同6.2,24小时后离心收集细胞,流式抗体PerCP cy5.5-anti humanCD4;Pacific blue anti-human CD8冰上染色1h,固定液室温30min,渗透液配置3μg/mLFITC anti-human BCL-xL重悬细胞室温静置30min,FACS洗一遍,通过流式细胞仪分析BCL-xL
结果如图41(图41A、图41B)所示,相比于ROR1/CD3双特异性抗体,不同结构ROR1/CD3/CD28三特异性抗体均有明显的T细胞抗凋亡能力增强效果,其中,ROR1/CD3/CD28 LTN具有较好的增强CD4
6.5不同效价ROR1/CD3/CD28三特异性抗体体外肿瘤杀伤活性
将PBMC细胞从液氮中取出,放入37℃水浴中快速解冻;使用RPMI 1640培养基稀释解冻细胞(培养基:细胞>10:1);离心1000rpm 5min,去上清液,培养基重悬PBMC细胞;重复上述离心一次;细胞计数,调整PBMC细胞密度;消化肿瘤细胞调整密度,使用CFSE标记MDAMB 468,调整PBMC与MDAMB 468效靶比为5:1和1:1,并配置MDAMB 468与等体积培养基混合阳性对照组。在U型板中配置200μL 100nM抗体,10倍稀释6个浓度梯度,10μL/孔转移至96孔板后将调好密度的PBMC与肿瘤细胞100μL/孔加入,MDAMB 468与等体积培养基混合作为阳性对照组孵育100μL/孔,孵育24h,检测活细胞数量。通过7AAD阴性细胞中CFSE阳性细胞的数量与阴性组对照计算肿瘤细胞杀伤百分比。
结果如图42所示,通过对杀伤百分比的比较发现,与ROR1/CD3双特异性抗体相比,三特异性抗体ROR1/CD3/CD28对ROR1阳性细胞MDAMB 468具有较好的细胞毒性,特别是三效价ROR1/CD3/CD28 LTN具有较高的ROR1阳性细胞杀伤能力,展现了更强的肿瘤抑制效果;因此可以比较出不同效价之间肿瘤细胞毒性较高的优势结构。
- 一种显著提高丝印网版膜面平整性的涂布工艺方法
- 一种数据线丝印用可调节网版
- 一种丝印网版脱模设备及丝印网版
