基于IL-2的构建体
文献发布时间:2024-04-18 20:01:23
技术领域
本发明部分地涉及包含白介素2(IL-2)或其变体的嵌合蛋白或嵌合蛋白复合物(包括基于Fc的嵌合蛋白复合物)以及它们作为治疗剂的用途。
相关申请的交叉引用
本申请要求2021年4月16日提交的美国临时专利申请号63/175,827和2022年1月7日提交的美国临时专利申请号63/297,330的权益,所述申请的全部内容特此以引用方式整体并入。
序列表
与本文一起以电子方式提交的文本文件的内容以引用方式整体并入本文。序列表的计算机可读格式副本(文件名:ORN-080PC_ST25.txt,创建日期:2022年4月14日;文件大小:1,151,315字节)。
背景技术
白介素2(IL-2)是细胞因子家族的成员,每个成员都有一个四α螺旋束。IL-2通过IL-2受体传导信号,IL-2受体是一种由两条或三条多肽链(即α链和/或β链和γ链)组成的复合物。
IL-2已被批准用于高剂量方案的癌症治疗。用IL-2治疗的说明性癌症包括肾细胞(肾)癌和黑素瘤(一种皮肤癌)。
IL-2通过含有α(IL-2Rα、CD25)和/或β(IL-2Rβ、CD122)以及共同γ受体多肽链(γc、CD132)的受体信号传导复合物刺激免疫细胞增殖和激活,但其效果是多效性和情境性的。在高剂量下,IL-2与异源二聚体IL-2Rβγ受体结合,导致肿瘤杀伤CD8
相反,CD8
已制备了受体选择性IL-2的构建体(例如,IL-2Rα和IL-2Rβ相互作用缺陷或减弱的构建体)。然而,这些构建体仍然存在副作用和毒性问题。有些问题可以通过减少剂量(例如,通过延长半衰期)来改善,但仅减少剂量并不能解决细胞选择性问题。因此,仍然需要基于IL-2的剂,这些剂具有减少的细胞副作用(脱靶效应)和较低的全身毒性,可用于IL-2Rβγ靶向(例如,用于癌症治疗中的CD8
因此,仍然需要具有改进的靶标选择性、药物动力学和治疗特性以及最小程度的毒性特征的安全有效的基于IL-2的治疗剂。
发明内容
因此,在一些方面,本发明涉及包含修饰的IL-2作为信号传导剂的嵌合蛋白和嵌合蛋白复合物,包括基于Fc的嵌合蛋白复合物。在一些实施方案中,所述经修饰的IL-2是经修饰的野生型IL-2,其中所述野生型IL-2具有氨基酸序列SEQ ID NO:1。在一些实施方案中,所述经修饰的IL-2是经修饰的新白细胞素,其中所述新白细胞素具有氨基酸序列SEQID NO:2。
在一些实施方案中,所述经修饰的IL-2信号传导剂包含:(i)选自D20E、D20F、D20G、D20H、D20I、D20K、D20L和D20V的突变;或(ii)选自N88G、N88E、N88K、N88Q和N88V的突变;或(iii)选自Q126G、Q126A、Q126E、Q126F、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的突变;或(iv)选自(i)和(iii)的突变或选自(ii)和(iii)的突变;或(v)选自以下的一个或多个突变:R38A/F42K/N88G/C125A、F42K/C125A、D20E/C125A、D20F/C125A、D20G/C125A、D20H/C125A、D20I/C125A、D20K/C125A、D20L/C125A、D20N/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88E/C125A、N88H/C125A、N88I/C125A、N88K/C125A、N88Q/C125A、N88R/C125A、N88T/C125A、N88V/C125A、D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、R38A/F42Y/E62A/C125A、R38A/F42Y/Y45A/E62A、F42Y/Y45A/L72G、R38A/F42Y/Y45A/E62A/C125A、F42Y/Y45A/L72G/C125A、R38A/F42K/N88G、R38A/F42K/Q126G、R38A/F42K/Q126I、R38A/F42K/Q126Y、R38A/F42K/Q126G/C125A、R38A/F42K/Q126I/C125A、R38A/F42K/Q126Y/C125A、R38A/F42K/E62A/N88G和R38A/F42K/E62A/N88G/C125A。
在一些实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1在选自R38、F42、E62、C125、Y45、L72、D20、N88和Q126的氨基酸残基处包含一个或多个突变。在此类实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1包含选自R38A、F42K、F42Y、E62A、C125A、Y45A、L72G、D20E、D20F、D20G、D20H、D20I、D20K、D20L、D20N、D20V、N88G、N88E、N88I、N88K、N88Q、N88R、N88V、R38A/F42Y/E62A/C125A、F42Y/Y45A/L72G/C125A、F42K/C125A、R38A/F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K/C125A、D20V/R38A/F42K/C125A、R38A/F42K/N88A/C125A、R38A/F42K/N88G/C125A、Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在各个实施方案中,所述经修饰的IL-2信号传导剂相对于SEQID NO:1包含选自D20V、D20E、N88G、F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、D20V/R38A/F42K/E62A、D20V/R38A/F42K/E62A/C125A、R38A/F42K/N88G、R38A/F42K/N88G/C125A、R38A/F42K/E62A/N88G、R38A/F42K/E62A/N88G/C125A、Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在特定实施方案中,所述经修饰的IL-2信号传导剂相对于SEQID NO:1包含选自R38A/F42Y/E62A/C125A、F42Y/Y45A/L72G/C125A、F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K/C125A、D20V/R38A/F42K/C125A和R38A/F42K/N88G/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2信号传导剂是经修饰的新白细胞素,其包含氨基酸序列SEQ ID NO:2。在此类实施方案中,包含SEQ ID NO:2的经修饰的IL-2信号传导剂在氨基酸残基D15和/或N40处具有一个或多个突变。举例来说,在一些实施方案中,包含SEQ ID NO:2的经修饰的IL-2信号传导剂包含D15T、D15H、N40I、N40G或N40R。
在一些实施方案中,相对于例如野生型IL-2,所述一个或多个突变或修饰提高了经修饰的IL-2的安全特性。在一些实施方案中,相对于例如野生型IL-2,所述一个或多个突变或修饰降低了经修饰的IL-2的生物活性。举例来说,所述一个或多个突变或修饰可以降低经修饰的IL-2对靶受体的亲和力。在一些实施方案中,所述靶受体是异源三聚体受体IL-2Rαβγ,其由IL-2Rα、IL-2Rβ和IL-2Rγ亚单位组成。在一些实施方案中,所述靶受体是异源二聚体受体IL-2Rβγ,其由IL-2Rβ和IL-2Rγ亚单位组成。在一些实施方案中,所述经修饰的IL-2包含一个或多个降低其对IL-2Rα亚单位的亲和力的突变或修饰。在另一个实施方案中,所述经修饰的IL-2包含一个或多个降低其对IL-2Rβ的亲和力的突变或修饰。在又一个实施方案中,所述经修饰的IL-2包含一个或多个降低其对IL-2Rγ的亲和力的突变或修饰。在一个实施方案中,所述经修饰的IL-2包含一个或多个降低其对IL-2Rα、IL-2Rβ和IL-2Rγ的任何组合的亲和力的突变或修饰(例如,一个或多个降低经修饰的IL-2对IL-2Rα、IL-2Rβ和IL-2Rγ或对IL-2Rα和IL-2Rβ或对IL-2Rγ和IL-2Rβ或对IL-2Rα和IL-2Rγ的亲和力的突变或修饰)。
在一些实施方案中,所述经修饰的IL-2对IL-2Rα和IL2Rβ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、D20V/R38A/F42K/E62A、D20V/R38A/F42K/E62A/C125A、R38A/F42K/N88G、R38A/F42K/N88G/C125A、R38A/F42K/E62A/N88G和R38A/F42K/E62A/N88G/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rα和IL-2Rγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自R38A/F42K/Q126G、R38A/F42K/Q126I和R38A/F42K/Q126Y的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rβ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E、D20F、D20G、D20H、D20I、D20K、D20L、D20V、N88G、N88E、N88K、N88Q、N88V、D20E/C125A、D20F/C125A、D20G/C125A、D20H/C125A、D20I/C125A、D20L/C125A、D20K/C125A、D20N/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88E/C125A、N88H/C125A、N88I/C125A、N88K/C125A、N88Q/C125A、N88R/C125A、N88T/C125A和N88V/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rβγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E/Q126A、D20E/Q126D、D20E/Q126E、D20E/Q126F、D20E/Q126G、D20E/Q126H、D20E/Q126I、D20E/Q126K、D20E/Q126L、D20E/Q126M、D20E/Q126N、D20E/Q126P、D20E/Q126R、D20E/Q126S、D20E/Q126T、D20E/Q126V、D20E/Q126W、D20E/Q126Y、D20V/Q126A、D20V/Q126D、D20V/Q126E、D20V/Q126F、D20V/Q126G、D20V/Q126H、D20V/Q126I、D20V/Q126K、D20V/Q126L、D20V/Q126M、D20V/Q126N、D20V/Q126P、D20V/Q126R、D20V/Q126S、D20V/Q126T、D20V/Q126V、D20V/Q126W、D20V/Q126Y、N88A/Q126A、N88A/Q126D、N88A/Q126E、N88A/Q126F、N88A/Q126G、N88A/Q126H、N88A/Q126I、N88A/Q126K、N88A/Q126L、N88A/Q126M、N88A/Q126N、N88A/Q126P、N88A/Q126R、N88A/Q126S、N88A/Q126T、N88A/Q126V、N88A/Q126W、N88A/Q126Y、N88G/Q126A、N88G/Q126D、N88G/Q126E、N88G/Q126F、N88G/Q126G、N88G/Q126H、N88G/Q126I、N88G/Q126K、N88G/Q126L、N88G/Q126M、N88G/Q126N、N88G/Q126P、N88G/Q126R、N88G/Q126S、N88G/Q126T、N88G/Q126V、N88G/Q126W和N88G/Q126Y的一个或多个突变。在另外的实施方案中,所述经修饰的IL-2对IL-2Rβγ表现出降低的亲和力和/或活性并且对激活的CD8细胞表现出增加的选择性。
在另一方面,所述经修饰的IL-2对IL-2Rβ表现出降低的亲和力和/或活性,并且相对于具有SEQ ID NO:1的野生型信号传导剂包含选自D20E、D20F、D20G、D20H、D20I、D20K、D20L、D20N、D20V、N88G、N88E、N88I、N88K、N88Q、N88R和N88V、D20E/C125A、D20F/C125A、D20G/C125A、D20H/C125A、D20I/C125A、D20K/C125A、D20L/C125A、D20N/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A和N88T/C125A的单个突变,并且不包含赋予对IL-2Rα亚单位(IL-2Rα)的降低的亲和力或生物活性的突变。在另外的实施方案中,所述经修饰的IL-2对IL-2Rβ表现出降低的亲和力和/或活性并且表现出对激活的CD8细胞的增加的选择性和对Treg的降低的选择性。
在一些实施方案中,所述靶受体是异源三聚体受体IL-2Rαβγ,其由IL-2Rα、IL-2Rβ和IL-2Rγ亚单位组成。在一些实施方案中,所述靶受体是异源二聚体受体IL-2Rβγ,其由IL-2Rβ和IL-2Rγ亚单位组成。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低或消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对缺乏α链的IL-2R的活性或亲和力的突变或修饰。在一些实施方案中,所述降低经修饰的IL-2的活性或亲和力和/或减弱经修饰的IL-2的突变或修饰可通过连接至经修饰的IL-2的靶向部分在靶细胞或治疗作用位点处恢复。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对缺乏α链的IL-2R的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对包含α链的IL-2R的活性或亲和力的突变或修饰,这种突变或修饰是减毒突变,其活性或亲和力可通过经由靶向部分诱导接近靶标或治疗作用位点(例如细胞或细胞外基质)来恢复。
在各个实施方案中,本发明涵盖包含含有糖基化突变的经修饰的IL-2信号传导剂的嵌合蛋白、嵌合蛋白复合物或基于Fc的嵌合蛋白复合物。在一些实施方案中,所述糖基化突变减少或消除经修饰的IL-2信号传导剂的糖基化。在一些实施方案中,所述糖基化突变是T3取代,其中所述突变是T3A、T3F、T3H、T3L、T3V和T3Y中的一者。在一些实施方案中,所述糖基化突变是所述经修饰的IL-2的前3、4、5、6、7或8个残基的缺失。
在一些实施方案中,所述嵌合蛋白包含一个或多个另外的信号传导剂,例如但不限于可以经过修饰的干扰素、白介素和肿瘤坏死因子。
在一些实施方案中,所述嵌合蛋白包含一个或多个靶向部分,所述一个或多个靶向部分允许恢复本文所描述的削弱或减弱的活性(例如,IL-2上的活性)。在一些实施方案中,所述嵌合蛋白包含一个或多个靶向部分,所述一个或多个靶向部分具有特异性地结合至目标靶标(例如抗原、受体)的识别结构域(例如抗原识别结构域,包括但不限于各种抗体型式,包括单结构域抗体)。在各个实施方案中,所述靶向部分具有特异性地结合至目标靶标(例如抗原、受体)的识别结构域,包括可见于一个或多个免疫细胞上的靶标,所述免疫细胞可以包括但不限于T细胞、Treg、细胞毒性T淋巴细胞、T辅助细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、抗肿瘤或肿瘤巨噬细胞(例如分别为M1或M2巨噬细胞)、B细胞和树突状细胞。在一些实施方案中,所述免疫细胞是T细胞并且所述靶向部分靶向CD8。在多个实施方案中,所述免疫细胞是Treg并且所述靶向部分靶向CTLA4。在多个实施方案中,所述免疫细胞是NK细胞并且所述靶向部分是NKp46。
在一些实施方案中,所述识别结构域特异性地结合至目标靶标(例如抗原、受体)并且有效地募集一种或多种免疫细胞。在一些实施方案中,所述目标靶标(例如抗原、受体)可见于一种或多种肿瘤细胞上。在一些实施方案中,本发明的嵌合蛋白可以直接或间接地将免疫细胞,例如可以杀死和/或阻抑肿瘤细胞的免疫细胞募集至作用位点(作为非限制性实例,诸如肿瘤微环境)。在一些实施方案中,所述识别结构域结合至在正常目标组织中发现的目标靶标。在一些实施方案中,本发明的嵌合蛋白可以结合至靶细胞以指导嵌合蛋白定位至目标组织细胞,同时还能够结合至第二种不同的细胞类型(例如免疫细胞)以赋予由经修饰的IL-2介导的组织定位生物效应。在一些实施方案中,所述识别结构域特异性地结合至目标靶标(例如抗原、受体),所述靶标是非细胞结构的一部分。
在各个实施方案中,本发明技术的嵌合蛋白与非靶向的经修饰的IL-2相比提供提高的细胞靶选择性、安全性和/或治疗活性和/或药物动力学特征(例如增加的血清半衰期)。
在一些实施方案中,本发明技术的嵌合蛋白是单链多肽。
在一些实施方案中,本发明技术的嵌合蛋白是包含两条或更多条多肽链的蛋白复合物。在一些实施方案中,所述靶向部分(或多个部分)和所述一个或多个信号传导剂(例如经修饰的IL-2)位于蛋白复合物中的相同多肽链上。在一些实施方案中,所述靶向部分(或多个部分)和所述一个或多个信号传导剂(例如经修饰的IL-2)位于蛋白复合物中的不同多肽链上。
在各个实施方案中,本发明的嵌合蛋白可用于治疗各种疾病或病症,诸如癌症、感染、免疫病症、自身免疫性疾病、心血管疾病、创伤愈合、缺血相关疾病、神经退行性疾病、代谢性疾病以及许多其他疾病和病症,并且本发明涵盖各种治疗方法。
在另一方面,本发明涉及包含经修饰的IL-2作为信号传导剂的基于Fc的嵌合蛋白复合物。在一些实施方案中,本发明的基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:291-296、298-335中的任一者具有至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%同一性的氨基酸序列的多肽。在特定实施方案中,本发明的基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:292、293、294、299、301、310、311、312、315、316、319、320、325、328、332、333和335中的任一者具有至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%同一性的氨基酸序列的多肽。
在一些实施方案中,本发明涉及嵌合蛋白或基于Fc的嵌合蛋白复合物,所述嵌合蛋白或基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:290-449、478-495或501-531中的任一者具有至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%同一性的氨基酸序列的多肽。
附图说明
图1A-图1F、图2A-图2H、图3A-图3H、图4A-图4D、图5A-图5F、图6A-图6J、图7A-图7D、图8A-图8F、图9A-图9J、图10A-图10F、图11A-图11L、图12A-图12L、图13A-图13F、图14A-图14L、图15A-图15L、图16A-图16J、图17A-图17J、图18A-图18F和图19A-图19F示出了本发明的基于Fc的嵌合蛋白复合物的各个非限制性说明性示意图。在多个实施方案中,每个示意图是本发明的组合物。在图中适用的地方,“TM”是指如本文所描述的“靶向部分”,“SA”是指如本文所描述的“信号传导剂”,
图1A-图1F示出了说明性同源二聚体2链复合物。这些图示出了同源二聚体2链复合物的说明性构型。
图2A-图2H示出了说明性同源二聚体2链复合物,其具有两个靶向部分(TM)(如本文所描述的,在一些实施方案中可以存在更多的靶向部分)。在多个实施方案中,TM1和TM2的位置是可互换的。在多个实施方案中,框中所示的构建体(即图2G和图2H)在TM1与TM2之间或在TM1与Fc之间具有信号传导剂(SA)。
图3A-图3H示出了说明性同源二聚体2链复合物,其具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)。在多个实施方案中,SA1和SA2的位置是可互换的。在多个实施方案中,框中所示的构建体(即图3G和图3H)在Fc与SA1和/或SA2之间、在Fc链的N端或C端之间具有TM。
图4A-图4D示出了说明性异源二聚体2链复合物,其具有分裂TM链和SA链,即TM在Fc的旋钮链上,而SA在Fc的孔洞链上。
图5A-图5F示出了说明性异源二聚体2链复合物,其具有分裂TM链和SA链,即两个TM都在Fc的旋钮链上,而SA在Fc的孔洞链上,具有两个靶向部分(如本文所描述的,在一些实施方案中可以存在更多的靶向部分)。在多个实施方案中,TM1和TM2的位置是可互换的。在一些实施方案中,TM1和TM2可以是相同的。
图6A-图6J示出了说明性异源二聚体2链复合物,即TM在Fc的旋钮链上,具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)。在这些取向和/或构型中,一个SA在旋钮链上,一个SA在孔洞链上。在多个实施方案中,SA1和SA2的位置是可互换的。
图7A-图7D示出了说明性异源二聚体2链复合物,其具有分裂TM链和SA链,即SA在Fc的旋钮链上,而TM在Fc的孔洞链上。
图8A-图8F示出了说明性异源二聚体2链复合物,其具有分裂TM链和SA链,即SA在Fc的旋钮链上,而两个TM都在Fc的孔洞链上,具有两个靶向部分(如本文所描述的,在一些实施方案中可以存在更多的靶向部分)。在多个实施方案中,TM1和TM2的位置是可互换的。在一些实施方案中,TM1和TM2可以是相同的。
图9A-图9J示出了说明性异源二聚体2链复合物,即TM在Fc的孔洞链上,且具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)。在这些取向和/或构型中,一个SA在旋钮链上,一个SA在孔洞链上。在多个实施方案中,SA1和SA2的位置是可互换的。
图10A-图10F示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的旋钮链上。
图11A-图11L示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的旋钮链上,具有两个靶向部分(如本文所描述的,在一些实施方案中可以存在更多的靶向部分)。在多个实施方案中,TM1和TM2的位置是可互换的。在一些实施方案中,TM1和TM2可以是相同的。
图12A-图12L示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的旋钮链上,具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)。在多个实施方案中,SA1和SA2的位置是可互换的。
图13A-图13F示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的孔洞链上。
图14A-图14L示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的孔洞链上,具有两个靶向部分(如本文所描述的,在一些实施方案中存在更多的靶向部分)。在多个实施方案中,TM1和TM2的位置是可互换的。在多个实施方案中,TM1和TM2可以是相同的。
图15A-图15L示出了说明性异源二聚体2链复合物,其中TM和SA在同一链上,即SA和TM均在Fc的孔洞链上,具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)。在多个实施方案中,SA1和SA2的位置是可互换的。
图16A-图16J示出了说明性异源二聚体2链复合物,其具有两个靶向部分(如本文所描述的,在一些实施方案中可以存在更多的靶向部分),并且其中SA在旋钮Fc上并且TM在每个链上。在多个实施方案中,TM1和TM2可以是相同的。
图17A-图17J示出了说明性异源二聚体2链复合物,其具有两个靶向部分(TM)(如本文所描述的,在一些实施方案中可以存在更多的靶向部分),并且其中SA在孔洞Fc上并且TM在每个链上。在多个实施方案中,TM1和TM2可以是相同的。
图18A-图18F示出了说明性异源二聚体2链复合物,其具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)并且具有分裂SA链和TM链:SA在旋钮上并且TM在孔洞Fc上。
图19A-图19F示出了说明性异源二聚体2链复合物,其具有两个信号传导剂(如本文所描述的,在一些实施方案中可以存在更多的信号传导剂)并且具有分裂SA链和TM链:TM在旋钮上并且SA在孔洞Fc上。
图20描绘了PBMC淋巴细胞群体中IL-2和Fc-IL-2驱动的STAT5磷酸化。
图21A-图21G示出了CD25敲除突变和CD8靶向对淋巴细胞群体中的STAT5磷酸化的影响。
图22A-图22G描绘了生物层干涉法中IL-2和Fc-IL-2融合蛋白与生物素化CD25的结合的传感图。
图23A-图23R描绘了针对CD8
图24A-图24R描绘了针对CD8
图25A-图25D示出了β突变(此处为N88G)和CD8靶向对PBMC亚群体中STAT5磷酸化的影响。
图26A-图26J示出了CD25和IL-2Rβ突变的各种组合及其对PMBC群体中pSTAT5的影响。
图27A-图27B描绘了FACS中CD25 scFv Fc融合物与HEK-Blue IL-2和HEK-BlueIL-1细胞的结合。
图28示出了CD25 scFv Fc融合物对HEK-Blue IL-2细胞中野生型IL-2信号传导的影响。
图29A-图29M描绘了具有CD25或β突变的ALN2变体的CD25靶向对某些PBMC亚群体中STAT5磷酸化的影响。
图30A-图30H示出了在PBMC亚群体中IL-2和Fc-IL-2模拟物/新白细胞素变体的STAT5磷酸化。
图31描绘了不同的二价(如果VHH1和VHH2相同)或双特异性(如果VHH1和VHH2代表不同的靶向结构域)旋钮入孔洞ALN2型式。
图32描绘了各种ALN2构型。
图33A-图33G描绘了与单价对应物相比,二价和双特异性CD8 VHH靶向性ALN2的STAT5磷酸化的STAT5比较。
图34A-图34E描绘了CD8+和Treg PBMC亚群体中不同型式的ALN2的STAT5磷酸化。
图35A-图35D显示与Treg PBMC亚群体相比,单肽ALN2在CD8+中诱导pSTAT5。
图36A-图36M描绘了在CD8+和CD8-PBMC淋巴细胞群体中CD8 VHH-Fc-IL-2及其T3O-糖基化变体的STAT5磷酸化。
图37A-图37D示出了在CD8+和Treg原代小鼠脾细胞中小鼠CD8靶向性α:βALN2变体的STAT5磷酸化。
图38描绘了在MC38和CT26同基因小鼠结肠癌模型中用缓冲液、Fc-ALN2或CD8-Fc-ALN2治疗的动物的肿瘤生长(以mm
图39示出了CD8-Fc-ALN2和抗PD-1共同治疗在MC38和CT26小鼠模型中的效果。
图40A-图40D示出了在CD8阳性PBMC中CD8靶向性Fcγ共同Q126突变体的STAT5磷酸化。
图41A-图41S描绘了BLI中CD8-Fc-IL-2及其Q126突变体融合蛋白与生物素化CD25的结合的传感图。
图42A-图42D示出了在三个不同供体的CD8+和Treg PBMC亚群体中α:γ突变体的pSTAT5磷酸化。
图43A-图43D描绘了“静息”或TransAct激活的CD8+或Treg PBMC亚群体的β:γALN2STAT5磷酸化。
图44示出了CD8-Fc-ALN2(12.5μg)、Fc-ALN2(10.7μg)或Fc-IL2(10.7μg)在单次剂量后1天对T细胞激活的影响。
图45描绘了CD8-Fc-ALN2(12.5μg)、Fc-ALN2(10.7μg)或Fc-IL2(10.7μg)在有或没有抗PD-1 Ab共同治疗的情况下在两次剂量后7天对T细胞激活的影响。
图46示出了CD8-Fc-ALN2(25μg)、Fc-ALN2(21.4μg)或Fc-IL2(21.4μg)在单次剂量后3天对T细胞激活的影响。
图47描绘了在A20小鼠模型中与野生型Fc-IL2,1相比,三次注射的12.5μg CD8-Fc-ALN2和抗PD-1 Ab的效果。
图48示出了在B16F10小鼠模型中与等摩尔Fc-ALN2治疗相比,三种剂量的12.5μgCD8-Fc-ALN2的效果。
图49描绘了在Panc02小鼠模型中与等摩尔Fc-ALN2治疗相比,两次注射12.5μgCD8-Fc-ALN2的效果。
图50描绘了比较野生型IL2、PD-L1靶向性和非靶向性ALN2的小鼠脾细胞(单一群体)中的STAT5磷酸化。
图51示出了在MC38小鼠模型中与等摩尔Fc-ALN2治疗相比,三种剂量的12.5μgCD8-Fc-ALN2和抗PD-1 Ab的效果。
图52描绘了在MC38小鼠模型中三种剂量的12.5μg TNCA1-Fc-ALN2或等效剂量的非靶向性ALN2在没有或有抗PD-1Ab共同治疗的情况下的效果。
图53示出了与非靶向性或野生型IL-2相比,CD8和NK原代小鼠脾细胞中小鼠CD8或NKp46或双特异性靶向性α:βALN2变体的STAT5磷酸化。
图54描绘了三个PBMC供体中ALN2变体R38A_F42K_D20E(上)和R38A_F42K_N88G(下)对CD25(左)和PD-1(右)的上调。数据绘制为平均值±SEM。
图55示出了1次治疗(5μg)后45分钟hCD8-Fc-ALN2对人免疫系统(HIS)小鼠中人T细胞激活的影响。
图56描绘了在原代小鼠脾细胞中具有不同功能丧失型β突变的小鼠CD8靶向性或非靶向性ALN2变体的CD25上调。
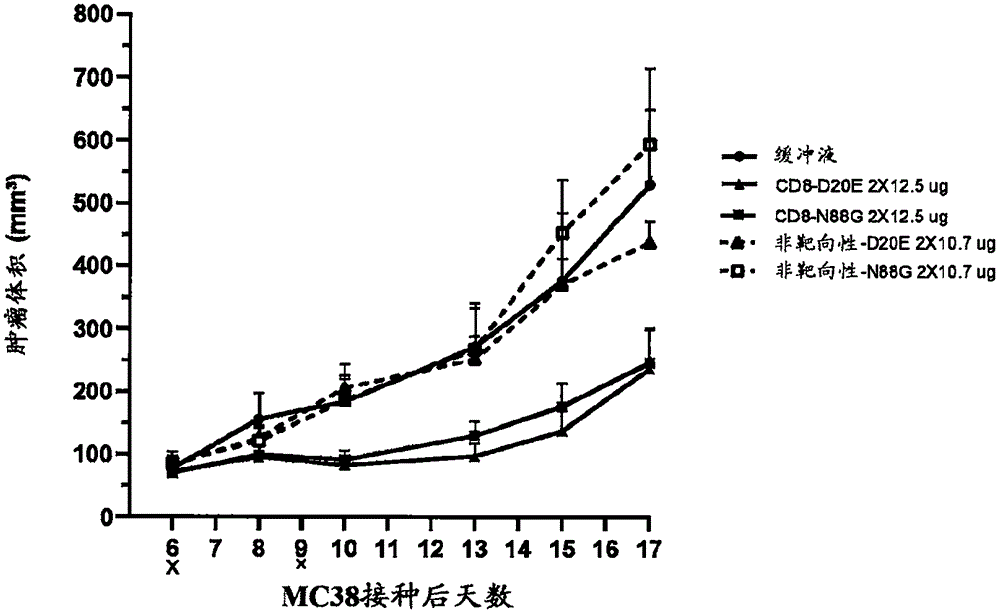
图57示出了在MC38小鼠模型中用12.5μg基于N88G或基于D20E的CD8-Fc-ALN2或等摩尔非靶向性ALN2在第6天和第9天治疗的效果。
图58描绘了在原代小鼠脾细胞中具有不同功能丧失型γ突变的ALN2变体的STAT5磷酸化。
图59示出了在MC38小鼠模型中三种剂量的12.5或4.17ugCD8-Fc-ALN2α:γ突变组合与等摩尔剂量的非靶向性Fc-ALN相比的效果。
图60示出了在MC38小鼠模型中三种剂量的4.17或1.4μg CD8-Fc-ALN2β:γ突变组合与等摩尔剂量的非靶向性Fc-ALN相比的效果。
图61描绘了HEK-B1ue CD8与HEK-Blue NKp46细胞中D20 ALN2变体的信号传导。
图62描绘了HEK-Blue CD8与HEK-Blue NKp46细胞中N88 ALN2变体的信号传导。
具体实施方式
本发明技术部分地基于以下发现:包含经修饰的IL-2的靶向性嵌合蛋白或蛋白复合物(包括基于Fc的嵌合蛋白复合物)表现出有益的治疗特性和减少的副作用。举例来说,本发明技术的嵌合蛋白具有高活性和/或长效作用,同时引起最小的副作用。本发明技术提供了包含嵌合蛋白的药物组合物以及所述药物组合物在治疗各种疾病中的用途。
在一些实施方案中,具有经修饰的IL-2的嵌合蛋白或蛋白复合物可能有利于减弱主要表达IL-2受体β和γ的CD8
在一些实施方案中,所述嵌合蛋白具有如本文所描述的针对CD8
在一些实施方案中,本发明涉及嵌合蛋白或基于Fc的嵌合蛋白复合物,所述嵌合蛋白或基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:290-449、478-495或501-531中的任一者具有至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%同一性的氨基酸序列的多肽。在另外的实施方案中,所述嵌合蛋白或基于Fc的嵌合蛋白复合物包含具有实施例1-25中的一个或多个中构建的氨基酸序列的多肽。
经修饰的IL-2
在一方面,本发明技术提供了一种嵌合蛋白,所述嵌合蛋白包含经修饰的IL-2。在各个实施方案中,本发明技术的嵌合蛋白包含经修饰的IL-2作为信号传导剂。在各个实施方案中,所述经修饰的IL-2信号传导剂涵盖所述经修饰的IL-2的功能性衍生物、类似物、前体、同种型、剪接变体或片段。在一些实施方案中,所述经修饰的IL-2涵盖对SEQ ID NO:1的突变和/或修饰,SEQ ID NO:1是野生型IL-2的氨基酸序列。在一些实施方案中,所述经修饰的IL-2对其靶受体具有降低的结合亲和力。
在一些实施方案中,所述经修饰的IL-2信号传导剂对IL-2Rα和/或IL-2Rβ和/或IL-2Rγ具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的IL-2对IL-2Rβ和/或IL-2Rγ具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的IL-2对IL-2Rα具有基本上降低或消除的亲和力和/或活性。此类实施方案可能有关于癌症的治疗,例如当所述经修饰的IL-2在IL-2Rβγ处具有激动性时。
在多个实施方案中,所述IL-2具有一个或多个使其远离具有α链的IL-2R的突变或修饰,以及一个或多个以可恢复的方式降低IL-2在仅具有βγ链的IL-2R处的活性或亲和力的减毒突变。
在多个实施方案中,所述IL-2具有一个或多个使其远离仅具有βγ链的IL-2R的突变或修饰,以及以可恢复的方式降低IL-2在具有α链的IL-2R处的活性或亲和力的减毒突变。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低或消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ复合物的活性或亲和力的突变或修饰。在一些实施方案中,所述经修饰的IL-2对IL-2Rα链的降低的活性或亲和力可通过经由本文所公开的靶向部分诱导接近靶标(例如细胞)来恢复。在一些实施方案中,所述消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰不能通过经由靶向部分诱导接近靶标(例如细胞)来恢复。在一些实施方案中,所述经修饰的IL-2对IL-2Rβγ复合物的降低的活性或亲和力可通过经由本文所公开的靶向部分诱导接近靶标(例如细胞)来恢复。在一些实施方案中,所述一个或多个降低经修饰的IL-2分别对IL-2Rα链和IL-2Rβγ复合物的活性或亲和力的突变均可通过经由本文所公开的靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个基本上消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对缺乏α链的IL-2R的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复,并且与野生型IL-2相比,这种IL-2对不表达靶向部分的靶标的细胞上的IL-2R基本上无活性,或者在接触表达靶向部分的靶标的细胞时,对包含α链的IL-2R基本上无活性,而对缺乏α链的IL-2R和/或表达靶向部分的靶标的细胞具有活性。在多个实施方案中,与来自不同突变或修饰的活性或亲和力相比,所述来自突变或修饰的活性或亲和力低约3倍或约5倍、或约10倍、或约30倍、或约100倍、或约300倍、或约500倍、或约1000倍。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rαβγ的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rα的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rαβγ的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复,并且与野生型IL-2相比,这种IL-2对不表达靶向部分的靶标的细胞上的IL-2R基本上无活性,或者在接触表达靶向部分的靶标的细胞时,对IL-2Rαβγ基本上无活性,而对IL-2Rβγ和/或表达靶向部分的靶标的细胞具有活性。
在多个实施方案中,所述IL-2对IL-2Rβγ(而非IL-2Rαβγ)具有选择性(例如偏向和/或强烈偏爱)作用,但对IL-2Rβγ的活性因突变或修饰而进一步减弱,从而使得IL-2的全身使用安全(例如,IL-2主要对治疗作用位点处的IL-2Rβγ具有活性,通过靶向部分定向至该治疗作用位点)。
在多个实施方案中,所述IL-2对NK细胞和/或CD8+细胞具有选择性(例如偏向和/或强烈偏爱)作用,但对Treg细胞基本上不具有选择性,并且对NK细胞和/或CD8+细胞的选择性(例如偏向和/或强烈偏爱)作用通过靶向而得到控制,从而减少或消除全身副作用。举例来说,在一些实施方案中,本发明的嵌合蛋白不仅针对具有免疫刺激效应的细胞,而且还以将IL-2作用集中在所需治疗位点的可控方式进行。如本文所描述,在多个实施方案中,此类嵌合蛋白可用于安全地刺激免疫系统以获得抗癌效应。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对缺乏α链的IL-2R的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对包含α链的IL-2R的活性或亲和力的突变或修饰,这种突变或修饰是减毒突变,其活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对缺乏α链的IL-2R的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对包含α链的IL-2R的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复,并且与野生型IL-2相比,这种IL-2对不表达靶向部分的靶标的细胞上的IL-2R基本上无活性,或者在接触表达靶向部分的靶标的细胞时,对缺乏α链的IL-2R基本上无活性,而对包含α链的IL-2R和/或表达靶向部分的靶标的细胞具有活性。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rβγ的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rα的活性或亲和力的突变或修饰,这种突变或修饰是减毒突变,其活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rβγ的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rαβγ的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rβγ的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rαβγ的活性或亲和力的突变或修饰,这种降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复,并且与野生型IL-2相比,这种IL-2对不表达靶向部分的靶标的细胞上的IL-2R基本上无活性,或者在接触表达靶向部分的靶标的细胞时,对IL-2Rβγ基本上无活性,而对IL-2Rαβγ和/或表达靶向部分的靶标的细胞具有活性。
在多个实施方案中,所述经修饰的IL-2对IL-2Rαβγ(而非IL-2Rβγ)具有选择性(例如偏向和/或强烈偏爱)作用,但对IL-2Rαβγ的活性因突变或修饰而进一步减弱,从而使得IL-2的全身使用安全(例如,IL-2主要对治疗作用位点处的IL-2Rαβγ具有活性,通过靶向部分定向至该治疗作用位点)。
在一些实施方案中,所述IL-2具有一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力以及对IL-2Rα链的正常活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在多个实施方案中,所述IL-2具有一个或多个降低经修饰的IL-2对IL-2Rα的活性或亲和力以及对IL-2Rβγ链的正常活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rα链的降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分(例如CD8、CD3或PD-1靶向部分)诱导接近靶标(例如细胞)来恢复并且可用于介导T细胞介导的免疫应答(例如CD8T细胞介导的免疫应答)。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rα和/或IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分(例如CD8、CD3或PD-1靶向部分)诱导接近靶标(例如细胞)来恢复并且可用于介导T细胞介导的免疫应答(例如CD8T细胞介导的免疫应答)。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个降低经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rα链和/或IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复并且可用于介导Treg应答。
在一些实施方案中,所述IL-2具有一个或多个突变或修饰:一个或多个消除经修饰的IL-2对IL-2Rα链的活性或亲和力的突变或修饰和/或一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复并且可用于介导Treg应答。
在一些实施方案中,所述IL-2具有一个或多个降低经修饰的IL-2对IL-2Rβγ链的活性或亲和力以及对IL-2Rα链的正常活性或亲和力的突变或修饰,其中经修饰的IL-2对IL-2Rβγ链的降低的活性或亲和力可通过经由靶向部分诱导接近靶标(例如细胞)来恢复并且可用于介导Treg应答。
在多个实施方案中,所述IL-2对Treg细胞具有选择性(例如,偏向和/或强烈偏向)作用,但对NK细胞和/或CD8+细胞基本上不具有选择性,并且对Treg细胞的选择性(例如偏向和/或强烈偏爱)作用通过靶向而得到控制,从而减少或消除全身副作用。举例来说,在一些实施方案中,本发明的嵌合蛋白不仅针对具有免疫抑制效应的细胞,而且还以将IL-2作用集中在所需治疗位点的可控方式进行。如本文所描述,在多个实施方案中,此类嵌合蛋白可用于安全地刺激免疫系统以获得抗自身免疫效应。
在一些实施方案中,所述经修饰的IL-2信号传导剂是经修饰的野生型IL-2。野生型IL-2具有以下氨基酸序列:
在一些实施方案中,所述经修饰的IL-2信号传导剂包含:(i)选自D20E、D20F、D20G、D20H、D20I、D20K、D20L和D20V的突变;或(ii)选自N88G、N88E、N88K、N88Q和N88V的突变;或(iii)选自Q126G、Q126A、Q126E、Q126F、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的突变;或(iv)选自(i)和(iii)的突变或选自(ii)和(iii)的突变;或(v)选自以下的一个或多个突变:R38A/F42K/N88G/C125A、F42K/C125A、D20E/C125A、D20F/C125A、D20G/C125A、D20H/C125A、D20I/C125A、D20K/C125A、D20L/C125A、D20N/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88E/C125A、N88H/C125A、N88I/C125A、N88K/C125A、N88Q/C125A、N88R/C125A、N88T/C125A、N88V/C125A、D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、R38A/F42Y/E62A/C125A、R38A/F42Y/Y45A/E62A、F42Y/Y45A/L72G、R38A/F42Y/Y45A/E62A/C125A、F42Y/Y45A/L72G/C125A、R38A/F42K/N88G、R38A/F42K/Q126G、R38A/F42K/Q126I、R38A/F42K/Q126Y、R38A/F42K/Q126G/C125A、R38A/F42K/Q126I/C125A、R38A/F42K/Q126Y/C125A、R38A/F42K/E62A/N88G和R38A/F42K/E62A/N88G/C125A。
在一些实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1在选自R38、F42、E62、C125、Y45、L72、D20、N88和Q126的氨基酸残基处包含一个或多个突变。在此类实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1包含选自R38A、F42K、F42Y、E62A、C125A、Y45A、L72G、D20E、D20F、D20G、D20H、D20I、D20K、D20L、D20N、D20V、N88G、N88E、N88I、N88K、N88Q、N88R、N88V、R38A/F42Y/E62A/C125A、F42Y/Y45A/L72G/C125A、F42K/C125A、R38A/F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K/C125A、D20V/R38A/F42K/C125A、R38A/F42K/N88A/C125A、R38A/F42K/N88G/C125A、Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在各个实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1包含选自D20V、D20E、N88G、F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、D20V/R38A/F42K/E62A、D20V/R38A/F42K/E62A/C125A、R38A/F42K/N88G、R38A/F42K/N88G/C125A、R38A/F42K/E62A/N88G、R38A/F42K/E62A/N88G/C125A、Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在特定实施方案中,所述经修饰的IL-2信号传导剂相对于SEQ ID NO:1包含选自R38A/F42Y/E62A/C125A、F42Y/Y45A/L72G/C125A、F42K/C125A、D20E/C125A、D20G/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88H/C125A、N88Q/C125A、N88T/C125A、D20E/R38A/F42K/C125A、D20V/R38A/F42K/C125A和R38A/F42K/N88G/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2信号传导剂包含选自表8中列出的那些的突变组合中的一个或多个。
不希望受理论束缚,认为与野生型IL-2相比,经修饰的IL-2剂对高亲和力IL-2受体(即IL-2Rαβγ)具有降低的亲和力并且保留对中亲和力IL-2受体(即IL-2Rβγ受体)的亲和力。
不希望受理论束缚,进一步认为与野生型IL-2相比,这些经修饰的IL-2剂对IL-2受体(例如IL-2Rβγ)具有降低的亲和力。
在一些实施方案中,在R38、F42、Y45和/或E62处具有突变的所述经修饰的IL-2信号传导剂能够诱导效应细胞的扩增,所述效应细胞包括CD8+T细胞和NK细胞而不是Treg细胞和/或内皮细胞。在一些实施方案中,在R38、F42、Y45和/或E62处具有突变的所述经修饰的IL-2信号传导剂相比野生型IL-2剂毒性更低。包含对IL-2Rα具有基本上降低的亲和力和/或活性的所述经修饰的IL-2剂的嵌合蛋白可以用于例如肿瘤学中。
在一些实施方案中,所述经修饰的IL-2剂在氨基酸残基D20处具有突变。举例来说,所述经修饰的IL-2剂可包含D20E、D20G、D20S、D20T或D20V。在一些实施方案中,与野生型IL-2剂相比,在D20处具有突变的经修饰的IL-2剂具有降低的毒性。在一些实施方案中,D20突变通过抑制内皮细胞的结合和激活来降低毒性。
在一些实施方案中,所述经修饰的IL-2剂在氨基酸C125处具有突变。举例来说,所述经修饰的IL-2剂可包含突变C125A。在一些实施方案中,在C125处具有突变的经修饰的IL-2剂优化了这种经修饰的IL-2剂的制备。在一些实施方案中,C125处的突变通过去除未配对的半胱氨酸残基促进了这种经修饰的IL-2剂的稳定性。在此类实施方案中,所述经修饰的IL-2剂可以对IL-2Rα具有基本上降低的亲和力和/或活性,如例如在Carmenate等人(2013)The Journal of Immunology,190:6230-6238中所描述,所述文献的全部公开内容特此以引用方式并入。
在其他实施方案中,所述经修饰的IL-2剂可以对IL-2Rβ具有基本上降低的亲和力和/或活性,如在例如WO 2016/025385中所描述,所述文献的全部公开内容特此以引用方式并入。在此类实施方案中,所述经修饰的IL-2剂可以诱导Treg细胞而不是效应细胞(诸如CD8+T细胞和NK细胞)的扩增。包含对IL-2Rβ具有基本上降低的亲和力和/或活性的所述经修饰的IL-2剂的嵌合蛋白可以例如用于治疗自身免疫性疾病中。在一些实施方案中,所述经修饰的IL-2剂可以在氨基酸残基N88处包含突变。举例来说,所述经修饰的IL-2剂可以包含N88A、N88D、N88G、N88H、N88Q或N88T。
在一些实施方案中,所述经修饰的IL-2信号传导剂包含SEQ ID NO:1的N端处Ala的缺失。在一些实施方案中,所述经修饰的IL-2剂包含SEQ ID NO:1的位置125处丝氨酸或丙氨酸取代半胱氨酸。在一些实施方案中,所述经修饰的IL-2剂包含SEQ ID NO:1的N端处Ala的缺失和位置125处丝氨酸或丙氨酸取代半胱氨酸。
在一些实施方案中,所述经修饰的IL-2对IL-2Rα和IL2Rβ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E/R38A/F42K、D20E/R38A/F42K/C125A、D20V/R38A/F42K、D20V/R38A/F42K/C125A、D20V/R38A/F42K/E62A、D20V/R38A/F42K/E62A/C125A、R38A/F42K/N88G、R38A/F42K/N88G/C125A、R38A/F42K/E62A/N88G和R38A/F42K/E62A/N88G/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rα和IL-2Rγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自R38A/F42K/Q126G、R38A/F42K/Q126I和R38A/F42K/Q126Y的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rβ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E、D20F、D20G、D20H、D20I、D20K、D20L、D20V、N88G、N88E、N88K、N88Q、N88V、D20E/C125A、D20F/C125A、D20G/C125A、D20H/C125A、D20I/C125A、D20L/C125A、D20K/C125A、D20N/C125A、D20S/C125A、D20T/C125A、D20V/C125A、N88A/C125A、N88D/C125A、N88G/C125A、N88E/C125A、N88H/C125A、N88I/C125A、N88K/C125A、N88Q/C125A、N88R/C125A、N88T/C125A和N88V/C125A的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自Q126A、Q126E、Q126F、Q126G、Q126H、Q126I、Q126K、Q126L、Q126N、Q126P、Q126R、Q126S、Q126T、Q126V、Q126W和Q126Y的一个或多个突变。
在一些实施方案中,所述经修饰的IL-2对IL-2Rβγ表现出降低的亲和力和/或活性,任选地其中所述经修饰的IL-2包含选自D20E/Q126A、D20E/Q126D、D20E/Q126E、D20E/Q126F、D20E/Q126G、D20E/Q126H、D20E/Q126I、D20E/Q126K、D20E/Q126L、D20E/Q126M、D20E/Q126N、D20E/Q126P、D20E/Q126R、D20E/Q126S、D20E/Q126T、D20E/Q126V、D20E/Q126W、D20E/Q126Y、D20V/Q126A、D20V/Q126D、D20V/Q126E、D20V/Q126F、D20V/Q126G、D20V/Q126H、D20V/Q126I、D20V/Q126K、D20V/Q126L、D20V/Q126M、D20V/Q126N、D20V/Q126P、D20V/Q126R、D20V/Q126S、D20V/Q126T、D20V/Q126V、D20V/Q126W、D20V/Q126Y、N88A/Q126A、N88A/Q126D、N88A/Q126E、N88A/Q126F、N88A/Q126G、N88A/Q126H、N88A/Q126I、N88A/Q126K、N88A/Q126L、N88A/Q126M、N88A/Q126N、N88A/Q126P、N88A/Q126R、N88A/Q126S、N88A/Q126T、N88A/Q126V、N88A/Q126W、N88A/Q126Y、N88G/Q126A、N88G/Q126D、N88G/Q126E、N88G/Q126F、N88G/Q126G、N88G/Q126H、N88G/Q126I、N88G/Q126K、N88G/Q126L、N88G/Q126M、N88G/Q126N、N88G/Q126P、N88G/Q126R、N88G/Q126S、N88G/Q126T、N88G/Q126V、N88G/Q126W和N88G/Q126Y的一个或多个突变。在另外的实施方案中,所述经修饰的IL-2对IL-2Rβγ表现出降低的亲和力和/或活性并且对激活的CD8细胞表现出增加的选择性。
新白细胞素
在一些实施方案中,所述经修饰的IL-2信号传导剂是经修饰的新白细胞素,其包含以下氨基酸序列:
在此类实施方案中,包含SEQ ID NO:2的经修饰的IL-2信号传导剂在氨基酸残基D15和/或N40处具有一个或多个突变。举例来说,在一些实施方案中,包含SEQ ID NO:2的经修饰的IL-2信号传导剂包含D15T、D15H、N40I、N40G或N40R。
在一些实施方案中,所述经修饰的IL-2信号传导剂包含与SEQ ID NO:1或2具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性(例如约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、或约99%序列同一性)的氨基酸序列。
在各个实施方案中,所述经修饰的IL-2经过修饰以具有一个或多个突变。在一些实施方案中,所述经修饰的IL-2经过修饰以具有一个或多个突变和一个或多个修饰(例如糖基化)。IL-2在位置3(T3)上含有苏氨酸O-糖基化位点。举例来说,在一些实施方案中,所述经修饰的IL-2信号传导剂包含T3 O-糖基化突变,其中所述突变是T3A、T3F、T3H、T3L、T3V和T3Y中的一者。在一些实施方案中,所述经修饰的IL-2信号传导剂包含T3 O-糖基化缺失突变,其中所述经修饰的IL-2序列的前3、4、5、6、7或8个残基缺失。
在一些实施方案中,所述一个或多个氨基酸突变可以独立地选自取代、插入、缺失和截短。
在一些实施方案中,所述氨基酸突变是氨基酸取代,并且可以包括保守和/或非保守取代。
可以例如基于在所涉及的氨基酸残基的极性、电荷、大小、溶解性、疏水性、亲水性和/或两亲特性方面的相似性进行“保守取代”。20种天然存在的氨基酸可以分组至以下六个标准氨基酸组中:(1)疏水性:Met、Ala、Val、Leu、Ile;(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;(3)酸性:Asp、Glu;(4)碱性:His、Lys、Arg;(5)影响链取向的残基:Gly、Pro;以及(6)芳香族:Trp、Tyr、Phe。
如本文所使用,“保守取代”定义为以上所示的六个标准氨基酸组中的同一组内所列出的一个氨基酸交换为另一个氨基酸。举例来说,Asp交换为Glu使得经如此修饰的多肽中保留一个负电荷。另外,基于甘氨酸和脯氨酸能够破坏α螺旋,它们可以彼此取代。
如本文所使用,“非保守取代”定义为以上所示的六个标准氨基酸组(1)至(6)中的不同组中所列出的一个氨基酸交换为另一个氨基酸。
在各个实施方案中,所述取代还可以包括非经典氨基酸(总体上例如硒代半胱氨酸、吡咯赖氨酸、N-甲酰基甲硫氨酸β-丙氨酸、GABA和δ-氨基乙酰丙酸、4-氨基苯甲酸(PABA)、常见氨基酸的D-异构体、2,4-二氨基丁酸、α-氨基异丁酸、4-氨基丁酸、Abu、2-氨基丁酸、γ-Abu、ε-Ahx、6-氨基己酸、Aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟基脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺基丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、环己基丙氨酸、β-丙氨酸、氟代氨基酸、设计师氨基酸诸如β甲基氨基酸、Cα-甲基氨基酸、Nα-甲基氨基酸和氨基酸类似物)。
在一些实施方案中,所述突变允许所述经修饰的IL-2相对于未突变的IL-2例如IL-2的野生型形式(例如SEQ ID NO:1)具有一种或多种减弱的活性,诸如降低的结合亲和力、降低的内源活性和降低的特异性生物活性中的一者或多者。举例来说,相对于未突变的IL-2例如IL-2的野生型形式(例如SEQ ID NO:1),所述一种或多种减弱的活性,诸如降低的结合亲和力、降低的内源活性和降低的特异性生物活性可以处在受体诸如IL-2Rαβγ处。结果,在各个实施方案中,所述突变允许所述经修饰的IL-2相对于未突变的IL-2(例如IL-2的野生型形式)具有降低的全身毒性、减少的副作用和减少的脱靶效应。
在一些实施方案中,所述经修饰的IL-2经过修饰以具有一个或多个降低其在治疗受体或靶受体处的结合亲和力或活性的突变。在一些实施方案中,所述经修饰的IL-2提供的活性是在治疗受体或靶受体处的激动作用(例如,激活治疗位点的细胞效应)或在治疗受体或靶受体处的拮抗作用(例如,减少或消除治疗位点的细胞效应)。举例来说,所述经修饰的IL-2可以激活治疗受体或靶受体。在此类实施方案中,所述突变使得所述经修饰的IL-2在所述治疗受体或靶受体处的激活活性被降低。
在一些实施方案中,与靶向部分连接能恢复所述治疗受体或靶受体处被降低的亲和力或活性。在其他实施方案中,与靶向部分连接基本上不能恢复所述治疗受体或靶受体处被降低的亲和力或活性。在各个实施方案中,本发明技术的嵌合蛋白减少了脱靶效应,因为所述经修饰的IL-2具有削弱在治疗受体或靶受体处的结合亲和力或活性的突变。在各个实施方案中,观察到副作用相对于例如野生型IL-2存在这种减少。在各个实施方案中,所述经修饰的IL-2对治疗活性位点的途径基本上无活性,并且其效应基本上针对特异性靶向的细胞类型,从而大大减少了不希望的副作用。
在各个实施方案中,所述经修饰的IL-2具有一个或多个突变,所述一个或多个突变致使所述经修饰的IL-2对一种或多种治疗受体具有减弱或降低的亲和力,例如,结合(例如K
在各个实施方案中,所述经修饰的IL-2相对于野生型IL-2对治疗受体或靶受体(例如IL-2Rαβγ或IL-2Rβγ或它们的亚单位IL-2Rα、IL-2Rβ和/或IL-2Rγ中的任一者)具有约1%、或约3%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%,或约10%-20%、约20%-40%、约50%、约40%-60%、约60%-80%、约80%-100%的亲和力。在一些实施方案中,相对于所述野生型IL-2,所述结合亲和力至少低约2倍、低约3倍、低约4倍、低约5倍、低约6倍、低约7倍、低约8倍、低约9倍、低至少约10倍、低至少约15倍、低至少约20倍、低至少约25倍、低至少约30倍、低至少约35倍、低至少约40倍、低至少约45倍、低至少约50倍、低至少约100倍、低至少约150倍,或低约10-50倍、低约50-100倍、低约100-150倍、低约150-200倍或低超过200倍。
可以使用本领域中已知的方法来测量受体结合活性。举例来说,可以通过对结合数据进行斯卡查德图分析和计算机拟合(例如Scatchard,The attractions of proteinsfor small molecules and ions.Ann NY Acad Sci 51:660-672,1949)或通过如Brecht等人Biosens Bioelectron 1993;8:387-392所描述在流经条件下进行反射干涉光谱法来评定亲和力和/或结合活性,所有文献的全部内容特此以引用方式并入。在一些实施方案中,通过生物层干涉法(BLI)测量受体结合活性。
在各个实施方案中,治疗受体或靶受体处减弱的活性、治疗受体或靶受体处减弱的亲和力可通过连接至对治疗活性位点处的抗原具有高亲和力的靶向部分(例如本文所描述的抗体或抗体形式)而恢复。通过将经修饰的IL-2连接至靶向部分来实现靶向。在一个实施方案中,所述经修饰的IL-2经由其氨基端连接至靶向部分。在另一个实施方案中,所述经修饰的IL-2具有其羧基端连接至靶向部分。以这种方式,在一些实施方案中,本发明的嵌合蛋白在治疗受体或靶受体处提供定位的、中靶的且受控的治疗作用。
在各个实施方案中,经修饰的IL-2在治疗受体或靶受体处的活性通过连接至对治疗活性位点处的抗原具有高亲和力的靶向部分(例如本文所描述的抗体或抗体形式)而增强。通过将经修饰的IL-2连接至靶向部分来实现靶向。在一个实施方案中,所述经修饰的IL-2经由其氨基端连接至靶向部分。在另一个实施方案中,所述经修饰的IL-2具有其羧基端连接至靶向部分。以这种方式,在一些实施方案中,本发明的嵌合蛋白在治疗受体或靶受体处提供定位的、中靶的且受控的治疗作用。
包含白介素或其变体的治疗剂
在多个实施方案中,本发明提供了嵌合蛋白或蛋白复合物,所述嵌合蛋白或蛋白复合物包含一个或多个结合至以下靶标中的一者或多者的靶向部分:CD8、CTLA4、CD3、CD4、DNAM-1、Nrp1(神经纤毛蛋白)、TNFR1、TNFR2、GITR、ICOS、CD20、CD70、Clec9a、NKp46、PD-1、PD-L1、PD-L2、SIRP1α、FAP、XCR1、肌腱蛋白和ECM蛋白。
靶向部分细胞募集
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物另外包含一个或多个靶向部分,所述一个或多个靶向部分具有特异性地结合至目标靶标(例如抗原、受体)的识别结构域。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可包含两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个靶向部分。在说明性实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含两个或更多个靶向部分。在此类实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以靶向两种不同的细胞(例如,以形成突触)或相同的细胞(例如,以得到更浓的信号传导剂效果)的靶向部分。
在一些实施方案中,所述目标靶标(例如抗原、受体)针对免疫细胞和/或器官细胞和/或组织细胞。
在各个实施方案中,所述目标靶标(例如抗原、受体)可见于一个或多个免疫细胞上,所述免疫细胞可以包括但不限于T细胞、细胞毒性T淋巴细胞、T辅助细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、抗肿瘤或肿瘤相关巨噬细胞(例如M1或M2巨噬细胞)、B细胞、Breg细胞、树突状细胞或它们的子集。在一些实施方案中,所述识别结构域特异性地结合至目标靶标(例如抗原、受体)并且有效地直接或间接地募集一种或多种免疫细胞。在一些实施方案中,所述目标靶标(例如抗原、受体)可见于一种或多种肿瘤细胞上。在一些实施方案中,所述目标靶标(例如抗原、受体)可见于肿瘤新生血管之上或之内。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以直接或间接地募集免疫细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以直接或间接地将免疫细胞,例如可以杀死和/或阻抑肿瘤细胞的免疫细胞募集至作用位点(作为非限制性实例,诸如肿瘤微环境)。
在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物存在具有特异性地结合至作为非细胞结构的一部分的靶标(例如抗原、受体)的识别结构域的靶向部分。在一些实施方案中,所述抗原或受体不是完整细胞或细胞结构的组成组分。在一些实施方案中,所述抗原或受体是细胞外抗原或受体。在一些实施方案中,所述靶标是非蛋白质非细胞标记物,包括但不限于核酸,包括DNA或RNA,诸如例如从坏死的肿瘤细胞或细胞外沉积物诸如胆固醇释放的DNA。
在一些实施方案中,目标靶标(例如抗原、受体)是基质或细胞外基质(ECM)的非细胞组分的一部分或与所述非细胞组分相关的标记物。如本文所使用,基质是指组织或器官的连接和支撑构架。基质可以包括细胞诸如成纤维细胞/成肌纤维细胞、神经胶质、上皮、脂肪、免疫、血管、平滑肌和免疫细胞以及细胞外基质(ECM)和细胞外分子的汇集。在各个实施方案中,目标靶标(例如抗原、受体)是基质诸如细胞外基质和细胞外分子的非细胞组分的一部分。如本文所使用,ECM是指所有组织和器官内存在的非细胞组分。ECM是由生物化学上独特的组分,包括但不限于蛋白质、糖蛋白、蛋白聚糖和多糖的大集合构成。ECM的这些组分通常由相邻的细胞产生并且经由胞吐作用分泌至ECM中。一旦分泌后,ECM组分便往往聚集而形成复杂的巨分子网状结构。在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白嵌合蛋白包含识别位于ECM的任何组分上的靶标(例如抗原或受体或非蛋白质分子)的靶向部分。ECM的说明性组分包括但不限于蛋白聚糖、非蛋白聚糖多糖、纤维和其他ECM蛋白质或ECM非蛋白质,例如多糖和/或脂质,或ECM相关分子(例如蛋白质或非蛋白质,例如多糖、核酸和/或脂质)。
在一些实施方案中,所述靶向部分识别ECM蛋白聚糖上的靶标(例如抗原、受体)。蛋白聚糖是糖基化的蛋白质。碱性蛋白聚糖单元包括具有一个或多个共价连接的糖胺聚糖(GAG)链的核心蛋白质。蛋白聚糖具有净负电荷,由此吸引带正电的钠离子(Na+),后者经由渗透作用吸引水分子,从而保持ECM和驻留细胞含水。蛋白聚糖还可能有助于捕获和存储ECM内的生长因子。本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以靶向的说明性蛋白聚糖包括但不限于硫酸乙酰肝素、硫酸软骨素和硫酸角质素。在一个实施方案中,所述靶向部分识别非蛋白聚糖多糖诸如透明质酸上的靶标(例如抗原、受体)。
在一些实施方案中,所述靶向部分识别ECM纤维上的靶标(例如抗原、受体)。ECM纤维包括胶原蛋白纤维和弹性蛋白纤维。在一些实施方案中,所述靶向部分识别胶原蛋白或胶原蛋白纤维上的一个或多个表位。胶原蛋白是ECM中最丰富的蛋白质。胶原蛋白呈纤维状蛋白形式存在于ECM中并且提供结构支撑以驻留细胞。在一个或多个实施方案中,所述靶向部分识别并且结合至ECM内存在的各种类型的胶原蛋白,包括但不限于纤维状胶原蛋白(I型、II型、III型、V型、XI型)、间杂有三螺旋的原纤维相关的胶原蛋白(facit collagen)(IX型、XII型、XIV型)、短链胶原蛋白(VIII型、X型)、基底膜胶原蛋白(IV型)和/或VI型、VII型或XIII型胶原蛋白。弹性蛋白纤维给组织提供弹性,允许它们在需要时拉伸然后回到它们的原始状态。在一些实施方案中,所述靶向部分识别弹性蛋白或弹性蛋白纤维上的一个或多个表位。
在一些实施方案中,所述靶向部分识别一种或多种ECM蛋白质,包括但不限于肌腱蛋白、纤连蛋白、纤维蛋白、层粘连蛋白(laminin)或巢蛋白(nidogen)/内联蛋白(entactin)。
在一个实施方案中,所述靶向部分识别并结合至肌腱蛋白。肌腱蛋白(TN)家族的糖蛋白包括至少四个成员,即肌腱蛋白C、肌腱蛋白R、肌腱蛋白X和肌腱蛋白W。肌腱蛋白的一级结构包括若干个共同基序,所述基序按顺序处于同一连续序列中:氨基端七价重复序列、表皮生长因子(EGF)样重复序列、纤连蛋白III型结构域重复序列和羧基端纤维蛋白原样球形结构域。每一个蛋白质成员与EGF样重复序列和纤连蛋白III型重复序列的数目和特性的典型变异相关。同种型变体还特别相对于肌腱蛋白C存在。已知肌腱蛋白C的超过27种剪接变体和/或同种型。在特定实施方案中,所述靶向部分识别并结合至肌腱蛋白CA1。类似地,肌腱蛋白R还具有不同的剪接变体和同种型。肌腱蛋白R通常呈二聚体或三聚体形式存在。肌腱蛋白X是肌腱蛋白家族中最大的成员,并且已知呈三聚体形式存在。肌腱蛋白W呈三聚体形式存在。在一些实施方案中,所述靶向部分识别肌腱蛋白上的一个或多个表位。在一些实施方案中,所述靶向部分识别肌腱蛋白的单体和/或二聚体和/或三聚体和/或六聚体形式。
在一个实施方案中,所述靶向部分识别并结合至纤连蛋白。纤连蛋白是连接细胞与ECM中的胶原蛋白纤维,从而允许细胞移动通过ECM的糖蛋白。在结合至整合素后,纤连蛋白展开从而形成功能二聚体。在一些实施方案中,所述靶向部分识别纤连蛋白的单体和/或二聚体形式。在一些实施方案中,所述靶向部分识别纤连蛋白上的一个或多个表位。在说明性实施方案中,所述靶向部分识别纤连蛋白细胞外结构域A(EDA)或纤连蛋白细胞外结构域B(EDB)。EDA水平升高与各种疾病和病症相关,所述疾病和病症包括牛皮癣、类风湿性关节炎、糖尿病和癌症。在一些实施方案中,所述靶向部分识别含有EDA同种型的纤连蛋白,并且可以用于使所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物靶向病变细胞,包括癌细胞。在一些实施方案中,所述靶向部分识别含有EDB同种型的纤连蛋白。在各个实施方案中,此类靶向部分可以用于使所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物靶向肿瘤细胞,包括肿瘤新生血管。
在一个实施方案中,所述靶向部分识别并结合至纤维蛋白。纤维蛋白是ECM的基质网状结构中经常发现的另一种蛋白质物质。纤维蛋白是由于纤维蛋白原上引起纤维蛋白聚合的蛋白酶凝血酶的作用而形成。在一些实施方案中,所述靶向部分识别纤维蛋白上的一个或多个表位。在一些实施方案中,所述靶向部分识别纤维蛋白的单体以及聚合形式。
在一个实施方案中,所述靶向部分识别并结合至层粘连蛋白。层粘连蛋白是基底层的主要组分,所述基底层是细胞和器官的蛋白质网状结构的基础。层粘连蛋白是含有α链、β链和γ链的异源三聚体蛋白。在一些实施方案中,所述靶向部分识别层粘连蛋白上的一个或多个表位。在一些实施方案中,所述靶向部分识别层粘连蛋白的单体、二聚体以及三聚体形式。
在一个实施方案中,所述靶向部分识别并结合至巢蛋白或内联蛋白。巢蛋白/内联蛋白是高度保守的硫酸化糖蛋白家族。它们组成了基底膜的主要结构组分,并且功能是连接基底膜中的层粘连蛋白与胶原蛋白IV网状结构。这个家族的成员包括巢蛋白-1和巢蛋白-2。在各个实施方案中,所述靶向部分识别巢蛋白-1和/或巢蛋白-2上的表位。
在各个实施方案中,所述靶向部分包含识别本文所描述的靶标中的任一者上存在的表位的抗原识别结构域。在一个实施方案中,所述抗原识别结构域识别所述蛋白质上存在的一个或多个线性表位。如本文所使用,线性表位是指所述蛋白质上存在的任何连续氨基酸序列。在另一个实施方案中,所述抗原识别结构域识别所述蛋白质上存在的一个或多个构象表位。如本文所使用,构象表位是指形成具有能够被抗原识别结构域识别的特征和/或形状和/或三级结构的三维表面的一个或多个氨基酸区段(可能是不连续的)。
在各个实施方案中,所述靶向部分可以结合至本文所描述的靶标中的任一者的全长和/或成熟形式和/或同种型和/或剪接变体和/或片段和/或任何其他天然存在的或合成的类似物、变体或突变体。在各个实施方案中,所述靶向部分可以结合至本文所描述的蛋白质的任何形式,包括单体、二聚体、三聚体、四聚体、异源二聚体、多聚体和缔合形式。在各个实施方案中,所述靶向部分可以结合至本文所描述的蛋白质的任何翻译修饰后的形式,诸如糖基化和/或磷酸化形式。
在各个实施方案中,所述靶向部分包含识别细胞外分子诸如DNA的抗原识别结构域。在一些实施方案中,所述靶向部分包含识别DNA的抗原识别结构域。在一个实施方案中,所述DNA从坏死或凋亡的肿瘤细胞或其他病变细胞脱落至细胞外间隙中。
在各个实施方案中,所述靶向部分包含识别一个或多个与动脉粥样硬化斑块相关的非细胞结构的抗原识别结构域。已知两种类型的动脉粥样硬化斑块。纤维脂质(纤维脂肪)斑块的特征是载满脂质的细胞积聚在动脉内膜下面。内皮下面有覆盖所述斑块的动脉粥样化核心的纤维帽。所述核心包括具有升高的组织胆固醇和胆固醇酯含量的载满脂质的细胞(巨噬细胞和平滑肌细胞)、纤维蛋白、蛋白聚糖、胶原蛋白、弹性蛋白和细胞碎屑。在晚期斑块中,所述斑块的中心核心通常含有细胞外胆固醇沉积物(从死细胞释放),所述细胞外胆固醇沉积物形成具有中空针样裂缝的胆固醇晶体的区域。在所述斑块外围是较年轻的泡沫状细胞和毛细管。纤维性斑块还局部化在内膜下、在动脉壁内,从而引起壁变厚和膨胀,并且有时引起内腔的多斑局部化变窄与一定程度的肌肉层萎缩。纤维性斑块含有胶原蛋白纤维(嗜酸性),使钙(嗜苏木精性)和载满脂质的细胞沉淀。在一些实施方案中,所述靶向部分识别并结合至这些斑块的一种或多种非细胞组分,诸如纤维蛋白、蛋白聚糖、胶原蛋白、弹性蛋白、细胞碎屑和钙或其他无机沉积物或沉淀物。在一些实施方案中,所述细胞碎屑是从死细胞释放的核酸,例如DNA或RNA。
在各个实施方案中,所述靶向部分包含识别与神经退行性疾病相关的脑斑块中发现的一个或多个非细胞结构的抗原识别结构域。在一些实施方案中,所述靶向部分识别并结合至位于阿尔茨海默氏病患者脑中发现的淀粉样斑块中的一个或多个非细胞结构。举例来说,所述靶向部分可以识别并且结合至作为淀粉样斑块的主要组分的肽淀粉样β。在一些实施方案中,所述靶向部分识别并结合至位于亨延顿氏病患者中发现的脑斑块中的一个或多个非细胞结构。在各个实施方案中,所述靶向部分识别并结合至与其他神经退行性或肌肉骨骼疾病诸如路易体痴呆和包涵体肌炎相关的斑块中发现的一个或多个非细胞结构。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以具有两个或更多个结合至非细胞结构的靶向部分。在一些实施方案中,存在两个靶向部分,一个靶向部分靶向细胞,而另一个靶向部分靶向非细胞结构。在各个实施方案中,所述靶向部分可以直接或间接地募集细胞,诸如疾病细胞和/或效应细胞。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物能够或可用于涉及改变有利于肿瘤的免疫攻击的免疫细胞平衡的方法中。举例来说,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以改变临床重要位点处的免疫细胞比率,从而有利于可以杀死和/或阻抑肿瘤的细胞(例如T细胞、细胞毒性T淋巴细胞、T辅助细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、抗肿瘤巨噬细胞(例如M1巨噬细胞)、B细胞、树突状细胞或它们的子集),并且对抗保护肿瘤的细胞(例如骨髓来源的阻抑细胞(MDSC)、调控T细胞(Treg)、肿瘤相关嗜中性粒细胞(TAN)、M2巨噬细胞、肿瘤相关巨噬细胞(TAM)或它们的子集)。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物能够增加效应T细胞与调控T细胞的比率。
举例来说,在一些实施方案中,所述识别结构域特异性地结合至与T细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集T细胞。在一个实施方案中,所述识别结构域特异性地结合至效应T细胞。在一些实施方案中,所述识别结构域直接或间接地募集效应T细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。说明性效应T细胞包括细胞毒性T细胞(例如αβTCR、CD3
说明性目标T细胞抗原包括例如(并且在适当时包括细胞外结构域):CD8、CD3、SLAMF4、IL-2Rα、4-1BB/TNFRSF9、IL-2 Rβ、ALCAM、B7-1、IL-4 R、B7-H3、BLAME/SLAMFS、CEACAM1、IL-6 R、CCR3、IL-7 Rα、CCR4、CXCR1/IL-S RA、CCR5、CCR6、IL-10Rα、CCR 7、IL-10Rβ、CCRS、IL-12 Rβ1、CCR9、IL-12R β2、CD2、IL-13 Rα1、IL-13、CD3、CD4、ILT2/CDS5j、ILT3/CDS5k、ILT4/CDS5d、ILT5/CDS5a、鲁特格林(lutegrin)α4/CD49d、CDS、整合素αE/CD103、CD6、整合素αM/CD 11 b、CDS、整合素αX/CD11c、整合素β2/CD1S、KIR/CD15S、CD27/TNFRSF7、KIR2DL1、CD2S、KIR2DL3、CD30/TNFRSFS、KIR2DL4/CD15Sd、CD31/PECAM-1、KIR2DS4、CD40配体/TNFSF5、LAG-3、CD43、LAIR1、CD45、LAIR2、CDS3、白三烯B4-R1、CDS4/SLAMF5、NCAM-L1、CD94、NKG2A、CD97、NKG2C、CD229/SLAMF3、NKG2D、CD2F-10/SLAMF9、NT-4、CD69、NTB-A/SLAMF6、共同γ链/IL-2 Rγ、骨调素、CRACC/SLAMF7、PD-1、CRTAM、PSGL-1、CTLA-4、RANK/TNFRSF11A、CX3CR1、CX3CL1、L-选择素、CXCR3、SIRPβ1、CXCR4、SLAM、CXCR6、TCCR/WSX-1、DNAM-1、促胸腺生成素、EMMPRIN/CD147、TIM-1、EphB6、TIM-2、Fas/TNFRSF6、TIM-3、Fas配体/TNFSF6、TIM-4、FcγRIII/CD16、TIM-6、TNFR1/TNFRSF1A、粒溶素、TNF RIII/TNFRSF1B、TRAIL R1/TNFRSF1OA、ICAM-1/CD54、TRAIL R2/TNFRSF 10B、ICAM-2/CD102、TRAILR3/TNFRSF10C、IFN-γR1、TRAILR4/INFRSF10D、IFN-γR2、TSLP、IL-1 R1和TSLP R。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性T细胞抗原中的一者或多者。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含针对T细胞上表达的检查点标记物,例如PD-1、PD-L1、CD28、CTLA4、ICOS、BTLA、KIR、LAG3、CD137、OX40、CD27、CD40L、TIM3和A2aR中的一者或多者的靶向部分。
举例来说,在一些实施方案中,所述识别结构域特异性地结合至与B细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集B细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。说明性目标B细胞抗原包括例如CD10、CD19、CD20、CD21、CD22、CD23、CD24、CD37、CD38、CD39、CD40、CD70、CD72、CD73、CD74、CDw75、CDw76、CD77、CD78、CD79a/b、CD80、CD81、CD82、CD83、CD84、CD85、CD86、CD89、CD98、CD126、CD127、CDw130、CD138、CDw150、CS1和B细胞成熟抗原(BCMA)。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性B细胞抗原中的一者或多者。
作为另一个实例,在一些实施方案中,所述识别结构域特异性地结合至与自然杀伤细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集自然杀伤细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。说明性目标自然杀伤细胞抗原包括例如TIGIT、2B4/SLAMF4、KIR2DS4、CD155/PVR、KIR3DL1、CD94、LMIR1/CD300A、CD69、LMIR2/CD300c、CRACC/SLAMF7、LMIR3/CD300LF、DNAM-1、LMIR5/CD300LB、Fc-εRII、LMIR6/CD300LE、Fc-γR1/CD64、MICA、Fc-γRIIB/CD32b、MICB、Fc-γRIIC/CD32c、MULT-1、Fc-γRIIA/CD32a、结合素-2/CD112、Fc-γRIII/CD16、NKG2A、FcRH1/IRTA5、NKG2C、FcRH2/IRTA4、NKG2D、FcRH4/IRTA1、NKp30、FcRH5/IRTA2、NKp44、Fc受体样蛋白3/CD16-2、NKp46/NCR1、NKp80/KLRF1、NTB-A/SLAMF6、Rae-1、Rae-1α、Rae-1β、Rae-1δ、H60、Rae-1ε、ILT2/CD85j、Rae-1γ、ILT3/CD85k、TREM-1、ILT4/CD85d、TREM-2、ILT5/CD85a、TREM-3、KIR/CD158、TREML1/TLT-1、KIR2DL1、ULBP-1、KIR2DL3、ULBP-2、KIR2DL4/CD158d和ULBP-3。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性NK细胞抗原中的一者或多者。
而且,在一些实施方案中,所述识别结构域特异性地结合至与巨噬细胞/单核细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集巨噬细胞/单核细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。说明性目标巨噬细胞/单核细胞抗原包括例如SIRP1a、B7-1/CD80、ILT4/CD85d、B7-H1、ILT5/CD85a、共同β链、整合素α4/CD49d、BLAME/SLAMF8、整合素αX/CD11c、CCL6/C10、整合素β2/CD18、CD155/PVR、整合素β3/CD61、CD31/PECAM-1、胶乳素、CD36/SR-B3、白三烯B4 R1、CD40/TNFRSF5、LIMPIIISR-B2、CD43、LMIR1/CD300A、CD45、LMIR2/CD300c、CD68、LMIR3/CD300LF、CD84/SLAMF5、LMIR5/CD300LB、CD97、LMIR6/CD300LE、CD163、LRP-1、CD2F-10/SLAMF9、MARCO、CRACC/SLAMF7、MD-1、ECF-L、MD-2、EMMPRIN/CD147、MGL2、内皮素/CD105、骨激活素/GPNMB、Fc-γRI/CD64、骨调素、Fc-γRIIB/CD32b、PD-L2、Fc-γRIIC/CD32c、Siglec-3/CD33、Fc-γRIIA/CD32a、SIGNR1/CD209、Fc-γRIII/CD16、SLAM、GM-CSF Rα、TCCR/WSX-1、ICAM-2/CD102、TLR3、IFN-γR1、TLR4、IFN-γR2、TREM-1、IL-1 RII、TREM-2、ILT2/CD85j、TREM-3、ILT3/CD85k、TREML1/TLT-1、2B4/SLAMF 4、IL-10Rα、ALCAM、IL-10 Rβ、氨基肽酶N/ANPEP、ILT2/CD85j、共同β链、ILT3/CD85k、Clq R1/CD93、ILT4/CD85d、CCR1、ILT5/CD85a、CCR2、整合素α4/CD49d、CCR5、整合素αM/CDll b、CCR8、整合素αX/CDllc、CD155/PVR、整合素β2/CD18、CD14、整合素β3/CD61、CD36/SR-B3、LAIR1、CD43、LAIR2、CD45、白三烯B4-R1、CD68、LIMPIIISR-B2、CD84/SLAMF5、LMIR1/CD300A、CD97、LMIR2/CD300c、LMIR3/CD300LF、凝血因子III/组织因子、LMIR5/CD300LB、CX3CR1、CX3CL1、LMIR6/CD300LE、CXCR4、LRP-1、CXCR6、M-CSF R、DEP-1/CD148、MD-1、DNAM-1、MD-2、EMMPRIN/CD147、MMR、内皮素/CD105、NCAM-L1、Fc-γRI/CD64、PSGL-1、Fc-γRIIIICD16、RP105、G-CSF R、L-选择素、GM-CSF Rα、Siglec-3/CD33、HVEM/TNFRSF14、SLAM、ICAM-1/CD54、TCCR/WSX-1、ICAM-2/CD102、TREM-1、IL-6R、TREM-2、CXCR1/IL-8RA、TREM-3和TREML1/TLT-1。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性巨噬细胞/单核细胞抗原中的一者或多者。
而且,在一些实施方案中,所述识别结构域特异性地结合至与树突状细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集树突状细胞,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。说明性目标树突状细胞抗原包括例如CLEC9A、XCR1、RANK、CD36/SRB3、LOX-1/SR-E1、CD68、MARCO、CD163、SR-A1/MSR、CD5L、SREC-1、CL-P1/COLEC12、SREC-II、LIMPIIISRB2、RP105、TLR4、TLR1、TLR5、TLR2、TLR6、TLR3、TLR9、4-IBB配体/TNFSF9、IL-12/IL-23 p40、4-氨基-1,8-萘二甲酰胺、ILT2/CD85j、CCL21/6Ckine、ILT3/CD85k、8-氧代-dG、ILT4/CD85d、8D6A、ILT5/CD85a、A2B5、鲁特格林α4/CD49d、Aag、整合素β2/CD18、AMICA、朗格汉斯蛋白(Langerin)、B7-2/CD86、白三烯B4R1、B7-H3、LMIR1/CD300A、BLAME/SLAMF8、LMIR2/CD300c、Clq R1/CD93、LMIR3/CD300LF、CCR6、LMIR5/CD300LB CCR7、LMIR6/CD300LE、CD40/TNFRSF5、MAG/Siglec-4-a、CD43、MCAM、CD45、MD-1、CD68、MD-2、CD83、MDL-1/CLEC5A、CD84/SLAMF5、MMR、CD97、NCAML1、CD2F-10/SLAMF9、骨激活素GPNMB、Chern23、PD-L2、CLEC-1、RP105、CLEC-2、CLEC-8、Siglec-2/CD22、CRACC/SLAMF7、Siglec-3/CD33、DC-SIGN、Siglec-5、DC-SIGNR/CD299、Siglec-6、DCAR、Siglec-7、DCIR/CLEC4A、Siglec-9、DEC-205、Siglec-10、Dectin-1/CLEC7A、Siglec-F、Dectin-2/CLEC6A、SIGNR1/CD209、DEP-1/CD148、SIGNR4、DLEC/CLEC4C、SLAM、EMMPRIN/CD147、TCCR/WSX-1、Fc-γR1/CD64、TLR3、Fc-γRIIB/CD32b、TREM-1、Fc-γRIIC/CD32c、TREM-2、Fc-γRIIA/CD32a、TREM-3、Fc-γRIII/CD16、TREML1/TLT-1、ICAM-2/CD102和辣椒素R1。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性DC抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至选自但不限于巨核细胞、血小板、红细胞、肥大细胞、嗜碱性粒细胞、嗜中性粒细胞、骨髓细胞、单核细胞、嗜酸性粒细胞或它们的子集的免疫细胞上的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集巨核细胞、血小板、红细胞、肥大细胞、嗜碱性粒细胞、嗜中性粒细胞、骨髓细胞、单核细胞、嗜酸性粒细胞或它们的子集,例如,在一些实施方案中,募集至治疗位点(例如,具有一个或多个疾病细胞或者为了治疗效果而加以调节的细胞的位置)。在一些实施方案中,所述免疫细胞选自T细胞、B细胞、树突状细胞、巨噬细胞、中性粒细胞、肥大细胞、单核细胞、红细胞、骨髓细胞、骨髓来源的阻抑细胞、NKT细胞和NK细胞,或它们的衍生物。在一些实施方案中,所述免疫细胞是T细胞并且所述靶向部分靶向CD8。在一些实施方案中,所述免疫细胞是Treg并且所述靶向部分靶向CTLA4。在一些实施方案中,所述免疫细胞是NK细胞并且所述靶向部分是NKp46。
在一些实施方案中,所述识别结构域特异性地结合至与巨核细胞和/或血小板相关的靶标(例如抗原、受体)。说明性目标巨核细胞和/或血小板抗原包括例如GP IIb/IIIa、GPIb、vWF、PF4和TSP。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性巨核细胞和/或血小板抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至与红细胞相关的靶标(例如抗原、受体)。说明性目标红细胞抗原包括例如CD34、CD36、CD38、CD41a(血小板糖蛋白IIb/IIIa)、CD41b(GPIIb)、CD71(转铁蛋白受体)、CD105、血型糖蛋白A、血型糖蛋白C、c-kit、HLA-DR、H2(MHC-II)和恒河猴抗原。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些说明性红细胞抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至与肥大细胞相关的靶标(例如抗原、受体)。说明性目标肥大细胞抗原包括例如SCFR/CD117、FcεRI、CD2、CD25、CD35、CD88、CD203c、C5R1、CMA1、FCER1A、FCER2、TPSAB1。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些肥大细胞抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至与嗜碱性粒细胞相关的靶标(例如抗原、受体)。说明性目标嗜碱性粒细胞抗原包括例如FcεRI、CD203c、CD123、CD13、CD107a、CD107b和CD164。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些嗜碱性粒细胞抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至与嗜中性粒细胞相关的靶标(例如抗原、受体)。说明性目标嗜中性粒细胞抗原包括例如7D5、CD10/CALLA、CD13、CD16(FcRIII)、CD18蛋白(LFA-1、CR3和p150、95)、CD45、CD67和CD177。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些嗜中性粒细胞抗原中的一者或多者。
在一些实施方案中,所述识别结构域特异性地结合至与嗜酸性粒细胞相关的靶标(例如抗原、受体)。说明性目标嗜酸性粒细胞抗原包括例如CD35、CD44和CD69。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些嗜酸性粒细胞抗原中的一者或多者。
在各个实施方案中,所述识别结构域可以结合至本领域技术人员已知的任何适当靶标、抗原、受体或细胞表面标记物。在一些实施方案中,所述抗原或细胞表面标记物是组织特异性标记物。说明性组织特异性标记物包括但不限于内皮细胞表面标记物,诸如ACE、CD14、CD34、CDH5、ENG、ICAM2、MCAM、NOS3、PECAM1、PROCR、SELE、SELP、TEK、THBD、VCAM1、VWF;平滑肌细胞表面标记物,诸如ACTA2、MYH1O、MYH11、MYH9、MYOCD;成纤维细胞(基质)细胞表面标记物,诸如ALCAM、CD34、COL1A1、COL1A2、COL3A1、FAP、PH-4;上皮细胞表面标记物,诸如CD1D、K6IRS2、KRT1O、KRT13、KRT17、KRT18、KRT19、KRT4、KRT5、KRT8、MUC1、TACSTD1;新生血管标记物,诸如CD13、TFNA、α-vβ-3(α
在一些实施方案中,所述识别结构域特异性地结合至与肿瘤细胞相关的靶标(例如抗原、受体)。在一些实施方案中,所述识别结构域直接或间接地募集肿瘤细胞。举例来说,在一些实施方案中,将肿瘤细胞直接或间接地募集至可以杀死和/或阻抑肿瘤细胞的一个或多个效应细胞(例如本文所描述的免疫细胞)。
肿瘤细胞或癌细胞是指细胞或组织的不受控制的生长和/或细胞存活时间的异常增加和/或对干扰身体器官和系统的正常功能的细胞凋亡的抑制。举例来说,肿瘤细胞包括良性和恶性癌症、息肉、增生以及休眠肿瘤或微转移。说明性肿瘤细胞包括但不限于以下的细胞:基底细胞癌、胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈癌;胃癌(包括胃肠癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾脏癌或肾癌;喉癌;白血病;肝癌;肺癌(例如小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状细胞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金氏淋巴瘤和非霍奇金氏淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金氏淋巴瘤(NHL);小淋巴细胞性(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞性NHL;高级成淋巴细胞性NHL;高级小非核裂细胞NHL;巨大肿块性NHL(bulky disease NHL);套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦巨球蛋白血症(Waldenstrom′s Macroglobulinemia);慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞性白血病;慢性成髓细胞性白血病;以及其他癌瘤和肉瘤:和移植后淋巴组织增生性病症(PTLD),以及与斑痣性错构瘤相关的异常血管增生、水肿(例如,与脑肿瘤相关的水肿)和梅格斯氏综合征(Meigs’syndrome)。
肿瘤细胞或癌细胞还包括但不限于癌瘤,例如各种亚型,包括例如腺癌、基底细胞癌、鳞状细胞癌和移行细胞癌)、肉瘤(包括例如骨和软组织)、白血病(包括例如急性骨髓性、急性成淋巴细胞性、慢性骨髓性、慢性淋巴细胞性和毛细胞)、淋巴瘤和骨髓瘤(包括例如霍奇金氏和非霍奇金氏淋巴瘤、轻链、非分泌性、MGUS和浆细胞瘤)和中枢神经系统癌症(包括例如脑(例如神经胶质瘤(例如星形细胞瘤、寡枝神经胶质瘤和室管膜瘤)、脑膜瘤、垂体腺瘤和神经瘤和脊髓肿瘤(例如脑膜瘤和纤维神经瘤)。
说明性肿瘤抗原包括但不限于MART-1/Melan-A、gp100、二肽基肽酶IV(DPPIV)、腺苷脱氨酶结合蛋白(ADAbp)、亲环蛋白b、结肠直肠相关抗原(CRC)-0017-1A/GA733、癌胚抗原(CEA)及其免疫原性表位CAP-1和CAP-2、etv6、aml1、前列腺特异性抗原(PSA)及其免疫原性表位PSA-1、PSA-2和PSA-3、前列腺特异性膜抗原(PSMA)、T细胞受体/CD3-ζ链、MAGE家族肿瘤抗原(例如MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A5、MAGE-A6、MAGE-A7、MAGE-A8、MAGE-A9、MAGE-A10、MAGE-A11、MAGE-A12、MAGE-Xp2(MAGE-B2)、MAGE-Xp3(MAGE-B3)、MAGE-Xp4(MAGE-B4)、MAGE-C1、MAGE-C2、MAGE-C3、MAGE-C4、MAGE-C5)、GAGE家族肿瘤抗原(例如GAGE-1、GAGE-2、GAGE-3、GAGE-4、GAGE-5、GAGE-6、GAGE-7、GAGE-8、GAGE-9)、BAGE、RAGE、LAGE-1、NAG、GnT-V、MUM-1、CDK4、酪氨酸酶、p53、MUC家族、HER2/neu、p21ras、RCAS1、α-胎儿球蛋白、E-钙粘蛋白、α-连锁蛋白、β-连锁蛋白和γ-连锁蛋白、p120ctn、gp100 Pmel117、PRAME、NY-ESO-1、cdc27、腺瘤性结肠息肉病蛋白(APC)、胞衬蛋白、连接蛋白37、Ig独特型、p15、gp75、GM2和GD2神经节苷脂、病毒产物诸如人乳头状瘤病毒蛋白、Smad家族肿瘤抗原、1mp-1、NA、EBV编码的核抗原(EBNA)-1、脑糖原磷酸化酶、SSX-1、SSX-2(HOM-MEL-40)、SSX-1、SSX-4、SSX-5、SCP-1CT-7、c-erbB-2、CD19、CD20、CD22、CD30、CD33、CD37、CD47、CS1、CD38、ASGPR、CD56、CD70、CD74、CD138、AGS16、MUC1、GPNMB、Ep-CAM、PD-L1、PD-L2、PMSA和BCMA(TNFRSF17)。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分结合这些肿瘤抗原中的一者或多者。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物结合至HER2。在另一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物结合至PD-L2。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对选自T细胞、B细胞、树突状细胞、嗜中性粒细胞、骨髓来源的阻抑细胞、巨噬细胞、NK细胞或它们的子集的免疫细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对T细胞(包括但不限于效应T细胞)的靶向部分,连同本文所描述的任何信号传导剂。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对B细胞的靶向部分,连同本文所描述的任何信号传导剂。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对树突状细胞的靶向部分,连同本文所描述的任何信号传导剂。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对巨噬细胞的靶向部分,连同本文所描述的任何信号传导剂。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对NK细胞的靶向部分,连同本文所描述的任何信号传导剂。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向以下各项介导的针对T细胞的靶向部分:CD8、SLAMF4、IL-2 Rα、4-1BB/TNFRSF9、IL-2 Rβ、ALCAM、B7-1、IL-4 R、B7-H3、BLAME/SLAMFS、CEACAM1、IL-6 R、CCR3、IL-7 Rα、CCR4、CXCR1/IL-S RA、CCR5、CCR6、IL-10Rα、CCR7、IL-10 Rβ、CCRS、IL-12 Rβ1、CCR9、IL-12 Rβ2、CD2、IL-13 Rα1、IL-13、CD3、CD4、ILT2/CDS5j、ILT3/CDS5k、ILT4/CDS5d、ILT5/CDS5a、鲁特格林(lutegrin)α4/CD49d、CDS、整合素αE/CD103、CD6、整合素αM/CD 11 b、CDS、整合素αX/CD11c、整合素β2/CD1S、KIR/CD15S、CD27/TNFRSF7、KIR2DL1、CD2S、KIR2DL3、CD30/TNFRSFS、KIR2DL4/CD15Sd、CD31/PECAM-1、KIR2DS4、CD40配体/TNFSF5、LAG-3、CD43、LAIR1、CD45、LAIR2、CDS3、白三烯B4-R1、CDS4/SLAMF5、NCAM-L1、CD94、NKG2A、CD97、NKG2C、CD229/SLAMF3、NKG2D、CD2F-10/SLAMF9、NT-4、CD69、NTB-A/SLAMF6、共同γ链/IL-2 Rγ、骨调素、CRACC/SLAMF7、PD-1、CRTAM、PSGL-1、CTLA-4、RANK/TNFRSF11A、CX3CR1、CX3CL1、L-选择素、CXCR3、SIRPβ1、CXCR4、SLAM、CXCR6、TCCR/WSX-1、DNAM-1、促胸腺生成素、EMMPRIN/CD147、TIM-1、EphB6、TIM-2、Fas/TNFRSF6、TIM-3、Fas配体/TNFSF6、TIM-4、FcγRIII/CD16、TIM-6、TNFR1/TNFRSF1A、粒溶素、TNF RIII/TNFRSF1B、TRAIL R1/TNFRSF1OA、ICAM-1/CD54、TRAIL R2/TNFRSF10B、ICAM-2/CD102、TRAILR3/TNFRSF10C、IFN-γR1、TRAILR4/TNFRSF10D、IFN-γR2、TSLP、IL-1 R1或TSLP R;连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有在T细胞上表达的检查点标记物,例如PD-1、CD28、CTLA4、ICOS、BTLA、KIR、LAG3、CD137、OX40、CD27、CD40L、TIM3和A2aR中的一者或多者,连同本文所描述的任何信号传导剂。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对PD-1的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个选择性地结合PD-1多肽的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个选择性地结合PD-1多肽的抗体、抗体衍生物或形式、肽或多肽或融合蛋白。
在一个实施方案中,所述靶向部分包含抗PD-1抗体喷罗珠单抗(pembrolizumab)(又名MK-3475、KEYTRUDA)或其片段。喷罗珠单抗和其他人源化抗PD-1抗体公开于Hamid等人(2013)New England Journal of Medicine 369(2):134-44、US 8,354,509和WO 2009/114335,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的喷罗珠单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:7的重链和/或含有氨基酸序列SEQ ID NO:8的轻链。
在一个实施方案中,所述靶向部分包含抗PD-1抗体纳武单抗(nivolumab)(又名BMS-936558、MDX-1106、ONO-4538、OPDIVO)或其片段。纳武单抗(克隆5C4)和其他特异性地结合至PD-1的人单克隆抗体公开于US 8,008,449和WO 2006/121168中,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,纳武单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:9的重链和/或含有氨基酸序列SEQ ID NO:10的轻链。
在一个实施方案中,所述靶向部分包含抗PD-1抗体皮地利珠单抗(pidilizumab)(又名CT-011、hBAT或hBAT-1)或其片段。皮地利珠单抗和其他人源化抗PD-I单克隆抗体公开于US 2008/0025980和WO 2009/101611中,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗PD-1抗体或其抗原结合片段包含轻链可变区,所述轻链可变区包含选自US 2008/0025980的SEQ ID NO:15-18的氨基酸序列:US 2008/0025980的SEQ ID NO:15(SEQ ID NO:11);US 2008/0025980的SEQ ID NO:16(SEQ ID NO:12);US 2008/0025980的SEQ ID NO:17(SEQ ID NO:13);和US 2008/0025980的SEQ ID NO:18(SEQ ID NO:14);和/或重链,所述重链包含选自US 2008/0025980的SEQID NO:20-24的氨基酸序列:US 2008/0025980的SEQ ID NO:20(SEQ ID NO:15);US 2008/0025980的SEQ ID NO:21(SEQ ID NO:16);US 2008/0025980的SEQ ID NO:22(SEQ ID NO:17);US 2008/0025980的SEQ ID NO:23(SEQ ID NO:18);和US 2008/0025980的SEQ ID NO:24(SEQ ID NO:19)。
在一个实施方案中,所述靶向部分包含含有US 2008/0025980的SEQ ID NO:18(SEQ ID NO:14)的轻链和含有US 2008/0025980的SEQ ID NO:22(SEQ ID NO:17)的重链。
在一个实施方案中,所述靶向部分包含AMP-514(又名MEDI-0680)。
在一个实施方案中,所述靶向部分包含WO2010/027827和WO 2011/066342中所公开的pd-12-Fc融合蛋白AMP-224,所述文献的全部公开内容特此以引用方式并入。在这种实施方案中,所述靶向部分可以包括包含WO2010/027827的SEQ ID NO:4(SEQ ID NO:20)的靶向结构域和/或包含WO2010/027827的SEQ ID NO:83(SEQ ID NO:21)的B7-DC融合蛋白。
在一个实施方案中,所述靶向部分包含PD-L1-Fc融合蛋白和/或PD-1-Fc融合蛋白,如WO 2019/191519中所描述的。
在一个实施方案中,所述靶向部分包含肽AUNP 12或US 2011/0318373或8,907,053中所公开的任何其他肽。举例来说,所述靶向部分可以包含具有以下序列的AUNP 12(即,US 2011/0318373的化合物8或SEQ ID NO:49):
(SEQ ID NO:22)。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-1抗体1E3或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1E3或其抗原结合片段包含含有氨基酸序列SEQ ID NO:23的重链可变区和/或含有氨基酸序列SEQ ID NO:24的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-1抗体1E8或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1E8或其抗原结合片段包含含有氨基酸序列SEQ ID NO:25的重链可变区和/或含有氨基酸序列SEQ ID NO:26的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-1抗体1H3或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1H3或其抗原结合片段包含含有氨基酸序列SEQ ID NO:27的重链可变区和/或含有氨基酸序列SEQ ID NO:28的轻链可变区。
在一个实施方案中,所述靶向部分包含如例如US 8,907,065和WO 2008/071447中所公开的针对PD-1的VHH,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,所述针对PD-1的VHH包含US 8,907,065的SEQ ID NO:347-351(US 8,907,065的SEQID NO:347(SEQ ID NO:29);US 8,907,065的SEQ ID NO:348(SEQ ID NO:30);US 8,907,065的SEQ ID NO:349(SEQ ID NO:31);US 8,907,065的SEQ ID NO:350(SEQ ID NO:32);和US 8,907,065的SEQ ID NO:351(SEQ ID NO:33))。
在一个实施方案中,所述靶向部分包含如US2011/0271358和WO2010/036959中所公开的抗PD-1抗体或其片段中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US2011/0271358的SEQ ID NO:25-29的氨基酸序列(US2011/0271358的SEQ IDNO:25(SEQ ID NO:34);US2011/0271358的SEQ ID NO:26(SEQ ID NO:35);US2011/0271358的SEQ ID NO:27(SEQ ID NO:36);US2011/0271358的SEQ ID NO:28(SEQ ID NO:37);和US2011/0271358的SEQ ID NO:29(SEQ ID NO:38));和/或轻链,所述轻链包含选自US2011/0271358的SEQ ID NO:30-33的氨基酸序列(US2011/0271358的SEQ ID NO:30(SEQ ID NO:39);US2011/0271358的SEQ ID NO:31(SEQ ID NO:40);US2011/0271358的SEQ ID NO:32(SEQ ID NO:41);和US2011/0271358的SEQ ID NO:33(SEQ ID NO:42))。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个选自TSR-042(Tesaro,Inc.)、REGN2810(RegeneronPharmaceuticals,Inc.)、PDR001(Novartis Pharmaceuticals)和BGB-A317(BeiGeneLtd.)的针对PD-1的抗体或其抗体片段。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对PD-L1的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个选择性地结合PD-L1多肽的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个选择性地结合PD-L1多肽的抗体、抗体衍生物或形式、肽或多肽或融合蛋白。
在一个实施方案中,所述靶向部分包含抗PD-L1抗体MEDI4736(又名度伐鲁单抗(durvalumab))或其片段。MEDI4736对PD-L1具有选择性,并且阻断PD-L1与PD-1和CD80受体的结合。用于本文所提供的方法中的MEDI4736及其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。MEDI4736的序列公开于WO/2016/06272中,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的MEDI4736或其抗原结合片段包含含有氨基酸序列SEQ ID NO:43的重链和/或含有氨基酸序列SEQ ID NO:44的轻链。
在说明性实施方案中,用于本文所提供的方法中的MEDI4736或其抗原结合片段包含含有氨基酸序列即WO/2016/06272的SEQ ID NO:4(SEQ ID NO:45)的重链可变区和/或含有氨基酸序列即WO/2016/06272的SEQ ID NO:3(SEQ ID NO:46)的轻链可变区。
在一个实施方案中,所述靶向部分包含抗PD-L1抗体阿特朱单抗(atezolizumab)(又名MPDL3280A、RG7446)或其片段。在说明性实施方案中,用于本文所提供的方法中的阿特朱单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:47的重链和/或含有氨基酸序列SEQ ID NO:48的轻链。
在一个实施方案中,所述靶向部分包含抗PD-L1抗体阿维鲁单抗(avelumab)(又名MSB0010718C)或其片段。在说明性实施方案中,用于本文所提供的方法中的阿维鲁单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:49的重链和/或含有氨基酸序列SEQ IDNO:50的轻链。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体BMS-936559(又名12A4、MDX-1105)或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的BMS-936559或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:51)的重链可变区和/或含有氨基酸序列(SEQ ID NO:52)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体3G10或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的3G10或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:53)的重链可变区和/或含有氨基酸序列(SEQ ID NO:54)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体10A5或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的10A5或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:55)的重链可变区和/或含有氨基酸序列(SEQ ID NO:56)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体5F8或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的5F8或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:57)的重链可变区和/或含有氨基酸序列(SEQ ID NO:58)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体10H10或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的10H10或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:59)的重链可变区和/或含有氨基酸序列(SEQ ID NO:60)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体1B12或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1B12或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:61)的重链可变区和/或含有氨基酸序列(SEQ ID NO:62)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体7H1或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的7H1或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:63)的重链可变区和/或含有氨基酸序列(SEQ ID NO:64)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体11E6或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的11E6或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:65)的重链可变区和/或含有氨基酸序列(SEQ ID NO:66)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体12B7或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的12B7或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:67)的重链可变区和/或含有氨基酸序列(SEQ ID NO:68)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2013/0309250和WO2007/005874中所公开的抗PD-L1抗体13G4或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的13G4或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:69)的重链可变区和/或含有氨基酸序列(SEQ ID NO:70)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-L1抗体1E12或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1E12或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:71)的重链可变区和/或含有氨基酸序列(SEQ ID NO:72)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-L1抗体1F4或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的1F4或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:73)的重链可变区和/或含有氨基酸序列(SEQ ID NO:74)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-L1抗体2G11或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2G11或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:75)的重链可变区和/或含有氨基酸序列(SEQ ID NO:76)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738中所公开的抗PD-L1抗体3B6或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的3B6或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:77)的重链可变区和/或含有氨基酸序列(SEQ ID NO:78)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US 2014/0044738和WO2012/145493中所公开的抗PD-L1抗体3D10或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的3D10或其抗原结合片段包含含有氨基酸序列(SEQ ID NO:79)的重链可变区和/或含有氨基酸序列(SEQ ID NO:80)的轻链可变区。
在一个实施方案中,所述靶向部分包含如US2011/0271358和WO2010/036959中所公开的抗PD-L1抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US2011/0271358的SEQ ID No:34-38的氨基酸序列(US2011/0271358的SEQ ID No:34(SEQID NO:81);US2011/0271358的SEQ ID No:35(SEQ ID NO:82);US2011/0271358的SEQ IDNo:36(SEQ ID NO:83);US2011/0271358的SEQ ID No:37(SEQ ID NO:84);和US2011/0271358的SEQ ID No:38(SEQ ID NO:85));和/或轻链,所述轻链包含选自(US2011/0271358的SEQ ID No:39-42的氨基酸序列:US2011/0271358的SEQ ID No:39(SEQ ID NO:86);US2011/0271358的SEQ ID No:40(SEQ ID NO:87);US2011/0271358的SEQ ID No:41(SEQ ID NO:88);和US2011/0271358的SEQ ID No:42(SEQ ID NO:89))。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体2.7A4或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.7A4或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:2(SEQ ID NO:90)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:7(SEQ ID NO:91)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体2.9D10或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.9D10或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:12(SEQ ID NO:92)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:17(SEQ ID NO:93)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体2.14H9或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.14H9或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:22(SEQ ID NO:94)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:27(SEQ ID NO:95)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体2.20A8或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.20A8或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:32(SEQ ID NO:96)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:37(SEQ ID NO:97)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体3.15G8或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的3.15G8或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:42(SEQ ID NO:98)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:47(SEQ ID NO:99)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体3.18G1或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的3.18G1或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:52(SEQ ID NO:100)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:57(SEQ ID NO:101)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353以及US2014/0356353中所公开的抗PD-L1抗体2.7A4OPT或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.7A4OPT或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:62(SEQ ID NO:102)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:67(SEQ ID NO:103)的轻链可变区。
在一个实施方案中,所述靶向部分包含如WO 2011/066389、US8,779,108和US2014/0356353中所公开的抗PD-L1抗体2.14H9OPT或其片段,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的2.14H9OPT或其抗原结合片段包含含有氨基酸序列即WO 2011/066389的SEQ ID No:72(SEQ ID NO:104)的重链可变区和/或含有氨基酸序列即WO 2011/066389的SEQ ID No:77(SEQ ID NO:105)的轻链可变区。
在一个实施方案中,所述靶向部分包含WO2016/061142中所公开的抗PD-L1抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自WO2016/061142的SEQID No:18、30、38、46、50、54、62、70和78的氨基酸序列(WO2016/061142的SEQ ID No:18(SEQID NO:106);WO2016/061142的SEQ ID No:30(SEQ ID NO:107);WO2016/061142的SEQ IDNo:38(SEQ ID NO:108);WO2016/061142的SEQ ID No:46(SEQ ID NO:109);WO2016/061142的SEQ ID No:50(SEQ ID NO:110);WO2016/061142的SEQ ID No:54(SEQ ID NO:111);WO2016/061142的SEQ ID No:62(SEQ ID NO:112);WO2016/061142的SEQ ID No:70(SEQ IDNO:113);和WO2016/061142的SEQ ID No:78(SEQ ID NO:114));和/或轻链,所述轻链包含选自WO2016/061142的SEQ ID No:22、26、34、42、58、66、74、82和86的氨基酸序列(WO2016/061142的SEQ ID No:22(SEQ ID NO:115);WO2016/061142的SEQ ID No:26(SEQ ID NO:116);WO2016/061142的SEQ ID No:34(SEQ ID NO:117);WO2016/061142的SEQ ID No:42(SEQ ID NO:118);WO2016/061142的SEQ ID No:58(SEQ ID NO:119);WO2016/061142的SEQID No:66(SEQ ID NO:120);WO2016/061142的SEQ ID No:74(SEQ ID NO:121);WO2016/061142的SEQ ID No:82(SEQ ID NO:122);和WO2016/061142的SEQ ID No:86(SEQ ID NO:123))。
在一个实施方案中,所述靶向部分包含WO2016/022630中所公开的抗PD-L1抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自WO2016/022630的SEQID No:2、6、10、14、18、22、26、30、34、38、42和46的氨基酸序列(WO2016/022630的SEQ IDNo:2(SEQ ID NO:124);WO2016/022630的SEQ ID No:6(SEQ ID NO:125);WO2016/022630的SEQ ID No:10(SEQ ID NO:126);WO2016/022630的SEQ ID No:14(SEQ ID NO:127);WO2016/022630的SEQ ID No:18(SEQ ID NO:128);WO2016/022630的SEQ ID No:22(SEQ IDNO:129);WO2016/022630的SEQ ID No:26(SEQ ID NO:130);WO2016/022630的SEQ ID No:30(SEQ ID NO:131);WO2016/022630的SEQ ID No:34(SEQ ID NO:132);WO2016/022630的SEQ ID No:38(SEQ ID NO:133);WO2016/022630的SEQ ID No:42(SEQ ID NO:134);和WO2016/022630的SEQ ID No:46(SEQ ID NO:135));和/或轻链,所述轻链包含选自WO2016/022630的SEQ ID No:4、8、12、16、20、24、28、32、36、40、44和48的氨基酸序列(WO2016/022630的SEQ ID No:4(SEQ ID NO:136);WO2016/022630的SEQ ID No:8(SEQ ID NO:137);WO2016/022630的SEQ ID No:12(SEQ ID NO:138);WO2016/022630的SEQ ID No:16(SEQ IDNO:139);WO2016/022630的SEQ ID No:20(SEQ ID NO:140);WO2016/022630的SEQ ID No:24(SEQ ID NO:141);WO2016/022630的SEQ ID No:28(SEQ ID NO:142);WO2016/022630的SEQ ID No:32(SEQ ID NO:143);WO2016/022630的SEQ ID No:36(SEQ ID NO:144);WO2016/022630的SEQ ID No:40(SEQ ID NO:145);WO2016/022630的SEQ ID No:44(SEQ IDNO:146);和WO2016/022630的SEQ ID No:48(SEQ ID NO:147))。
在一个实施方案中,所述靶向部分包含WO2015/112900中所公开的抗PD-L1抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自WO 2015/112900的SEQID No:38、50、82和86的氨基酸序列(WO 2015/112900的SEQ ID No:38(SEQ ID NO:148);WO2015/112900的SEQ ID No:50(SEQ ID NO:149);WO 2015/112900的SEQ ID No:82(SEQ IDNO:150);和WO 2015/112900的SEQ ID No:86(SEQ ID NO:151));和/或轻链,所述轻链包含选自WO 2015/112900的SEQ ID No:42、46、54、58、62、66、70、74和78的氨基酸序列(WO2015/112900的SEQ ID No:42(SEQ ID NO:152);WO 2015/112900的SEQ ID No:46(SEQ IDNO:153);WO 2015/112900的SEQ ID No:54(SEQ ID NO:154);WO 2015/112900的SEQ IDNo:58(SEQ ID NO:155);WO 2015/112900的SEQ ID No:62(SEQ ID NO:156);WO 2015/112900的SEQ ID No:66(SEQ ID NO:157);WO 2015/112900的SEQ ID No:70(SEQ ID NO:158);WO 2015/112900的SEQ ID No:74(SEQ ID NO:159);和WO 2015/112900的SEQ ID No:78(SEQ ID NO:160))。
在一个实施方案中,所述靶向部分包含WO 2010/077634和US 8,217,149中所公开的抗PD-L1抗体中的任一者,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗PD-L1抗体或其抗原结合片段包含含有氨基酸序列即WO 2010/077634的SEQ ID No:20(SEQ ID NO:161)的重链区和/或含有氨基酸序列即WO2010/077634的SEQ ID No:21(SEQ ID NO:162)的轻链可变区。
在一个实施方案中,所述靶向部分包含可获自如US 20120039906中所公开的可在CNCM寄存编号CNCM I-4122、CNCM I-4080和CNCM I-4081下获取的杂交瘤的抗PD-L1抗体中的任一者,所述文献的全部公开内容特此以引用方式并入。
在一个实施方案中,所述靶向部分包含如例如US 8,907,065和WO 2008/071447中所公开的针对PD-L1的VHH,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,所述针对PD-L1的VHH包含US 8,907,065的SEQ ID No:394-399(US 8,907,065的SEQ ID No:394(SEQ ID NO:163);US 8,907,065的SEQ ID No:395(SEQ ID NO:164);US 8,907,065的SEQ ID No:396(SEQ ID NO:165);US 8,907,065的SEQ ID No:397(SEQ ID NO:166);US 8,907,065的SEQ ID No:398(SEQ ID NO:167);和US 8,907,065的SEQ ID No:399(SEQ ID NO:168))。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对PD-L2的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个选择性地结合PD-L2多肽的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个选择性地结合PD-L2多肽的抗体、抗体衍生物或形式、肽或多肽或融合蛋白。
在一个实施方案中,所述靶向部分包含如例如US 8,907,065和WO 2008/071447中所公开的针对PD-L2的VHH,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,所述针对PD-L2的VHH包含US 8,907,065的SEQ ID No:449-455(US 8,907,065的SEQ ID No:449(SEQ ID NO:169);US 8,907,065的SEQ ID No:450(SEQ ID NO:170);US 8,907,065的SEQ ID No:451(SEQ ID NO:171);US 8,907,065的SEQ ID No:452(SEQ ID NO:172);US 8,907,065的SEQ ID No:453(SEQ ID NO:173);US 8,907,065的SEQ ID No:454(SEQ ID NO:174);和US 8,907,065的SEQ ID No:455(SEQ ID NO:175))。
在一个实施方案中,所述靶向部分包含如US2011/0271358和WO2010/036959中所公开的抗PD-L2抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US 2011/0271358的SEQ ID No:43-47的氨基酸序列(US2011/0271358的SEQ ID No:43(SEQID NO:176);US2011/0271358的SEQ ID No:44(SEQ ID NO:177);US2011/0271358的SEQ IDNo:45(SEQ ID NO:178);US201I/0271358的SEQ ID No:46(SEQ ID NO:179);和US2011/0271358的SEQ ID No:47(SEQ ID NO:180));和/或轻链,所述轻链包含选自US2011/0271358的SEQ ID No:48-51的氨基酸序列(US2011/0271358的SEQ ID No:48(SEQ ID NO:181);US2011/0271358的SEQ ID No:49(SEQ ID NO:182);US2011/0271358的SEQ ID No:50(SEQ ID NO:183);和US2011/0271358的SEQ ID No:51(SEQ ID NO:184))。
在各个实施方案中,本发明的靶向部分可以包含与本文公开的序列中的任一者具有至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、或100%同一性(例如,与本文公开的序列中的任一者具有约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、约99%或约100%序列同一性)的靶向PD-1、PD-L1和/或PD-L2的序列。
在各个实施方案中,本发明的靶向部分可以包含如本文所公开的靶向PD-1、PD-L1和/或PD-L2的重链、轻链、重链可变区、轻链可变区、互补性决定区(CDR)和框架区序列的任何组合。
选择性地结合或靶向PD-1、PD-L1和/或PD-L2的其他抗体、抗体衍生物或形式、肽或多肽或者融合蛋白公开于以下文献中:WO 2011/066389、US 2008/0025980、US 2013/0034559、US 8,779,108、US 2014/0356353、US 8,609,089、US 2010/028330、US 2012/0114649、WO 2010/027827、WO 2011,/066342、US 8,907,065、WO 2016/062722、WO 2009/101611、WO2010/027827、WO 2011/066342、WO 2007/005874、WO 2001/014556、US2011/0271358、WO 2010/036959、WO 2010/077634、US 8,217,149、US 2012/0039906、WO 2012/145493、US 2011/0318373、美国专利号8,779,108、US 20140044738、WO 2009/089149、WO2007/00587、WO 2016061142、WO 2016,02263、WO 2010/077634和WO 2015/112900,所述文献的全部公开内容特此以引用方式并入。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CD8介导的针对T细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对T细胞上的CD8的靶向部分。
在一个实施方案中,针对CD8的靶向部分包含VHH,所述VHH包含以下氨基酸序列:
在一个实施方案中,针对CD8的靶向部分包含VHH,所述VHH包含以下氨基酸序列:
在一个实施方案中,针对CD8的靶向部分包含VHH,所述VHH包含以下氨基酸序列:
在各个实施方案中,本发明的靶向部分可以包含与本文公开的序列中的任一者具有至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、或100%同一性(例如,与本文公开的序列中的任一者具有约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、约99%或约100%序列同一性)的靶向CD8的序列。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CD4介导的针对T细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对T细胞上的CD4的靶向部分。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CD3、CXCR3、CCR4、CCR9、CD70、CD103或一种或多种免疫检查点标记物介导的针对T细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对T细胞上的CD3的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对在T细胞上表达的CD3的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个选择性地结合CD3多肽的靶向部分。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个选择性地结合CD3多肽的抗体、抗体衍生物或形式、肽或多肽或融合蛋白。
在一个实施方案中,所述靶向部分包含抗CD3抗体莫罗单抗(muromonab)-CD3(又名Orthoclone OKT3)或其片段。莫罗单抗-CD3公开于美国专利号4,361,549和Wilde等人(1996)51:865-894中,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的莫罗单抗-CD3或其抗原结合片段包含含有氨基酸序列(SEQID NO:185)的重链和/或含有氨基酸序列(SEQ ID NO:186)的轻链。
在一个实施方案中,所述靶向部分包含抗CD3抗体奥昔珠单抗(otelixizumab)或其片段。奥昔珠单抗公开于美国专利号20160000916和Chatenoud等人(2012)9:372-381中,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的奥昔珠单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:187的重链和/或含有氨基酸序列SEQ ID NO:188的轻链。
在一个实施方案中,所述靶向部分包含抗CD3抗体替利珠单抗(teplizumab)(又名AKA MGA031和hOKT3γ1(Ala-Ala))或其片段。替利珠单抗公开于Chatenoud等人(2012)9:372-381中,所述文献的全部公开内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的替利珠单抗或其抗原结合片段包含含有氨基酸序列SEQ ID NO:189的重链和/或含有氨基酸序列SEQ ID NO:190的轻链。
在一个实施方案中,所述靶向部分包含抗CD3抗体维西珠单抗(visilizumab)(又名
在一个实施方案中,所述靶向部分包含抗CD3抗体佛拉鲁单抗(foralumab)(又名NI-0401)或其片段。在各个实施方案中,所述靶向部分包含US20140193399、US 7,728,114、US20100183554和US 8,551,478中公开的抗CD3抗体中的任一者,所述文献的全部公开内容特此以引用方式并入。
在说明性实施方案中,用于本文所提供的方法中的抗CD3抗体或其抗原结合片段包含含有氨基酸序列即US 7,728,114的SEQ ID No:2和6(US 7,728,114的SEQ ID No:2(SEQ ID NO:193)和US 7,728,114的SEQ ID No:6(SEQ ID NO:194))的重链可变区和/或含有氨基酸序列即US 7,728,114的SEQ ID NO 4和8(US 7,728,114的SEQ ID NO 4(SEQ IDNO:195)和US 7,728,114的SEQ ID NO 8(SEQ ID NO:196))的轻链可变区。
在一个实施方案中,所述靶向部分包含含有氨基酸序列即US 7,728,114的SEQ IDNO:2的重链可变区和含有氨基酸序列即US 7,728,114的SEQ ID NO:4的轻链可变区。在一个实施方案中,所述靶向部分包含US2016/0168247中所公开的抗CD3抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US2016/0168247的SEQ ID No:6-9的氨基酸序列(US2016/0168247的SEQ ID No:6(SEQ ID NO:197);US2016/0168247的SEQ IDNo:7(SEQ ID NO:198);US2016/0168247的SEQ ID No:8(SEQ ID NO:199);和US2016/0168247的SEQ ID No:9(SEQ ID NO:200));和/或轻链,所述轻链包含选自US2016/0168247的SEQ ID No:10-12的氨基酸序列(US2016/0168247的SEQ ID No:10(SEQ ID NO:201);US2016/0168247的SEQ ID No:11(SEQ ID NO:202);和US2016/0168247的SEQ ID No:12(SEQ ID NO:203))。
在一个实施方案中,所述靶向部分包含US2015/0175699中所公开的抗CD3抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含含有选自US2015/0175699的SEQ ID No:9(SEQID NO:204)的氨基酸序列的重链;和/或含有选自US2015/0175699的SEQ ID No:10(SEQ IDNO:205)的氨基酸序列的轻链。
在一个实施方案中,所述靶向部分包含US 8,784,821中所公开的抗CD3抗体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US 8,784,821的SEQ IDNo:2、18、34、50、66、82、98和114的氨基酸序列(US 8,784,821的SEQ ID No:2(SEQ ID NO:206);US 8,784,821的SEQ ID No:18(SEQ ID NO:207);US 8,784,821的SEQ ID No:34(SEQID NO:208);US 8,784,821的SEQ ID No:50(SEQ ID NO:209);US 8,784,821的SEQ ID No:66(SEQ ID NO:210);US 8,784,821的SEQ ID No:82(SEQ ID NO:211);US 8,784,821的SEQID No:98(SEQ ID NO:212);和US 8,784,821的SEQ ID No:114(SEQ ID NO:213));和/或轻链,所述轻链包含选自US 8,784,821的SEQ ID No:10、26、42、58、74、90、106和122的氨基酸序列(US 8,784,821的SEQ ID No:10(SEQ ID NO:214);US 8,784,821的SEQ ID No:26(SEQID NO:215);US 8,784,821的SEQ ID No:42(SEQ ID NO:216);US 8,784,821的SEQ ID No:58(SEQ ID NO:217);US 8,784,821的SEQ ID No:74(SEQ ID NO:218);US 8,784,821的SEQID No:90(SEQ ID NO:219);US 8,784,821的SEQ ID No:106(SEQ ID NO:220);和US 8,784,821的SEQ ID No:122(SEQ ID NO:221))。
在一个实施方案中,所述靶向部分包含US20150118252中所公开的抗CD3结合构建体中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含含有选自US20150118252的SEQ ID No:6和86(US20150118252的SEQ ID No:6(SEQ ID NO:222)和US20150118252的SEQ ID No:86(SEQID NO:223))的氨基酸序列的重链;和/或含有选自US2015/0175699的SEQ ID No:3(US20150118252的SEQ ID No:3(SEQ ID NO:224))的氨基酸序列的轻链。
在一个实施方案中,所述靶向部分包含US2016/0039934中所公开的抗CD3结合蛋白中的任一者,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,用于本文所提供的方法中的抗体或其抗原结合片段包含重链,所述重链包含选自US2016/0039934的SEQ ID No:6-9的氨基酸序列(US2016/0039934的SEQ ID No:6(SEQ ID NO:225);US2016/0039934的SEQ ID No:7(SEQ ID NO:226);US2016/0039934的SEQ ID No:8(SEQ ID NO:227);和US2016/0039934的SEQ ID No:9(SEQ ID NO:228));和/或轻链,所述轻链包含选自US2016/0039934的SEQ ID No:1-4的氨基酸序列(US2016/0039934的SEQ ID No:1(SEQ IDNO:229);US2016/0039934的SEQ ID No:2(SEQ ID NO:230);US2016/0039934的SEQ ID No:3(SEQ ID NO:231);和US2016/0039934的SEQ ID No:4(SEQ ID NO:232))。
在各个实施方案中,本发明的靶向部分可以包含与本文所公开的序列中的任一者具有至少约60%、至少约61%、至少约62%、至少约63%、至少约64%、至少约65%、至少约66%、至少约67%、至少约68%、至少约69%、至少约70%、至少约71%、至少约72%、至少约73%、至少约74%、至少约75%、至少约76%、至少约77%、至少约78%、至少约79%、至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、或100%同一性(例如,与本文所公开的序列中的任一者具有约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、约99%或约100%序列同一性)的靶向CD3的序列。
在各个实施方案中,本发明的靶向部分可以包含如本文所公开的靶向CD3的重链、轻链、重链可变区、轻链可变区、互补性决定区(CDR)和框架区序列的任何组合。在各个实施方案中,本发明的靶向部分可以包含CD3特异性抗体的任何重链、轻链、重链可变区、轻链可变区、互补性决定区(CDR)和构架区序列,所述CD3特异性抗体包括但不限于X35-3、VIT3、BMA030(BW264/56)、CLB-T3/3、CRIS7、YTH12.5、F1 11-409、CLB-T3.4.2、TR-66、WT32、SPv-T3b、11D8、XIII-141、XIII-46、XIII-87、12F6、T3/RW2-8C8、T3/RW2-4B6、OKT3D、M-T301、SMC2、WT31和F101.01。这些CD3特异性抗体在本领域中是众所周知的,并且尤其描述于Tunnacliffe(1989),Int.Immunol.1,546-550中,所述文献的全部公开内容特此以引用方式并入。
选择性地结合或靶向CD3的其他抗体、抗体衍生物或形式、肽或多肽或融合蛋白公开于美国专利公布号2016/0000916、美国专利号4,361,549、5,834,597、6,491,916、6,406,696、6,143,297、6,750,325和国际公布号WO 2004/052397中,所述文献的全部公开内容特此以引用方式并入。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向PD-1介导的针对T细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向以下各项介导的针对B细胞的靶向部分:CD10、CD19、CD20、CD21、CD22、CD23、CD24、CD37、CD38、CD39、CD40、CD70、CD72、CD73、CD74、CDw75、CDw76、CD77、CD78、CD79a/b、CD80、CD81、CD82、CD83、CD84、CD85、CD86、CD89、CD98、CD126、CD127、CDw130、CD138或CDw150,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对CD20的靶向部分。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CD19、CD20或CD70介导的针对B细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CD20介导的针对B细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对B细胞上的CD20的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。作为实例,在一些实施方案中,所述CD20靶向部分是具有以下序列的重组的只有重链的抗体(VHH):
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向以下各项介导的针对NK细胞的靶向部分:2B4/SLAMF4、KIR2DS4、CD155/PVR、KIR3DL1、CD94、LMIR1/CD300A、CD69、LMIR2/CD300c、CRACC/SLAMF7、LMIR3/CD300LF、DNAM-1、LMIR5/CD300LB、Fc-εRII、LMIR6/CD300LE、Fc-γR1/CD64、MICA、Fc-γRIIB/CD32b、MICB、Fc-γRIIC/CD32c、MULT-1、Fc-γRIIA/CD32a、结合素-2/CD112、Fc-γRIII-CD16、NKG2A、FcRH1/IRTA5、NKG2C、FcRH2/IRTA4、NKG2D、FcRH4/IRTA1、NKp30、FcRH5/IRTA2、NKp44、Fc受体样蛋白3/CD16-2、NKp46/NCR1、NKp80/KLRF1、NTB-A/SLAMF6、Rae-1、Rae-1α、Rae-1β、Rae-1δ、H60、Rae-1ε、ILT2/CD85j、Rae-1γ、ILT3/CD85k、TREM-1、ILT4/CD85d、TREM-2、ILT5/CD85a、TREM-3、KIR/CD158、TREML1/TLT-1、KIR2DL1、ULBP-1、KIR2DL3、ULBP-2、KIR2DIA/CD158d或ULBP-3;连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向Kir1α、DNAM-1或CD64介导的针对NK细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向TIGIT或KIR1介导的针对NK细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对NK细胞上的TIGIT的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向以下各项介导的针对树突状细胞的靶向部分:CLEC-9A、XCR1、RANK、CD36/SRB3、LOX-1/SR-E1、CD68、MARCO、CD163、SR-A1/MSR、CD5L、SREC-1、CL-P1/COLEC12、SREC-II、LIMPIIISRB2、RP105、TLR4、TLR1、TLR5、TLR2、TLR6、TLR3、TLR9、4-IBB配体/TNFSF9、IL-12/IL-23 p40、4-氨基-1,8-萘二甲酰胺、ILT2/CD85j、CCL21/6Ckine、ILT3/CD85k、8-氧代-dG、ILT4/CD85d、8D6A、ILT5/CD85a、A2B5、鲁特格林α4/CD49d、Aag、整合素β2/CD18、AMICA、朗格汉斯蛋白(Langerin)、B7-2/CD86、白三烯B4 R1、B7-H3、LMIR1/CD300A、BLAME/SLAMF8、LMIR2/CD300c、Clq R1/CD93、LMIR3/CD300LF、CCR6、LMIR5/CD300LB CCR7、LMIR6/CD300LE、CD40/TNFRSF5、MAG/Siglec-4-a、CD43、MCAM、CD45、MD-1、CD68、MD-2、CD83、MDL-1/CLEC5A、CD84/SLAMF5、MMR、CD97、NCAML1、CD2F-10/SLAMF9、骨激活素GPNMB、Chern 23、PD-L2、CLEC-1、RP105、CLEC-2、Siglec-2/CD22、CRACC/SLAMF7、Siglec-3/CD33、DC-SIGN、Siglec-5、DC-SIGNR/CD299、Siglec-6、DCAR、Siglec-7、DCIR/CLEC4A、Siglec-9、DEC-205、Siglec-10、Dectin-1/CLEC7A、Siglec-F、Dectin-2/CLEC6A、SIGNR1/CD209、DEP-1/CD148、SIGNR4、DLEC、SLAM、EMMPRIN/CD147、TCCR/WSX-1、Fc-γR1/CD64、TLR3、Fc-γRIIB/CD32b、TREM-1、Fc-γRIIC/CD32c、TREM-2、Fc-γRIIA/CD32a、TREM-3、Fc-γRIII/CD16、TREML1/TLT-1、ICAM-2/CD102或辣椒素R1;连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CLEC-9A、DC-SIGN、CD64、CLEC4A或DEC205介导的针对树突状细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对树突状细胞上的CLEC9A的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向CLEC9A介导的针对树突状细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对树突状细胞上的CLEC9A的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向XCR1介导的针对树突状细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对树突状细胞上的XCR1的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向RANK介导的针对树突状细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对树突状细胞上的RANK的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
作为非限制性实例,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向以下各项介导的针对单核细胞/巨噬细胞的靶向部分:SIRP1a、B7-1/CD80、ILT4/CD85d、B7-H1、ILT5/CD85a、共同β链、整合素α4/CD49d、BLAME/SLAMF8、整合素αX/CDllc、CCL6/C10、整合素β2/CD18、CD155/PVR、整合素β3/CD61、CD31/PECAM-1、胶乳素、CD36/SR-B3、白三烯B4 R1、CD40/TNFRSF5、LIMPIIISR-B2、CD43、LMIR1/CD300A、CD45、LMIR2/CD300c、CD68、LMIR3/CD300LF、CD84/SLAMF5、LMIR5/CD300LB、CD97、LMIR6/CD300LE、CD163、LRP-1、CD2F-10/SLAMF9、MARCO、CRACC/SLAMF7、MD-1、ECF-L、MD-2、EMMPRIN/CD147、MGL2、内皮素/CD105、骨激活素/GPNMB、Fc-γRI/CD64、骨调素、Fc-γRIIB/CD32b、PD-L2、Fc-γRIIC/CD32c、Siglec-3/CD33、Fc-γRIIA/CD32a、SIGNR1/CD209、Fc-γRIII-CD16、SLAM、GM-CSF Rα、TCCR/WSX-1、ICAM-2/CD102、TLR3、IFN-γR1、TLR4、IFN-γR2、TREM-1、IL-1 RII、TREM-2、IL.T2/CD85j、TREM-3、ILT3/CD85k、TREML1/TLT-1、2B4/SLAMF4、IL-10Rα、ALCAM、IL-10Rβ、氨基肽酶N/ANPEP、ILT2/CD85j、共同β链、ILT3/CD85k、C1q R1/CD93、ILT4/CD85d、CCR1、ILT5/CD85a、CCR2、CD206、整合素α4/CD49d、CCR5、整合素αM/CDllb、CCR8、整合素αX/CDllc、CD155/PVR、整合素β2/CD18、CD14、整合素β3/CD61、CD36/SR-B3、LAIR1、CD43、LAIR2、CD45、白三烯B4-R1、CD68、LIMPIIISR-B2、CD84/SLAMF5、LMIR1/CD300A、CD97、LMIR2/CD300c、CD163、LMIR3/CD300LF、凝血因子III/组织因子、LMIR5/CD300LB、CX3CR1、CX3CL1、LMIR6/CD300LE、CXCR4、LRP-1、CXCR6、M-CSF R、DEP-1/CD148、MD-1、DNAM-1、MD-2、EMMPRIN/CD147、MMR、内皮素/CD105、NCAM-L1、Fc-γRI/CD64、PSGL-1、Fc-γRIIIICD16、RP105、G-CSFR、L-选择素、GM-CSF Rα、Siglec-3/CD33、HVEM/TNFRSF 14、SLAM、ICAM-1/CD54、TCCR/WSX-1、ICAM-2/CD102、TREM-1、IL-6R、TREM-2、CXCR1/IL-8RA、TREM-3或TREML1/TLT-1;连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向B7-H1、CD31/PECAM-1、CD163、CCR2或巨噬细胞甘露糖受体CD206介导的针对单核细胞/巨噬细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有例如通过靶向SIRP1a介导的针对单核细胞/巨噬细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有针对巨噬细胞上的SIRP1a的靶向部分和针对肿瘤细胞上的PD-L1或PD-L2的第二靶向部分。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对检查点标记物例如PD-1/PD-L1或PD-L2、CD28/CD80或CD86、CTLA4/CD80或CD86、ICOS/ICOSL或B7RP1、BTLA/HVEM、KIR、LAG3、CD137/CD137L、OX40/OX40L、CD27、CD40L、TIM3/Gal9、CD47、CD70和A2aR中的一者或多者的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个针对相同或不同免疫细胞的靶向部分。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有一个或多个针对选自T细胞、B细胞、树突状细胞、巨噬细胞、NK细胞或它们的子集的免疫细胞的靶向部分,连同本文所描述的任何信号传导剂(例如经修饰的IL-2)。
在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含针对肿瘤细胞的靶向部分。在此类实施方案中,所述靶向部分可以结合至本文所描述的任何肿瘤抗原。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含一个或多个具有结合至目标靶标(例如抗原、受体)的识别结构域的靶向部分,所述目标靶标包括见于选自以下的一种或多种细胞上的靶标:脂肪细胞(例如白色脂肪细胞、褐色脂肪细胞)、肝脂细胞、肝细胞、肾细胞(例如肾壁细胞、肾唾液腺、肾乳腺等)、导管细胞(精囊、前列腺等的导管细胞)、肠刷状缘细胞(带有微绒毛)、外分泌腺纹状导管细胞、胆囊上皮细胞、输出小管无纤毛细胞、附睾主细胞、附睾基底细胞、内皮细胞、成釉细胞上皮细胞(牙釉质分泌)、耳前庭系统的半月扁平上皮细胞(蛋白聚糖分泌)、Corti牙间上皮细胞的器官(分泌覆盖毛细胞的覆膜)、松散的结缔组织成纤维细胞、角膜成纤维细胞(角膜细胞)、腱成纤维细胞、骨髓网状组织成纤维细胞、非上皮成纤维细胞、周皮细胞、椎间盘的髓核细胞、成牙骨质细胞/牙骨质细胞(cementoblast/cementocyte)(牙根骨样ewan细胞分泌)、成牙本质细胞/牙本质细胞(odontoblast/odontocyte)(牙本质分泌)、透明软骨细胞、纤维软骨细胞、弹性软骨细胞、成骨细胞/骨细胞(osteoblast/osteocyte)、骨祖细胞(成骨细胞的干细胞)、眼玻璃体的透明细胞、耳的淋巴周围空间的星状细胞、肝星状细胞(Ito细胞)、胰腺星状细胞、骨骼肌细胞、卫星细胞、心肌细胞、平滑肌细胞、虹膜的肌上皮细胞、外分泌腺的肌上皮细胞、外分泌的分泌上皮细胞(例如唾液腺细胞、乳腺细胞、泪腺细胞、汗腺细胞、皮脂腺细胞、前列腺细胞、胃腺细胞、胰腺腺泡细胞、肺泡细胞)、激素分泌细胞(例如垂体细胞、神经分泌细胞、肠和呼吸道细胞、甲状腺细胞、甲状旁腺细胞、肾上腺细胞、睾丸间质细胞、胰岛细胞)、角化上皮细胞、湿分层屏障上皮细胞、神经元细胞(例如感觉转导细胞、自主神经元细胞、感觉器官和外周神经支持细胞以及中枢神经系统神经元和神经胶质细胞诸如中间神经元、主细胞、星形胶质细胞、少突胶质细胞和室管膜细胞)。
靶向部分形式
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分是能够特异性结合的基于蛋白质的剂,诸如抗体或其衍生物。在一个实施方案中,所述靶向部分包含抗体。在各个实施方案中,抗体是包括两条重链和两条轻链的全长多聚体蛋白。每条重链包括一个可变区(例如V
在一些实施方案中,所述靶向部分包含抗体衍生物或抗体形式。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分是单结构域抗体、只有重链的重组抗体(VHH)、单链抗体(scFv)、只有重链的鲨鱼抗体(VNAR)、微量蛋白(半胱氨酸结蛋白、打结素(knottin))、DARPin;四连接素(Tetranectin);Affibody;反式体(Transbody);抗运载蛋白;AdNectin;Affilin;微型体(Microbody);肽适体;奥特瑞斯(alterase);塑性抗体;费洛体(phylomer);斯塔都体(stradobody);巨型体(maxibody);伊维体(evibody);菲诺体(fynomer)、犰狳重复蛋白、库尼茨型结构域(Kunitzdomain)、高亲合性多聚体(avimer)、阿特里体(atrimer)、普罗体(probody)、免疫体(immunobody)、曲奥单抗(triomab)、特洛伊体(troybody);佩普体(pepbody);疫苗体(vaccibody)、单特异性体(UniBody);affimer、双特异性体(DuoBody)、Fv、Fab、Fab′、F(ab′)2、肽模拟分子或合成分子,如以下美国专利号或专利公布号中所描述:US 7,417,130、US 2004/132094、US 5,831,012、US 2004/023334、US 7,250,297、US 6,818,418、US 2004/209243、US 7,838,629、US7,186,524、US 6,004,746、US 5,475,096、US 2004/146938、US 2004/157209、US 6,994,982、US 6,794,144、US 2010/239633、US 7,803,907、US 2010/119446和/或US 7,166,697,所述专利的内容特此以引用方式整体并入。还参见Storz MAbs.2011年5月-6月;3(3):310-317。
在一个实施方案中,所述靶向部分包含单结构域抗体,诸如来自例如产生VHH抗体的生物体(诸如骆驼、鲨鱼)的VHH,或者设计的VHH。VHH是抗体来源的治疗性蛋白质,它们含有天然存在的重链抗体的独特结构和功能性质。VHH技术是基于来自骆驼的缺乏轻链的完全功能抗体。这些重链抗体含有单个可变结构域(VHH)和两个恒定结构域(CH2和CH3)。VHH可以NANOBODY或NANOBODIES的商标购得。
在一个实施方案中,所述靶向部分包含VHH。在一些实施方案中,所述VHH是人源化VHH或骆驼化VHH。
在一些实施方案中,所述VHH包含完全人VH结构域,例如HUMABODY(CrescendoBiologics,Cambridge,UK)。在一些实施方案中,完全人VH结构域(例如HUMABODY)是单价、二价或三价的。在一些实施方案中,所述完全人VH结构域(例如HUMABODY)是单特异性或多特异性的,诸如单特异性、双特异性或三特异性的。说明性完全人VH结构域(例如HUMABODIES)描述于例如WO 2016/113555和WO 2016/113557中,所述文献的全部内容以引用方式并入。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的靶向部分是能够特异性地结合至细胞受体,诸如细胞受体的天然配体的基于蛋白质的剂。在各个实施方案中,所述细胞受体见于一个或多个免疫细胞上,所述免疫细胞可以包括但不限于T细胞、细胞毒性T淋巴细胞、T辅助细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞、抗肿瘤巨噬细胞(例如M1巨噬细胞)、B细胞、树突状细胞或它们的子集。在一些实施方案中,所述细胞受体见于巨核细胞、血小板、红细胞、肥大细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞或它们的子集上。
在一些实施方案中,所述靶向部分是天然配体,诸如趋化因子。可以包括在本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物中的说明性趋化因子包括但不限于CCL1、CCL2、CCL4、CCL5、CCL6、CCL7、CCL8、CCL9、CCL10、CCL11、CCL12、CCL13、CCL14、CCL15、CCL16、CL17、CCL18、CCL19、CCL20、CCL21、CCL22、CCL23、CCL24、CLL25、CCL26、CCL27、CXCL1、CXCL2、CXCL3、CXCL4、CXCL5、CXCL6、CXCL7、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CXCL13、CXCL14、CXCL15、CXCL16、CXCL17、XCL1、XCL2、CX3CL1、HCC-4和LDGF-PBP。在说明性实施方案中,所述靶向部分可以是XCL1,它是识别并结合至树突状细胞受体XCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL1,它是识别并结合至CCR8的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL2,它是识别并结合至CCR2或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL3,它是识别并结合至CCR1、CCR5或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL4,它是识别并结合至CCR1或CCR5或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL5,它是识别并结合至CCR1或CCR3或CCR4或CCR5的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL6,它是识别并结合至CCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL7,它是识别并结合至CCR2或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL8,它是识别并结合至CCR1或CCR2或CCR2B或CCR5或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL9,它是识别并结合至CCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL10,它是识别并结合至CCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL11,它是识别并结合至CCR2或CCR3或CCR5或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL13,它是识别并结合至CCR2或CCR3或CCR5或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL14,它是识别并结合至CCR1或CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL15,它是识别并结合至CCR1或CCR3的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL16,它是识别并结合至CCR1、CCR2、CCR5或CCR8的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL17,它是识别并结合至CCR4的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL19,它是识别并结合至CCR7的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL20,它是识别并结合至CCR6的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL21,它是识别并结合至CCR7的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL22,它是识别并结合至CCR4的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL23,它是识别并结合至CCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL24,它是识别并结合至CCR3的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL25,它是识别并结合至CCR9的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL26,它是识别并结合至CCR3的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL27,它是识别并结合至CCR10的趋化因子。在另一个说明性实施方案中,所述靶向部分是CCL28,它是识别并结合至CCR3或CCR10的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL1,它是识别并结合至CXCR1或CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL2,它是识别并结合至CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL3,它是识别并结合至CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL4,它是识别并结合至CXCR3B的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL5,它是识别并结合至CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL6,它是识别并结合至CXCR1或CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL8,它是识别并结合至CXCR1或CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL9,它是识别并结合至CXCR3的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL10,它是识别并结合至CXCR3的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL11,它是识别并结合至CXCR3或CXCR7的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL12,它是识别并结合至CXCR4或CXCR7的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL13,它是识别并结合至CXCR5的趋化因子。在另一个说明性实施方案中,所述靶向部分是CXCL16,它是识别并结合至CXCR6的趋化因子。在另一个说明性实施方案中,所述靶向部分是LDGF-PBP,它是识别并结合至CXCR2的趋化因子。在另一个说明性实施方案中,所述靶向部分是XCL2,它是识别并结合至XCR1的趋化因子。在另一个说明性实施方案中,所述靶向部分是CX3CL1,它是识别并结合至CX3CR1的趋化因子。
在一些实施方案中,所述靶向部分是天然配体,诸如FMS样酪氨酸激酶3配体(Flt3L)或其截短区域(例如,其能够结合Flt3)。在一些实施方案中,所述靶向部分是Flt3L的细胞外结构域。在一些实施方案中,所述靶向部分包含Flt3L结构域,其中所述Flt3L结构域是单链二聚体,任选地其中一个FIt3L结构域经由一个或多个接头连接至另一Flt3L结构域,其中所述接头是柔性接头。在一些实施方案中,本发明的靶向部分包含:Flt3L结构域,其中所述Flt3L结构域是单链二聚体;和Fc结构域,所述Fc结构域任选地具有一个或多个突变,所述一个或多个突变减少或消除所述Fc结构域的一种或多种效应功能,促进所述Fc结构域中的Fc链配对,和/或使所述Fc结构域中的铰链区稳定化。在一些实施方案中,所述靶向部分识别CD20。在一些实施方案中,所述靶向部分识别PD-L1。在一些实施方案中,所述靶向部分识别Clec9A。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含各种组合的靶向部分。在一个说明性实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包含两个靶向部分,其中两个靶向部分均是抗体或其衍生物。在另一个说明性实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包含两个靶向部分,其中两个靶向部分均是细胞受体的天然配体。在另一个说明性实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包含两个靶向部分,其中一个靶向部分是抗体或其衍生物,并且另一靶向部分是细胞受体的天然配体。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域在功能上调节(以非限制性方式,部分或完全中和)目标靶标(例如抗原、受体),例如基本上抑制、降低或中和所述抗原具有的生物效应。举例来说,各个识别结构域可以针对一种或多种主动阻抑或有能力阻抑例如患有肿瘤的患者的免疫系统的肿瘤抗原。举例来说,在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物在功能上调节免疫抑制信号(例如检查点抑制剂),例如,TIM-3、BTLA、PD-1、CTLA-4、B7-H4、GITR、半乳凝素-9、HVEM、PD-L1、PD-L2、B7-H3、CD244、CD160、TIGIT、SIRPα、ICOS、CD172a和TMIGD2中的一者或多者。举例来说,在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物经工程化以破坏、阻断、减少和/或抑制免疫抑制信号的传递,作为非限制性实例,PD-1与PD-L1或PD-L2的结合和/或CTLA-4与AP2M1、CD80、CD86、SHP-2和PPP2R5A中的一者或多者的结合。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域结合但不在功能性上调节目标靶标(例如抗原、受体),例如所述识别结构域是或类似于结合抗体。举例来说,在各个实施方案中,所述识别结构域仅仅靶向抗原或受体,但基本上不抑制、降低或在功能性上调节所述抗原或受体具有的生物效应。举例来说,上述一些较小的抗体形式(例如,与例如完整抗体相比)具有靶向难于接近的表位的能力并提供较大范围的特异性结合位点。在各个实施方案中,所述识别结构域结合在物理上与对抗原或受体的生物活性重要的抗原位点(例如,抗原的活性位点)隔开的表位。
此类非中和结合可用于本发明的各个实施方案中,包括使用本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物直接或间接地经由效应抗原诸如本文所描述的任何效应抗原将活性免疫细胞募集至所需位点的方法。举例来说,在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以用在减少或消除肿瘤的方法中经由CD8将细胞毒性T细胞直接或间接地募集至肿瘤细胞(例如,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包含抗CD8识别结构域和针对肿瘤抗原的识别结构域)。在此类实施方案中,期望直接或间接地募集表达CD8的细胞毒性T细胞但不在功能上调节所述CD8的活性。正相反,在这些实施方案中,CD8信号传导是肿瘤减小或消除作用的重要部分。作为另一个实例,在减少或消除肿瘤的各种方法中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物用于经由CLEC9A直接或间接地募集树突状细胞(DC)(例如,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包含抗CLEC9A识别结构域和针对肿瘤抗原的识别结构域)。在此类实施方案中,期望直接或间接地募集表达CLEC9A的DC但不在功能上调节所述CLEC9A的活性。正相反,在这些实施方案中,CLEC9A信号传导是肿瘤减小或消除作用的重要部分。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域结合至例如树突状细胞上的XCR1。举例来说,在一些实施方案中,所述识别结构域包含XCL1的全部或部分或非中和抗XCR1剂。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域结合至免疫调节抗原(例如免疫刺激或免疫抑制抗原)。在各个实施方案中,所述免疫调节抗原是以下各项中的一者或多者:4-1BB、OX-40、HVEM、GITR、CD27、CD28、CD30、CD40、ICOS配体;OX-40配体、LIGHT(CD258)、GITR配体、CD70、B7-1、B7-2、CD30配体、CD40配体、ICOS、ICOS配体、CD137配体和TL1A。在各个实施方案中,此类免疫刺激抗原在肿瘤细胞上表达。在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域结合此类免疫刺激抗原但不在功能上调节此类免疫刺激抗原,因此允许募集表达这些抗原的细胞而不降低或丧失其潜在肿瘤减少或消除能力。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的识别结构域可以处于包含两个具有中和活性的识别结构域,或者包含两个具有非中和(例如结合)活性的识别结构域,或者包含一个具有中和活性的识别结构域和一个具有非中和(例如结合)活性的识别结构域的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的范围内。
Fc结构域
片段可结晶结构域(Fc结构域)是抗体中的与位于免疫系统所涉细胞(例如B淋巴细胞、树突状细胞、自然杀伤细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞)的细胞表面上的Fc受体相互作用的尾部区域。在IgG、IgA和IgD抗体同种型中,Fc结构域由两个相同的蛋白质片段组成,这些蛋白质片段来源于抗体两条重链的第二和第三恒定结构域。在IgM和IgE抗体同种型中,Fc结构域在每条多肽链中包含三个重链恒定结构域(CH结构域2-4)。
在一些实施方案中,本发明技术的基于Fc的嵌合蛋白复合物包含Fc结构域。在一些实施方案中,所述Fc结构域选自IgG、IgA、IgD、IgM或IgE。在一些实施方案中,所述Fc结构域选自IgG1、IgG2、IgG3或IgG4。
在一些实施方案中,所述Fc结构域选自人IgG、IgA、IgD、IgM或IgE。在一些实施方案中,所述Fc结构域选自人IgG1、IgG2、IgG3或IgG4。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物的Fc结构域包含IgG的CH2和CH3区。在一些实施方案中,所述IgG是人IgG。在一些实施方案中,所述人IgG选自IgG1、IgG2、IgG3或IgG4。
在一些实施方案中,所述Fc结构域包含一个或多个突变。在一些实施方案中,所述Fc结构域的一个或多个突变减少或消除了Fc结构域的效应功能。在一些实施方案中,所述突变的Fc结构域对靶受体具有降低的亲和力或结合。作为实例,在一些实施方案中,所述Fc结构域的突变减少或消除了Fc结构域与FcγR的结合。在一些实施方案中,FcγR选自FcγRI;FcγRIIa、131 R/R;FcγRIIa、131 H/H、FcγRIIb;和FcγRIII。在一些实施方案中,所述Fc结构域的突变减少或消除了与补体蛋白(诸如例如C1q)的结合。在一些实施方案中,所述Fc结构域的突变减少或消除了与与FcγR和补体蛋白(诸如例如C1q)两者的结合。
在一些实施方案中,所述Fc结构域包含LALA突变以减少或消除Fc结构域的效应功能。作为实例,在一些实施方案中,LALA突变包括人IgG(例如IgG1)中的L234A和L235A取代(其中编号是基于根据EU公约(PNAS,Edelman等人,1969;63(1)78-85)对人IgG1的CH2残基的常用编号)。
在一些实施方案中,所述人IgG的Fc结构域在46处包含突变以减少或消除Fc结构域的效应功能。作为实例,在一些实施方案中,所述突变选自L234A、L234F、L235A、L235E、L235Q、K322A、K322Q、D265A、P329G、P329A、P331G和P331S。
在一些实施方案中,所述Fc结构域包含FALA突变以减少或消除Fc结构域的效应功能。作为实例,在一些实施方案中,所述FALA突变包括人IgG4中的F234A和L235A取代。
在一些实施方案中,人IgG4的Fc结构域在F234、L235、K322、D265和P329中的一者或多者处包含突变,以减少或消除Fc结构域的效应功能。作为实例,在一些实施方案中,所述突变选自F234A、L235A、L235E、L235Q、K322A、K322Q、D265A、P329G和P329A。
在一些实施方案中,所述Fc结构域的一个或多个突变使Fc结构域中的铰链区稳定化。作为实例,在一些实施方案中,所述Fc结构域在人IgG的S228处包含突变以使铰链区稳定化。在一些实施方案中,所述突变是S228P。
在一些实施方案中,所述Fc结构域的一个或多个突变促进Fc结构域中的链配对。在一些实施方案中,通过离子配对(亦称带电对、离子键或带电残基对)促进链配对。
在一些实施方案中,所述Fc结构域在IgG的以下氨基酸残基中的一者或多者处包含突变以促进离子配对:D356、E357、L368、K370、K392、D399和K409。
作为实例,在一些实施方案中,人IgG Fc结构域包含表1中的突变组合之一以促进离子配对。
/>
在一些实施方案中,链配对经由旋钮入孔洞突变促成。在一些实施方案中,所述Fc结构域包含一个或多个突变,以实现Fc结构域中的旋钮入孔洞相互作用。在一些实施方案中,将第一Fc链工程化以表达“旋钮”,并且将第二Fc链工程化以表达互补的“孔洞”。作为实例,在一些实施方案中,人IgG Fc结构域包含表2的突变,以实现旋钮入孔洞相互作用。
在一些实施方案中,本发明技术的基于Fc的嵌合蛋白复合物中的Fc结构域包含以上公开的突变的任何组合。作为实例,在一些实施方案中,所述Fc结构域包含促进离子配对和/或旋钮入孔洞相互作用的突变。作为实例,在一些实施方案中,所述Fc结构域包含具有以下一种或多种特性的突变:促进离子配对,诱导旋钮入孔洞相互作用,减少或消除Fc结构域的效应功能,以及引起Fc稳定化(例如,在铰链处)。
作为实例,在一些实施方案中,人IgG Fc结构域包含表3中公开的突变,所述突变促进Fc结构域中的离子配对和/或促进旋钮入孔洞相互作用。
作为实例,在一些实施方案中,人IgG Fc结构域包含表4中公开的突变,所述突变促进Fc结构域中的离子配对,促进旋钮入孔洞相互作用或它们的组合。在多个实施方案中,表4的“链1”和“链2”可以互换(例如,链1可以具有Y407T,并且链2可以具有T366Y)。
/>
/>
/>
作为实例,在一些实施方案中,人IgG Fc结构域包含表5中公开的突变,所述突变减少或消除了Fc结构域中的FcγR和/或补体结合。在多个实施方案中,两条链中都有表5的突变。
/>
/>
在一些实施方案中,本发明技术的基于Fc的嵌合蛋白复合物中的Fc结构域是同源二聚体,即,所述嵌合蛋白复合物中的Fc区包含两个相同的蛋白质片段。
在一些实施方案中,本发明技术的基于Fc的嵌合蛋白复合物中的Fc结构域是异源二聚体,即,所述Fc结构域包含两个不同的蛋白质片段。
在一些实施方案中,使用本文所描述的离子配对和/或旋钮入孔洞突变来工程化异源二聚体Fc结构域。在一些实施方案中,异源二聚体的基于Fc的嵌合蛋白复合物具有反式取向/构型。在反式取向/构型中,在多个实施方案中,靶向部分和信号传导剂(例如IL-2)未见于本发明的基于Fc的嵌合蛋白复合物的同一多肽链上。
在一些实施方案中,所述Fc结构域包括野生型人IgG1的核心铰链区或从其开始,所述核心铰链区包含序列Cys-Pro-Pro-Cys(SEQ ID NO:276)。在一些实施方案中,所述Fc结构域还包括上铰链或其部分(例如,DKTHTCPPC(SEQ ID NO:451);参见WO 2009053368)、EPKSCDKTHTCPPC(SEQ ID NO:452)或EPKSSDKTHTCPPC(SEQ ID NO:453);参见Lo等人,Protein Engineering第11卷第6期第495-500页,1998))。
基于Fc的嵌合蛋白复合物
本发明技术的基于Fc的嵌合蛋白复合物包含至少一个本文所公开的Fc结构域、至少一个本文所公开的信号传导剂(SA)(例如IL-2)和至少一个本文所公开的靶向部分(TM)。
应当理解,本发明的基于Fc的嵌合蛋白复合物可以涵盖两种融合蛋白的复合物,每一融合蛋白包含Fc结构域。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物是异源二聚体的。在一些实施方案中,所述异源二聚体的基于Fc的嵌合蛋白复合物具有反式取向/构型。在一些实施方案中,所述异源二聚体的基于Fc的嵌合蛋白复合物具有顺式取向/构型。
在一些实施方案中,使用本文所描述的离子配对和/或旋钮入孔洞突变来工程化异源二聚体Fc结构域。在一些实施方案中,异源二聚体的基于Fc的嵌合蛋白复合物具有反式取向。
在反式取向中,在多个实施方案中,靶向部分和信号传导剂未见于本发明的基于Fc的嵌合蛋白复合物的同一多肽链上。在顺式取向中,在多个实施方案中,靶向部分和信号传导剂见于所述基于Fc的嵌合蛋白复合物的独立多肽链上。在顺式取向中,在多个实施方案中,靶向部分和信号传导剂见于所述基于Fc的嵌合蛋白复合物的同一多肽链上。
在一些实施方案中,在本文所描述的异源二聚体蛋白复合物中存在超过一个靶向部分时,一个靶向部分可以处于反式取向(相对于信号传导剂),而另一靶向部分可以处于顺式取向(相对于信号传导剂)。在一些实施方案中,信号传导剂和靶标部分在Fc结构域的相同末端/侧(N末端或C末端)上。在一些实施方案中,信号传导剂和靶向部分在Fc结构域的不同侧/末端(N端和C端)上。
在一些实施方案中,在本文所描述的异源二聚体蛋白复合物中存在超过一个靶向部分时,所述靶向部分可见于异源二聚体蛋白复合物中的同一Fc链上或两条不同的Fc链上(在后一种情况下,所述靶向部分由于在不同的Fc链上,所以相对于彼此是反式的)。在一些实施方案中,在同一Fc链上存在超过一个靶向部分时,所述靶向部分可以在Fc链的同一或不同侧/末端(N端或/和C端)上。
在一些实施方案中,在本文所描述的异源二聚体蛋白复合物中存在超过一个信号传导剂时,所述信号传导剂可见于异源二聚体蛋白复合物中的同一Fc链上或两条不同的Fc链上(在后一种情况下,所述信号传导剂由于在不同的Fc链上,所以相对于彼此是反式的)。在一些实施方案中,在同一Fc链上存在超过一个信号传导剂时,所述信号传导剂可以在Fc链的同一或不同侧/末端(N端或/和C端)上。
在一些实施方案中,在本文所描述的异源二聚体蛋白复合物中存在超过一个信号传导剂时,一个信号传导剂可以处于反式取向(如相对于靶向部分),而另一信号传导剂可以处于顺式取向(如相对于靶向部分)。
在一些实施方案中,所述异源二聚体的基于Fc的嵌合蛋白复合物在单个多肽上不包含信号传导剂(例如IL-2)和靶向部分。
在一些实施方案中,所述基于Fc的嵌合蛋白相对于缺乏Fc的嵌合蛋白或不是异源二聚体复合物的嵌合蛋白具有改善的体内半衰期。在一些实施方案中,所述基于Fc的嵌合蛋白相对于缺乏Fc的嵌合蛋白或不是异源二聚体复合物的嵌合蛋白具有改善的溶解性、稳定性和其他药理特性。
异源二聚体的基于Fc的嵌合蛋白复合物由两种不同的多肽组成。在本文所描述的实施方案中,靶向结构域与信号传导剂(例如IL-2)位于不同的多肽上,因此,蛋白质仅含有一个靶向结构域拷贝,并且也只能制备一个信号传导剂(例如IL-2)拷贝(这提供了一种构型,其中对所期望特性的潜在干扰可以得到控制)。此外,在多个实施方案中,仅一个靶向结构域(例如VHH)可以避免细胞表面上抗原的交联(在一些情况下这可能引发不良作用)。此外,在多个实施方案中,一个信号传导剂(例如IL-2)可以减轻分子“拥挤”和对依赖于靶向结构域的亲合力介导的效应功能恢复的潜在干扰。此外,在多个实施方案中,异源二聚体的基于Fc的嵌合蛋白复合物可以具有两个靶向部分,并且这些靶向部分可以被置于两个不同的多肽上。举例来说,在多个实施方案中,可以掩盖两个靶向部分(例如VHH)的C端,以避免潜在的自身抗体或预先存在的抗体(例如VHH自身抗体或预先存在的抗体)。此外,在多个实施方案中,例如在不同多肽上具有靶向结构域而非信号传导剂(例如IL-2)(例如野生型信号传导剂,例如IL-2)的异源二聚体的基于Fc的嵌合蛋白复合物,可能有利于两种细胞类型(例如肿瘤细胞和免疫细胞)的“交联”。此外,在多个实施方案中,异源二聚体的基于Fc的嵌合蛋白复合物可以具有两个信号传导剂,每个信号传导剂位于不同的多肽上以允许更复杂的效应应答。
此外,在多个实施方案中,例如在不同多肽上具有靶向结构域而非信号传导剂(例如IL-2)的异源二聚体的基于Fc的嵌合蛋白复合物,以实践的方式提供了靶向部分和信号传导剂(例如IL-2)的组合多样性。例如,在多个实施方案中,具有本文所描述的任何靶向部分的多肽可以与具有本文所描述的任何信号传导剂的多肽“现成”组合,以允许在单个基于Fc的嵌合蛋白复合物中快速产生靶向部分和信号传导剂的各种组合。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含一个或多个接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含连接Fc结构域、一个或多个信号传导剂(例如IL-2)和一个或多个靶向部分的接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含连接各信号传导剂(例如IL-2)和靶向部分(或者在存在超过一个靶向部分时将信号传导剂(例如IL-2)连接至所述靶向部分之一)的接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含将各信号传导剂(例如IL-2)连接至Fc结构域的接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含将各靶向部分连接至Fc结构域的接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含将靶向部分连接至另一靶向部分的接头。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含将信号传导剂(例如IL-2)连接至另一信号传导剂的接头。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含两个或更多个靶向部分。在此类实施方案中,所述靶向部分可以是相同的靶向部分或者它们可以是不同的靶向部分。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含两个或更多个信号传导剂。在此类实施方案中,所述信号传导剂可以是相同的靶向部分或者它们可以是不同的靶向部分。
作为实例,在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含Fc结构域、至少两个信号传导剂(SA)和至少两个靶向部分(TM),其中所述Fc结构域、信号传导剂和靶向部分选自本文所公开的Fc结构域、信号传导剂和靶向部分中的任一者。在一些实施方案中,所述Fc结构域是同源二聚体的。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图1A-图1F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图2A-图2H的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图3A-图3H的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图4A-图4D的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图5A-图5F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图6A-图6J的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图7A-图7D的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图8A-图8F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图9A-图9J的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图10A-图10F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图11A-图11L的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图12A-图12L的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图13A-图13F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图14A-图14L的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图15A-图15L的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图16A-图16J的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图17A-图17J的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图18A-图18F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图19A-图19F的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图20A-图20E的示意图中的任一者的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图31的示意图的形式。
在各个实施方案中,所述基于Fc的嵌合蛋白复合物采取图32的示意图的形式。
在一些实施方案中,本发明涵盖基于Fc的嵌合蛋白复合物,所述基于Fc的嵌合蛋白复合物包含表7的一种或多种变体和/或表7中列“ALN2变体”内列出的一种或多种构建体。
在一些实施方案中,所述信号传导剂连接至所述靶向部分并且所述靶向部分连接至Fc结构域的相同末端(参见图1A-图1F)。在一些实施方案中,所述Fc结构域是同源二聚体的。
在一些实施方案中,所述信号传导剂和所述靶向部分连接至Fc结构域,其中靶向部分和信号传导剂连接在相同末端上(参见图1A-图1F)。在一些实施方案中,所述Fc结构域是同源二聚体的。
在一些实施方案中,所述靶向部分连接至信号传导剂并且所述信号传导剂连接至Fc结构域的相同末端(参见图1A-图1F)。在一些实施方案中,所述Fc结构域是同源二聚体的。
在一些实施方案中,同源二聚体的基于Fc的嵌合蛋白复合物具有两个或更多个靶向部分。在一些实施方案中,存在四个靶向部分和两个信号传导剂,所述靶向部分连接至Fc结构域,并且所述信号传导剂连接至靶向部分的相同末端(参见图2A-图2H)。在一些实施方案中,所述Fc结构域是同源二聚体的。在一些实施方案中,在存在四个靶向部分和两个信号传导剂的情况下,两个靶向部分连接至Fc结构域,并且两个靶向部分连接至信号传导剂,所述信号传导剂连接至Fc结构域的相同末端(参见图2A-图2H)。在一些实施方案中,所述Fc结构域是同源二聚体的。在一些实施方案中,在存在四个靶向部分和两个信号传导剂的情况下,两个靶向部分彼此连接,并且每对中的一个靶向部分连接至Fc结构域的相同末端,并且信号传导剂连接至Fc结构域的相同末端(参见图2A-图2H)。在一些实施方案中,所述Fc结构域是同源二聚体的。在一些实施方案中,在存在四个靶向部分和两个信号传导剂的情况下,两个靶向部分彼此连接,其中每对中的一个靶向部分连接至信号传导剂(例如IL-2),而该对中的另一个靶向部分连接至Fc结构域,其中连接至Fc结构域的靶向部分连接在相同末端上(参见图2A-图2H)。在一些实施方案中,所述Fc结构域是同源二聚体的。
在一些实施方案中,同源二聚体的基于Fc的嵌合蛋白复合物具有两个或更多个信号传导剂。在一些实施方案中,在存在四个信号传导剂和两个靶向部分的情况下,两个信号传导剂彼此连接,并且该对中的一个信号传导剂连接至Fc结构域的相同末端,并且所述靶向部分连接至Fc结构域的相同末端(参见图3A-图3H)。在一些实施方案中,所述Fc结构域是同源二聚体的。在一些实施方案中,在存在四个信号传导剂和两个靶向部分的情况下,两个信号传导剂连接至Fc结构域的相同末端,并且所述信号传导剂中的两个各自连接至靶向部分,其中所述靶向部分连接至Fc结构域的相同末端(参见图3A-图3H)。在一些实施方案中,所述Fc结构域是同源二聚体的。在一些实施方案中,在存在四个信号传导剂和两个靶向部分的情况下,两个信号传导剂彼此连接,并且该对中的一个信号传导剂连接至靶向部分,并且所述靶向部分连接至Fc结构域的相同末端(参见图3A-图3H)。在一些实施方案中,所述Fc结构域是同源二聚体的。
作为实例,在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含Fc结构域,其中所述Fc结构域包含一个或多个离子配对突变和/或一个或多个旋钮入孔洞突变;至少一个信号传导剂(例如IL-2);以及至少一个靶向部分,其中所述离子配对基序和/或旋钮入孔洞基序、信号传导剂(例如IL-2)和靶向基团选自本文所公开的离子配对基团和/或旋钮入孔洞基序、信号传导剂和靶向部分中的任一者。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,所述信号传导剂(例如IL-2)连接至所述靶向部分,所述靶向部分连接至所述Fc结构域(参见图10A-图10F和图13A-图13F)。在一些实施方案中,所述靶向部分连接至所述信号传导剂(例如IL-2),所述信号传导剂连接至所述Fc结构域(参见图10A-图10F和图13A-图13F)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,所述信号传导剂(例如IL-2)和所述靶向部分连接至所述Fc结构域(参见图4A-图4D、图7A-图7D、图10A-图10F和图13A-图13F)。在一些实施方案中,所述靶向部分和所述信号传导剂(例如IL-2)连接至不同Fc链的相同末端(参见图4A-图4D和图7A-图7D)。在一些实施方案中,所述靶向部分和所述信号传导剂(例如IL-2)连接至不同Fc链的不同末端(参见图4A-图4D和图7A-图7D)。在一些实施方案中,所述靶向部分和所述信号传导剂(例如IL-2)连接至相同的Fc链(参见图10A-图10F和图13A-图13F)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,所述信号传导剂(例如IL-2)连接至Fc结构域,并且两个靶向部分可以:1)彼此连接,其中一个靶向部分连接至Fc结构域;或者2)各自连接至Fc结构域(参见图5A-图5F、图8A-图8F、图11A-图11L、图14A-图14L、图16A-图16J和图17A-图17J)。在一些实施方案中,靶向部分连接在一个Fc链上,而信号传导剂(例如IL-2)在另一Fc链上(参见图5A-图5F和图8A-图8F)。在一些实施方案中,成对的靶向部分和信号传导剂(例如IL-2)连接至相同的Fc链(参见图1iA-图11L和图14A-图14L)。在一些实施方案中,一个靶向部分连接至Fc结构域,另一个靶向部分连接至信号传导剂(例如IL-2),并且成对的靶向部分连接至Fc结构域(参见图11A-图11L、图14A-图14L、图16A-图16J和图17A-图17J)。在一些实施方案中,不成对的靶向部分和成对的靶向部分连接至相同的Fc链(参见图11A-图11L和图14A-图14L)。在一些实施方案中,不成对的靶向部分和成对的靶向部分连接至不同的Fc链(参见图16A-图16J和图17A-图17J)。在一些实施方案中,不成对的靶向部分和成对的靶向部分连接在相同的末端上(参见图16A-图16J和图17A-图17J)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,靶向部分连接至信号传导剂(例如IL-2),所述信号传导剂连接至Fc结构域,并且不成对的靶向部分连接至Fc结构域(参见图11A-图11L、图14A-图14L、图16A-图16J和图17A-图17J)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的靶向部分连接至相同的Fc链(参见图11A-图11L和图14A-图14L)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的靶向部分连接至不同的Fc链(参见图16A-图16J和图17A-图17J)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的靶向部分连接在相同的末端上(参见图16A-图16J和图17A-图17J)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,靶向部分连接在一起,并且信号传导剂(例如IL-2)连接至所述成对的靶向部分中的一个,其中未连接至信号传导剂(例如IL-2)的靶向部分连接至Fc结构域(参见图11A-图11L和图14A-图14L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,靶向部分连接在一起,并且信号传导剂(例如IL-2)连接至所述成对的靶向部分中的一个,其中信号传导剂(例如IL-2)连接至Fc结构域(参见图11A-图11L和图14A-图14L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,靶向部分均连接至信号传导剂(例如IL-2),其中靶向部分中的一个连接至Fc结构域(参见图11A-图11L和图14A-图14L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在一个信号传导剂(例如IL-2)和两个靶向部分的情况下,靶向部分和信号传导剂(例如IL-2)连接至Fc结构域(参见图16A-图16J和图17A-图17J)。在一些实施方案中,靶向部分连接在末端上(参见图16A-图16J和图17A-图17J)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂连接至Fc结构域的相同末端,并且靶向部分连接至Fc结构域(参见图6A-图6J和图9A-图9J)。在一些实施方案中,信号传导剂连接至同一Fc链上的Fc结构域,而靶向部分连接在另一Fc链上(参见图18A-图18F和图19A-图19F)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂(例如IL-2)连接至靶向部分,所述靶向部分连接至Fc结构域,另一信号传导剂(例如IL-2)连接至Fc结构域(参见图6A-图6J、图9A-图9J、图12A-图12L和图15A-图15L)。在一些实施方案中,靶向部分和不成对的信号传导剂(例如IL-2)连接至不同的Fc链(参见图6A-图6J和图9A-图9J)。在一些实施方案中,靶向部分和不成对的信号传导剂(例如IL-2)连接至不同Fc链的相同末端(参见图6A-图6J和图9A-图9J)。在一些实施方案中,靶向部分和不成对的信号传导剂(例如IL-2)连接至不同Fc链的不同末端(参见图6A-图6J和图9A-图9J)。在一些实施方案中,靶向部分和不成对的信号传导剂(例如IL-2)连接至相同的Fc链(参见图12A-图12L和图15A-图15L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,靶向部分连接至信号传导剂(例如IL-2),所述信号传导剂连接至Fc结构域,并且另一个信号传导剂(例如IL-2)连接至Fc结构域(参见图6A-图6J和图9A-图9J)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的信号传导剂(例如IL-2)连接至不同的Fc链(参见图6A-图6J和图9A-图9J)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的信号传导剂(例如IL-2)连接至不同Fc链的相同末端(参见图6A-图6J和图9A-图9J)。在一些实施方案中,成对的信号传导剂(例如IL-2)和不成对的信号传导剂(例如IL-2)连接至不同Fc链的不同末端(参见图6A-图6J和图9A-图9J)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂连接在一起,并且靶向部分连接至成对的信号传导剂中的一个,其中靶向部分连接至Fc结构域(参见图12A-图12L和图15A-图15L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂连接在一起,并且所述信号传导剂中的一个连接至Fc结构域,并且靶向部分连接至Fc结构域(参见图12A-图12L、图15A-图15L、图18A-图18F和图19A-图19F)。在一些实施方案中,成对的信号传导剂和靶向部分连接至相同的Fc链(参见图12A-图12L和图15A-图15L)。在一些实施方案中,成对的信号传导剂和靶向部分连接至不同的Fc链(参见图18A-图18F和图19A-图19F)。在一些实施方案中,成对的信号传导剂和靶向部分连接至不同Fc链的相同末端(参见图18A-图18F和图19A-图19F)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂均连接至靶向部分,其中所述信号传导剂中的一个连接至Fc结构域(参见图12A-图12L和图15A-图15L)。在一些实施方案中,所述Fc结构域是异源二聚体的。在一些实施方案中,所述Fc结构域包含减少或消除其效应功能的突变。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,信号传导剂连接在一起,并且所述信号传导剂中的一个连接至靶向部分,并且另一个信号传导剂(例如IL-2)连接至Fc结构域(参见图12A-图12L和图15A-图15L)。
在一些实施方案中,在存在两个信号传导剂和一个靶向部分的情况下,每个信号传导剂(例如IL-2)连接至Fc结构域,并且靶向部分连接至所述信号传导剂中的一个(参见图12A-图12L和图15A-图15L)。在一些实施方案中,信号传导剂连接至相同的Fc链(参见图12A-图12L和图15A-图15L)。
在一些实施方案中,靶向部分或信号传导剂(例如IL-2)连接至包含CH2和CH3结构域中的一者或两者和任选地铰链区的Fc结构域。举例来说,编码作为单个核苷酸序列连接至Fc结构域的靶向部分、信号传导剂(例如IL-2)或它们的组合的载体可用于制备此类多肽。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:291-296、298-335、340-345、347-359、361-368、371-375、377-449中的任一者具有至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%同一性的氨基酸序列的多肽。
在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:291-296和298-335中的任一者具有至少95%、或至少98%、或至少99%同一性的氨基酸序列的多肽。在多个实施方案中,所述基于Fc的嵌合蛋白复合物包含具有选自SEQ ID NO:291-296、298-335的氨基酸序列且相对于所述氨基酸序列具有少于10个突变的多肽。在多个实施方案中,所述基于Fc的嵌合蛋白复合物包含具有选自SEQ ID NO:291-296、298-335的氨基酸序列且相对于所述氨基酸序列具有少于5个突变的多肽。在一些实施方案中,所述基于Fc的嵌合蛋白复合物包含具有选自SEQ ID NO:291-296、298-335的氨基酸序列的多肽。在特定实施方案中,所述基于Fc的嵌合蛋白复合物包含具有与SEQ ID NO:292、293、294、299、301、310、311、312、315、316、319、320、325、328、332、333和335中的任一者具有至少95%、或至少98%、或至少99%同一性的氨基酸序列的多肽。在特定实施方案中,所述基于Fc的嵌合蛋白复合物包含具有选自SEQ ID NO:292、293、294、299、301、310、311、312、315、316、319、320、325、328、332、333和335的氨基酸序列的多肽。
另外的信号传导剂
在一方面,本发明提供了嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物除本文所描述的经修饰的IL-2之外,还包含一个或多个信号传导剂(例如免疫调节剂)。在说明性实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物除本文所描述的经修饰的IL-2之外,还可包含两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个信号传导剂。在各个实施方案中,所述另外的信号传导剂经过修饰以便对其受体中的一者或多者具有降低的亲和力或活性,从而允许减弱活性(包括激动或拮抗)和/或预防所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的非特异性信号传导或不理想螯合。
在各个实施方案中,所述另外的信号传导剂在其野生型形式下具有拮抗性,并且携带一个或多个减弱其拮抗活性的突变。在各个实施方案中,所述另外的信号传导剂由于一个或多个突变而具有拮抗性,例如激动性信号传导剂被转化成拮抗性信号传导剂,并且任选地,这种经过转化的信号传导剂还携带一个或多个减弱其拮抗活性的突变(例如,如WO2015/007520中所描述,所述文献的全部内容特此以引用方式并入)。
在各个实施方案中,所述另外的信号传导剂选自细胞因子、生长因子和激素的经修饰型式。此类细胞因子、生长因子和激素的说明性实例包括但不限于淋巴因子、单核因子、传统多肽激素(诸如人生长激素、N-甲硫氨酰人生长激素和牛生长激素);甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;松弛素原;糖蛋白激素诸如促卵泡激素(FSH)、促甲状腺激素(TSH)和促黄体生成激素(LH);肝脏生长因子;成纤维细胞生长因子;催乳激素;胎盘催乳激素;肿瘤坏死因子-α和肿瘤坏死因子-β;苗勒氏管抑制物;小鼠促性腺激素相关肽;抑制素;激活素;血管内皮生长因子;整合素;促血小板生成素(TPO);神经生长因子如NGF-α;血小板生长因子;转化生长因子(TGF)诸如TGF-α和TGF-β;胰岛素样生长因子-I和胰岛素样生长因子-II;骨诱导因子;干扰素诸如例如干扰素-α、干扰素-β和干扰素-γ(以及I型干扰素、II型干扰素和III型干扰素)、集落刺激因子(CSF)诸如巨噬细胞-CSF(M-CSF);粒细胞-巨噬细胞-CSF(GM-CSF);和粒细胞-CSF(G-CSF);白介素(IL),诸如例如IL-1β、IL-1α、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-15和IL-18;肿瘤坏死因子诸如例如TNF-α或TNF-β;和其他多肽因子,包括例如LIF和kit配体(KL)。如本文所使用,细胞因子、生长因子和激素包括获自天然来源或者由重组的细菌、真核生物或哺乳动物细胞培养系统产生的蛋白质,以及天然序列细胞因子的生物活性等效物。
在一些实施方案中,所述另外的信号传导剂是选自但不限于转化生长因子(TGF)诸如(TGF-α和TGF-β)、表皮生长因子(EGF)、胰岛素样生长因子(诸如胰岛素样生长因子-I和胰岛素样生长因子-II)、成纤维细胞生长因子(FGF)、遗传调节蛋白(heregulin)、血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)的生长因子的经修饰型式。
在一个实施方案中,所述生长因子是成纤维细胞生长因子(FGF)的经修饰型式。说明性FGF包括但不限于FGF1、FGF2、FGF3、FGF4、FGF5、FGF6、FGF7、FGF8、FGF9、FGF10、FGF11、FGF12、FGF13、FGF14、鼠FGF15、FGF16、FGF17、FGF18、FGF19、FGF20、FGF21、FGF22和FGF23。
在一个实施方案中,所述生长因子是血管内皮生长因子(VEGF)的经修饰型式。说明性VEGF包括但不限于VEGF-A、VEGF-B、VEGF-C、VEGF-D和PGF以及它们的同种型,包括VEGF-A的各种同种型,诸如VEGF
在一个实施方案中,所述生长因子是转化生长因子(TGF)的经修饰型式。说明性TGF包括但不限于TGF-α和TGF-β及其亚型,包括TGF-β的各种亚型,包括TGFβ1、TGFβ2和TGFβ3。
在一些实施方案中,所述另外的信号传导剂是选自但不限于以下的激素的经修饰型式:人绒毛膜促性腺激素、促性腺激素释放激素、雄激素、雌激素、促甲状腺激素、促卵泡激素、促黄体生成激素、催乳激素、生长激素、促肾上腺皮质激素、抗利尿激素、催产素、促甲状腺激素释放激素、生长激素释放激素、促肾上腺皮质激素释放激素、生长激素抑制素、多巴胺、褪黑激素、甲状腺素、降血钙素、甲状旁腺激素、糖皮质激素、盐皮质激素、肾上腺素、去甲肾上腺素、黄体酮、胰岛素、升糖素、支链淀粉、钙三醇、钙化醇、心房利钠肽、胃泌素、分泌素、胆囊收缩素、神经肽Y、饥饿素、PYY3-36、胰岛素样生长因子(IGF)、瘦素、促血小板生成素、红细胞生成素(EPO)和血管紧张素原。
在一些实施方案中,所述另外的信号传导剂是免疫调节剂,例如白介素、干扰素和肿瘤坏死因子中的一者或多者。
在一些实施方案中,所述另外的信号传导剂是白介素,包括例如IL-1β;IL-2;IL-3;IL-4;IL-5;IL-6;IL-7;IL-8;IL-9;IL-10;IL-11;IL-12;IL-13;IL-14;IL-15;IL-16;IL-17;IL-18;IL-19;IL-20;IL-21;IL-22;IL-23;IL-24;IL-25;IL-26;IL-27;IL-28;IL-29;IL-30;IL-31;IL-32;IL-33;IL-35;IL-36或者它们的片段、变体、类似物或家族成员。白介素是由淋巴细胞、单核细胞和巨噬细胞合成的一组多功能细胞因子。已知的功能包括刺激免疫细胞(例如T辅助细胞、B细胞、嗜酸性粒细胞和淋巴细胞)的增殖、嗜中性粒细胞和T淋巴细胞的趋化性和/或干扰素的抑制。可以使用本领域中已知的测定法来测定白介素活性:Matthews等人,Lymphokines and Interferons:A Practical Approach,Clemens等人编辑,IRL Press,Washington,D.C.1987,第221-225页;以及Orencole和Dinarello(1989)Cytokine 1,14-20。
在一些实施方案中,所述信号传导剂是干扰素诸如I型干扰素、II型干扰素和III型干扰素的经修饰型式。说明性干扰素包括例如干扰素-α-1、干扰素-α-2、干扰素-α-4、干扰素-α-5、干扰素-α-6、干扰素-α-7、干扰素-α-8、干扰素-α-10、干扰素-α-13、干扰素-α-14、干扰素-α-16、干扰素-α-17和干扰素-α-21、干扰素-β以及干扰素-γ、干扰素κ、干扰素ε、干扰素τ和干扰素ω。
在多个实施方案中,所述另外的信号传导剂是I型干扰素。在多个实施方案中,所述I型干扰素选自IFNα2、IFNα1、IFN-β、IFN-γ、共有IFN、IFN-ε、IFN-κ、IFN-τ、IFN-δ和IFN-v。
在一些实施方案中,所述另外的信号传导剂是肿瘤坏死因子(TNF)或TNF家族中的蛋白质,包括但不限于TNF-α、TNF-β、LT-β、CD40L、CD27L、CD30L、FASL、4-1BBL、OX40L和TRAIL的经修饰型式。
在各个实施方案中,所述另外的信号传导剂是具有一个或多个突变的信号传导剂的经修饰(例如突变)形式。在各个实施方案中,所述突变允许经修饰的信号传导剂相对于信号传导剂的未经修饰或未突变,即野生型形式具有一种或多种减弱的活性,诸如降低的结合亲和力、降低的内源活性和降低的特异性生物活性中的一者或多者(例如,比较同一种信号传导剂的野生型形式对比修饰(例如突变)形式)。在各个实施方案中,所述突变允许所述经修饰的信号传导剂相对于未经修饰或未突变信号传导剂即未突变IL-2具有一种或多种减弱的活性,诸如降低的结合亲和力、降低的内源活性和降低的特异性生物活性中的一者或多者。在一些实施方案中,减弱或降低结合或亲和力的突变包括基本上降低或消除结合或活性的那些突变。在一些实施方案中,减弱或降低结合或亲和力的突变不同于基本上降低或消除结合或活性的那些突变。结果,在各个实施方案中,所述突变允许信号传导剂相对于未突变,即野生型信号传导剂更安全,例如,具有降低的全身毒性、减少的副作用和减少的脱靶效应(例如,比较同一种信号传导剂的野生型形式对比修饰(例如突变)形式)。在各个实施方案中,所述突变允许信号传导剂相对于未突变的信号传导剂,例如IL-2的未突变序列更安全,例如,具有降低的全身毒性、减少的副作用和减少的脱靶效应。
在各个实施方案中,所述另外的信号传导剂经过修饰以具有一个或多个降低其对其受体中的一者或多者的结合亲和力或活性的突变。在一些实施方案中,所述信号传导剂经过修饰以具有一个或多个基本上降低或消除对所述受体的结合亲和力或活性的突变。在一些实施方案中,所述野生型信号传导剂提供的活性是在所述受体处的激动作用(例如,激活治疗位点的细胞效应)。举例来说,所述野生型信号传导剂可以激活其受体。在此类实施方案中,所述突变使得经修饰的信号传导剂在所述受体处的激活活性被降低或消除。举例来说,所述突变可以使得所述经修饰的信号传导剂向靶细胞递送减弱的激活信号,或者可以消除所述激活信号。在一些实施方案中,所述野生型信号传导剂提供的活性是在所述受体处的拮抗作用(例如阻断或阻遏治疗位点的细胞效应)。举例来说,所述野生型信号传导剂可以拮抗或抑制所述受体。在这些实施方案中,所述突变使得所述经修饰的信号传导剂在所述受体处的拮抗活性被降低或消除。举例来说,所述突变可以使得所述经修饰的信号传导剂向靶细胞递送减弱的抑制信号,或者可以消除所述抑制信号。在各个实施方案中,所述信号传导剂由于一个或多个突变而具有拮抗性,例如将激动性信号传导剂转化成拮抗性信号传导剂(例如,如WO 2015/007520中所描述,所述文献的全部内容特此以引用方式并入),并且任选地,这种经转化的信号传导剂还携带一个或多个降低其对其受体中的一者或多者的结合亲和力或活性,或者基本上降低或消除对其受体中的一者或多者的结合亲和力或活性的突变。
在一些实施方案中,所述受体处降低的亲和力或活性可通过与一个或多个靶向部分连接或在包含于本文所公开的基于Fc的嵌合蛋白复合物中后而诱导或恢复。在其他实施方案中,所述受体处降低的亲和力或活性基本上不能通过一个或多个靶向部分的活性或在包含于本文所公开的基于Fc的嵌合蛋白复合物中后而诱导或恢复。
在各个实施方案中,所述另外的信号传导剂对靶细胞具有活性,因为所述一个或多个靶向部分补偿了实质性激活所需的结合(例如但不限于和/或亲合力)的缺失/不足。在各个实施方案中,所述经修饰的信号传导剂对治疗活性位点的途径基本上无活性,并且其效应基本上针对特异性靶向的细胞类型,从而大大减少了不希望的副作用。
在一些实施方案中,所述另外的信号传导剂可以包括一个或多个减弱或减少对一个受体(即,治疗受体)的结合或亲和力的突变以及一个或多个基本上降低或消除第二受体处的结合或活性的突变。在此类实施方案中,这些突变可以处在相同或不同的位置上(即,相同突变或多个突变)。在一些实施方案中,减少一个受体处的结合和/或活性的一个或多个突变与基本上降低或消除另一个受体处的结合和/或活性的一个或多个突变不同。在一些实施方案中,减少一个受体处的结合和/或活性的一个或多个突变与基本上降低或消除另一个受体处的结合和/或活性的一个或多个突变相同。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有经修饰的信号传导剂,所述经修饰的信号传导剂兼具减弱治疗受体处的结合和/或活性且因此允许更受控制的中靶治疗效果(例如相对于野生型信号传导剂)的突变与基本上降低或消除另一个受体处的结合和/或活性且因此减少副作用(例如相对于野生型信号传导剂)的突变。
在一些实施方案中,结合或活性的实质性降低或消除基本上不能通过靶向部分或在包含于本文所公开的基于Fc的嵌合蛋白复合物中后而诱导或恢复。在一些实施方案中,结合或活性的实质性降低或消除可通过靶向部分或在包含于本文所公开的基于Fc的嵌合蛋白复合物中后而诱导或恢复。在各个实施方案中,基本上降低或消除第二受体处的结合或活性还可以防止另一个受体介导的不利效应。可以选地或另外地,基本上降低或消除另一个受体处的结合或活性改善了治疗效果,因为治疗性嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的降低或消除的螯合远离治疗作用位点。举例来说,在一些实施方案中,这就回避了对高剂量的能补偿另一个受体处的损失的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的需要。这种降低剂量的能力还提供了较低的副作用可能性。
在各个实施方案中,所述另外的经修饰的信号传导剂包含一个或多个突变,所述一个或多个突变致使所述信号传导剂对其受体中的一者或多者具有降低、基本上降低或消除的亲和力,例如结合(例如K
在所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有降低一个受体处的结合且基本上降低或消除第二受体处的结合的突变的实施方案中,经修饰的信号传导剂对一个受体的结合亲和力的减弱或降低程度低于对另一个受体的亲和力的实质性降低或消除。在一些实施方案中,经修饰的信号传导剂对一个受体的结合亲和力的减弱或降低比对另一个受体的亲和力的实质性降低或消除低约1%、或约3%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约60%、约65%、约70%、约75%、约80%、约85%、约90%或约95%。在各个实施方案中,实质性降低或消除是指在结合亲和力和/或活性方面存在比减弱或降低更大程度的降低。
在各个实施方案中,所述另外的经修饰的信号传导剂包含一个或多个突变,所述一个或多个突变使所述信号传导剂的内源活性例如相对于所述野生型信号传导剂(包括但不限于,相对于未突变的IL-2)降至约75%、或约70%、或约60%、或约50%、或约40%、或约30%、或约25%、或约20%、或约10%、或约5%、或约3%、或约1%。
在各个实施方案中,所述另外的经修饰的信号传导剂包含一个或多个突变,所述一个或多个突变使所述信号传导剂对本文所描述的细胞因子、生长因子和激素中的任一者的受体具有降低的亲和力和/或活性。
在一些实施方案中,所述另外的经修饰的信号传导剂包含一个或多个突变,所述一个或多个突变致使所述信号传导剂对其受体具有降低的亲和力,比所述一个或多个靶向部分对其一个或多个受体的结合亲和力更低。在一些实施方案中,这种结合亲和力差异存在于相同细胞上的信号传导剂/受体与靶向部分/受体之间。在一些实施方案中,这种结合亲和力差异允许所述信号传导剂(例如突变的信号传导剂)具有局部化中靶效应并且使构成在野生型信号传导剂情况下观察到的副作用的基础的脱靶效应最小化。在一些实施方案中,这种结合亲和力低至少约2倍、或至少约5倍、或至少约10倍、或至少约15倍、或低至少约25倍、或至少约50倍、或至少约100倍、或至少约150倍。
可以使用本领域中已知的方法来测量受体结合活性。举例来说,可以通过对结合数据进行斯卡查德图分析和计算机拟合(例如Scatchard,1949)或通过如Brecht等人(1993)所描述在流经条件下进行反射干涉光谱法来评定亲和力和/或结合活性,所有文献的全部内容特此以引用方式并入。在一些实施方案中,使用生物层干涉法(BLI)测量受体结合活性。
本文所描述的野生型信号传导剂的氨基酸序列在本领域中是众所周知的。因此,在各个实施方案中,所述另外的经修饰的信号传导剂包含与本文所描述的信号传导剂的已知野生型氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性(例如约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、或约99%序列同一性)的氨基酸序列。
在各个实施方案中,所述另外的经修饰的信号传导剂包含与本文所公开的任何序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性(例如约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、或约99%序列同一性)的氨基酸序列。
在各个实施方案中,所述另外的经修饰的信号传导剂包含具有一个或多个氨基酸突变的氨基酸序列。在一些实施方案中,所述一个或多个氨基酸突变可以独立地选自取代、插入、缺失和截短。
在一些实施方案中,所述氨基酸突变是氨基酸取代,并且可以包括如本文所描述的保守和/或非保守取代。
如本文所描述,所述另外的经修饰的信号传导剂携带影响一个或多个受体处的亲和力和/或活性的突变。在各个实施方案中,存在对治疗受体,例如通过其介导期望的治疗效果(激动或拮抗)的受体的降低的亲和力和/或活性。在各个实施方案中,所述经修饰的信号传导剂携带基本上降低或消除在受体,例如通过其不介导期望的治疗效果(例如,由于结合的混杂性的结果)的受体处的亲和力和/或活性的突变。如本文所描述的任何经修饰的信号传导剂的受体,例如细胞因子、生长因子和激素之一都是本领域中已知的。
提供在受体处降低的亲和力和/或活性(例如激动性)的说明性突变发现于WO2013/107791(例如,关于干扰素)、WO 2015/007542(例如,关于白介素)和WO 2015/007903(例如,关于TNF)中,各文献的全部内容特此以引用方式并入。提供在治疗受体处降低的亲和力和/或活性(例如拮抗性)的说明性突变见于WO 2015/007520中,所述文献的全部内容特此以引用方式并入。
在一些实施方案中,所述另外的经修饰的信号传导剂包含一个或多个突变,所述一个或多个突变致使所述信号传导剂对I型细胞因子受体、II型细胞因子受体、趋化因子受体、肿瘤坏死因子受体(TNFR)超家族中的受体中、TGF-β受体、免疫球蛋白(Ig)超家族中的受体和/或酪氨酸激酶超家族中的受体具有降低的亲和力和/或活性。
在各个实施方案中,所述另外的信号传导剂的受体是I型细胞因子受体。I型细胞因子受体在本领域中是已知的,并且包括但不限于IL2(β亚单位)、IL3、IL4、IL5、IL6、IL7、IL9、IL11、IL12、GM-CSF、G-CSF、LIF、CNTF的受体,以及促血小板生成素(TPO)、催乳素和生长激素的受体。说明性I型细胞因子受体包括但不限于GM-CSF受体、G-CSF受体、LIF受体、CNTF受体、TPO受体和I型IL受体。
在各个实施方案中,所述另外的信号传导剂的受体是II型细胞因子受体。II型细胞因子受体是由异源亚单位构成的多聚体受体并且是主要用于干扰素的受体。此受体家族包括但不限于干扰素-α、干扰素-β和干扰素-γ、IL10、IL22和组织因子的受体。说明性II型细胞因子受体包括但不限于IFNα受体(例如IFNAR1和IFNAR2)、IFNβ受体、IFNγ受体(例如IFNGR1和IFNGR2)和II型IL受体。
在各个实施方案中,所述另外的信号传导剂的受体是G蛋白偶联受体。趋化因子受体是具有七个跨膜结构并与G蛋白偶联以进行信号转导的G蛋白偶联受体。趋化因子受体包括但不限于CC趋化因子受体、CXC趋化因子受体、CX3C趋化因子受体和XC趋化因子受体(XCR1)。说明性趋化因子受体包括但不限于CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CCR10、CXCR1、CXCR2、CXCR3、CXCR3B、CXCR4、CXCR5、CSCR6、CXCR7、XCR1和CX3CR1。
在各个实施方案中,所述另外的信号传导剂的受体是TNFR家族成员。肿瘤坏死因子受体(TNFR)家族成员共享由围绕CXXCXXC核心基序的三个二硫键形成的富半胱氨酸结构域(CRD),从而形成细长分子。说明性肿瘤坏死因子受体家族成员包括:CD1 20a(TNFRSF1A)、CD 120b(TNFRSF1B)、淋巴毒素β受体(LTBR、TNFRSF3)、CD 134(TNFRSF4)、CD40(CD40、TNFRSF5)、FAS(FAS、TNFRSF6)、TNFRSF6B(TNFRSF6B)、CD27(CD27、TNFRSF7)、CD30(TNFRSF8)、CD137(INFRSF9)、TNFRSF1OA(TNFRSF1OA)、TNFRSF1OB、(TNFRSF1OB)、TNFRSF1OC(TNFRSF1OC)、TNFRSF1OD(TNFRSF1OD)、RANK(TNFRSFI 1A)、骨保护素(TNFRSF1 IB)、TNFRSF12A(TNFRSF12A)、TNFRSF13B(TNFRSF13B)、TNFRSF13C(TNFRSF13C)、TNFRSF14(TNFRSF14)、神经生长因子受体(NGFR、TNFRSF16)、TNFRSF17(TNFRSF17)、TNFRSF18(TNFRSF18)、TNFRSF19(TNFRSF19)、TNFRSF21(TNFRSF21)和TNFRSF25(TNFRSF25)。
在各个实施方案中,所述另外的信号传导剂的受体是TGF-β受体。TGF-β受体是单程丝氨酸/苏氨酸激酶受体。TGF-β受体包括但不限于TGFBR1、TGFBR2和TGFBR3。
在各个实施方案中,所述另外的信号传导剂的受体是Ig超家族受体。免疫球蛋白(Ig)超家族中的受体与免疫球蛋白享有结构同源性。Ig超家族中的受体包括但不限于白介素1受体、CSF-1R、PDGFR(例如PDGFRA和PDGFRB)和SCFR。
在各个实施方案中,所述另外的信号传导剂的受体是酪氨酸激酶超家族受体。所述酪氨酸激酶超家族中的受体在本领域中是众所周知的。大约有58种已知的受体酪氨酸激酶(RTK),分为20个亚家族。所述酪氨酸激酶超家族中的受体包括但不限于FGF受体及其各种同种型,诸如FGFR1、FGFR2、FGFR3、FGFR4和FGFR5。
在一个实施方案中,所述另外的经修饰的信号传导剂是干扰素α。在此类实施方案中,所述经修饰的IFNα剂对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的IFN-α剂对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有基本上降低或消除的亲和力和/或活性。
干扰素α的突变形式对本领域技术人员是已知的。在说明性实施方案中,所述经修饰的信号传导剂是具有氨基酸序列SEQ ID NO:233的等位基因形式IFNα2a。
在说明性实施方案中,所述经修饰的信号传导剂是具有氨基酸序列SEQ ID NO:234的等位基因形式IFNα2b(,它在氨基酸位置23处与IFNα2a不同)。
在一些实施方案中,所述IFNα2突变体(IFNα2a或IFNα2b)在144-154位的一个或多个氨基酸,诸如氨基酸位置145、148、149和/或153处发生突变。在一些实施方案中,所述IFNα2突变体包含选自A145G、L153A、R149A和M148A的一个或多个突变。此类突变体描述于例如WO2013/107791和Piehler等人,(2000)J.Biol.Chem,275:40425-33中,所有文献的全部内容特此以引用方式并入。
在一些实施方案中,所述IFNα2突变体对IFNAR1具有降低的亲和力和/或活性。在一些实施方案中,所述IFNα2突变体包含选自如WO2010/030671中所描述的F64A、N65A、T69A、L80A、Y85A和Y89A的一个或多个突变,所述文献的全部内容特此以引用方式并入。
在一些实施方案中,所述IFNα2突变体包含选自如WO2008/124086中所描述的K133A、R144A、R149A和L153A的一个或多个突变,所述文献的全部内容特此以引用方式并入。
在一些实施方案中,所述IFNα2突变体包含选自如WO2015/007520和WO2010/030671中所描述的R120E和R120E/K121E的一个或多个突变,所述文献的全部内容特此以引用方式并入。在此类实施方案中,所述IFNα2突变体拮抗野生型IFNα2活性。在此类实施方案中,所述突变IFNα2对IFNAR1具有降低的亲和力和/或活性,而保留对IFNR2的亲和力和/或活性。
在一些实施方案中,所述人IFNα2突变体包含(1)选自R120E和R120E/K121E的一个或多个突变,不希望受理论束缚,所述突变能产生拮抗效应;和(2)选自K133A、R144A、R149A和L153A的一个或多个突变,不希望受理论束缚,所述突变允许减弱例如IFNAR2处的效应。在一个实施方案中,所述人IFNα2突变体包含R120E和L153A。
在一些实施方案中,所述人IFNα2突变体包含一个或多个突变,所述一个或多个突变选自如WO 2013/059885中所公开的L15A、A19W、R22A、R23A、L26A、F27A、L30A、L30V、K31A、D32A、R33K、R33A、R33Q、H34A、D35A、Q40A、D114R、L117A、R120A、R125A、K134A、R144A、A145G、A145M、M148A、R149A、S152A、L153A和N156A,所述文献的全部公开内容特此以引用方式并入。在一些实施方案中,所述人IFNα2突变体包含如WO 2013/059885中所公开的突变H57Y、E58N、Q61S和/或L30A。在一些实施方案中,所述人IFN-α2突变体包含如WO 2013/059885中所公开的突变H57Y、E58N、Q61S和/或R33A。在一些实施方案中,所述人IFNα2突变体包含如WO 2013/059885中所公开的突变H57Y、E58N、Q61S和/或M148A。在一些实施方案中,所述人IFNα2突变体包含如WO 2013/059885中所公开的突变H57Y、E58N、Q61S和/或L153A。在一些实施方案中,所述人IFNα2突变体包含如WO 2013/059885中所公开的突变N65A、L80A、Y85A和/或Y89A。在一些实施方案中,所述人IFNα2突变体包含如WO 2013/059885中所公开的突变N65A、L80A、Y85A、Y89A和/或D114A。在一些实施方案中,所述人IFNα2突变体包含选自R144X
在一些实施方案中,所述另外的经修饰的信号传导剂是IFNα1。在此类实施方案中,所述经修饰的IFNα1信号传导剂还对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的IFNα1剂对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有基本上降低或消除的亲和力和/或活性。
在一些实施方案中,相对于SEQ ID NO:450,所述另外的经修饰的IFNα1信号传导剂经过修饰以在位置L15、A19、R23、S25、L30、D32、R33、H34、Q40、D115、L118、K121、R126、E133、K134、K135、R145、A146、M149、R150、S153、L154和N157处的一个或多个氨基酸处具有突变。所述突变可任选地是疏水性突变,并且可以例如选自丙氨酸、缬氨酸、亮氨酸和异亮氨酸。在一些实施方案中,相对于SEQ ID NO:450,所述IFNα1干扰素经过修饰以具有一个或多个选自以下的突变:L15A、A19W、R23A、S25A、L30A、L30V、D32A、R33K、R33A、R33Q、H34A、Q40A、D115R、L118A、K121A、K121E、R126A、R126E、E133A、K134A、K135A、R145A、R145D、R145E、R145G、R145H、R145I、R145K、R145L、R145N、R145Q、R145S、R145T、R145V、R145Y、A146D、A146E、A146G、A146H、A146I、A146K、A146L、A146M、A146N、A146Q、A146R、A146S、A146T、A146V、A146Y、M149A、M149V、R150A、S153A、L154A和N157A。在一些实施方案中,相对于SEQID NO:450,所述IFNα1突变体包含一个或多个选自以下的突变:L30A/H58Y/E59N/Q62S、R33A/H58Y/E59N/Q62S、M149A/H58Y/E59N/Q62S、L154A/H58Y/E59N/Q62S、R145A/H58Y/E59N/Q62S、D115A/R121A、L118A/R121A、L118A/R121A/K122A、R121A/K122A和R121E/K122E。
在一个实施方案中,所述另外的经修饰的IFNα1信号传导剂或其变体经过修饰相对于SEQ ID NO:450在氨基酸位置C1、C29、C86、C99或C139处具有一个或多个突变。就这一点而言,Beilharz等人Journal of interferon research 6.6(1986):677-685(特此以引用方式整体并入)描述了可用于引入本发明的经修饰的IFNα1中的各种IFNα1突变。位置C86处的突变可以是例如C86S或C86A或C86Y。IFNα1的这些C86突变体被称为基于还原半胱氨酸的聚集突变体。在一些实施方案中,相对于SEQ ID NO:450,IFNα1变体包括位置C1、C86和C99处的突变。
在一个实施方案中,所述另外的经修饰的信号传导剂是干扰素β。在此类实施方案中,所述经修饰的干扰素β剂还对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的干扰素β剂对IFN-α/β受体(IFNAR),即IFNAR1和/或IFNAR2链具有基本上降低或消除的亲和力和/或活性。
在说明性实施方案中,所述经修饰的另外的信号传导剂是IFNβ。在各个实施方案中,所述IFNβ涵盖IFNβ的功能性衍生物、类似物、前体、同种型、剪接变体或片段。在各个实施方案中,所述IFNβ涵盖来源于任何物种的IFNβ。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含小鼠IFNβ的经修饰型式。在另一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含人IFNβ的经修饰型式。人IFNβ是包含166个氨基酸残基的分子量为约22kDa的多肽。人IFNβ的氨基酸序列是SEQID NO:277。
在一些实施方案中,所述人IFNβ是呈人IFNβ的糖基化形式的IFNβ-1a。在一些实施方案中,所述人IFNβ是呈人IFNβ的非糖基化形式的IFNβ-1b,它具有Met-1缺失和Cys-17至Ser突变。
在各个实施方案中,所述经修饰的IFNβ具有一个或多个突变,所述一个或多个突变降低了所述IFNα1变体对IFNAR的IFNAR1亚单位的结合或亲和力。在一个实施方案中,所述经修饰的IFNβ在IFNAR1处具有降低的亲和力和/或活性。在各个实施方案中,所述经修饰的IFNβ是人IFNβ,并且在位置F67、R71、L88、Y92、I95、N96、K123和R124处具有一个或多个突变。在一些实施方案中,所述一个或多个突变是选自F67G、F67S、R71A、L88G、L88S、Y92G、Y92S、I95A、N96G、K123G和R124G的取代。在一个实施方案中,所述经修饰的IFNβ包含F67G突变。在一个实施方案中,所述经修饰的IFNβ包含K123G突变。在一个实施方案中,所述经修饰的IFNβ包含F67G和R71A突变。在一个实施方案中,所述经修饰的IFNβ包含L88G和Y92G突变。在一个实施方案中,所述经修饰的IFNβ包含Y92G、I95A和N96G突变。在一个实施方案中,所述经修饰的IFNβ包含K123G和R124G突变。在一个实施方案中,所述经修饰的IFNβ包含F67G、L88G和Y92G突变。在一个实施方案中,所述经修饰的IFNβ包含F67S、L88S和Y92S突变。
在一些实施方案中,所述经修饰的IFNβ具有一个或多个突变,所述一个或多个突变降低了所述IFNα1变体对IFNAR的IFNAR2亚单位的结合或亲和力。在一个实施方案中,所述经修饰的IFNβ在IFNAR2处具有降低的亲和力和/或活性。在各个实施方案中,所述经修饰的IFNβ是人IFNβ,并且在位置W22、R27、L32、R35、V148、L151、R152和Y155处具有一个或多个突变。在一些实施方案中,所述一个或多个突变是选自W22G、R27G、L32A、L32G、R35A、R35G、V148G、L151G、R152A、R152G和Y155G的取代。在一个实施方案中,所述经修饰的IFNβ包含W22G突变。在一个实施方案中,所述经修饰的IFNβ包含L32A突变。在一个实施方案中,所述经修饰的IFNβ包含L32G突变。在一个实施方案中,所述经修饰的IFNβ包含R35A突变。在一个实施方案中,所述经修饰的IFNβ包含R35G突变。在一个实施方案中,所述经修饰的IFNβ包含V148G突变。在一个实施方案中,所述经修饰的IFNβ包含R152A突变。在一个实施方案中,所述经修饰的IFNβ包含R152G突变。在一个实施方案中,所述经修饰的IFNβ包含Y155G突变。在一个实施方案中,所述经修饰的IFNβ包含W22G和R27G突变。在一个实施方案中,所述经修饰的IFNβ包含L32A和R35A突变。在一个实施方案中,所述经修饰的IFNβ包含L151G和R152A突变。在一个实施方案中,所述经修饰的IFNβ包含V148G和R152A突变。
在一些实施方案中,所述经修饰的IFNβ具有以下突变中的一者或多者:R35A、R35T、E42K、M62I、G78S、A141Y、A142T、E149K和R152H。在一些实施方案中,所述经修饰的IFNβ具有以下突变中的一者或多者:R35A、R35T、E42K、M62I、G78S、A141Y、A142T、E149K和R152H,结合C17S或C17A。
在一些实施方案中,所述经修饰的IFNβ具有以下突变中的一者或多者:R35A、R35T、E42K、M62I、G78S、A141Y、A142T、E149K和R152H,结合本文所描述的任何其他IFNβ突变。
人IFNβ的晶体结构是已知的,并且描述于Karpusas等人,(1998)PNAS,94(22):11813-11818中。具体而言,已显示人IFNβ的结构包括五个α螺旋(即A、B、C、D和E)和四个连接这些螺旋的环区(即AB、BC、CD和DE环)。在各个实施方案中,所述经修饰的IFNβ在A、B、C、D、E螺旋和/或AB、BC、CD和DE环中具有一个或多个突变,所述一个或多个突变降低了所述经修饰的IFN-β在治疗受体诸如IFNAR处的结合亲和力或活性。说明性突变描述于WO2000/023114和US20150011732中,所述文献的全部内容特此以引用方式并入。在说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置15、16、18、19、22和/或23处包含丙氨酸取代的人IFNβ。在说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置28-30、32和33处包含丙氨酸取代的人IFNβ。在一个说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置36、37、39和42处包含丙氨酸取代的人IFNβ。在说明性实施方案中,所述经修饰的IFNβ是人IFNβ,所述人IFNβ在氨基酸位置64和67处包含丙氨酸取代并且在位置68处包含丝氨酸取代。在一个说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置71-73处包含丙氨酸取代的人IFNβ。在说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置92、96、99和100处包含丙氨酸取代的人IFNβ。在说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置128、130、131和134处包含丙氨酸取代的人IFNβ。在说明性实施方案中,所述经修饰的IFNβ是在氨基酸位置149、153、156和159处包含丙氨酸取代的人IFNβ。在一些实施方案中,所述突变IFNβ包含SEQ IDNO:277和在W22处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在R27处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在W22处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R27处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L32处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在R35处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L32处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R35处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在F67处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在R71处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在F67处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R71处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L88处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在F67处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在L88处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L88处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在I95处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在N96处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在Y92处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在I95处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在N96处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在K123处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在R124处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在K123处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R124处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L151处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在R152处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在L151处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R152处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在V148处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)和甲硫氨酸(M)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在V148处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基;以及在R152处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,所述突变IFNβ包含SEQ ID NO:277和在Y155处的突变,所述突变是选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)和缬氨酸(V)的脂族疏水性残基。
在一些实施方案中,本发明涉及一种嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含:(a)经修饰的IFNβ和此处所公开的经修饰的IL-2或IL-2变体,所述经修饰的IFNβ具有氨基酸序列SEQ ID NO:277和在位置W22处的突变,其中所述突变是脂族疏水性残基;和(b)一个或多个靶向部分,所述一个或多个靶向部分包含特异性地结合至目标抗原或受体的识别结构域,所述经修饰的IFNβ和所述一个或多个靶向部分任选地与一个或多个接头连接。在各个实施方案中,在位置W22处的突变是选自G、A、L、I、M和V的脂族疏水性残基。在各个实施方案中,在位置W22处的突变是G。
其他说明性IFNβ突变体提供在PCT/EP2017/061544中,所述文献的全部公开内容以引用方式并入本文。
在一些实施方案中,所述经修饰的另外的信号传导剂是干扰素γ。在此类实施方案中,所述经修饰的干扰素γ剂对干扰素γ受体(IFNGR),即IFNGR1和IFNGR2链具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的干扰素γ剂对干扰素γ受体(IFNGR),即IFNGR1和IFNGR2链具有基本上降低或消除的亲和力和/或活性。
在一些实施方案中,所述经修饰的另外的信号传导剂是共有干扰素。通过扫描几种人非等位基因IFNα亚型的序列并且在每个相应位置分配最常观察到的氨基酸,可以生成共有干扰素。所述共有干扰素在166个氨基酸中有20个氨基酸与IFNα2b不同(88%同源性),并且与IFNβ比较显示在30%以上的氨基酸位置具有同一性。在各个实施方案中,所述共有干扰素包含以下氨基酸序列SEQ ID NO:278。
在一些实施方案中,所述共有干扰素包含氨基酸序列SEQ ID NO:279,该氨基酸序列与氨基酸序列SEQ ID NO:278相差一个氨基酸,即,SEQ ID NO:279缺少SEQ ID NO:278的起始甲硫氨酸残基。
在各个实施方案中,所述共有干扰素包括所述共有干扰素的修饰型式,即共有干扰素变体,作为信号传导剂。在各个实施方案中,所述共有干扰素涵盖所述共有干扰素的功能性衍生物、类似物、前体、同种型、剪接变体或片段。
在一个实施方案中,所述共有干扰素变体选自美国专利号4,695,623、4,897,471、5,541,293和8,496,921中所公开的共有干扰素变体,所有这些文献的全部内容特此以引用方式并入。例如,所述共有干扰素变体可以包含如美国专利号4,695,623、4,897,471和5,541,293中所公开的IFN-CON
在一个实施方案中,所述共有干扰素变体包含IFN-CON
在一个实施方案中,所述共有干扰素变体包含美国专利号8,496,921中所公开的任一变体的氨基酸序列。例如,所述共有变体可以包含氨基酸序列SEQ ID NO:282。
在另一个实施方案中,所述共有干扰素变体可以包含氨基酸序列SEQ ID NO:283。
在一些实施方案中,所述共有干扰素变体可以是PEG化的,即包含PEG部分。在一个实施方案中,所述共有干扰素变体可以包含连接在SEQ ID NO:283的S156C位置处的PEG部分。
在一些实施方案中,工程化干扰素是人IFNα2a的变体,在序列Glu-Glu-Phe-Gly-Asn-Gln(SEQ ID NO:284)的约41位插入Asp产生了Glu-Glu-Phe-Asp-Gly-Asn-Gln(SEQ IDNO:285)(这导致相对于IFNα2a序列,序列的重新编号)和以下突变:Arg23Lys、Leu26Pro、Glu53Gln、Thr54Ala、Pro56Ser、Asp86Glu、Ile104Thr、Gly106Glu、Thr110Glu、Lys117Asn、Arg125Lys和Lys136Thr。本文中描述共有干扰素的所有实施方案均等同地应用于该工程化干扰素。
在一些实施方案中,所述另外的经修饰的信号传导剂是血管内皮生长因子(VEGF)。VEGF是强有力的生长因子,它在生理性和病理性血管生成中起主要作用,调控血管通透性,并且可以充当表达VEGF受体的细胞上的生长因子。除其他功能外,另外的功能还包括刺激巨噬细胞谱系和内皮细胞中的细胞迁移。VEGF生长因子家族中存在若干成员,以及至少三个受体(VEGFR-1、VEGFR-2和VEGFR-3)。VEGF家族的成员可以结合并激活不止一种VEGFR类型。例如,VEGF-A结合VEGFR-1和VEGFR-2,而VEGF-C结合VEGFR-2和VEGFR-3。VEGFR-1和VEGFR-2激活能调控血管生成,而VEGFR-3激活与淋巴管生成相关联。主要的促血管生成信号是由VEGFR-2激活产生的。据报道,VEGFR-1激活可能与血管生成中的负作用相关联。还已经报道,VEGFR-1信号传导对于经由骨髓来源的VEGFR-1阳性细胞(有助于在骨中形成转移前龛)的体内肿瘤进展是重要的。已经开发了若干种基于VEGF-A指导的/中和的治疗性抗体的疗法,这些疗法主要用于依赖血管生成的各种人类肿瘤的治疗。但这些疗法并非没有副作用。考虑到这些疗法作为一般的非细胞/组织特异性VEGF/VEGFR相互作用抑制剂来起作用,这可能不足为奇。因此,将VEGF(例如,VEGF-A)/VEGFR-2抑制限制于特定的靶细胞(例如肿瘤血管内皮细胞)是合乎需要的。
在一些实施方案中,所述VEGF是VEGF-A、VEGF-B、VEFG-C、VEGF-D或VEGF-E以及它们的同种型,包括VEGF-A的各种同种型,诸如VEGF
促血管生成疗法在各种疾病(例如缺血性心脏病、出血等)中也很重要,并且包括基于VEGF的疗法。VEGFR-2的激活具有促血管生成作用(作用于内皮细胞)。VEFGR-1的激活能刺激炎性细胞(包括例如巨噬细胞)迁移并导致炎症相关的高血管通透性。VEFGR-1的激活还可以促进骨髓相关的肿瘤龛形成。因此,在这种情况下,选择用于VEGFR-2激活的基于VEGF的治疗剂将是合乎需要的。另外,期望细胞特异性靶向例如内皮细胞。
在一些实施方案中,所述另外的经修饰的信号传导剂对VEGFR-2具有降低的亲和力和/或活性(例如拮抗性),并且/或者对VEGFR-1具有基本上降低或消除的亲和力和/或活性。举例来说,当经由与肿瘤内皮细胞标记物(例如PSMA等)结合的靶向部分靶向肿瘤血管内皮细胞时,这种构建体会特异性地抑制此类标记物阳性细胞上的VEGFR-2激活,而不会激活在途中和靶细胞上的VEGFR-1(如果活性被消除),由此消除了对炎症反应的诱导。相较于VEGF-A中和疗法,这将为许多肿瘤类型提供更具选择性且更安全的抗血管生成疗法。
在一些实施方案中,所述另外的经修饰的信号传导剂对VEGFR-2具有降低的亲和力和/或活性(例如激动性),并且/或者对VEGFR-1具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,通过靶向血管内皮细胞,这样的构建体促进血管生成而不引起VEGFR-1相关的炎症反应诱导。因此,这样的构建体将具有靶向的促血管生成效应,并且基本上降低了由VEGFR-2以及VEGR-1的全身性激活所引起的副作用的风险。
在说明性实施方案中,所述经修饰的信号传导剂是VEGF
在另一个说明性实施方案中,所述另外的经修饰的信号传导剂是VEGF
在这些实施方案中,所述经修饰的信号传导剂在氨基酸I83处具有突变(例如,在I83处的取代突变,例如I83K、I83R或I83H)。不希望受理论束缚,据信此类突变可导致降低的受体结合亲和力。参见,例如,美国专利号9,078,860,所述专利的全部内容特此以引用方式并入。
在一个实施方案中,所述另外的经修饰的信号传导剂是TNFα。TNF是一种多效性细胞因子,它有许多种不同的功能,包括调控细胞生长、分化、细胞凋亡、肿瘤发生、病毒复制、自身免疫性、免疫细胞功能和迁移、炎症以及败血性休克。它结合至靶细胞上的两种独特的膜受体:TNFR1(p55)和TNFR2(p75)。TNFR1表现出非常广泛的表达模式,而TNFR2优先表达在淋巴细胞、Treg、内皮细胞、某些神经元、小胶质细胞、心肌细胞和间质干细胞的某些群体上。响应于受体激活而激活非常独特的生物学途径,但也存在一定的重叠。通常,不希望受理论束缚,TNFR1信号传导与细胞凋亡(细胞死亡)的诱导相关,而TNFR2信号传导与细胞存活信号的激活(例如,NFkB途径的激活)相关。TNF的施用具有全身性毒性,并且这主要是由于TNFR1配接。然而,应当注意,TNFR2的激活还与多种活性相关,同TNFR1一样,在开发基于TNF的治疗剂的情形下,对TNF靶向和活性的控制非常重要。
在一些实施方案中,所述另外的经修饰的信号传导剂对TNFR1和/或TNFR2具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对TNFR1和/或TNFR2具有基本上降低或消除的亲和力和/或活性。TNFR1表达于大部分组织中,并且参与细胞死亡信号传导,而相形之下,TNFR2参与细胞存活信号传导。因此,在针对癌症治疗方法的实施方案中,所述经修饰的信号传导剂对TNFR1具有降低的亲和力和/或活性并且/或者对TNFR2具有基本上降低或消除的亲和力和/或活性。在这些实施方案中,可以使所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物靶向需要细胞凋亡的细胞,例如肿瘤细胞或肿瘤血管内皮细胞。在针对促进细胞存活的方法的实施方案中,举例来说,在用于治疗神经退行性病症的神经发生中,所述经修饰的信号传导剂对TNFR2具有降低的亲和力和/或活性并且/或者对TNFR1具有基本上降低或消除的亲和力和/或活性。换句话说,在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含允许有利于死亡或存活信号的经修饰的TNF-α剂。
在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有经修饰的TNF,所述经修饰的TNF对TNFR1具有降低的亲和力和/或活性并且/或者对TNFR2具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,与野生型TNF和/或仅携带促使对TNFR1具有降低的亲和力和/或活性的一个或多个突变的嵌合体相比,这种嵌合体是更有效的细胞凋亡诱导剂。在一些实施方案中,这种嵌合体可用于诱导肿瘤细胞死亡或肿瘤血管内皮细胞死亡(例如,用于治疗癌症)。此外,在一些实施方案中,举例来说,这些嵌合体避免或减少经由TNFR2激活T
在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物具有经修饰的TNF,所述经修饰的TNF对TNFR2具有降低的亲和力和/或活性并且/或者对TNFR1具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,这种嵌合体在可能是各种疾病设定,包括但不限于刺激神经发生下的特定治疗目标的一些细胞类型中是更有效的细胞存活激活剂。另外,偏好TNFR2的嵌合体还可用于治疗自身免疫性疾病(例如克罗恩氏病、糖尿病、MS、结肠炎等和本文所描述的众多其他自身免疫性疾病)。在一些实施方案中,所述嵌合体靶向自身反应性T细胞。在一些实施方案中,所述嵌合体促进了T
在一些实施方案中,所述嵌合体例如通过激活TNFR2和/或避免TNFR1而引起自身反应性T细胞的死亡(例如,对TNFR2具有降低的亲和力和/或活性并且/或者对TNFR1具有基本上降低或消除的亲和力和/或活性的经修饰的TNF)。不希望受理论束缚,这些自身反应性T细胞让其细胞凋亡/存活信号例如被NFkB途径活性/信号传导变化改变。
在一些实施方案中,基于TNFR2的嵌合体在诸多疾病中具有另外的治疗应用,所述疾病包括各种自身免疫性疾病、心脏病、脱髓鞘和神经退行性病症,以及感染性疾病等等。
在一个实施方案中,所述野生型TNFα具有氨基酸序列SEQ ID NO:237。
在此类实施方案中,所述经修饰的TNFα剂在一个或多个氨基酸位置29、31、32、84、85、86、87、88、89、145、146和147处具有突变,从而产生了具有降低的受体结合亲和力的经修饰的TNFα。参见,例如,美国专利号7,993,636,所述专利的全部内容特此以引用方式并入。
在一些实施方案中,所述经修饰的人TNFα部分在如例如WO/2015/007903中所描述的一个或多个氨基酸位置R32、N34、Q67、H73、L75、T77、S86、Y87、V91、I97、T105、P106、A109、P113、Y115、E127、N137、D143和A145处具有突变,所述文献的全部内容特此以引用方式并入(编号根据人TNF序列,Genbank登记号BAG70306,版本BAG70306.1,G1:197692685)。在一些实施方案中,所述经修饰的人TNFα部分具有选自R32G、N34G、Q67G、H73G、L75G、L75A、L75S、T77A、S86G、Y87Q、Y87L、Y87A、Y87F、V91G、V91A、I97A、I97Q、I97S、T105G、P106G、A109Y、P113G、Y115G、Y115A、E127G、N137G、D143N、A145G和A145T的取代突变。在一个实施方案中,所述人TNFα部分具有选自Y87Q、Y87L、Y87A和Y87F的突变。在另一个实施方案中,所述人TNFα部分具有选自I97A、I97Q和I97S的突变。在另一个实施方案中,所述人TNFα部分具有选自Y115A和Y115G的突变。
在一些实施方案中,所述经修饰的TNFα剂具有选自如WO2008/124086中所描述的N39Y、S147Y和Y87H的一个或多个突变,所述文献的全部内容特此以引用方式并入。
在一个实施方案中,所述另外的经修饰的信号传导剂是TNFβ。TNFβ可以与LT-β(LT-α1β2)形成同源三聚体或异源三聚体。在一些实施方案中,所述经修饰的信号传导剂对TNFR1和/或TNFR2和/或疱疹病毒进入介体(HEVM)和/或LT-βR具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型TNFβ具有氨基酸序列SEQ ID NO:238。
在此类实施方案中,所述经修饰的TNFβ剂可以在106-113位的一个或多个氨基酸处包含突变,从而产生对TNFR2具有降低的受体结合亲和力的经修饰的TNFβ。在一个实施方案中,所述经修饰的信号传导剂在氨基酸位置106-113处具有一个或多个取代突变。在说明性实施方案中,所述取代突变选自Q107E、Q107D、S106E、S106D、Q107R、Q107N、Q107E/S106E、Q107E/S106D、Q107D/S106E和Q107D/S106D。在另一个实施方案中,所述经修饰的信号传导剂在位置106-113处具有约1至约3个氨基酸的插入。
在一些实施方案中,所述另外的经修饰的剂是TNF家族成员(例如TNF-α、TNF-β),它可以是如WO 2015/007903中所描述的单链三聚体型式,所述文献的全部内容以引用方式并入。
在一些实施方案中,所述经修饰的剂是TNF家族成员(例如TNF-α、TNF-β),它在TNFR1处具有降低的亲和力和/或活性,即拮抗活性(例如天然拮抗活性或者由于一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入)。在这些实施方案中,所述经修饰的剂是TNF家族成员(例如TNF-α、TNF-β),它还任选地对TNFR2具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,所述经修饰的剂是TNF家族成员(例如TNF-α、TNF-β),它在TNFR2处具有降低的亲和力和/或活性,即拮抗活性(例如天然拮抗活性或者由于一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入)。在这些实施方案中,所述经修饰的剂是TNF家族成员(例如TNF-α、TNF-β),它还任选地对TNFR1具有基本上降低或消除的亲和力和/或活性。此类实施方案的构建体可用于例如以细胞特异性方式阻遏TNF应答的方法中。在一些实施方案中,所述拮抗性TNF家族成员(例如TNF-α、TNF-β)是如WO 2015/007903中所描述的单链三聚体型式。
在一个实施方案中,所述另外的经修饰的信号传导剂是TRAIL。在一些实施方案中,所述经修饰的TRAIL剂对DR4(TRAIL-RI)和/或DR5(TRAIL-RII)和/或DcR1和/或DcR2具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的TRAIL剂对DR4(TRAIL-RI)和/或DR5(TRAIL-RII)和/或DcR1和/或DcR2具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型TRAIL具有氨基酸序列SEQ ID NO:239。
在此类实施方案中,所述经修饰的TRAIL剂可以在氨基酸位置T127-R132、E144-R149、E155-H161、Y189-Y209、T214-1220、K224-A226、W231、E236-L239、E249-K251、T261-H264和H270-E271处包含突变(编号根据人序列,Genbank登记号NP_003801,版本10NP_003801.1,G1:4507593;参见上文)。
在一个实施方案中,所述另外的经修饰的信号传导剂是TGFα。在此类实施方案中,所述经修饰的TGFα剂对表皮生长因子受体(EGFR)具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的TGFα剂对表皮生长因子受体(EGFR)具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述另外的经修饰的信号传导剂是TGFβ。在此类实施方案中,所述经修饰的信号传导剂对TGFBR1和/或TGFBR2具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对TGFBR1和/或TGFBR2具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂任选地对TGFBR3具有降低或基本上降低或消除的亲和力和/或活性,不希望受理论束缚,所述TGFBR3可以充当TGF-β受体的配体的储库。在一些实施方案中,相对于TGFBR2,TGFβ可能更倾向于TGFBR1,或者相对于TGFBR1,TGFβ可能更倾向于TGFBR2。相似地,不希望受理论束缚,LAP可以充当TGF-β受体的配体的储库。在一些实施方案中,所述经修饰的信号传导剂对TGFBR1和/或TGFBR2具有降低的亲和力和/或活性,并且/或者对潜在型相关肽(LAP)具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,此类嵌合体可用于卡-恩二氏病(Camurati-Engelmanndisease)或与不适当的TGFβ信号传导相关的其他疾病。
在一些实施方案中,所述另外的经修饰的剂是TGF家族成员(例如TGFα、TGFβ),它在TGFBR1、TGFBR2、TGFBR3中的一者或多者处具有降低的亲和力和/或活性,即拮抗活性(例如天然拮抗活性或者由一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入本文)。在这些实施方案中,所述经修饰的剂是TGF家族成员(例如TGFα、TGFβ),它还任选地在TGFBR1、TGFBR2、TGFBR3中的一者或多者处具有基本上降低或消除的亲和力和/或活性。
在一些实施方案中,所述另外的经修饰的剂是TGF家族成员(例如TGFα、TGFβ),它在TGFBR1和/或TGFBR2处具有降低的亲和力和/或活性,即拮抗活性(例如天然拮抗活性或者由一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入本文)。在这些实施方案中,所述经修饰的剂是TGF家族成员(例如TGFα、TGFβ),它还任选地在TGFBR3处具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-1。在一个实施方案中,所述经修饰的信号传导剂是IL-1α或IL-1β。在一些实施方案中,所述经修饰的信号传导剂对IL-1R1和/或IL-1RAcP具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-1R1和/或IL-1RAcP具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-1R2具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-1R2具有基本上降低或消除的亲和力和/或活性。举例来说,在一些实施方案中,本发明的经修饰的IL-1剂避免IL-1R2处的相互作用,并且因此基本上降低其作为治疗剂的引诱剂和/或接收剂的功能。
在一个实施方案中,所述野生型IL-1β具有氨基酸序列SEQ ID NO:240。
IL-1β是促炎性细胞因子和重要的免疫系统调控剂。它是CD4 T细胞应答的有效激活剂,能增加Th17细胞的比例以及产生IFNγ和IL-4的细胞的扩增。IL-1β还是CD8+T细胞的有效调控剂,从而增强抗原特异性CD8+T细胞扩增、分化、移行至外围和记忆。IL-1β受体包含IL-1R1和IL-1R2。结合至IL-1R1和经由IL-1R1进行信号传导构成了IL-1β借以介导许多种其生物学(和病理学)活性的机制。IL1-R2可以起诱饵受体的作用,从而降低IL-1β用于相互作用和经由IL-1R1进行信号传导的可用性。
在一些实施方案中,所述经修饰的IL-1β对IL-1R1具有降低的亲和力和/或活性(例如激动活性)。在一些实施方案中,所述经修饰的IL-1β对IL-1R2具有基本上降低或消除的亲和力和/或活性。在此类实施方案中,存在可诱导的或可恢复的IL-1β/IL-1R1信号传导,并且防止了IL-R2处治疗性嵌合体的损失,并且因此减少了所需IL-1的剂量(例如,相对于野生型或仅携带针对IL-R1的减毒突变的嵌合体)。此类构建体可用于例如治疗癌症,包括例如刺激免疫系统以建立抗癌应答的方法中。
在一些实施方案中,所述经修饰的IL-1β对IL-1R1具有降低的亲和力和/或活性(例如拮抗活性,例如天然拮抗活性或者由于一个或多个突变所致的拮抗活性,参见例如WO2015/007520,所述文献的全部内容特此以引用方式并入)。在一些实施方案中,所述经修饰的IL-1β对IL-1R2具有基本上降低或消除的亲和力和/或活性。在此类实施方案中,存在不可诱导的或不可恢复的IL-1β/IL-1R1信号传导,并且防止了IL-R2处治疗性嵌合体的损失,并且因此减少了所需IL-1β的剂量(例如,相对于野生型或仅携带针对IL-R1的减毒突变的嵌合体)。此类构建体可用于例如治疗自身免疫性疾病,包括例如阻抑免疫系统的方法中。
在此类实施方案中,所述经修饰的信号传导剂具有氨基酸52-54缺失,这就产生了对I型IL-1R具有降低的结合亲和力并且具有降低的生物活性的经修饰的人IL-1β。参见例如WO 1994/000491,所述文献的全部内容特此以引用方式并入。在一些实施方案中,所述经修饰的人IL-1β具有选自A117G/P118G、R120X、L122A、T125G/L126G、R127G、Q130X、Q131G、K132A、S137G/Q138Y、L145G、H146X、L145A/L147A、Q148X、Q148G/Q150G、Q150G/D151A、M152G、F162A、F162A/Q164E、F166A、Q164E/E167K、N169G/D170G、I172A、V174A、K208E、K209X、K209A/K210A、K219X、E221X、E221S/N224A、N224S/K225S、E244K、N245Q的一个或多个取代突变(其中X可以是任何氨基酸变化,例如非保守变化),从而表现出降低的与IL-1R的结合,如例如WO2015/007542和WO/2015/007536中所描述,所述文献的全部内容特此以引用方式并入(编号基于人IL-1β序列,Genbank登记号NP_000567,版本NP-000567.1,G1:10835145)。在一些实施方案中,所述经修饰的人IL-1β可以具有选自R120A、R120G、Q130A、Q130W、H146A、H146G、H146E、H146N、H146R、Q148E、Q148G、Q148L、K209A、K209D、K219S、K219Q、E221S和E221K的一个或多个突变。在一个实施方案中,所述经修饰的人IL-1β包含突变Q131G和Q148G。在一个实施方案中,所述经修饰的人IL-1β包含突变Q148G和K208E。在一个实施方案中,所述经修饰的人IL-1β包含突变R120G和Q131G。在一个实施方案中,所述经修饰的人IL-1β包含突变R120G和H146G。在一个实施方案中,所述经修饰的人IL-1β包含突变R120G和K208E。在一个实施方案中,所述经修饰的人IL-1β包含突变R120G、F162A和Q164E。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-3。在一些实施方案中,所述经修饰的信号传导剂对IL-3受体具有降低的亲和力和/或活性,所述IL-3受体是与跟共同β(βc或CD131)亚单位配对的独特α链的异源二聚体。在一些实施方案中,所述经修饰的信号传导剂对IL-3受体具有基本上降低或消除的亲和力和/或活性,所述IL-3受体是与跟共同β(βc或CD131)亚单位配对的独特α链的异源二聚体。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-4。在这种实施方案中,所述经修饰的信号传导剂对1型和/或2型IL-4受体具有降低的亲和力和/或活性。在这种实施方案中,所述经修饰的信号传导剂对1型和/或2型IL-4受体具有基本上降低或消除的亲和力和/或活性。1型IL-4受体由具有共同γ链的IL-4Rα亚单位构成并且特异性地结合IL-4。2型IL-4受体包括与被称为IL-13Rα1的不同亚单位结合的IL-4Rα亚单位。在一些实施方案中,所述经修饰的信号传导剂对2型IL-4受体具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型IL-4具有氨基酸序列SEQ ID NO:242。
在此类实施方案中,所述经修饰的IL-4剂在氨基酸R121(R121A、R121D、R121E、R121F、R121H、R121I、R121K、R121N、R121P、R121T、R121W)、E122(E122F)、Y124(Y124A、Y124Q、Y124R、Y124S、Y124T)和S125(S125A)处具有一个或多个突变。不希望受理论束缚,认为这些经修饰的IL-4剂维持I型受体介导的活性,但是显著降低了其他受体介导的生物活性。参见例如美国专利号6,433,157,所述专利的全部内容特此以引用方式并入。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-6。IL-6通过细胞表面I型细胞因子受体复合物进行信号传导,所述复合物包括配体结合IL-6R链(CD126)和信号转导组分gp130。IL-6还可以结合至IL-6R的可溶形式(sIL-6R),后者是IL-6R的细胞外部分。sIL-6R/IL-6复合物可能参与神经突长出和神经元存活,并且因此可能在通过髓鞘再生进行的神经再生中非常重要。因此,在一些实施方案中,所述经修饰的信号传导剂对IL-6R/gp130和/或sIL-6R具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-6R/gp130和/或sIL-6R具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型IL-6具有氨基酸序列SEQ ID NO:243。
在此类实施方案中,所述经修饰的信号传导剂在氨基酸58、160、163、171或177处具有一个或多个突变。不希望受理论束缚,认为这些经修饰的IL-6剂表现出降低的对IL-6Rα的结合亲和力和降低的生物活性。参见例如WO 97/10338,所述文献的全部内容特此以引用方式并入。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-10。在这种实施方案中,所述经修饰的信号传导剂对IL-10受体1和IL-10受体2具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-10受体1和IL-10受体2具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-11。在这种实施方案中,所述经修饰的信号传导剂对IL-11Rα和/或IL-11Rβ和/或gp130具有降低的亲和力和/或活性。在这种实施方案中,所述经修饰的信号传导剂对IL-11Rα和/或IL-11Rβ和/或gp130具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-12。在这种实施方案中,所述经修饰的信号传导剂对IL-12Rβ1和/或IL-12Rβ2具有降低的亲和力和/或活性。在这种实施方案中,所述经修饰的信号传导剂对IL-12Rβ1和/或IL-12Rβ2具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-13。在这种实施方案中,所述经修饰的信号传导剂对IL-4受体(IL-4Rα)和IL-13Rα1具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-4受体(IL-4Rα)或IL-13Rα1具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型IL-13具有氨基酸序列SEQ ID NO:244。
在此类实施方案中,所述经修饰的IL-13剂在氨基酸13、16、17、66、69、99、102、104、105、106、107、108、109、112、113和114处具有一个或多个突变。不希望受理论束缚,认为这些经修饰的IL-13剂表现出降低的生物活性。参见例如WO 2002/018422,所述文献的全部内容特此以引用方式并入。
在一个实施方案中,所述信号传导剂是野生型或经修饰的IL-15。在多个实施方案中,所述经修饰的IL-15对白介素15受体具有降低的亲和力和/或活性。
在一个实施方案中,所述野生型IL-15具有以下氨基酸序列:
在此类实施方案中,所述经修饰的IL-15剂相对于SEQ ID NO:292在氨基酸S7、D8、K10、K11、E46、L47、V49、I50、D61、N65、L66、I67、I68、L69、N72、Q108处具有一个或多个突变。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-18。在一些实施方案中,所述经修饰的信号传导剂对IL-18Rα和/或IL-18Rβ具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IL-18Rα和/或IL-18Rβ具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对II型IL-18Rα,即缺乏信号传导所需的TIR结构域的IL-18Rα同种型具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型IL-18具有氨基酸序列SEQ ID NO:245。
在此类实施方案中,所述经修饰的IL-18剂可以在选自如WO/2015/007542中所描述的Y37-K44、R49-Q54、D59-R63、E67-C74、R80、M87-A97、N 127-K129、Q139-M149、K165-K171、R183和Q190-N191的氨基酸或氨基酸区域处包含一个或多个突变,所述文献的全部内容特此以引用方式并入(编号基于人IL-18序列,Genbank登记号AAV38697,版本AAV38697.1,G1:54696650)。
在一个实施方案中,所述另外的经修饰的信号传导剂是IL-33。在这种实施方案中,所述经修饰的信号传导剂对ST-2受体和IL-1RAcP具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对ST-2受体和IL-1RAcP具有基本上降低或消除的亲和力和/或活性。
在一个实施方案中,所述野生型IL-33具有氨基酸序列SEQ ID NO:246。
在此类实施方案中,所述经修饰的IL-33剂可以在选自如WO/2015/007542中所描述的I113-Y122、S127-E139、E144-D157、Y163-M183、E200、Q215、L220-C227和T260-E269的氨基酸或氨基酸区域处包含一个或多个突变,所述文献的全部内容特此以引用方式并入(编号基于人序列,Genbank登记号NP_254274,版本NP_254274.1,G1:15559209)。
在一个实施方案中,所述经修饰的信号传导剂是表皮生长因子(EGF)。EGF是有效生长因子家族的成员。成员包括EGF、HB-EGF,以及其他成员,诸如TGFα、双调蛋白、神经调节蛋白、上皮调节蛋白、β细胞蛋白。EGF家族受体包括EGFR(ErbB1)、ErbB2、ErbB3和ErbB4。这些受体可以充当同源二聚体和/或异源二聚体受体亚型。不同的EGF家族成员对各种受体亚型表现出不同的选择性。举例来说,EGF与ErbB1/ErbB1、ErbB1/ErbB2、ErbB4/ErbB2和其他一些异源二聚体亚型相关。HB-EGF具有相似的模式,但它也与ErbB4/4相关。积极或消极地调节EGF(EGF样)生长因子信号传导具有相当大的治疗意义。举例来说,在EGFR信号传导构成主要的促进生长信号的各种癌症的治疗中,抑制EGFR信号传导是有意义的。或者,在例如促进伤口愈合(急性和慢性)、口腔粘膜炎(各种癌症疗法,包括但不限于放射疗法的主要副作用)中,刺激EGFR信号传导具有治疗意义。
在一些实施方案中,所述另外的经修饰的信号传导剂对ErbB1、ErbB2、ErbB3和/或ErbB4具有降低的亲和力和/或活性。此类实施方案可用于例如治疗伤口的方法中。在一些实施方案中,所述经修饰的信号传导剂结合至一个或多个ErbB1、ErbB2、ErbB3和ErbB4并拮抗这些受体的活性。在此类实施方案中,所述经修饰的信号传导剂对ErbB1、ErbB2、ErbB3和/或ErbB4具有降低的亲和力和/或活性,这允许以减弱的方式拮抗这些受体的活性。此类实施方案可用于例如癌症的治疗中。在一个实施方案中,所述经修饰的信号传导剂对ErbB1具有降低的亲和力和/或活性。ErbB1是激酶抑制剂的治疗靶标-这些激酶抑制剂大多数具有副作用,因为它们的选择性不高(例如,吉非替尼(gefitinib)、厄洛替尼(erlotinib)、阿法替尼(afatinib)、布加替尼(brigatinib)和艾克替尼(icotinib))。在一些实施方案中,与靶向EGF受体的其他药剂相比,减弱的拮抗性ErbB1信号传导更具中靶性并且具有更少的副作用。
在一些实施方案中,所述另外的经修饰的信号传导剂对ErbB1具有降低的亲和力和/或活性(例如拮抗性,例如天然拮抗活性或者由于一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入)并且/或者对ErbB4或可能与其相互作用的其他亚型具有基本上降低或消除的亲和力和/或活性。通过经由靶向部分进行特异性靶向,将实现对ErbB1/ErbB1受体激活的细胞选择性阻抑(拮抗作用,例如天然拮抗活性或者由于一个或多个突变所致的拮抗活性,参见例如WO 2015/007520,所述文献的全部内容特此以引用方式并入),而不牵涉可能与抑制相关副作用有关的其他受体亚型。因此,与在体内抑制所有细胞类型中的EGFR活性的EGFR激酶抑制剂相比,这种构建体将提供细胞选择性(例如,由于受体扩增、过度表达等原因而具有激活的EGFR信号传导的肿瘤细胞)抗EGFR(ErbB1)药物作用,且副作用减少。
在一些实施方案中,所述另外的经修饰的信号传导剂对ErbB4和/或可能与其相互作用的其他亚型具有降低的亲和力和/或活性(例如激动性)。通过经由靶向部分靶向特定靶细胞,实现了ErbB1信号传导的选择性激活(例如上皮细胞)。在一些实施方案中,这种构建体可用于治疗伤口(促进愈合)且副作用减少,尤其可用于治疗慢性疾患和治疗剂局部施用以外的应用(例如全身性伤口愈合)。
在一个实施方案中,所述经修饰的信号传导剂是胰岛素或胰岛素类似物。在一些实施方案中,所述经修饰的胰岛素或胰岛素类似物对胰岛素受体和/或IGF1或IGF2受体具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的胰岛素或胰岛素类似物对胰岛素受体和/或IGF1或IGF2受体具有基本上降低或消除的亲和力和/或活性。胰岛素受体处减弱的应答允许控制糖尿病、肥胖症、代谢紊乱等,而直接远离IGF1或IGF2受体则避免了前癌的影响。
在一个实施方案中,所述经修饰的信号传导剂是胰岛素样生长因子I或胰岛素样生长因子II(IGF-1或IGF-2)。在一个实施方案中,所述经修饰的信号传导剂是IGF-1。在这种实施方案中,所述经修饰的信号传导剂对胰岛素受体和/或IGF1受体具有降低的亲和力和/或活性。在一个实施方案中,所述经修饰的信号传导剂可以结合至IGF1受体并且拮抗该受体的活性。在这种实施方案中,所述经修饰的信号传导剂对IGF1受体具有降低的亲和力和/或活性,这允许以减弱的方式拮抗该受体的活性。在一些实施方案中,所述经修饰的信号传导剂对胰岛素受体和/或IGF1受体具有基本上降低或消除的亲和力和/或活性。在一些实施方案中,所述经修饰的信号传导剂对IGF2受体具有降低的亲和力和/或活性,这允许以减弱的方式拮抗该受体的活性。在一个实施方案中,所述经修饰的信号传导剂对胰岛素受体具有基本上降低或消除的亲和力和/或活性,并且因此不干扰胰岛素信号传导。在各个实施方案中,这适用于癌症治疗。在各个实施方案中,本发明的剂可以防止IR同种型A引起对癌症治疗的抗性。
在一个实施方案中,所述经修饰的信号传导剂是EPO。在各个实施方案中,所述经修饰的EPO剂相对于本文所描述的基于野生型EPO或其他EPO的剂对EPO受体(EPOR)受体和/或肝配蛋白受体(EphR)具有降低的亲和力和/或活性。在一些实施方案中,所述经修饰的EPO剂对EPO受体(EPOR)受体和/或Eph受体(EphR)具有基本上降低或消除的亲和力和/或活性。说明性EPO受体包括但不限于EPOR同源二聚体或EPOR/CD131异源二聚体。还包括β-共用受体(βcR)作为EPO受体。说明性Eph受体包括但不限于EPHA1、EPHA2、EPHA3、EPHA4、EPHA5、EPHA6、EPHA7、EPHA8、EPHA9、EPHA10、EPHB1、EPHB2、EPHB3、EPHB4、EPHB5和EPHB6。在一些实施方案中,所述经修饰的EPO蛋白包含一个或多个突变,所述一个或多个突变致使所述EPO蛋白对包含一种或多种不同的EPO受体或Eph受体的受体(例如异源二聚体、异源三聚体等,包括但不限于:EPOR-EPHB4、EPOR-βcR-EPOR)具有降低的亲和力。还提供了欧洲专利公布号2492355的受体,包括但不限于NEPOR,所述文献的全部内容特此以引用方式并入。
在一个实施方案中,所述人EPO具有氨基酸序列SEQ ID NO:247(前27个氨基酸是信号肽)。
在一个实施方案中,所述人EPO蛋白是EPO的成熟形式(其中信号肽被切除),它是166个氨基酸残基的糖蛋白,具有序列SEQ ID NO:248。
预计人EPO蛋白的结构包含四螺旋束,包括螺旋A、螺旋B、螺旋C和螺旋D。在各个实施方案中,所述经修饰的EPO蛋白包含位于EPO蛋白的对生物活性重要的四个区域,即氨基酸残基10-20、44-51、96-108和142-156中的一者或多者突变。在一些实施方案中,所述一个或多个突变位于残基11-15、44-51、100-108和147-151处。这些残基局限于螺旋A(Val11、Arg14和Tyr15)、螺旋C(Ser100、Arg103、Ser104和Leu108)、螺旋D(Asn147、Arg150、Gly151和Leu155)以及A/B连接环(残基42-51)。在一些实施方案中,所述经修饰的EPO蛋白在氨基酸41-52之间以及氨基酸147、150、151和155的残基处包含突变。不希望受理论束缚,据信这些残基的突变对受体结合与体外生物活性都具有实质性影响。在一些实施方案中,所述经修饰的EPO蛋白在残基11、14、15、100、103、104和108处包含突变。不希望受理论束缚,据信这些残基的突变对受体结合活性具有中度影响,并且对体外生物活性具有大得多的影响。说明性取代包括但不限于以下中的一者或多者:Val11Ser、Arg14Ala、Arg14Gln、Tyr15lle、Pro42Asn、Thr44lle、Lys45Asp、Val46Ala、Tyr51Phe、Ser100Glu、Ser100Thr、Arg103Ala、Ser104lle、Ser104Ala、Leu108Lys、Asn147Lys、Arg150Ala、Gly151ALa和Leu155Ala。
在一些实施方案中,所述经修饰的EPO蛋白包含影响生物活性而不影响结合的突变,例如Eliot等人Mapping of the Active Site of Recombinant HumanErythropoietin 1997年1月15日;Blood:89(2)中列出的那些突变,所述文献的全部内容特此以引用方式并入。
在一些实施方案中,所述经修饰的EPO蛋白包含涉及EPO蛋白中参与受体接触的表面残基的一个或多个突变。不希望受理论束缚,据信这些表面残基的突变不太可能影响蛋白质折叠,从而保留一定的生物活性。可以突变的说明性表面残基包括但不限于残基147和150。在说明性实施方案中,所述突变是取代,包括N147A、N147K、R150A和R150E中的一者或多者。
在一些实施方案中,所述经修饰的EPO蛋白包含在残基N59、E62、L67和L70处的一个或多个突变以及影响二硫键形成的一个或多个突变。不希望受理论束缚,据信这些突变影响折叠和/或预计处在被包埋的位置上,并且因此间接地影响生物活性。
在一个实施方案中,所述经修饰的EPO蛋白包含K20E取代,所述取代显著减少受体结合。参见例如Elliott等人,(1997)Blood,89:493-502,所述文献的全部内容特此以引用方式并入。
可以并入本发明的嵌合EPO蛋白中的其他EPO突变公开于例如以下文献中:Elliott等人,(1997)Blood,89:493-502,所述文献的全部内容特此以引用方式并入;和Taylor等人,(2010)PEDS,23(4):251-260,所述文献的全部内容特此以引用方式并入。
在各个实施方案中,所述信号传导剂是毒素或有毒的酶。在一些实施方案中,所述毒素或有毒的酶来源于植物和细菌。说明性的毒素或有毒的酶包括但不限于白喉毒素、假单胞菌毒素、炭疽毒素、核糖体灭活蛋白(RIP)诸如篦麻毒素和肥皂草素、葫莲根毒素、相思子毒素、白树毒素和美洲商陆抗病毒蛋白。另外的毒素包括Mathew等人,(2009)Cancer Sci100(8):1359-65中所公开的那些,全部公开内容特此以引用方式并入。在此类实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以用于以细胞类型特异性方式诱导细胞死亡。在此类实施方案中,所述毒素可以经过修饰,例如突变以降低所述毒素的亲和力和/或活性以便减弱效应,如针对本文的其他信号传导剂所描述。
接头和官能团
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物任选地包含一个或多个接头。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含连接靶向部分和信号传导剂(例如经修饰的IL-2)的接头。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含含有接头的信号传导剂(例如经修饰的IL-2)。在一些实施方案中,所述接头可以用于连接如本文所描述的各个官能团、残基或部分与嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物。在一些实施方案中,所述接头是不影响或降低结合区和结合蛋白的稳定性、取向、结合、中和和/或清除率特征的单个氨基酸或多个氨基酸。在各个实施方案中,所述接头选自肽、蛋白质、糖或核酸。
在一些实施方案中,提供了编码以单一核苷酸序列形式连接至本文所描述的任何接头的本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的载体,并且所述载体可以用于制备此类嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物。在多个实施方案中,基于Fc的嵌合蛋白复合物的取代基在载体中以核苷酸序列的形式表达。
在一些实施方案中,所述接头长度允许靶向部分和信号传导剂(例如经修饰的IL-2)与其受体的有效结合。举例来说,在一些实施方案中,所述接头的长度允许所述靶向部分中的一个和所述信号传导剂与相同细胞上的受体的有效结合。
在一些实施方案中,所述接头长度至少等于所述靶向部分中的一个和所述信号传导剂与相同细胞上的受体的结合位点之间的最小距离。在一些实施方案中,所述接头长度是所述靶向部分中的一个和所述信号传导剂与相同细胞上的受体的结合位点之间的最小距离的至少两倍、或三倍、或四倍、或五倍、或十倍、或二十倍、或25倍、或50倍、或一百倍、或更多倍。
如本文所描述,所述接头的长度允许所述靶向部分中的一个和所述信号传导剂与相同细胞上的受体的有效结合,结合是依序的,例如靶向部分/受体结合先于信号传导剂/受体结合。
在一些实施方案中,在单个嵌合体中有两个接头,每个柔性接头连接信号传导剂与靶向部分。在各个实施方案中,所述接头的长度允许形成具有疾病细胞和效应细胞的位点,而没有会阻止调节任一细胞的位阻。
本发明设想多种接头序列的用途。在各个实施方案中,所述接头可以来源于天然存在的多结构域蛋白或者是如例如以下文献中所描述的经验接头:Chichili等人,(2013),Protein Sci.22(2):153-167;Chen等人,(2013),Adv Drug Deliv Rev.65(10):1357-1369,所述文献的全部内容特此以引用方式并入。在一些实施方案中,可以使用接头设计数据库和计算机程序,诸如以下文献中所描述的那些来设计所述接头:Chen等人,(2013),AdvDrug Deliv Rev.65(10):1357-1369和Crasto等人,(2000),Protein Eng.13(5):309-312,所述文献的全部内容特此以引用方式并入。在各个实施方案中,所述接头可以是功能性的。举例来说但不限于,所述接头可以发挥功能以改善本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的折叠和/或稳定性,改善表达,改善药物动力学,并且/或者改善生物活性。
在一些实施方案中,所述接头是多肽。在一些实施方案中,所述接头少于约100个氨基酸长。举例来说,所述接头可以是少于约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、或约2个氨基酸长。在一些实施方案中,所述接头是多肽。在一些实施方案中,所述接头超过约100个氨基酸长。举例来说,所述接头可以是超过约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、或约2个氨基酸长。在一些实施方案中,所述接头是柔性的。在另一个实施方案中,所述接头是刚性的。
在涉及具有两个或更多个靶向部分的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的一些实施方案中,一个接头将两个靶向部分彼此连接并且这种接头具有较短长度,而一个接头连接靶向部分和信号传导剂,这种接头比连接两个靶向部分的接头更长。举例来说,连接两个靶向部分的接头与连接靶向部分和信号传导剂的接头之间的氨基酸长度差异可以是约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、或约2个氨基酸。
在各个实施方案中,所述接头基本上由甘氨酸和丝氨酸残基构成(例如约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%甘氨酸和丝氨酸)。举例来说,在一些实施方案中,所述接头是(Gly
在一些实施方案中,所述接头是GGGSE(SEQ ID NO:272)、GSESG(SEQ ID NO:273)、GSEGS(SEQ ID NO:274)、GEGGSGEGSSGEGSSSEGGGSEGGGSEGGGSEGGS(SEQ ID NO:275)和每4个氨基酸间隔随机放置G、S和E的接头中的一者或多者。
在一些实施方案中,所述接头是抗体(例如IgG、IgA、IgD和IgE,包括子类(例如IgG1、IgG2、IgG3和IgG4,以及IgA1和IgA2))的铰链区。在各个实施方案中,所述接头是抗体(例如IgG、IgA、IgD和IgE,包括子类(例如IgG1、IgG2、IgG3和IgG4,以及IgA1和IgA2))的铰链区。IgG、IgA、IgD和IgE类抗体中发现的铰链区充当柔性间隔基,从而允许Fab部分在空间中自由移动。与恒定区相反,所述铰链结构域在结构上具有多样性,在序列和长度方面都因免疫球蛋白类别和子类而各异。举例来说,铰链区的长度和柔性因IgG子类而各异。IgG1的铰链区涵盖氨基酸216-231,而且因为它自由灵活,Fab片段可以关于其对称轴旋转并且在以两个重链间二硫桥中的第一个为中心的球体内移动。IgG2具有比IgG1短的铰链,具有12个氨基酸残基和四个二硫桥。IgG2的铰链区缺乏甘氨酸残基,相对较短,并且含有通过额外的重链间二硫桥加以稳定的刚性聚脯氨酸双螺旋。这些性质约束了IgG2分子的柔性。IgG3因其独特的延长铰链区(长达IgG1铰链的约四倍),含有62个氨基酸(包括21个脯氨酸和11个半胱氨酸),形成非柔性聚脯氨酸双螺旋而不同于其他子类。在IgG3中,Fab片段相对远离Fc片段,从而赋予所述分子以更大的柔性。IgG3中的细长铰链还负责其与其他子类相比具有较高分子量。IgG4的铰链区比IgG1的短,并且其柔性介于IgG1与IgG2的柔性之间。铰链区的柔性按降序报告为IgG3>IgG1>IgG4>IgG2。
根据结晶学研究,免疫球蛋白铰链区可以在功能上进一步细分为三个区域:上铰链区、核心区和下铰链区。参见Shin等人,1992ImmunologicalR evieWs 130:87。上铰链区包括从C
在一些实施方案中,所述接头是合成的接头,诸如PEG。
在各个实施方案中,所述接头可以是功能性的。举例来说但不限于,所述接头可以发挥功能以改善本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的折叠和/或稳定性,改善表达,改善药物动力学,并且/或者改善生物活性。在另一个实例中,所述接头可以发挥功能以使所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物靶向特定的细胞类型或位置。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包括一个或多个官能团、残基或部分。在各个实施方案中,所述一个或多个官能团、残基或部分连接或基因融合至本文所描述的信号传导剂或靶向部分中的任一者。在一些实施方案中,此类官能团、残基或部分赋予本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物以一种或多种所期望的性质或功能性。此类官能团和用于将它们引入至嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物中的技术的实例在本领域中是已知的,举例来说,参见Remington′s Pharmaceutical Sciences,第16版,MackPublishing Co.,Easton,Pa.(1980)。
在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物中的每一者可以通过与另一种剂缀合和/或融合以延长半衰期或以其他方式改善药效学和药物动力学特性。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以与PEG、XTEN(例如呈rPEG形式)、聚唾液酸(POLYXEN)、白蛋白(例如人血清白蛋白或HAS)、弹性蛋白样蛋白(ELP)、PAS、HAP、GLK、CTP、转铁蛋白等等中的一者或多者融合或缀合。在各个实施方案中,个别嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物中的每一者与BioDrugs(2015)29:215-239中所描述的剂中的一者或多者融合,所述文献的全部内容特此以引用方式并入。
在一些实施方案中,所述官能团、残基或部分包含合适的药理学上可接受的聚合物,诸如聚(乙二醇)(PEG)或其衍生物(诸如甲氧基聚(乙二醇)或mPEG)。在一些实施方案中,所述PEG部分的连接增加嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的半衰期和/或降低其免疫原性。一般来说,可以使用聚乙二醇化的任何合适的形式,诸如本领域中用于抗体和抗体片段的聚乙二醇化(包括但不限于单结构域抗体,诸如VHH);参见例如Chapman,Nat.Biotechnol.,54,531-545(2002);Veronese和Harris,Adv.DrugDeliv.Rev.54,453-456(2003);Harris和Chess,Nat.Rev.Drug.Discov.,2,(2003)和WO04060965,所述文献的全部内容特此以引用方式并入。用于蛋白质的聚乙二醇化的各种试剂还可以得自市面,例如,得自美国的Nektar Therapeutics。在一些实施方案中,使用定点聚乙二醇化,具体而言,经由半胱氨酸残基(参见例如Yang等人,Protein Engineering,16,10,761-770(2003),所述文献的全部内容特此以引用方式并入)。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物经过修饰以便适当地引入一个或多个供连接PEG用的半胱氨酸残基,或者包含一个或多个供连接PEG用的半胱氨酸残基的氨基酸序列可以使用本领域中已知的技术融合至所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的氨基和/或羧基端。
在一些实施方案中,所述官能团、残基或部分包含N连接或O连接的糖基化。在一些实施方案中,引入所述N连接或O连接的糖基化作为共翻译和/或翻译后修饰的一部分。
在一些实施方案中,所述官能团、残基或部分包含一个或多个可检测标记或其他信号产生基团或部分。合适的标记和适用于连接、使用和检测它们的技术在本领域中是已知的,并且包括但不限于荧光标记(诸如荧光素、异硫氰酸酯、罗丹明、藻红素、藻青素、别藻蓝素、邻苯二甲醛以及荧光胺和荧光金属诸如Eu或其他镧系金属)、磷光标记、化学发光标记或生物发光标记(诸如鲁米那(luminal)、异鲁米诺(isoluminol)、热性吖啶酯(theromatic acridinium ester)、咪唑、吖啶盐、草酸酯、二氧杂环丁烷或GFP以及它们的类似物)、放射性同位素、金属、金属螯合物或金属阳离子或者特别适用于体内、体外或原位诊断和成像的其他金属或金属阳离子,以及发色团和酶(诸如苹果酸脱氢酶、葡萄球菌核酸酶、δ-V-类固醇异构酶、酵母乙醇脱氢酶、α-甘油磷酸脱氢酶、磷酸丙糖异构酶、生物素亲和素过氧化物酶、辣根过氧化酶、碱性磷酸酶、天冬酰胺酶、葡萄糖氧化酶、β-半乳糖苷酶、核糖核酸酶、尿素酶、催化酶、葡萄糖-VI-磷酸脱氢酶、葡糖淀粉酶和乙酰化胆碱脂酶)。其他合适的标记包括可以使用NMR或ESR光谱加以检测的部分。本发明的此类标记的VHH和多肽可以例如用于体外、体内或原位测定(包括本身已知的免疫测定,诸如ELISA,RIA、EIA和其他“夹心测定”等)以及体内诊断和成像目的,取决于对具体标记的选择。
在一些实施方案中,所述官能团、残基或部分包含连接或基因融合至所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的标签。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以包括单个标签或多个标签。举例来说,所述标签是不抑制或防止嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与其靶标或其他目标抗原诸如肿瘤抗原的结合的肽、糖或DNA分子。在各个实施方案中,所述标签是至少约:三个至五个氨基酸长、五个至八个氨基酸长、八个至十二个氨基酸长、十二个至十五个氨基酸长或十五个至二十个氨基酸长。说明性标签描述于诸如美国专利公布号US2013/0058962。在一些实施方案中,所述标签是亲和力标签,诸如谷胱甘肽-S-转移酶(GST)和组氨酸(His)标签。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含His标签。
在一些实施方案中,所述官能团、残基或部分包含螯合基团,例如,以螯合金属或金属阳离子之一。合适的螯合基团例如包括但不限于二乙烯三胺五乙酸(DTPA)或乙二胺四乙酸(EDTA)。
在一些实施方案中,所述官能团、残基或部分包含作为特异性结合对,诸如生物素-(链霉)亲和素结合对的一个部分的官能团。这种官能团可以用来连接本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与跟所述结合对的另一半结合(即,通过形成结合对)的另一个蛋白质、多肽或化学化合物。举例来说,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以缀合至生物素,并且连接至与亲和素或链霉亲和素缀合的另一个蛋白质、多肽、化合物或载体。举例来说,这种缀合的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以用作例如诊断系统中的报告基因,其中可检测信号产生剂缀合至亲和素或链霉亲和素。此类结合对还可以例如用于使所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物结合至载体,包括适用于药物目的的载体。一个非限制性实例是Cao和Suresh,Journal of Drug Targeting,8,4,257(2000)所描述的脂质体制剂。此类结合对还可以用于连接治疗活性剂与本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物。
嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的制备
本文描述了用于制备本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的方法。举例来说,可以使用本领域中已知的方法以化学方式合成编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的DNA序列(例如,编码信号传导剂(例如经修饰的IL-2)和靶向部分和接头的DNA序列)。合成DNA序列可以连接至其他适当的核苷酸序列,包括例如表达控制序列,以产生编码所期望的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的基因表达构建体。因此,在各个实施方案中,本发明提供了包含编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核苷酸序列的分离的核酸。
编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸可以并入(连接)至表达载体中,所述表达载体可以通过转染、转化或转导技术而引入宿主细胞中。举例来说,可以通过反转录病毒转导将编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸引入至宿主细胞中。说明性宿主细胞是大肠杆菌细胞、中国仓鼠卵巢(CHO)细胞、人胚肾293(HEK 293)细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人肝细胞癌细胞(例如Hep G2)、昆虫Sf9细胞和骨髓瘤细胞。可以使转化的宿主细胞在允许宿主细胞表达编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的基因的条件下生长。因此,在各个实施方案中,本发明提供了包含编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸的表达载体。在各个实施方案中,本发明另外提供了包含此类表达载体的宿主细胞。
具体的表达和纯化条件将取决于所采用的表达系统而变化。举例来说,如果在大肠杆菌中表达基因,那么首先通过将工程化的基因置于合适的细菌启动子例如Trp或Tac和原核信号序列的下游而将它克隆至表达载体中。在另一个实例中,如果将要在真核宿主细胞,例如CHO细胞中表达工程化的基因,那么首先将它插入含有例如合适的真核启动子、分泌信号、增强子和各种内含子的表达载体中。可以使用转染、转化或转导技术将基因构建体引入至宿主细胞中。
本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以通过使经编码所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的表达载体转染的宿主细胞在允许表达所述蛋白质的条件下生长来产生。在表达后,可以使用本领域中众所周知的技术,例如亲和力标签诸如谷胱甘肽-S-转移酶(GST)和组氨酸标签或通过色谱法来收集并且纯化所述蛋白质。
因此,在各个实施方案中,本发明提供了一种编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸。在各个实施方案中,本发明提供了一种包含编码本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸的宿主细胞。
在各个实施方案中,IL-2、其变体,或包含IL-2或其变体的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以在体内表达,例如在患者体内表达。举例来说,在各个实施方案中,IL-2、其变体或包含IL-2或其变体的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以编码IL-2或其变体或包含IL-2或其变体的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的核酸的形式施用。在各个实施方案中,所述核酸是DNA或RNA。在一些实施方案中,所述IL-2、其变体或包含IL-2或其变体的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物是由经修饰的mRNA,即包含一个或多个经修饰的核苷酸的mRNA编码。在一些实施方案中,所述经修饰的mRNA包含一个或多个在美国专利号8,278,036中发现的修饰,所述专利的全部内容特此以引用方式并入。在一些实施方案中,所述经修饰的mRNA包含m5C、m5U、m6A、s2U、Ψ和2′-O-甲基-U中的一者或多者。在一些实施方案中,本发明涉及施用编码一种或多种本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的经修饰的mRNA。在一些实施方案中,本发明涉及包含所述经修饰的mRNA的基因治疗载体。在一些实施方案中,本发明涉及包括所述基因治疗载体的基因治疗方法。在各个实施方案中,所述核酸呈溶瘤病毒,例如腺病毒、呼肠孤病毒、麻疹、单纯疱疹、新城疫病毒或牛痘的形式。
在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含作为VHH的靶向部分。在各个实施方案中,所述VHH不局限于特定的生物学来源或特定的制备方法。举例来说,所述VHH一般可以通过以下方式获得:(1)通过分离天然存在的重链抗体的V
在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含对应于针对目标靶标的天然存在的重链抗体的V
在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含已经“人源化”,即通过将天然存在的V
在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包含已经“骆驼化”,即通过将来自常规4链抗体的天然存在的VH结构域的氨基酸序列中的一个或多个氨基酸残基置换为骆驼重链抗体的V
在各个实施方案中,“人源化”与“骆驼化”可以通过以下方式来进行:分别提供编码天然存在的V
药学上可接受的盐和赋形剂
本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以具有能与无机或有机酸反应的充分碱性的官能团,或能与无机或有机碱反应的羧基,以形成药学上可接受的盐。如本领域中众所周知,药学上可接受的酸加成盐是由药学上可接受的酸形成。此类盐包括例如以下文献中列出的药学上可接受的盐:Journal ofPharmaceutical Science,66,2-19(1977)和The Handbook of Pharmaceutical Salts;Properties,Selection,and Use.P.H.Stahl和C.G.Wermuth(编辑),Verlag,Zurich(Switzerland)2002,所述文献特此以引用方式整体并入。
作为非限制性实例,药学上可接受的盐包括硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、丹宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、樟脑磺酸盐、双羟萘酸盐、苯基乙酸盐、三氟乙酸盐、丙烯酸盐、氯代苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、甲基苯甲酸盐、邻乙酰氧基苯甲酸盐、萘-2-苯甲酸盐、异丁酸盐、苯基丁酸盐、α-羟基丁酸盐、丁炔-1,4-二甲酸盐、己炔-1,4-二甲酸盐、癸酸盐、辛酸盐、肉桂酸盐、乙醇酸盐、庚酸盐、马尿酸盐、苹果酸盐、羟基马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、烟酸盐、酞酸盐、对苯二酸盐、丙炔酸盐、丙酸盐、苯基丙酸盐、癸二酸盐、辛二酸盐、对溴代苯磺酸盐、氯代苯磺酸盐、乙基磺酸盐、2-羟乙基磺酸盐、甲基磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、萘-1,5-磺酸盐、二甲苯磺酸盐和酒石酸盐。
术语“药学上可接受的盐”还指具有酸性官能团,诸如羧酸官能团的本发明组合物与碱形成的盐。合适的碱包括但不限于碱金属诸如钠、钾和锂的氢氧化物;碱土金属诸如钙和镁的氢氧化物;其他金属诸如铝和锌的氢氧化物;氨和有机胺,诸如未经取代或经羟基取代的单烷基胺、二烷基胺或三烷基胺、二环己基胺;三丁胺;吡啶;N-甲基,N-乙基胺;二乙基胺;三乙基胺;单(2-OH-低级烷基胺)、双(2-OH-低级烷基胺)或三(2-OH-低级烷基胺)(诸如单(2-羟基乙基)胺、双(2-羟基乙基)胺或三(2-羟基乙基)胺)、2-羟基-叔丁胺或三(羟甲基)甲胺、N,N-二-低级烷基-N-(羟基-低级烷基)-胺(诸如N,N-二甲基-N-(2-羟基乙基)胺)或三(2-羟基乙基)胺;N-甲基-D-葡萄糖胺;和氨基酸,诸如精氨酸、赖氨酸等等。
在一些实施方案中,本文所描述的组合物呈药学上可接受的盐的形式。
药物组合物和制剂
在各个实施方案中,本发明有关于包含本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和药学上可接受的载体或赋形剂的药物组合物。本文所描述的任何药物组合物都可以作为包含药学上可接受的载体或媒介物的组合物的组分施用至受试者。此类组合物可以任选地包含适量的药学上可接受的赋形剂,以便提供用于适当施用的形式。
在各个实施方案中,药物赋形剂可以是液体,诸如水和油,包括石油、动物、植物或合成来源的那些液体,诸如花生油、大豆油、矿物油、芝麻油等等。所述药物赋形剂可以是例如生理盐水、阿拉伯树胶、明胶、淀粉糊、滑石、角蛋白、胶体二氧化硅、脲等等。另外,可以使用助剂、稳定剂、增稠剂、润滑剂和着色剂。在一个实施方案中,当施用至受试者时,所述药学上可接受的赋形剂是无菌的。当经静脉内施用本文所描述的任何剂时,水是可用的赋形剂。还可以采用生理盐水溶液和葡萄糖水溶液和甘油溶液作为液体赋形剂,具体来说,用于可注射溶液。合适的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等等。本文所描述的任何剂在需要时还可以包含微量润湿剂或乳化剂或pH值缓冲剂。合适的药物赋形剂的其他实例描述于Remington’s Pharmaceutical Sciences 1447-1676(Alfonso R.Gennaro编辑,第19版1995)中,所述文献以引用方式并入本文。
本发明包括所描述的药物组合物(和/或其他治疗剂)的各种制剂形式。本文所描述的任何发明药物组合物(和/或其他治疗剂)可以呈溶液、悬浮液、乳液、滴剂、片剂、丸剂、丹剂、胶囊剂、含有液体的胶囊剂、明胶胶囊、粉剂、持续释放制剂、栓剂、乳液、气雾剂、喷雾剂、悬浮液、冻干粉剂、冷冻悬浮液、干燥粉剂的形式或任何其他合用的形式。在一个实施方案中,所述组合物呈胶囊剂形式。在另一个实施方案中,所述组合物呈片剂形式。在又一个实施方案中,所述药物组合物被配制为呈软凝胶胶囊形式。在另一个实施方案中,所述药物组合物被配制为呈明胶胶囊形式。在又一个实施方案中,所述药物组合物被配制为液体。
在必要时,本发明的药物组合物(和/或其他剂)还可以包括增溶剂。所述剂还可以与如本领域中已知的合适的媒介物或递送装置一起递送。本文概述的组合疗法可以在单个递送媒介物或递送装置中共同递送。
本发明的包含本发明药物组合物(和/或其他剂)的制剂可能适宜呈单位剂型的形式存在,并且可以通过制药领域中众所周知的任何方法来制备。此类方法一般包括使所述治疗剂与构成一种或多种辅助成分的载体缔合的步骤。典型地,所述制剂是通过使所述治疗剂均匀地并且密切地与液体载体、细粉状固体载体或二者缔合,然后在必要时将产物成形为所期望的制剂的剂型(例如湿式或干式造粒、粉末掺合物等,随后使用本领域中已知的常规方法进行制片)来制备。
在各个实施方案中,本文所描述的任何药物组合物(和/或其他剂)根据常规程序配制为适合于本文所描述的施用模式的组合物。
施用途径包括例如:口服、皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外、舌下、鼻内、脑内、阴道内、经皮、直肠、通过吸入或局部。施用可以是局部的或全身的。在一些实施方案中,所述施用是通过口服实现。在另一个实施方案中,所述施用是通过肠胃外注射。施用模式可以留给医师判断,并且部分取决于医学病状的部位。在大部分情况下,施用使得本文所描述的任何剂释放至血流中。
在一个实施方案中,本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物根据常规程序配制为适合于口服施用的组合物。举例来说,用于口服递送的组合物可以呈片剂、糖锭、水性或油性悬浮液、颗粒剂、粉剂、乳液、胶囊剂、糖浆或酏剂形式。口服施用的组合物可以包含一种或多种剂,例如甜味剂,诸如果糖、阿斯巴特(aspartame)或糖精;调味剂,诸如薄荷油、冬青油或樱桃油;着色剂;和防腐剂,以提供药学上可口的制剂。此外,在呈片剂或丸剂形式时,所述组合物可以经过包衣以延迟胃肠道中的崩解和吸收,从而在较长时间段内提供持续作用。在本文所描述的渗透活性驱动的任何嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物周围的选择性渗透膜还适用于口服施用的组合物。在后面的这些平台中,来自于所述胶囊剂周围的环境的流体被驱动化合物吸入,所述驱动化合物膨胀从而通过孔口置换所述剂或剂组合物。与立即释放制剂的尖峰分布相反,这些递送平台可以提供本质上零阶的递送分布。时间延迟材料诸如单硬脂酸甘油酯或硬脂酸甘油酯也是可用的。口服组合物可以包括标准赋形剂,诸如甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素和碳酸镁。在一个实施方案中,所述赋形剂属于药物等级。悬浮液以及活性化合物可以含有悬浮剂,诸如例如乙氧基化异硬脂醇、聚氧化乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、皂土、琼脂、黄芪胶等以及它们的混合物。
适用于肠胃外施用(例如静脉内、肌肉内、腹膜内、皮下和关节内注射和输注)的剂型包括例如溶液、悬浮液、分散液、乳液等等。它们还可以制造为呈无菌固体组合物(例如冻干组合物)形式,所述形式可以在即将使用前溶解或悬浮在无菌可注射介质中。它们可以含有例如本领域中已知的悬浮剂或分散剂。适用于肠胃外施用的制剂组分包括无菌稀释剂诸如注射用水、生理盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂诸如抗坏血酸或亚硫酸氢钠;螯合剂诸如EDTA;缓冲液诸如乙酸盐、柠檬酸盐或磷酸盐;和张力调节剂诸如氯化钠或葡萄糖。
对于静脉内施用而言,合适的载体包括生理盐水、抑菌水、克列莫佛(Cremophor)ELTM(BASF,Parsippany,NJ)或磷酸盐缓冲生理盐水(PBS)。所述载体在制造和存储条件下应当是稳定的,并且应当经过防腐以免受微生物影响。所述载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)以及它们的合适的混合物的溶剂或分散介质。
本文所提供的组合物可以单独或与其他合适的组分组合而制成气雾剂制剂(即,“喷雾”)以便经由吸入施用。气雾剂制剂可以放入加压可接受的推进剂诸如二氯二氟甲烷、丙烷、氮气等等中。
本文所描述的任何发明药物组合物(和/或其他剂)可以通过控制释放或持续释放手段或通过本领域普通技术人员众所周知的递送装置施用。实例包括但不限于美国专利号3,845,770、3,916,899、3,536,809、3,598,123、4,008,719、5,674,533、5,059,595、5,591,767、5,120,548、5,073,543、5,639,476、5,354,556和5,733,556中所描述的那些,各美国专利以引用方式整体并入本文。此类剂型可用于使用例如羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、其他聚合物基质、凝胶、渗透膜、渗透系统、多层涂层、微粒、脂质体、微球体或它们的组合提供一种或多种活性成分的控制释放或持续释放,从而在变化的比例下提供所期望的释放分布。可以容易地选择本领域技术人员已知的合适的控制释放或持续释放制剂,包括本文所描述的那些,以便与本文所描述的剂的活性成分一起使用。本发明因此提供了适合口服施用的单个单位剂型,诸如但不限于适合于控制释放或持续释放的片剂、胶囊剂、囊形片和胶囊片。
可以通过各种条件包括但不限于pH值变化、温度变化来刺激、通过适当的光的波长、酶的浓度或可用性、水的浓度或可用性或者其他生理条件或化合物来刺激活性成分的控制释放或持续释放。
在另一个实施方案中,控制释放系统可以放在欲治疗的目标区域的附近,因此仅需要全身剂量的一部分(参见例如Goodson,Medical Applications of ControlledRelease,同上,第2卷,第115-138页(1984))。可以使用Langer,1990,Science 249:1527-1533)的综述中讨论的其他控制释放系统。
药物制剂优选地是无菌的。可以例如通过经无菌过滤膜过滤来实现灭菌。在组合物被冻干的情况下,可以在冻干和复水之前或之后进行过滤灭菌。
施用和剂量
应当了解,根据本发明施用的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的实际剂量将根据具体剂型和施用模式而变化。许多因素可改变嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的作用。例如体重、性别、饮食、施用时间、施用途径、排泄速率、受试者的状况、药物组合、遗传倾向和反应敏感性可以在本领域技术人员考虑范围内。可以连续地或者以最大耐受剂量内的一个或多个离散剂量进行施用。本领域技术人员可以使用常规剂量施用测试来确定给定条件组的最佳施用速率。
在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的合适的剂量在约0.01μg/kg至约100mg/kg受试者体重、约0.01μg/kg至约10mg/kg受试者体重或约0.01μg/kg至约1mg/kg受试者体重的范围内,例如约0.01μg/kg、约0.02μg/kg、约0.03μg/kg、约0.04μg/kg、约0.05μg/kg、约0.06μg/kg、约0.07μg/kg、约0.08μg/kg、约0.09μg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.4mg/kg、约0.5mg/kg、约0.6mg/kg、约0.7mg/kg、约0.8mg/kg、约0.9mg/kg、约1mg/kg、约1.1mg/kg、约1.2mg/kg、约1.3mg/kg、约1.4mg/kg、约1.5mg/kg、约1.6mg/kg、约1.7mg/kg、约1.8mg/kg、1.9mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg体重或约100mg/kg体重,包括所有值和介于这些值之间的范围。
所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的个别剂量可以呈含有例如每个单位剂型约1μg至约100mg、约1μg至约90mg、约1μg至约80mg、约1μg至约70mg、约1μg至约60mg、约1μg至约50mg、约1μg至约40mg、约1μg至约30mg、约1μg至约20mg、约1μg至约10mg、约1μg至约5mg、约1μg至约3mg、约1μg至约1mg或每个单位剂型约1μg至约50μg的单位剂型(例如片剂、胶囊剂或液体制剂)的形式施用。举例来说,单位剂型可以是约1μg、约2μg、约3μg、约4μg、约5μg、约6μg、约7μg、约8μg、约9μg、约10μg、约11μg、约12μg、约13μg、约14μg、约15μg、约16μg、约17μg、约18μg、约19μg、约20μg、约21μg、约22μg、约23μg、约24μg、约25μg、约26μg、约27μg、约28μg、约29、约30μg、约35μg、约40μg、约45μg、约50μg、约60μg、约70μg、约80μg、约90μg、约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg或约100mg,包括所有值和介于这些值之间的范围。
在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物是以每天约1μg至约100mg、每天约1μg至约90mg、每天约1μg至约80mg、每天约1μg至约70mg、每天约1μg至约60mg、每天约1μg至约50mg、每天约1μg至约40mg、每天约1μg至约30mg、每天约1μg至约20mg、每天约01μg至约10mg、每天约1μg至约5mg、每天约1μg至约3mg或每天约1μg至约1mg的量施用。在各个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物是以如下每日剂量施用:约1μg、约2μg、约3μg、约4μg、约5μg、约6μg、约7μg、约8μg、约9μg、约10μg、约11μg、约12μg、约13μg、约14μg、约15μg、约16μg、约17μg、约18μg、约19μg、约20μg、约21μg、约22μg、约23μg、约24μg、约25μg、约26μg、约27μg、约28μg、约29、约30μg、约35μg、约40μg、约45μg、约50μg、约60μg、约70μg、约80μg、约90μg、约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg或约100mg,包括所有值和介于这些值之间的范围。
根据本发明的某些实施方案,包含所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的药物组合物可以施用例如每天超过一次(例如每天约两次、约三次、约四次、约五次、约六次、约七次、约八次、约九次或约十次)、约每天一次、约每隔一天一次、约每第三天一次、约一周一次、约每两周一次、约每个月一次、约每两个月一次、约每三个月一次、约每六个月一次或约每年一次。在一个实施方案中,包含嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的药物组合物每周施用约三次。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可长期施用。举例来说,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以如本文所描述施用至少约1周、至少约2周、至少约3周、至少约4周、至少约5周、至少约6周、至少约7周、至少约8周、至少约9周、至少约10周、至少约11周或至少约12周。举例来说,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以施用12周、24周、36周或48周。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物施用至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月或至少约12个月。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以施用至少约1年、至少约2年、至少约3年、至少约4年或至少约5年。
组合疗法和其他治疗剂
在各个实施方案中,将本发明的药物组合物与一种或多种另外的治疗剂联合共同施用。共同施用可以同时或依序进行。
在一个实施方案中,将所述其他治疗剂和本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物同时施用至受试者。如本文所使用,术语“同时”意指所述其他治疗剂和所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的施用时间间隔不超过约60分钟,诸如不超过约30分钟、不超过约20分钟、不超过约10分钟、不超过约5分钟或不超过约1分钟。所述其他治疗剂和所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的施用可以通过同时施用单一制剂(例如包含所述其他治疗剂和所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的制剂)或独立的制剂(例如包括所述其他治疗剂的第一制剂和包括所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的第二制剂)来进行。
共同施用不需要同时施用各治疗剂,只要其施用时程使得所述其他治疗剂和嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的药理学活性在时间上重叠,由此发挥组合治疗作用即可。举例来说,所述其他治疗剂和所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以依序施用。如本文所使用,术语“依序”意指所述其他治疗剂和所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的施用时间间隔超过约60分钟。举例来说,依序施用所述其他治疗剂与所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物之间的时间可以间隔超过约60分钟、超过约2小时、超过约5小时、超过约10小时、超过约1天、超过约2天、超过约3天、超过约1周、间隔超过约2周或间隔超过约一个月。最佳的施用时间将取决于代谢速率、排泄速率和/或所施用的其他治疗剂和嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的药物动力学活性。可以先施用所述其他治疗剂或所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物细胞。
共同施用也不需要通过相同施用途径向受试者施用所述治疗剂。实际上,各治疗剂可以通过任何适当的途径,例如经肠胃外或非肠胃外施用。
在一些实施方案中,本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与另一种治疗剂共同施用时协同起作用。在此类实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和其他治疗剂的施用剂量可以低于当各剂用于单一疗法情形时所采用的剂量。
在一些实施方案中,本发明有关于化学治疗剂作为其他治疗剂。举例来说但不限于,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与化学治疗剂的这种组合可用于治疗癌症,如本文中其他部分所描述。化学治疗剂的实例包括但不限于烷化剂,诸如噻替派(thiotepa)和CYTOXAN环磷酰胺;烷基磺酸酯,诸如白消安(busulfan)、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶,诸如苯佐替派(benzodopa)、卡波醌(carboquone)、美妥替派(meturedopa)和乌瑞替派(uredopa);乙烯亚胺和甲基蜜胺,包括六甲蜜胺(altretamine)、曲他胺(triethylenemelamine)、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺(trimethylolomelamine);多聚乙酰(acetogenin)(例如布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(camptothecin)(包括合成类似物拓扑替康(topotecan));苔藓抑素(bryostatin);海绵抑素(cally statin);CC-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);念珠藻环肽(cryptophycin)(例如,念珠藻环肽1和念珠藻环肽8);海兔抑素(dolastatin);倍癌霉素(duocarmycin)(包括合成类似物,KW-2189和CB 1-TM1);伊斯罗宾(eleutherobin);水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑素(spongistatin);氮芥,诸如苯丁酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、胆磷酰胺(cholophosphamide)、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、氮芥(mechlorethamine)、氮芥氧化物盐酸盐(mechlorethamine oxide hydrochloride)、美法仑(melphalan)、新恩比兴(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫司汀(prednimustine)、曲磷胺(trofosfamide)、乌拉莫司汀(uracil mustard);亚硝基脲,诸如卡莫司汀(carmustine)、氯脲霉素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)和雷莫斯汀(ranimnustine);抗生素,诸如烯二炔类抗生素(例如卡利奇霉素(calicheamicin),尤其是卡利奇霉素γ1和卡利奇霉素ω1(参见例如Agnew,Chem.Intl.Ed.Engl.,33:183-186(1994)));达内霉素(dynemicin),包括达内霉素A;双膦酸盐,诸如氯屈膦酸盐(clodronate);埃斯波霉素(esperamicin);以及新制癌菌素发色团(neocarzinostatin chromophore)和相关色素蛋白烯二炔类抗生素发色团、阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、安曲霉素(authramycin)、偶氮丝氨酸(azaserine)、博来霉素(bleomycin)、放线菌素C(cactinomycin)、卡拉比星(carabicin)、洋红霉素(caminomycin)、嗜癌素(carzinophilin)、色霉素(chromomycinis)、放线菌素D(dactinomycin)、柔红霉素(daunorubicin)、地托比星(detorubicin)、6-重氮基-5-氧代-L-正亮氨酸、ADRIAMYCIN多柔比星(doxorubicin)(包括吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉基-多柔比星和脱氧多柔比星)、表柔比星(epirubicin)、依素比星(esorubicin)、伊达比星(idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素类(mitomycins)诸如丝裂霉素C、霉芬酸(mycophenolic acid)、诺加霉素(nogalamycin)、橄榄霉素(olivomycin)、培洛霉素(peplomycin)、泼非霉素(potfiromycin)、嘌呤霉素(puromycin)、奎那霉素(quelamycin)、罗多比星(rodorubicin)、链黑霉素(streptonigrin)、链佐星(streptozocin)、杀结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);抗代谢物,诸如甲氨蝶呤(methotrexate)和5-氟尿嘧啶(5-FU);叶酸类似物,诸如迪诺特宁(denopterin)、甲氨蝶呤、蝶罗呤(pteropterin)、曲美沙特(trimetrexate);嘌呤类似物,诸如氟达拉滨(fludarabine)、6-巯基嘌呤、噻咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,诸如环胞苷(ancitabine)、阿扎胞苷(azacitidine)、6-氮杂尿苷、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、双脱氧尿苷(dideoxyuridine)、脱氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷(floxuridine);雄激素,诸如卡芦睾酮(calusterone)、丙酸屈他雄酮(dromostanolone propionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睾内酯(testolactone);抗肾上腺药,诸如氨鲁米特(minoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂,诸如亚叶酸(frolinic acid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸(aminolevulinic acid);恩尿嘧啶(eniluracil);安吖啶(amsacrine);贝斯布西(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);秋水仙胺(demecolcine);地吖醌(diaziquone);依洛尼塞(elformithine);依利醋铵(elliptiniurn acetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;蘑菇多糖(lentinan);氯尼达明(lonidainine);类美登素(maytansinoid),诸如美登素(maytansine)和安丝菌素(ansamitocins);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidanmol);二胺硝吖啶(nitraerine);喷司他汀(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛素蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基酰肼;丙卡巴肼(procarbazine);PSK多糖复合物(JHS Natural Products,Eugene,Oreg.);雷佐生(razoxane);根霉素(rhizoxin);西佐喃(sizofuran);锗螺胺(spirogermanium);替奴佐酸(tenuazonic acid);三亚胺醌(triaziquone);2,2′,2″-三氯三乙胺;单端孢霉烯(trichothecenes)(例如T-2毒素、粘液霉素A(verracurin A)、杆孢菌素A(roridin A)和蛇形菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolaetol);哌泊溴烷(pipobroman);加西托星(gacytosine);阿糖胞苷(arabinoside)(“Ara-C”);环磷酰胺;噻替派;类紫杉醇(taxoid),例如TAXOL太平洋紫杉醇(paclitaxel)(Bristol-Myers SquibbOncology,Princeton,N.J.)、ABRAXANE太平洋紫杉醇的不含聚氧乙烯化蓖麻油(Cremophor)的经白蛋白工程化的纳米粒子制剂(American PharmaceuticalPartners,Schaumberg,111.)以及TAXOTERE多西他赛(doxetaxel)(Rhone-Poulenc Rorer,Antony,France);苯丁酸氮芥;GEMZAR吉西他滨(gemcitabine);6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,诸如顺铂(cisplatin)、奥沙利铂(oxaliplatin)和卡铂(carboplatin);长春碱(vinblastine);铂;依托泊苷(etoposide)(VP-16);异环磷酰胺;米托蒽醌;长春新碱(vincristine);NAVELBINE.长春瑞滨(vinorelbine);诺消灵(novantrone);替尼泊苷(teniposide);依达曲沙(edatrexate);柔红霉素(daunomycin);氨基蝶呤(aminopterin);希罗达(xeloda);伊班膦酸盐(ibandronate);伊立替康(irinotecan)(Camptosar、CPT-11)(包括伊立替康与5-FU的治疗方案和亚叶酸(leucovorin));拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄素(retinoid),诸如视黄酸(retinoic acid);卡培他滨(capecitabine);康普瑞汀(combretastatin);亚叶酸(LV);奥沙利铂(oxaliplatin),包括奥沙利铂治疗方案(FOLFOX);拉帕替尼(lapatinib)(Tykerb);减少细胞增殖的PKC-α、Raf、H-Ras、EGFR的抑制剂(例如埃罗替尼(erlotinib)(Tarceva))和VEGF-A的抑制剂;以及以上任一者的药学上可接受的盐、酸或衍生物。另外,所述治疗方法还可以包括使用辐射。另外,所述治疗方法还可以包括使用光动力疗法。
在一些实施方案中,包括但不限于感染性疾病应用,本发明涉及抗感染剂作为其他治疗剂。在一些实施方案中,所述抗感染剂是抗病毒剂,包括但不限于阿巴卡韦(Abacavir)、阿昔洛韦(Acyclovir)、阿德福韦(Adefovir)、安普那韦(Amprenavir)、阿扎那韦(Atazanavir)、西多福韦(Cidofovir)、达芦那韦(Darunavir)、地拉韦啶(Delavirdine)、去羟肌苷(Didanosine)、多可沙诺(Docosanol)、依非韦仑(Efavirenz)、埃替格韦(Elvitegravir)、恩曲他滨(Emtricitabine)、恩福韦地(Enfuvirtide)、依曲韦林(Etravirine)、泛昔洛韦(Famciclovir)和膦甲酸盐(Foscarnet)。在一些实施方案中,抗感染剂是抗细菌剂,包括但不限于头孢菌素类抗生素(头孢胺苄(cephalexin)、头孢呋辛(cefuroxime)、头孢羟胺苄(cefadroxil)、头孢唑林(cefazolin)、头孢噻吩(cephalothin)、头孢克洛(cefaclor)、头孢孟多(cefamandole)、头孢西丁(cefoxitin)、头孢丙烯(cefprozil)和头孢托罗酯(ceftobiprole));氟喹诺酮类抗生素(fluoroquinoloneantibiotics)(环丙沙星(cipro)、左氟沙星(Levaquin)、氧氟沙星(floxin)、加替沙星(tequin)、莫西沙星(avelox)和诺氟沙星(norflox));四环素类抗生素(四环素、米诺环素(minocycline)、羟四环素(oxytetracycline)和去氧环素(doxycycline));青霉素类抗生素(阿莫西林(arnoxicillin)、胺苄西林(ampicillin)、青霉素V、双氯西林(dicloxacillin)、羧苄西林(carbenicillin)、万古霉素(vancomycin)和甲氧西林(methicillin));单酰胺环类抗生素(胺曲南(aztreonam));以及碳青霉烯类抗生素(厄他培南(ertapenem)、多尼培南(doripenem)、亚胺培南(imipenem)/西司他丁(cilastatin)和美罗培南(meropenem))。在一些实施方案中,抗感染剂包括抗疟药(例如氯喹(chloroquine)、奎宁(quinine)、甲氟喹(mefloquine)、伯胺喹(primaquine)、去氧环素(doxycycline)、蒿甲醚(artemether)/苯芴醇(lumefantrine)、阿托伐醌(atovaquone)/氯胍(proguanil)和磺胺多辛(sulfadoxine)/乙胺嘧啶(pyrimethamine))、甲硝唑(metronidazole)、替硝唑(tinidazole)、伊维菌素(ivermectin)、双羟萘酸噻嘧啶(pyrantel pamoate)和阿苯达唑(albendazole)。
在说明性实施方案中,本发明有关于使用肝炎治疗剂作为另外的治疗剂。在各个实施方案中,肝炎治疗剂包括但不限于IFN-α(诸如INTRON A)或聚乙二醇化IFN-α(诸如Pegasys或PEG-INTRON)、利巴韦林(ribavirin)、波普瑞韦(boceprevir)、西美瑞韦(simeprevir)、素非布韦(sofosbuvir)、西美瑞韦、达卡他韦(daclatasvir)、雷迪帕韦(ledipasvir)/素非布韦(Harvoni)、奥比他韦(ombitasvir)/帕利瑞韦(paritaprevir)/利托那韦(ritonavir)(Technivie)、奥比他韦/帕利瑞韦/利托那韦/达萨布韦(dasabuvir)(Viekira Pak)、拉米夫定(lamivudine)、阿德福韦(adefovir)、恩替卡韦(entecavir)、替比夫定(telbivudine)、恩替卡韦、替诺福韦(tenofovir)、维帕他韦(velpatasvir)、艾尔巴韦(elbasvir)、格佐匹韦(grazoprevri)、达萨布韦以及它们的任何组合。在一个实施方案中,所述另外的治疗剂是IFN-α(例如INTRON A)或聚乙二醇化IFN-α(例如Pegasys或PEG-INTRON)。在另一个实施方案中,所述另外的治疗剂是利巴韦林。
在一些实施方案中,本发明涉及使用所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和免疫阻抑剂的组合疗法。在一些实施方案中,本发明涉及对利用免疫阻抑剂进行治疗的患者施用所述Clec9A结合剂。
在一个实施方案中,所述免疫阻抑剂是TNF。在说明性实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与TNF共同施用时协同作用。在说明性实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与TNF共同施用以用于治疗肿瘤或癌症时协同作用。举例来说,共同施用本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和TNF可以协同作用以减轻或消除所述肿瘤或癌症,或者减缓所述肿瘤或癌症的生长和/或进展和/或转移。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与TNF的组合当与单独用在单一疗法的情形下的所述剂相比时可以表现出提高的安全特性。在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和TNF的施用剂量可以低于当各剂用于单一疗法情形时所采用的剂量。
在一些实施方案中,包括但不限于自身免疫应用的一些实施方案中,其他治疗剂是免疫阻抑剂,所述免疫阻抑剂是消炎剂,诸如类固醇类消炎剂或非类固醇类消炎剂(NSAID)。类固醇,特别是肾上腺皮质类固醇及其合成类似物在本领域中是众所周知的。可用于本发明中的皮质类固醇的实例包括但不限于羟基曲安西龙(hydroxyltriamcinolone)、α-甲基地塞米松(alpha-methyldexamethasone)、β-甲基地塞米松、二丙酸倍氯米松(beclomethasone dipropionate)、苯甲酸倍他米松(betamethasonebenzoate)、二丙酸倍他米松、戊酸倍他米松、戊酸氯倍他素(clobetasol valerate)、地奈德(desonide)、去羟米松(desoxymethasone)、地塞米松(dexamethasone)、二乙酸二氟拉松(diflorasone diacetate)、戊酸二氟可龙(diflucortolone valerate)、氟氢缩松(fluadrenolone)、氟氯奈德(fluclorolone acetonide)、特戊酸氟美松(flumethasonepivalate)、氟轻松(fluosinolone acetonide)、醋酸氟轻松(fluocinonide)、氟可丁酯(flucortine butylester)、氟可龙(fluocortolone)、醋酸氟泼尼定(fluprednidene/fluprednylidene)、氟氢缩松(flurandrenolone)、哈西奈德(halcinonide)、醋酸氢化可的松(hydrocortisone acetate)、丁酸氢化可的松(hydrocortisone butyrate)、甲泼尼龙(methylprednisolone)、曲安奈德(triamcinolone acetonide)、可的松(cortisone)、可托多松(cortodoxone)、醋酸氟轻松、氟氢可的松(fludrocortisone)、二醋酸二氟拉松(difluorosone diacetate)、丙酮化氟雄诺龙(fluradrenolone acetonide)、甲羟松(medrysone)、安西缩松(amcinafel)、安西非特(amcinafide)、倍他米松及其相应酯、氯泼尼松(chloroprednisone)、氯可托龙(clocortelone)、克西诺龙(clescinolone)、二氯松(dichlorisohe)、二氟泼尼酯(difluprednate)、氟氯奈德(flucloronide)、氟尼缩松(flunisolide)、氟米龙(fluoromethalone)、氟培龙(fluperolone)、氟泼尼龙(fluprednisolone)、氢化可的松(hydrocortisone)、甲泼尼松(meprednisone)、帕拉米松(paramethasone)、泼尼松龙(prednisolone)、泼尼松(prednisone)、二丙酸倍他米松。可以用于本发明中的(NSAID)包括但不限于水杨酸、乙酰水杨酸、水杨酸甲酯、乙二醇水杨酸酯、水杨酰胺、苯甲基-2,5-二乙酰氧基苯甲酸、布洛芬(ibuprofen)、舒林酸(fulindac)、萘普生(naproxen)、酮洛芬(ketoprofen)、依托芬那酯(etofenamate)、保泰松(phenylbutazone)和吲哚美辛(indomethacin)。在一些实施方案中,所述免疫阻抑剂可以是细胞抑制剂,诸如烷化剂、抗代谢物(例如硫唑喋呤、甲氨蝶呤)、细胞毒性抗生素、抗体(例如巴利昔单抗(basiliximab)、达克珠单抗(daclizumab)和莫罗单抗(muromonab))、抗免疫亲和素(anti-immunophilin)(例如环孢素(cyclosporine)、他克莫司(tacrolimus)、西罗莫司(sirolimus))、干扰素、阿片类、TNF结合蛋白、霉酚酸酯以及小生物剂(例如芬戈莫德、多球壳素(myriocin))。其他消炎剂描述于例如美国专利号4,537,776中,所述文献的完整内容特此以引用方式并入。
在一些实施方案中,本发明有关于作为另外的治疗剂用于治疗肥胖的各种剂。用于治疗肥胖症的说明性剂包括但不限于奥利司他(orlistat)(例如ALLl、XENICAL)、氯卡色林(loracaserin)(例如BELVIQ)、苯丁胺(phentermine)-托吡酯(topiramate)(例如QSYMIA)、西布曲明(sibutramme)(例如REDUCTIL或MERJDIA)、利莫那班(rimonabant)(ACOMPLLA)、艾塞那肽(exenatide)(例如BYETTA)、普兰林肽(pramlintide)(例如SYMLIN)苯丁胺、苄非他明(benzphetamine)、二乙胺苯丙酮(diethylpropion)、苯甲曲秦(phendimetrazme)、安非他酮(bupropion)和二甲双胍(metformin)。干扰身体吸收食物中的特定营养物质的能力的剂在所述另外的剂中,例如奥利司他(例如ALU、XENICAL)、葡甘露聚糖和瓜尔胶。抑制食欲的剂也在所述另外的剂中,例如儿茶酚胺及其衍生物(诸如芬特明(phenteimine)和其他基于安非他命的药物)、各种抗抑郁剂和情绪稳定剂(例如安非他酮和托吡酯)、减食欲剂(例如dexedrine、地高辛)。增加身体代谢的剂也在所述另外的剂中。
在一些实施方案中,另外的治疗剂可以选自食欲抑制剂、神经递质再摄取抑制剂、多巴胺能激动剂、血清素能激动剂、GABA能信号传导调节剂、抗惊厥剂、抗抑郁剂、单胺氧化酶抑制剂、P物质(NK1)受体拮抗剂、黑皮质素受体激动剂和拮抗剂、脂肪酶抑制剂、脂肪吸收抑制剂、能量摄取或代谢调控剂、大麻素受体调节剂、用于治疗成瘾的剂、用于治疗代谢综合征的剂、过氧化物酶体增殖物激活受体(PPAR)调节剂;二肽基肽酶4(DPP-4)拮抗剂、用于治疗心血管疾病的剂、用于治疗甘油三酯水平升高的剂、用于治疗低HDL的剂、用于治疗高胆固醇血症的剂和用于治疗高血压的剂。一些用于心血管疾病的剂包括他汀类药物(例如洛伐他汀(lovastatin)、阿托伐他汀(atorvastatin)、氟伐他汀(fluvastatin)、瑞舒伐他汀(rosuvastatin)、辛伐他汀(simvastatin)和帕伐他汀(pravastatin))和ω-3剂(例如LOVAZA、EPANQVA、VASCEPA、酯化ω-3,一般有鱼油、磷虾油、海藻油)。在一些实施方案中,另外的剂可以选自安非他命、苯并二氮平、磺酰脲、美格替奈(meglitinide)、噻唑烷二酮、双胍、β-阻滞剂、XCE抑制剂、利尿剂、硝酸盐、钙通道阻滞剂、芬特明、西布曲明、氯卡色林、西替利司他(cetilistat)、利莫那班、泰伦那班(taranabant)、托吡酯、加巴喷丁(gabapentin)、丙戊酸(valproate)、维加巴因(vigabatrin)、安非他酮、噻加宾(tiagabine)、舍曲林(sertraline)、氟西汀(fluoxetine)、曲唑酮(trazodone)、唑尼沙胺(zonisamide)、哌醋甲酯(methylphenidate)、伐伦克林(varenicline)、纳曲酮(naltrexone)、二乙胺苯丙酮、苯甲曲秦、雷帕格奈德(rcpaglini.de)、那格列奈(nateglinide)、格列美脲(glimepiride)、二甲双胍、吡格列酮(pioglitazone)、罗西格列酮(rosiglilazone)和西他列汀(sitagliptin)。
在一些实施方案中,本发明有关于作为另外的治疗剂用于治疗糖尿病的剂。说明性抗糖尿病剂包括但不限于磺酰脲(例如DYMELOR(醋磺环己脲)、DIABINESE(氯磺丙脲)、ORINASE(甲磺丁脲)和TOLINASE(甲磺氮卓脲)、GLUCOTROL(格列甲嗪)、GLUCOTROLXL(延长释放)、DIABETA(格列本脲)、MICRONASE(格列本脲)、GLYNASE PRESTAB(格列本脲)和AMARYL(格列美脲));双胍(例如二甲双胍(GLUCOPHAGE、GLUCOPHAGE XR、RIOMET、FORTAMET和GLUMETZA));噻唑烷二酮(例如ACTOS(吡格列酮)和AVANDIA(罗格列酮);α-葡糖苷酶抑制剂(例如PRECOSE(阿卡波糖)和GLYSET(米格列酮);美格替奈(例如PRANDIN(瑞格列奈)和STARLIX(那格列奈));二肽基肽酶IV(DPP-IV)抑制剂(例如JANUVIA(西他列汀)、NESINA(阿格列汀)、ONGLYZA(沙格列汀)和TRADJENTA(利格列汀));钠-葡萄糖同转运蛋白2(SGLT2)抑制剂(例如INVOKANA(卡格列净));和组合药丸(例如组合了格列本脲(磺酰脲)和二甲双胍的GLUCOVANCE、组合了格列甲嗪(磺酰脲)和二甲双胍的METAGLIP和在一个药丸中使用二甲双胍和罗格列酮(AVANDIA)的AVANDAMET、KAZANO(阿格列汀和二甲双胍)、OSENI(阿格列汀加吡格列酮)、二甲双胍口服剂、ACTOS口服剂、BYETTA皮下剂、JANUVIA口服剂、WELCHOL口服剂、JANUMET口服剂、格列甲嗪口服剂、格列美脲口服剂、GLUCOPHAGE口服剂、LANTUS皮下剂、格列本脲口服剂、ONGLYZA口服剂、AMARY1口服剂、LANTUS SOLOSTAR皮下剂、BYDUREON皮下剂、LEVEMIR FLEXPEN皮下剂、ACTOPLUS MET口服剂、GLUMETZA口服剂、TRADJENTA口服剂、溴麦角环肽口服剂、KOMBIGLYZE XR口服剂、INVOKANA口服剂、PRANDIN口服剂、LEVEMIR皮下剂、PARLODEL口服剂、吡格列酮口服剂、NOVOLOG皮下剂、NOVOLOG FLEXPEN皮下剂、VICTOZA2-PAK皮下剂、HUMALOG皮下剂、STARLIX口服剂、FORTAMET口服剂、GLUCOVANCE口服剂、GLUCOPHAGE XR口服剂、NOVOLOG Mix 70-30FLEXPEN皮下剂、GLYBURIDE-METFORMIN口服剂、阿卡波糖口服剂、SYMLINPEN 60皮下剂、GLUCOTRO1 XL口服剂、NOVOLIN R注射剂、GLUCOTROL口服剂、DUETACT口服剂、西他列汀口服剂、SYMLINPEN 120皮下剂、HUMALOGKWIKPEN皮下剂、JANUMET XR口服剂、GLIPIZIDE-METFORMIN口服剂、CYCLOSET口服剂、HUMALOG MIX 75-25皮下剂、那格列奈口服剂、HUMALOG Mix 75-25KWIKPEN皮下剂、HUMULIN70/30皮下剂、PRECOSE口服剂、APIDRA皮下剂、Humulin R注射剂、Jentadueto口服剂、Victoza 3-Pak皮下剂、Novolin 70/30皮下剂、NOVOLIN N皮下剂、地特胰岛素皮下剂、微粒化格列本脲口服剂、GLYNASE口服剂、HUMULINN皮下剂、甘精胰岛素皮下剂、RIOMET口服剂、吡格列酮-二甲双胍口服剂、APIDRA SOLOSTAR皮下剂、赖脯胰岛素皮下剂、GLYSET口服剂、HUMULIN 70/30 Pen皮下剂、考来维纶口服剂、西他列汀-二甲双胍口服剂、DIABETA口服剂、常规人胰岛素注射剂、HUMULIN N Pen皮下剂、艾塞那肽皮下剂、HUMALOG Mix 50-50KWIKPEN皮下剂、利拉鲁肽皮下剂、KAZANO口服剂、瑞格列奈口服剂、氯磺丙脲口服剂、门冬胰岛素皮下剂、NOVOLOG Mix 70-30皮下剂、HUMALOG Mix 50-50皮下剂、沙格列汀口服剂、ACTOPLUS Met XR口服剂、米格列醇口服剂、NPH重组人胰岛素皮下剂、NPH胰岛素和常规人胰岛素皮下剂、甲磺氮卓脲口服剂、米非司酮口服剂、门冬胰岛素鱼精蛋白-门冬胰岛素皮下剂、瑞格列奈-二甲双胍口服剂、沙格列汀-二甲双胍口服剂、利格列汀-二甲双胍口服剂、NESINA口服剂、OSENI口服剂、甲磺丁脲口服剂、赖脯胰岛素鱼精蛋白和赖脯胰岛素皮下剂、普兰林肽皮下剂、谷赖胰岛素皮下剂、吡格列酮-格列美脲口服剂、PRANDIMET口服剂、NOVOLOG PenFill皮下剂、利格列汀口服剂、艾塞那肽微球体皮下剂、KORLYM口服剂、阿格列汀口服剂、阿格列汀-吡格列酮口服剂、阿格列汀-二甲双胍口服剂、卡格列净口服剂、赖脯胰岛素(Lispro)(HUMALOG);门冬胰岛素(Aspart)(NOVOLOG);谷赖胰岛素(Glulisine)(APIDRA);常规胰岛素(Regular)(NOVOLIN R或HUMULIN R);NPH(NOVOLIN N或HUMULIN N);甘精胰岛素(Glulisine)(LANTUS);地特胰岛素(Detemir)(LEVEMIR);HUMULIN或NOVOLIN70/30;和NOVOLOG Mix 70/30 HUMALOG Mix 75/25或50/50。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与嵌合抗原受体(CAR)T细胞疗法组合使用时协同作用。在说明性实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与CAR T细胞疗法组合用于治疗肿瘤或癌症时协同作用。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物剂当与CAR T细胞疗法组合用于治疗基于血液的肿瘤时协同作用。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物当与CAR T细胞疗法组合用于治疗实体肿瘤时协同作用。举例来说,使用所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物和CAR T细胞可以协同作用以减轻或消除所述肿瘤或癌症,或者减缓所述肿瘤或癌症的生长和/或进展和/或转移。在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物诱导CAR T细胞分裂。在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物诱导CART细胞增殖。在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物预防CART细胞无应答。
在各个实施方案中,所述CAR T细胞疗法包含靶向诸多抗原(例如肿瘤抗原),诸如但不限于碳酸酐酶IX(CAIX)、5T4、CD19、CD20、CD22、CD30、CD33、CD38、CD47、CS1、CD138、Lewis-Y、L1-CAM、MUC16、ROR-1、IL13Rα2、gp100、前列腺干细胞抗原(PSCA)、前列腺特异性膜抗原(PSMA)、B细胞成熟抗原(BCMA)、第16型人乳头状瘤病毒E6(HPV-16 E6)、CD171、叶酸受体α(FR-α)、GD2、人表皮生长因子受体2(HER2)、间皮素、EGFRvIII、成纤维细胞激活蛋白(FAP)、癌胚抗原癌胚抗原(CEA)和血管内皮生长因子受体2(VEGF-R2)以及本领域中众所周知的其他肿瘤抗原的CAR T细胞。其他说明性肿瘤抗原包括但不限于MART-1/Melan-A、gp100、二肽基肽酶IV(DPPIV)、腺苷脱氨酶结合蛋白(ADAbp)、亲环蛋白b、结肠直肠相关抗原(CRC)-0017-1A/GA733、癌胚抗原(CEA)及其免疫原性表位CAP-1和CAP-2、etv6、aml1、前列腺特异性抗原(PSA)及其免疫原性表位PSA-1、PSA-2和PSA-3、T细胞受体/CD3-ζ链、MAGE家族肿瘤抗原(例如MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A5、MAGE-A6、MAGE-A7、MAGE-A8、MAGE-A9、MAGE-A10、MAGE-A11、MAGE-A12、MAGE-Xp2(MAGE-B2)、MAGE-Xp3(MAGE-B3)、MAGE-xp4(MAGE-B4)、MAGE-C1、MAGE-C2、MAGE-C3、MAGE-C4、MAGE-C5)、GAGE家族肿瘤抗原(例如GAGE-1、GAGE-2、GAGE-3、GAGE-4、GAGE-5、GAGE-6、GAGE-7、GAGE-8、GAGE-9)、BAGE、RAGE、LAGE-1、NAG、GnT-V、MUM-1、CDK4、酪氨酸酶、p53、MUC家族、HER2/neu、p21ras、RCAS1、α-胎儿球蛋白、E-钙粘蛋白、α-连锁蛋白、β-连锁蛋白和γ-连锁蛋白、p120ctn、gP100Pmel117、PRAME、NY-ESO-1、cdc27、腺瘤性结肠息肉病蛋白(APC)、胞衬蛋白、连接蛋白37、Ig独特型、p15、gp75、GM2和GD2神经节苷脂、病毒产物诸如人乳头状瘤病毒蛋白、Smad家族肿瘤抗原、1mp-1、NA、EBV编码的核抗原(EBNA)-1、脑糖原磷酸化酶、SSX-1、SSX-2(HOM-MEL-40)、SSX-1、SSX-4、SSX-5、SCP-1 CT-7、c-erbB-2、CD19、CD37、CD56、CD70、CD74、CD138、AGS16、MUC1、GPNMB、Ep-CAM、PD-L1和PD-L2。
说明性CAR T细胞疗法包括但不限于JCAR014(Juno Therapeutics)、JCAR015(Juno Therapeutics)、JCAR017(Juno Therapeutics)、JCAR018(Juno Therapeutics)、JCAR020(Juno Therapeutics)、JCAR023(Juno Therapeutics)、JCAR024(JunoTherapeutics)、CTL019(Novartis)、KTE-C19(Kite Pharma)、BPX-401(BellicumPharmaceuticals)、BPX-501(Bellicum Pharmaceuticals)、BPX-601(BellicumPharmaceuticals)、bb2121(Bluebird Bio)、CD-19睡美人细胞(Ziopharm Oncology)、UCART19(Cellectis)、UCART123(Cellectis)、UCART38(Cellectis)、UCARTCS1(Cellectis)、OXB-302(Oxford BioMedica、MB-101(Mustang Bio)和由InnovativeCellular Therapeutics开发的CAR T细胞。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与一种或多种多发性硬化(MS)治疗剂组合用于治疗MS的方法中,所述MS治疗剂包括但不限于3-干扰素、醋酸格拉替雷、T-干扰素、IFN-β-2(美国专利公布号2002/0025304)、螺旋锗(例如N-(3-二甲基氨基丙基)-2-氮杂-8,8-二甲基-8-锗螺[4:5]癸烷、N-(3-二甲基氨基丙基)-2-氮杂-8,8-二乙基-8-锗螺[4:5]癸烷、N-(3-二甲基氨基丙基)-2-氮杂-8,8-二丙基-8-锗螺[4:5]癸烷和N-(3-二甲基氨基丙基)-2-氮杂-8,8-二丁基-8-锗螺[4:5]癸烷)、维生素D类似物(例如1,25(OH)2D3(参见例如美国专利号5,716,946))、前列腺素(例如拉坦前列素(latanoprost)、溴莫尼定(brimonidine)、PGE1、PGE2和PGE3,参见例如美国专利公布号2002/0004525)、四环素和衍生物(例如米诺环素(minocycline)和多西环素(doxycycline),参见例如美国专利公布号20020022608)、VLA-4结合抗体(参见例如美国专利公布号2009/0202527)、促肾上腺皮质激素、皮质类固醇、强的松(prednisone)、甲基强的松(methylprednisone)、2-氯脱氧腺苷、米托蒽醌、柳氮磺胺吡啶(sulphasalazine)、氨甲蝶呤、硫唑嘌呤、环磷酰胺、环孢菌素、富马酸盐、抗CD20抗体(例如利妥昔单抗(rituximab))和盐酸泰札尼啶(tizanidine hydrochloride)。
在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与治疗MS的一种或多种症状或副作用的一种或多种治疗剂组合使用。此类剂包括但不限于金刚胺、巴氯芬(baclofen)、罂粟碱(papaverine)、美克洛嗪(meclizine)、羟嗪、磺胺甲恶唑(sulfamethoxazole)、环丙沙星(ciprofloxacin)、多库酯(docusate)、匹莫林(pemoline)、丹曲林(dantrolene)、去氨加压素(desmopressin)、地塞米松(dexamethasone)、托特罗定(tolterodine)、苯妥英(phenyloin)、奥昔布宁(oxybutynin)、比沙可啶(bisacodyl)、文拉法辛(venlafaxine)、阿米替林(amitriptyline)、六亚甲基四胺(methenamine)、氯硝西泮(clonazepam)、异烟肼(isoniazid)、伐地那非(vardenafil)、呋喃妥英(nitrofurantoin)、车前子亲水胶浆(psyllium hydrophilic mucilloid)、前列地尔(alprostadil)、加巴喷丁(gabapentin)、去甲替林(nortriptyline)、帕罗西汀(paroxetine)、溴丙胺太林(propantheline bromide)、莫达非尼(modafinil)、氟西汀(fluoxetine)、非那吡啶(phenazopyridine)、甲基强的松龙(methylprednisolone)、卡马西平(carbamazepine)、丙咪嗪(imipramine)、地西泮(diazepam)、西地那非(sildenafil)、安非他酮(bupropion)和舍曲林(sertraline)。
在一些实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与本文所描述的一种或多种疾病修饰疗法(DMT)(例如,表6的剂)组合用于治疗多发性硬化的方法中。在一些实施方案中,本发明提供了与使用本文所描述的一种或多种DMT(例如,下表6中列出的剂)而不使用一种或多种所公开的结合剂相比有所改善的治疗效果。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与所述一种或多种DMT的组合产生了协同治疗效果。
说明性疾病修饰疗法包括但不限于:
/>
/>
/>
/>
在一些实施方案中,本发明涉及利用输血的组合疗法。举例来说,本发明的组合物可以作为输血的补充。在一些实施方案中,本发明涉及利用铁补充剂的组合疗法。
在一些实施方案中,本发明涉及利用一种或多种基于EPO的剂的组合疗法。举例来说,本发明的组合物可以用作其他基于EPO的剂的佐剂。在一些实施方案中,本发明的组合物用作其他基于EPO的剂的维持疗法。其他基于EPO的剂包括以下:依泊汀α,包括但不限于DARBEPOETIN(ARANESP)、EPOCEPT(LUPIN PHARMA)、NANOKINE(NANOGEN PHARMACEUTICAL)、EPOFIT(INTASPHARMA)、EPOGEN(AMGEN)、EPOGIN、EPREX(JANSSEN-CILAG)、BINOCRIT7(SANDOZ)、PROCRIT;依泊汀β,包括但不限于NEORECORMON(HOFFMANN-LA ROCHE)、RECORMON、单甲氧基聚乙二醇-依泊汀β(MIRCERA,ROCHE);依泊汀δ,包括但不限于DYNEPO(红细胞生成刺激蛋白,SHIRE PLC);依泊汀ω,包括但不限于EPOMAX;依泊汀ζ,包括但不限于SILAPO(STADA)和RETACRIT(HOSPIRA);以及其他EPO,包括但不限于EPOCEPT(LUPINPHARMACEUTICALS)、EPOTRUST(PANACEA BIOTEC LTD)、ERYPRO SAFE(BIOCON LTD.)、REPOITIN(SERUM INSTITUTE OF INDIA LIMITED)、VINTOR(EMCURE PHARMAC EUTICALS)、EPOFIT(INTAS PHARMA)、ERYKINE(INTAS BIO PHARMACEUTICA)、WEPOX(WOCKHARDTBIOTECH)、ESPO GEN(LG LIFE SCIENCES)、RELIPOIETIN(RELIANCE LIFE SCI ENCES)、SHANPOIETIN(SHANTHA BIOTECHNICSLTD)、ZYR OP(CADILA HEALTHCARE LTD.)、EPIAO(RHUEPO)(SHENYA NG SUNSHINE PHARMACEUTICAL CO.LTD)、CINNAPOIETIN (CINNAGEN)。
在一些实施方案中,本发明涉及利用一种或多种免疫调节剂,例如但不限于调节免疫检查点的剂的组合疗法。在各个实施方案中,所述免疫调节剂靶向PD-1、PD-L1和PD-L2中的一者或多者。在各个实施方案中,所述免疫调节剂是PD-1抑制剂。在各个实施方案中,所述免疫调节剂是对PD-1、PD-Ll和PD-L2中的一者或多者具有特异性的抗体。举例来说,在一些实施方案中,所述免疫调节剂是抗体,诸如但不限于,纳武单抗(ONO-4538/BMS-936558,MDX1106,OPDIVO,BRISTOL MYERS SQUIBB)、派姆单抗(KEYTRUDA,MERCK)、皮地利珠单抗(CT-011,CURE TECH)、MK--3475(MERCK)、BMS 936559(BRISTOL MYERS SQUIBB)、MPDL328OA(ROCHE)。在一些实施方案中,所述免疫调节剂靶向CD137或CD137L中的一者或多者。在各个实施方案中,所述免疫调节剂是对CD137或CD137L中的一者或多者具有特异性的抗体。举例来说,在一些实施方案中,所述免疫调节剂是抗体,诸如但不限于乌瑞鲁单抗(urelumab)(又称为BMS-663513和抗4-1BB抗体)。在一些实施方案中,将本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与乌瑞鲁单抗(任选地与纳武单抗、利丽单抗(lirilumab)和乌瑞鲁单抗中的一者或多者)组合以治疗实体肿瘤和/或B细胞非霍奇金氏淋巴瘤和/或头颈癌和/或多发性骨髓瘤。在一些实施方案中,所述免疫调节剂是靶向以下一者或多者的剂:CTLA-4、AP2M1、CD80、CD86、SHP-2和PPP2R5A。在各个实施方案中,所述免疫调节剂是对以下一者或多者具有特异性的抗体:CTLA-4、AP2M1、CD80、CD86、SHP-2和PPP2R5A。举例来说,在一些实施方案中,所述免疫调节剂是抗体,诸如但不限于伊匹单抗(ipilimumab)(MDX-010、MDx-101,Yervoy,BMS)和/或曲美目单抗(tremelimumab)(Pfizer)。在一些实施方案中,将本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与伊匹单抗(任选地与巴维昔单抗(bavituximab))组合以治疗黑素瘤、前列腺癌和肺癌中的一者或多者。在各个实施方案中,所述免疫调节剂靶向CD20。在各个实施方案中,所述免疫调节剂是对CD20具有特异性的抗体。举例来说,在一些实施方案中,所述免疫调节剂是抗体,诸如但不限于,奥法木单抗(GENMAB)、奥滨尤妥珠单抗(obinutuzumab)(GAZYVA)、AME-133v(APPLIEDMOLECULAR EVOLUTION)、奥瑞珠单抗(GENENTECH)、TRU-015(TRUBION/EMERGENT)、维妥珠单抗(veltuzumab)(IMMU-106)。
在一些实施方案中,本发明涉及利用WO 2013/10779、WO 2015/007536、WO 2015/007520、WO 2015/007542和WO 2015/007903中所描述的一种或多种嵌合剂的组合疗法,所述文献的全部内容特此以引用方式整体并入。
在一些实施方案中,本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物包括经过修饰的衍生物,即通过将任何类型的分子共价连接至该组合物以使得共价连接不会妨碍该组合物的活性。举例来说但不限于,衍生物包括通过特别是糖基化、脂化、乙酰化、聚乙二醇化、磷酸化、酰胺化、利用已知的保护基团/阻断基团衍生化、蛋白水解裂解、连接至细胞配体或其他蛋白质等进行修饰的组合物。可以利用已知技术,包括但不限于特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等进行多种化学修饰中的任一种。
在其他实施方案中,本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物还包含细胞毒性剂,在说明性实施方案中,所述细胞毒性剂包含毒素、化疗剂、放射性同位素以及引起细胞凋亡或细胞死亡的剂。此类剂可以与本文所描述的组合物缀合。
因此,本文所描述的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以经历翻译后修饰以添加效应子部分,诸如化学接头;可检测部分,诸如荧光染料、酶、底物、生物发光材料、放射性材料和化学发光部分;或功能性部分,诸如链霉亲合素、抗生物素蛋白、生物素、细胞毒素、细胞毒性剂和放射性材料。
说明性细胞毒性剂包括但不限于甲氨蝶呤、氨基蝶呤、6-巯基喋呤、6-硫鸟喋呤、阿糖胞苷、5-氟尿嘧啶、达卡巴嗪;烷化剂,诸如氮芥、噻替派、苯丁酸氮芥、美法仑、卡莫司汀(BSNU)、丝裂霉素C、洛莫司汀(CCNU)、1-甲基亚硝基脲、环磷酰胺、氮芥、白消安、二溴甘露醇、链佐星、丝裂霉素C、顺-二氯二胺铂(II)(DDP)、顺铂和卡铂(伯尔定);蒽环霉素,包括柔红霉素(先前的道诺霉素)、多柔比星(阿霉素)、地托比星、卡米诺霉素、伊达比星、表柔比星、米托蒽醌和比生群;抗生素,包括放线菌素D(dactinomycin/actinomycin D)、博来霉素、刺孢霉素、光辉霉素和安曲霉素(AMC);以及抗有丝分裂剂,诸如长春生物碱类(vincaalkaloid)、长春新碱(vincristine)和长春花碱(vinblastine)。其他细胞毒性剂包括太平洋紫杉醇(紫杉醇)、蓖麻毒素、假单胞菌外毒素、吉西他滨、细胞松弛素B、短杆菌肽D、溴乙锭、依米丁(emetine)、依托泊苷、替尼泊苷、秋水仙素、二羟基蒽二酮、1-脱氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素、丙卡巴肼、羟基脲、天冬酰胺酶、皮质类固醇、米托坦(O,P′-(DDD))、干扰素,以及这些细胞毒性剂的混合物。
其他细胞毒性剂包括但不限于化疗剂,诸如卡铂、顺铂、太平洋紫杉醇、吉西他滨、刺孢霉素、多柔比星、5-氟尿嘧啶、丝裂霉素C、放线菌素D、环磷酰胺、长春新碱、博来霉素、VEGF拮抗剂、EGFR拮抗剂、铂、紫杉醇、伊立替康、5-氟尿嘧啶、吉西他滨、亚叶酸、类固醇、环磷酰胺、美法仑、长春生物碱类(例如长春碱、长春新碱、长春地辛和长春瑞滨)、莫司汀类、酪氨酸激酶抑制剂、放射疗法、性激素拮抗剂、选择性雄激素受体调节剂、选择性雌激素受体调节剂、PDGF拮抗剂、TNF拮抗剂、IL-1拮抗剂、白介素(例如IL-12或IL-2)、IL-12R拮抗剂、毒素缀合的单克隆抗体、肿瘤抗原特异性单克隆抗体、爱必妥(Erbitux)、阿瓦斯丁(Avastin)、帕妥珠单抗(Pertuzumab)、抗CD20抗体、美罗华(Rituxan)、奥瑞珠单抗、奥法木单抗、DXL625、
其他细胞毒性剂包括如Goldenberg在美国专利号6,653,104中所描述的细胞毒性核糖核酸酶。本发明的实施方案还涉及放射免疫缀合物,其中在使用或不使用复合物形成剂的情况下,发射α或β粒子的放射性核种稳定偶合至嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物。此类放射性核素包括β-发射体,诸如磷-32、钪-47、铜-67、镓-67、钇-88、钇-90、碘-125、碘-131、钐-153、镥-177、铼-186或铼-188;以及α发射体,诸如砹-211、铅-212、铋-212、铋-213或锕-225。
说明性可检测部分还包括但不限于辣根过氧化物酶、乙酰胆碱酯酶、碱性磷酸酶、β-半乳糖苷酶和荧光素酶。其他说明性荧光材料包括但不限于罗丹明、荧光素、异硫氰酸荧光素、伞形酮、二氯三嗪基胺、藻红蛋白和丹磺酰氯。其他说明性化学发光部分包括但不限于鲁米诺。其他说明性生物发光材料包括但不限于荧光素和水母发光蛋白。其他说明性放射性材料包括但不限于碘-125、碳-14、硫-35、氚和磷-32。
治疗方法
本文所描述的方法和组合物可应用于治疗各种疾病和病症,包括但不限于癌症、感染、免疫病症、贫血、自身免疫性疾病、心血管疾病、创伤愈合、局部缺血相关疾病、神经退行性疾病、代谢性疾病和许多其他疾病和病症。
另外,任何本发明的剂都可以用于治疗各种疾病和病症,或制造用于治疗各种疾病和病症的药物,所述疾病和病症包括但不限于癌症、感染、免疫病症、炎症性疾病或疾患,以及自身免疫性疾病。
在一些实施方案中,本发明涉及对以下一种或多种疾病或患有以下一种或多种疾病的患者的治疗:慢性肉芽肿病、骨硬化病、特发性肺纤维化、弗里德希共济失调(Friedreich’s ataxia)、特应性皮炎、恰加斯病(Chagas disease)、癌症、心力衰竭、自身免疫性疾病、镰状细胞病、地中海贫血、失血、输血反应、糖尿病、维生素B12缺乏症、胶原血管病、舒瓦克曼综合征(Shwachman syndrome)、血小板减少性紫癜、乳糜泻、内分泌缺乏状态诸如甲状腺功能减退或爱迪生氏病(Addison′s disease)、自身免疫性疾病如克罗恩氏病(Crohn′s Disease)、系统性红斑狼疮、类风湿性关节炎或青少年类风湿性关节炎、溃疡性结肠炎免疫病症诸如嗜酸性筋膜炎、低免疫球蛋白血症或胸腺瘤/胸腺癌、移植物抗宿主病、白血病前期、非血液综合征(例如唐氏综合征(Down′s)、杜波维茨综合征(Dubowwitz)、塞克尔综合征(Seckel))、费尔蒂综合征(Felty syndrome)、溶血性尿毒综合征、骨髓增生异常综合征、夜间阵发性血红蛋白尿症、骨髓纤维瘤、全血细胞减少症、纯红细胞再生障碍、舍亨二氏紫癜(Schoenlein-Henoch purpura)、疟疾、蛋白质饥饿、月经过多、系统性硬化、肝硬化、代谢减退状态和充血性心力衰竭。
在一些实施方案中,本发明涉及一种用于治疗癌症的方法,所述方法包括i)向有需要的患者施用有效量的嵌合蛋白、嵌合蛋白复合物和/或基于Fc的嵌合蛋白复合物;ii)向有需要的患者施用有效量的编码嵌合蛋白、嵌合蛋白复合物和/或基于Fc的嵌合蛋白复合物的重组核酸;或iii)向有需要的患者施用有效量的包含编码嵌合蛋白、嵌合蛋白复合物和/或基于Fc的嵌合蛋白复合物的重组核酸的宿主细胞。
在一些实施方案中,本发明涉及对以下一种或多种疾病或患有以下一种或多种疾病的患者的治疗:慢性肉芽肿病、骨硬化病、特发性肺纤维化、弗里德希共济失调、特应性皮炎、恰加斯病、分枝杆菌感染、癌症、硬皮病、肝炎、丙型肝炎、败血性休克和类风湿性关节炎。
在一些实施方案中,本发明涉及治疗癌症或患有癌症的患者。如本文所使用,癌症是指可能干扰身体器官和系统的正常功能的任何不受控制的细胞生长,并且包括原发性和转移性肿瘤两种。原发性肿瘤或癌症从其原始位置迁移并且种在重要器官可以通过受影响器官的功能减退而最终导致受试者死亡。转移是由于癌细胞从原发性肿瘤播散至身体其他部分而在远离原发性肿瘤位置出现的一个癌细胞或一组癌细胞。转移最终可能导致受试者死亡。举例来说,癌症可以包括良性和恶性癌症、息肉、增生以及休眠肿瘤或微转移。
可治疗的说明性癌症包括但不限于癌瘤,例如各种亚型,包括例如腺癌、基底细胞癌、鳞状细胞癌和移行细胞癌)、肉瘤(包括例如骨和软组织)、白血病(包括例如急性骨髓性、急性成淋巴细胞性、慢性骨髓性、慢性淋巴细胞性和毛细胞)、淋巴瘤和骨髓瘤(包括例如霍奇金氏和非霍奇金氏淋巴瘤、轻链、非分泌性、MGUS和浆细胞瘤)和中枢神经系统癌症(包括例如脑(例如神经胶质瘤(例如星形细胞瘤、寡枝神经胶质瘤和室管膜瘤)、脑膜瘤、垂体腺瘤和神经瘤和脊髓肿瘤(例如脑膜瘤和纤维神经瘤)。
可以治疗的说明性癌症包括但不限于:基底细胞癌;胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结肠和直肠癌;结缔组织癌;消化系统癌症;子宫内膜癌;食道癌;眼癌;头颈癌;胃癌(包括胃肠癌);成胶质细胞瘤;肝癌;肝细胞瘤;上皮内赘瘤;肾脏癌或肾癌;喉癌;白血病;肝癌;肺癌(例如,小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状细胞癌);黑素瘤;骨髓瘤;成神经细胞瘤;口腔癌(唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤(例如卡波西肉瘤);皮肤癌;鳞状细胞癌;胃癌;睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤,包括霍奇金氏淋巴瘤和非霍奇金氏淋巴瘤,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金氏淋巴瘤(NHL);小淋巴细胞性(SL)NHL;中级/滤泡性NHL;中级弥漫性NHL;高级成免疫细胞性NHL;高级成淋巴细胞性NHL;高级小非核裂细胞NHL;巨大肿块性NHL;套细胞淋巴瘤;AIDS相关淋巴瘤;和瓦尔登斯特伦巨球蛋白血症;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞性白血病;慢性成髓细胞性白血病;以及其他癌瘤和肉瘤;和移植后淋巴组织增生性病症(PTLD),以及与斑痣性错构瘤相关的异常血管增生;水肿(例如与脑肿瘤相关的水肿);和梅格斯氏综合征。在一个实施方案中,本发明涉及治疗白血病包括毛细胞白血病。在另一个实施方案中,本发明涉及治疗黑素瘤包括恶性黑素瘤。在另一个实施方案中,本发明涉及治疗卡波西肉瘤包括AIDS相关性卡波西肉瘤。
在一些实施方案中,本发明涉及对微生物感染和/或慢性感染或患有微生物感染和/或慢性感染的患者的治疗。说明性感染包括但不限于恰加斯病、HIV/AIDS、结核病、骨髓炎、乙型肝炎、丙型肝炎、爱波斯坦-巴尔病毒(Epstein-Barr virus)或细小病毒、T细胞白血病病毒、细菌过度生长综合征、真菌或寄生虫感染。
在一些实施方案中,本发明涉及治疗肝炎。可以治疗的说明性性肝炎包括但不限于甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、自身免疫性肝炎、酒精性肝炎、急性肝炎和慢性肝炎。
在说明性实施方案中,本发明涉及治疗慢性丙型肝炎。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗感染任一种丙型肝炎基因型的患者,所述基因型包括基因型1(例如1a、1b)、基因型2(例如2a、2b、2c和2d)、基因型3(例如3a、3b、3c、3d、3e和3f)、基因型4(例如4a、4b、4c、4d、4e、4f、4g、4h、4i和4j)、基因型5a和基因型6a。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗对标准护理抗病毒疗法反应不佳或无反应的患者或者另外难以用标准护理丙型肝炎疗法治疗的患者。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗对使用或不使用利巴韦林的IL-2疗法表现出低应答或无应答的患者。在一个实施方案中,所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗对聚乙二醇化干扰素和利巴韦林的组合疗法反应缓慢或无反应的患者。在一个实施方案中,本发明涉及对感染丙型肝炎基因型1或任何其他基因型但对先前IL-2疗法无反应的患者的治疗。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗具有高基线病毒载量(例如,大于800,000IU/mL)的患者。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗患有严重肝损伤的患者,包括那些患有晚期肝纤维化和/或肝硬化的患者。
在一些实施方案中,本发明涉及治疗未接受过抗病毒疗法的患者。在其他实施方案中,本发明涉及治疗对先前抗病毒疗法无反应的患者。在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗复发患者。
在一些实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可有效治疗包括白人、非裔美国人、西班牙裔和亚洲人在内的所有种族的肝炎感染。在一个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物在治疗对伴有或不伴有利巴韦林的IL-2疗法反应不佳的非裔美国人时可能特别有效。
在各个实施方案中,本发明的靶向性嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与例如非靶向性IFNα1或未经修饰的野生型IL-2或经修饰的IL-2相比提供提高的安全性。在说明性实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物的施用与最小副作用相关,所述副作用诸如有与使用非靶向性IL-2或未经修饰的野生型IL-2或经修饰的IL-2相关的那些副作用(例如流感样症状、肌痛、白细胞减少、血小板减少、中性粒细胞减少、抑郁和体重减轻)。
在一些实施方案中,本发明的靶向性嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与例如非靶向性IL-2或未经修饰的野生型IL-2或经修饰的IL-2相比显示出提高的治疗活性。在一些实施方案中,本发明的靶向性嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物与例如非靶向性IL-2或未经修饰的野生型IL-2或经修饰的IL-2相比显示出改善的药物动力学特征(例如更长的血清半衰期和稳定性)。
不希望受理论束缚,据信由于此类有利的安全性和药代动力学和治疗特征,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于以高剂量和/或长时间治疗患者。举例来说,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可以高剂量用于针对慢性丙型肝炎感染的初始诱导疗法。在另一个实例中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于长期维持疗法以防止疾病复发。
在各个实施方案中,使用本发明的组合物来治疗或预防一种或多种炎症性疾病或疾患,诸如炎症、急性炎症、慢性炎症、呼吸道疾病、动脉粥样硬化、再狭窄、哮喘、过敏性鼻炎、特异性皮炎、脓毒性休克、类风湿性关节炎、炎症性肠病、炎症性盆腔病、疼痛、眼部炎症性疾病、乳糜泻、莱氏综合征(Leigh Syndrome)、甘油激酶缺乏症、家族性嗜酸性粒细胞增多症(FE)、常染色体隐性痉挛性共济失调、喉部炎症性疾病;结核病、慢性胆囊炎、支气管扩张、硅肺病和其他尘肺病。
在各个实施方案中,使用本发明的组合物来治疗或预防一种或多种自身免疫性疾病或疾患,诸如多发性硬化、糖尿病、狼疮、乳糜泻、克罗恩氏病、溃疡性结肠炎、格林-巴利综合征(Guillain-Barre syndrome)、硬皮病、古德帕斯彻氏综合征(Goodpasture′ssyndrome)、韦格纳氏肉芽肿病(Wegener′s granulomatosis)、自身免疫性癫痫、拉斯马森氏脑炎(Rasmussen′s encephalitis)、原发性胆汁性硬化、硬化性胆管炎、自身免疫性肝炎、艾迪森氏病(Addison′s disease)、桥本氏甲状腺炎(Hashimoto′s thyroiditis)、纤维肌痛症、美尼尔氏综合征(Menier′s syndrome);移植排斥(例如,预防同种异体移植排斥)、恶性贫血、类风湿性关节炎、全身性红斑狼疮、皮肌炎、修格连氏综合征(Sjogren′ssyndrome)、红斑狼疮、多发性硬化、重症肌无力、瑞特氏综合征(Reiter′s syndrome)、格雷夫氏病(Grave′s disease)和其他自身免疫性疾病。
在各个实施方案中,使用本发明的组合物来治疗、控制或预防心血管疾病,诸如影响心脏和血管的疾病或疾患,包括但不限于冠心病(CHD)、脑血管疾病(CVD)、主动脉瓣狭窄、周围性血管病、动脉粥样硬化、动脉硬化、心肌梗塞(心脏病发作)、脑血管疾病(中风)、短暂性脑缺血发作(TIA)、心绞痛(稳定的和不稳定的)、心房纤颤、心律不齐、血管疾病和/或充血性心力衰竭。
在各个实施方案中,使用本发明的组合物来治疗或预防一种或多种代谢相关病症。在各个实施方案中,本发明可用于治疗、控制或预防糖尿病,包括1型糖尿病和2型糖尿病以及与肥胖相关的糖尿病。本发明的组合物和方法可用于治疗或预防糖尿病相关病症,包括但不限于糖尿病性肾病、高血糖症、糖耐量受损、胰岛素抗性、肥胖、脂质异常、血脂异常、高脂血症、高甘油三酯血症、高胆固醇血症、低HDL水平、高LDL水平、动脉粥样硬化及其后遗症、血管再狭窄、肠易激综合征、炎症性肠病(包括克罗恩氏病和溃疡性结肠炎)、其他炎症性疾患、胰脏炎、腹部肥胖、神经退化性疾病、视网膜病、赘生性疾患、脂肪细胞肿瘤、脂肪细胞癌(诸如脂肪肉瘤)、前列腺癌和其它癌症(包括胃癌、乳腺癌、膀胱癌和结肠癌)、血管生成、阿尔茨海默氏病、牛皮癣、高血压、代谢综合征(例如,人存在以下病症中的三种或更多种:腹部肥胖、高甘油三酯血症、低HDL胆固醇、高血压和高空腹血浆葡萄糖)、卵巢雄激素过多症(多囊卵巢综合征)和胰岛素抗性是一个组成部分的其他病症,诸如睡眠呼吸暂停。本发明的组合物和方法可用于治疗、控制或预防肥胖(包括遗传性或环境性)和肥胖相关的病症。本文的肥胖相关病症与肥胖相关、由肥胖引起或者是肥胖的结果。肥胖相关病症的实例包括肥胖、糖尿病、过量进食、暴饮暴食和贪食症、高血压、血浆胰岛素浓度升高和胰岛素抗性、血脂异常、高脂血症、子宫内膜癌、乳腺癌、前列腺癌、肾癌和结肠癌、骨关节炎、阻塞性睡眠呼吸暂停、胆结石、心脏病、心律异常和心律不齐、心肌梗塞、充血性心力衰竭、冠心病、猝死、中风、多囊卵巢病、颅咽管瘤、普拉德-威利综合征(Prader-WilliSyndrome)、弗勒利希氏综合征(Frohlich′s syndrome)、GH缺乏型受试者、正常变异性身材矮小、特纳氏综合征(Turner′s syndrome)和表现出代谢活性降低或静息时能量消耗量(占总不含脂肪物质的百分比)降低的其他病理学疾患,例如患有急性成淋巴细胞性白血病的儿童。肥胖相关病症的其他实例有代谢综合征、胰岛素抗性综合征、生殖激素异常、性功能障碍和生殖功能障碍(诸如生育能力受损、不育症、男性性腺功能减退和女性多毛症)、与母体肥胖相关的胎儿缺陷、胃肠动力障碍(诸如肥胖相关的胃食管回流)、呼吸障碍诸如肥胖性肺换气不足综合征(匹克威克综合征(Pickwickian syndrome))、呼吸急促、心血管病症、炎症(诸如全身性血管炎症)、动脉硬化、高胆固醇血症、下背部疼痛、胆囊疾病、高尿酸血症、痛风和肾癌,以及麻木风险增高。本发明的组合物和方法还可用于治疗阿尔茨海默氏病。
在各个实施方案中,使用本发明的组合物来治疗或预防一种或多种呼吸道疾病,诸如特发性肺纤维化(IPF)、哮喘、慢性阻塞性肺病(COPD)、支气管扩张、过敏性鼻炎、窦炎、肺血管收缩、炎症、过敏、呼吸受阻、呼吸窘迫综合征、囊性纤维化、肺高压、肺血管收缩、肺气肿、汉坦病毒肺综合征(Hantavirus pulmonary syndrome,HPS)、吕弗勒氏综合征(Loeffler′s syndrome)、古德帕斯彻氏综合征(Goodpasture′s syndrome)、胸膜炎、肺炎、肺水肿、肺纤维化、肉样瘤病、与呼吸道合胞病毒感染相关的并发症和其他呼吸道疾病。
在一些实施方案中,本发明用于治疗或预防一种或多种神经退行性疾病。说明性神经变性疾病包括但不限于弗里德希共济失调、多发性硬化(包括但不限于良性多发性硬化;复发-缓解型多发性硬化(RRMS);继发性进行性多发性硬化(SPMS);进行性复发性多发性硬化症(PRMS);和原发性进行性多发性硬化(PPMS))、阿尔茨海默氏病(包括但不限于早期发作阿尔茨海默氏病、晚期发作阿尔茨海默氏病和家族性阿尔茨海默氏病(FAD)、帕金森氏病和帕金森症(包括但不限于特发性帕金森氏病、血管帕金森症、药物诱发的帕金森症、路易体痴呆、遗传性帕金森氏病、青少年帕金森氏病)、亨延顿氏病、肌萎缩性侧素硬化(ALS,包括但不限于偶发性ALS、家族性ALS、西太平洋ALS、青少年ALS、西拉玛雅病(Hiramaya Disease))。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗创伤,例如非愈合性创伤、溃疡、灼伤或冻伤、慢性或急性创伤、开放性或闭合性创伤、内伤或外伤(说明性外伤是穿透性和非穿透性创伤)。
在各个实施方案中,本发明的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物可用于治疗局部缺血,作为非限制性实例,与急性冠状动脉综合征相关的局部缺血、急性肺损伤(ALI)、急性心肌梗塞(AMI)、急性呼吸窘迫综合征(ARDS)、动脉阻塞性疾病、动脉硬化、关节软骨缺陷、无菌性全身性炎症、动脉粥样硬化性心血管疾病、自身免疫性疾病、骨折、骨折、脑水肿、脑灌注不足、伯格氏病(Buerger′s disease)、灼伤、癌症、心血管疾病、软骨损伤、脑梗塞、脑缺血、脑中风、脑血管疾病、化学疗法诱导的神经病、慢性感染、慢性肠系膜缺血、跛行、充血性心力衰竭、结缔组织损伤、挫伤、冠状动脉病(CAD)、严重型肢体缺血(CLI)、克罗恩氏病、深静脉血栓形成、深部创伤、溃疡愈合延迟、创伤愈合延迟、糖尿病(I型和II型)、糖尿病性神经病变、糖尿病诱导的局部缺血、弥漫性血管内凝血(DIC)、栓塞性脑缺血、冻伤、移植物对抗宿主病、遗传性出血性毛细管扩张缺血性血管病、高氧性损伤、缺氧、炎症、炎症性肠病、炎症性疾病、肌腱损伤、间歇性跛行、肠缺血、局部缺血、缺血性脑病、缺血性心脏病、缺血性末梢血管病、胎盘缺血、缺血性肾病、缺血性血管病、缺血性再灌注损伤、撕裂伤、左主冠状动脉疾病、肢体缺血、下肢缺血、心肌梗塞、心肌缺血、器官缺血、骨关节炎、骨质疏松症、骨肉瘤、帕金森氏病、周围动脉病(PAD)、周围动脉病、周围缺血、周围神经病变、周围性血管病、癌前、肺水肿、肺栓塞、重塑障碍、肾缺血、视网膜缺血、视网膜病、败血症、皮肤溃疡、实体器官移植、脊髓损伤、中风、软骨下骨囊肿、血栓形成、血栓形成性脑缺血、组织缺血、短暂性缺血性发作(TIA)、外伤性脑损伤、溃疡性结肠炎、肾血管病、血管炎症性疾患、希佩尔-林道综合征(von Hippel-Lindausyndrome)或者组织或器官创伤。
在各个实施方案中,本发明涉及治疗一种或多种贫血,包括由慢性肾病(例如由透析)和/或抗癌剂(例如化学疗法和/或HIV治疗(例如齐多夫定(Zidovudine)(INN)或叠氮胸苷(AZT))、炎症性肠病(例如克罗恩氏病和溃疡性结肠炎)引起的贫血、与炎症性疾患(例如关节炎、狼疮、IBD)相关的贫血、与糖尿病、精神分裂症、脑型疟相关的贫血、再生障碍性贫血和由癌症治疗(例如化学疗法和/或放射)导致的脊髓发育不良和各种骨髓发育不良综合征病(例如镰状细胞性贫血、血红蛋白SC病、血红蛋白C病、α地中海贫血和β地中海贫血、早产后新生儿贫血和相应疾患)。
在一些实施方案中,本发明涉及治疗贫血或患有贫血的患者,贫血即红细胞中发现的红细胞数目和/或血红蛋白量低于正常值的疾患。在各个实施方案中,贫血可以是急性的或慢性的。举例来说,本发明的贫血包括但不限于缺铁性贫血、肾贫血、慢性疾病/炎症贫血、恶性贫血(诸如大红细胞性胃液缺乏性贫血、青少年恶性贫血和先天性恶性贫血)、癌症相关性贫血、抗癌相关性贫血(例如化学疗法相关性贫血、放射疗法相关性贫血)、单纯性红血球发育不良、伴随过量胚细胞的难治性贫血、再生障碍性贫血、X连锁铁粒幼细胞性贫血、溶血性贫血、镰状细胞性贫血、由ESA产生受损引起的贫血、脊髓发育不良综合征、低色性贫血、小红细胞性贫血、铁粒幼细胞性贫血、自身免疫性溶血性贫血、库利氏贫血(Cooley′sanemia)、地中海贫血、戴-布二氏贫血(Diamond Blackfan anemia)、范科尼氏贫血(Fanconi′s anemia)和药物诱导的免疫性溶血性贫血。贫血可以导致严重的症状,包括缺氧、慢性疲劳、注意力不集中、皮肤苍白、低血压、眩晕和心力衰竭。
在一些实施方案中,本发明涉及治疗由慢性肾衰竭引起的贫血。在一些实施方案中,本发明涉及治疗由使用一种或多种肾替代疗法,包括透析、血液透析、腹膜透析、血液过滤、血液透析过滤和肾移植引起的贫血。
在一些实施方案中,本发明涉及治疗没有进行透析的慢性肾病患者的贫血。举例来说,本发明涉及处在第1阶段CKD、或第2阶段CKD、或第3阶段CKD、或第4阶段CKD、或第5阶段CKD的患者。在一些实施方案中,本发明的患者是第4阶段CKD或第5阶段CKD。在一些实施方案中,本发明的患者已经进行了肾脏移植。在一些实施方案中,本发明涉及治疗患有急性肾损伤(AKI)的患者的贫血。
在一些实施方案中,贫血是由化学疗法诱导的。举例来说,化学疗法可以是任何骨髓抑制性化学疗法。在一些实施方案中,化学疗法是Revlimid、Thalomid、地塞米松、阿霉素(Adriamycin)和Doxil中的一种或多种。在一些实施方案中,化学疗法是一种或多种基于铂的药物,包括顺铂(例如PLATINOL)和卡铂(例如PARAPLATIN)。在一些实施方案中,化学疗法是本文所描述的化学治疗剂中的任一种。在一些实施方案中,化学疗法是Groopman等人JNatl Cancer Inst(1999)91(19):1616-1634中描述的任何剂,所述文献的内容以引用方式整体并入本文。在一些实施方案中,本发明的组合物和方法用于治疗晚期阶段癌症患者(例如第IV阶段或第III阶段或第II阶段癌症)的化学疗法相关性贫血。在一些实施方案中,本发明的组合物和方法用于治疗接受剂量密集性化学疗法或其他侵袭性化学疗法方案的癌症患者的化学疗法相关性贫血。
在一些实施方案中,本发明涉及治疗患有一种或多种基于血液的癌症,诸如白血病、淋巴瘤和多发性骨髓瘤的患者的贫血。此类癌症可以直接影响骨髓。此外,本发明涉及已经扩散至骨或骨髓的转移性癌症。在一些实施方案中,本发明涉及治疗进行放射疗法的患者的贫血。这种放射疗法可能损伤骨髓,从而降低其制造红细胞的能力。在其他实施方案中,本发明涉及治疗铁、维生素B12和叶酸中有一种或多种减少或缺乏的患者的贫血。在其他实施方案中,本发明涉及治疗失血过多(包括但不限于手术后或者由造成内部出血的肿瘤导致)的患者的贫血。在其他实施方案中,本发明涉及治疗慢性病贫血患者的贫血。
在一些实施方案中,本发明的方法和组合物刺激红细胞产生。在一些实施方案中,本发明的方法和组合物刺激骨髓中的定向红细胞祖细胞的分裂和分化。
本发明的某些实施方案尤其可用于治疗癌症患者的化学疗法诱导的贫血。在一些实施方案中,本发明的方法和组合物允许在癌症患者结束化学疗法后继续施用所述嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物。在一些实施方案中,本发明的方法和组合物允许以相对于非癌症患者没有减少的剂量治疗癌症患者。在一些实施方案中,本发明的方法和组合物允许治疗正在接受化学疗法并且被认为可治愈的癌症患者。在各个实施方案中,所述癌症患者存在血栓史、近期手术、长期卧床休养或活动受限和用化学治疗剂进行治疗中的一项或多项。
药盒
本发明还提供了用于施用本文所描述的任何剂(例如具有或没有各种其他治疗剂的嵌合蛋白或嵌合蛋白复合物诸如基于Fc的嵌合蛋白复合物)的药盒。所述药盒是包括至少一种本文所描述的本发明药物组合物在内的材料或组分的组合体。因此,在一些实施方案中,所述药盒含有至少一种本文所描述的药物组合物。
配置在药盒中的组分的确切特性取决于其预定目的。在一个实施方案中,所述药盒被配置用于治疗人受试者的目的。
在所述药盒中可以包括使用说明书。使用说明书典型地包括有形表示,其描述了使用所述药盒的组分实现所期望的结果,诸如治疗癌症时将要采用的技术。任选地,所述药盒还含有本领域技术人员容易了解的其他有用组分,诸如稀释剂、缓冲剂、药学上可接受的载体、注射器、导管、敷涂器、吸移工具或测量工具、包扎材料或其他有用的附件。
装配在药盒中的材料和组分可以提供给从业人员,以保持其可操作性和效用的任何便利且适合的方式储存。举例来说,这些组分可以在室温、冷藏温度或冷冻温度下提供。这些组分典型地包含在合适的包装材料中。在各个实施方案中,包装材料是由众所周知的方法构造,优选地以提供无菌、无污染的环境。包装材料可以具有指示所述药盒和/或其组分的内含物和/或目的的外部标签。
定义
在整个申请中,本发明的嵌合蛋白或蛋白复合物可由术语“AcTaleukin-2”和/或“ALN2”表示。
如本文所使用,“一个/一种(a/an)”或“所述(the)”可以意指一个或多于一个。
除非特别说明或从上下文显而易见,否则如本文所使用,术语“或”被理解为包含性的并且涵盖“或”与“和”两者。
此外,术语“约”当与引用的数值指示结合使用时意指所引用的数值指示加或减所述引用的数值指示的至多10%,例如在(加或减)所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%之内。举例来说,语言“约50”覆盖45至55的范围。
“有效量”当与医学用途结合使用时是有效提供目标疾病的发病率的可测量治疗、预防或降低的量。
如本文所使用,如果活性和/或效应的读出在剂或刺激物存在下相对于不存在此类调节降低了显著量,诸如降低了至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%或更多、多达并且包括至少约100%,那么某性质“降低”。如本领域普通技术人员所理解,在一些实施方案中,活性降低并且一些下游读出将降低但其他下游读出可以增加。
相反地,如果活性和/或效应的读出在剂或刺激物存在下相对于不存在此类剂或刺激物增加了显著量,例如增加了至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%或更多、多达并且包括至少约100%或更多、至少约2倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约50倍、至少约100倍,那么活性“增加”。
如本文所提及,除非另外规定,否则全部组成百分比都以总组合物的重量计。如本文所使用,词语“包括”及其变化形式旨在是非限制性的,使得在列表中对项目的列举不应排除也可以用于这项技术的组合物和方法中的其他类似项目。类似地,术语“可以(can/may)”及其变化形式旨在是非限制性的,使得一个实施方案可以包含某些要素或特征的列举不排除本发明技术的不含有那些要素或特征的其他实施方案。
尽管开放性的术语“包含”作为术语诸如包括、含有或具有的同义词在本文中用以描述和要求本发明,但本发明或其实施方案可以可选地使用替代性术语如“由……组成”或“基本上由……组成”加以描述。
如本文所使用,词语“优选的”和“优选地”是指所述技术的在某些情况下提供某些益处的实施方案。然而,其他实施方案在相同或其他情况下也可以是优选的。此外,列举一个或多个优选实施方案不意指其他实施方案是无用的,并且不打算将其他实施方案从所述技术的范围中排除。
用于实现治疗效果所需要的本文所描述的组合物的量可以出于特定目的根据常规程序凭经验确定。一般来说,对于出于治疗目的而施用治疗剂而言,治疗剂是以药理学有效剂量给予。“药理学有效量”、“药理学有效剂量”、“治疗有效量”或“有效量”是指足以产生所期望的生理效应的量或能够实现所期望的结果、特别是用于治疗病症或疾病的量。如本文所使用,有效量将包括足以例如延迟病症或疾病的症状的发展、改变病症或疾病的症状的过程(例如,减缓疾病的症状的进展)、减少或消除病症或疾病的一种或多种症状或表现形式,以及逆转病症或疾病的症状的量。治疗益处还包括中断或减缓潜在疾病或病症的进展,无关于是否实现了改善。
有效量、毒性和治疗功效可以通过标准药物程序在细胞培养物或实验动物中测定,例如测定LD50(约50%群体的致死剂量)和ED50(在约50%群体中具有治疗有效性的剂量)。剂量可以取决于所用剂型和所用施用途径而变化。毒性与治疗效果之间的剂量比率是治疗指数并且可以表示为LD50/ED50比。在一些实施方案中,展现较大治疗指数的组合物和方法是优选的。治疗有效剂量最初可以由体外测定(包括例如细胞培养物测定)加以估算。此外,剂量可以在动物模型中配制以实现包括如在细胞培养物中或在适当动物模型中测定的IC50的循环血浆浓度范围。所描述的组合物在血浆中的含量可以例如通过高效液相色谱法加以测量。任何特定剂量的效应都可以通过合适的生物测定来监测。剂量可以由医师确定并且根据需要调整以适应观察到的治疗效果。
在某些实施方案中,效应将引起至少约10%、至少约20%、至少约30%、至少约50%、至少约70%或至少约90%的可定量变化。在一些实施方案中,效应将引起约10%、约20%、约30%、约50%、约70%或甚至约90%或更大的可定量变化。治疗益处还包括中断或减缓潜在疾病或病症的进展,无关于是否实现了改善。
如本文所使用,“治疗方法”同样适用于组合物用于治疗本文所描述的疾病或病症的用途和/或组合物用于制造用以治疗本文所描述的疾病或病症的药物的一种和/或多种用途。通过以下非限制性实施例进一步说明本发明。
实施例
出于以下实施例的目的,在整个申请中,本发明的嵌合蛋白或蛋白复合物可由术语“AcTaleukin-2”和/或“ALN2”表示。
实施例1:IL-2和Fc-IL-2驱动外周血单核细胞(PBMC)中的STAT5磷酸化
该实施例描述了如何修饰白介素2(IL-2),使得仅激活靶细胞,而不再激活具有负面或不利影响的细胞。在该实施例中,表达CD8的T细胞(例如细胞毒性T细胞或CTL)的抗肿瘤活性得到增强,而调控T细胞(Treg)的免疫阻抑功能受到限制。这种细胞功能的解偶联可以部分地通过在这些细胞中使用IL-2受体(IL-2R)来实现:CTL中的信号传导是由中等亲和力IL-2R复合物(由IL-2Rβ(CD122)和γ共同(γc;CD132)链组成)介导的,而在Treg中,高亲和力IL-2R复合物还包含IL-2Rα(CD25)链。开发CTL特异性IL-2活性的策略包括:(i)CD8靶向,(ii)消除CD25结合,从而消除该受体参与信号传导,以及(iii)选择功能丧失型受体β和γ突变,这些突变可在(CD8)靶向后恢复。
首先,检查了Fc融合物对IL-2活性的影响。为此,将细胞因子通过柔性20*GGS接头克隆(在pcDNA3.4载体中)到异源二聚体的“旋钮入孔洞”人IgG1 Fc主链的C端。Fc序列含有L234A_L235A_K322Q效应突变和“孔洞”修饰Y349C_T366S_L368A_Y407V(在序列hFc3中)或“旋钮”突变S354C_T366W(在序列hFc4-hIL-2_C125A中)。出于稳定性和可制造性的原因,将IL-2中125位的游离半胱氨酸突变为丙氨酸(C125A)。
为了产生此“旋钮入孔洞”Fc-IL-2,根据制造商的说明,将“孔洞”和“旋钮”质粒的组合转染到ExpiCHO细胞(ThermoFisher)中。转染后七天,使用蛋白A旋转板(ThermoFisher)纯化重组蛋白,定量,并使用SDS-PAGE进行纯度测试。
测试所得AcTaleukin-2(ALN2)在以下细胞中的STAT5磷酸化:(i)CD8阳性T细胞(CD8+);(ii)CD25阴性常规T细胞(CD25-Tconv);(iii)CD25阳性常规T细胞(CD25+Tconv);或(iv)调控T细胞(Treg),定义为CD4+CD25+FoxP3+。简单来说,使用Lymphoprep(StemCelltechnologies)进行密度梯度离心,从健康供体的血沉棕黄层中分离出PBMC。使用连续稀释的野生型重组IL-2或Fc-IL-2将细胞在37℃下刺激30分钟。在离心后,将细胞重悬于溶解/固定缓冲液(BD Biosciences)中,并再在37℃下孵育10分钟。将细胞洗涤并与人FcR封闭试剂(Miltenyi Biotec)一起孵育,并在室温下用抗CD25和抗CD8染色30分钟。随后使用透化缓冲液III(BD Biosciences)将细胞在4℃下透化30分钟。最后将细胞用抗CD3、抗CD4、抗FoxP3和抗pSTAT5染色1小时。在MACSQuant X仪器(Miltenyi Biotec)上采集样品,并使用FloWLogic软件(Miltenyi Biotec)进行分析。
图20说明(i)与其他细胞类型相比,Treg细胞对IL-2更加敏感,并且(ii)Fc融合物影响所有测试群体中的信号传导。例如,Fc-IL-2对Treg的活性比IL-2低±20倍,而融合物对CD8阳性细胞几乎没有活性。
实施例2:CD25敲除减弱所有细胞类型中的Fc-IL-2信号传导
该实施例检验了被描述为减少CD25结合的五种突变组合对Fc-IL-2融合物行为的影响:(i)R38A_F42Y_Y45A_E62A;(ii)F42Y_Y45A_L72G;(iii)F42K;(iV)R38A_F42K;和(v)E61Q。
使hFc4-hIL-2_C125A构建体中的这些残基突变(所得序列参见下文)。将这些旋钮构建体与孔洞融合物hCD8 VHH-hFc3组合,其中hCD8 VHH 1CDA65序列通过20*GGS接头融合至具有孔洞突变的Fc(序列如下),这允许评估CD8靶向效率。如上文所描述将质粒组合转染到ExpiCHO中并进行纯化。测试所得蛋白质在不同淋巴细胞群体中的STAT5磷酸化(图21A-图21G)。数据表明,减少CD25相互作用(例如,通过R38A_F42K突变)影响所有亚群体中的信号传导,并且这种效应与CD25的存在无关(图21A-图21B)。这可能说明CD25突变不仅直接影响CD25结合,而且还具有一些构象效应。如果使用CD8 VHH将CD25敲除突变体靶向表达CD8的细胞,则这些细胞中的信号传导明显增加,而其他细胞类型中的信号传导大部分保持不变(图21C-图21G)。E61Q突变是一个例外(图21G),与其他四个变体相比,其减毒只是适度的。
在Octet RED96仪器(ForteBio)上使用生物层干涉法(BLI)也显示,CD25突变确实使与CD25的结合减少。简单来说,使用Pierce IP用抗体生物素化试剂盒对重组CD25(AcroBiosystems)进行生物素化,并将其加载到链霉亲和素传感器上。监测七种浓度的野生型IL-2、Fc-IL-2或Fc-ALN2与突变CD25结合位点(所有CD8靶向性)的缔合和解离,并用于计算缔合和解离常数,并由此计算亲和力(图22A-图22G)。与Fc的融合似乎不影响IL-2与CD25的结合,并且表明在实施例1中观察到的活性丧失是由于与IL-2Rβ和/或IL-2Rγc链的结合效率较低。另一方面,组合突变R38A_F42Y_Y45A_E62A;F42Y_Y45A_L72G;F42K;R38A_F42K完全消除可检测的CD25结合(即,无法测量特异性结合)。此外,这里突变E61Q的影响只是适度的,并且解释了前面描述的更有效的STAT5磷酸化。
总之,CD25敲除突变会减弱所有细胞类型中的IL-2信号传导(与CD25表达无关),而CD8靶向部分地恢复了表达CD8的细胞中的信号传导。然而,这种具有突变CD25结合位点的ALN2分子仍然在Treg细胞中清楚地传导信号,EC
实施例3:具有残余IL-2Rβ结合的残基的突变的经修饰IL-2的鉴定
先前的实验表明,CD25结合位点的突变会导致信号传导减弱,而CD8靶向至少部分地恢复了信号传导的这种损失。所得ALN2变体仍然能够在超敏感Treg细胞中诱导STAT5磷酸化。为了进一步减少后一种信号传导(从而减少ALN2活性的CD8选择性),检查了参与IL-2Rβ结合的残基的可恢复(靶向后)功能丧失型突变的选项。
在hFc4-hIL-2_C125A构建体中使候选残基D20和N88突变为任何其他氨基酸(不包括C和M)(序列参见下文)。将所得构建体与CD8-hFc3组合,用于在ExpiCHO中表达。使用蛋白A旋转板(ThermoFisher)从上清液中纯化重组蛋白,定量,并使用SDS-PAGE进行纯度测试。
如下测试所得ALN2变体在CD8
图23A-图23R(D20突变体的筛选)和图24A-图24R(N88突变体的筛选)表明,大多数突变对pSTAT5结果有巨大影响。(与野生型相比)保留大部分活性的变体是D20E、D20V、N88A、N88G(以及较小程度的D20S、D20T、N88D、N88Q、N88H和N88T),EC
然后,在CD8
实施例4:CD25敲除和β突变的组合
该实施例的目的是将CD25敲除突变(例如,R38A_F42K)与表现最佳的IL-2Rβ突变(例如,D20E、D20V、N88A和N88G)组合。如实施例1所描述将所得构建体(序列参见下文)与CD8 VHH-hFc3配偶体组合并测试在CD8
i.CD25敲除(例如,R38A_K42K)突变影响所有亚群体中的信号传导,与CD25表达无关(图26A和图26F)。
ii.IL-2Rβ突变(例如D20E、D20V、N88A、N88G)也影响所有亚群体中的信号传导。
iii.在CD8阳性细胞上,具有突变CD25或CD25和β位点组合突变的变体的EC
iv.尽管功效降低,但具有突变的CD25或IL-2Rβ结合位点的ALN2变体仍然在Treg细胞中清楚地传导信号(图26B、图26C、图26D、图26E和图26F)。
v.需要CD25和IL-2Rβ突变的组合来几乎完全消除超敏感Treg细胞中的信号传导(图26G-图26J)。
vi.CD25结合减少和选定的IL-2Rβ突变以及靶向CD8的这种组合,最终导致相比Treg对CD8
表7.参考图26A-图26J中描绘的组,CD25和IL-2Rβ突变的组合的EC
~:无法确定准确的EC
总之,与CD8+T细胞相比,Treg细胞对野生型IL-2的敏感性平均高100,000倍。CD8靶向、CD25结合敲除和选定的可恢复IL-2Rβ突变的组合导致ALN2分子具有偏好表达CD8的细胞的1,000倍的特异性,并且在1,000甚至10,000pM(相当于约0.1-1μg/ml)浓度下没有可检测的Treg活性。值得注意的是,仅具有IL-2Ra突变的IL-2分子在10,000pM下已表现出Treg的最大激活(图26A-图26J)。
实施例5:IL-2活性的CD25靶向
在自身免疫性疾病的情形下,认为可能期望特异性地激活(例如,通过IL-2)Treg细胞,同时保持其他(IL-2)应答细胞不受影响。该实施例探讨了用经修饰的IL-2分子激活Treg的可能性,这些分子靶向在这些细胞上高度表达的CD25受体。选择两种非中和性抗CD25抗体(MA251和7G7B6)的scFv变体作为靶向结构域。为此,将VH和VL序列通过3*GGGGS接头以两个取向(VH-VL和VL-VH)融合,并连接至具有效应突变和孔洞突变的hFc3序列(序列参见下文)。将所得构建体与表达hFc4的质粒组合(以产生无武装的旋钮入孔洞Fc构建体),用于在ExpiCHO细胞中制备。如上文所描述纯化所得蛋白质并最初测试(i)与表达CD25的细胞的结合,以及(ii)IL-2信号传导的中和。对于结合,将两种HEK源性细胞系HEK-Blue-IL-2(表达功能性IL-2R;InvivoGen)和HEK-Blue-IL-1(表达功能性IL-1R;InvivoGen)与连续稀释的MA251和7G7B6 scFv无武装蛋白在4℃下孵育2小时。在FACS中使用荧光标记的抗人Ab来测量结合。在MACSQuant X仪器(Miltenyi Biotec)上采集样品,并使用FloWLogic软件(Miltenyi Biotec)进行分析。图27A-图27B中的数据清楚地说明,CD25 scFv靶向性Fc融合物仅结合至表达CD25的HEK-Blue-IL-2细胞,而不结合至相关的HEK-Blue-IL-1细胞。
在HEK-Blue IL-2细胞中测量对IL-2信号传导的影响。在加入连续稀释的野生型IL-2之前,将细胞不与或与过量(10μg/ml)的无武装CD25 scFv Fc融合物一起预孵育(图28)。在刺激过夜后,使用Phospha-Light
然后,研究CD25靶向(此处使用7G7B6scFv_VH-VL靶向结构域)恢复CD25(此处为F38A_F42K)和IL2Rβ突变(此处为N88A和N88G)或它们的组合(R38A_F42K_N88A和R38A_F42K_N88G)的生物活性损失的能力。将具有这些突变的hFc4-hIL-2构建体与CD8 VHH-hFc3或hFc3构建体组合,用于在ExpiCHO细胞中的制备和纯化。如前文所描述比较所得ALN2变体在CD25
i.CD25靶向对野生型Fc-IL-2信号传导没有明显影响(图29B与图29C)
ii.CD25或IL2Rβ突变明显影响所有测试亚群体中的信号传导(图29C与图29F、图29H、图29J、图29L和图29N)。在浓度达100nM下组合的CD25和β突变(R38A_F42K_N88G)完全消除STAT5磷酸化(图29N)
iii.CD25靶向明显恢复表达CD25的细胞中CD25和IL2RβALN2变体的活性(图29E与图29F以及图29G与图29H)。这产生仅在CD25
iv.与野生型Fc-IL-2融合物相比,组合突变(R38A_F42K_N88A和R38A_F42K_N88G)仅部分恢复(图29B与图29K以及图29B与图29M)
总之,CD25靶向(如此处非中和性抗CD25抗体的scFv型式所示)允许特异性地恢复表达CD25的细胞与CD25阴性细胞中由CD25和/或β突变引起的功能丧失。
实施例6:IL-2模拟物(新白细胞素)及其突变体的靶向
基于IL-2的晶体结构,重新设计了一种缺乏CD25结合位点但仍能有效地通过IL-2Rβ和γc受体传导信号的IL-2/IL-15模拟物(参见Silva等人,“De novo design of potentand selective mimics of IL-2 and IL-15,”Nature,第565卷,第186-191页,2019)。这种101个氨基酸的IL-2_模拟物独立于IL-2Rα和IL-15Rα引发下游细胞信号传导(例如STAT5磷酸化),并且在黑素瘤和结肠癌小鼠模型中具有优于IL-2的治疗活性。
在该实施例中,此IL-2_模拟物序列通过柔性接头20*GGS接头融合至具有效应突变和旋钮突变的hIgG1 Fc的C端(hEc4-IL-2_模拟物;序列参见下文)。在此构建体中,残基D15(相当于人IL-2中的D20)突变为T或H,残基N40(相当于人IL-2中的N88)突变为I、G和R,以尝试减弱与IL-2Rβ链的结合。将所得构建体(野生型或突变型)与CD8 VHH-hFc3组合,用于在ExpiCHO细胞中制备。如实施例1所描述测试所得IL-2_模拟物(新白细胞素)变体在CD8
图30A-图30H中的数据说明:
i.不同的细胞群对野生型IL-2的敏感性如下:CD8+<CD25-Tconv<CD25+Tconv<<<Treg(图30A)。
ii.非靶向IL-2_模拟物Fc变体对所有测试的PBMC亚群体具有或多或少相同的活性(例如,对于CD8+、CD25-Tconv、Treg和CD25+Tconv的EC50值分别为6.1pM、9.6pM、2.3pM和8.0pM细胞)(图30B)。
iii.野生型IL-2_模拟物的CD8靶向增加CD8阳性细胞中的信号传导,但不增加其他细胞类型中的信号传导(图30C),导致选择性指数为约10倍。
iv.突变D15T、D15H、N40I和N40R几乎完全消除了CD8阴性细胞中的IL-2_模拟物信号传导。仅在非常高的浓度(100nM)下才能在这些细胞中观察到pSTAT5特征(图30D、图30E、图30F和图30H)。
v.CD8靶向能够恢复(至少部分地)信号传导损失,导致EC50值为38pM(D15T);169pM(D15H);53pM(N40I);和12pM(N40R)(图30D、图30E、图30F和图30H),并且与图30C中的靶向性野生型IL-2模拟物相比,选择性指数提高了10-100倍。
vi.在CD8阳性细胞或是CD8阴性细胞上,N40G突变的功能丧失不太严重(图30G),但与图30C中的靶向性野生型IL-2模拟物相比,选择性指数提高了10-100倍。
总之,IL-2_模拟物的CD8靶向以及残基D15和N40的突变明显增加了相对于CD8阴性细胞对CD8阳性细胞中的信号传导的选择性。野生型IL-2_模拟物的靶向仅导致选择性适度增加。
以上实施例1-6的氨基酸序列:
○hFc3(SEQ ID NO:290)
○hFc4-hIL-2_C125A(SEQ ID NO:291)
○hFc4-hIL-2_R38A_F42Y_Y45A_E62A_C125A(SEQ ID NO:292)
○hFc4-hIL-2_F42Y_Y45A_L72G_C125A(SEQ ID NO:293)
○hFc4-hIL-2_F42K_C125A(SEQ ID NO:294)
○hFc4-hIL-2_R38A_F42K_C125A(SEQ ID NO:295)
○hFc4-hIL-2_E61Q_C125A(SEQ ID NO:296)
○hCD8 VHH-hFc3(SEQ ID NO:297)
○hFc4-hIL-2_D20A_C125A(SEQ ID NO:298)
○hFc4-hIL-2_D20E_C125A(SEQ ID NO:299)
○hFc4-hIL-2_D20F_C125A(SEQ ID NO:300)
○hFc4-hIL-2_D20G_C125A(SEQ ID NO:301)
○hFc4-hIL-2_D20H_C125A(SEQ ID NO:302)
○hFc4-hIL-2_D20I_C125A(SEQ ID NO:303)
○hFc4-hIL-2_D20K_C125A(SEQ ID NO:304)
○hFc4-hIL-2_D20L_C125A(SEQ ID NO:305)
○hFc4-hIL-2_D20N_C125A(SEQ ID NO:306)
○hFc4-hIL-2_D20P_C125A(SEQ ID NO:307)
○hFc4-hIL-2_D20Q_C125A(SEQ ID NO:308)
○hFc4-hIL-2_D20R_C125A(SEQ ID NO:309)
○hFc4-hIL-2_D20S_C125A(SEQ ID NO:310)
○hFc4-hIL-2_D20T_C125A(SEQ ID NO:311)
○hFc4-hIL-2_D20V_C125A(SEQ ID NO:312)
○hFc4-hIL-2_D20W_C125A(SEQ ID NO:313)
○hFc4-hIL-2_D20Y_C125A(SEQ ID NO:314)
○hFc4-hIL-2_N88A_C125A(SEQ ID NO:315)
○hFc4-hIL-2_N88D_C125A(SEQ ID NO:316)
○hFc4-hIL-2_N88E_C125A(SEQ ID NO:317)
○hFc4-hIL-2_N88F_C125A(SEQ ID NO:318)
○hFc4-hIL-2_N88G_C125A(SEQ ID NO:319)
○hFc4-hIL-2_N88H_C125A(SEQ ID NO:320)
○hFc4-hIL-2_N88I_C125A(SEQ ID NO:321)
○hFc4-hIL-2_N88K_C125A(SEQ ID NO:322)
○hFc4-hIL-2_N88L_C125A(SEQ ID NO:323)
○hFc4-hIL-2_N88P_C125A(SEQ ID NO:324)
○hFc4-hIL-2_N88Q_C125A(SEQ ID NO:325)
○hFc4-hIL-2_N88R_C125A(SEQ ID NO:326)
○hFc4-hIL-2_N88S_C125A(SEQ ID NO:327)
○hFc4-hIL-2_N88T_C125A(SEQ ID NO:328)
○hFc4-hIL-2_N88V_C125A(SEQ ID NO:329)
○hFc4-hIL-2_N88W_C125A(SEQ ID NO:330)
○hFc4-hIL-2_N88Y_C125A(SEQ ID NO:331)
○hFc4-hIL-2_D20E_R38A_A42K_C125A(SEQ ID NO:332)
○hFc4-hIL-2_D20V_R38A_F42K_C125A(SEQ ID NO:333)
○hFc4-hIL-2_R38A_F42K_N88A_C125A(SEQ ID NO:334)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:335)
oMA251 scFv_VH-VL-hFc3(SEQ ID NO:336)
○MA251 scFv_VL-VH-hFc3(SEQ ID NO:337)
○7G7B6 scFv_VH-VL-hFc3(SEQ ID NO:338)
○7G7B6 scFv_VL-VH-hFc3(SEQ ID NO:339)
○hFc4-IL-2_模拟物(SEQ ID NO:340)
○hFc4-IL-2_模拟物_D15T(SEQ ID NO:341)
○hFc4-IL-2_模拟物_D15H(SEQ ID NO:342)
○hFc4-IL-2_模拟物_N40I(SEQ ID NO:343)
○hFc4-IL-2_模拟物_N40G(SEQ ID NO:344)
○hFc4-IL-2_模拟物_N40R(SEQ ID NO:345)
实施例7:IL-2中T3 O-糖基化的缺失
IL-2在位置3(T3)上含有苏氨酸O-糖基化位点。在该实施例中,评估了在制备、可制造性和生物活性情形下移除该位点的可能性。使用两种策略:(i)位点特异性突变,其中T3突变为A、F、H、L、V或Y,或(ii)缺失诱变,其中IL-2序列的前3、4、5、6、7或8个残基缺失。以CD8靶向性ALN2型式使用标准诱变技术进行突变。将IL-2序列(通过柔性20*GGS接头)克隆到具有L234A_L235A_K322Q效应突变和S354C_T366W“旋钮”突变的hIgG1 Fc序列(称为hFc4)的C端。IL-2弹头含有以下突变:(i)R38A_F42K,阻断与CD25或IL-2Rα的结合,(ii)N88G,以可恢复的方式减弱与IL-2Rβ的相互作用,以及(iii)C125A,去除游离半胱氨酸残基,导致优越的可制造性。将所得构建体与CD8 VHH 1CDA65和具有L234A_L235A_K322Q效应突变和Y349C_T366S_L368A_Y407V“孔洞”突变的hIG1 Fc(称为hFc3)的融合物组合。为了产生此“旋钮入孔洞”Fc-ALN2,根据制造商的说明,将“孔洞”和“旋钮”质粒的组合转染到ExpiCHO细胞(ThermoFisher)中。转染后一周,收集上清液并通过离心除去细胞。将重组蛋白基于蛋白A结合特性(Hitrap MabSelect SuRe柱,GE Healthcare)并通过随后的尺寸排阻色谱法(Superdex 200 increase HiScale 16/40柱,GE Healthcare)纯化,两者均在
测试所得ALN2 O-糖基化变体在以下细胞中的STAT5磷酸化:(i)CD8阳性T细胞(CD8
为了评估O-糖基化ALN2变体的稳定性,将纯化的蛋白质浓缩至10mg/ml,并进行五次冷冻(-20℃)-解冻循环。在每个循环之后,将样品离心,并在Nanodrop分光光度计上测量蛋白质浓度。在冷冻-解冻循环之前和之后,在
在该实施例中使用以下氨基酸序列:
○hCD8 VHH-hFc3(SEQ ID NO:346)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:347)
○hFc4-hIL-2_T3A_R38A_F42K_N88G_C125A(SEQ ID NO:348)
○hFc4-hIL-2_T3F_R38A_F42K_N88G_C125A(SEQ ID NO:349)
○hFc4-hIL-2_T3H_R38A_F42K_N88G_C125A(SEQ ID NO:350)
○hFc4-hIL-2_T3L_R38A_F42K_N88G_C125A(SEQ ID NO:351)
○hFc4-hIL-2_T3V_R38A_F42K_N88G_C125A(SEQ ID NO:352)
○hFc4-hIL-2_T3Y_R38A_F42K_N88G_C125A(SEQ ID NO:353)
○hFc4-hIL-2_R38A_F42K-N88G_C125A_del3(SEQ ID NO:354)
○hFc4-hIL-2_R38A_F42K_N88G_C125A_del4(SEQ ID NO:355)
○hFc4-hIL-2_R38A_F42K_N88G_C125A_del5(SEQ ID NO:356)
○hFc4-hIL-2_R38A_F42K_N88G_C125A_del6(SEQ ID NO:357)
○hFc4-hIL-2_R38A_F42K_N88G_C125A_del7(SEQ ID NO:358)
○hFc4-hIL-2_R38A_F42K_N88G_C125A_del8(SEQ ID NO:359)
实施例8:IL-2活性的二价和双互补位靶向
在该实施例中,使用具有一个或两个VHH的型式比较了IL-2活性靶向CD8阳性细胞的效率。这些VHH可以是相同的(产生二价构型)或不同的(产生所谓的双互补位型式)。在旋钮入孔洞支架上,VHH和IL-2弹头可以不同的构型进行克隆,如图31中所概述。
具体地,在编码具有图31中描绘的构型1的ALN2变体的载体中克隆七个不同的CD8VHH:1CDA65、2CDA5、3CDA19、2CDA47、2CDA68、R2HCD26和R3HCD129。如实施例7所描述,IL-2弹头含有R38A_F42K、N88G和C125A突变,分别用于CD25敲除、可恢复β减弱和可制造性。所得ALN2型式通过使用以下质粒组合瞬时转染ExpiCHO细胞来产生:
●hCD8 VHH 1CDA65-hFc3+hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH 1CDA65-hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH 2CDA5-hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH 3CDA19-hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH 2CDA47-hFc4-IL-2_R38A_F42K_N88G-C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH 2CDA68-hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH R2HCD26-hFc4-IL-2_R38A_F42K_N88G_C125A
●hCD8 VHH 1CDA65-hFc3+hCD8 VHH R3HCD 129-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH 1CDA65-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH 2CDA5-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH 3CDA19-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH 2CDA47-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH 2CDA68-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH R2HCD26-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hCD8 VHH R3HCD 129-hFc4-IL-2_R38A_F42K_N88G_C125A
●hFc3+hFc4-IL-2_R38A_F42K_N88G_C125A
如前文所描述从上清液中纯化所得蛋白质并测试其在CD8
单特异性构建体具有图32的构型4,而VHH 1CDA65是具有图32的构型1的构建体并且作为单特异性构建体产生。在图33A-图33G中其被称为1CDA-65-Fc-ALN2bis。图33A-图33G中的数据说明,在CD8细胞上:
i.构建体1CDA65-Fc-ALN2和1CDA65-Fc-ALN2 bis具有相似的效力;
ii.二价1CDA65-1CDA65-Fc-ALN2与其单价对应物1CDA65-Fc-ALN2或1CDA65-Fc-ALN2-bis具有相似的活性;并且
iii.对于双互补位构型1CDA65-2CDA5-Fc-ALN2、1CDA65-2CDA68-Fc-ALN2和1CDA65-R2HCD26-Fc-ALN2观察到生物活性的增加。值得注意的是,VHH 1CDA65和2CDA4774属于同一表位仓,而VHH 2CDA5、3CDA19、2CDA68和R2HCD26属于第二仓。由于其亲和力较低,未确定VHH R3HCD129的表位仓。值得注意的是,具有来自不同表位仓的两个靶向结构域的ALN2变体的活性是其单特异性对应物的平均10倍。
在该实施例中使用以下氨基酸序列:
●hCD8 VHH 1CDA65-hFc3(SEQ ID NO:360)
●hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:361)
●hCD8 VHH 1CDA65-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:362)
●hCD8 VHH 2CDA5-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:363)
●hCD8 VHH 3CDA19-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:364)
●hCD8 VHH 2CDA47-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:365)
●hCD8 VHH 2CDA68-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:366)
●hCD8 VHH R2HCD26-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:367)
●hCD8 VHH R3HCD129-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:368)
●hFc3(SEQ ID NO:369)
实施例9:替代ALN2构型的评估
在该实施例中,比较了不同的CD8靶向性ALN2构型。具体地,将VHH和/或IL-2弹头克隆到旋钮入孔洞Fc支架的N端或C端,位于分子的相同或相对位点上。型式可以容纳一个或两个弹头,串联克隆或克隆在不同的Fc链上。VHH与弹头也可以串联克隆,或者VHH克隆在两个IL-2部分之间。图32中示意性地概述了所有可能的构型。
如前文所描述将以下ALN2质粒组合转染到ExpiCHO细胞中,从上清液中纯化,测试在CD8
●hCD8 VHH 1CDA65-hFc3+hFc4-IL-2_R38A_F42K_N88G_C125A(图32中的构型1)
●hCD8 VHH 1CDA65-hFc3+IL-2_R38A_F42K_N88G_C125A-hFc4-IL-2_R38A_F42K_N88G_C125A(图32中的构型9)
●hCD8 VHH 1CDA65-hFc3-hFc4-IL-2_R38A_F42K_N88G_C125A+hFc4-IL-2_R38A_F42K_N88G_C125A(图32中的构型13)
●hCD8 VHH 1CDA65-hFc3+hFc4-IL-2_R38A_F42K_N88G_C125A-IL-2_R38A_F42K_N88G_C125A(图32中的构型25)
●hCD8 VHH 1CDA65-hFc3+IL-2_R38A_A42K_N88G_C125A-IL-2_R38A_F42K_N88G_C125A-hFc4(图32中的构型26)
此外,图34A-图34E中的数据说明,所有测试的变体在CD8+细胞中都有明确的pSTAT5,而在Treg细胞中则没有,从而说明了它们的选择性。
在该实施例中使用以下氨基酸序列:
●hCD8 VHH 1CDA65-hFc3(SEQ ID NO:370)
●hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:371)
●IL-2_R38A_F42K_N88G_C125A-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:372)
●hCD8 VHH 1CDA65-hFc3-hFc4-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:373)
●hFc4-IL-2_R38A_F42K_N88G_C125A-IL-2_R38A_F42K_N88G_C125A(SEQ ID NO:374)
●IL-2_R38A_F42K_N88G_C125A-IL-2_R38A_F42K_N88G_C125A-hFc4(SEQ ID NO:375)
实施例10:β和γ突变的组合
该实施例的目的是评估IL-2Rβ结合位点中的功能丧失型突变(N88A、N88G、D20E或D20V)与阻碍与IL-2R中的γ
表8汇总了这些突变:
以CD8靶向性ALN2型式使用标准诱变技术进行突变或其组合(如上文实施例中所描述)。此处,出于可制造性的原因,IL-2弹头仅含有C125A突变。将所得质粒与CD8 VHH-hFc3质粒组合,用于在ExpiCHO细胞中瞬时转染。使用蛋白A旋转板(ThermoFisher)纯化蛋白质,定量,并使用SDS-PAGE进行纯度测试。
如下测试所得ALN2变体在CD8
在该实施例中使用以下氨基酸序列:
○hCD8 VHH-hFc3(SEQ ID NO:376)
○hFc4-hIL-2_C125A(SEQ ID NO:377)
○hFc4-hIL-2_C125A_D20E_Q126A(SEQ ID NO:378)
○hFc4-hIL-2_C125A_D20E_Q126D(SEQ ID NO:379)
○hFc4-hIL-2_C125A_D20E_Q126E(SEQ ID NO:380)
○hFc4-hIL-2_C125A_D20E_Q126F(SEQ ID NO:381)
○hFc4-hIL-2_C125A_D20E_Q126G(SEQ ID NO:382)
○hFc4-hIL-2_C125A_D20E_Q126H(SEQ ID NO:383)
○hFc4-hIL-2_C125A_D20E_Q126I(SEQ ID NO:384)
○hFc4-hIL-2_C125A_D20E_Q126K(SEQ ID NO:385)
○hFc4-hIL-2_C125A_D20E_Q126L(SEQ ID NO:386)
○hFc4-hIL-2_C125A_D20E_Q126M(SEQ ID NO:387)
○hFc4-hIL-2_C125A_D20E_Q126N(SEQ ID NO:388)
○hFc4-hIL-2_C125A_D20E_Q126P(SEQ ID NO:389)
○hFc4-hIL-2_C125A_D20E_Q126R(SEQ ID NO:390)
○hFc4-hIL-2_C125A_D20E_Q126S(SEQ ID NO:391)
○hFc4-hIL-2_C125A_D20E_Q126T(SEQ ID NO:392)
○hFc4-hIL-2_C125A_D20E_Q126V(SEQ ID NO:393)
○hFc4-hIL-2_C125A_D20E_Q126W(SEQ ID NO:394)
○hFc4-hIL-2_C125A_D20E_Q126Y(SEQ ID NO:395)
○hFc4-hIL-2_C125A_D20V_Q126A(SEQ ID NO:396)
○hFc4-hIL-2_C125A_D20V_Q126D(SEQ ID NO:397)
○hFc4-hIL-2_C125A_D20V_Q126E(SEQ ID NO:398)
○hFc4-hIL-2_C125A_D20V_Q126F(SEQ ID NO:399)
○hFc4_hIL-2_C125A_D20V_Q126G(SEQ ID NO:400)
○hFc4-hIL-2_C125A_D20V_Q126H(SEQ ID NO:401)
○hFc4-hIL-2_C125A_D20V_Q126I(SEQ ID NO:402)
○hFc4-hIL-2_C125A_D20V_Q126K(SEQ ID NO:403)
○hFc4-hIL-2_C125A_D20V_Q126L(SEQ ID NO:404)
○hFc4-hIL-2_C125A_D20V_Q126M(SEQ ID NO:405)
○hFc4-hIL-2_C125A_D20V_Q126N(SEQ ID NO:406)
○hFc4-hIL-2_C125A_D20V_Q126P(SEQ ID NO:407)
○hFc4-hIL-2_C125A_D20V_Q126R(SEQ ID NO:408)
○hFc4-hIL-2_C125A_D20V_Q126S(SEQ ID NO:409)
○hFc4-hIL-2_C125A_D20V_Q126T(SEQ ID NO:410)
○hFc4-hIL-2_C125A_D20V_Q126V(SEQ ID NO:411)
○hFc4-hIL-2_C125A_D20V_Q126W(SEQ ID NO:412)
○hFc4-hIL-2_C125A_D20V_Q126Y(SEQ ID NO:413)
○hFc4-hIL-2_C125A_N88A_Q126A(SEQ ID NO:414)
○hFc4-hIL-2_C125A_N88A_Q126D(SEQ ID NO:415)
○hFc4-hIL-2_C125A_N88A_Q126E(SEQ ID NO:416)
○hFc4-hIL-2_C125A_N88A_Q126F(SEQ ID NO:417)
○hFc4-hIL-2_C125A_N88A_Q126G(SEQ ID NO:418)
○hFc4-hIL-2_C125A_N88A_Q126H(SEQ ID NO:419)
○hFc4-hIL-2_C125A_N88A_Q126I(SEQ ID NO:420)
○hFc4-hIL-2_C125A_N88A_Q126K(SEQ ID NO:421)
○hFc4-hIL-2_C125A_N88A_Q126L(SEQ ID NO:422)
○hFc4-hIL-2_C125A_N88A_Q126M(SEQ ID NO:423)
○hFc4-hIL-2_C125A_N88A_Q126N(SEQ ID NO:424)
○hFc4-hIL-2_C125A_N88A_Q126P(SEQ ID NO:425)
○hFc4-hIL-2_C125A_N88A_Q126R(SEQ ID NO:426)
○hFc4-hIL-2_C125A_N88A_Q126S(SEQ ID NO:427)
○hFc4-hIL-2_C125A_N88A_Q126T(SEQ ID NO:428)
○hFc4-hIL-2_C125A_N88A_Q126V(SEQ ID NO:429)
○hFc4-hIL-2_C125A_N88A_Q126W(SEQ ID NO:430)
○hFc4-hIL-2_C125A_N88A_Q126Y(SEQ ID NO:431)
○hFc4-hIL-2_C125A_N88G_Q126A(SEQ ID NO:432)
○hFc4-hIL-2_C125A_N88G_Q126D(SEQ ID NO:433)
○hFc4-hIL-2_C125A_N88G_Q126E(SEQ ID NO:434)
○hFc4-hIL-2_C125A_N88G_Q126F(SEQ ID NO:435)
○hFc4-hIL-2_C125A_N88G_Q126G(SEQ ID NO:436)
○hFc4-hIL-2_C125A_N88G_Q126H(SEQ ID NO:437)
○hFc4-hIL-2_C125A_N88G_Q126I(SEQ ID NO:438)
○hFc4-hIL-2_C125A_N88G_Q126K(SEQ ID NO:439)
○hFc4-hIL-2_C125A_N88G_Q126L(SEQ ID NO:440)
○hFc4-hIL-2_C125A_N88G_Q126M(SEQ ID NO:441)
○hFc4-hIL-2_C125A_N88G_Q126N(SEQ ID NO:442)
○hFc4-hIL-2_C125A_N88G_Q126P(SEQ ID NO:443)
○hFc4-hIL-2_C125A_N88G_Q126R(SEQ ID NO:444)
○hFc4-hIL-2_C125A_N88G_Q126S(SEQ ID NO:445)
○hFc4-hIL-2_C125A_N88G_Q126T(SEQ ID NO:446)
○hFc4-hIL-2_C125A_N88G_Q126V(SEQ ID NO:447)
○hFc4-hIL-2_C125A_N88G_Q126W(SEQ ID NO:448)
○hFc4-hIL-2_C125A_N88G_Q126Y(SEQ ID NO:449)
实施例11:单肽ALN2变体
该实施例显示了单肽ALN2变体的效应。将无αIL-2变体(突变R38A_F42K)克隆成单肽A-Kine型式。为此,将编码CD8 VHH 1CDA65和IL-2的序列通过柔性20*GGS接头融合在pcDNA3.4表达载体中以进行真核表达。出于纯化目的添加C端6*His标签。使用标准诱变技术制备D20E、D20V、N88A和N88G突变体,并根据制造商的指南将所得质粒转染到ExpiCHO细胞(ThermoFisher)中。转染后一周,收集上清液并通过离心除去细胞。将重组蛋白基于His标签(HisTrap Excel柱;Cytiva)并通过随后的尺寸排阻色谱法(Superdex 200 increaseHiScale 16/40柱,Cytiva)纯化,两者均在
如前文所描述,测试所得蛋白质在CD8+与Treg细胞中的STAT5磷酸化。如图35A-图35D中所示,除了突变R38A_F42K_D20V之外,所有突变在测试浓度范围内都允许相对于Treg细胞选择性地对CD8+进行信号传导。N88变体R38A_F42K_N88A(EC
在该实施例中使用以下氨基酸序列:
○hCD8 VHH-hIL-2_D20E_R38A_F42K_C125A(SEQ ID NO:478)
○hCD8 VHH-hIL-2_D20V_R38A_F42K_C125A(SEQ ID NO:479)
○hCD8 VHH-hIL-2_R38A_F42K_N88A_C125A(SEQ ID NO:480)
○hCD8 VHH-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:481)
实施例12:IL-2弹头中T3 O-糖基化位点的去除
IL-2在位置3(T3)上含有苏氨酸O-糖基化位点。在该实施例中,评估了在制备、可制造性和生物活性情形下移除该位点的可能性。使用两种策略:(i)位点特异性突变,其中T3突变为A、F、H、L、V或Y,或(ii)缺失诱变,其中IL-2序列的前3、4、5、6、7或8个残基缺失。以CD8靶向性ALN2型式使用标准诱变技术进行突变。将IL-2序列(通过柔性20*GGS接头)克隆到具有L234A_L235A_K322Q效应突变和S354C_T366W“旋钮”突变的hIgG1 Fc序列(称为hFc4)的C端。IL-2弹头含有以下突变:(i)R38A_F42K,阻断与CD25或IL-2Rα的结合,(ii)N88G,以可恢复的方式减弱与IL-2Rβ的相互作用,以及(iii)C125A,去除游离半胱氨酸残基,导致优越的可制造性。将所得构建体与CD8 VHH 1CDA65和具有L234A_L235A_K322Q效应突变和Y349C_T366S_L368A_Y407V“孔洞”突变的hIG1 Fc(称为hFc3)的融合物组合。为了产生此“旋钮入孔洞”Fc-ALN2,根据制造商的说明,将“孔洞”和“旋钮”质粒的组合转染到ExpiCHO细胞(ThermoFisher)中。转染后一周,收集上清液并通过离心除去细胞。使用蛋白A旋转板(ThermoFisher)纯化重组蛋白,定量,并使用SDS-PAGE进行纯度测试。如下测试所得变体在CD8阳性(CD8+)和CD8阴性(CD8-)PBMC群体中的STAT5磷酸化:将PBMC用人FcR封闭试剂(Miltenyi Biotec)封闭并用荧光标记的CD8特异性Ab染色。在染色和洗涤后,将细胞用连续稀释的CD8 VHH-Fc-IL-2变体(如所示)在37℃下刺激30分钟。随后根据制造商的指南,使用溶解/固定缓冲液(BD Biosciences)固定细胞,并使用透化缓冲液III(BDBiosciences)进行透化。在用pSTAT5特异性抗体过夜染色后,在MACSQuant X仪器(Miltenyi Biotec)上分析样品,并使用FlowLogic软件(Miltenyi Biotec)进行分析。
图36A-图36M中的数据说明,将T3取代为H、I、L V、Y或A,或缺失多达7个氨基酸,对CD8+细胞具有相当的活性,EC50值从1到5ng/ml不等。然而,IL-2_del8变体的活性比野生型IL-2低10倍。相比之下,T3F(未显示)突变不再显示可检测的活性。显示对CD8群体中的信号传导的影响非常相似。
在该实施例中使用以下氨基酸序列:
○hFc4-hIL-2_C125A(SEQ ID NO:482)
○hCD8 VHH-hFc3(SEQ ID NO:483)
○hFc4-hIL-2_T3A_C125A(SEQ ID NO:484)
○hFc4-hIL-2_T3H_C125A(SEQ ID NO:485)
○hFc4-hIL-2_T3L_C125A(SEQ ID NO:486)
○hFc4-hIL-2_T3V_C125A(SEQ ID NO:487)
○hFc4-hIL-2_T3Y_C125A(SEQ ID NO:488)
○hFc4-hIL-2_C125A_del3(SEQ ID NO:489)
○hFc4-hIL-2_C125A_del4(SEQ ID NO:490)
○hFc4-hIL-2_C125A_del5(SEQ ID NO:491)
○hFc4-hIL-2_C125A_del6(SEQ ID NO:492)
○hFc4-hIL-2_C125A_del7(SEQ ID NO:493)
○hFc4-hIL-2_C125A_del8(SEQ ID NO:494)
实施例13:α:β组合的体内评估
由于人IL-2对小鼠IL-2受体有交叉反应,因此测试了人α:βALN2变体对小鼠细胞的活性。为此,在具有效应突变和全突变的VHH-Fc融合物中,将人CD8特异性VHH(1CDA65)替换为小鼠CD8特异性VHH R2CDE47。将所得构建体(mCD8 VHH-hFc3)与融合至具有R38A_F42Kα敲除突变和可恢复β突变D20E、D20V、N88A或N88G之一的ALN2弹头的旋钮Fc组合。如上文所描述,将小鼠CD8靶向性ALN2变体在ExpiCHO中表达并进行纯化。最初,测试这些变体在原代小鼠脾细胞中的STAT5磷酸化。简单来说,对来自C57B1/6小鼠的脾细胞(用ACK缓冲液溶解的RBC)进行细胞表面标记物(活力、CD3、CD4、CD8α、CD8β)染色,并用不同的小鼠CD8靶向性ALN2变体离体刺激30分钟。通过添加1X TFP固定/透化缓冲液(BD Pharmingen)停止刺激,并在4℃下孵育50分钟,然后用1X TFP透化/洗涤缓冲液(BD Pharmingen)进行2次洗涤步骤。将细胞沉淀物重悬于透化/洗涤缓冲液III(转录因子磷酸化缓冲液套组,BDPharmingen)中,并在-20℃下孵育过夜,随后进行细胞内FoxP3和pSTAT5染色。在MACSQuantl6流式细胞仪上采集样品并使用FlowLogic 8.4软件(Miltenyi Biotec)进行分析。
D20E、N88A或N88G组合对CD8+细胞的活性相当(EC
在两种同基因小鼠结肠癌模型MC38和CT26中评估了具有组合突变R38A_F42K_N88G的小鼠CD8靶向性ALN2变体(CD8-Fc-ALN2)的抗肿瘤功效,并与非靶向性ALN2变体(Fc-ALN2)进行了比较。简单来说,对C57B1/6J小鼠(雌性,9周龄)皮下注射(s.c.)6E+5个MC38细胞,或者对Balb/c小鼠(雌性,9周龄)皮下注射6E+5个CT26细胞。7天后,肿瘤体积达到20-90mm
每天测量肿瘤大小(平均值+/-SEM;每组n=5)并绘制于图38中。数据清楚地说明,与经缓冲液治疗的动物相比,非靶向性ALN2没有显著效果,而CD8-Fc-ALN2在两种模型中均明显且显著地抑制了肿瘤生长。在第21天,在MC38模型中,甚至有一只经CD8-Fc-ALN2治疗的动物完全无肿瘤。
在一项平行实验中,研究了CD8-Fc-ALN2和作为检查点抑制剂的抗PD-1 Ab在MC38和CT26模型中的联合作用。为此,在肿瘤接种后第7、10、14和17天荷瘤C57B1/6J(MC38)或Balb/c小鼠(CT26)静脉内接受缓冲液或CD8-Fc-ALN2(12.5μg/小鼠)。在静脉内治疗的同一天,为此缓冲液或ALN2治疗补充腹膜内(i.p.)抗PD-1 Ab治疗(200μg/小鼠)。图39中所示的肿瘤大小为平均值+/-SEM(每组n=5)。每条曲线末尾的数字表示实验结束时(第22天)完全无肿瘤小鼠的数量。在MC38模型中,抗PD-1本身没有效应,单独的CD8-Fc-ALN2具有中等效应(5只小鼠中有2只完全无肿瘤),但联合使用在所有动物中均导致肿瘤完全消退。在CT26模型中观察到类似的联合/附加效应:虽然两种单一疗法(CD8-Fc-ALN2和抗PD-1)没有显著效应,但联合治疗减缓了肿瘤生长,甚至在一只动物中完全根除了肿瘤。
值得注意的是,在第一次MC38肿瘤接种56天后,无肿瘤MC38小鼠随后在另一侧接受再攻击。所有无肿瘤和再攻击的小鼠在2个月后仍然完全无肿瘤,而对照动物在肿瘤接种17至21天后长出肿瘤,需要安乐死(达到1500mm
在该实施例中使用以下氨基酸序列:
○mCD8 VHH-hFc3(SEQ ID NO:495)
○hFc4-hIL-2_D20E_R38A_F42K_C125A(SEQ ID NO:332)
○hFc4-hIL-2_D20V_R38A_F42K_C125A(SEQ ID NO:333)
○hFc4-hIL-2_R38A_F42K_N88A_C125A(SEQ ID NO:334)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:335)
○hFc3(SEQ ID NO:369)
实施例14:γ共同突变的筛选
在癌症背景下,可能需要用IL-2选择性地激活细胞毒性T淋巴细胞(CTL),同时最大限度地减少对抑制这些免疫应答的Treg细胞的影响。一种治疗策略是使用这些所谓的无αIL-2变体,这些变体不再结合IL-2Rα链,而该链主要导致Treg细胞对IL-2超敏感。如上文所描述,CD8靶向性无αFc变体仍然能够以1至2ng/ml的EC
在该实施例中,评估了与γ共同受体相互作用的位点的突变,以评估这种突变与β突变具有相同的有益效果的程度。A-Kine突变的可能候选者是残基Q126的取代,该残基是IL-2与γ共链之间相互作用的核心。因此,在Fc4-IL-2_C125A链中将该残基突变为任何其他(半胱氨酸除外)氨基酸,并与CD8 VHH-hFc3组合,用于在ExpiCHO中制备。转染一周后,使用蛋白A旋转板(ThermoFisher)从上清液中纯化蛋白质,定量,并使用SDS-PAGE进行纯度测试。如前文所描述,将这些突变与野生型IL-2(具有C125A突变)对CD8阳性PBMC中STAT5磷酸化的影响进行比较。基于这些应答,将突变分为四类(图40A-图40D):
i.无效应突变(活性损失0-10倍)
ii.适度效应突变(活性损失10-50倍)
iii.中等效应突变(活性损失50-500倍)
iv.强突变(活性损失>500倍)或Q126D几乎完全丧失活性
随后,使用Octet装置来研究Q126突变影响IL-2与IL-2Rα链的相互作用/结合的程度。简单来说:将生物素化的CD25(IL-2Rα)加载到链霉亲和素传感器上,监测两种浓度(50和10nM)的CD8VHH-hFc3+hFc4-IL-2或其Q126突变体的缔合和解离,并用于计算缔合和解离常数,并由此计算亲和力。图41A-图41S中的数据说明,大多数突变不影响这种相互作用,但有两个例外:突变Q126F(由于缔合率较低,亲和力降低10倍)和Q126P,其几乎完全消除结合。后者表明脯氨酸取代导致构象转变,从而影响IL-2分子的其他部分。
下表提供了缔合和解离常数以及亲和力:
基于这两个数据集,保留上述每个类别中的一个突变(适度:Q126Y,中等:Q126G,强:Q126I),用于在以下实施例中进行进一步分析。
在该实施例中使用以下氨基酸序列:
○hCD8 VHH-hFc3(SEQ ID NO:501)
○hFc4-hIL-2_C125A(SEQ ID NO:502)
○hFc4_C125A_Q126A(SEQ ID NO:503)
○hFc4_C125A_Q126D(SEQ ID NO:504)
○hFc4_C125A_Q126E(SEQ ID NO:505)
○hFc4_C125A_Q126F(SEQ ID NO:506)
○hFC4_C125A_Q126G(SEQ ID NO:507)
○hFc4_C125A_Q126H(SEQ ID NO:508)
○hFc4_C125A_Q126I(SEQ ID NO:509)
○hFc4_C125A_Q126K(SEQ ID NO:510)
○hFc4_C125A_Q126L(SEQ ID NO:511)
○hFc4_C125A_Q126M(SEQ ID NO:512)
○hFc4_C125A_Q126N(SEQ ID NO:513)
○hFc4_C125A_Q126P(SEQ ID NO:514)
○hFc4_C125A_Q126R(SEQ ID NO:515)
○hFc4_C125A_Q126S(SEQ ID NO:516)
○hFc4_C125A_Q126T(SEQ ID NO:517)
○hFc4_C125A_Q126V(SEQ ID NO:518)
○hFc4_C125A_Q126W(SEQ ID NO:519)
○hFc4_C125A_Q126Y(SEQ ID NO:520)
实施例15:α和γ突变的组合
与α:β组合类似,将α突变(R38A_F42K)在deALN2弹头中与三个选定的γ突变(Q126G、Q126I和Q126Y)组合。如前文所描述,产生三个所得ALN2,纯化,并测试三个不同健康供体的CD8+和Treg PBMC子集中的STAT5磷酸化。图42A-图42D中的结果说明:
○如前所观察:Treg对IL-2的敏感性比CD8+细胞高4个对数
○相比之下,CD8+细胞对具有任何组合α:γ突变的ALN2的敏感性比Treg高约3个对数。
○与强Q126I突变的组合允许CD8+细胞中有清楚的信号传导,而在高达10μg/mL下在Treg细胞中STAT5磷酸化几乎不存在。
在该实施例中使用以下氨基酸序列:
○hCD8 VHH-hFc3(SEQ ID NO:521)
○hFc4-IL-2_R38A_F42K_Q126G(SEQ ID NO:522)
○hFc4-IL-2_R38A_F42K_Q126I(SEQ ID NO:523)
○hFc4-IL-2_R38A_F42K_Q126Y(SEQ ID NO:524)
实施例16:β和γ突变组合对激活的CD8细胞的选择性
在癌症治疗中使用无αIL-2变体(见上文)的第一个主要缺点是,这些分子不能与内源性表达的IL-2竞争结合IL-2Rα链。事实上,在肿瘤环境中,主要是CD4
为了模拟CD8+细胞的激活(从而上调CD25),用TransAct(与重组人源化CD3和CD28激动剂缀合的纳米基质;Miltenyi Biotec)处理新鲜分离的健康供体的PBMC持续两天,之后用D20E_Q126G或D20E_Q126Y ALN2变体进行刺激,以STAT5磷酸化作为功能性读出。从图43A-图43D中可以看出,与CD8+细胞相比,这两种β:γ突变体对Treg的活性更高(大约l0倍),但这种敏感性在激活的PBMC上完全相反。此处,可能由于IL-2Rα的上调,CD8+细胞对β:γALN2变体变得高度敏感。这些数据说明,这些ALN2变体对激活的CD8阳性细胞具有选择性。
在该实施例中使用以下氨基酸序列:
○ hCD8 VHH-hFc3(SEQ ID NO:297)
○hFc4-IL-2_D20E_Q126G(SEQ ID NO:382)
○hFc4-IL-2_D20E_Q126Y(SEQ ID NO:395)
○hFc4-hIL-2_C125A(SEQ ID NO:482)
实施例17:
对C57B1/6J小鼠(雌性,9周龄)皮下(s.c.)注射6E+5个MC38细胞。7天后,开始治疗:小鼠静脉内(i.v.)接受(1)缓冲液、(2)靶向性CD8-Fc-ALN2(12.5μg/小鼠)、(3)等摩尔剂量的非靶向性Fc-ALN2(10.7μg/小鼠)或(4)等摩尔剂量的野生型Fc-IL2(10.7μg/小鼠)。一天后,取出脾脏和肿瘤,在CD8或CD4阳性T细胞中进行STAT5磷酸化(记录IL-2受体信号传导)以及膜CD69和CD25表达(记录激活)的细胞内分析。图44中绘制的结果显示,虽然非靶向性Fc-ALN2没有在CD8阳性T细胞中诱导pSTAT5、CD69或CD25,但CD8-Fc-ALN2构建体的诱导作用总体上非常稳健且令人惊讶,甚至比野生型Fc-ALN2更有效。相比之下,野生型Fc-IL2在CD4和FoxP3阳性调控T细胞(Treg)以及其他(FoxP3阴性)CD4阳性T细胞中非常有效地诱导STAT5磷酸化。重要的是,如pSTAT5数据所证明,CD8-Fc-ALN2对FoxP3阳性调控T细胞(Treg)没有任何影响,甚至降低了这些细胞的激活。
为了评估T细胞增殖,在肿瘤接种后14天(即治疗开始后1周,即在第7天和第10天进行2次治疗后)对循环(使用Vetscan HMS,Zoetis)以及脾脏和肿瘤(通过流式细胞术)中的淋巴细胞进行计数。图45中绘制的结果显示,在血液和脾脏中,靶向性CD8-Fc-ALN2是有效引起淋巴细胞增殖的唯一治疗方法(与以等摩尔量注射的非靶向性Fc-ALN2和野生型Fc-IL2相比)。在肿瘤组织中,野生型Fc-IL2能够增加CD8阳性T细胞的数量。加入抗PD-1 Ab治疗进一步增强了CD8-Fc-ALN2诱导的循环和肿瘤组织中的淋巴细胞增殖,但令人惊讶的是Fc-IL2没有做到。
此外,在治疗后3天收集的脾脏中,25μg CD8-Fc-ALN2比等摩尔的21.7μg野生型Fc-IL2更能增强CD8阳性T细胞中的CD25表达(由此激活)(分别为70%与20%),而只有野生型Fc-IL2诱导CD4阳性T细胞中的CD25表达(参见图46)。
在该实施例中使用以下氨基酸序列:
○mCD8 VHH-hFc3(SEQ ID NO:495)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:335)
○hFc3(SEQ ID NO:369)
○hFc4-hIL-2_C125A(SEQ ID NO:482)
实施例18:CD8-Fc-ALN2在A20、B16和Panc02肿瘤模型中的功效
先前证明,具有组合α:β突变R38A_F42K_N88G的小鼠CD8靶向性ALN2变体(CD8-Fc-ALN2)的抗肿瘤功效在两种同基因小鼠结肠癌模型MC38和CT26中非常成功。此外,还在其他3种肿瘤模型中分析了其抗肿瘤功效:淋巴瘤A20、黑素瘤B16F10和胰腺腺癌Panc02。在本实验中,Balb/c小鼠(雌性,9周龄)皮下(s.c.)接种6E+5个A20细胞,并在第10天开始治疗,或C57B1/6J(雌性,9周龄)小鼠皮下接种6E+5个B16F10或Panc02细胞,并在第6天开始治疗。
首先,在肿瘤接种后第10、14和17天,对A20荷瘤小鼠进行以下静脉内(i.v.)治疗:(1)缓冲液,(2)靶向性CD8-Fc-ALN2(12.5μg/小鼠),作为单一疗法,(3)或靶向性CD8-Fc-ALN2(12.5μg/小鼠)与200μg/小鼠抗PD-1 Ab的组合,或(4)非靶向性野生型Fc-IL2(等摩尔10.7μg/小鼠)。肿瘤大小(平均值+/-SEM;每组n=5)绘制于图47中。图47显示,非靶向性野生型Fc-IL-2和靶向性CD8-Fc-ALN2均显著抑制肿瘤生长,但野生型Fc-IL-2治疗的小鼠在第二次治疗后全部死亡(图47中指示为“5/5+”或所有动物死亡)。这一结果与CD8-Fc-ALN2治疗的小鼠形成对比,记录了Balb/c小鼠对野生型IL-2毒副作用的极端敏感性,但对CD8-Fc-ALN2没有这种敏感。实验结束时,5只接受CD8-Fc-ALN2治疗的动物中有4只完全无肿瘤。另外的抗PD-1治疗最初并不能提高CD8-Fc-ALN2的疗效;此外,在该组中,5只小鼠中有4只无肿瘤,但在另外两个月的随访后,这种情况发生了变化。在这个较晚的时间点,六只小鼠(2只来自用CD8-Fc-ALN2治疗的组,4只来自用CD8-Fc-ALN2+抗PD1治疗的组)仍然没有肿瘤,用A20肿瘤细胞在另一侧进行再攻击。与同一天接种相同A20细胞的初始小鼠相比,所有6只小鼠均保持无肿瘤状态,也没有长出新肿瘤。
其次,在肿瘤接种后第6、9和13天,对B16F10荷瘤小鼠进行以下静脉内治疗:(1)缓冲液,(2)靶向性CD8-Fc-ALN2(12.5μg/小鼠)或(3)非靶向性Fc-ALN2(等摩尔10.7μg/小鼠)。接种后第16天的肿瘤大小(平均值+/-SEM;每组n=4-5)绘制于图48中。CD8-Fc-ALN2显著减缓肿瘤生长,而非靶向性ALN2则没有效果。
最后,在肿瘤接种后第6和13天,对Panc02荷瘤小鼠进行以下静脉内治疗:(1)缓冲液,(2)靶向性CD8-Fc-ALN2(12.5μg/小鼠)或(3)非靶向性Fc-ALN2(等摩尔10.7μg/小鼠)。接种后第16天的肿瘤大小(平均值+/-SEM;每组n=5)绘制于图49中。CD8-Fc-ALN2显著减缓肿瘤生长,而非靶向性ALN2则未观察到这一点。
在该实施例中使用以下氨基酸序列:
○mCD8 VHH-hFc3(SEQ ID NO:495)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:335)
○hFc3(SEQ ID NO:369)
实施例19:ALN2的肿瘤靶向
在该实施例中,评估了使用PD-L1 VHH将ALN2活性靶向肿瘤(或其他免疫细胞)的潜力。PD-L1-Fc-ALN2蛋白是通过用以下质粒组合转染ExpiCHO细胞来制备的,并如前文所描述进行纯化:
●PD-L1-Fc-IL-2_R38A_F42K_N88G:mPD-L1vHH-hFc3+hFc4-IL-2_R38A_F42K_N88G
通过如实施例13所描述分析STAT5的磷酸化,在小鼠脾细胞上验证了PD-L1ALN2的效力和特异性。图50显示,非靶向性Fc-ALN2在高达10μg/ml下在小鼠脾细胞中不能诱导pSTAT5,而PD-L1靶向能够诱导与WT IL-2类似的pSTAT5信号。
为了测试MC38肿瘤模型(表达PD-L1的肿瘤)的功效,选择了PD-L1靶向性ALN2。对C57B1/6J小鼠(雌性,9周龄)皮下注射6E+5个MC38细胞。六天后,开始治疗:小鼠静脉内(i.v.)接受(1)缓冲液,(2)靶向性Fc-ALN2(具有IL-2突变R38A_F42K_N88G;12.5μg/小鼠),或(3)非靶向性Fc-ALN2,三次(第6天、第9天和第13天)。接种后第17天的肿瘤大小(平均值+/-SEM;每组n=4-6)绘制于图51中,显示只有PD-L1靶向性ALN2有特异性肿瘤生长抑制作用。
此外,在癌症情形下产生了靶向细胞外肿瘤基质的ALN2(基于TenascinC-A1特异性VHH)。该TNC-Fc-ALN2蛋白是通过用以下质粒组合转染ExpiCHO细胞来制备的,并如上文所描述进行纯化:
●TNC-Fc-IL-2_R38A_F42K_N88G:mTNC VHH-hFc3+hFc4-IL-2_R38A_F42K_N88G
为了测试在MC38肿瘤模型中的功效,对C57B1/6J小鼠(雌性,9周龄)皮下注射6E+5个MC38细胞。六天后,开始治疗:小鼠静脉内(i.v.)接受(1)缓冲液,(2)非靶向性Fc-ALN2,或(3)TNCA1靶向性Fc-ALN2(具有IL-2突变R38A_F42K_N88G;12.5μg/小鼠),三次(第6天、第9天和第13天)。每周测量肿瘤大小三次,并将平均值+/-SEM(n=4-6)绘制于图52中。当提到时,在静脉内治疗的同一天,为ALN2治疗补充腹膜内注射(i.p.)抗PD-1 Ab治疗(200μg/小鼠)。可以看出,与抗PD-1 Ab疗法相结合并且与非靶向性Fc-ALN2相比,TNC靶向性Fc-ALN2治疗明显且显著地抑制了肿瘤生长。令人惊讶的是,在第21天,仅在TNC-Fc-ALN2+PD-L1治疗组中发现了一些未检测到肿瘤的小鼠,即在六只动物中有三只。
实施例20:ALN2的双特异性靶向
如前文所描述,产生FAP靶向性ALN2、NKp46靶向性ALN2以及以下双特异性ALN2并从ExpiCHO上清液中纯化:
●NKp46-Fc-ALN2(NKp46 VHH-hFc3(序列如下)+hFc4-hIL-2_R38A_F42K_N88G的组合)。该构建体将ALN2靶向NK细胞。
●NKp46-CD8-Fc-ALN2(NKp46 VHH-hFc3+CD8 VHH-hFc4-hIL-2_R38A_F42K_N88G的组合;序列如下)。该构建体将ALN2靶向NK细胞和CD8细胞两者。
●FAP-Fc-ALN2(FAP VHH-hFc3(序列如下)+hFc4-hIL-2_R38A_F42K_N88G的组合)。该构建体通过FAP特异性VHH将ALN2靶向肿瘤或癌症相关成纤维细胞。
●FAP-CD8-Fc-ALN2(FAP VHH-hFc3+CD8 VHH-hFc4-hIL-2_R38A_F42K_N88G的组合;序列如下)。该构建体通过FAP特异性VHH将ALN2靶向肿瘤或癌症相关成纤维细胞以及CD8细胞。
通过如实施例13所描述分析STAT5的磷酸化,在小鼠脾细胞上验证了NKp46-CD8-ALN2的效力和特异性。图53显示,非靶向性Fc-ALN2在浓度高达10μg/ml时在CD8细胞中不诱导pSTAT5,而在NK细胞中仅在EC50估计值(由于在10μg/ml时未达到最大信号,因此为外推数据)约为5μg/mL时才产生轻微效应。CD8和NK细胞可同时被双特异性构建体刺激,其EC50分别为约46(相对于非靶向>200倍窗口)和2ng/ml(相对于非靶向为约2500倍窗口),这至少与CD8或NKp46单特异性ALN2相似。
作为上述实验的后续,如前文所描述产生了另外2个双特异性构建体并从ExpiCHO上清液中纯化:
●CD8_PD-1_Fc-ALN2(PD-1VHH-hFc3+CD8 VHH-hFc4-hIL-2_R38A_F42K_N88G的组合)。
●CD8_PD-L1_Fc-ALN2(PD-L1 VHH-hFc3+CD8 VHH-hFc4-hIL-2_R38A_F42K_N88G的组合)
评估这些构建体在MC38荷瘤小鼠中的抗肿瘤效应。这些小鼠在肿瘤大小为约100-200mm3时接受一次静脉内治疗,或间隔3-4天重复治疗,每2至3天评估肿瘤大小。
在本实验中使用的序列:
●mNKp46 VHH-hFc3(SEQ ID NO:525)
●mFAP VHH-hFc3(SEQ ID NO:526)
●mPD-L1 VHH-hFc3(SEQ ID NO:527)
●mTNC VHH-hFc3(SEQ ID NO:528)
●mCD8 VHH-hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:529)
●mPD-1VHH-hFc3(SEQ ID NO:530)
实施例21:用D20E和N88G CD8-Fc-ALN2变体激活CD8细胞
通过在FACS中分析激活标记物CD25(IL-2Rα链)和PD-1的细胞表面表达,评估了人CD8靶向性IL-2变体的选择性激活,该变体具有消除对IL-2Rα链的活性的“无α”突变(R38A_F42K)和可恢复的功能丧失型β突变(hCD8-Fc-ALN2_N88G或hCD8-Fc-ALN2_D20E)的组合。五天后监测三名PBMC供体中的表达。数据(三名供体的平均值)绘制于图54中,清楚地表明这些突变体的CD8靶向允许相对于脱靶细胞在CD8阳性细胞中这些标记物的选择性上调(由此激活)。
此外,在携带MDA-MB-231肿瘤的具有人免疫系统的免疫缺陷小鼠(HIS小鼠)中,相同的人CD8靶向性ALN2分子仅在CD8阳性T淋巴细胞中有效且特异性地诱导STAT5磷酸化(在注射后45分钟分析)(图55)。通过对2日龄NSG幼仔进行人脐带血CD34阳性干细胞照射和肝内注射,获得人源化HIS小鼠;荷瘤HIS小鼠在6月龄时静脉内注射hCD8-Fc-ALN2。
与人CD8靶向性变体类似,小鼠CD8靶向性Fc-ALN2变体是通过“无α”突变与可恢复的功能丧失型β链突变D20E或N88G(已在前面的实施例中使用)的组合产生的,如下:
●mCD8-Fc-IL-2_R38A_F42K_D20E:mCD8 VHH-hFc3+hFc4-IL-2_R38A_F42K_D20E
●mCD8-Fc-IL-2_R38A_F42K_N88G:mCD8 VHH-hFc3+hFc4-IL-2_R38A_F42K_N88G
如上文所描述表达和纯化变体,并通过测量6天后CD25的细胞表面表达的上调,在小鼠脾细胞上测试CD8阳性细胞的激活(图56)。R38A_F42K_D20E和R38A_F42K_N88G变体均以选择性和可比较的方式明显增加该激活标记物的表达,即在CD8阳性细胞中有明显效应,但在脱靶(CD8阴性)细胞中没有效应。
在该实施例中使用以下氨基酸序列:
○mCD8 VHH-hFc3(SEQ ID NO:495)
○hCD8 VHH-hFc3(SEQ ID NO:483)
○hFc4-hIL-2_R38A_F42K_N88G_C125A(SEQ ID NO:335)
○hFc4-IL-2_R38A_F42K_D20E(SEQ ID NO:332)
实施例22:D20E和N88G CD8-ALN2变体的抗肿瘤效应
为了在MC38肿瘤模型中进行评估,对C57B1/6J小鼠(雌性,9周龄)皮下注射6E+5个MC38细胞。六天后,开始治疗:小鼠静脉内接受(1)缓冲液,(2)靶向性CD8-Fc-ALN2(12.5μg/小鼠),或(3)等摩尔量的非靶向性Fc-ALN2(10.7μg/小鼠),两次(第6天和第9天)。
●CD8-Fc-IL-2_R38A_F42K_D20E:mCD8 VHH-hFc3(SEQ ID NO:495)+hFc4-IL-2_R38A_F42K_D20E(SEQ ID NO:333)
●CD8-Fc-IL-2_R38A_F42K_N88G:mCD8 VHH-hFc3(SEQ ID NO:495)+hFc4-IL-2_R38A_F42K_N88G(SEQ ID NO:335)
●Fc-IL-2_R38A_F42K_N88G:VHH-hFc3(SEQ ID NO:369)+hFc4-IL-2_R38A_F42K_N88G(SEQ ID NO:335)
●Fc-IL-2_R38A_F42K_N88G:VHH-hFc3(SEQ ID NO:369)+hFc4-IL-2_R38A_F42K_D20E(SEQ ID NO:332)
每周测量肿瘤大小三次,平均生长曲线绘制于图57中,结果表明,在两种非靶向性对应物都没有作用的情况下,基于D20E的CD8-Fc-ALN2至少与基于N88G的CD8-Fc-ALN2一样有效。
实施例23:MC38肿瘤模型中α:γALN2的体内评估
在该实施例中,分析了“无α”突变与可恢复的功能丧失型γ突变的组合的抗肿瘤功效。如前文所描述将以下构建体在原代脾细胞中表达、纯化并测试STAT5磷酸化:
●CD8-Fc-IL-2_R38A_F42K_Q126G:mCD8 VHH-hFc3(SEQ ID NO.495)+hFc4-IL-2_R38A_F42K_Q126G(SEQ ID NO.522)
●CD8-Fc-IL-2_R38A_F42K_Q126I:mCD8 VHH-hFc3(SEQ ID NO.495)+hFc4-IL-2_R38A_F42K_Q126I(SEQ ID NO.523)
●CD8-Fc-IL-2_R38A_F42K_Q126Y:mCD8 VHH-hFc3(SEQ ID NO.495)+hFc4-IL-2_R38A_F42K_Q126Y(SEQ ID NO.524)
图58中的数据显示“无α”突变与Q126G或Q126Y的组合产生具有相当活性的ALN2变体(EC
对于体内评估,对C57B1/6J小鼠(雌性,9周龄)皮下注射6E+5个MC38细胞。六天后,开始治疗:小鼠在在第6、9和13天静脉内接受(1)缓冲液,(2)CD8-Fc-ALN2(12.5μg/小鼠),(3)CD8-Fc-ALN2(4.17μg/小鼠),(4)等效的非靶向性ALN2(12.5μg/小鼠),或(4)等效的非靶向性ALN2(3.57μg/小鼠)。第17天(即最后一次治疗后4天)的肿瘤大小以平均值+/-SEM(n=7)绘制于图59中。图59中可看出,α:γALN2能够剂量依赖性地显著延迟肿瘤生长,CD8靶向性ALN2具有优异的效果。
实施例24:β:γ组合的体内评估
如前文所描述将ALN2变体CD8-Fc-IL-2_N88G_Q126G(mCD8 VHH-hFc3(SEQ ID NO:495)+hFc4-IL-2_N88G_Q126G)在ExpiCHO中表达并从上清液中纯化:
○hFc4-IL-2_R38A_F42K_N88G_C125A_Q126G(SEQ ID NO:531)
对于体内评估,对C57B1/6J小鼠(雌性,9周龄)皮下注射6E+5个MC38细胞。六天后,开始治疗:小鼠在在第6、9和13天静脉内接受(1)缓冲液,(2)CD8-Fc-ALN2(4.17μg/小鼠),(3)CD8-Fc-ALN2(1.4μg/小鼠),(4)等效的非靶向性ALN2(3.57μg/小鼠),或(4)等效的非靶向性ALN2(1.19μg/小鼠)。第17天(即最后一次治疗后4天)的肿瘤大小以平均值+/-SEM(n=7)绘制于图60中。图60中可看出,β:γALN2能够剂量依赖性地显著延迟肿瘤生长,CD8靶向性ALN2具有优异的效果。
实施例25:特异性靶向表达IL-2Rα链的细胞的IL-2变体的筛选
在之前的实施例中,将β(D20或N88)和γ(Q126)减毒突变组合以形成具有完整IL-2Rα结合位点的β:γALN2变体,并且使用CD8靶向来增加相对于例如Treg对激活的CD8阳性细胞的选择性。不幸的是,此类ALN2变体的表达不佳。因此,作为β和γ突变组合的替代方案,重新筛选了实施例3中表现为不可恢复的β突变(D20和N88)。实施例3中β突变体的初始筛选是在“静息”或未激活的CD8阳性PBMC上进行的,这些PBMC对IL-2Rα表达呈阴性。在该实施例中,在表达功能性三聚体α:β:γIL-2受体的细胞上重新筛选D20和N88突变体。为此,对稳定表达人CD8(HEK-Blue CD8)或人NKp46(HEK-Blue NKp46)的HEK-Blue IL-2细胞(InvivoGen)中的信号传导进行了分析。D20(图61)和N88(图62)变体的数据令人惊讶地说明,对于许多突变体(例如D20F、D20G、D20H、D20I、D20K、D20L、D20N、N88E、N88I、N88K、N88Q、N88R和N88V),信号传导明显减弱(与CD8-Fc-IL2相比),并且这种活性损失至少部分地可以在CD8靶向后恢复(HEK-Blue CD8与HEK-Blue NKp46细胞),而在功能性二聚体β:γIL-2受体上筛选时,这些突变体的情况并非如此。
等效方案
尽管已经结合本发明的具体实施方案描述了本发明,但应当理解,总体来说,按照本发明的原理,能够进行进一步修改并且本申请意在涵盖本发明的任何变化方案、用途或改编,并且包括如在本发明所属领域内的已知或惯用实践范围内和如可以应用于上文所阐述的基本特征和如下所附权利要求书范围内的对本公开的背离。
本领域技术人员仅仅使用常规实验就将认识到或者能够确定本文具体描述的具体实施方案的众多等效方案。此类等效方案意图涵盖在以下权利要求书的范围内。
以引用方式并入
本文引用的所有专利和出版物特此都以引用方式整体并入。
本文讨论的出版物只提供其在本申请提交日期之前的公开内容。在本文中不应被解释为承认本发明由于在先发明而无权先于此类出版物。
如本文所使用,所有标题都只用于组织,而非意在以任何方式限制本公开。任何个别部分的内容都可以同样适用于所有部分。
- 蛋白质与配体分子的亲和力预测方法及装置
- 基于分子描述符的蛋白质-配体亲和力预测方法
