体液转运装置及体液运转方法
文献发布时间:2023-06-19 13:48:08
技术领域
本发明涉及医疗器械领域,具体为一种体液转运装置及体液运转方法。
背景技术
体液转运泵一般用于将病变部位产生的体液转运至膀胱,再由膀胱排出至体外,但由于病变部位产生的炎症体液常含有细菌、癌细胞等有害物质,因此病变部位的体液通过现有的体液转运泵转运至膀胱后,会使体液含有的细菌及癌细胞等有害物质在膀胱内产生定植风险,容易对病人造成二次伤害。
发明内容
基于此,有必要针对上述技术问题,提供一种体液转运装置。
本发明提供一种体液转运装置,包括导管、泵体及灭活模块,所述导管具有进液端及出液端,所述泵体设置于所述进液端与所述出液端之间,所述灭活模块设置于所述泵体与所述出液端之间,所述泵体用于将所述导管中的体液从所述进液端方向输送至所述出液端方向,所述灭活模块用于灭活所述体液中的细胞。
如此设置,病变部位产生的含有细菌、癌细胞等有害物质的体液能够通过体液转运装置的灭活模块被灭活,降低了体液转运至膀胱后可能对人体造成二次伤害的风险,也避免了体液排出体外后对环境造成污染的可能性。
为了避免体液产生回流,在本发明其中一个实施例中,所述体液转运装置还包括至少一个单向阀,所述单向阀使所述体液仅沿所述进液端方向流向所述出液端方向;
至少一个所述单向阀设置于所述进液端与所述泵体之间;或者,
至少一个所述单向阀设置于所述泵体与所述灭活模块之间;或者,
至少一个所述单向阀设置于所述灭活模块与所述出液端之间。
如此设置,流向为进液端至出液端的单向阀能够保证病变部位产生的体液可以持续或间续的向病变部位外排出,避免带有炎症的体液回流至病变部位。
为了给体液提供灭活场所,在本发明其中一个实施例中,所述灭活模块内设置有灭活腔室,所述灭活腔室与所述导管相连通;且所述灭活腔室的周壁上设有能够自密封的穿刺窗。
如此设置,体液能够从导管流入到灭活腔室中等待被灭活,灭活腔室设有的穿刺窗能够供外部抽取体液测定细胞参数或者供外部向灭活腔室中注入药剂溶液等进行灭活,且穿刺窗由于具有自密封性,因此也能够保证体液不会漏出或溢出。
为了对灭活腔室中的体液进行灭活,在本发明其中一个实施例中,所述灭活模块还包括灭活单元及驱动器,所述灭活单元及所述驱动器均设置于所述灭活腔室;所述灭活单元用于灭活所述体液,所述驱动器连接于所述灭活单元并用于为所述灭活单元供能。
如此设置,驱动器能够为灭活单元供能,以使灭活单元进行灭活工作,灭活腔室中体液所含有的细菌、癌细胞等有害物质将被灭活单元灭活,降低从灭活腔室排出后的体液的有害性,避免对人体或环境造成影响。
为了便于控制灭活单元的启闭,在本发明其中一个实施例中,所述灭活模块还包括控制终端,所述控制终端与所述驱动器耦合连接,所述控制终端用于控制所述驱动器启闭。
如此设置,当体液转运装置植入人体后,医生或者其他操作人员能够从外界通过控制终端控制体内灭活模块进行灭活。
为了对灭活腔室中的体液进行灭活,在本发明其中一个实施例中,所述灭活单元包括至少一组电极组件,每组所述电极组件包括互相配对的第一电极与第二电极,所述第一电极与所述第二电极分别设置于所述灭活腔室相对背离的两侧,所述第一电极及所述第二电极用于在所述灭活腔室内形成脉冲电场。
如此设置,体液中的细菌、癌细胞等有害物质能够被配对电极产生的脉冲电场灭活,降低体液排出体外后对环境产生污染,或者降低体液排出至膀胱后对人体造成二次伤害的可能性。
为了对灭活腔室中的体液进行灭活,在本发明其中一个实施例中,所述灭活单元包括至少一个超声波发生器,所述超声波发生器设置于所述灭活腔室,所述超声波发生器用于向所述灭活腔室内发射超声波。
如此设置,灭活腔室内的体液能够被超声波发生器产生的超声波灭活,进而消除或降低体液中的有害物质,降低体液排出体外后对环境产生污染,或者降低体液排出至膀胱后对人体造成二次伤害的可能性。
为了提高灭活效率,在本发明其中一个实施例中,所述电极组件为多组,多组所述电极组件间序工作。
如此设置,能够提高灭活腔室中脉冲电场的覆盖面积,充分对体液进行灭活。
为了提高灭活效率,在本发明其中一个实施例中,所述超声波发生器为多个,多个所述超声波发生器间序工作。
如此设置,能够提高超声波覆盖范围和强度,保证灭活质量和效率。
一种体液运转方法,所述体液运转方法基于体液转运装置,所述体液运转方法包括:
所述体内目标位置的体液进入所述体液转运装置;
所述体液转运装置灭活所述体液中的细胞;
灭活后的所述体液被输出体外。
如此设置,体内目标位置的体液中的有害物质将被体液转运装置灭活,进而避免体内目标位置的体液对人体造成二次伤害或者对环境造成污染。
为了保证体液中的细胞被充分灭活,在本发明其中一个实施例中,所述体液转运装置灭活所述体液中的细胞之前还包括步骤;
抽取目标位置的所述体液,并测定目标位置的所述体液中的细胞参数,所述细胞参数包括细胞成分及细胞浓度。
如此设置,在灭活之前能够根据体液中的细胞参数相应调整灭活强度、灭活次数、灭活时长等数据,进而能够保证灭活腔室内的体液能够被充分灭活。
为了保证体液中的细胞被充分灭活,在本发明其中一个实施例中,所述体液转运装置灭活所述体液中的细胞包括:
根据目标位置的所述体液中的细胞参数,设定灭活参数,所述体液转运装置依据所述灭活参数灭活所述体液中的细胞。
如此设置,能够根据细胞参数调整体液转运装置的灭活参数,例如灭活强度、灭活次数、灭活时长等数据,进而保证灭活腔室内的体液能够被充分灭活。
为了灭活体液中的细胞,在本发明其中一个实施例中,所述体液转运装置还包括灭活腔室及灭活单元,所述灭活单元设置于所述灭活腔室,所述灭活单元包括电极组件或超声组件;
所述体液转运装置灭活所述体液中的细胞包括:
所述电极组件在所述灭活腔室内产生脉冲电场,所述体液中的细胞被所述脉冲电场灭活;或者,
所述超声组件向所述灭活腔室内发射超声波,所述体液被所述超声波灭活。
如此设置,灭活腔室内的体液能够被电极组件产生的脉冲电场或者超声组件产生的的超声波充分灭活。
为了灭活体液中的细胞,在本发明其中一个实施例中,所述体液转运装置包括灭活腔室,所述体液转运装置灭活所述体液中的细胞包括:
向所述灭活腔室内注射灭活药剂灭活所述体液中的细胞。
如此设置,灭活腔室内的体液能够直接被灭活药剂直接灭活,方便迅速。
为了避免未被灭活的体液被排出体液转运装置,在本发明其中一个实施例中,所述灭活后的所述体液被输出体外包括:
预设体积的灭活后的所述体液被所述体液转运装置输送至膀胱,然后由膀胱输出体外;其中,预设体积为所述灭活腔室容积的1%~50%。
如此设置,能够较大限度的避免未被灭活的体液被排出至体外或者膀胱中。
附图说明
图1为本发明提供的体液转运装置的第一个实施例结构示意图;
图2为本发明提供的体液转运装置的第二个实施例结构示意图;
图3为本发明提供的体液转运装置的第三个实施例结构示意图。
主要元件符号说明:
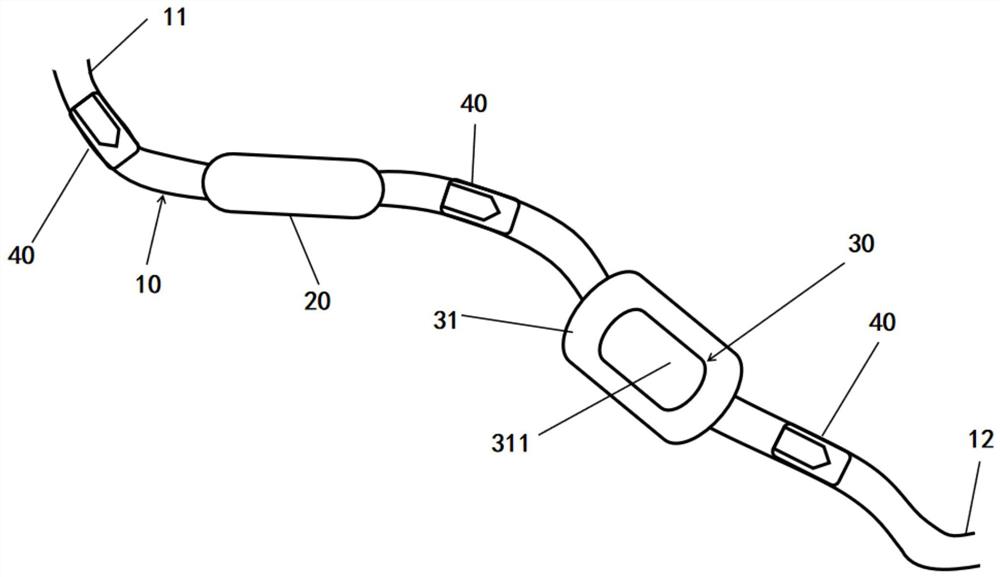
100、体液转运装置;10、导管;11、进液端;12、出液端;20、泵体;30、灭活模块;31、灭活腔室;311、穿刺窗;32、灭活单元;321、第一电极;322、第二电极;323、超声波发生器;33、驱动器;40、单向阀。
以上主要元件符号说明结合附图及具体实施方式对本发明作进一步详细的说明。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,当组件被称为“安装于”另一个组件,它可以直接在另一个组件上或者也可以存在居中的组件。当一个组件被认为是“设置于”另一个组件,它可以是直接设置在另一个组件上或者可能同时存在居中组件。当一个组件被认为是“固定于”另一个组件,它可以是直接固定在另一个组件上或者可能同时存在居中组件。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“或/及”包括一个或多个相关的所列项目的任意的和所有的组合。
参见图1,图1为本发明提供的体液转运装置100的第一个实施例结构示意图;本发明提供一种体液转运装置100,应用于人体病变部位体液的转运与灭活,可以理解,在其他实施例中,本发明提供的体液转运装置100也可以应用于其他需要进行体液转运的部位或者场景。
本发明提供的一种体液转运装置100,包括导管10、泵体20,导管10具有进液端11及出液端12,泵体20设置于进液端11与出液端12之间,泵体20用于将导管10中的体液从进液端11方向输送至出液端12方向。
在使用过程中,进液端11放置在体内产生体液的病变部位,泵体20作为液体流动的主要动力来源,能够使处于体液位置的体液通过导管10的进液端11转运至导管的出液端12。可以理解,体液位置不限于腹腔、胸腔、盆腔、颅内和皮下;出液端12可设置在膀胱内,如此,体液能够通过出液端12进入膀胱并依从于人体自发的排尿反射动作排出体外。可以理解,出液端12也可直接设置在体外,使体液直接排出体外。
体液转运泵一般用于将病变部位产生的体液转运至膀胱,再由膀胱排出至体外,但由于病变部位产生的炎症体液常含有细菌、癌细胞等有害物质,因此病变部位的体液通过现有的体液转运泵转运至膀胱后,会使体液含有的细菌及癌细胞等有害物质在膀胱内产生定植风险,容易对病人造成二次伤害。
基于此,本发明提供的体液转运装置100还包括灭活模块30,灭活模块30设置于泵体20与出液端12之间,灭活模块30用于灭活体液中的细胞。
如此,体液位置处的体液能够从进液端11转运经至灭活模块30进行灭活后再从灭活模块30转运至出液端12,保证了体液转运至膀胱后不会对膀胱造成二次伤害,或者避免了体液直接排出体外造成环境污染。
可以理解,导管10可采用末端开口式或者头端封闭式,导管10的进液端11和出液端12还可以设置有沿长导管10周长分布的微孔,以避免蛋白或者矿物质堵塞、大网膜组织或成纤维组织包裹造成的导管10失效。
在本实施例中,体液转运装置还包括至少一个单向阀40,单向阀40使体液仅沿进液端11方向流向出液端12方向;至少一个单向阀40设置于进液端11与泵体20之间;或者,至少一个单向阀40设置于泵体20与灭活模块30之间;或者,至少一个单向阀40设置于灭活模块30与出液端12之间。
优选的,在本实施例中,共设置有三个单向阀40,三个单向阀40分别设置在进液端11与泵体20之间、泵体20与灭活模块30之间以及灭活模块30与出液端12之间。三个单向阀40的转运方向相同,均为从导管的进液端11方向转运至出液端12的方向,单向阀40具有止逆功能,只保证体液流向为正向即进液端11至出液端12的方向时开启,反向则无法转运。单向阀40还具有自锁紧功能,即反向逆流压力越大,单向阀40的锁定就越紧密,可以理解,满足上述功能的单向阀结构包括但不限于鸭嘴阀、球阀、玫瑰阀等。
可以理解,在其他实施例中,单向阀40设置个数不限于三个,只要能够保证体液转运装置正常的运转即可。
此外,为保证液体正向流速受到控制,单向阀40还需具有一定的开启压力,在本实施例中,优选的,开启压力范围设定在80Pa-150Pa。可以理解,在其他实施例中,开启压力范围不限于80Pa-150Pa,只要能够保证体液转运装置正常运转,开启压力可根据实际情况设定。
可以理解,泵体20可采用电力驱动或者磁力驱动,泵体20的结构包括但不限于齿轮泵、蠕动泵、隔膜泵、振动泵、轴流泵等。在本实施例中,由于出液端12优选设置在膀胱内,因此,为了保证体液的转运,避免病变部位位置压力小于膀胱压力而无法正常转运体液,泵体20输出的压力差在本实施例中优选为2mmHg~25mmHg。所述压力差为泵体20入口(即靠近进液端11的端口)与出口(即靠近灭活模块30端口)的压力差值。
在本实施例中,灭活模块30内设置有灭活腔室31,灭活腔室31与导管10相连通;且灭活腔室31的周壁上设有能够自密封的穿刺窗311。
操作人员能够通过穿刺窗311向灭活腔室31注射灭活药剂对灭活腔室31内的体液进行灭活,在本实施例中,灭活腔室31由具有良好生物安全性和生物惰性的硬质材料制成,包括但不限于聚氨酯、聚醚醚酮、聚甲醛、聚砜、聚碳酸酯等。且硬质材料能够保证腔体内部存在固定容量的体液,保证灭活的质量。
此外,在本实施例中,作为优选,穿刺窗311包括但不限于由医用硅胶、医用聚氨酯等弹性体制成,可以理解,在其他实施例中,只要能够保证穿刺窗311具有自密封性能,即穿刺后穿刺损伤部位能够自动闭合不发生漏液的情况下,穿刺窗311也可采用其他适合的材料制成。
作为优选,穿刺窗311采用的弹性体材料还具有一定的硬度,其硬度范围为40A-85A,进一步的,在本实施例中,优选为55A-75A。
同时,在本实施例中,优选的,灭活腔室31在结构组装时对穿刺窗311存在一定的压缩量,横纵向压缩量均优选为穿刺窗311原尺寸的20%-50%,可以理解,只要保证穿刺窗311被穿刺后能够自密封不发生漏液,在其他实施例中,横纵向压缩量可根据实际需求设定为其他范围。
参见图2及图3,图2为本发明提供的体液转运装置100的第二个实施例结构示意图;图3为本发明提供的体液转运装置100的第三个实施例结构示意图。
本发明还提供有第二个实施例与第三个实施例,第二个实施例与第三个实施例与第一个实施例的发明构思相同,区别在于,在第二个实施例与第三个实施例中,灭活模块30还包括灭活单元32及驱动器33,灭活单元32及驱动器33均设置于灭活腔室31;灭活单元32用于灭活体液,驱动器33连接于灭活单元并用于为灭活单元32供能。
灭活模块30还包括控制终端,控制终端与驱动器33耦合连接,控制终端用于控制驱动器33启闭。即控制终端能够为驱动器33提供能量以及向驱动器33发送控制指令,进而灭活单元32能够在控制终端及驱动器33的共同作用下进行工作,以杀灭灭活腔室31中固定容量液体中的细菌或者癌细胞等有害物质。
同时,在第二个实施例与第三个实施例中,控制终端也能够为泵体20提供能量及发送控制指令,需要注意的是,当泵体20为电力驱动时,控制终端应具备无线充电功能,当泵体20采用磁力驱动时,控制终端应具备输出稳定或交变磁场的功能,可以理解,在其他实施例中,泵体20也可通过其他控制终端或者控制件进行单独控制。
可以理解,控制终端为驱动器33提供能量包括但不限于无线充电、感应线圈充电、超声能量传输等模式。
优选的,控制终端可以通过NFC模式为泵体20及驱动器33提供相关控制指令。
在本发明第二个实施例中,灭活单元32包括至少一组电极组件,每组电极组件包括互相配对的第一电极321与第二电极322,第一电极321与第二电极322分别设置于灭活腔室31相对背离的两侧,第一电极321及第二电极322用于在灭活腔室31内形成脉冲电场。可以理解,只要不影响第一电极321与第二电极322正负配对产生脉冲强电场,第一电极321与第二电极322的位置可以互相调换。
电极组件为多组,多组电极组件间序工作。优选的,电极组件为三组,三组电极组件间序工作。控制终端能够通过驱动器使三组电极组件单独/成对/序列/共同工作,电极组件产生的脉冲强电场,能够使细菌或者癌细胞等有害物质的细胞膜发生不可逆的穿孔甚至细胞破裂,导师细胞器散失或细胞死亡,以达到灭活体液的目的。可以理解,在其他实施例中,根据实际需求,电极组件也可设置为一组、两组或者四组以上。
在本实施例中,优选的,脉冲波宽为10~200ms,电场强度为1000~3000V/cm。
优选的,为了避免电极间短路,在实施例中,三组电极组件是间序工作的,即同时有且只有一对配对电极在启动状态,其他组配对电极处于关闭状态。
为了保证灭活或者减少体液中有害细胞的效果,同时为了避免灭活腔室31内液体电离,具体的,脉冲波宽优选为80ms~150ms,电场强度1500V/cm~2500V/cm;每组脉冲以0.5Hz~2Hz的频率重复60~120个脉冲循环,每组脉冲循环间缓冲500ms,每组配对电极工作3遍,即可保证灭活/减少效果。可以理解,在其他实施例中,上述灭活参数可根据具体情况调整设定。
在本发明第三个实施例中,灭活单元32包括至少一个超声波发生器323,超声波发生器323设置于灭活腔室31,超声波发生器323用于向灭活腔室31内发射超声波。
超声波发生器323为多个,多个超声波发生器323间序工作,优选的,在本实施例中,超声波发生器323为三个。在控制终端与驱动器33的共同作用下,三个超声波发生器可同时工作,也可轮流交替进行工作。
超声波发生器在驱动器33的驱动下可发出超声波,优选的,超声波频率为20KHz-60KHz,能量密度为0.2W/cm
为了在保证灭活效果的同时,避免灭活腔室31内温度过高,优选的,超声波发生器323在连续工作3~10s后即停机20s以上等待液体降温,0.5Hz频率间序工作,工作—停机循环重复5遍以上即可。可以理解,在其他实施例中,超声波发生器323的工作时间和间隔时间以及循环次数可根据具体情况设置,只要不影响对体液的灭活效果即可。
在本发明中,还提供有一种体液运转方法,体液运转方法基于体液转运装置100,体液运转方法包括:
体内目标位置的体液进入体液转运装置100;
体液转运装置100灭活体液中的细胞;
灭活后的体液被输出体外。
在其中一个实施例中,优选的,体液转运装置100包括灭活腔室31,体内目标位置的体液进入体液转运装置100之前还包括步骤:
向灭活腔室31内注入生理盐水。
在其中一个实施例中,优选的,体液转运装置100灭活体液中的细胞之前还包括步骤;
抽取目标位置的体液,并测定目标位置的体液中的细胞参数,细胞参数包括细胞成分及细胞浓度。体液转运装置100灭活体液中的细胞包括:
根据目标位置的体液中的细胞参数,设定灭活参数,体液转运装置100依据灭活参数灭活体液中的细胞。
可以理解,细胞参数包括但不限于细胞成分、细胞浓度等,灭活参数根据具体情况包括但不限于频率、能量密度、间隔时间、工作顺序及循环次数等。
在其中一个实施例中体液转运装置100还包括灭活腔室31及灭活单元32,灭活单元32设置于灭活腔室31,灭活单元32包括电极组件;
体液转运装置100灭活体液中的细胞包括:
电极组件在灭活腔室31内产生脉冲电场,体液中的细胞被脉冲电场灭活。
在其中一个实施例中,优选的,电极组件为多组;电极组件在灭活腔室31内产生脉冲电场,体液被脉冲电场灭活包括:
每组电极组件在灭活腔室31内间序产生脉冲电场,体液被脉冲电场灭活。
其中,间序是指多组电极组件交替进行工作,同时间仅一对配对电极工作,可以理解,多组电极组件可交叉工作也可循环工作。
在其中一个实施例中,体液转运装置100还包括灭活腔室31及灭活单元32,灭活单元32设置于灭活腔室31,灭活单元32包括超声组件;
体液转运装置100灭活体液中的细胞包括:
超声组件向灭活腔室31内发射超声波,体液被超声波灭活。
在其中一个实施例中,超声波发生器323为多个;优选的,超声组件包括三个超声波发生器323,可以理解,在其他实施例中,超声组件也可设置为一个、两个或者四个以上。多个超声波发生器可同时工作,也可轮流交替进行工作。
在其中一个实施例中,体液转运装置100还包括控制终端、驱动器33及泵体20,控制终端设置在体外,驱动器33及泵体20均设置于体内,控制终端与驱动器33及泵体20耦合连接,驱动器33为灭活单元32供能,泵体20用于将体液输送至灭活腔室31;
体液中的细胞在体液转运装置100内被灭活之前还包括步骤:
测试体外的控制终端是否能够控制体内的驱动器33、灭活单元及/或泵体20正常工作。可以理解,驱动器的正常工作是指,控制终端能够控制体内的驱动器33的启闭并且调节驱动器33的运转功率;泵体20的正常工作是指,控制终端能够控制泵体20的启闭及运转功率;灭活单元32的正常工作是指,控制终端控制驱动器33开启后,驱动器33能够带动灭活单元32运转,并且控制终端能够控制灭活单元32的启闭以及控制灭活单元32调整灭活参数(例如当灭活单元32为多组匹配电极时,灭活参数包括但不限于电极的正负极设置、电场强度、电极的脉冲波宽、脉冲频率、间隔时间、电极工作次数等;当灭活单元32为超声波发生器时,灭活参数包括但不限于超声波频率、能量密度、超声组件工作时间、工作次数等)。
在其中一个实施例中,体液转运装置100包括灭活腔室31,体液转运装置100灭活体液中的细胞包括:
向灭活腔室31内注射灭活药剂灭活体液中的细胞。
在其中一个实施例中,优选的,灭活后的体液被输出体外包括:
灭活后的体液被体液转运装置100输送至膀胱,然后由膀胱输出体外。
在其中一个实施例中,优选的,所述灭活后的所述体液被所述体液转运装置100输送至膀胱,然后由膀胱输出体外包括:
预设体积的灭活后的体液被体液转运装置100输送至膀胱,然后由膀胱输出体外;其中,预设体积为灭活腔室31容积的1%~50%。
进一步的,预设体积优选为灭活腔室31容积的30%~50%。
具体的,参见图1,在本发明的第一个实施例中,基于图1所示的体液转运装置100,体液运转方法的步骤包括:
通过微创方式将带有细胞灭活功能的体液转运装置100植入体内,其中导管10的进液端11置于目标位置处,出液端12末端优选置于膀胱内,为了便于注射灭活药剂,泵体20及灭活模块30置于真皮层下、筋膜层上,优选距离体表1-2cm处。转运装置其他部分视情况可置于产生体液的目标位置、皮下或者膀胱内。
优选的,体液转运装置100植入体内后,通过注射器或者其他可医疗工具利用穿刺窗311进行皮下穿刺,向灭活腔室31内注入生理盐水,通过体液转运装置开启泵体20,使灭活腔室内以及导管内的气体排出,以此保证转运体液的顺畅性和转运效率。可以理解,在其他实施例中,也可不注入生理盐水。
通过注射器抽取一定量的目标位置的体液,通过医学化验手段分析目标位置的体液中细胞参数,例如细胞浓度、细胞种类(含有细菌或者癌细胞或者细菌与癌细胞的混合物)等。
根据细胞参数,调整灭活参数,例如选择合适的灭活药剂,调整灭活药剂的浓度、用量(用量可参照膀胱的容量,一般采用500ml)等,然后将调整好灭活参数的预设浓度的灭活药剂通过穿刺窗311注入至灭活腔室31内。可以理解,灭活药剂包括但不限于抗生素或者抗癌药物等;同时,注射所用的医疗用具包括但不限于蝶翼无损伤针、留置针等注射针,根据实际情况也可在注射针的尾端直接连接注射器或者其他延长管来辅助预设浓度灭活药剂的注入。
灭活药剂对体液完成灭活后,控制泵体20继续转运体液,使体液通过膀胱排出体外或者直接排出体外,优选的,单次转运体液的转运量为灭活腔室31的1%-50%,以最大程度避免排出的体液内含有未被灭活的细胞,同时通过上述注射器或者药物输注设备持续输入预设浓度的具有针对性的灭活药剂。
灭活腔室31内的体液与灭活药剂的混合物到达膀胱后,灭活药剂仍能继续发挥灭活作用,直至出现排尿反映,使灭活后的体液排出至体外。
参见图2,在本发明的第二个实施例中,基于图2所示的体液转运装置100,体液运转方法的步骤包括:
通过微创方式将带有细胞灭活功能的体液转运装置100植入体内,其中导管10的进液端11置于目标位置处,出液端12末端优选置于膀胱内,为了便于注射灭活药剂,泵体20及灭活模块30置于真皮层下、筋膜层上,优选距离体表1-2cm处。转运装置其他部分视情况可置于产生体液的目标位置、皮下或者膀胱内。
体液转运装置植入体内后,通过体外控制终端测试泵体20级灭活模块30是否能够正常工作。
进一步,优选的,体液转运装置100植入体内后,通过注射器或者其他可医疗工具利用穿刺窗311进行皮下穿刺,向灭活腔室31内注入生理盐水,通过体液转运装置100开启泵体20,使灭活腔室31内以及导管10内的气体排出,以此保证转运体液的顺畅性和转运效率。可以理解,在其他实施例中,也可不注入生理盐水。
通过注射器抽取一定量的目标位置的体液,通过医学化验手段分析目标位置的体液中细胞参数,例如细胞浓度、细胞种类(含有细菌或者癌细胞或者细菌与癌细胞的混合物)等。可以理解,注射器包括但不限于蝶翼无损伤针、留置针等注射针,根据实际情况也可在注射针的尾端直接连接注射器或者其他延长管来辅助预设浓度灭活药剂的注入。
根据细胞参数,调整灭活参数,具体的,通过体外控制终端开启驱动器33,由驱动器33控制灭活单元的三组电极组件进行间序、循环工作,每对第一电极321与第二电极322之间形成电场强度为3000V/cm,脉冲波宽100ms的脉冲强电场,每组脉冲重复90次,每组配对电极重复3遍,以保证灭活腔室31内的体液被充分灭活。
对体液完成灭活后,通过控制终端挂壁灭活模块30,控制泵体20继续转运体液,使体液通过出液端12转运至膀胱,再由膀胱的排尿反应排出体外,在其他实施例中,也可直接由出液端12排出体外。
优选的,单次转运体液的转运量为灭活腔室31的1%-50%,防止有未被灭活的体液被排放至体外或者膀胱内。具体的,单次转运体液的转运量为灭活腔室31的30%-50%,进一步的,重复灭活及转运过程,直至达到所需转运量。
参见图3,在本发明的第二个实施例中,基于图3所示的体液转运装置100,体液运转方法的步骤包括:
通过微创方式将带有细胞灭活功能的体液转运装置100植入体内,其中导管10的进液端11置于目标位置处,出液端12末端优选置于膀胱内,为了便于注射灭活药剂,泵体20及灭活模块30置于真皮层下、筋膜层上,优选距离体表1-2cm处。转运装置其他部分视情况可置于产生有害体液的目标位置、皮下或者膀胱内。
体液转运装置植入体内后,通过体外控制终端测试泵体20级灭活模块30是否能够正常工作。
进一步,优选的,体液转运装置100植入体内后,通过注射器或者其他可医疗工具利用穿刺窗311进行皮下穿刺,向灭活腔室31内注入生理盐水,通过体液转运装置100开启泵体20,使灭活腔室31内以及导管10内的气体排出,以此保证转运体液的顺畅性和转运效率。可以理解,在其他实施例中,也可不注入生理盐水。
通过注射器抽取一定量的目标位置的体液,通过医学化验手段分析目标位置的体液中细胞参数,例如细胞浓度、细胞种类(含有细菌或者癌细胞或者细菌与癌细胞的混合物)等。可以理解,注射器包括但不限于蝶翼无损伤针、留置针等注射针,根据实际情况也可在注射针的尾端直接连接注射器或者其他延长管来辅助预设浓度灭活药剂的注入。
根据细胞参数,调整灭活参数,具体的,通过体外控制终端开启驱动器33,由驱动器33控制灭活单元的三个超声波发生器323同时或者间序工作,优选的,超声频率为20KHz,能量密度为0.2W/cm
对体液完成灭活后,通过控制终端挂壁灭活模块30,控制泵体20继续转运体液,使体液通过出液端12转运至膀胱,再由膀胱的排尿反应排出体外,在其他实施例中,也可直接由出液端12排出体外。
优选的,单次转运体液的转运量为灭活腔室31的1%-50%,以防止有未被灭活的体液被排放至体外或者膀胱内。具体的,单次转运体液的转运量优选为灭活腔室31的30%-50%,进一步的,重复灭活及转运过程,直至达到所需转运量。
本发明提供一种体液转运装置100,病变部位产生的含有细菌、癌细胞等有害物质的体液能够通过体液转运装置100的灭活模块30被灭活,降低了体液转运至膀胱后可能对人体造成二次伤害的风险,也避免了体液排除体外后对环境造成污染的可能性。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 体液转运装置及体液运转方法
- 外泌体液体活检样本的制备装置和制备方法以及由此制备的外泌体液体活检样本的分析方法
