一种III型人源化胶原蛋白及其制备方法和应用
文献发布时间:2024-04-18 19:44:28
技术领域
本发明涉及合成生物学技术领域,特别涉及一种III型人源化胶原蛋白及其制备方法和应用。
背景技术
胶原蛋白是人体细胞外基质中含量最多的蛋白,对人体细胞和组织发挥正常功能具有至关重要的作用。人体中目前已发现28种不同类型的胶原蛋白,其中I型、II型和III型胶原蛋白占总胶原蛋白含量的85%以上。III型胶原蛋白呈疏网状散布于I型胶原蛋白周围,起到支撑缔结组织的作用,能维持皮肤组织细腻柔滑。人在成年之后,真皮成纤维细胞停止合成III型胶原蛋白,这就导致III型胶原蛋白在皮肤组织中的比例呈逐年下降的趋势。
目前工业胶原蛋白原料主要来源于动物提取,采用酸、碱或酶法提取动物皮肤或骨骼中的胶原蛋白,但存在原料供应不足、批次稳定性低、分离纯化难度高和存在免疫原性等问题,导致下游应用成本较高。近些年来随着合成生物学领域的发展,利用微生物重组表达胶原蛋白逐渐成为新的发展趋势。目前常用的胶原蛋白微生物重组表达系统主要有大肠杆菌、毕赤酵母和酿酒酵母,其中毕赤酵母以其卓越的翻译后修饰和蛋白分泌表达能力受到人们的广泛关注。相比于动植物等真核生物表达系统,毕赤酵母表达系统具有操作简易、可进行高密度发酵,蛋白表达量高、周期短和成本低等优点。相比于大肠杆菌等原核生物,毕赤酵母能够对外源蛋白进行高效的分泌表达,有利于蛋白的分离纯化过程并且不含内毒素。
重组表达胶原蛋白的分离纯化是其规模化生产的限制因素之一,纯化费用常常超过总成本的30%以上,并且重组表达的胶原蛋白往往难以形成完整稳定的三螺旋结构,导致其稳定性较差,蛋白经常在分离纯化过程中降解,生产的重组胶原蛋白生物活性存疑。因此从天然胶原蛋白序列中筛选能够形成三螺旋结构的胶原蛋白功能片段并且进行分泌表达,简化分离纯化工艺,无疑在工业化生产中具有显著的优势。
当前,关于重组表达人胶原蛋白的报道主要集中在全长胶原单链和螺旋区部分片段及部分片段的串联组合表达,相比于全长单链,功能片段的串联表达具有分子量较小,易于分泌表达、产量较高并且具有天然胶原蛋白的功能活性等优势,逐渐成为研究的重点所在。
中国发明专利CN109593126A公开了一种多肽及其生产方法和用途,文中多肽黏附效果优越,在水溶液中稳定性高,但采用大肠杆菌进行表达,需要进行破壁处理,分离纯化工艺较为复杂;专利CN114920826A公开了一种III型类人胶原蛋白,该Ⅲ型类人胶原蛋白水溶性较好,能够在毕赤酵母中可溶性分泌表达,但文中未提及该蛋白是否具有三螺旋结构,在人体细胞微环境中能否稳定发挥作用存在疑问;专利CN102443057A公开了一种重组人源胶原蛋白,含有599个氨基酸,并利用毕赤酵母进行重组表达,但文中未提及所述蛋白的水溶性以及单链是否能够在细胞外自发形成三螺旋结构。
发明内容
为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种III型人源化胶原蛋白。
本发明的另一目的在于提供上述III型人源化胶原蛋白的制备方法。
本发明的再一目的在于提供上述III型人源化胶原蛋白的应用。
本发明的III型人源化胶原蛋白水溶性较好且能够在细胞外自发形成三螺旋结构,能够促进成人成纤维细胞和HaCaT细胞增殖,并且可通过毕赤酵母进行分泌重组表达,简化分离纯化工艺,降低生产成本。
本发明的目的通过下述技术方案实现:
本发明的第一个目的是提供一种III型人源化胶原蛋白,其氨基酸序列为包含SEQID NO.1所示序列的n个重复,n为≥1的整数,优选的n为1~30的整数;进一步优选地n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29和30,其中当n为≥2的整数时,各重复序列之间不含接头,是直接连接的。
优选的,当n=1时,氨基酸序列如SEQ ID NO.1所示,其编码基因的核苷酸序列如SEQ ID NO.4所示。
优选的,当n=10时,氨基酸序列如SEQ ID NO.2所示,其编码基因的核苷酸序列如SEQ ID NO.5所示。
优选的,当n=30时,氨基酸序列如SEQ ID NO.3所示,其编码基因的核苷酸序列如SEQ ID NO.6所示。
所述III型人源化胶原蛋白包含:
1)与SEQ ID NO.1所示的氨基酸序列具有80%以上同源性的氨基酸序列,其保留SEQ ID NO.1的氨基酸序列的细胞增殖效果;
2)在SEQ ID NO.1所示的氨基酸序列中添加、替换、缺失或插入1个或多个氨基酸残基的氨基酸序列,其保留SEQ ID NO.1的氨基酸序列的细胞增殖效果;
3)将SEQ ID NO.1所示序列中的脯氨酸(Pro,P)替换为非天然氨基酸,例如羟脯氨酸(Hyp)、氟脯氨酸(Flp)和氯脯氨酸(Clp)等。羟脯氨酸、氟脯氨酸(Flp)和4-氯脯氨酸可能是4-顺式或4-反式构型,其保留SEQ ID NO.1氨基酸序列的细胞增殖效果;
4)对SEQ ID NO.1所示的氨基酸序列或其所示的序列的n个重复序列中N末端氨基酸进行乙酰化修饰,C末端氨基酸进行酰胺化修饰,其保留SEQ ID NO.1氨基酸序列的细胞增殖效果;
本发明的另一个目的是提供上述III型人源化胶原蛋白的编码基因。
本发明的第三个目的是提供包含所述编码基因的重组表达载体。
所述的重组表达载体是以pPIC9K为载体。
本发明的第四个目的是提供表达所述的III型人源化胶原蛋白的重组菌。
进一步地,所述的重组菌优选以毕赤酵母GS115为宿主。
本发明的第五个目的是提供所述的重组菌株的构建方法,包括如下步骤:将包含III型人源化胶原蛋白编码基因的重组表达载体转化至毕赤酵母GS115感受态细胞中,培养、筛选阳性转化子,得到所述的重组菌。
本发明的第六个目的是提供快速制备III型人源化胶原蛋白的方法,包括如下步骤:将所述的III型人源化胶原蛋白的重组菌以2~10%接种量接种至发酵培养基中,加入甲醇进行诱导发酵48~120h,离心去除菌体,得到含有III型人源化胶原蛋白的上清液,纯化除盐得到所述的III型人源化胶原蛋白。
进一步地,所述的发酵培养基为BMMY培养基,配方为YNB 13.4g/L,生物素4.0×10
所述的甲醇的浓度为0.5%~3%v/v;进一步为1%v/v。
所述的诱导发酵的条件为28~30℃、200~250rpm发酵48~120h;进一步为28℃、250rpm发酵96h。
优选的,所述纯化除盐为:添加硫酸铵I处理,离心、收集上清液,再加入硫酸铵II处理,离心收集沉淀并进行透析,收集上清液得到所述的III型人源化胶原蛋白。
所述硫酸铵I的终浓度为10~50%,所述硫酸铵II的终浓度为55~95%(优选70%)。
所述硫酸铵I处理的时间为1~10h,所述硫酸铵II处理的时间为1~10h。
所述透析膜截留分子量为3~20kDa,优选为5kDa。
所述透析的次数为1~6次,优选为4~6次。
所述透析缓冲液为去离子水、磷酸缓冲液或乙酸缓冲液中的一种。
所述的III型人源化胶原蛋白在生物医药材料或化妆品中的应用。
本发明相对于现有技术具有如下的优点及效果:
本发明提供的III型人源化胶原蛋白氨基酸序列采用100%的人胶原蛋白序列,无免疫原性和内毒素;水溶性较好,可塑性强,具有可加工性;存在三螺旋结构,具有应用于组织工程等领域的潜在价值;并且利用毕赤酵母进行分泌重组表达,产物结构单一,分离纯化工艺简单,有利于工业规模的放大生产。
附图说明
图1是III型人源化胶原蛋白制备流程图。
图2是重组表达III型人源化胶原蛋白发酵上清液SDS-PAGE检测;其中,泳道1:HC1,泳道2:HC10,泳道3:HC30。
图3是重组表达III型人源化胶原蛋白亲疏水性预测;其中,依次对应HC1、HC10、HC30。
图4是纯化后III型人源化胶原蛋白圆二色谱检测。
图5是纯化后III型人源化胶原蛋白对人成纤维细胞增殖的活性检测,注:与空白对照组(Blank)相比,***p<0.001。
图6是纯化后III型人源化胶原蛋白对HaCaT细胞增殖的活性检测,注:与空白对照组(Blank)相比,***p<0.001。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。所使用的材料、试剂等,如无特殊说明,为从商业途径得到的试剂和材料。
下述实施例中涉及到的培养基如下:
LB培养基(g·L
YPD培养基(g·L
MD固体培养基(g·L
BMGY培养基(g·L
BMMY培养基(g·L
培养基均使用去离子水配制,配制完成后121℃灭菌15~20min。
在本发明中,使用的氨基酸序列为GKDGPRGPTGPIGPPGPAGQPGDKGE G(SEQ IDNO.1),其对应核酸序列由SEQ ID NO.4所示。本发明的III型人源化胶原蛋白可以包含多个以SEQ ID NO.1所示的重复序列,条件是重复序列之间不含接头。本发明对重复序列的数目没有限制,只要其能保留SEQ ID NO.1氨基酸序列的增殖效果即可。优选地,重复序列的数目是10个,即包含以SE Q ID NO.2所示序列的蛋白,其对应核酸序列如SEQ ID NO.5所示。
本发明的蛋白包含以SEQ ID NO.1所示的序列或与其氨基酸序列具有80%以上同源性的氨基酸序列,或在其所示序列的n个重复序列中添加、取代、缺失或插入1、2、3、4、5、6、7、8、9、10个氨基酸残基的氨基酸序列,其保留SEQ ID NO.1氨基酸序列的增殖效果。
其中,本发明所述的同源性指的是序列的重合率,可以是两序列直接的数量关系,如部分相同、相似的百分比;还包括两序列在同一位点核苷酸或氨基酸残基完全相同的序列比例;也可以是从某个共同祖先经趋异进化形成的不同的序列。可以通过常规生物信息学方法比对序列信息得到。
氨基酸添加是指在本发明的蛋白氨基酸序列N末端或C末端添加若干个氨基酸,其保留SEQ ID NO.1氨基酸序列的增殖效果。其中,chen等人在人III型胶原蛋白活性序列两端分别延伸若干个氨基酸后,发现对3T3细胞活性无明显影响(Hua,Chen et al.“Characterization by high-resolution crystal structure analysis of a triple-helix region of human collagen type III with potent cell adhesion activity.”Biochemical and Biophysical Research Communications 508(2018):1018-1023.)
氨基酸取代是指对本发明的蛋白氨基酸序列中1、2或3个氨基酸被性质相似或相近的氨基酸所替换而形成的多肽或蛋白。氨基酸的替换形式可以是将Gly替换为Pro或Ala;将Lys替换为Arg、Gln、Asn或His;将Asp替换为Glu;将Pro替换为Ala;将Arg替换为Lys、Gln、Asn或His;将Thr替换为Ser;将Ile替换为Leu、Val、Met、Ala或Phe;将Ala替换为Val、Leu或Ile;将Gln替换为Asn;将Glu替换为Asp,其保留SEQ ID NO.1氨基酸序列的增殖效果。
氨基酸缺失是指从本发明的蛋白氨基酸序列中删除1、2或3个以上氨基酸,其保留SEQ ID NO.1氨基酸序列的增殖效果。其中,Yu等人发现在类胶原N末端删除若干个氨基酸,例如精氨酸、丙氨酸、亮氨酸和天冬氨酸对类胶原三螺旋结构和稳定性无显著影响(Yu,LeTracy et al.“Hollow Octadecameric Self-Assembly of Collagen-like Peptides.”Journal of the American Chemical Society(2023):n.pag.)
氨基酸插入是指在本发明的蛋白氨基酸序列的适当位置插入氨基酸残基,插入的氨基酸残基也可以全部或部分彼此相邻,或插入的氨基酸之间都不彼此相邻,其保留SEQID NO.1氨基酸序列的增殖效果。
本发明中所述的氨基酸优选为L型氨基酸;同时其中的一个或多个(如2-7个、2-6个、2-5个或2-4个)氨基酸也可以用构象为D型的氨基酸、人工修饰的氨基酸、自然界存在的稀有氨基酸等进行替换,以提高蛋白的生物利用度、稳定性和生物活性。其中D型氨基酸是指与组成蛋白质的L型氨基酸相对应的氨基酸;人工修饰的氨基酸指经过甲基化、磷酸化等修饰的组成蛋白质的常见L型氨基酸;自然界存在的稀有氨基酸包括组成蛋白质的不常见氨基酸和不组成蛋白质的氨基酸,例如5-羟基赖氨酸、甲基组氨酸、γ-氨基丁酸、高丝氨酸等。同时包括将脯氨基酸替换为非天然氨基酸,例如羟脯氨酸(Hyp)、氟脯氨酸(Flp)和4-氯脯氨酸(Clp)(PubChem CID:69997622)等。羟脯氨酸(Hyp)、氟脯氨酸(Flp)和氯脯氨酸(Clp)可能是4-顺式或4-反式构型,其保留SEQ ID NO.1氨基酸序列的增殖效果。
本发明的蛋白包含SEQ ID NO.1所示的序列或其所示的序列的n个重复序列,对其氨基酸序列中N末端氨基酸进行乙酰化修饰,C末端氨基酸进行酰胺化修饰,其保留SEQ IDNO.1氨基酸序列的增殖效果。
本发明的III型人源化胶原蛋白制备流程图如图1所示。
实施例1基因表达载体的构建
当n=1时(记为HC1),氨基酸序列如SEQ ID NO.1所示,针对毕赤酵母表达平台进行密码子优化,具体核苷酸序列如SEQ ID NO.4所示。
当n=10时(记为HC10),氨基酸序列如SEQ ID NO.2所示。针对毕赤酵母表达平台进行密码子优化,具体核苷酸序列如SEQ ID NO.5所示。
当n=30时(记为HC30),氨基酸序列如SEQ ID NO.3所示,针对毕赤酵母表达平台进行密码子优化,具体核苷酸序列如SEQ ID NO.6所示。
委托南京金斯瑞生物科技有限公司对SEQ ID NO.4、SEQ ID NO.5和SEQ ID NO.6序列进行全基因合成。将所述合成的全基因序列通过SnaBI(TACGTA)和EcoRI(GAATTC)酶切连接整合到pPIC9K载体上,通过热激法转化到宿主菌株E.coli TOP10中,采用含有氨苄青霉素的LB平板筛选阳性转化子,再用含氨苄青霉素的LB液体培养基进行培养。采用质粒小提试剂盒提取质粒,得到重组表达载体pPIC9K-HC1、pPIC9K-HC10和pPIC9K-HC30。
实施例2重组表达菌株的构建
重组质粒pPIC9K-HC1、pPIC9K-HC10和pPIC9K-HC30采用Sac I限制性内切酶对载体进行酶切线性化,37℃酶切2h。酶切体系如下:
酶切反应完成后同样用PCR产物纯化试剂盒对片段进行纯化,并检测酶切产物浓度。
将纯化后的pPIC9K-HC1、pPIC9K-HC10和pPIC9K-HC30线性化片段通过电转化的方式转入毕赤酵母GS115感受态细胞,具体步骤如下:
1)取20μL线性化质粒,加入到80μL毕赤酵母GS115感受态细胞中,随后转移至预冷的0.2cm电转杯中,并在冰上孵育5min;
2)电击条件:1.5kV,2mm内径电转杯,电击时间3.5~4.5ms;
3)立即加入1mL 1M山梨醇溶液重悬菌体并转移至无菌2mL离心管中;
4)重悬菌体30℃静置2h;
5)电转化后的酵母悬液涂布于MD平板进行筛选,30℃培养2天。
挑选单菌落进行菌落PCR和测序验证。对测序正确的阳性转化子进行保藏用于后续实验。
实施例3重组毕赤酵母摇瓶发酵
1)挑选阳性转化子接种到10mL/50mL YPD培养基中,30℃、250rpm培养18h,然后以1%接种量转接到25mL/250mL BMGY培养基,28℃、250rpm培养菌体OD
2)室温下5000g离心5min收集菌体,用BMMY培养基重悬菌体至OD
3)每24h添加1%甲醇;
4)发酵96h后通过SDS-PAGE检测发酵上清中蛋白表达情况。SDS-PAGE检测结果如图2所示,在4.6kDa、33kDa和95kDa左右有明显条带。
实施例4III型人源化胶原蛋白快速纯化
由于发酵上清中蛋白条带单一且蛋白水溶性较好(图3),因此采用硫酸铵分级沉淀法纯化目的蛋白,具体操作步骤如下:
1)在冰浴条件下,加入终浓度为50%硫酸铵对实施例4中收集的发酵上清液沉淀1h后,在4℃,10000g离心10min,去除沉淀中的杂质,保留上清液;
2)于上清中继续加入硫酸铵使其终浓度为70%,沉淀10h,4℃,10000g离心10min,获得蛋白沉淀;
3)将蛋白沉淀溶于超纯水中,并加入5kDa的透析袋中,在冰浴条件下于超纯水中进行透析,每4~6h换一次超纯水(透析液),共换4~6次以除去硫酸铵离子,将纯化后的蛋白冻干保藏。
实施例5纯化后III型人源化胶原蛋白圆二色谱检测
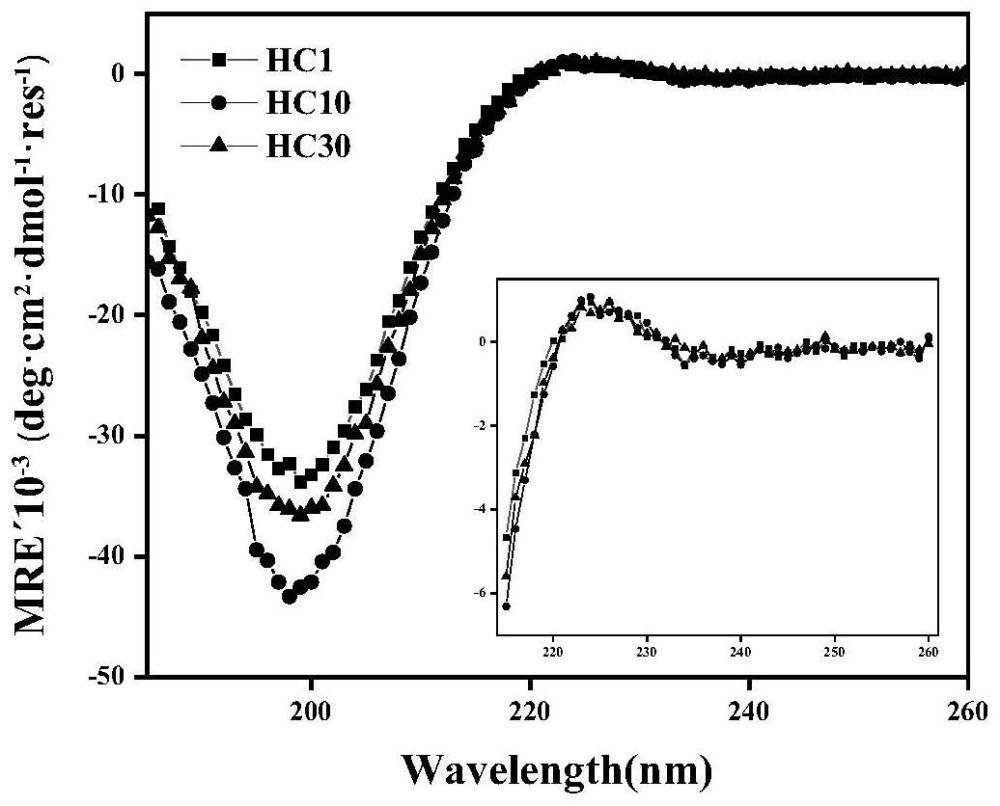
将上述蛋白冻干粉溶解于超纯水中至终浓度为0.2mg/mL,检测前样品预先在4℃平衡24h,4℃在190~260nm范围进行扫描(step 1nm,averaging time 5s)。具有结果如图4所示,可以看出III型人源化胶原蛋白圆二色谱在200nm附近的波长处有明显负峰,在226nm附近的波长处有正峰。表明III型人源化胶原蛋白形成了三螺旋结构。
实施例6细胞增殖测定
采用CCK8法检测III型人源化胶原蛋白对人成纤维细胞和HaCaT细胞(人永生化纤维细胞)增殖的影响,具体实验步骤如下:
1)对提前培养好的人成纤维细胞和HaCaT细胞进行消化、离心、计数;
2)接种100μL 10
3)显微镜下观察细胞生长状态和密度,取生长状态良好,细胞分布及密度均一的细胞进行后续实验;
4)配制10μg/mL的样品溶液,每个样品三个平行,在37℃、5%CO
5)每孔中加入10μL的CCK-8溶液,然后37℃、5%CO
以不加任何样品作为空白对照(Blank),以添加PBS作为对照,以牛III型胶原蛋白(记为牛Collagen)(SouthernBiotech,Bovine Type IIICollagen-Solution,货号:1240-02S)作为阳性对照,结果如图5和6所示,可以看出培养24后,III型人源化胶原蛋白HC1、HC10和HC30能够明显促进成人成纤维细胞和HaCaT细胞增殖,增殖效果与天然牛III型胶原蛋白相当。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
