一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂及其制备方法和应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于纳米药物制剂及核酸疫苗技术领域,更具体的说是涉及一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂及其制备方法和应用。
背景技术
肿瘤高的侵袭性及后期的转移性已严重威胁人类健康,随着新型治疗方式的出现,肿瘤免疫治疗已成为一种有潜力的新型治疗策略,与传统的化疗及手术治疗方式不同,肿瘤免疫治疗方式是通过刺激机体的免疫系统产生强效的免疫效力来杀伤肿瘤细胞,并不会对正常细胞产生较大的影响,在这其中,肿瘤疫苗通过递送肿瘤相关抗原或特异性抗原进入机体组织,诱导抗原提呈细胞成熟,经MHC类分子和T细胞相互作用,产生有效的抗肿瘤免疫效应。与多肽/蛋白疫苗相比,信使RNA(mRNA)疫苗具有更强的有效性,更高的安全性,并且具备快速量产的可能性,因此,mRNA疫苗有望成为治疗肿瘤的有效免疫策略。mRNA疫苗通过向体内递送特定抗原的mRNA序列,并在胞质中翻译为蛋白质,激活机体的免疫系统来达到免疫治疗的目的。但mRNA疫苗在存在良好前景的同时,也存在一些障碍,例如在体内多种酶的作用下,mRNA极不稳定,易被核酸酶讲解。且自身所携带的负电荷使得递送效率较为低下,需要寻求合适的递送载体提高mRNA的递送效率并有效保护mRNA被酶的降解。纳米载体技术可作为有效的策略来解决mRNA递送难题。
肿瘤微环境中NK细胞的浸润程度与肿瘤细胞的状态密切相关。mRNA疫苗所诱导的适应性免疫应答能力也依赖于先天免疫应答能力的增强,而肿瘤微环境中NK细胞的数量较少削弱了适应性免疫应答的效力。NK细胞源于骨髓中造血干细胞,由NK前体细胞分化而来,因其具有MHC非依赖性,无需抗原提呈细胞刺激,便可通过分泌γ-干扰素(IFN-γ),肿瘤坏死因子α(TNF-α)等调节适应性免疫应答途径,直接杀伤肿瘤细胞,可作为CD8
作为一种生物相容性载体,脂质纳米粒的核心空腔可作为包载mRNA的有效部位,脂质纳米粒的生物膜样的结构易于和受体细胞结合,达到更高的转染效果,并可在体内安全降解。阳离子脂质体可更好的负载带负电的核酸药物,兼具载体和佐剂功能,可诱导较强的体液免疫和细胞免疫效力。嘎德莫特作为一种咪唑啉类似物,将其包载于阳离子脂质体中,可经TLR7受体可调节NK细胞的比例,可刺激NK细胞增殖,激活固有免疫辅助细胞免疫应答策略。
黑色素瘤在病程晚期,癌细胞大量扩散,经血管或淋巴管通过血液系统向全身多器官进行转移,常见于肺部的转移,可引起咳嗽咳血等严重症状,严重危害人类的健康,针对黑色素瘤及肺转移的后果,采用肿瘤疫苗治疗的策略在于提升适应性免疫应答的同时,也能增强固有免疫应答能力,通过改善DC细胞,CD8
综上所述,如何构建一种治疗黑色素瘤及其肺转移的mRNA疫苗是本领域技术人员亟需解决的问题。
发明内容
有鉴于此,本发明提供了一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂及其制备方法和应用。
所述的治疗黑色素瘤及其肺转移的mRNA疫苗制剂可利用脂质体复合物共包载抗原特异性mRNA及嘎德莫特,mRNA翻译为蛋白后,经树突状细胞表面MHC分子递送,活化T细胞介导的免疫应答;嘎德莫特通过TLR7在改善CD8
为了实现上述目的,本发明采用如下技术方案:
本发明第一技术目的是提供一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂,所述治疗黑色素瘤及其肺转移的mRNA疫苗制剂是由负载嘎德莫特的阳离子脂质体复合物、鱼精蛋白和mRNA构成;其中,
所述负载嘎德莫特的阳离子脂质体复合物为嘎德莫特吸附于阳离子脂质体上;
所述嘎德莫特和mRNA分别占所述mRNA疫苗制剂质量的1.5%~5%和10~20%;
具体地,所述嘎德莫特通过自组装方式吸附于阳离子脂质体的磷脂层,以形成所述负载嘎德莫特的阳离子脂质体复合物;所述负载嘎德莫特的阳离子脂质体复合物携带的表面电荷通过静电吸附力包裹鱼精蛋白-mRNA缩合物;所述鱼精蛋白-mRNA缩合物是由鱼精蛋白与mRNA按照质量比0.5:1-7:1缩合而得。
该疫苗可实现嘎德莫特与mRNA的共包载,协同发挥抗肿瘤作用,其中嘎德莫特可激动TLR7受体,上调NK细胞的数量;mRNA可翻译为蛋白,经树突状细胞表面分子MHC分子的呈递,诱导活化T细胞免疫效应,协同增强机体先天免疫和适应性免疫能力,用于黑色素瘤及其后期肺转移的治疗。
该疫苗可通过Toll样受体信号通路、细胞毒性T淋巴细胞信号通路、JAK-STAT信号通路、趋化因子信号通路、自然杀伤细胞介导的先天免疫应答等通路发挥抗肿瘤作用,抑制黑色素瘤经典致病途径抑制黑色素瘤增值及其肺转移过程,直接杀伤肿瘤细胞;
优选的,通过TLR7受体激活、CD8
优选的,所述治疗黑色素瘤及其肺转移的mRNA疫苗制剂的粒径为100~500nm,Zeta电位为+10~+25mV,包封率为80~96%,mRNA的载药量为9.5~18%。
进一步地,所述mRNA为肿瘤抗原相关mRNA,包括肿瘤特异性抗原和肿瘤相关抗原;具体地所述mRNA为黑色素瘤抗原A1、酪氨酸酶相关蛋白抗原TRP-2或癌胚抗原、黑色素瘤分化抗原gp-100;所述mRNA优选黑色素瘤分化抗原gp-100,其理论长度为2130nt,在黑色素瘤纤维组织中高表达;所述嘎德莫特为靶向TLR7的咪唑啉类似物,分子量为313.39742,可包载阳离子脂质体中发挥作用。
更进一步地,所述阳离子脂质体由磷脂、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000按照摩尔比2:1:1:0.15~3:2:1:0.4组成;所述阳离子脂质体与嘎德莫特的质量比为25:1~50:1;
所述磷脂为1,2-双十八烯氧基-3-甲基铵丙烷氯盐、溴化三甲基-2,3-二油酰氧基丙基铵、4-(N,N-二甲基氨基)丁酸(二亚油基)甲酯中的一种或几种组合。
本发明第二技术目的是提供一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂的制备方法,所述制备方法采用薄膜分散法,具体操作步骤如下:
1)将嘎德莫特和阳离子脂质体溶于有机溶剂,经过减压旋转蒸发形成脂质薄膜,使用氮气除去有机溶剂,之后加入水化介质,在35~55℃水浴环境下水化孵育5~30min,得到负载嘎德莫特的阳离子脂质体复合物;
2)将鱼精蛋白与mRNA按照0.5:1-7:1比例混匀缩合,得到鱼精蛋白-mRNA缩合物;
3)将步骤2)制备的鱼精蛋白-mRNA缩合物加入到经步骤1)制备的负载嘎德莫特的阳离子脂质体复合物中,室温孵育15~25min,即得到所述的治疗黑色素瘤及其肺转移的mRNA疫苗制剂。
优选的,所述有机溶剂为氯仿-甲醇、乙醚、乙醇、石油醚中的一种或几种组合;
所述氯仿-甲醇的体积比为4:1~9:1;
所述水化介质为磷酸盐缓冲液、Tris-HCl缓冲液或生理盐水,浓度为10~45mmol/L,pH为5~7.5。
需要说明的是,制备过程中,以粒径、Zeta电位、载药量、包封率、稳定性等脂质体特性为考察指标,对主要影响因素,包括旋蒸温度、转速、水化介质的种类及pH、水化温度、水化方式等多个条件逐一进行筛选,并对其进行优化,以获得性能最优的mRNA疫苗。
本发明的第三技术目的是提供一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂在提高免疫效应的应用。
进一步地,所述疫苗制剂的免疫通过皮下注射、肌肉注射或鼻粘膜途径给药,免疫治疗3次,每次免疫治疗间隔3-5天。
优选的,采用皮下注射途径进行免疫。
值得说明的是,所述mRNA疫苗可有效的在树突细胞内翻译为蛋白质,增加脾脏细胞数量,增强脾脏免疫功能,抑制肿瘤细胞增值。
所述mRNA疫苗能够诱导有效的细胞免疫应答能力,在嘎德莫特的协助作用下,在黑色素瘤及其肺转移的治疗过程中,借助树突状细胞、CD8
经由上述的技术方案可知,与现有技术相比,本发明提供了一种治疗黑色素瘤及其肺转移的mRNA疫苗制剂及其制备方法和应用,具有以下有益效果:
1)黑色素瘤是一种起源于皮肤黑素细胞大量异常增值,具有高侵袭性和转移性的恶性肿瘤,致死率占皮肤癌的80%,严重危害人类健康。传统治疗方式所造成的侵袭性,系统毒性给患者带来严重的副作用。现如今,mRNA疫苗诱导的抗肿瘤效果已得到了初步的证实,mRNA疫苗在设计生产上的灵活性,应用中的安全性,使其具有良好的前景,但在体内多种酶的作用下,mRNA极不稳定,易被核酸酶讲解。且自身所携带的负电荷使得递送效率较为低下等问题亟待解决。本发明利用一种生物相容性高且在体内可安全降解的阳离子脂质体来包载mRNA和嘎德莫特,用于黑色素瘤及其肺转移的免疫治疗。
2)肿瘤疫苗发挥治疗作用依赖于专职的抗原提呈细胞,而树突状细胞作为目前已知功能最强的抗原提呈细胞发挥着关键作用,且树突状细胞遍布机体各个器官及组织,成为有效根除肿瘤的的理想工具。mRNA疫苗在被递送载体递送进入树突细胞后,从溶酶体逃逸进入胞质后,经核糖体翻译为蛋白后,被蛋白酶降解为多肽片段后,由MHCI呈递,诱导活化CD8
本发明将TL7受体激动剂嘎德莫特插入阳离子脂质体的磷脂层,使阳离子脂质体复合物兼具载体和佐剂功能,并以此包裹鱼精蛋白-mRNA缩合物,制得一种治疗黑色素瘤及其肺转移的mRNA疫苗。通过琼脂糖凝胶电泳筛选出负载嘎德莫特的脂质体复合物、鱼精蛋白与mRNA的最佳比例为3:1:1,其包封率为95.0%,载药量为10.1%。此外,使用绿色荧光蛋白(EGFP)为报告基因,利用激光共聚焦显微镜成像、流式细胞术结合蛋白质免疫印迹实验验证细胞摄取mRNA疫苗能力、荧光蛋白翻译水平及蛋白表达。
3)本发明制得的治疗黑色素瘤及其肺转移的mRNA疫苗体外树突状细胞刺激成熟实验结果显示:疫苗能显著上调树突状细胞表面共刺激分子CD86、CD80、MHC-I、CCR7的表达水平,表明其能够有效促进小鼠骨髓未成熟树突状细胞的分化成熟;mRNA疫苗体外抗肿瘤实验结果显示:与对照组相比,mRNA疫苗可抑制肿瘤细胞增值,发挥杀伤肿瘤细胞的作用,进而表明本发明中治疗黑色素瘤及其肺转移的mRNA疫苗是一种良好的肿瘤治疗药物。
4)通过皮下给药的方式对黑色素瘤小鼠进行治疗,监测小鼠18天内肿瘤体积、小鼠体重和生存率的变化,可明显发现mRNA疫苗可显著抑制肿瘤生长,且通过心肝脾肺肾组织HE染色结果得知,mRNA疫苗在有效治疗浓度内,具有较高的生物安全性。此外,通过免疫荧光染色及流式结果分析,对脾脏与肿瘤中的CD8
5)通过皮下给药的方式对黑色素瘤肺转移小鼠进行治疗,可明显发现mRNA疫苗具有显著的抑制转移肿瘤生长作用。通过小动物活体成像和肺部肿瘤照片检测小鼠肿瘤发展情况,结果可知,mRNA疫苗组可显著抑制肿瘤发展,具有明显的效果。与此同时,免疫荧光检测结果证实,经mRNA疫苗治疗的小鼠,CD8
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为本发明的治疗黑色素瘤及其肺转移的mRNA疫苗的结构示意图和相关特性表征图。
图2为本发明的治疗黑色素瘤及其肺转移的mRNA疫苗的细胞摄取率(流式细胞术和激光共聚焦扫描显微镜)及WB表达翻译图。
图3为本发明的治疗黑色素瘤及其肺转移的mRNA疫苗对树突状细胞刺激成熟的流式细胞术测定结果图和抑制肿瘤细胞增值结果图。
图4为本发明的治疗黑色素瘤及其肺转移的mRNA疫苗在黑色素瘤小鼠中的体内抗肿瘤效果评价图。
图5为本发明的治疗黑色素瘤及其肺转移的mRNA疫苗在黑色素瘤肺转移小鼠中的体内抗肿瘤效果评价图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1通过薄膜分散法制备治疗黑色素瘤及其肺转移的mRNA疫苗
按DOTMA:胆固醇:DSPE-PEG2000:嘎德莫特摩尔比3:2:1:0.4溶于氯仿-甲醇溶剂中,水浴35℃旋转蒸发形成脂质薄膜,随后使用氮气除去有机溶剂(10min)后再加入Tris-HCl水化介质,在40℃水浴环境下水化孵育30min,得到负载嘎德莫特的脂质体复合物。鱼精蛋白与mRNA以质量比1:1混匀缩合,得鱼精蛋白-mRNA缩合物。将所得鱼精蛋白-mRNA缩合物加入到负载嘎德莫特的脂质体复合物中,室温孵育25min,即得可治疗黑色素瘤及其肺转移的mRNA疫苗(负载嘎德莫特的脂质体复合物、鱼精蛋白与mRNA的质量比为3:1:1)。
使用粒径、Zeta电位、包封率、载药量测定等方法对mRNA疫苗进行表征,并采用琼脂糖凝胶电泳实验考察mRNA与载体之间的包封情况。结果表明:可以成功构建脂质体mRNA疫苗,粒径为174.0±11.8nm,PDI0.282±0.074,zeta电位13.2±2.5mV,EE90.3±5.1%,LE9.5±0.8%。
实施例2通过薄膜分散法制备治疗黑色素瘤及其肺转移的mRNA疫苗
按DOTAP:胆固醇:DSPE-PEG2000:嘎德莫特摩尔比2:2:1:0.4溶于氯仿-甲醇溶剂中,水浴38℃旋转蒸发形成脂质薄膜,随后使用氮气除去有机溶剂(10min)后再加入Tris-HCl水化介质,在50℃水浴环境下水化孵育30min,得到负载嘎德莫特的脂质体复合物。鱼精蛋白与mRNA以质量比1:1混匀缩合,得鱼精蛋白-mRNA缩合物。将所得鱼精蛋白-mRNA缩合物加入到负载嘎德莫特的脂质体复合物中,室温孵育30min,即得可治疗黑色素瘤及其肺转移的mRNA疫苗(负载嘎德莫特的脂质体复合物、鱼精蛋白与mRNA的质量比为3:1:1)。
使用粒径、Zeta电位、包封率、载药量测定等方法对mRNA疫苗进行表征,并采用琼脂糖凝胶电泳实验考察mRNA与载体之间的包封情况。结果表明:可以成功构建脂质体mRNA疫苗,粒径为289.1±14.3nm,PDI0.488±0.096,zeta电位21.4±2.9mV,EE80.9±5.4%,LE6.3±0.7%(结果如图1所示)。
实施例3通过薄膜分散法制备治疗黑色素瘤及其肺转移的mRNA疫苗
按DLin-MC3-DMA:胆固醇:DSPE-PEG2000:嘎德莫特摩尔比2:1:1:0.15溶于石油醚溶剂中,水浴40℃旋转蒸发形成脂质薄膜,随后使用氮气除去有机溶剂(10min)后再加入Tris-HCl水化介质,在55℃水浴环境下水化孵育30min,得到负载嘎德莫特的脂质体复合物。鱼精蛋白与mRNA以质量比1:1混匀缩合得鱼精蛋白-mRNA缩合物。将所得鱼精蛋白-mRNA缩合物加入到负载嘎德莫特的脂质体复合物中,室温孵育25min,即得可治疗黑色素瘤及其骨转移的mRNA疫苗(负载嘎德莫特的脂质体复合物、鱼精蛋白与mRNA的质量比为3:1:1)。
使用粒径、Zeta电位、包封率、载药量测定等方法对mRNA疫苗进行表征,并采用琼脂糖凝胶电泳实验考察mRNA与载体之间的包封情况。结果表明:可以成功构建脂质体mRNA疫苗,粒径为314.1±12.6nm,PDI0.396±0.174,zeta电位19.3±1.9mV,EE75.8±3.2%,LE7.9±0.2%。
具体地结果如图1所示,图中a为mRNA疫苗结构示意图,b为实施例1制备的疫苗的粒径、电位、载药量、多分散指数、包封率结果示意图(Lip为空白阳离子脂质体,LPR为包载mRNA的脂质体复合物,GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物),c为经过琼脂糖凝胶电泳实验优选不同比例负载嘎德莫特的脂质体复合物及鱼精蛋白包封mRNA结果示意图(从左至右分别为阳离子脂质体包封mRNA,鱼精蛋白包封mRNA,阳离子脂质体、鱼精蛋白联合包封mRNA),d为实施例1制备的疫苗透射电镜形态。
进一步的,针对本发明制备过程所做的工艺筛选如下:
1、不同成膜温度、旋转蒸发时间对阳离子脂质体的影响
将不同比例的脂质(DOTMA、胆固醇、DSPE-PEG2000、嘎德莫特)按一定比例加入50ml圆底烧瓶中,涡旋混匀后,考察35~55℃水浴旋转蒸发15~25min完全挥发有机溶剂,待底部形成均匀的脂质膜,向圆底烧瓶中加入Tris缓冲液测量粒径。
结果表明成膜温度在35℃,旋转蒸发20min,并用氮气吹干后,所得脂质体的粒径为168.8±12.7nm。
2、不同水化温度和时间对阳离子脂质体的影响
将上述工艺1筛选得到的脂质体在40-60℃水浴条件下水化10~40min,制备得到阳离子脂质体,考察不同条件脂质体的粒径和电位。
结果表明,水化温度为40℃,水化时间为30min时,所得脂质体的粒径为179.4±9.5nm,PDI0.235±0.067,zeta电位为11.3±1.8mV。
3、不同PH Tris溶液对阳离子脂质体粒径及电位的影响
将上述工艺2筛选得到的脂质膜加入不同PH条件下的Tris缓冲液,考察对粒径电位的影响。结果表明,使用PH7.4的Tris-HCl水化介质,所得脂质体粒径为174.0±11.8nm,PDI0.282±0.074,zeta电位13.2±2.5mV。
效果验证
实验1:考察治疗黑色素瘤及其肺转移的mRNA疫苗的细胞摄取效率
使用实施例1制备所得疫苗,采用编码增强绿色荧光蛋白(EGFP)mRNA为报告基因,质量为5μg,考察DC2.4细胞对mRNA疫苗的摄取情况。分别采用激光共聚焦显微镜下观察EGFP在细胞中的瞬时表达,以及用流式细胞仪测定EGFP在细胞中的荧光强度。
结果如图2所示,图中a为细胞摄取的激光共聚焦图(GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物),b为细胞摄取的流式表达图(LPR为包载mRNA的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物),c为gp-100mRNA在树突状细胞内的蛋白表达图(LPR为包载mRNA的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物,B16为阳性对照),d为细胞毒性评价图(Lip为空白阳离子脂质体,LPR为包载mRNA的脂质体复合物,GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物)。
通过流式细胞术结合激光共聚焦显微镜验证包载EGFPmRNA的LPR和GD-LPR能显著被APCs摄取并表达出绿色荧光蛋白,结果充分说明LPR与GD-LPR可有效被免疫细胞摄取,并在胞内翻译。
实验2:考察治疗黑色素瘤及其肺转移的mRNA疫苗的蛋白翻译能力
使用实施例2制备所得疫苗,并给药至DC2.4细胞,48h后提取细胞总蛋白,采用蛋白质印迹法考察不同组别中gp-100翻译为蛋白情况,借以判断mRNA疫苗递送核酸的能力及其有效翻译能力。
结果如图2所示,图中a为细胞摄取的激光共聚焦图(GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物),b为细胞摄取的流式表达图(LPR为包载mRNA的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物),c为gp-100mRNA在树突状细胞内的蛋白表达图(LPR为包载mRNA的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物,B16为阳性对照),d为细胞毒性评价图(Lip为空白阳离子脂质体,LPR为包载mRNA的脂质体复合物,GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物)。
负载gp-100mRNA的不同制剂组被DC2.4细胞摄取,并在胞质中翻译为蛋白质,这表明mRNA疫苗可以有效地将mRNA递送到抗原提呈细胞中,并在胞质中成功翻译为蛋白质,进而发挥抗原作用,为肿瘤疫苗发挥作用提供前提条件,验证其应用的前提。
实验3:考察治疗黑色素瘤及其肺转移的mRNA疫苗的刺激树突状细胞成熟和抑制肿瘤细胞生长能力。
培养并获得骨髓原代树突细胞,给予细胞不同制剂刺激48h后,流式细胞术考察树突细胞成熟标志CD80、MHCI、CCR7表达情况。
不同制剂处理如下:
阴性对照组:PBS;
疫苗组:Lip、LPR、mLip、mLPR;
阳性对照组:LPS。
培养获得骨髓原代巨噬细胞、腹腔原代巨噬细胞,给予细胞不同制剂刺激48h后,流式细胞术考察巨噬细胞细胞中M1型巨噬细胞与M2型巨噬细胞比例变化。
结果如图3所示,图中a、b、c为树突状细胞刺激成熟结果,a为CD86分子,b为CD80分子,c为MHCI、CCR7分子,d为mRNA疫苗体外抑制黑色素瘤细胞增值的结果图;其中,PBS为对照组,Lip为空白阳离子脂质体,LPR为包载mRNA的脂质体复合物,GD-Lip为包载嘎德莫特的脂质体复合物,GD-LPR为共载嘎德莫特与mRNA的脂质体复合物。
治疗黑色素瘤及其肺转移的mRNA疫苗能够显著促进细胞成熟分子CD80、MHCI、CCR7的表达,表明其具有刺激树突细胞成熟的能力,并极化M2型巨噬细胞为M1型巨噬细胞,增强其杀伤肿瘤细胞能力。
实验4:考察治疗黑色素瘤及其肺转移的mRNA疫苗在荷瘤小鼠体内治疗效果
C57BL/6小鼠于接种黑色素瘤细胞后第7天进行第一次给药,间隔三天再次给药,共给药3次。mRNA疫苗通过皮下途径进行免疫治疗,接种体积为100μl(gp-100mRNA10μg/只)。每隔3天测量肿瘤体积、小鼠体重。末次给药3天后牺牲小鼠,取出肿瘤,称重。对小鼠心肝脾肺肾组织进行HE染色,考察不同mRNA疫苗组的生物安全性;对小鼠肿瘤组织进行免疫荧光染色,考察mRNA疫苗对肿瘤组织中肿瘤细胞、CD8+T细胞、NK细胞的影响;对小鼠肿瘤组织进行流式细胞术检测,考察肿瘤中免疫细胞的变化。
结果如图4所示,图中a为经治疗后小鼠肿瘤变化图,b为小鼠肿瘤体积在18天内连续测定图,c为小鼠生存周期,d为小鼠心肝脾肺肾HE染色图,e为小鼠肿瘤组织免疫荧光染色图(蓝色:细胞核,绿色:肿瘤细胞,红色:CD8+T,粉色:M2型巨噬细胞),f为脾脏组织CD8+T细胞比例,g为脾脏组织NK细胞比例,h,i为小鼠血清中TNF-α、IL-10结果图;其中,G1为未经治疗组,G2为脂质体组,G3为包载嘎德莫特的脂质体复合物,G4包载mRNA的脂质体复合物,G5为共载嘎德莫特与mRNA的脂质体复合物。
肿瘤体积生长曲线表明所构建的治疗黑色素瘤及其肺转移的mRNA疫苗可显著抑制肿瘤生长(图4a、图4b),且通过小鼠体重变化检测及心肝脾肺肾HE染色(图4c和图4d)验证疫苗具有一定的生物安全性。图4e、图4f、图4g、图4h及图4i结果说明mRNA疫苗可显著提升脾脏及肿瘤组织中T淋巴细胞、NK细胞比例,降低肿瘤细胞数量,激活免疫系统,抑制黑色素瘤发展。
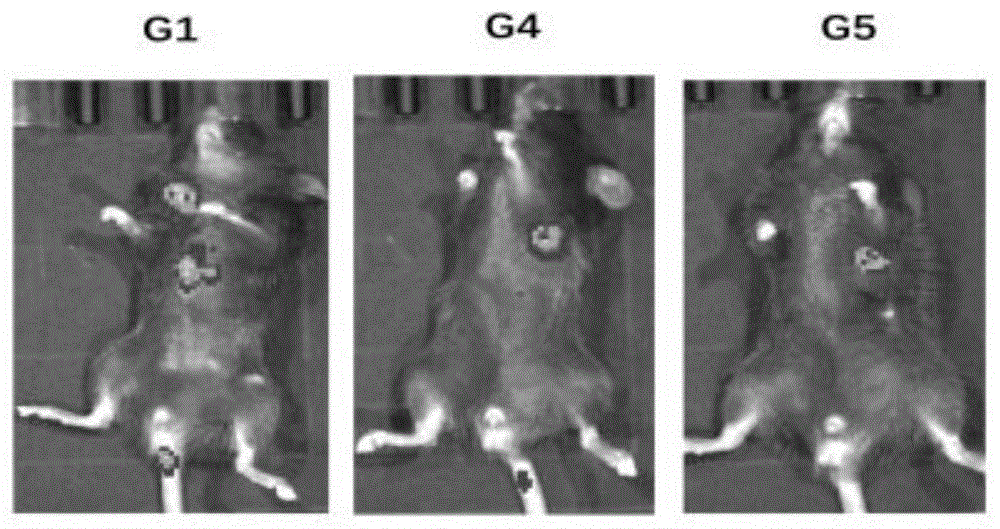
实验5:考察治疗黑色素瘤及其肺转移的mRNA疫苗在黑色素瘤肺转移小鼠体内治疗效果。
C57BL/6小鼠于尾静脉接种荧光黑色素瘤细胞后第7天进行第一次给药,间隔3天再次给药,共给药3次。mRNA疫苗通过皮下途径进行免疫治疗,接种体积为100μl(gp-100mRNA10μg/只)。末次给药3天后使用小动物活体成像检测小鼠体内荧光肿瘤细胞的荧光强度。
结果如图5所示,图中G1为未经治疗组,G4为包载mRNA的脂质体复合物,G5为共载嘎德莫特与mRNA的脂质体复合物,GD-LPR组显著抑制肿瘤生长,具有良好的抗肿瘤效果。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
