一株β-葡聚糖产量提高的出芽短梗霉及其应用
文献发布时间:2023-06-19 09:27:35
技术领域
本发明涉及一株β-葡聚糖产量提高的出芽短梗霉及其应用,属于微生物技术领域。
背景技术
β-1,3-葡聚糖(β-葡聚糖)是一种重要的生物活性多糖,广泛分布于植物、细菌和真菌中,具有重要的营养价值和生物功能。近年来,β-葡聚糖在医药、食品、化妆品、饲料添加剂等领域越来越受到人们的关注,有关β-葡聚糖活性及应用等方面的研究逐年增加。β-葡聚糖具有多种生物活性,免疫调节作用是其最基本的功能,可以刺激先天免疫系统,提高免疫能力,从而达到抗细菌、抗病毒的能力大大提高,可用于肿瘤免疫治疗的研究;β-葡聚糖作为天然的免疫刺激物,可制备为疫苗佐剂,提高免疫系统对疫苗抗原的敏感性;β-葡聚糖还可以促进伤口愈合,美国和欧盟已批准β-葡聚糖可用于促进伤口愈合和烧伤治疗的产品中。β-葡聚糖具有高粘度、高持水性、乳化稳定性等性能,在食品工业中常作为增稠剂、持水剂、黏结剂及乳化稳定剂应用于调味料、甜点等食品,改善食品质构特性;另外,β-葡聚糖还有降血糖、降血脂和调节认知的功能,这使得β-葡聚糖可作为一种功能性食品进行开发。在化妆品行业,β-葡聚糖具有抗凝血、抗氧化、促进细胞增生、抑菌和吸水性能,可产生保湿、延缓衰老、促进上皮纤维成细胞增殖和美化肤色等多种功能。β-葡聚糖作为一种很好的天然免疫增强剂,可改善动物健康状况,同时对重金属与毒素具有一定的吸附作用,作为饲料添加剂,被广泛用于水产养殖和饲料工业。
β-葡聚糖的生产常采用化学、物理和酶法等方法进行提取,原料主要包括植物、真菌、酵母以及藻类,其中在酵母细胞壁中含量最高。近年来,利用出芽短梗霉(Aureobasidium pullulans)发酵法生产β-葡聚糖已经成为一种发展趋势。在好氧条件下,出芽短梗霉将葡萄糖转变为尿苷二磷酸葡萄糖(UDPG),而UDPG又是β-葡聚糖和普鲁兰多糖生物合成共用的前体物质。为了提高β-葡聚糖的产量,一方面需要增加胞内UDPG的供给,另一方面需要提高β-葡聚糖合成酶的活性,并降低普鲁兰合成酶的活性。如今,出芽短梗霉合成β-葡聚糖的研究还处于起步阶段。Kang等人通过敲除野生型菌株A.pullulansIMS822KCTC11179BP中的普鲁兰合成酶基因(pul)后得到突变株NP1221,与野生型菌株相比,该突变株在发酵过程中不产生普鲁兰多糖,仅合成β-葡聚糖,168h后的产量为2.5g/L。Hirabayashi等人利用A.pullulans ATCC 20524发酵产生β-葡聚糖,并对其化学结构进行了研究。另外,Singh和Saini在研究中提到,硝酸钠作为氮源可以促进β-1,3-葡聚糖的合成。由于β-葡聚糖的生物合成机制至今仍未被解析,如何进一步提高前体物质UDPG的含量并实现β-葡聚糖产量的增加,仍有待进一步研究。
采用传统的发酵优化方法可以提高β-葡聚糖的产量,但产量仍然较低,发酵生产效率不高。而采用基因工程技术手段选育突变株,虽然可以对副产物普鲁兰的消除具有一定的效果,但是对于提高β-葡聚糖产量难以起到积极的效果。因此,本发明采用根癌农杆菌介导的方法,对出芽短梗霉进行遗传改造,从根本上增强β-葡聚糖的生物合成途径,提高胞内前体物质UDPG的供给量,最终达到提高出芽短梗霉生产β-葡聚糖产量的目的。
发明内容
为解决上述问题,本发明采用根癌农杆菌介导的方法对出芽短梗霉进行遗传转化,建立T-DNA突变库,在含有潮霉素和氯霉素的平板上筛选出遗传性能稳定的出芽短梗霉突变株,通过分批发酵培养,实现β-葡聚糖高产的目标。
本发明的第一个目的是提供一株β-葡聚糖产量提高的出芽短梗霉,分类学命名为出芽短梗霉Aureobasidium pullulans,于2020年06月03日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.19650,保藏地址为北京市朝阳区北辰西路1号院3号。
本发明的第二个目的是提供所述的出芽短梗霉的选育方法,所述方法是采用根癌农杆菌介导出芽短梗霉进行遗传转化,在含有潮霉素和氯霉素的平板上筛选得到所述的出芽短梗霉。
本发明的第三个目的是提供所述的出芽短梗霉在发酵生产β-葡聚糖中的应用。
进一步地,所述的应用包括将出芽短梗霉接种至种子培养基中进行培养获得种子液,再将种子液接种至发酵培养基中进行发酵培养生产β-葡聚糖。
进一步地,所述的种子培养基的配方为马铃薯180-220g/L,葡萄糖18-22g/L。
进一步地,所述的发酵培养基的配方为葡萄糖40-120g/L,酵母粉2-4g/L,(NH
进一步地,所述的发酵培养为分批发酵。
本发明的第四个目的是提供一种微生物菌剂,所述的微生物菌剂包括所述的出芽短梗霉。
进一步地,所述的微生物菌剂为固态菌剂。
进一步地,所述的微生物菌剂为液态菌剂。
本发明的有益效果:
本发明的出芽短梗霉于2020年06月03日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.19650,保藏地址为北京市朝阳区北辰西路1号院3号。本发明的出芽短梗霉相较于出发菌株,胞内UDPG含量提高,β-葡聚糖产量提高2-3倍。
生物材料保藏:
出芽短梗霉(Aureobasidium pullulans),于2020年06月03日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.19650,保藏地址为北京市朝阳区北辰西路1号院3号。
附图说明
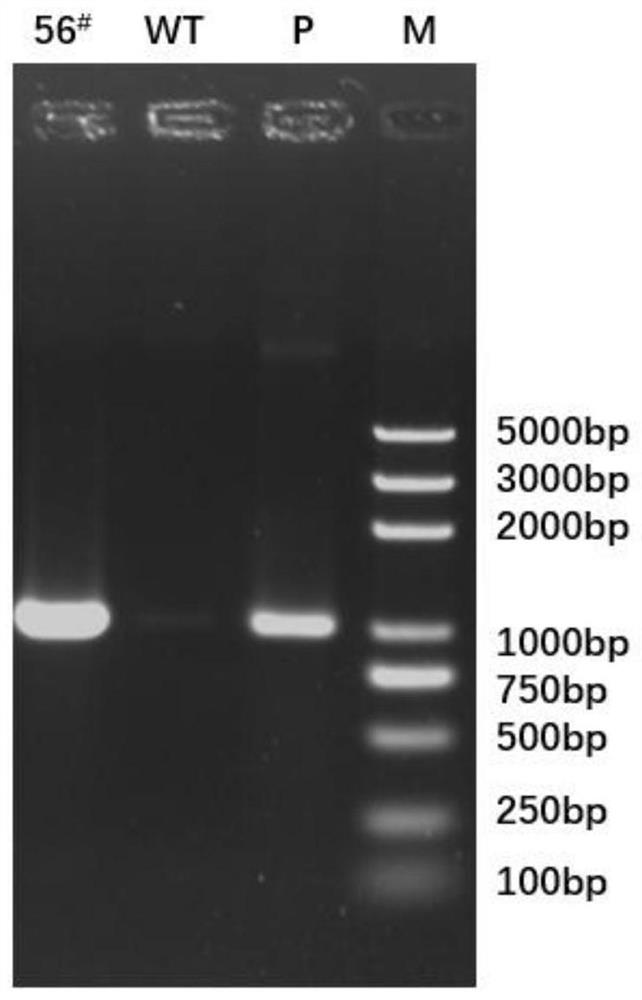
图1为出发菌株(WT)和突变株(56#)的PCR验证结果示意图。
具体实施方式
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
出发菌株为出芽短梗霉(Aureobasidium pullulans CCTCC M 2012259)。
突变株为A.pullulans 56#。该突变株于2020年06月03日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC 19650。
根癌农杆菌(Agrobacterium tumefaciens AGL-1),苏州大学微生物工程研究室保存。
YEB培养基:酵母提取物10g/L,蛋白胨5g/L,蔗糖5g/L,MgSO
YCK培养基:酵母提取物10g/L,蛋白胨5g/L,蔗糖5g/L,MgSO
IM培养基:葡萄糖1.8g/L,K
M-100培养基:葡萄糖20g/L,酵母提取物6.7g/L,(NH
种子培养基:马铃薯200g/L,葡萄糖20g/L,自然pH值。
发酵培养基:葡萄糖50g/L或100g/L,酵母粉3g/L,(NH
细胞干质量与葡聚糖产量测定:取20mL发酵液,80℃水浴15min灭活,冷却至室温后在12 000rpm离心10min。沉淀用蒸馏水洗涤3次,用丙酮分离细胞和葡聚糖。收集后于70℃烘干至质量恒定。
胞内UDPG含量的测定:取5mL发酵液,于4℃、12 000rpm离心10min,生理盐水洗涤2次后,将湿细胞重新悬浮在5mL 0.2mol/L磷酸缓冲溶液(pH7.0)中,超声破碎10min(破碎10s,间隔10s),在4℃、12 000rpm离心20min后得到的上清液即为无细胞提取物,用于测定胞内UDPG含量。UDPG采用HPLC法进行测定。色谱柱为Supelcosil LC-18-DB柱(4.6mm×250mm),流动相为40mmol/L三乙胺-乙酸缓冲液(pH 6.0),流速1mL/min,柱温22℃,检测波长254nm。
实施例1:出芽短梗霉突变株的构建
1根癌农杆菌感受态细胞制备
(1)将根癌农杆菌接种于YEB琼脂平板,30℃培养24h;
(2)挑取单菌落接种于3mL YEB(含卡那霉素)试管中,30℃、200rpm摇床培养过夜;
(3)在30mL YEB(含卡那霉素)的三角瓶中接入1mL过夜培养的菌液,30℃、200rpm振荡培养5~8h,使菌体生长至对数期(OD
(4)用50mL预冷的离心管分装预冷的菌液;
(5)在4℃、4000rpm离心5min,收集菌体,弃上清;
(6)用6mL预冷的20mmol/L CaCl
(7)再用3mL预冷的20mmol/L CaCl
(8)每30mL菌液用1.5mL含50%甘油的20mmol/L CaCl
2将质粒载体转化根癌农杆菌感受态细胞
(1)从-80℃冰箱中取出根癌农杆菌感受态细胞,冰上解冻10min,加入5μL质粒,轻弹混匀;
(2)液氮冷冻5min,立即37℃热激5min;
(3)冰浴3min,室温放置2min,加入450μL YEB(不含抗生素),30℃、200rpm培养2h;
(4)于4000rpm离心1min,倒掉部分上清,余下约100~200μL混匀后均匀涂布于YCK平板,30℃下倒置培养2天。
3根癌农杆菌介导转化出芽短梗霉
(1)挑取YCK平板上的单菌落,于5mL YCK培养基中,将根癌农杆菌培养到对数生长期OD
(2)将出芽短梗霉的种子接种于YPD平板上,30℃倒置培养2天。挑取单菌落于5mLYPD培养基中培养至对数生长期,OD
(3)用8层擦镜滤纸过滤出芽短梗霉,用无菌水稀释出芽短梗霉10倍。
(4)取100μL稀释后的出芽短梗霉与100μL培养待用的根癌农杆菌混匀后,均匀涂布于表面铺有水相微孔滤膜的IM琼脂平板上,22℃共培养60h,将微孔滤膜转移至含有合适筛选压力(200mg/L氯霉素和100mg/L潮霉素B)的M100琼脂平板上,25℃培养3~6d至出现转化子;
(5)将滤膜上的转化子挑至含有3mL双倍筛选压力(400mg/L氯霉素和200mg/L潮霉素B)的M100液体培养基中培养1~2d,提取基因组。利用引物Hyg-for(GAAAAAGCCTGAACTCACCGC)、Hyg-rev(CTATTTCTTTGCCCTCGGACG)进行PCR验证,验证结果如图1所示。结果显示,突变株56
并将获得的PCR片段进行测序,测序结果显示在突变株56#中,Hyg片段成功整合到A.pullulans的基因组上,且没有发生突变。因此,该突变株即为构建成功的阳性克隆,于2020年06月03日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCCNo.19650,保藏地址为北京市朝阳区北辰西路1号院3号。
实施例2:出发菌株A.pullulans CCTCC M 2012259与突变株A.pullulans CGMCC19650摇瓶发酵
种子培养:
将在-70℃超低温冰箱中保藏的菌种(1mL)接种入装有50mL种子培养基的三角瓶中,于30℃、200rpm摇床培养24h获得种子液。
摇瓶发酵:
将种子液按10%(v/v)接种量接种至发酵培养基,于30℃、200rpm摇床培养72h。其中,发酵培养基中葡萄糖含量为50g/L。
出发菌株A.pullulans CCTCC M 2012259实验结果:细胞干重:8.85~9.23g/L;β-葡聚糖产量:2.02~2.28g/L;胞内UDPG含量4.36~4.57mg/g。
突变株A.pullulans CGMCC 19650实验结果:细胞干重:13.99~14.55g/L;β-葡聚糖产量:4.31~4.53g/L;胞内UDPG含量8.26~8.84mg/g。
实施例3:出发菌株A.pullulans CCTCC M 2012259与突变株A.pullulans CGMCC19650分批发酵
利用出发菌株A.pullulans CCTCC M 2012259和突变株A.pullulans CGMCC19650进行分批发酵培养,发酵条件是:按照10%(v/v)的接种量将种子液接种至装有3L发酵培养基的5L发酵罐中,在30℃、400rpm和3L/min通气量的条件下培养72h。pH值采用梅特勒电极在位监测,并通过自动流加3mol/L H
出发菌株A.pullulans CCTCC M 2012259实验结果:细胞干重:9.01~9.35g/L;β-葡聚糖产量:2.42~2.81g/L;胞内UDPG含量4.60~4.64mg/g。
突变株A.pullulans CGMCC 19650实验结果:细胞干重:13.33~13.75g/L;β-葡聚糖产量:4.56~4.77g/L;胞内UDPG含量8.54~8.66mg/g。
实施例4:出发菌株A.pullulans CCTCC M 2012259与突变株A.pullulans CGMCC19650分批发酵
按照实施例3中所述发酵条件,发酵培养基中葡萄糖含量为100g/L,利用出发菌株A.pullulans CCTCC M 2012259和突变株A.pullulans CGMCC 19650进行分批发酵,发酵时间120h。
出发菌株A.pullulans CCTCC M 2012259实验结果:细胞干重:8.68~9.19g/L;β-葡聚糖产量:2.36~2.64g/L;胞内UDPG含量5.37~5.49mg/g。
突变株A.pullulans CGMCC 19650实验结果:细胞干重:19.65~19.98g/L;β-葡聚糖产量:6.58~6.92g/L;胞内UDPG含量8.72~8.76mg/g。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
