一种禽白血病病毒A/B/J亚群三重PCR检测引物及其应用
文献发布时间:2023-06-19 10:44:55
技术领域
本发明涉及一种禽白血病病毒A/B/J亚群三重PCR检测引物及其应用,属于禽白血病病毒A/B/J亚群检测技术领域。
背景技术
禽白血病(Avian leukosis,AL)是由反转录病毒科,α-逆转录病毒属的禽白血病病毒(Avian leukosis virus,ALV)引起的一类以淋巴细胞瘤、髓细胞瘤、血管瘤为主的肿瘤性疾病。ALV基因组主要包括gag、pol和env 3个基因,其中gag和pol基因相对保守,而包括gp85在内的env基因存在着较大变异,根据病毒囊膜蛋白gp85基因序列的差异,可将ALV分为A~K 11个亚群。11个亚群中,A、B、C、D、J和K 6个亚群为外源性病毒,能导致感染鸡出现明显的临床症状,致使机体产生肿瘤、生产性能下降,甚至死亡。其中A、B和J亚群是目前导致鸡群发病的优势毒种,在禽类养殖场中较为常见。
近年来,由于没有有效疫苗和药物可供使用,禽白血病的发病率逐渐升高,给养禽业造成了巨大的损失。目前,临床上主要采用病毒分离鉴定、聚合酶链式反应(PCR)、酶联免疫吸附试验(ELISA)、间接免疫荧光试验(IFA)、实时荧光定量PCR及RT-LAMP等方法来检测ALV,但其操作繁琐、费时费力、敏感性较差、易产生假阳性,应用这些方法难以快速进行早期诊断。
发明内容
基于上述,本发明提供一种禽白血病病毒A/B/J亚群三重PCR检测引物及其应用,以解决现有禽白血病病毒A/B/J亚群检测技术存在的操作繁琐、费时费力、敏感性较差、易产生假阳性的技术问题。
本发明的技术方案是:一种禽白血病病毒A/B/J亚群三重PCR检测引物,所述检测引物包括分别用于检测禽白血病病毒A、B和J亚群的引物,其中,
禽白血病病毒亚群A检测引物为:
上游引物F1:AGCCGGGGAACCTTTGGATTACAT
下游引物R1:TCCGCAACACCCACTGACATTACC
禽白血病病毒亚群B检测引物为:
上游引物F2:TCCTGGCGGCCCTGAGAACA
下游引物R2:CCGCAACATCCGCTGACATTACC
禽白血病病毒亚群J检测引物为:
上游引物F3:ATAAGACGGGCCGAACAGATTTTT
下游引物R3:CGCCCCACCAGTCCCATTA;
以上引物如SEQ ID NO.1、2、3、4、5、6所示。
本发明还提供一种所述的禽白血病病毒A/B/J亚群三重PCR检测引物在禽白血病病毒检测中的应用。
可选的,所述应用包括以下步骤:
(1)病毒分离及基因组提取;
(2)多重PCR反应;
(3)结果判断。
可选的,PCR进行扩增反应的反应条件为:95℃预变性5min;95℃变性1min,58℃退火45s,72℃延伸2min,共35次循环;72℃再延伸10min。
可选的,禽白血病病毒亚群A检测引物浓度为0.6μmol/L,禽白血病病毒亚群B检测引物浓度为0.3μmol/L,禽白血病病毒亚群J检测引物浓度为0.5μmol/L。
可选的,结果判断方式为:如果扩增出761bp片段,则判断有禽白血病病毒亚群A;如果扩增出579bp片段,则判断有禽白血病病毒亚群B;如果扩增出353bp片段,则判断有禽白血病病毒亚群J。
本发明采用多重PCR检测技术,该技术是在普通PCR技术的基础上发展起来的,多重PCR可在同一体系中加入多对引物,可同时对多个目的基因进行扩增,既具有传统方法的优点,又可对同一样品同时检测多种病原,可以达到同步诊断的目的。
本发明的有益效果是:本发明建立的三重PCR方法可同时检测ALV A、B、J三个亚群,该方法临床试验检测结果与单重RT-PCR检测结果一致,且具有操作简单、节约成本、特异性高、稳定性好的优点,可为临床上快速鉴别ALV A、B、J亚群提供了重要的技术支持。
本本发明根据ALV A、B、J亚群原型株的gp85基因设计合成了3对特异性引物,预期扩增片段大小分别为761bp、579bp、353bp,各片段长度差在150bp以上,可以提高琼脂糖凝胶电泳上的分辨率。此外,本发明对多重PCR反应的参数不断进行优化,最终确定其最适退火温度为58℃;最佳引物浓度组合为ALV A 0.6μmol/L、ALV B 0.3μmol/L、ALV J 0.5μmol/L;ALV A、B、J亚群质粒的最低检出量分别为11.7pg、1.17pg、11.7fg。
附图说明
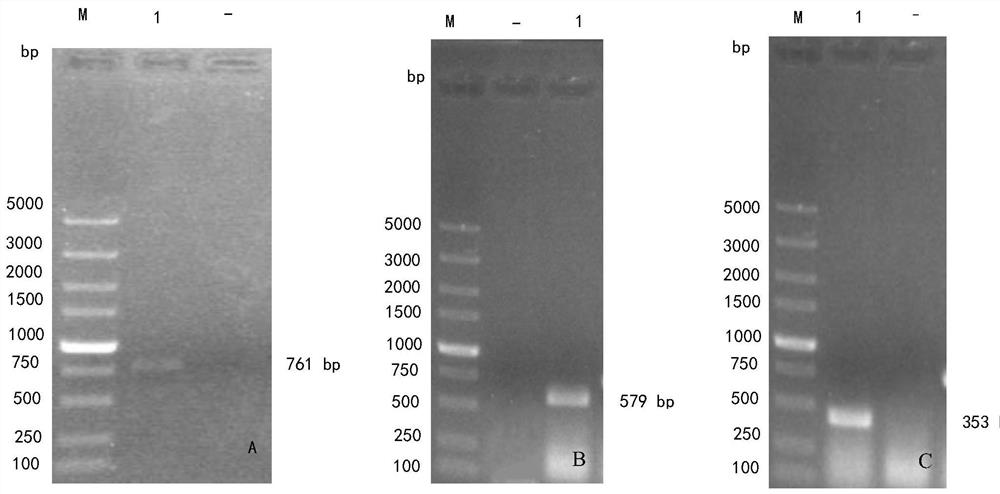
图1中从左至右分别为ALV A(A)、B(B)、J(C)单重RT-PCR结果,图中,M DL5000 DNAMarker,1对应ALV A、B、J阳性病料;-阴性对照;
图2为ALV A克隆菌液PCR鉴定结果,图中,M DL2000 DNA Marker;1-4ALV A克隆菌液;
图3为ALV B克隆菌液PCR鉴定结果,图中,M DL2000 DNA Marker;1-5ALV B克隆菌液;
图4为ALV J克隆菌液PCR鉴定结果,图中,M DL2000 DNA Marke,1-5ALV J克隆菌液;
图5为退火温度优化结果,图中,M DL5000 DNA Marker;1-7退火温度依次为55℃、56℃、57℃、58℃、59℃、60℃、61℃;
图6为引物浓度优化结果,图中,M DL5000 DNA Marker,1-7分别对应表2中的不同引物浓度组合;
图7为特异性试验结果,图中,M DL5000 DNA Marker,1ALV A+B+J;2ALV A;3ALVB;4ALV J;-阴性对照;5IBDV;6NDV;7AIV;8MDV;9FAdv;
图8为敏感性试验结果,图中,M DL5000 DNA Marker,1ALV A/B/J质粒117ng;2ALVA/B/J质粒11.7ng;3ALV A/B/J质粒1.17ng;4ALV A/B/J质粒117pg;5ALV A/B/J质粒11.7pg;6ALV A/B/J质粒1.17pg;7ALV A/B/J质粒117fg;8ALV A/B/J质粒11.7fg;-阴性对照;
图9为重复性试验结果,图中,M DL5000 DNA Marker,1ALV A+B+J;2ALV A+B;3ALVB+J;4ALV A+J;5ALV A;6ALV B;7ALV J;
图10为疑似AL核酸A亚群单重RT-PCR结果,图中,M DL2000 DNA Marker,1-5分别为5份疑似AL病原核酸;+阳性对照;-阴性对照;
图11为疑似AL核酸B亚群单重RT-PCR结果,图中,M DL2000 DNA Marker,1-5分别为5份疑似AL病原核酸;+阳性对照;-阴性对照;
图12为疑似AL核酸J亚群单重RT-PCR结果,图中,M DL2000 DNA Marker,1-5分别为5份疑似AL病原核酸;+阳性对照;-阴性对照;
图13为疑似AL核酸A/B/J亚群三重RT-PCR结果,图中,M DL2000 DNA Marker,1-5分别为5份疑似AL病原核酸;+阳性对照;-阴性对照。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
1材料与方法
1.1病料及毒株来源
ALV A、B、J亚群阳性样本与传染性法氏囊病病毒(IBDV)、马立克病病毒(MDV)、禽腺病毒(FAdv)均保存于贵州大学预防兽医学实验室;临床试验所用5份疑似AL病料来源于贵州省天河潭某养殖场;禽流感病毒(AIV)和新城疫病毒(NDV)为AIV和NDV通用型RT-PCR检测试剂盒中的阳性样本(世纪元亨生物科技公司)。
1.2主要试剂
病毒基因组RNA提取试剂盒购自天根生化科技(北京)有限公司;HiFi-ScriptcDNA第一链合成试剂盒、2×Es Taq DNA Mix购自康为世纪生物科技有限公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;琼脂糖凝胶DNA回收试剂盒、pMD19-T载体、DL5000DNA Marker购自宝生物工程(大连)有限公司;大肠杆菌DH5α感受态细胞购自碧云天公司。
1.3检测引物
参照GenBank数据库中ALV A、B、J亚群原型株的gp85基因,设计3对特异性引物,引物信息见表1。
表1引物信息
以上引物分别如SEQ ID NO.1、2、3、4、5、6所示
1.4阳性样品制备
1.4.1重RT-PCR检测及产物鉴定
根据病毒基因组RNA提取试剂盒进行总RNA的提取,并将其反转录为cDNA保存于-20℃冰箱。分别以反转录的cDNA为模板,进行单重PCR扩增。总体积为50μL:上、下游引物各2.5μL,2×Es Taq DNA Mix 25μL,模板核酸5μL,ddH2O 15μL。反应条件:95℃预变性5min;95℃变性1min,59℃退火45s,72℃延伸2min,共35次循环;72℃再延伸10min。反应结束后,采用1%的琼脂糖凝胶电泳检测RT-PCR产物,取目的基因胶条送生工生物工程(上海)股份有限公司测序。
1.4.2重组质粒的构建
胶回收目的片段,连接至pMD-19T载体,挑取单个菌落于含Amp的LB液体培养基中过夜培养12h,取克隆菌液进行PCR鉴定,反应体系及程序同1.4.1,PCR产物送生工生物工程(上海)股份有限公司测序,提取测序正确菌液的质粒,并将质粒浓度稀释到相同数量级。
1.5多重PCR方法的建立及条件优化
1.5.1退火温度优化
ALV A、B、J三亚群质粒浓度稀释到相同等量级后均为117ng/μL,以此为模板进行退火温度的优化。反应体系为50μL:2×Es Taq DNA Mix 25μL,三对引物终浓度均为0.4μmol/L,混合模板3μL,ddH
1.5.2引物浓度优化
反应体系为50μL:2×Es Taq DNA Mix 25μL,混合模板3μL,设置7组不同引物浓度组合进行多重PCR引物浓度的优化,ddH
表2引物浓度组合
1.5.3特异性试验
以优化的多重PCR方法对ALV A+B+J混合质粒模板、ALV A、ALV B、ALV J、IBDV、NDV、AIV、MDV、FAdv核酸模板进行检测,鉴定该方法的特异性。
1.5.4敏感性试验
将1.4.2提取的3种质粒模板分别进行10倍梯度稀释,分别为1×100、1×10
1.5.5重复性试验
应用建立的多重PCR方法对ALV A+B+J、ALV A+B、ALV B+J、ALV A+J、ALV A、ALV B、ALV J的质粒样本进行多次重复试验,以鉴定该方法的重复性。
1.6多重PCR方法的初步应用
根据病毒基因组RNA提取试剂盒提取5份疑似AL病料的总RNA,并将其反转录为cDNA保存于-20℃冰箱。分别以反转录的cDNA为模板,进行单重和多重RT-PCR扩增,验证本发明建立的多重PCR检测方法的阳性符合率。单重RT-PCR反应体系和程序同1.4.1,多重RT-PCR使用优化后的反应体系和程序。
2结果
2.1单重RT-PCR检测
阳性病料单重RT-PCR结果表明,3个亚群均出现特异性扩增条带(图1A、B、C),测序结果显示ALV A长为761bp,ALV B长为579bp,ALV J长为353bp,与预期扩增片段大小相符。测序结果BLAST比对分析表明,其与参考基因的同源性均达到98%以上。
2.2重组质粒的构建
ALV A、B、J克隆菌液PCR鉴定结果见图2-图4,三亚群均出现特异性扩增条带,大小与预期扩增片段相符。
2.3退火温度优化
优化结果见图5,由图可知退火温度在58℃时3个亚群的条带较为特异且均一,因此,可确定最佳退火温度为58℃。
2.4引物浓度优化
本次试验共设置了7组不同引物浓度组合进行优化,结果见图6,由图可知,最佳引物浓度组合为ALV A 0.6μmol/L、ALV B 0.3μmol/L、ALV J 0.5μmol/L。
2.5特异性试验
本发明建立的多重PCR方法对ALV A+B+J混合质粒模板、ALV A、ALV B、ALV J质粒模板有特异性扩增,而对IBDV、NDV、AIV、MDV、FAdv均无特异性扩增,表明本发明多重PCR方法有较好的特异性(图7)。
2.6敏感性试验
在优化的多重PCR条件下,该多重PCR对ALV A亚群质粒的最低检出量为11.7pg、ALV B亚群质粒的最低检出量为1.17pg、ALV J亚群质粒的最低检出量为11.7fg(图8)。
2.7重复性试验
重复性实验结果显示,ALV A+B+J、ALV A+B、ALV B+J、ALV A+J、ALV A、ALV B和ALVJ的质粒模板均能扩增与预期大小一致的目的条带,表明本发明多重PCR方法具有良好的重复性(图9)。
2.8多重PCR方法的初步应用
5份疑似AL病料单重及多重RT-PCR结果分别见图10-图13,由图10-图12可知,单重RT-PCR仅J亚群出现特异性扩增条带,大小与预期扩增片段相符,J亚群阳性率为100%(5/5);由图13可知,三重RT-PCR仅J亚群出现特异性扩增条带,大小与预期扩增片段相符,阳性率为100%(5/5),与单重ALV J亚群RT-PCR结果相符,证明本本发明建立的ALV A、B、J亚群三重检测方法具有一定的临床实用性。
核苷酸序列表:
SEQUENCE LISTING
序列表
<110> 贵州大学
<120> 一种禽白血病病毒A/B/J亚群三重PCR检测引物及其应用
<160> 6
<210> 1
<211> DNA
<212> 24
<213> 人工序列
<400> 1
AGCCGGGGAA CCTTTGGATT ACAT 24
<210> 2
<211> DNA
<212> 466
<213>人工序列
<400>2
TCCGCAACAC CCACTGACAT TACC 24
<210> 3
<211> DNA
<212> 20
<213>人工序列
<400>3
TCCTGGCGGC CCTGAGAACA 20
<210> 4
<211> DNA
<212> 23
<213>人工序列
<400>4
CCGCAACATC CGCTGACATT ACC 23
<210>5
<211> DNA
<212> 24
<213>人工序列
<400>5
ATAAGACGGG CCGAACAGAT TTTT 24
<210>6
<211> DNA
<212> 19
<213>人工序列
<400>6
CGCCCCACCA GTCCCATTA 19
- 一种禽白血病病毒A/B/J亚群三重PCR检测引物及其应用
- 一种一步法PCR检测禽白血病病毒A/B/J/K亚群引物组及试剂盒
