用于口服给药的依达拉奉混悬剂
文献发布时间:2023-06-19 11:26:00
[技术领域]
本发明涉及用于口服给药的依达拉奉混悬剂,并且涉及制备所述用于口服给药的依达拉奉混悬剂的药盒。
[背景技术]
依达拉奉是3-甲基-1-苯基-2-吡唑啉-5-酮(参见下式):
[化学式1]
并且已知其除了作为脑部功能正常化药剂之外,还作为ALS(肌萎缩侧索硬化)治疗剂的制药用途(专利文献1和2)。
作为一种运动神经元疾病,ALS是由诸如手无力、手指运动障碍以及上肢的肌束收缩的初期症状,通过诸如肌肉萎缩和/或肌无力、延髓麻痹和肌束收缩的症状,导致呼吸衰竭的难治性疾病。根据发病部位,ALS分为上肢、延髓、下肢和混合型。在所有这些类型中,随着症状的发展,全身性肌肉群受到影响。ALS的病因尚未充分阐明。已经提出了以下假设作为ALS的主要病因:(1)自身免疫理论(出现针对Ca通道的自身抗体);(2)过度兴奋性氨基酸和/或毒性理论(细胞外谷氨酸增加和谷氨酸转运障碍);(3)氧化应激障碍理论(Cu/Zn超氧化物歧化酶(SOD)遗传异常和自由基引起的神经细胞损伤);(4)细胞骨架障碍理论(运动神经细胞中神经丝的蓄积和包涵体的出现);和(5)神经营养因子缺乏。
目前,依达拉奉用作ALS治疗剂。但是,作为ALS治疗剂的依达拉奉仅以注射剂的形式提供,需要一种对患者和照料者负担较小且从QOL角度而言是优选的口服给药的药品,。
然而,与直接向血液中给药的注射剂不同,对于诸如从胃肠道吸收和首过效应的多种因素影响生物利用度的口服给药的药品,获得与注射剂生物学等效的药品是困难的。
作为用于口服给药的药品,固体药品如片剂和胶囊剂是常见的。然而,当直接服用这些剂型的药品时,预期吞咽能力下降的ALS患者难以服用所述药品。对于这些患者,口服给药形式如液体和混悬剂是期望的。
非专利文献1-3描述了依达拉奉的CMC-Na混悬剂。然而,据描述,当将这些混悬剂向动物给药时,它们都具有低的生物利用度。
专利文献3中记载了使用黄芪胶水溶液的用于口服给药的依达拉奉溶液,并且记载在大鼠中获得了足够的血液浓度。然而,其在血液中的浓度低于非专利文献1-3中描述的CMC-Na混悬剂的结果,并且该文献中描述的药品也不具有与注射剂相当的生物利用度。
为了克服混悬剂中的低生物利用度,专利文献4描述了具有优异吸收性的依达拉奉溶液。但是,由于依达拉奉在水中的溶解度低,该溶液的剂量高达100mL,因此从患者的药物依从性的角度来看是不优选的。
[相关技术]
[专利文献]
[专利文献1]日本专利公开第H5-31523号。
[专利文献2]日本专利第3758164号。
[专利文献3]日本专利申请公开第2004-91441号。
[专利文献4]国际公开第WO 2018/134243号。
[非专利文献]
[非专利文献1]Journal of Pharmaceutical Sciences 103:730-742,2014。
[非专利文献2]International Journal of Pharmaceutics 515(2016)490-500
[非专利文献3]Drug Delivery,24:1,962-978。
[发明概述]
[发明要解决的问题]
本发明旨在提供用于口服给药的依达拉奉混悬剂,其可以减轻ALS患者和照料者的负担,并可以达到与注射剂相当的ALS治疗效果。
[解决问题的手段]
本申请发明人进行了深入研究,结果发现,通过混合分散剂,依达拉奉颗粒可以均匀地分散于水中,并可保持分散状态,并且即使在储存后依达拉奉颗粒沉降的情况下,通过轻轻摇动可以使依达拉奉颗粒迅速再分散,从而可以制备药学上优异的用于口服的依达拉奉混悬剂。另外,根据非专利文献1-3的发现,基于之前的动物实验结果,从生物利用度的角度而言,制备的用于口服给药的依达拉奉混悬剂被认为是不利的混悬剂。然而,本发明人发现,当向人类给药时,混悬剂表现出出乎意料的优异生物利用度,并因此完成了本发明。
用于解决所述问题的手段是下列<1>-<23>,但不限于这些。
<1>用于人类口服给药的依达拉奉混悬剂,其含有:依达拉奉颗粒;分散剂;和水。
<2>根据<1>所述的混悬剂,其中所述分散剂是显示1%或更高的透射散射光强度的分散剂。
<3>根据<1>所述的混悬剂,其中所述分散剂是显示80度或更小的接触角的分散剂。
<4>根据<1>所述的混悬剂,其中所述分散剂是选自聚乙烯醇、甲基纤维素、羟丙甲纤维素、蔗糖脂肪酸酯和聚山梨醇酯中的一种或两种。
<5>根据<4>所述的混悬剂,其中所述分散剂是选自聚乙烯醇和甲基纤维素中的一种或两种。
<6>根据<4>或<5>所述的混悬剂,其中所述分散剂是聚乙烯醇。
<7>根据<4>-<6>中任一项所述的混悬剂,其中所述聚乙烯醇具有86.5-89.0的皂化度,并且其4%水溶液在20℃下具有3mm
<8>根据<1>-<7>中任一项所述的混悬剂,其中所述分散剂的混合量为0.001%(w/v)-1.0%(w/v)。
<9>根据<1>-<8>中任一项所述的混悬剂,其还含有增稠剂。
<10>根据<9>所述的混悬剂,其中所述增稠剂是选自黄原胶和黄芪胶粉中的一种或两种。
<11>根据<9>或<10>所述的混悬剂,其中所述增稠剂是黄原胶。
<12>根据<9>-<11>中任一项所述的混悬剂,其中所述增稠剂的混合量为0.1%(w/v)-1.2%(w/v)。
<13>根据<1>-<12>中任一项所述的混悬剂,其中所述混悬剂中依达拉奉颗粒具有10μm-100μm的D50粒径和50μm-300μm的D90粒径。
<14>根据<1>-<13>中任一项所述的混悬剂,其中所述依达拉奉颗粒的混合量为0.06%(w/v)-36%(w/v)。
<15>根据<1>-<14>中任一项所述的混悬剂,其还含有选自甜味剂、稳定剂和pH调节剂中的一种或多种添加剂。
<16>根据<1>-<15>中任一项所述的混悬剂,其具有50mPa·s-1750mpa·s的粘度。
<17>根据<1>-<16>中任一项所述的混悬剂,其具有1g/mL-1.5g/mL的密度。
<18>根据<1>-<17>中任一项所述的混悬剂,其中当根据日本药典进行溶出试验(试验溶液:第一溶液;并且桨叶转速:50rpm)时,所述试验开始30分钟后依达拉奉的溶出度为80%或更高。
<19>用于制备用于人类口服给药的依达拉奉混悬剂的药盒,其含有:(A)含有依达拉奉颗粒的固体组合物;和(B)分散剂溶液。
<20>用于人类口服给药的依达拉奉混悬剂,其特征在于,当将含有90-120mg依达拉奉的混悬剂向人类口服给药时,血浆中的依达拉奉显示500-2500ng/mL的平均Cmax和1000-2500h*ng/mL的平均AUC
<21>用于人类口服给药的依达拉奉混悬剂,其特征在于,当使用依达拉奉注射剂作为对照药品来进行其中将含有90-120mg依达拉奉的混悬剂向人类口服给药的交叉研究时,相对于所述对照药品的Cmax几何平均值之比的90%置信区间的下限和相对于所述对照药品的AUC
<22>用于人类口服给药的依达拉奉混悬剂,其特征在于,当使用依达拉奉注射剂作为对照药品来进行其中将含有90-120mg依达拉奉的混悬剂向人类口服给药的交叉研究时,相对于所述对照药品的Cmax几何平均值之比和相对于所述对照药品的AUC
<23>ALS治疗剂,其特征在于,每一次口服给药的药品剂量为1-20mL,并且所述剂量含有50-210mg的依达拉奉。
[发明效果]
根据本发明,可以提供用于口服给药的依达拉奉混悬剂,其可以减轻ALS患者和照料者的负担,并可以实现与注射剂相当的ALS治疗效果。
[附图简要说明]
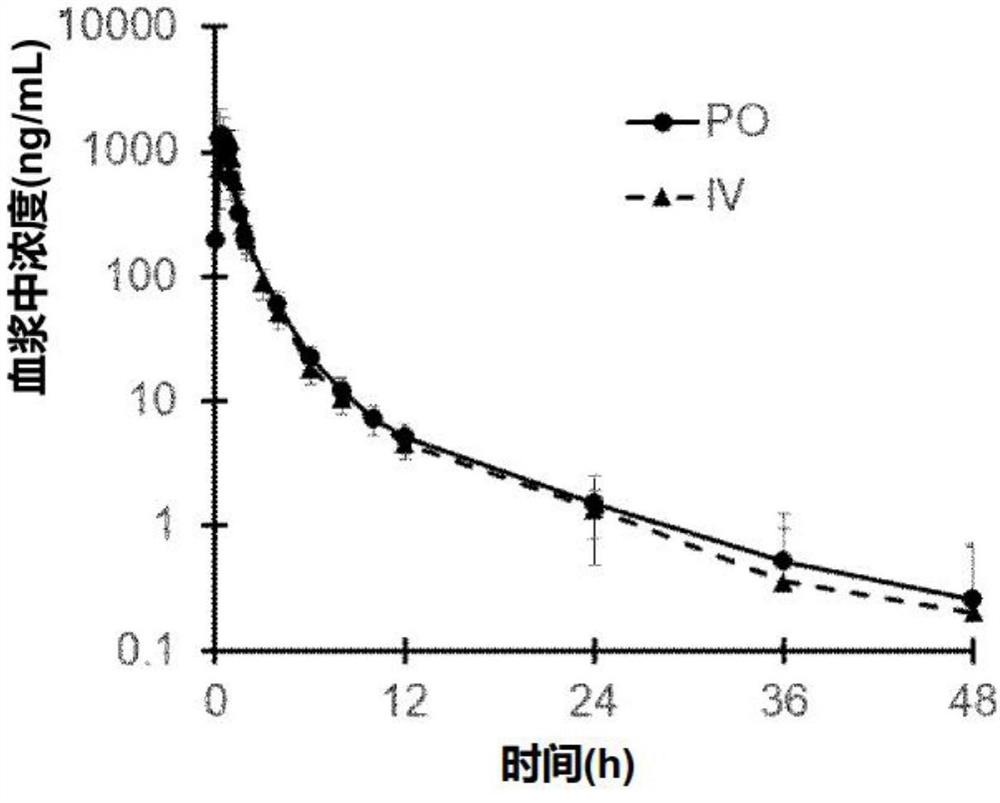
图1是显示实施例26中描述的混悬剂给药时血浆中未改变的依达拉奉的PK曲线和依达拉奉注射给药时血浆中未改变的依达拉奉的PK曲线的图,其中PO为混悬剂,并且IV为注射剂。
[具体实施方式]
在下文中,对本发明的用于口服给药的依达拉奉混悬剂和用于制备所述用于口服给药的依达拉奉混悬剂的药盒进行详细说明。本说明书中引用的所有出版物均通过援引加入本说明书中。
另外,在本说明书中,除非另有说明,“%(w/v)”是指相对于混悬剂的体积的重量%,并且使用“-”表示的数值范围表示包括将“-”的前后的数值分别作为最小值和最大值的范围。
本发明的用于人类口服给药的混悬剂含有依达拉奉颗粒、分散剂和水。因此,本发明的混悬剂减轻了ALS患者和照料者的负担,并取得了与注射剂相当的ALS治疗效果。
本发明的混悬剂可以根据需要进一步含有增稠剂。
因此,即使是吞咽困难的患者也能够容易地饮用而没有误吸的风险,并且能够较长时间地维持依达拉奉颗粒的分散状态。此外,通过含有增稠剂,当将所述混悬剂向人类给药时,患者血液中药物浓度的变化可以大大降低,并且可以预期更稳定的药物效果。
本发明中的依达拉奉是公知的化合物,并且本领域技术人员可以容易地合成,例如,使用日本专利公开第H5-31523号中描述的方法。
本发明的混悬剂中所含的依达拉奉颗粒为含有依达拉奉的固体颗粒,并且可以仅由依达拉奉形成,或者也可以含有其他组分。依达拉奉可以为结晶态或无定形态。
所述混悬剂中依达拉奉颗粒的粒径不特别限定。然而,从例如在混悬剂中保持稳定的分散状态、快速体内吸收和当服用所述混悬剂时的光滑感的角度来看,优选D50粒径(基于体积累积50%粒径)的范围是10μm-100μm,并且D90粒径(基于体积累积90%粒径)范围是50μm-300μm;并且,更优选范围是20μm-80μm的D50粒径,和范围是100μm-250μm的D90粒径。在本发明中,所述累积50%粒径和所述累积90%粒径是基于体积的粒径。
使用激光衍射粒径分布装置(Sympatec/HELOS&CUVETTE),通过将一部分混悬剂分散在用于测量的分散介质(依达拉奉饱和水溶液)中,来测量混悬剂中依达拉奉颗粒的粒径分布。
本发明的混悬剂中混合的依达拉奉颗粒的浓度(混合量)可根据提供给ALS患者的依达拉奉的最佳剂量和混悬剂的量(一次剂量、日剂量、周剂量、10天剂量等)适当调整。然而,允许保持作为混悬剂的剂型的量是适当的。当依达拉奉颗粒仅由依达拉奉形成时,依达拉奉颗粒的配置可以为2mg/mL或更高,其等于或高于依达拉奉对分散介质(例如水)的饱和溶解度,且优选为0.06%(w/v)-36%(w/v),更优选为0.5%(w/v)-36%(w/v),或0.5%(w/v)-20%(w/v),甚至更优选为1%(w/v)-20%(w/v),或1%(w/v)-10%(w/v),且最优选为1%(w/v)-5%(w/v)。
本发明的混悬剂含有分散剂。因此,本发明的混悬剂中的依达拉奉颗粒处于良好的分散状态,并且即使在长期储存后依达拉奉颗粒沉降时,通过摇动(例如,手动或机械摇动)也能迅速再分散依达拉奉颗粒。再分散行为可通过目测或使用光谱法(例如,使用激光衍射粒径分布装置)来确认。
作为分散剂,可以使用任何能使依达拉奉颗粒良好分散于水中而不引起依达拉奉颗粒形成二次团聚物的分散剂。这类分散剂的实例是显示1%或更高的透射散射光强度的分散剂。在此,“1%或更高”是指1%-100%的范围。
所述显示X%或更高的透过散射光强度的分散剂是指当测量通过混合40mL的0.1%(w/v)分散剂水溶液和840mg依达拉奉而获得的液体的表面下方的透射散射光强度(ΔT%)时,透射散射光强度为X%或更高的分散剂。例如,显示1%或更高的透射散射光强度的分散剂是指,当测量通过混合40mL的0.1%(w/v)的分散剂水溶液和840mg依达拉奉(D50:37μm,D90:143μm)并将混合物用搅拌器搅拌30分钟或更长时间而获得的液体表面下方的透射散射光强度(ΔT%)时,透射散射光强度为1%或更高的分散剂。另外,这里所述透射散射光强度是指开始测量透射散射光强度之后10分钟获得的值,所述测量通过以下进行:在圆柱状的样品瓶(内径:25mm×外径:27.5mm×高度:72mm)中填充20mL上述液体,并且通过使用TURBISCAN塔(Formulaction制造)(25℃)在样品瓶39-40mm高度处测量透射散射光强度。
显示1%或更高的透射散射光强度的分散剂的实例包括聚乙烯醇、蔗糖脂肪酸酯、聚山梨醇酯、甲基纤维素和羟丙甲纤维素。
此外,作为分散剂,也可以适当地使用显示80度或更小的接触角的分散剂。这里,“80度或更小”表示0-80度的范围。显示80度或更小的接触角的分散剂是指,在依达拉奉片剂上滴加依达拉奉饱和水溶液(包含溶解于其中的0.1%(w/v)的分散剂)的液滴时,该液滴的切线与依达拉奉片剂表面所成的角度(接触角)为80度或更小的分散剂。这里,所述依达拉奉片剂是指通过在直径8mm的平冲头上,在800kg的压片压力下,将120mg依达拉奉(D50:37μm,D90:143μm)压缩成型而得到的依达拉奉片剂,并且接触角的测量是指其中使用接触角测量装置(由Kyowa Interface Science制造的CAX-150)在以下条件下测量接触角的情况:
使用的注射器:玻璃,1mL
针:23规格
液体体积:1μL
测量时间:3.1秒后
接触角为80度或更小的分散剂的实例包括聚乙烯醇、蔗糖脂肪酸酯、聚山梨醇酯、羟丙甲纤维素等。
优选的分散剂的具体实例是选自聚乙烯醇、蔗糖脂肪酸酯、聚山梨醇酯、甲基纤维素和羟丙甲纤维素中的一种或多种。特别优选地,所述分散剂是选自聚乙烯醇和甲基纤维素中的一种或两种,并且最优选地,所述分散剂是聚乙烯醇。
作为聚乙烯醇,优选皂化度为86.5-89.0的聚乙烯醇,其4%水溶液在20℃下的运动粘度为3mm
这些分散剂可以各自独立地使用,或者可以将这些分散剂中的两种或更多种组合使用。
所述分散剂的混合量可以在使依达拉奉颗粒分散且不会对可制造性产生不良影响的范围内选择,通常范围是0.001%(w/v)-1.0%(w/v),优选为0.005%(w/v)-0.5%(w/v),并且最优选为0.01%(w/v)-0.1%(w/v)。
在本发明的混悬剂中,为了使依达拉奉颗粒长时间保持良好的分散状态,可以混合增稠剂。通过含有增稠剂,即使对于吞咽困难的患者也能够实现容易地吞咽而没有误吸的风险的效果,并且当向人类给药时,患者血液中药物浓度的变化大大降低,并且可以预期更稳定的药物效果。
作为增稠剂,可以使用药学上已知的增稠剂。具体地,例如可以使用羧甲基纤维素钠、糊精、黄芪胶粉、黄原胶等。从依达拉奉的储存稳定性的角度而言,优选黄芪胶粉和黄原胶,并且最优选黄原胶。
这些增稠剂可以各自独立地使用,或者可以将这些增稠剂中的两种或更多种组合使用。
所述增稠剂的较大混合量使得分散状态保持更长的时间。然而,当所述混合量太大时,粘度大并且可制造性劣化,并且药品变得难以吞咽且沉降颗粒在长期储存后的再分散性也会劣化,因此,这是不利的。例如,所述增稠剂为黄原胶,所述增稠剂的混合量可为0.1%(w/v)-1.2%(w/v),并且优选0.2%(w/v)-1.0%(w/v),并且最优选0.3%(w/v)-0.5%(w/v)。
通过混合增稠剂可以赋予所述混悬剂粘度,使得即使是吞咽困难的患者也容易饮用所述混悬剂,并且可以防止误吸,因此是优选的。这样的混悬剂的粘度的范围可以是不超过1750mPa·s,优选范围是50mpa·s-1750mPa·s,并且最优选范围是150mPa·s-900mPa·s。
所述增稠剂的混合量不限于上述描述,并且可以适当地调整以实现上述粘度。
另外,通过混合增稠剂取得了预料不到的效果,即,当将所述混悬剂向患者给药时,可以使患者血液中依达拉奉浓度变化最小化,因此,可以预期对所有患者具有稳定的药效。
在本发明用于口服给药的混悬剂中,为了调整作为口服给药的药品的混悬剂的味道,并且通过提高混悬剂的溶液密度来延迟依达拉奉颗粒的沉降的目的,可以混合甜味剂。在甜味剂中,与其它添加剂相比,糖可以提高混合比,并且可有助于提高溶液密度。此外,通过溶解糖,可以使溶液密度接近所述颗粒的密度,并且可以有助于抑制所述颗粒的沉降速度。
期望所述混悬剂的密度接近所述依达拉奉颗粒的密度,并且范围是等于或超过水的密度,并且优选范围是1g/mL-1.5g/mL,并且最优选范围是1.05g/mL-1.2g/mL。
所述甜味剂的实例包括糖、人造甜味剂和非糖甜味剂。糖的具体实例包括甘露醇、山梨糖醇、木糖醇、麦芽糖醇、赤藓糖醇、蔗糖、海藻糖、乳糖、麦芽糖、葡萄糖、甘油等。人类造甜味剂的具体实例包括三氯蔗糖、阿斯巴甜、乙酰磺胺酸钾、糖精等。非糖甜味剂的具体实例包括奇异果甜蛋白、甜叶菊提取物等。其中,优选山梨糖醇、木糖醇或蔗糖,更优选山梨糖醇或蔗糖,并且最优选山梨糖醇。
这些甜味剂可以各自独立使用,或者可以将这些甜味剂中的两种或更多种组合使用。
在考虑接受者的喜好和颗粒沉降的抑制下,所述甜味剂的混合量可以适当调整。但是,山梨糖醇的混合量为5%(w/v)-70%(w/v),优选为10%(w/v)-60%(w/v),并且更优选为20%(w/v)-50%(w/v)。
作为本发明的混悬剂中的药物成分的依达拉奉具有易受液体中溶解氧氧化的性质,因此,优选混合已知的稳定剂。这样的稳定剂的实例包括抗氧化剂(如亚硫酸盐、亚硫酸氢盐和焦亚硫酸盐)、半胱氨酸、甲硫氨酸、聚乙二醇、聚氧乙烯聚氧丙烯二醇、EDTA等。特别优选的是日本专利公开第H7-121861号中描述的稳定剂。即,所述稳定剂是选自亚硫酸盐、亚硫酸氢盐和焦亚硫酸盐中的一种或多种抗氧化剂,和选自半胱氨酸的稳定剂。
亚硫酸盐的实例包括亚硫酸钠(Na
所述抗氧化剂的添加量优选为0.001%(w/v)-0.5%(w/v),并且特别优选为0.01%(w/v)-0.2%(w/v),并且半胱氨酸的添加量优选为0.005%(w/v)-0.5%(w/v),并且特别优选为0.01%(w/v)-0.2%(w/v)。
另外,由于已知在2.5或更低的pH下以及在6.0或更高的pH下依达拉奉的氧化加速,所以优选在本发明的混悬剂中混合pH调节剂。所述pH调节剂的用量可以将所述混悬剂的pH调节到2.5-6.0的范围,优选3.0-4.5的范围。可以使用碱或酸将pH调节至期望的值。当需要降低pH时,可以使用酸性pH调节剂(例如盐酸、磷酸、乙酸、柠檬酸、酒石酸等,优选磷酸)。当需要提高pH时,可以使用碱性pH调节剂(例如,氢氧化钠、氢氧化钾、碳酸钙、氧化镁、氢氧化镁等,优选氢氧化钠)。
在本发明的混悬剂中,必要时,可以进一步混合诸如香料、防腐剂和消泡剂的药学上可接受的药品添加剂。
可以使用各种调味剂(例如柑橘调味剂(例如橙子、柠檬和葡萄柚)、桃、葡萄、香草、苏打和浆果调味剂(例如草莓、酸果蔓和蓝莓))的香料。香料的优选混合量为,例如0.05%(w/v)-0.2%(w/v)。
消泡剂的实例包括二甲基硅油乳液、脂肪酸酯、聚山梨醇酯、乙醇等。消泡剂的混合量为例如0.01%(w/v)-0.05%(w/v)。
防腐剂的实例包括对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、苯甲酸、山梨酸、苯甲酸钠、苯甲醇、苯乙醇等。防腐剂的混合量为,例如0.01%(w/v)-0.5%(w/v)。然而,在本发明的混悬剂中,出乎预料地,即使没有防腐剂也没有观察到细菌的生长,因此不需要防腐剂。
本发明的用于口服给药的混悬剂中使用的液体介质(分散介质)优选为水,并且可以含有药学上可接受的有机溶剂。这样的有机溶剂的实例包括丙二醇(1,2-丙二醇)、聚乙二醇300、聚乙二醇400、乙醇等。
本发明的混悬剂中优选的组分组合的实施方案如下所述,但不限于此。
(1)依达拉奉颗粒、聚乙烯醇(分散剂)、黄原胶(增稠剂)、山梨糖醇(甜味剂)、亚硫酸氢钠(稳定剂)、L-半胱氨酸盐酸盐(稳定剂)、磷酸(pH调节剂)、氢氧化钠(pH调节剂)、二甲基硅油乳液(消泡剂)和水。
(2)依达拉奉颗粒、聚乙烯醇(分散剂)、黄芪胶粉(增稠剂)、山梨糖醇(甜味剂)、亚硫酸氢钠(稳定剂)、L-半胱氨酸盐酸盐(稳定剂)、磷酸(pH调节剂)、氢氧化钠(pH调节剂)、二甲基硅油乳液(消泡剂)和水。
(3)依达拉奉颗粒、蔗糖脂肪酸酯(分散剂)、黄原胶(增稠剂)、蔗糖(甜味剂)、亚硫酸氢钠(稳定剂)、L-半胱氨酸盐酸盐(稳定剂)、乙酸(pH调节剂)、氢氧化钠(pH调节剂)、二甲基硅油乳液(消泡剂)和水。
(4)依达拉奉颗粒、聚乙烯醇(分散剂)、黄原胶(增稠剂)、山梨糖醇(甜味剂)、亚硫酸氢钠(稳定剂)、磷酸(pH调节剂)、氢氧化钠(pH调节剂)、二甲基硅油乳液(消泡剂)和水。
(5)依达拉奉颗粒、聚乙烯醇(分散剂)、黄原胶(增稠剂)、山梨糖醇(甜味剂)、亚硫酸氢钠(稳定剂)、L-半胱氨酸盐酸盐(稳定剂)、磷酸(pH调节剂)、氢氧化钠(pH调节剂)、二甲基硅油乳液(消泡剂)、香料和水。
本发明的混悬剂中,所述依达拉奉颗粒长时间保持良好的分散状态。因此,即使当从整个溶液中分配一定量时,也总是能够确保药物含量的均匀性。此外,本发明的混悬剂具有诸如以下的特征:即使依达拉奉颗粒在长期储存后沉降,所述依达拉奉颗粒也可以通过摇动而迅速再分散;依达拉奉的化学稳定性在如此长的储存期间不受损害;并且即使没有防腐剂也没有细菌生长。
另外,本发明的药品通过进一步混合增稠剂,还可以实现以下效果:由于赋予了药品适当的粘度,因此即使是吞咽困难的患者也能够容易地服用并且降低了误吸的风险,并且在将该药品向人类给药时,患者血液中药物浓度的变化降低,可以预期稳定的药效。
本发明的混悬剂表现出优异的生物利用度。因此,非常低的作为口服剂量的依达拉奉剂量(具体地为90-120mg,更具体地为100-110mg,并且最具体地为105mg)可达到与目前在临床环境中用作ALS治疗剂的依达拉奉注射剂(例如日本商品名的“Radicust”(注册商标))给药(在1小时内静脉注射60mg依达拉奉)时相当的血液中药物浓度变化。
具体地,对于本发明的混悬剂,当使用依达拉奉注射剂作为对照来进行交叉研究时,相对于所述对照药品的Cmax几何平均值之比的90%置信区间的下限和相对于所述对照药品的AUC
此外,在本发明的混悬剂的上述研究中,相对于所述对照药品的Cmax几何平均值之比的90%置信区间的范围是0.8-2.0,并且相对于所述对照药品的AUC
此外,在本发明的混悬剂的上述研究中,相对于所述对照药品的Cmax几何平均值之比的90%置信区间的范围是0.8-1.5,并且相对于所述对照药品的AUC
此外,在本发明的混悬剂的上述研究中,相对于所述对照药品的Cmax几何平均值之比,和相对于所述对照药品的AUC
当将本发明的混悬剂(例如,依达拉奉为90-120mg,更具体地为100-110mg,并且甚至更具体地为105mg)向人类口服给药时,平均Cmax的范围是500-2500ng/mL,并且平均AUC
与上述依达拉奉注射剂等效的混悬剂的实例包括但不限于具有以下组成的混悬剂。
依达拉奉颗粒:2.1%(w/v)
聚乙烯醇(分散剂):0.1%(w/v)
黄原胶(增稠剂):0.3%(w/v)
山梨糖醇(甜味剂):40%(w/v)
亚硫酸钠(稳定剂):0.1%(w/v)
L-半胱氨酸盐酸盐(稳定剂):0.05%(w/v)
氢氧化钠(pH调节剂):适量
磷酸(pH调节剂):适量
二甲基硅油乳液(消泡剂):0.05%(w/v)
分散介质:水
通过口服给药5mL该混悬剂(依达拉奉105mg),获得与在60分钟内静脉注射依达拉奉注射剂(依达拉奉60mg)的情况相当的血浆浓度变化。
本发明的所述用于口服给药的混悬剂可以通过将上述依达拉奉颗粒、分散剂和必要时的其它组分(增稠剂、甜味剂等)与水混合来制备。
所述依达拉奉颗粒使用优选具有2μm-50μm的D50粒径(基于体积累积50%粒径)和100μm-250μm的D90粒度(基于体积累积90%粒径)。为了制备具有上述粒径的依达拉奉颗粒,例如,当依达拉奉颗粒仅由依达拉奉形成时,可以使用已知的粉碎机如气流粉碎机、锤式粉碎机、针式粉碎机或球磨机将用日本专利公开第H5-31523号等中描述的方法获得的依达拉奉原始粉末调节为具有所需粒径的依达拉奉颗粒。所述依达拉奉颗粒的粒径可以使用激光衍射粒径分布仪(Sympatec/HELOS&CUVETTE)通过干法测量。
通过改变所用依达拉奉颗粒的粒径,可以改变依达拉奉从获得的药品中的溶出速率。具体地,粒径越小,溶出越快。例如,当所述依达拉奉颗粒是使用上述方法获得的依达拉奉原始粉末的粉状产品时,D50粒径的范围是10μm-50μm,D90粒径的范围是50μm-200μm,以及优选地,D50粒径范围是20μm-40μm,且D90粒径范围是70μm-150μm或更小。因此,当根据日本药典进行溶出试验时(试验溶液:第一溶液、第二溶液、0.05mol/L的乙酸和乙酸钠缓冲溶液(pH 4.0)等;桨叶转速:50rpm-75rpm),得到在所述试验开始30分钟后依达拉奉溶出度为80%或更高的药品,因此可以预期获得快速的药效。
对于本发明的混悬剂,在将组分混合后,可以使用已知的混合方法(如搅拌、摇动和超声辐射)制备均匀的混悬剂。
合适的制备方法的实例是其中使依达拉奉颗粒均匀分散(悬浮)在溶解有分散剂的水中(分散剂溶液)的方法。这种情况包括将依达拉奉颗粒放入分散剂溶液中,以及将分散剂溶液加入依达拉奉颗粒中。
在依达拉奉颗粒分散之前,可以预先向所述分散剂溶液中加入其它组分(如增稠剂和甜味剂),或者可以在依达拉奉颗粒分散的同时加入,或者可以在依达拉奉颗粒分散之后加入。此外,这些组分的添加时机对于每个组分可以不同。
本发明用于口服给药的混悬剂以其中依达拉奉颗粒悬浮的状态提供,这是优选的,因为在给药时操作较少。但是,还可以提供在使用时制备的药盒,其中将依达拉奉颗粒和水分开。这样形式的实例是用于制备依达拉奉混悬剂的药盒,其包含:(A)含有依达拉奉颗粒的固体组合物;和(B)分散剂溶液。与制备的混悬剂相比,可以预期在使用时制备的药盒在更长时间内具有储存稳定性。
(A)含有依达拉奉颗粒的固体组合物可以仅含有依达拉奉颗粒,或者可以为还含有其它组分的混合物。作为依达拉奉颗粒,可以使用用于制备混悬剂的那些颗粒。另外,使用已知方法将含有依达拉奉颗粒的固体组合物粒化,并且可以将其精细粒化或粒化,或压制并压片。
另外在(B)分散剂溶液中,不仅可以加入本发明中使用的分散剂,还可以加入其它组分如增稠剂和甜味剂。医护人员可以将(A)和(B)混合并摇动混合物获得本发明的混悬剂。
此外,本发明用于口服给药的混悬剂可以以固体组合物的形式提供,其允许在使用时仅通过加入水来制备本发明的混悬剂,即,以含有依达拉奉颗粒和分散剂的固体组合物的形式提供。当然,该固体组合物可以含有用于本发明所述混悬剂的其它组分,例如增稠剂和甜味剂。另外,使用已知方法将所述固体组合物粒化,并且可将其精细粒化或粒化,或压制并压片。
在该实施方案中,医护人员可以将含有依达拉奉颗粒和分散剂的固体组合物与水混合,并摇动混合物以获得本发明的混悬剂。
将本发明的混悬剂使用间断给药方法给药,该方法在WO 2005/75434中描述,并且目前用于在临床环境中使用依达拉奉注射剂的ALS治疗,即其中以给药期和休药期为一个单位,并将其重复两次或更多次的给药方法。当给药期和休药期重复两次或更多次时,该时期的结束总是休药期。然而,不必提供最后的休药期。即,例如,当给药期和休药期重复两次时,这是“给药期、休药期、给药期和休药期”的情况;然而,在不提供最后的休药期的情况下,也可以是“给药期、休药期和给药期”的情况。
休药期是指在7天或更多,优选14天内不进行连续给药的期间。
给药期可以是14天,或14天中的10天。14天中的10天表示14个连续天中的任意10天。进行给药的10天可以是连续10天或由一个或多个时段(在其中每个中,1-4天不进行给药)隔开的不连续的10天。作为给药期,可以在观察患者状况的同时选择优选的周期。
更具体地,一个实例是其中在14天的初始给药期之后提供14天的初始休药期,然后重复14天中的10天的给药期和14天的休药期的方法。14天中的10天给药期和14天休药期的重复次数没有特别限制,只要重复次数为1或更多。
间断给药期间的日剂量可以根据患者的年龄和状况(例如,疾病的严重性)适当地选择。通常,对于成人,依达拉奉的剂量为60mg-400mg,优选60mg-300mg,更优选90mg-210mg,特别优选90mg、100mg、105mg、180mg、200mg或210mg,甚至更优选105mg或210mg,并且最优选105mg。
或者,可将本发明的混悬剂在给药期间每日或几乎每日向患者给药。日剂量可以根据患者的年龄和状况(例如,疾病的严重性)适当地选择。通常,对于成人,依达拉奉的剂量为60mg-400mg,优选60mg-300mg,更优选90mg-210mg,特别优选90mg、100mg、105mg、180mg、200mg或210mg,甚至更优选105mg或210mg,并且最优选105mg。在每日给药和间断给药中,每日的给药次数都没有限制,并且可以在观察患者状况的同时选择优选的每日给药次数。然而,考虑到患者的负担等,每天的给药次数优选为3、2或1次,并且更优选为1次。
此外,在本发明的混悬剂的情况下,可以高含量含有依达拉奉。因此,可以减少含有上述剂量的依达拉奉药品的剂量,这对吞咽困难的患者是有利的。例如,在本发明的混悬剂的情况下,可以制备ALS治疗剂,其每次口服药品的剂量为1-20mL,并且该剂量含有50-210mg依达拉奉。
此外,除了ALS之外,本发明的混悬剂还可以用于已经报道涉及氧化应激的疾病,例如,具有运动功能障碍的神经系统变性疾病(例如帕金森病和脊髓小脑变性);肌肉疾病(例如肌营养不良);具有认知损害的颅内神经系统变性疾病(例如阿尔茨海默病);血管疾病(例如脑梗死);全身性炎症疾病(例如多发性硬化和系统性硬皮病);和局部炎症疾病(例如口腔炎)。
[实施例]
下文中,通过使用实施例和测试例对本发明进行详细说明。然而,本发明不限于此。
实施例1
将200mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)溶解于200mL水中,制成0.1%(w/v)的聚乙烯醇水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散于10mL聚乙烯醇水溶液中,得到用于口服给药的依达拉奉混悬剂。
实施例2
将200mg聚乙烯醇(Nippon Synthetic Chemistry Industry Co.,Ltd.,EG-05P)溶解于200mL水中,再将1000mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)溶解于所得聚乙烯醇水溶液中,制得0.1%(w/v)聚乙烯醇/0.5%(w/v)黄原胶水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL聚乙烯醇/黄原胶水溶液中,得到依达拉奉混悬剂。
实施例3
将200mg聚乙烯醇(Nippon Synthetic Chemistry Industry Co.,Ltd.,EG-05P)溶解于200mL水中,再将1000mg黄芪胶粉(Suzu Funmatsu Yakuhin K.K.)溶解于所得的聚乙烯醇水溶液中,制得0.1%(w/v)聚乙烯醇/0.5%(w/v)黄芪胶粉水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL聚乙烯醇/黄芪胶粉水溶液中,得到依达拉奉混悬剂。
实施例4
将200mg甲基纤维素(Shin-Etsu Chemical Co.,Ltd.,SM-25)溶解于200mL水中,制成0.1%(w/v)的甲基纤维素水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL甲基纤维素水溶液中,得到依达拉奉混悬剂。
实施例5
将200mg甲基纤维素(Shin-Etsu Chemical Co.,Ltd.,SM-25)溶解于200mL水中,再将1000mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)溶解于所得甲基纤维素水溶液中,制得0.1%(w/v)甲基纤维素/0.5%(w/v)黄原胶水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL甲基纤维素/黄原胶水溶液中,得到依达拉奉混悬剂。
实施例6
将200mg甲基纤维素(Shin-Etsu Chemical Co.,Ltd.,SM-25)溶解于200mL水中,再将1000mg黄芪胶粉(Suzu Funmatsu Yakuhin K.K.)溶解于所得甲基纤维素水溶液中,制得0.1%(w/v)甲基纤维素/0.5%(w/v)黄芪胶粉水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL甲基纤维素/黄芪胶粉的水溶液中,得到依达拉奉混悬剂。
实施例7
将200mg聚乙烯醇(Nippon Synthetic Chemistry Industry Co.,Ltd.,EG-05P)溶解于200mL水中,再将1600mg羧甲基纤维素钠(Daicel FineChem Ltd.,CMC Daicel1150)溶解于所得聚乙烯醇水溶液中,制得0.1%(w/v)聚乙烯醇/0.5%(w/v)羧甲基纤维素钠水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL聚乙烯醇/羧甲基纤维素钠水溶液中,得到依达拉奉混悬剂。
实施例8
将200mg聚乙烯醇(Nippon Synthetic Chemistry Industry Co.,Ltd.,EG-05P)溶解于200mL水中,再将160g糊精(Nippon Starch Chemical Co.,Ltd.,Akadama 3)溶解于所得聚乙烯醇水溶液中,制成0.1%(w/v)聚乙烯醇/0.5%(w/v)糊精水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL聚乙烯醇/糊精水溶液中,得到依达拉奉混悬剂。
实施例9
将200mg甲基纤维素(Shin-Etsu Chemical Co.,Ltd.,SM-25)溶解于200mL水中,再将1600mg羧甲基纤维素钠(Daicel FineChem Ltd.,CMC Daicel 1150)溶解于甲基纤维素水溶液中,制成0.1%(w/v)甲基纤维素/0.5%(w/v)羧甲基纤维素钠水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL甲基纤维素/羧甲基纤维素钠水溶液中,得到依达拉奉混悬剂。
实施例10
将200mg甲基纤维素(Shin-Etsu Chemical Co.,Ltd.,SM-25)溶解于200mL水中,再将160g糊精(Nippon Starch Chemical Co.,Ltd.,Akadama 3)溶解于所得甲基纤维素水溶液中,制成0.1%(w/v)甲基纤维素/0.5%(w/v)糊精水溶液。100mg依达拉奉颗粒(依达拉奉粉末,D50:37μm;D90:143μm)分散在10mL甲基纤维素/糊精水溶液中,得到依达拉奉混悬剂。
实施例11
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例12
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、80mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例13
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例14
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、200mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例15
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、4g D-山梨糖醇、40mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例16
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、4g D-山梨糖醇、120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例17
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、20mg二甲基硅油乳液(Basildon,PD30S)、4g D-山梨糖醇、200mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,得到用于口服给药的依达拉奉混悬剂。
实施例18
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、40mg亚硫酸氢钠、20mg L-半胱氨酸盐酸盐水合物、20mg二甲基硅油乳液(Basildon,PD30S)、4g D-山梨糖醇、120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,向所得混悬剂中加入适量的氢氧化钠和磷酸以调节其pH至4.20,得到依达拉奉混悬剂。
实施例19
将40mg苯甲酸、2mg对羟基苯甲酸丙酯和2mg对羟基苯甲酸丁酯溶解在40mg乙醇中,以制备防腐剂溶液。将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、40mg亚硫酸氢钠、20mg L-半胱氨酸盐酸盐水合物、20mg二甲基硅油乳液(Basildon,PD30S)、4g D-山梨糖醇、120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和800mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,之后加入防腐剂溶液。向所得混悬剂中加入适量的氢氧化钠和磷酸,以将其pH调节至4.20,得到依达拉奉混悬剂。
实施例20
将200mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)溶解于200mL的纯净水中,制得0.1%(w/v)的聚乙烯醇溶液。将120mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)分散于10mL聚乙烯醇溶液中,得到依达拉奉混悬剂。
实施例21
将300mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)分散于10mL实施例20中所获得的0.1%(w/v)聚乙烯醇溶液中,得到依达拉奉混悬剂。
实施例22
将200mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)和1000mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)溶解于200mL纯化水中,制得0.1%(w/v)聚乙烯醇/0.5%(w/v)黄原胶溶液。将300mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)分散于10mL所述聚乙烯醇/黄原胶溶液中,得到依达拉奉混悬剂。
实施例23
使用依达拉奉颗粒(依达拉奉粉末,D50:19μm,D90:73μm)代替实施例19中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
实施例24
使用依达拉奉颗粒(依达拉奉粉末,D50:32μm,D90:110μm)代替实施例19中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例25]
使用依达拉奉颗粒(依达拉奉粉末,D50:44μm,D90:204μm)代替实施例19中所述的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例26]
将40mg聚乙烯醇(Nippon Synthetic Chemical Industry Co.,Ltd.,EG-05P)、40mg亚硫酸氢钠、20mg L-半胱氨酸盐酸盐水合物、20mg二甲基硅油乳液(Basildon,PD30S)、16g D-山梨糖醇、120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG)和840mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)溶解或分散于水中,使混合物的体积变为40mL,并向所得混悬剂中加入适量的氢氧化钠和磷酸,以调节其pH至4.20,得到依达拉奉混悬剂。
[实施例27]
使用依达拉奉颗粒(依达拉奉粉末,D50:17μm,D90:64μm)代替实施例26中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例28]
使用依达拉奉颗粒(依达拉奉粉末,D50:21μm,D90:79μm)代替实施例26中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例29]
使用依达拉奉颗粒(依达拉奉粉末,D50:31μm,D90:124μm)代替实施例26中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例30]
使用依达拉奉颗粒(依达拉奉粉末,D50:46μm,D90:185μm)代替实施例26中的依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm),得到依达拉奉混悬剂。
[实施例31]
使用200mg黄芪胶粉(Suzu Funmatsu Yakuhin K.K.)代替实施例26中的120mg黄原胶(Sansho Co.,Ltd.,KELTROL-CG),得到依达拉奉混悬剂。
测试例1(分散剂的选择)
在室温下制备下表中的药品添加剂的0.1%(w/v)水溶液,所述药品添加剂通常被认为是具有能够将固体颗粒分散在液体中的功能的物质。
将50mL的各添加剂水溶液加入3600mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)中,并用搅拌器搅拌混合物。结果如下表中所示。
[表1]
从上表的结果可以发现,只有聚乙烯醇、甲基纤维素、蔗糖脂肪酸酯和羟丙甲纤维素可以将依达拉奉颗粒适当地分散在水中。
测试例2(透射散射光强度试验))
在室温下制备下表中的药品添加剂的0.1%(W/v)水溶液,所述药品添加剂各自通常被认为是具有能够将固体颗粒分散在液体中的功能的物质。
将40mL的各添加剂水溶液加入至840mg依达拉奉颗粒(依达拉奉粉末,D50:37μm,D90:143μm)中,并用搅拌器搅拌混合物30分钟或更长时间,并确认所述依达拉奉颗粒的分散状态。
另外,将20mL上文得到的分散液填充到样品瓶(内径:25mm×外径:27.5mm×高度:72mm)中,并开始使用TURBISCAN塔(Formulaction制造)(温度设定为25℃)在样品瓶39-40mm高度处测量透射散射光强度ΔT%,将开始测量10分钟后的值作为各添加剂的透射散射光强度ΔT%。添加剂的透射散射光强度ΔT%和依达拉奉颗粒在添加剂溶液中的分散状态如下表中所示。
由上表的结果可见,可适当地分散依达拉奉颗粒的分散剂具有1%或更高的透射散射光强度ΔT%。
测试例3(接触角试验)
将120mg依达拉奉药物(D50:37μm,D90:143μm)用单冲压压片机(压实分析仪)(冲头:直径为8mm的平冲头;压片压力:800kgf)压制成型,得到用于接触角测量的依达拉奉片剂。
在室温下制备依达拉奉饱和水溶液,其中溶解有0.1%(w/v)下表中描述的药品添加剂,其各自通常被认为是具有使固体颗粒分散在液体中的功能的物质,并使用接触角测量装置(Kyowa Interface Science,Inc.,CAX-150)测量相对于上述制备的依达拉奉片剂的接触角。结果如下表中所示。
所用注射器:玻璃,1mL
针:23规格
液体体积:1μL
测量时间:3.1秒后
[表3]
从上述结果和测试例1或2的结果可见,相对于依达拉奉片剂,对含有0.1%(w/v)添加剂的依达拉奉饱和水溶液,显示80度或更小接触角的物质可以将依达拉奉适当地分散在水中。
测试例4(稳定性)
将实施例1-10中制备的依达拉奉混悬剂各5mL装入玻璃瓶中并密封,并将其在60℃下储存4周。4周后,根据日本药典中依达拉奉注射剂所述的纯度试验中的相关物质(i),测量各混悬剂中依达拉奉相关物质的量。结果如下表中所示。
[表4]
从上述结果可见,尽管实施例1-10中任何一个所产生的依达拉奉相关物质的量都很小,但其中使用黄原胶或黄芪胶粉作为增稠剂的实施例1-6的混悬剂中所产生的依达拉奉相关物质的量特别小。
测试例5(含量均匀性试验)
使用注射器从实施例11-14中得到的依达拉奉混悬剂(各40mL)中每次取样5mL,共取样7次。测量5mL混悬剂试样中的依达拉奉的含量。结果如下所示(表中的值是相对于在5mL原混悬剂中含有的100mg依达拉奉的相对值(%))。
[表5]
所有混悬剂都保证了含量均匀性,特别是,在各自含有增稠剂的实施例12-14的混悬剂中,表现出更优选的含量均匀性。
测试例6(再分散性试验)
将实施例15-17中得到的各混悬剂放入离心分离器中,并对其施加6.6小时4000g的重力,使依达拉奉颗粒沉降。离心完成后,用手轻轻摇动各混悬剂。实施例15和16的各混悬剂中的依达拉奉颗粒在10秒内再分散,实施例17的药品中的依达拉奉颗粒在40秒内再分散。上述重力条件相当于储存3年。
测试例7(防腐功效试验)
根据日本药典,使用实施例18-19中得到的混悬剂进行防腐功效试验。虽然没有掺入防腐剂,但实施例18的混悬剂显示出与其中掺入防腐剂的实施例19的混悬剂相当的防腐效果。
[表6]
测试例8
将实施例20-22中得到的依达拉奉混悬剂(10mL)各自向禁食状态的6名健康成年男性口服给药。在给药前和给药后0.25、0.5、1、1.5、2、4、6、8、12、24、36和48小时收集血液样品,并测量血浆中未改变的依达拉奉浓度。获得的PK性质如下表中所示。
[表7]
实施例20(依达拉奉:120mg)的Cmax和AUC
此外,从实施例21和22的PK性质之间的比较可见,通过加入增稠剂,个体血浆中依达拉奉浓度的变化降低,即,可以预期稳定的药效。
测试例9(1)(溶出试验)
根据日本药典的溶出试验方法2(桨法)对实施例19、23、24和25中制备的混悬剂进行溶出试验。
·洗脱液:900ml日本药典溶出试验的第一溶液(pH 1.2)或第二溶液(pH6.8)
·测量方法:240nm波长下的吸光度
·桨叶转速:50rpm
·样品数:n=3
根据仿制药品的生物等效性指导方针测定当实施例19的药品用作标准药品时,开始试验后30分钟依达拉奉溶出率以及其它实施例的溶出特性的相似性,且F2函数(以15、30和45分钟作为溶出率比较时间)的计算结果在下表中显示。发现用于制备依达拉奉混悬剂的依达拉奉的粒径越小溶出越快,并且可以通过改变依达拉奉颗粒的粒径来控制溶出速率。另一方面,从F2函数值来看,在第一溶液(pH1.2)中,实施例23-25的药品显示与实施例19的药品在生物学上等效的溶出特性,并且在第二溶液(pH6.8)中,实施例23和24的药品显示与实施例19的药品在生物学上等效的溶出特性。
[表8]
*50或更高的F2函数值为与标准药品等效。
测试例9(2)(溶出试验)
根据日本药典的溶出试验方法2(桨法)对实施例27-30中制备的混悬剂进行溶出试验。
·洗脱液:900ml的0.05mol/L的乙酸/乙酸钠缓冲液(pH4.0)900ml
·测量方法:240nm波长下的吸光度
·桨叶转速:50rpm
·样品数:n=3
根据仿制药品的生物等效性指导方针测定当实施例29的药品用作标准药品时,开始试验后30分钟依达拉奉溶出率以及其它实施例的溶出特性的相似性,且F2函数(以15、30和45分钟作为溶出率比较时间)的计算结果在下表中显示。发现用于制备依达拉奉混悬剂的依达拉奉的粒径越小溶出越快,并且可以通过改变依达拉奉颗粒的粒径来控制溶出速率。另一方面,从F2函数值来看,实施例27、28和30的药品显示与实施例29的药品在生物学上等效的溶出特性。
[表9]
*50或更高的F2函数值为与标准药品等效。
测试例10(生物等效性试验)
将实施例26中得到的混悬剂在42名日本健康个体中进行非盲、单剂量、随机交叉研究,使用依达拉奉注射剂作为目标药物。
实施例26的依达拉奉混悬剂的给药如下进行:轻轻摇动装有混悬剂的玻璃瓶,用口服给药注射器抽取5mL(105mg依达拉奉)混悬剂,将抽取的混悬剂向在禁食状态下个体口服给药。
所述依达拉奉注射剂的给药是通过在1小时内将200mL依达拉奉注射剂(Radicut注射剂)(60mg依达拉奉)静脉注射于禁食状态下的个体来进行。
实施例26中所述的混悬剂给药时血浆中未变化的依达拉奉的PK曲线和依达拉奉注射剂给药时血浆中未变化的依达拉奉的PK曲线如下图和表中所示。
[表10]
另外,实施例26的药品相对于依达拉奉注射剂的生物等效性评价结果如下表中所示。
[表11]
实施例26的药品给药时的Cmax或AUC
[工业实用性]
本发明的依达拉奉混悬剂特别可用作ALS治疗剂。因此,本发明具有工业实用性。
- 用于口服给药的依达拉奉混悬剂
- 依达拉奉在制备用于预防和治疗脑淀粉样血管病的药物中的应用
