应用免疫荧光干式定量法的COVID-19中和抗体检测试剂盒
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物技术领域,特别是涉及一种新型冠状病毒(COVID-19)中和抗体检测试剂盒。
背景技术
新型冠状病毒(COVID-19)有四种主要的结构蛋白:棘突蛋白(Spike protein,S蛋白),核衣壳蛋白(Nucleocapsid,N蛋白),膜蛋白(Membrane protein,M蛋白),包膜蛋白(Envelope protein,E蛋白)。棘突蛋白S蛋白有两个亚基:S1和S2,其中受体结合结构域(RBD)位于S1亚基上。RBD是棘突蛋白抗原的独特区域,可与人类的ACE2受体结合,COVID-19通过RBD与ACE-2受体的结合,介导病毒进入细胞内部繁殖,从而出现症状,导致发病。
新冠病毒中和抗体可以特异性识别并且结合新冠病毒的RBD位点,在血液中和病毒结合,抢先阻断病毒与人ACE-2结合,从而防止病毒进入细胞繁殖产生症状。对新冠病毒中和抗体检测可以为疫苗研发和效果评价提供有力支撑,可以指导检测人群是否需要加强针、加强接种等。当然,新冠病毒中和抗体检测结果仅供临床参考,不能单独作为诊断或排除病例的依据。
目前,常规的抗体检测(IgG、IgM)方法不能用于新冠疫苗接种人群中和抗体的检测问题。对新冠中和抗体的检测的主要可分为胶体金、免疫荧光法(层析法,LFA),酶联免疫吸附检测(ELISA)和化学发光法。其中胶体金法和免疫荧光法的灵敏度和精密度较差,准确度低,容易受到其他杂光的干扰。ELISA和化学发光法具有更高的检测灵敏性和特异性,但操作复杂、耗时长、需要大型设备和专业操作人员,在灵活性、使用便捷性、检测及时性上存在不足,而且相关试剂需要冷藏保存,在运输及保存条件上要求较高。
CN112051400A公开了一种POCT检测中的胶体金技术,其试纸条上包被鼠抗人IgG抗体的检测线和羊抗鼠IgG抗体的控制线,结合垫上喷涂标记有鼠IgG、新冠病毒RBD或NTD中和位点蛋白的胶体金,通过与胶体金免疫分析读数仪结合,进行待测物含量的检测。此测试方法准确性及灵敏度较差,精密度较难控制。
CN112485436A公开了一种POCT检测中的胶体金技术,其试纸条上包被血管紧张素转化酶2(ACE2)的检测线和鼠抗鸡IgG抗体的控制线,胶体金垫上喷涂标记有胶体金标记的重组新型冠状病毒RBD蛋白,通过肉眼观察检测线显色情况判断是否含有待测物。此该方法只能进行定性检测,其只能得到阴、阳性的结果,最多只能根据显色线的强弱进一步判断强阳,中阳,弱阳,不能进行定量检测,准确区分中和抗体浓度高低,不能为临床提供较多的检测信息。
因此,在POCT检测新型冠状病毒(COVID-19)中和抗体领域,仍需开发一种检验灵敏度高、重现性好、稳定性强、操作便捷的新型冠状病毒(COVID-19)中和抗体检测试剂盒。
发明内容
本发明的目的在于克服现有技术的缺陷,提供一种检验灵敏度高、重现性好、稳定性强、操作便捷的新型冠状病毒(COVID-19)中和抗体检测试剂盒。
为实现上述目的,本发明采取以下技术方案:
一种新型冠状病毒(COVID-19)中和抗体检测试剂盒,包括检测缓冲液、采样管及检测试剂条,所述检测试剂条包括卡壳及设置于所述卡壳中的试纸条,所述卡壳上设有加样孔和检测窗,加样孔显示为样品垫,检测窗显示为硝酸纤维素膜;所述试纸条包括样品垫、荧光结合垫、硝酸纤维素膜、吸水垫及载膜底板,所述载膜底板为最底层,载膜底板上由依次粘接有吸水垫、硝酸纤维素膜、荧光结合垫、样品垫;其特征在于所述硝酸纤维素膜上分别包被有血管紧张素转化酶2(ACE2)构成的检测线及DNP抗体或者DNP-BSA复合物构成的质控线,所述荧光结合垫上包含检测线荧光标记物和质控线荧光标记物,检测线荧光标记物为荧光微球标记的重组新型冠状病毒棘突糖蛋白(RBD),质控线荧光标记物为荧光微球标记的DNP-BSA复合物或者DNP抗体。
进一步的,所述试剂盒中检测缓冲液包括10mM-100mM的Tris、硼酸盐或磷酸盐溶液,浓度为0.1%-1%的表面活性剂,100mM-200mM的盐化合物,浓度为1%-2%的酪蛋白,浓度为0.01%-0.05%的防腐剂,pH为7.5-8.5;所述表面活性剂为吐温20或曲拉通-100,所述防腐剂为proclin300。
进一步的,所述检测线上血管紧张素转化酶2(ACE2)在包被液中浓度为0.5-1.5mg/mL,所述质控线为DNP-BSA复合物或DNP抗体,其在包被液中浓度为0.5-1mg/mL,包被液中除相关蛋白抗体外还包括50mM-100mM磷酸盐缓冲液,浓度为1%-2%的海藻糖,浓度为0.1%-1%的BSA;上述检测及质控蛋白皆以0.5-1.2μL/cm包被于硝酸纤维素膜上,于烘房45℃过夜烘干。
进一步的,所述荧光结合垫的材质为玻璃纤维,采用手工处理或者机器处理,每张玻璃纤维垫喷涂50ml结合垫处理液,处理后放置到网架上,放入37℃烘箱中,12~24h烘干;使用标记物稀释液将荧光微球标记的新型冠状病毒棘突糖蛋白(RBD)稀释100倍,荧光微球标记的DNP多克隆抗体稀释300倍,以喷量为2μl/cm,利用喷点仪器在荧光结合垫上喷涂,放置烘房,在37℃烘干18小时。
进一步的,所述荧光微球为羧基荧光微球。
进一步的,所述结合垫预处理液含有缓冲液、糖类、表面活性剂;所述缓冲液为磷酸盐缓冲液,浓度为10mM-50mM;所述糖类为海藻糖、蔗糖浓度为0.1%-10%;所述表面活性剂为吐温20,浓度为0.1%-1%。
进一步的,所述标记物稀释液含有缓冲液、保护蛋白、糖类、表面活性剂、防腐剂;所述缓冲液为Tris缓冲液,浓度为10mM-50mM;所述保护蛋白为酪蛋白,浓度0.1%-3%;所述糖类为海藻糖、蔗糖,浓度为0.1%-10%;所述表面活性剂为S9,浓度为0.5%-1.5%;所述防腐剂为proclin300,浓度为0.01%-0.1%。
进一步的,所述新型冠状病毒(COVID-19)中和抗体检测试剂盒还包括二维码,所述二维码存储有产品的项目名称、批号信息。
本发明的新型冠状病毒(COVID-19)中和抗体检测试剂盒的检测原理如下:
采用竞争法原理,结合垫上分别有荧光标记的新型冠状病毒棘突糖蛋白(RBD)和荧光标记的DNP多克隆抗体作为显色标记物,在硝酸纤维素膜上的检测线(T)处包被有血管紧张素转化酶2(ACE2),质控线(C)处包被有DNP-BSA复合物。当样本中存在中和抗体将与荧光标记的新型冠状病毒棘突糖蛋白(RBD)结合,并阻止RBD与ACE2之间的蛋白质相互作用,检测线(T)处不存在信号反应。当样本中不存在中和抗体,荧光标记的新型冠状病毒棘突蛋白(RBD),被ACE2捕获,检测线(T)处显色。荧光标记的DNP多克隆抗体扩散到质控线(C)区域被DNP-BSA复合物捕获形成质控区信号带。随着待检样本中和抗体含量的增加,检测线(T)条带的荧光信号亦减少,呈负相关。通过配套仪器收集检测区域的荧光信号,信号值与样本中抗RBD中和抗体的含量呈反比。
本发明与现有技术相比,本发明具有以下有益效果:
(1)本发明通过比较直接竞争和间接竞争的模式,本发明创造性地发现采用间接竞争法比直接竞争法检测新冠中和抗体具有更高的性能优势。本发明试剂盒基于间接竞争模式,检测COVID-19中和抗体的灵敏度更高。间接竞争法中,硝酸纤维素膜上检测线(T线)包被有血管紧张素转化酶2(ACE2),荧光结合垫上有荧光微球标记的新型冠状病毒(COVID-19)重组蛋白RBD。样本中的中和抗体经过样本垫后优先和结合垫上的RBD蛋白结合,剩余的再和包被于膜上的ACE2蛋白结合,这样可以使当样本中仅含有少量的中和抗体时,其能和荧光微球标记的RBD蛋白充分结合,从而能够提高灵敏度。而在直接竞争反应模式中,硝酸纤维素膜上检测线(T线)包被有新型冠状(COVID-19)重组蛋白RBD,荧光结合垫上有荧光微球标记的血管紧张素转化酶2(ACE2)。样本中的中和抗体和荧光微球标记的ACE2蛋白同时与包被于硝酸纤维素膜上的RBD蛋白竞争性的结合,两者结合机率是等同的。若中和抗体量少于荧光微球标记ACE2量时,很可能存在中和抗体未能与RBD蛋白结合的现象,从而T线信号值不受影响,导致漏检的情况产生。
(2)本发明提供的试剂盒配合荧光免疫分析仪进行判读,结果更为准确客观,灵敏度更高,重复性更佳。
(3)本发明提供的试剂盒通过国际标准物质(20/268)进行校准,结果更为准确可靠。
(4)本发明提供的试剂盒可在室温条件下保存,其活性不受影响,经加速热稳定性试验测试显示稳定性良好,无需冷藏,极大方便了试剂盒的储存和运输。
(5)本试剂盒使用简单快速,经济性高,用于对新冠病毒中和抗体的快速检测,适用于普通人群的筛查;并且适用于对新冠病毒的治疗效果及治愈后检测,以及普通正常人群接种疫苗后的效果判断。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
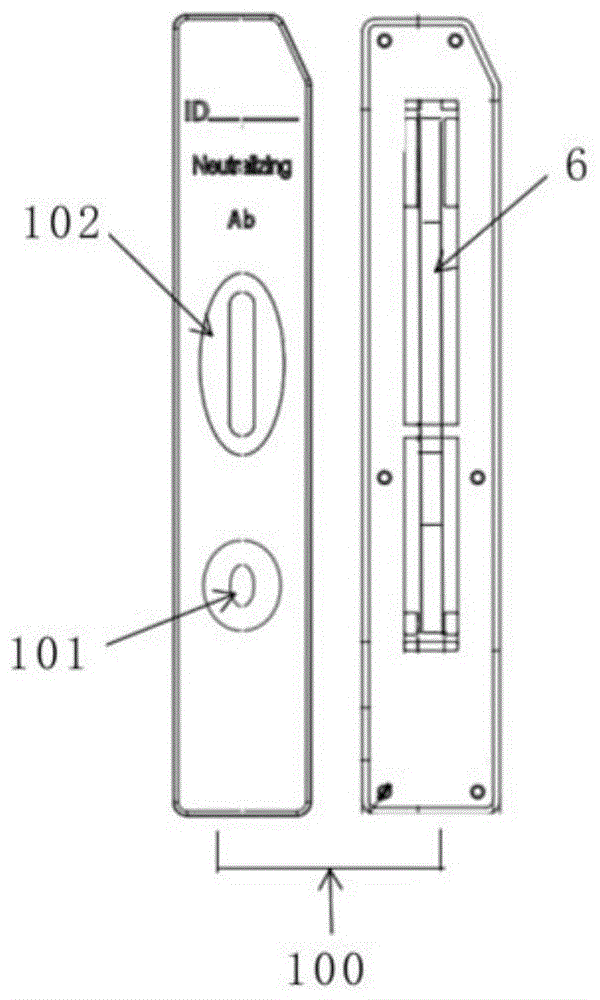
图1为本发明新型冠状病毒中和抗体检测卡的结构示意图。
图2:本发明新型冠状病毒中和抗体检测卡中的试纸条的结构示意图。
其中,1-载膜底板;2-样品垫;3-荧光结合垫;4-硝酸纤维素膜;5-吸水垫;6-试纸条;7-样本;8-荧光标记重组RBD蛋白及荧光标记DNP蛋白;9-检测线:重组ACE2蛋白;10-质控线:DNP-BSA复合物;100-上、下卡壳;101-加样窗口;102-检测窗口。
具体实施方式
为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合附图对本发明作进一步的详细介绍。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
如图1、2所示,本发明的新型冠状病毒(COVID-19)中和抗体检测试剂盒包括检测卡,检测卡包括上下卡壳100及试纸条,所述卡壳100上设有加样孔101和检测窗102,试纸条设置在卡壳100内,试纸条包括载膜底板1、吸水垫5、样品垫2、硝酸纤维素膜4、荧光结合垫3,载膜底板1上依次粘贴样品垫2、荧光结合垫3、硝酸纤维素膜4及吸水垫5,样品垫2和荧光结合垫3部分叠加,荧光结合垫3与硝酸纤维素膜4第一端部分叠加,硝酸纤维素膜的4第二端与吸水垫5部分叠加,硝酸纤维素膜4上设有检测线9与质控线10,检测线在靠近加样孔一端,质控线在远离加样孔一端,加样孔显示为样品垫2,检测窗显示为硝酸纤维素膜4。
检测线9与质控线10平行且线间距为5mm,荧光结合垫3上喷有荧光微球标记的重组新型冠状病毒RBD蛋白、荧光微球标记的DNP抗体。
该新型冠状病毒(COVID-19)中和抗体检测试剂盒的检测原理在于,在测试过程中,将血液样本与检测缓冲液分别添加到样本孔中,并扩散至荧光垫,在此处荧光标记的S-RBD蛋白抗原与血液样本中的新型冠状病毒中和抗体结合。然后通过毛细管作用迁移到试纸的硝酸纤维素膜中,游离的S-RBD蛋白抗原被捕获到已经固定在试纸上的ACE2蛋白上。因此,血液样本中的新型冠状病毒中和抗体越多,则试纸上积累的S-RBD蛋白抗原越少。检测器的荧光信号强度反映所捕获的新型冠状病毒中和抗体的量,并通过免疫荧光分析仪进行分析,以显示血液样本中新型冠状病毒中和抗体的浓度。
进一步的,新型冠状病毒(COVID-19)中和抗体检测试剂盒还包括样品稀释液,该样品稀释液含有缓冲液、表面活性剂及防腐剂。检测时,吸取20μL全血、血清或血浆加入加样孔中,再滴加两滴缓冲液到检测卡的加样孔上,反应10min后,将试剂卡插入荧光免疫分析仪中即可进行检测。该检测方法方便快捷、反应充分、操作简单。
该新型冠状病毒(COVID-19)中和抗体检测试剂盒基于新型冠状病(COVID-19)中和抗体作为检测标志物,可以为新冠疫苗的免疫效果评价提供有力支撑,可以指导检测人群是否需要加强针、加强接种等。当然,新冠病毒中和抗体检测结果仅供临床参考,不能单独作为诊断或排除病例的依据。
具体地,在其中一个实施例中,所述样品稀释液包括缓冲液、表面活性剂、防腐剂、保护蛋白及其他盐化合物,其中缓冲液为20mM-50mMTris缓冲液,所述缓冲液提供一定的pH和离子浓度,利于层析中一些免疫或其他反应的进行;所述表面活性剂为吐温20,浓度为0.1%-1%,有利于层析过程中活性组分均匀快速的流动;所述防腐剂为proclin300,浓度为0.01%-0.1%,所述防腐剂可抑制溶液长菌,酪蛋白及其他盐能够稳定产品性能降低样本干扰。
在其中一个实施例中,所述新型冠状病毒(COVID-19)中和抗体检测试剂盒还包括二维码,所述二维码存储有产品的项目名称、批号及标准曲线数据。与配套的干式荧光免疫分析仪使用,将二维码扫入后,读取相关信息。
在其中一个实施例中,所述检测卡中上、下卡壳内部构造不同会对产品重复性和灵敏度性能产生影响。
实施例1
(一)试剂卡的制备
(1)检测线及质控线的制备:
①包被稀释液的准备:称取磷酸氢二钠、磷酸二氢钾、氯化钠、甲醇、Procling-300、牛血清白蛋白、海藻糖用纯化水彻底溶解,其终浓度分别为10g/L、1g/L、10g/L、50L/1000L、2.5L/1000L、1g/L、20g/L,检测溶液pH值,如不在pH7.4±0.05范围,则使用盐酸或氢氧化钠调节至pH7.4±0.05。配制完成后2℃-8℃保存。
②检测线及质控线包被液准备:利用包被液将血管紧张素转化酶2(ACE2)及DNP-BSA复合物浓度稀释至1.0mg/mL。
③划膜:先将硝酸纤维素膜黏贴在载膜底板上,用连续划膜机机将稀释好的检测线及质控线溶液按0.7uL/cm的液量均匀点划到硝酸纤维素膜上,质控线靠近加样端,检测线在吸水端;质控线距加样端底边为29mm±0.5mm,检测线距加样端底边为34mm±0.5mm然后放入电热鼓风干燥箱45℃过夜烘干。
(2)预处理结合垫的制备:
①结合垫预处理液准备:称取磷酸二钠钠、磷酸二氢钾、氯化钠及海藻糖用纯化水彻底溶解,其终浓度分别为10g/L、1g/L、10g/L、20g/L。
②结合垫预处理:结合垫的材质为玻璃纤维,采用手工处理或者机器处理,每张玻璃纤维喷涂50ml结合垫处理液。处理后放置到网架上,放入37度烘箱中,12~24h烘干。
(3)荧光微球标记新型冠状(COVID-19)重组蛋白RBD及荧光微球标记DNP抗体准备:
①荧光微球的活化:利用MEST缓冲液清洗荧光微球后,在其中加入NHS、EDC使其终浓度达到20mg/ml,旋转混匀仪室温避光反应半小时。
②新型冠状(COVID-19)重组蛋白RBD及DNP抗体标记:利用MEST缓冲液清洗后,每1mg微球加入100ug蛋白或抗体混匀后,旋转混匀仪室温避光反应两小时。
③新型冠状(COVID-19)重组蛋白RBD荧光微球标记物及DNP抗体荧光微球标记物的封闭:标记后在其中加入1%-2%的牛血清白蛋白或脱脂奶粉混匀后,旋转混匀仪室温避光反应一小时。
④新型冠状(COVID-19)重组蛋白RBD荧光微球标记物及DNP抗体荧光微球标记物的保存:将封闭后的新型冠状(COVID-19)重组蛋白RBD荧光微球标记物及DNP抗体荧光微球标记物用含1%酪蛋白的100mM硼酸-硼酸盐缓冲液保存。
(4)荧光结合垫的制备:
①标记物稀释液的准备:在100mM Tris缓冲液中分别加入酪蛋白、吐温-20、S9、海藻糖使其终浓度分别为2g/L、5g/L、0.5g/L、20g/L,最终利用盐酸调节pH至8.0。
②荧光标记物喷点溶液准备:在标记物稀释液中加入1.5%-2.5%新型冠状(COVID-19)重组蛋白RBD荧光标记物及0.5%-1%DNP抗体荧光微球标记物。
③荧光标记物喷点:用喷金标机将荧光标记物喷点溶液溶液按2μL/cm的喷量均匀喷点到预处理结合垫上,喷金标机滑台下降高度设定为50,喷嘴高度设定为30mm。喷点长度设定为300mm。喷点完成后置于35~39℃烘干12~24小时。
(5)样品垫的制备:
①样品垫处理液准备:称取磷酸氢二钠、磷酸二氢钾、蔗糖、吐温-20、S17用纯化水溶解,其浓度分别为10g/L、1g/L、30g/L、2g/L。
②样品垫喷洒及干燥:采用手工处理或者机器处理,每张玻璃纤维喷涂50ml样品垫处理液。处理后放置到网架上,放入37℃烘箱中,12~24h烘干。
(6)试剂卡的组装:将包被好硝酸纤维素膜及载膜底板放置于模具中,将吸水纸、荧光结合垫、样品垫分别裁切至18mm、10mm、17mm宽,随后将切好吸水纸、荧光结合垫、样品垫按照图2的结构搭接,也即:载膜底板1上依次粘贴样品垫2、荧光结合垫3、硝酸纤维素膜4及吸水垫5,样品垫2和荧光结合垫3部分叠加,荧光结合垫3与硝酸纤维素膜4第一端部分叠加,硝酸纤维素膜的4第二端与吸水垫5部分叠加,硝酸纤维素膜4上设有检测线9与质控线10,检测线在靠近加样孔一端,质控线在远离加样孔一端。
随后将试剂卡切成特定宽度的试纸条,将试纸条放入壳体中固定位置,盖上盖,压卡,加样孔101显示为样品垫2,检测窗102显示为硝酸纤维素膜4。封入铝箔袋中,加入硅胶干燥剂,密封。
(二)样品稀释液的制备:
使用10mM的Tris缓冲液稀释吐温20至0.5%的浓度,再加入1.5%的盐化合物,再加入1%的Casein蛋白,并添加0.05%Proclin300,调节pH至8.0,混匀,分装至缓冲液管中。
(三)校准曲线的制备
利用组装好产品对图2所述国际标准品进行测试,每个梯度分别测试3组,分别将每次检测的试纸条放入荧光免疫分析仪中读取荧光信号值。结果如下表1:
利用四参数拟合中和抗体定量标准曲线参数如下表2
曲线拟合后利用20/268(实际包括20/150、20/148、20/144、20/140、20/142,浓度由高到低共5支),及其稀释品进行验证,验证结果如下表3:
以上结果表面本发明所述试剂盒产品检测结果与国际标准品具有较好的相关性,具有较高的准确度。
试剂盒的总装:将多个试剂卡、一瓶样品稀释液、一份二维码、一份采样管、一份说明书进行包装。
采用本发明的试剂盒检测新型冠状病毒(COVID-19)中和抗体的荧光免疫定量检测方法包括以下步骤:
1)启动仪器:开启荧光免疫分析仪,仪器进入初始界面;
2)准备:用分析仪配套的扫码枪扫描包装盒上的二维码,确认二维码信息与检测试剂卡的批号相匹配;
3)加样:用加样枪吸取待测样本(血清、血浆、全血)20μL,加入到样本孔中,再将缓冲液瓶滴加两滴缓冲液(60μL)至检测卡上的样本孔内;
4)模式选择:根据样本类型,在分析仪上选择样本类型“血清/血浆”或“全血”,选择“快速检测”;
5)结果读取:检测卡加样10分钟后,立即将试剂卡插入仪器中,点击“测试”按钮,系统将自动检测并显示结果。
