融合蛋白组合物的应用
文献发布时间:2023-06-19 11:55:48
本申请是申请号为2013800348475的专利申请的分案申请。
技术领域
本申请总体上涉及自身免疫疾病领域,并且尤其涉及治疗、预防或延迟1型糖尿病进展。
背景技术
最常见形式的1型糖尿病(T1DM)是免疫介导的疾病,其中胰岛素分泌β细胞遭自身免疫应答破坏。存在与疾病发作相关联的许多遗传和环境因素,疾病涉及含有特异性靶向胰岛素分泌β细胞的免疫细胞的胰岛的逐渐炎性浸润。这种病变在未确定的一段时间(数月至数年)内发展。虽然胰岛素的发现允许治疗T1DM,但是当前没有治愈方法。最常见形式的1型糖尿病是免疫介导的,其中胰岛素产生β细胞遭破坏。然而,在诊断时,大多数患者仍然具有可观量的胰岛素产生。残留β细胞功能的保存是非常需要的,因为它可减少疾病的短期和长期并发症。
已经进行了数次临床试验来试图用免疫调节剂或基于抗原的治疗阻止1型糖尿病的自身免疫性。最值得注意的是,抗CD3、抗CD20和GAD-65抗原疫苗的试验已在保存β细胞功能方面展示一些功效,如由刺激C肽分泌得以证明。T细胞在与1型糖尿病相关联的自身免疫性方面发挥核心作用。
然而,需要的是用于1型糖尿病的另外新疗法,它们能够停止或减慢自身免疫性β细胞破坏,引起β细胞功能和C肽分泌的保存,尤其适于新近诊断为患有1型糖尿病的患者中。
发明内容
根据本申请的某些实施方案涉及治疗受试者的糖尿病的方法,方法包括施用有效量的融合蛋白组合物,融合蛋白组合物包含T细胞共刺激拮抗剂和免疫球蛋白分子的一部分。
在一些实施方案中,T细胞共刺激拮抗剂包括CTLA4的细胞外结构域、细胞外结构域的有效片段或细胞外结构域的免疫活性变体。T细胞共刺激拮抗剂可结合B细胞或其它抗原呈递细胞(APC)上表达的B7抗原。在一些实施方案中,B7抗原在B细胞和APC上表达。
在一些实施方案中,融合蛋白是阿巴西普(Abatacept)。在一些实施方案中,组合物进一步包含油基载体,如油包水乳液(例如,IFA或Montamide ISA)。组合物可通过静脉内输注来施用,如在约50ml至200ml生理盐水中,或以在约5mg/kg至约50mg/kg范围变化的剂量,或以在约250mg至2000mg范围变化的剂量,或以500mg、750mg或1000mg的剂量来施用。
如本文描述的方法还可包括确定随着时间推移在从受试者获取的血液样品中C肽的水平,水平是在抑制自身攻击性T细胞的活化方面作为治疗有效性的指示物。在一些实施方案中,组合物在抑制自身攻击性T细胞的活化中的有效性是通过以下来指示:如与标准相比,维持C肽产生或延迟C肽产生的减少,或如与标准相比,改善的HbA1c或受试者使用的胰岛素减少。这类测量可离体进行,如通过分析血液样品来进行。受试者中C肽产生的减少可被延迟至少3、6、9、12或18个月,或2、3、4年或更多年。
在一些实施方案中,优选患者群体得到治疗。举例来说,选自具有统计学上较大应答率的群体的患者,如白人患者得到治疗。
本申请提供的一些实施方案提供预防冒有糖尿病风险的受试者的糖尿病发作的方法,方法包括施用有效量的融合蛋白组合物,融合蛋白组合物包含T细胞共刺激拮抗剂和免疫球蛋白分子的一部分。本文提供的一些实施方案提供延迟冒有糖尿病风险的受试者的糖尿病发作至少3个月、6个月、9个月、12个月或18个月,或2年、3年、4年或更多年的方法,方法通过施用有效量的融合蛋白组合物来实现,融合蛋白组合物来包含T细胞共刺激拮抗剂和免疫球蛋白分子的一部分。本申请阐明并描述了如将会显而易知的实施方案的这些和其它特征。
附图说明
下文参考例如后附的附图来提供各种实施方案的详述。本领域的技术人员将理解的是,以下所描述的附图仅是出于说明的目的。附图不意图以任何方式限制申请人教导的范围。
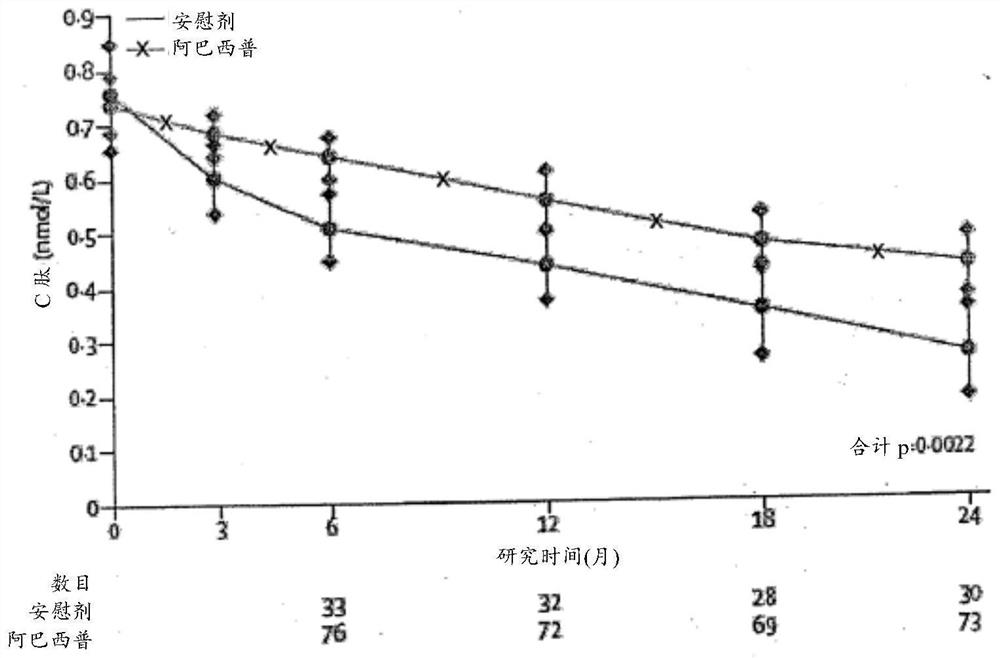
图1是每个治疗组的随着时间推移的刺激C肽2-h AUC平均值的群体平均值。估计值来自针对年龄、性别、C肽的基线值和治疗分配来调整的ANCOVA模型。Y轴是在log(y+1)标度上。误差条展示95%置信区间(CI)。AUC=曲线下面积。
图2是每个治疗组的随着时间推移的刺激C肽2-h AUC平均值的预测群体平均值。估计值来自混合效果模型的分析,模型针对年龄、性别、C肽的基线值和治疗分配来调整,并且包括在log(y+1)标度上作为直线的时间的固定效果。AUC=曲线下面积。
图3是每个治疗组的随着时间推移的2-h峰C肽保持等于或高于0.2nmol/L的参与者的比例。
图4A和图4B是每个治疗组的随着时间推移的(A)HbA1c和(B)胰岛素使用的群体平均值。估计值来自针对年龄、性别、HbA1c的基线值和治疗分配来调整的ANCOVA模型。胰岛素使用是按3个月时间间隔以每kg体重来使用。误差条展示95%CI。HbA1c是糖基化血红蛋白A1c。
图5是在预先指定的基线因子类别内对于2年刺激C肽AUC平均值的治疗效果的比率(阿巴西普相比于安慰剂)。估计值来自针对年龄、性别、C肽的基线值、所指示的分类因子、治疗分配和治疗相互作用项来调整的C肽的ANCOVA建模对数。治疗效果的同质性测试对于DR3等位基因状态(p=0.025)和种族(p=0.0003)是显著的。AUC=曲线下面积。HbA1c=糖基化血红蛋白A1c。
应了解,附图只是示例性的并且对附图的所有参考只出于说明目的,并且不希望以任何方式限制以下本文描述的实施方案的范围。
具体实施方式
已经发现CTLA4分子可用于治疗、预防或延迟受试者的1型糖尿病(T1DM)的进展。
残留β细胞功能(如通过峰C肽≥0.2nmol/L所测量)的保存是非常需要的,因为它可减少疾病的短期和长期并发症。已经进行了数次临床试验来试图用免疫调节剂或基于抗原的治疗阻止1型糖尿病中的自身免疫性。最显著地,抗CD3、抗CD20和GAD-65抗原疫苗的试验已在保存β细胞功能方面展示一些功效,如由刺激C肽分泌得以证明。C肽是在体内与胰岛素一起产生的蛋白质。在健康胰腺中,前胰岛素原与A链、C肽、B链和信号序列一起分泌。将信号序列截止,留下胰岛素原。然后C肽被切断,留下A链和B链以形成胰岛素。由于C肽和胰岛素以等摩尔量存在,因此它是胰岛素产生和胰腺β细胞健康的非常可靠标记物。
T细胞在与1型糖尿病相关联的自身免疫性中发挥核心作用。为了变得完全活化并且具有自身攻击性,据信T细胞需要至少两个关键信号。(Marelli-Berg FM,Okkenhaug K,Mirenda V.A Trends Immunol2007;28:267-73。)第一信号是抗原呈递细胞上的MHC分子的凹槽中的抗原与T细胞受体(TCR)之间的相互作用。最重要的第二信号是抗原呈递细胞(APC)上的CD80和CD86与T细胞上的CD28之间的相互作用。这种共刺激第二信号是细胞的完全活化所需要的,并且没有它T细胞不会变得具有功能性。因此,已提出将共刺激阻断作为自身免疫性和移植的治疗手段。(Bluestone JA,St Clair EW,Turka LA.Immunity 2006;24:233-38。)
细胞毒性T淋巴细胞相关联抗原4(CTLA4),也称为CD152,是涉及免疫系统的调控的蛋白质。天然存在的CTLA4描述于美国专利号5,434,131、5,844,095和5,851,795中。天然CTLA4蛋白质由CTLA4基因编码。CTLA4是细胞表面蛋白,其具有N端细胞外结构域、跨膜结构域和C端胞质结构域。细胞外结构域结合至且/或干扰靶抗原,如CD80和CD86,充当性质T细胞刺激的天然破坏。在一些实施方案中,CTLA4分子的细胞外结构域开始于位置+1处的甲硫氨酸并且结束于位置+124处的天冬氨酸;在其它实施方案中,细胞外结构域开始于位置-1处的丙氨酸并且结束于位置+124处的天冬氨酸。
CTLA4分子是包括细胞毒性T淋巴细胞相关联抗原4(CTLA4)细胞外结构域的分子。在一些实施方案中,CTLA4的细胞外结构域包括CTLA4蛋白质的一部分,所述部分识别并结合至至少一种B7(CD80/86)抗原,如B细胞和APC上表达的B7抗原。细胞外结构域还可包括CTLA4的结合B7抗原的片段或衍生物。CTLA4细胞外结构域还可识别并结合CD80(B7-1)和/或CD86(B7-2)。细胞外结构域还可包括CTLA4的结合CD80和/或CD86的片段或衍生物。
CTLA4分子可为融合蛋白,其中融合蛋白定义为使用本领域中熟知的方法连接在一起的一个或多个氨基酸序列。连接的氨基酸序列从而形成一种融合蛋白。在一些实施方案中,CTLA4分子含有免疫球蛋白的至少一部分,如免疫球蛋白的Fc部分。在一些实施方案中,CTLA4分子是分离和纯化的CTLA4分子。
在一些实施方案中,CTLA4分子是含有免疫球蛋白的至少一部分,如免疫球蛋白的Fc部分的蛋白质。在一些实施方案中,CTLA4分子是分离和纯化的CTLA4分子。
在一个优选实施方案中,CTLA4分子是阿巴西普。阿巴西普是可溶性融合蛋白,其由连接至人免疫球蛋白G1(IgG1)的修饰Fc(铰链、CH2和CH3结构域)部分的人CTLA-4的细胞外结构域组成。阿巴西普通过重组DNA技术在哺乳动物细胞表达系统中产生。阿巴西普的表观分子量是92千道尔顿。
阿巴西普被开发用于成人类风湿性关节炎和幼年特发性关节炎,并且被指出可用于减少病征和症状、诱导主要临床反应、抑制结构破坏的进展,并且改善患有中度至重度活动性类风湿性关节炎的成人患者的身体功能。
阿巴西普由Bristol-Myers Squibb开发并且公开于例如美国专利5,851,795、美国专利7,455,835和美国专利公布20011/311529中。阿巴西普的商品名为ORENCIA,它可用作单一疗法,或与不同于肿瘤坏死因子(TNF)拮抗剂的疾病缓解抗风湿性药物(DMARD)同时使用。阿巴西普还被指示可用于减少患有中度至重度活动性多关节幼年特发性关节炎的6岁和年龄更大的儿科患者的病征和症状。阿巴西普可用作单一疗法或与甲氨蝶呤(MTX)同时使用。由于阿巴西普是选择性共刺激调节剂并且抑制T细胞的共刺激,它不应与TNF拮抗剂同时施用。
阿巴西普选择性结合至CD80和CD86,从而阻断与CD28的相互作用并且干扰T细胞活化。它抑制初始T细胞活化,因而具有选择性抑制特定抗原的T细胞应答的潜力而非广泛免疫抑制。效应记忆T细胞应答较少取决于CD28共刺激并且据推测较少通过共刺激阻断来抑制。(Lo DJ,Weaver TA,Stempora L,等人Am J Transplant 2011;11:22–33。)
动物和人类中的研究已经展示共刺激第二信号的干扰有利地影响自身免疫性。使用阿巴西普的共刺激阻断已被证明在牛皮癣(Abrams JR,Lebwohl MG,Guzzo CA,等人JClin Invest 1999;103:1243–52)和牛皮癣性关节炎(Mease P,Genovese MC,GladsteinG,等人Arthritis Rheum 2011;63:939–48)中具有临床有效性,并且被批准用于治疗包括幼年类风湿性关节炎的类风湿性关节炎,Genant HK,Peterfy CG,Westhovens R,等人AnnRheum Dis 2008;67:1084–89)。(Ruperto N,Lovell DJ,Quartier P,等人Lancet 2008;372:383–91。)另外,共刺激阻断可有效控制同种异体移植物排斥。(Vincenti F,Larsen C,Durrbach A.N Engl J Med 2005;353:770–81。)此外,Lenschow和同事(Lenschow DJ,HoSC,Sattar H,等人J Exp Med 1995;181:1145–55)证明使用抗B7-2单克隆抗体和CTLA4–免疫球蛋白融合蛋白两者的共刺激阻断可在10周龄之前施用时预防NOD小鼠模型的糖尿病。
现在已经展示使用如CTLA-4组合物并且尤其阿巴西普的T细胞共刺激拮抗剂的共刺激调节可通过阻断自身攻击性T细胞的产生来在新近诊断患有1型糖尿病的患者中阻止或减缓自身免疫性β细胞破坏,导致保持C肽分泌(Orban等人,Lancet 2011;378(9789):412-9。)
因此,本文提供通过施用CTLA4分子来治疗、预防糖尿病或延缓糖尿病进展的方法。本申请方法可预防或延迟糖尿病发作,或预防或延迟残留β细胞团块的损失,提供更长缓解期并且在生命后期延缓糖尿病相关并发症的发作。
T1DM可通过如本文描述的方法来治疗。治疗可针对具有残留β细胞功能的受试者以及不再具有任何β细胞功能的受试者。治疗还被可建议来用于经由移植或注射或其它β细胞替换手段(如胚胎或其它干细胞疗法或其它替换模式)提供外源性β细胞的受试者。
可在受试者中通过首先选择易患糖尿病的受试者并施用如本文描述的CTLA4分子来预防T1DM。易患糖尿病的受试者可通过GAD65自身抗体(GAA)、ICA512自身抗体(ICA512AA)或抗胰岛素自身抗体(IAA)中的一个或多个的表达来选择。这些自身抗体中的每一种与进展至自身免疫性1型糖尿病的风险相关联。GAD65自身抗体(GAA)、ICA512自身抗体(ICA512AA)或抗胰岛素自身抗体(IAA)中的两个或更多个的表达与进展至自身免疫性1型糖尿病的高风险相关联。(Liping Yu等人,Diabetes August 2001vol.50no.8 1735-1740;Verge CF等人,Diabetes 45:926–933,199;Verge CF.等人,Diabetes47:1857–1866,1998;和Bingley PJ,等人,Diabetes 43:1304–1310,1994)。
T1DM的发作可通过如本文描述的方法来延迟,以使得受试者不需要胰岛素历时更长时间。替代地或另外地,本申请方法在已患糖尿病受试者中可延长“蜜月期”。蜜月期是其中胰岛素通过胰腺分泌,从而引起高血糖水平减退,并且由于对胰岛素注射和治疗的反应而产生正常或接近正常的葡萄糖水平的时期。
如本文描述的CTLA4分子可与药学上可接受的载体组合施用并且以药物组合物形式施用。术语“药学上可接受的载体”根据所需具体剂型包括任何和所有溶剂、稀释剂或其它液体媒介物、分散或混悬助剂、表面活性剂、等渗剂、增稠或乳化剂、防腐剂、固体粘合剂、润滑剂等。Remington's Pharmaceutical-Sciences,第16版,E.W.Martin(MackPublishing Co.,Easton,Pa.,1980)公开用于配制药物组合物的各种载体和其已知制备技术。除了如通过产生任何不希望的生物作用或另外以有害的方式与药物组合物的任何其它组分相互作用而与物质或其衍生物不相容的任何常规载体介质以外,载体的使用被涵盖在本申请的范围内。可充当药学上可接受的载体的材料的一些实例是糖诸如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素和其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;粉状黄蓍胶;麦芽;明胶;滑石粉;赋形剂,如椰子油和栓剂蜡;油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇,如丙二醇;酯,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏溶液;乙醇,和磷酸盐缓冲溶液,以及其它无毒相容润滑剂,如月桂基硫酸钠和硬脂酸镁,以及着色剂、释放剂、包衣剂、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可根据配方配制人员的判断而存在于组合物中。
包括药学上可接受的载体的本文描述的化合物可使用多种途径或施用模式来递送至患者。适合施用途径包括但不限于吸入、经皮、口服、直肠、经粘膜、肠道和肠胃外施用,包括肌肉内、皮下和静脉内注射。
如本文描述的组合物可与佐剂一起施用。术语“佐剂”可为单独施用时缺乏显著活性但是可增强另一种治疗剂的活性的化合物。在一些实施方案中,佐剂选自由以下组成的组:缓冲剂、抗微生物防腐剂、表面活性剂、抗氧化剂、滋养调节剂、抗菌剂、增稠剂和粘度改良剂。在一些实施方案中,佐剂是IFA,或其它油基佐剂以30-70%之间,优选地40-60%之间,更优选地45-55%之间的重量比例(w/w)存在。在一些实施方案中,CTLA4和IFA或其它油基佐剂以约50/50重量比率存在。在一些实施方案中,药物组合物不含污染物,例如,热原。
对于口服施用,化合物可容易通过将CTLA4分子与本领域中熟知的一种或多种药学上可接受的载体组合来配制。这类载体使得本申请的化合物可配制为片剂、丸剂、糖锭剂、胶囊、液体、凝胶、糖浆、浆液、混悬液等,以供所治疗的患者口服摄入。用于口服的药物制剂可通过以下获得:添加固体赋形剂,任选地研磨所得混合物,并且(如果需要的话)在添加适合的助剂之后,加工颗粒混合物以获得片剂或糖锭剂核心。适合的赋形剂尤其是填充剂,如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂,例如像玉米淀粉、小麦淀粉、米淀粉、马铃薯淀粉、明胶、黄芪胶、甲基纤维素、羟基丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。如果需要,可以添加崩解剂,如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。
化合物可被配制用于通过注射进行肠胃外施用,例如,通过弹丸式注射(bolusinjection)或持续输注施用。注射是施用本申请组合物的优选方法。用于注射的制剂可与添加的防腐剂一起以单位剂型提供在例如安瓿中或在多剂量容器中。组合物可采用油性或水性媒介物中的混悬液、溶液或乳液的这类形式,并且可含有配制剂,如可添加混悬、稳定和/或分散剂,如交联聚乙烯基吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。因此,在一些实施方案中,组合物可为油包水乳液。在其它实施方案中,组合物可为水包油乳液。这类水包油乳液可尤其适用于控制释放特征并且提供活性药物的缓慢释放,从而可潜在地在这类乳液不受改变的情况下被吸收。
用于肠胃外施用的药物制剂包括呈水溶性形式的活性化合物的水溶液。此外,活性化合物的混悬液可以制备为适当的油性注射混悬液。适合亲脂性溶剂或媒介物包括脂肪油(如芝麻油)或合成脂肪酸酯(如油酸乙酯或三酸甘油酯)或脂质体。水性注射混悬液可含有增加混悬液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,混悬液也可以含有适合的稳定剂,或增加化合物溶解度以允许制备高浓度溶液的试剂。对注射来说,本申请的药物组合物可在水溶液,优选生理相容缓冲液(如汉克斯溶液、林格氏溶液或生理缓冲盐水)中配制。或者,活性成分可呈粉末形式,以用于在使用前利用适合的媒介物(例如,无菌无热原水)来构建。
在一些实施方案中,包含CTLA4分子的组合物也包括油基载体。油基载体是包括至少10重量%的适合于结合治疗剂来施用至人的天然或合成油的组合物。在优选实施方案中,载体包括至少20、30、50、70、80、90、95、98或99重量%的油。在一些实施方案中,油基载体可包括小于70、60、50、40、30或20重量%的油。在优选实施方案中,油在10重量%至95重量%范围内,优选地20重量%至90重量%或30重量%至70重量%的油。油应被选择来使得在施用至受试者时,它提供分散于其中的物质的持续释放。适合油包括矿物油(例如,Drakeol 6VR轻质矿物油)、植物油、角鲨烯或液体石蜡。在一些实施方案中,油基载体可含有一种以上类型油。在一些实施方案中,油基载体可包括免疫刺激剂,例如,免疫刺激葡聚糖,但是优选得多的是油基载体不包括免疫刺激剂,例如,免疫刺激葡聚糖、细菌组分,例如,分枝杆菌组分。在一个优选实施方案中,油基载体不包括明矾组分。
虽然不希望受理论约束,据信油基载体通过触发与炎症以及防护能力相关的免疫活性细胞来起作用。油基载体也可充当抗原媒介物和缓慢释放或长期抗原呈递装置。当注入受试者时,油基载体和抗原组合物可在注射位点形成抗原积存物,从而防止抗原降解。抗原可从此积存物释放缓慢至系统,并且提供长效的抗原呈递以及扩大的总接触表面面积并吸引炎性细胞。巨噬细胞可消化大多数并入的材料并且在其表面上呈递经过加工的抗原。抗原可从此积存物释放缓慢至系统中并且提供长效的抗原供应来充当共刺激调节剂。
油基载体任选地包括乳化剂或表面活性剂组分。乳化剂或表面活性剂(和乳化剂或表面活性剂的量)经过选择以使得它促进物质(例如,抗原制剂)与油的混合或分散。油基载体可包括0.1重量%至50重量%,优选地1重量%至30重量%,更优选地5重量%至20重量%的表面活性剂或乳化剂。乳化剂或表面活性剂的实例包括Arlacel A、二缩甘露醇油酸酯(例如,Montamide 80-二缩甘露醇单油酸酯)、无水甘露糖醇/油酸酯、聚氧乙烯或聚氧丙烯。
油基载体或佐剂通常由与水混合的两种组分:(1)油和(2)乳化剂或表面活性剂所组成。适合油和乳化剂在本领域中为已知的。举例来说,油可为矿物油、植物油、角鲨烯或液体石蜡。乳化剂或表面活性剂可为,例如,Arlacel A、二缩甘露醇油酸酯、无水甘露糖醇/油酸酯、聚氧乙烯或聚氧丙烯。示例性油基佐剂包括常规IFA、Montamide ISA佐剂或亨特氏TiterMax佐剂。在优选实施方案中,佐剂包括20重量%至95重量%,优选地30重量%至90重量%,更优选地40重量%至70重量%的油相,和0.1重量%至50重量%,优选地1重量%至30重量%,更优选地5重量%至20重量%的表面活性剂或乳化剂。各种类型的油基佐剂描述于例如美国专利号5,814,321、美国专利号6,299,884、美国专利号6,235,282和美国专利号5,976,538中。
IFA通常是非代谢油(例如,矿物油)、水和表面活性剂(例如,Arlacel A)的混合物。不同于完全弗氏佐剂(CFA),IFA不含有细菌组分,例如,分枝杆菌。在人中使用IFA的第一次大规模接种疫苗发生于美国军事人员(Davenport(1968)Ann Allergy 26:288-292;Beebe等人,(1972)Am J Epidemiol 95:337-346;Salk&Salk(1977)Science195:834-847)。关于恶性肿瘤、过敏疾病和胶原病的结果基本上是阴性的,但是有证据表明一些人在接种位点具有囊胞样反应。随访研究证明这些不良事件是归因于化合物的不正确施用,即它皮下而非肌肉内给药。根据这些实验,IFA被一些人视为不适合于人使用,但是它仍然广泛用于动物研究。最近几年中,新形式的IFA证明对于HIV免疫疗法或治疗接种疫苗的人的使用是安全的(Turner等人(1994)AIDS 8:1429-1435;Trauger等人(1995)J Acquir ImmuneDefic Syndr Hum Retrovirol 10Supp2:S74-82;Trauger等人(1994)J Infect Dis 169:1256-1264)。
Montanide ISA佐剂(Seppic,Paris,France)是一组基于油/表面活性剂的佐剂,其中不同表面活性剂与非代谢矿物油、代谢油或两者的混合物组合。这些佐剂被制备来用作与Ag水溶液的乳液。Montanide ISA 50(ISA=不完全Seppic佐剂)的表面活性剂是二缩甘露醇油酸酯,即弗氏佐剂中的表面活性剂的主要部分。Montanide组的表面活性剂经历严格的质量控制以防止可导致过度炎症的任何物质的污染,如已在用于弗氏佐剂中的一些Arlacel A批料中发现所述污染。各种Montanide ISA组的佐剂用作油包水乳液、水包油乳液或水包油包水乳液。由于表面活性剂和油组合的变化,不同佐剂适应不同水相/油相比率。
亨特氏TiterMax(CytRx Corp.,Norcross,Ga.)是以类似于用于常规弗氏佐剂的方式制备为油包水乳液的基于油/表面活性剂的佐剂。然而,它使用代谢油(角鲨烯)和具有良好蛋白质抗原结合能力以及辅助活性的非离子表面活性剂。辅助活性可部分地涉及表面活性剂的活化补体并且结合补体组分的能力,因为此有助于将Ag靶向输送至脾和淋巴节中的滤泡树突状细胞。用于可购得佐剂中的表面活性剂是由Hunter(Hunter等人,1991Vaccine 9:250-256)开发的聚氧乙烯与聚氧丙烯的许多合成非离子嵌段共聚物中的一种。利用共聚物包衣的微粒来使乳液稳定允许形成具有小于20%油的稳定乳液,这是最小化所注射的总佐剂的重要因素。
佐剂可与抗原一起使用以引出细胞介导免疫力和产生抗体保护性同种型(在小鼠中为IgG2a并且在灵长类中为IgG1)。不同类型的佐剂共有类似副作用,如注射位点的反应和致热性。明矾是一种用于人疫苗的常用佐剂,它也在注射位点产生可观的肉芽肿反应(Allison&Byars(1991)Mol Immunol 28:279-284)。不完全弗氏佐剂的作用模式可涉及非特异性以及特异性免疫应答。IFA似乎通过触发与炎症以及保护能力相关的免疫活性细胞来起作用。IFA也充当抗原媒介物和缓慢释放或长期抗原呈递装置。将IFA和抗原化合物注入患者,它在注射位点形成抗原积存物,从而防止抗原降解。抗原从此积存物释放缓慢至系统,并且提供长效的抗原呈递以及扩大的总接触表面面积并吸引炎性细胞。巨噬细胞消化大多数并入的材料并且在其表面上呈递经过加工的抗原。抗原可从此积存物释放缓慢至系统并且提供长效的抗原供应来充当共刺激调节剂。
已发现IFA对于抗原免疫原性的特异性增强效果产生增加的体液免疫(优选保护性抗体产生;在人中为IgG1并且在小鼠中为IgG2a)并且引起特异性细胞介导免疫(优选Th2类型)。具体来说,作为一个实例,IFA中的人重组胰岛素B链在NOD小鼠胰岛中产生Th2细胞因子模式(Ramiya等人(1996)J Autoimmun 9:349-356)。IFA在动物模型中对经过糖尿病预防试验的佐剂是独特的。Ramiya和同事(同上文)得出的结论是:明矾和DPT两者作为佐剂具有与所使用的抗原不相关的“非特异性”保护效果,而IFA是具有用于动物中糖尿病预防的抗原特异性保护效果的唯一佐剂。
IFA,优选被批准用于人的IFA,例如,Montanide(例如,Montanide ISA51,SeppicInc.,France)或等效组合物,是用于本文描述的方法和疫苗的优选佐剂。Montanide ISA51在我们的动物研究和我们的人研究中没有展示全身或显著局部副作用。
对于口服施用,化合物可容易通过将活性化合物与本领域中熟知的药学上可接受的载体组合来配制。这类载体使得本申请的化合物可配制为片剂、丸剂、糖锭剂、胶囊、液体、凝胶、糖浆、浆液、混悬液等,以供所治疗的患者口服摄入。用于口服的药物制剂可通过以下获得:添加固体赋形剂,任选地研磨所得混合物,并且(如果需要的话)在添加适合的助剂之后,加工颗粒混合物以获得片剂或糖锭剂核心。适合的赋形剂尤其是填充剂,如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂,例如像玉米淀粉、小麦淀粉、米淀粉、马铃薯淀粉、明胶、黄芪胶、甲基纤维素、羟基丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。如果需要,可以添加崩解剂,如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。
化合物可被配制用于通过注射进行肠胃外施用,例如,通过弹丸式注射或持续输注施用。注射是施用本申请组合物的优选方法。用于注射的制剂可与添加的防腐剂一起以单位剂型提供例如在安瓿中或在多剂量容器中。组合物可采用油性或水性媒介物中的混悬液、溶液或乳液的这类形式,并且可含有配制剂,如可添加混悬、稳定和/或分散剂,如交联聚乙烯基吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。
用于肠胃外施用的药物制剂包括呈水溶性形式的活性化合物的水溶液。此外,活性化合物的混悬液可以制备为适当的油性注射混悬液。适合亲脂性溶剂或媒介物包括脂肪油(如芝麻油)或合成脂肪酸酯(如油酸乙酯或三酸甘油酯)或脂质体。水性注射混悬液可含有增加混悬液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,混悬液也可以含有适合的稳定剂,或增加化合物溶解度以允许制备高浓度溶液的试剂。对注射来说,本申请的药物组合物可在水溶液,优选生理相容缓冲液(诸如汉克斯溶液、林格氏溶液或生理缓冲盐水)中配制。或者,活性成分可呈粉末形式,以用于在使用前利用适合的媒介物(例如,无菌无热原水)构建。
提供至受试者的CTLA4分子的组合的量取决于受试者体型和体重以及疾病进展。对于本文描述的化合物,治疗有效量可最初在体外测定中确定。由于本申请化合物可具有低吸收和低生物利用率,因此治疗有效量可根据例如化合物或其代谢物的血液水平,或化合物或其代谢物的粪便浓度来确定。如本领域中熟知的,用于人的治疗有效量也可根据动物模型来确定。治疗有效剂量也可从已知展现类似药理学活性的化合物的人数据来确定。施加剂量可基于与已知化合物比较施用化合物的相对效力来调节。
肠胃外施用本文描述的化合物的患者剂量通常在约1mg/天至约10,000mg/天范围内,更通常约10mg/天至约1,000mg/天,并且最通常约50mg/天至约500mg/天。就患者体重而言,典型剂量在约0.01至约150mg/kg/天范围内,更通常约0.1至约15mg/kg/天,并且最通常约1至约10mg/kg/天,例如5mg/kg/天或3mg/kg/天。
CTLA4分子可以单一每日剂量施用或它可每天多次施用。或者,它可每天小于一次施用。给药可在一段时间内,如每月或每28天一次。在一些实施方案中,可在开始治疗时给与其它剂量(例如,弹丸式给药)。在一些实施方案中,剂量含有大约5、10、20、30、50、100mg/kg的CTLA4分子。
本文使用的术语的定义意图并入在化学和药物领域中关于每个术语公认的当前技术现状定义。在适当情况下,提供例证。定义适用于在整个本说明书中使用的术语,除非在具体情况中单独地或作为较大组的一部分另外加以限制。
如本文使用,术语“施用”意图包括直接和间接地将化合物递送至它的预期作用位点的所有手段。
如本文在延迟糖尿病进展的情形中使用的短语“延迟进展”意指在1型糖尿病的临床发作之后功能性残留β细胞团块的损失被延迟。T1DM的延迟进展可例如通过测量C肽产生来测量。
短语“药学上可接受的”是指在施用至如哺乳动物(例如,人)的动物时生理上可耐受并且通常不产生过敏或类似不利反应(如胃不适、眩晕等)的添加剂或组合物。术语“药学上可接受的载体”根据所需具体剂型包括任何和所有溶剂、稀释剂或其它液体媒介物、分散或混悬助剂、表面活性剂、等渗剂、增稠或乳化剂、防腐剂、固体粘合剂、润滑剂等。Remington's,The Science and Practice of Pharmacy,(Gennaro,A.R.编,第19版,1995,Mack Pub.Co.)公开用于配制药物组合物的各种载体和其已知制备技术。除了如通过产生任何不希望的生物作用或另外以有害的方式与药物组合物的任何其它组分相互作用而与物质或其衍生物不相容的任何常规载体介质以外,所述载体的使用被涵盖在本申请的范围内。可充当药学上可接受的载体的材料的一些实例包括但不限于糖如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素和其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;粉状黄蓍胶;麦芽;胶质;滑石粉。赋形剂,如椰子油和栓剂蜡;油,如花生油,棉籽油;红花油,芝麻油;橄榄油;玉米油和大豆油;二醇,如丙二醇;酯,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏溶液;乙醇,和磷酸盐缓冲溶液,以及其它非毒性相容的润滑剂,如月桂基硫酸钠和硬脂酸镁,以及着色剂、释放剂、包衣剂、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可根据配制人员的判断而存在于组合物中。
术语“药物组合物”是指具有如载体和/或赋形剂的其它试剂的本文描述的组合物或其药学上可接受的盐。优选地,药物组合物具有以至少95%纯度,或98%纯度,或99%纯度,或更大纯度存在的活性剂。
如本文使用,术语“受试者”是患有糖尿病、前糖尿病或易患糖尿病体质的人或其它动物。因此,在一些实施方案中,受试者需要如本文提供的治疗性治疗。优选患者是哺乳动物。患者的实例包括但不限于人、马、猴、犬、猫、小鼠、大鼠、奶牛、猪、山羊和绵羊。在一些实施方案中,“受试者”通常是患有糖尿病的人患者。在一些实施方案中,“受试者”是在最近200、100或50天内被诊断患有T1DM的人患者。在一些实施方案中,“受试者”是最近被诊断患有糖尿病但是仍然具有残留β细胞功能的人患者。在一些此类实施方案中,残留β细胞功能是可检测的,或至少10%、20%、30%、40%、50%、60%或更多的β细胞处于完全运作胰腺中。
术语“治疗有效量”是指在剂量下和在所需时间周期在细胞培养物、组织系统、动物或人中有效实现所需生物或医药反应(例如,所需治疗结果)的量。组合物的有效量可以根据多种因素而不同,如个体的疾病病况、年龄、性别以及体重和CTLA4分子在个体体内引出所需反应的能力。治疗有效量也是其中治疗有利效果超过组合物的任何毒性或有害影响的量。在一些实施方案中,反应包括减轻和/或延迟所治疗的疾病、病状或病症的一个或多个症状的发作。
如本文使用的术语“治疗”定义为将治疗剂应用或施用至受试者,或将治疗剂应用或施用至患有糖尿病、疾病症状或易患病体质的受试者的分离组织或细胞系。治疗意图包括预防发作、减缓进展、逆转或另外改善、改善或影响疾病、疾病症状或易患病体质。举例来说,用本文描述的组合物治疗受试者,例如,人受试者可在1型糖尿病的临床发作之前、期间或之后减慢、改善或停止受试者的正在进行的自身免疫性,例如,针对胰腺β细胞的反应。
术语“约”或“大致”意指如本领域普通技术人员所确定的特定值在可接受的误差范围内,误差范围部分取决于所述值如何测量或测定——例如测量系统的限制或特定用途所需要的精确度。举例来说,如根据在本领域中的实践,“约”可意指1个或2个标准偏差。或者,“约”可意指给定值的最多20%、优选地最多10%并且更优选地最多5%的范围。当在本申请和权利要求书中描述特定值时,除非另外规定,否则应假定术语“约”意指在特定值的可接受误差范围内。
除非上下文另有明确说明,否则本文中和所附权利要求中所使用的单数形式“一(个/种)”和“所述”包括复数的提及物。因此,例如,对“一个分子”的提及包括这类分子中的一个或多个,“一种树脂”包括这类不同树脂中的一种或多种,并且对“一种方法”的提及包括提及本领域普通技术人员已知的可被修改或取代本文描述的方法的等效步骤和方法。
虽然以上描述提供各种实施方案的实例和特定细节,但是应认识到,所描述实施方案的一些特征和/或功能允许修改而不脱离所描述实施方案的范围。以上描述意图说明本申请,但其范围只通过所附权利要求的用语来限制。
实施例
根据下列实施例可以进一步理解申请人教导的各方面,实施例不应当被解释为以任何方式限制申请人教导的范围。
实施例1-研究设计和患者
针对本研究对过去100天内被诊断患有1型糖尿病的患者(6-45岁)进行平行筛选。如果患者具有至少一个糖尿病相关自身抗体(微量测定胰岛素抗体[如果胰岛素疗法的持续时间小于7天];谷氨酸脱羧酶-65[GAD-65]抗体;胰岛细胞抗原-512[ICA-512]抗体;或胰岛细胞自身抗体),并且具有在诊断糖尿病之后至少21天并在37天随机化期内完成的混合餐耐量试验(MMTT)期间被测量到0.2nmol/L或更高的刺激C肽浓度,那么患者适合参与研究。
对于乙型肝炎表面抗原、丙型肝炎或HIV的血清抗体来说,血液样品被筛选为阳性的人被排除参与研究。也测试样品的埃-巴二氏病毒(Epstein-Barr virus,EBV)。在筛选时具有活性EBV感染迹象的个体不合格。随机化之后展示活性EBV感染迹象的参与者不接受另外的研究药物直到消退。
患者以2:1比率随机分配,按照参与地点来分级,接受使用双盲方案的阿巴西普或安慰剂实验治疗。表1提供参与者的基线人口统计和实验室特征。
表1
数据是n(%)、平均值(SD)或中值(范围)。AUC=曲线下面积。HbA1c=糖基化血红蛋白A1c。
*排除因指示变量而数据缺失的参与者(缺失编号:种族,1;HbA1c,2;胰岛素使用,1;HLA等位基因状态,4)。
实施例2-程序
阿巴西普(Orencia,Bristol-Myers Squibb,Princeton,NJ,USA)在第1、14和28天给与,然后每28天给与,最后剂量在第700天(总共27个剂量),给与形式为在100mL 0.9%氯化钠输注中以10mg/kg剂量(每剂最大1000mg)进行30分钟静脉内输注。标准盐水输注用作安慰剂。患者不接受任何在前给药(premedication)。
所有患者接受密集糖尿病管理。目标是如美国糖尿病协会所推荐实现密集血糖控制。(American Diabetes Association.Diabetes Care2011;33(增刊1):S11–61。)患者使用多次每日胰岛素注射或胰岛素泵。血糖监测通过频繁每日血糖监测来进行。不允许使用影响血糖控制的非胰岛素药品。
血液样品中心分析。使用双位点免疫酶测定(Tosoh Bioscience,South SanFrancisco,CA,USA)测量来自冷冻血浆的C肽浓度。糖基化血红蛋白A1c(HbA1c)用离子交换高效液相色谱(Variant II,Bio-RadDiagnostics,Hercules,CA,USA)来测量。根据划分的双份样品,每次测定的可靠性系数大于0.99。生物化学自身抗体(微量测定胰岛素抗体、GAD-65抗体、ICA-512抗体)用放射免疫结合测定来测量并且胰岛细胞自身抗体(ICA)用间接免疫荧光来测量。完成例行化学图(Roche Diagnostics[Indianapolis,IN,USA]Hitachi917分析器和试剂)。HLA II类等位基因用PCR扩增和序列特异性杂交来测量。β细胞功能通过刺激C肽分泌来评估。本试验的预先指定的主要结果是对在24个月访问完成的4h MMTT2的前2h的刺激C肽应答的曲线下面积(AUC)的比较。4-h MMTT在基线和24个月完成;2-hMMTT在3、6、12和18个月获得。已完成其2年访问MMTT的患者包括于主要结果评估中。2年治疗期结束之后,参与者进入2年随访期(研究保持双盲)以继续评估安全和功效,包括每6个月的MMTT。预先指定的次要结果包含:随着时间推移的C肽的斜率、各组之间发生峰C肽损失的差异小于0.2nmol/L、HbA1c差异和随着时间推移的胰岛素剂量,以及安全性。预先指定的子组因子包含年龄、性别、种族、基线C肽、基线胰岛素使用、基线HbA1c和HLA类型。
实施例3-统计分析
Spotfire S+8.1统计分析软件用于所有分析。108个参与者的样品大小计划提供85%功率来使用0.05水平(单侧)测试来检测几何平均C肽相对于安慰剂组的50%增加,其中随访损失为10%并且分配治疗相比于对照为2:1(基于在变换标度上0.248的估计平均值和0.179的SD)。所有分析基于具有已知测量的预先指定意向性治疗群组。缺失值假定为随机缺失。与主要和次要端点的意向性治疗比较相关联的p值是双侧的,但是试验设计基于单侧假设检验。完成端点治疗效果的期中分析并且根据具有O’Brien-Fleming边界的Lan和DeMets方法,向数据和安全监测委员会报告一次。(Lan KKG,DeMets DL.Biometrika 1983;70:659–63。)C肽平均AUC、HbA1c和总每日胰岛素剂量的预先指定分析方法是针对年龄、性别和基线值应变量和治疗分配来调整的协方差分析模型。每个治疗组的预测平均值和相关联95%置信区间(CI)建立于其它协变量的平均值下。与治疗效果相关联的显著性水平来自Wald测试(拟合模型)。log(XC–Pep+1)的标准化变换对于C肽AUC平均值是预先指定的,并且残差的正常曲线表明它是足够的。C肽平均AUC等于AUC除以2-h间隔(即,AUC/120)。AUC使用梯形法则,根据MMTT期间的C肽的定时测量来计算。小于0.2nmol/L(高于其的水平与降低并发症风险相关联)的第一刺激峰C肽的时间用标准存活方法(Cox模型和Kaplan-Meier方法)来分析。不良事件等级用魏氏秩和测试来分析。(Agresti A.Categorical dataanalysis.New York,NY,USA:John Wiley and Sons,1990。)从6个月至24个月的C肽平均AUC变化的平均速率使用具有针对年龄、性别、基线C肽平均AUC和治疗分配来调整的随机截距和斜率的混合效果模型来估计。初始拟合包括治疗和时间的固定相互作用效果,但是由于不存在它不同于零的任何统计证据而被移除。为了评估整个时段的治疗效果,我们将类似混合模型与具有我们定义时间没有结构并以6个月间隔来分组的差异的数据加以拟合。
实施例4-结果
在登记研究的112位患者中,77位随机分配接受阿巴西普实验处理并且35位分配接受安慰剂。表1总结两个组的基线特征。唯一值得注意的失衡是与阿巴西普组相比,安慰剂组中的更大比例的男性,和安慰剂组中的较高的平均HbA1c。治疗组实际上施用的输注数目使用魏氏秩和测试来比较;未检测到显著差异(p=0.61)。总体上,给与3024次潜在输注中的2514次(83%),并且未给与的许多输注是根据方案而定(例如,患者患上EBV感染或怀孕)。完成738个预期MMTT中的689个(93%)。在2年的主要分析中,分配阿巴西普的参与者具有0.375nmol/L的几何平均刺激C肽2-h AUC(95%CI 0.290–0.465),与分配安慰剂的参与者的0.266nmol/L(0.171–0.368)形成比较。对于阿巴西普组,2年的调节群体C肽平均2-hAUC是0.378nmol/L并且对于安慰剂组是0.238nmol/L;因而,使用阿巴西普的情况下,2年的C肽AUC高59%(95%CI 6.1–112)(p=0.0029)。在基线HbA1c作为协变量添加时,结果保持未改变并保持显著(p=0.0028)。为了解决从基线到2年评估(主要端点)的C肽浓度的差异,对3、6、12和18个月的C肽结果单独建模。
图1展示2年内的调节群体C肽平均2-h AUC。与分配安慰剂的患者相比,接受阿巴西普的患者在6、12和18个月,并且在全部的合计时间点具有显著较高平均AUC(p=0.0022)。为了计算治疗对于延迟C肽减少的效果,我们计算治疗组随着时间推移的C肽AUC平均值的预测群体平均值(图2)。图线基于使用在6、12、18和24个月的MMTT的所有可用数据的混合线性模型的拟合。当测试斜率和治疗的相互作用项的拟合改善(即,测试两个治疗组具有不同C肽衰变速率的证据)时,此结果不显著(p=0.85)。因此,使用假定相同斜率的更简单模型并且图2展示这些结果。因此,阿巴西普组平均值降低至与安慰剂组相同水平的估计滞后时间是9.6月(95%CI 3.47–15.6)。通过24个月评估,阿巴西普组中的(32%)患者具有小于0.2nmol/L的AUC峰刺激C肽,与安慰剂上的15个(43%)患者相比(图3)。峰C肽落至低于0.2nmol/L的调节相对(阿巴西普相比于安慰剂组)风险是0.433(95%CI 0.218–0.861)。在24个月随访期间,与安慰剂组相比,阿巴西普组具有较低调整平均HbA1c(图4A)(对于所有合计时间点,p=0.002),但是HbA1c在基线也较低。但是,甚至在调整基线差异之后,24个月内的治疗组差异仍然存在(p=0.0071)。研究结束时,与安慰剂的八位(26%)患者相比,阿巴西普的34位(47%)患者具有低于7%的HbA1c。这是尤其显著的,因为86%所有患者在18岁以下;在此组中,此HbA1c好于ADA年龄特异性靶HbA1c。阿巴西普组中的参与者在研究期间的一些时间点(6和12月)具有较低胰岛素剂量,但是在24个月,两个组中的胰岛素剂量是类似的(图4;在24个月,p=NS,但是由于较早时间点的差异,在所有合计时间点,p=0.040)。
图5展示关于年龄、性别、种族、基线C肽、基线胰岛素使用、基线HbA1c和HLA类型的治疗效果的同质性测试的结果。阿巴西普在非白人参与者中的明显不利影响可以假设产生,然而各组规模较小。
表2和表3概述安全和不良事件。阿巴西普良好耐受。输注相关不良事件以低频率发生(2514次输注中的47次[2%]涉及27位患者)并且并非临床显著的。其中,在阿巴西普的77位患者中的17位(22%)发生36次反应,并且在安慰剂的35位患者中的六位(17%)中发生11次反应(通过费歇尔精确测试,对于参与者比例来说,p=0.62)。整体不良事件率(包括实验室异常)较低,在两个组之间没有差异。具体来说,感染(包括EBV)或嗜中性白血球减少症未增加(在阿巴西普的七位[9%]患者中,在安慰剂的五位[14%]患者中发生)。有七个低血糖发作报告为不利事件,其中两个是严重低血糖(每组中一个)。
表2:根据不利影响最坏等级的患者数目
数据为n(%)。使用魏氏秩和测试,治疗组的最坏等级并非统计不同。*意外死亡,与研究不相关。
表3:根据不利事件类型的事件和患者的数目
数据为n或n(%)。治疗组的不利影响类别使用单侧(替代阿巴西普组中较高频率)费歇尔精确测试来测试;仅全身症状是显著的(p=0.049)。*意外死亡,与研究不相关。
实施例5-讨论
结果表明在2年内,使用阿巴西普的共刺激调节减缓最近发作1型糖尿病中的β细胞功能减少达9.6月。早期有益效果表明T细胞活化仍然大约在1型糖尿病临床诊断时间发生,即使疾病过程大概进展几年。然而,尽管在24个月中连续施用阿巴西普,但是基于包含6个月至24个月的时间间隔的混合模型结果,阿巴西普组的β细胞功能类似于安慰剂组。β细胞功能的后续续减少导致我们推测随着疾病的临床过程进展,持续T细胞活化下降。然而,与安慰剂组的差异在药物施用期间保持。进一步观察确立是否有利效果在停止每月阿巴西普输注之后持续。这些患者的随访展示药物有利效果持续超过药物施用至少一年。
阿巴西普良好耐受,两个组之间在不良事件上没有差异。然而,临床适用性的潜在限制是活疫苗在阿巴西普治疗3个月内不能使用。考虑到目标群体年幼,此因素可能是至关重要的。主要效果似乎在开始治疗之后较早发生,随后恢复β细胞功能降低。此模式使人想起抗CD3、抗CD20和GAD-65疫苗的效果,其全部示出一些功效,继而稍后与对照组类似的β细胞功能减少。然而此方法脱颖而出,因为不同于所利用的其它干预,这几乎没有可观的副作用。此结果与我们的T细胞活化突出的诊断之后存在较早机会窗口的观念一致。在我们的研究中,在24个月,与使用安慰剂相比,使用阿巴西普时高59%的平均AUC C肽类似于使用那些其它干预所发现的情况,但是研究的直接比较很难,因为重要基线特征包括年龄、随机化时的疾病持续时间和基线HbA1c存在差异。此外,我们的研究与那些研究的不同之处在于阿巴西普在整个研究中连续施用,而在抗CD3、抗CD20和GAD-65疫苗的情况下,药物的施用在随机化之后2-4周完成。关键地,我们的研究并非被设计来确立是否短治疗方案足以在2年内保持改善C肽分泌或是否在2年后需要继续治疗。所有患者完成其阿巴西普疗程,研究的正在进行的随访相调查是否在停止药物之后改进C肽分泌得以持续以及有多长久。在一个抗CD3试验中,患者的长期随访展示在3年之后,治疗和安慰剂组之间的C肽分泌差异减少。对于阿巴西普,情况并非如此,因为一年停止治疗数据证明有益的效果得以保持,阿巴西普治疗与安慰剂组之间的C肽保持的差异未降低(与安慰剂组相比,在3年时,阿巴西普组中C肽多62%)。另外,阿巴西普治疗组HbA1c甚至一年停止治疗之后保持显著较好。
在阿巴西普组中,在整个试验中,平均HbA1c低于安慰剂组,但是它在基线时也较低。在阿巴西普治疗组中,低于7%的HbA1c保持18个月是显著的,因为96位(86%)研究参与者是18岁或更年轻。在这个改善水平下的HbA1c的临床重要性是有据可查的。(TheDiabetes Control and Complications Trial Research Group.N Engl J Med 1993;329:977–86。)在两个组中,胰岛素使用是类似的,因而未造成HbA1c的差异。在我们的试验中,在2年研究药物施用期间,患有最近发作1型糖尿病的阿巴西普治疗患者具有通过C肽测量的更多内源性胰岛素产生。停止阿巴西普之后的这些效果的持续时间在这些患者的正在进行的随访中加以测试。一年疗法中止数据展示阿巴西普的有利效果在药物施用后持续至少一年。进一步跟踪患者。在2年内施用的阿巴西普在患有1型糖尿病的患者中展示极好安全概况。它的主要效果似乎在开始治疗之后较早发生,然而需要进一步研究来测试在自身免疫过程中这种药物可有效减缓自身免疫性的深入程度。这些方法可以更容易地用皮下型式阿巴西普来测试。
本文所使用的章节标题仅是出于组织目的,而不应解释为以任何方式限制主题。
此外,虽然结合各种实施方案描述了申请人的教导,但是不意图将申请人的教导限于这些实施方案。相反,申请人的教导包括如本领域技术人员将了解的各种替代、修改和等效物。
- 一种单核细胞负载E6E7融合蛋白的疫苗组合物及其制备方法与应用
- 含猪肺炎支原体抗原的融合蛋白、疫苗组合物与应用
