高特异RPA/RAA检测试剂盒及检测方法
文献发布时间:2023-06-19 11:59:12
技术领域
本发明专利涉及高特异RPA(重组酶聚合酶扩增)/RAA(重组酶介导的扩增)检测试剂盒及其检测方法,属于核酸检测领域。
背景技术
重组酶聚合酶扩增技术(RPA)自2006年开发以来被誉为“可替代PCR的犀利技术”,可实现在37~42℃恒温条件下孵育10~30min完成靶标核酸的指数扩增,彻底摆脱了PCR反应对于精密热循环仪等设备的依赖。重组酶介导的扩增技术(RAA)反应原理与RPA相同,都是依赖重组酶、DNA聚合酶和单链结合蛋白在恒温条件下进行核酸快速扩增。两者唯一的不同在于,RPA的重组酶来源于T4噬菌体,RAA的重组酶来源于细菌或真菌。正是由于快速灵敏、对设备要求低等优势,RPA/RAA技术广泛应用于现场即时检测(Point-of-caretesting,POCT)。
虽然RPA/RAA产物的检测方法多种多样,但适合于POCT的灵敏特异、快速便捷的产物检测方法却亟待开发。传统的凝胶电泳检测法操作繁琐,尤其是开管操作易产生交叉污染,不适于现场快速检测。荧光探针法是目前RPA/RAA产物检测最常用的方法,它是在RPA/RAA体系中加入核酸酶和特定的检测探针(如exo检测、fpg检测),利用探针特异性识别扩增产物进而引发核酸酶切割探针产生荧光信号,实时监测RPA/RAA扩增产物,产生类似于荧光定量PCR中的荧光扩增曲线,实现对待测靶标的高特异检测。然而,RPA/RAA反应的定量性能无法与PCR媲美,这主要由于RPA/RAA扩增完全依赖多种酶促反应的速率,其扩增动力学不像PCR那样完全依赖于反应循环数,所以很难通过扩增抬起时间对靶标进行定量。因此,采用实时荧光法监测RPA/RAA反应不仅增加了仪器成本,而且难以准确定量,并不是RPA/RAA检测的理想方法。近年来,微流控芯片技术异军突起,多篇文章将其应用于RPA/RAA的现场快速检测,但是由于Exo检测法对反应组分的加入次序有严格要求且不适于荧光信号的终点检测,无疑对于微流控技术提出了更高的要求。虽然采用侧流层析试纸条技术可对RPA/RAA产物进行可视化检测,但开管操作易产生交叉污染,尽管利用一次性卡套装置可实现在封闭的腔体内完成试纸条检测过程,降低了交叉污染的风险,但每管RPA/RAA产物均需额外的卡套装置无疑增加了耗材成本。
基于光电或是化学发光的独特RPA/RAA检测方法一定程度上可实现高灵敏、高特异或是可视化检测,但这些方法仍需要依赖独特的光电设备或是需要开管洗涤,无疑也会限制RPA/RAA技术在POCT领域的推广与使用。此外,现有RPA/RAA产物检测方法的特异性不够好,尽管将基于Cas12a或Cas13a蛋白的探针酶切方法(如DETECTR和SHERLOCK)用于RPA/RAA产物检测可提高特异性,但这些技术步骤较多,依然需要开管检测。
因此,亟需开发一种闭管、高特异RPA/RAA扩增检测方法,无需特殊昂贵且大型的设备,通过简单操作和便携设备即可实现高灵敏、高特异性的快速检测。
发明内容
本发明的目的是提供一种高特异RPA/RAA检测试剂盒。
本发明采用的技术方案为:
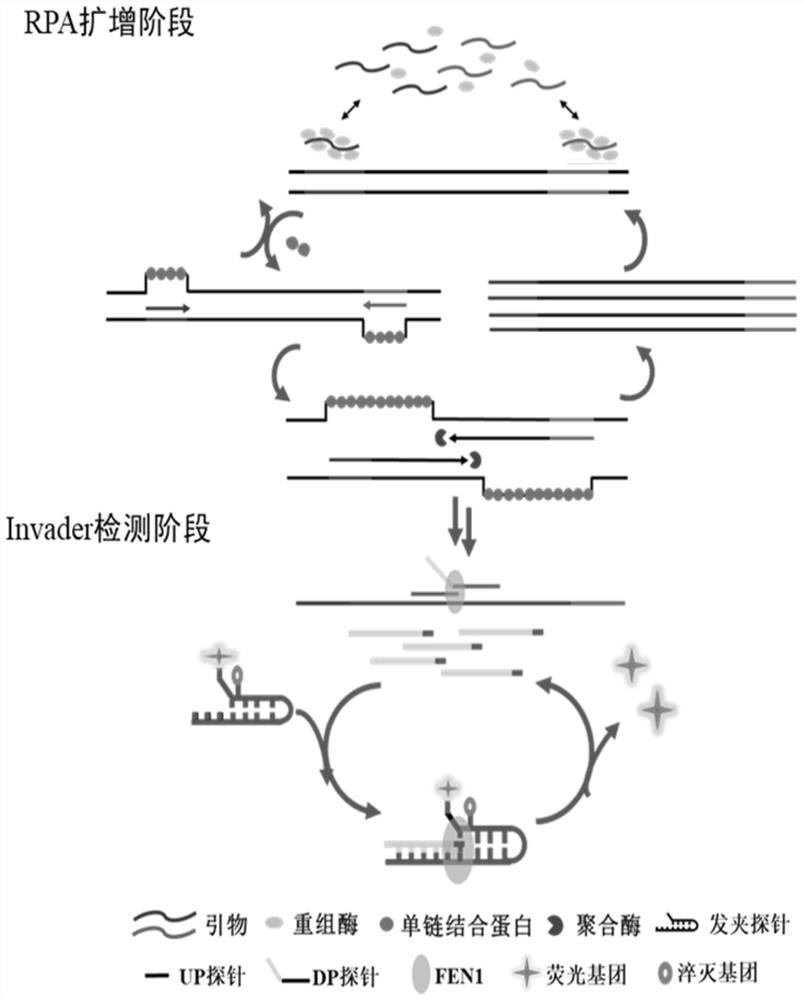
一种高特异RPA/RAA检测试剂盒,包括重组酶、寡核苷酸引物、DNA聚合酶、单链DNA结合蛋白,其特征在于:还包括上游寡核苷酸探针(UP探针)、下游寡核苷酸探针(DP探针)、发夹探针及flap核酸内切酶;
所述下游寡核苷酸探针设计为3’端与靶标序列互补,5’端与靶标序列不互补,所述上游寡核苷酸探针与靶标序列互补,上游寡核苷酸探针的3’末端单个碱基侵入到下游寡核苷酸探针与靶标杂交的双链区域,形成flap核酸内切酶识别底物,flap核酸内切酶切割释放出下游寡核苷酸探针5’端与靶标不互补的部分;
所述发夹探针上标记有荧光基团与淬灭基团,下游寡核苷酸探针5’端与靶标不互补的部分与发夹探针互补,侵入到发夹探针5’双链区域,再次形成flap核酸内切酶识别底物,flap核酸内切酶酶切使荧光基团与淬灭基团分离。
本发明方法是在RPA/RAA体系中引入flap核酸内切酶及针对靶标设计的一对上下游寡核苷酸探针和荧光报告发夹探针,当核酸待测靶标被重组酶聚合酶扩增得到产物后,所述上下游探针会与所述扩增产物杂交形成flap核酸内切酶识别与切割的底物,进而引发级联切割反应将荧光标记发夹探针切割产生荧光信号,实现对重组酶聚合酶扩增产物的识别与报告,通过记录实时荧光曲线或肉眼直接观察管内荧光的方式进行检测。
优选的,所述flap核酸内切酶为:Afu FEN1、Pfu FEN1、Mja FEN1或Mth FEN1。
优选的,所述flap核酸内切酶为Afu FEN1。
优选的,所述发夹探针5’端标记有荧光基团和淬灭基团,所述荧光基团选自FAM、HEX、TET、JOE、TAMRA、Cy5或Cy3,所述淬灭基团选自DABCYL、ECLIPSE、TAMRA或BHQ。
优选的,所述发夹探针上的荧光基团和淬灭基团间隔1~6个碱基,flap核酸内切酶的酶切位点在间隔碱基上。
优选的,RPA/RAA检测试剂盒包含以下成分:120ng/μL T4 UvsX蛋白、60ng/μLT4UvsY蛋白、600ng/μL T4 gp32蛋白、30ng/μL Bsu聚合酶或8~13ng/μL Sau聚合酶、800μM脱氧核糖核苷酸(dNTP)、150nM~600nM上下游寡核苷酸扩增引物、5%聚乙二醇35000、2mM二硫苏糖醇、50mM磷酸肌酸、100ng/μL肌酸激酶、3mM三磷酸腺苷、pH7.9的50mM Tri-醋酸、20~100mM乙酸钾、14mM乙酸镁、0.1~0.5μM上下游寡核苷酸探针与发夹探针、50~500ng/μL flap核酸内切酶。
本发明还提供了一种高特异RPA/RAA检测方法,其特征在于其步骤包括:
(1)根据待测靶标的DNA序列设计寡核苷酸引物、上游寡核苷酸探针、下游寡核苷酸探针及发夹探针并合成,提取待测样本的基因组DNA;
(2)在待测样本的基因组DNA中加入权利要求1-6中任一项所述的高特异RPA/RAA检测试剂盒中的重组酶、寡核苷酸引物、DNA聚合酶、单链DNA结合蛋白、上游寡核苷酸探针、下游寡核苷酸探针、发夹探针及flap核酸内切酶,控制温度进行DNA扩增反应,在该步骤中,重组酶与寡核苷酸引物结合,形成酶和引物复合体,复合体定位到靶标上,在单链DNA结合蛋白的帮助下,解链靶标DNA,随后在DNA聚合酶的作用下,形成新的DNA互补链;
(3)待DNA扩增反应完成后,调整温度,进行flap核酸内切酶切割反应,检测反应过程中是否有荧光信号发生,若检测到荧光信号则说明待测样本中存在靶标DNA,在该步骤中,下游寡核苷酸探针的3’端结合到新的DNA扩增产物上,上游寡核苷酸探针也结合到新的DNA扩增产物上,且上游寡核苷酸探针的3’末端单个碱基侵入到下游寡核苷酸探针与靶标杂交的双链区域,形成flap核酸内切酶识别底物,flap核酸内切酶切割该底物,释放出下游寡核苷酸探针5’端与靶标不互补的部分;释放出的下游寡核苷酸探针5’端与靶标不互补的部分结合到发夹探针上,5’端侵入到发夹探针5’双链区域,再次形成flap核酸内切酶识别底物,flap核酸内切酶切割该底物,发夹探针上标记的荧光基团与淬灭基团因切割而相互分离,产生荧光信号,通过荧光信号即可判断反应体系中是否存在待测靶标。
优选的,步骤(2)中扩增反应的温度为30~45℃。
优选的,步骤(2)中扩增反应的时间为10~30min。
优选的,步骤(3)中flap核酸内切酶切割反应的温度为63℃。
优选的,步骤(3)中flap核酸内切酶切割反应的时间为5~30min。
本发明的有益效果为:
1.比传统RPA/RAA检测方法特异性好;
2.因特异性高使镁离子可预先加入到体系中,无需将镁离子先加在管盖直至反应前才离心加入到体系中,操作更简便;
3.荧光标记检测探针通用,无需根据待测靶标设计荧光标记探针,降低了试剂成本和探针设计难度;
4.信号扩增法检测RPA/RAA产物,进一步提高了检测灵敏度。
5.本发明可广泛应用于下列领域有关生物的特异基因的快速检测:人致病性病原体的检测、农牧养殖业中病原体的检测、植物病原微生物的检测、SNP突变检测。
附图说明
图1为本发明高特异RPA/RAA检测方法的原理图。
图2为高特异RPA/RAA检测方法的典型检测结果。
图3为高特异RPA/RAA检测方法检测HIV模板的结果。
图4为高特异RPA/RAA检测方法检测HBV模板的结果。
图5为高特异RPA/RAA检测方法检测HCV模板的结果。
具体实施方式
下面结合附图对本发明的具体实施方式做进一步说明。
实施例1:
人类免疫缺陷病毒(HIV)gag基因的扩增检测。
通过查阅文献和用软件分析筛选出人类免疫缺陷病毒(HIV)gag基因中保守性高、特异性强的核酸序列作为靶序列,根据RPA引物设计指导原则设计出RPA引物并合成,由Universal Invader
HIV-RPA-F:GGACATCAAGCAGCCATGCAAATGTTAAAAGAG
HIV-RPA-R:TGCTATGTCACTTCCCCTTGGTTCTCTCATCTGGC
HIV-UP:CTGCATGCACTGGATGCACC
HIV-DP:ACGGACGCGGAGTCTATCCCATTCTGCAG-P
发夹探针:CTGCAGAATGGG ATAGAGTGCATCCAG[T(FAM)]G-[dSpacer]A-[T(BHQ1)]GCAGGGCCTATTGCAC核酸模板为人工合成的含有HIV gag基因靶序列的质粒(上海捷瑞生物工程有限公司)。反应体系(反应总体积为20μL)组成如下:
扩增反应在37℃下反应30min后在63℃下反应20分钟,读取FAM荧光信号。
结果判断:
反应结束后,存在荧光信号为阳性,无荧光信号为阴性。结果如图2所示,阳性反应管中可观测到荧光,实时荧光曲线抬起,而阴性反应管则无荧光信号。灵敏度检测结果如图3所示,最低可检测到1拷贝的HIV模板。
实施例2:
乙型肝炎病毒(HBV)S基因的扩增检测。
通过查阅文献和用软件分析筛选出乙型肝炎病毒(HBV)S基因中保守性高、特异性强的核酸序列作为靶序列,根据RPA引物设计指导原则设计出RPA引物并合成,由UniversalInvader
HBV-RPA-F:GTGGACTTCTCTCAATTTTCTAGGGGGAGCACC
HBV-RPA-R:AAGAGGAATATGATAAAACGCCGCAGACACATCC
HBV-UP:CAGTCCCCAACCTCCAATCACC
HBV-DP:ACGGACGCGGAGTCACCAACCTCTTGTC-P
发夹探针:CTGCAGAATGGGATAGAGTGCATCCAG[T(FAM)]G-[dSpacer]A-[T(BHQ1)]GCAGGGCCTATTGCAC
核酸模板为人工合成的含有HBV S基因靶序列的质粒(上海捷瑞生物工程有限公司)。
反应体系(反应总体积为20μL)组成如下:
扩增反应在37℃下反应30min,后在63℃下反应20分钟,读取FAM荧光信号。
结果判断:
反应结束后,存在荧光信号为阳性,无荧光信号为阴性。如图4所示,最低可检测到1拷贝的HBV模板。
实施例3:
丙型肝炎病毒(HCV)UTR基因的扩增检测。
通过查阅文献和用软件分析筛选出丙型肝炎病毒(HCV)UTR基因中保守性高、特异性强的核酸序列作为靶序列,根据RPA引物设计指导原则设计出RPA引物并合成,由Universal Invader
HCV-RPA-F:TGAGTACACCGGAATTGCCAGGACGACCGG
HCV-RPA-R:CGCAAGCACCCTATCAGGCAGTACCACAAGGC
HCV-UP:CCCCCGCAAGACTGCTAT
HCV-DP:ACGGACGCGGAGGCCGAGTAGTGTTGG-P
发夹探针:CTGCAGAATGGGATAGAGTGCATCCAG[T(FAM)]G-[dSpacer]A-[T(BHQ1)]GCAGGGCCTATTGCAC
核酸模板为人工合成的含有HCV UTR基因靶序列的质粒(上海捷瑞生物工程有限公司)。
反应体系(反应总体积为20μL)组成如下:
扩增反应在37℃下反应30min,后在63℃下反应20分钟,读取FAM荧光信号。
结果判断:
反应结束后,存在荧光信号为阳性,无荧光信号为阴性。如图5所示,最低可检测到10拷贝的HCV模板。
- 高特异RPA/RAA检测试剂盒及检测方法
- 高特异性多个运动机能相关基因检测试剂盒及检测方法
