一种纳米疫苗及其制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于疫苗制备领域,具体涉及一种纳米疫苗及其制备方法。
背景技术
疫苗是一种极富前景的免疫疗法。疫苗通过将抗原递送至抗原提呈细胞(APC),再由APC将抗原提呈给T细胞,从而激活机体的先天免疫和抗原特异性免疫反应、实现机体特定的免疫调节功能(如肿瘤疫苗实现肿瘤细胞杀伤)。在疫苗的实际应用中,常常由于自身免疫原性较低等原因导致无法有效激起机体免疫反应、治疗疗效未及预期。因此,如何提高疫苗在体内的免疫原性是该领域的一个重点研究方向。
由于纳米颗粒通常具有类似细菌、病毒的尺寸大小,从理论上来说,其天然具有更好的免疫原性。通过合理的设计、采用纳米技术构建得到的纳米疫苗可以提高抗原递呈细胞对于药物分子(如抗原)的摄取效率,并提高药物分子在细胞质内的定向释放能力。虽然常见的、基于无机材料制备的纳米颗粒(例如金纳米粒、二氧化硅纳米粒等)或者有机无机杂化的纳米颗粒(例如金属有机框架等),具有尺寸可控、功能可调等优势(Nat Rev DrugDiscov 20,101–124(2021).https://doi.org/10.1038/s41573-020-0090-8.);但合成这些无机或者有机无机杂化纳米粒的原料大多是非天然的,难以在体内降解,即对机体具有潜在的毒性,因而限制了这些纳米颗粒进一步的临床转化(Theranostics.2019May 18;9(11):3134-3149.doi:10.7150/thno.33539.)。
腺嘌呤(Ad)是脱氧核糖核酸和核糖核酸中的一种碱基,作为一种常见的核碱基广泛存在于机体内。这种天然特性使其作为辅料具有很好的安全性。同时,从分子结构角度来说,腺嘌呤是一种含氮杂环嘌呤,它具有和金属离子配位结合的能力。目前,尚未有基于金属离子络合腺嘌呤制备纳米疫苗的报道。
发明内容
针对现有技术的不足,本发明提供了一种纳米疫苗及其制备方法和应用。本发明提供的基于腺嘌呤和金属离子配位自组装形成的纳米疫苗,可用以单独负载抗原或同时共负载抗原和佐剂分子,具有很好的应用潜力。
本发明首先提供了腺嘌呤(简称:Ad)在制备纳米疫苗中的应用,所述腺嘌呤与锌离子配位络合形成配位自组装载体从而负载抗原制成纳米疫苗。其中的抗原可以是多肽、核酸(包括DNA或mRNA)、蛋白质。本发明的纳米疫苗对负载的抗原序列本身并没有限制,即抗原的序列对负载过程没有影响,是一种通用型的纳米疫苗。
优选的,制备的纳米疫苗在负载抗原的同时还可负载佐剂,所述佐剂为具有非特异性增强机体对抗原的免疫应答或改变免疫应答类型功效的免疫增强剂,例如带负电的非甲基化胞嘧啶和鸟嘌呤二核苷酸为核心的寡聚脱氧核苷酸CpG ODN。从形成纳米疫苗的角度,佐剂不是必需的;从功能角度,加了佐剂免疫效果会更好。
本发明又提供了一种纳米疫苗的制备方法,包括以下步骤:
(1)将腺嘌呤溶解于水中配置成Ad溶液,将锌盐溶于水中配置成Zn溶液,将抗原溶解于水中或借助DMSO溶解难溶性抗原后再稀释到水中配置成抗原溶液;
(2)将Ad溶液和Zn溶液混合均匀,然后加入抗原溶液(抗原形式包括多肽、核酸如mRNA和DNA)混合均匀,震荡得到悬液;
(3)收集悬液中固体颗粒物质,并加入水分散得到所述纳米疫苗。其中收集悬液中固体颗粒物质的方法可以是离心,也可以是过滤分离、静置沉淀这些常用的分离方式。
碱性溶液环境可以使腺嘌呤分子结构中的咪唑官能团去质子化,以便该分子与Zn离子进一步进行配位自组装。
优选的,所述锌盐选自六水合硝酸锌、二水合醋酸锌、氯化锌、硫酸锌中的至少一种。这些锌盐性质接近,锌离子的价态均为二价锌。
优选的,Ad溶液的浓度范围为5mM~30mM;Zn溶液的浓度范围为15mM~100mM。采用多肽形式的抗原时,Zn/Ad组分与多肽的质量比为50~100∶5~9.7。
优选的,步骤(2)中,加入抗原溶液混合均匀后,调节混合液的pH值至8。
优选的,所述的制备方法,制备纳米疫苗时还加入佐剂,所述佐剂为带负电的非甲基化胞嘧啶和鸟嘌呤二核苷酸为核心的寡聚脱氧核苷酸CpG ODN(以下简称CpG)。将佐剂溶解于水中配置成佐剂溶液,步骤(2)中,在加入抗原溶液同时加入佐剂溶液并混合均匀。由于在本发明的纳米疫苗组成中,选用CpG作为佐剂使用时,可根据实际需求采用不同的CpG佐剂,即CpG本身的序列长短及碱基的排列情况并不起决定性作用。
优选的,Zn/Ad组分、CpG与多肽的质量比为50~100∶1∶5~9.7,最优选质量比为75∶1∶5.0。
本发明提供了所述制备方法制备的纳米疫苗。
本发明有益效果:
1)制备方法操作简单、纯水相合成,通常不涉及有机溶剂。
2)该种纳米疫苗可同时共负载抗原和佐剂分子。
3)主要辅料成分是腺嘌呤,具有很好的生物安全性和相容性。
4)制备得到的纳米疫苗具有pH响应的特点,可以在环境pH值接近5时解体,释放负载药物。
5)制备得到的纳米疫苗具有均一的颗粒尺寸,更易被树突细胞(简称:DC)摄取。
6)制备得到的纳米疫苗可以高效促进DC成熟,提高DC细胞表面共刺激分子的表达。
7)制备的纳米疫苗可以显著提升DC对抗原的交叉递呈效率,可有效激活细胞免疫。
附图说明
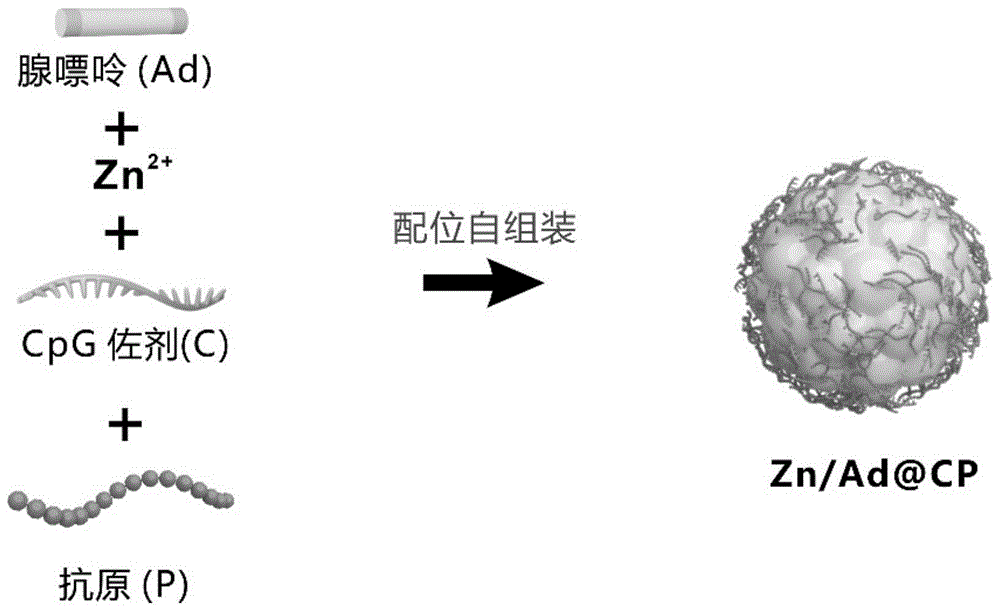
图1为Zn/Ad@CP配位自组装纳米疫苗的示意图。
图2为空载的Zn/Ad配位自组装纳米疫苗的透射电镜照片。
图3为Zn/Ad@CP纳米疫苗的透射电镜照片。
图4为空载的Zn/Ad纳米粒与共负载佐剂和抗原的Zn/Ad@CP纳米疫苗的粒径分布图。
图5为空载的Zn/Ad纳米粒(a)与共负载佐剂和抗原的Zn/Ad@CP纳米疫苗(b)的电位图。
图6为Zn/Ad@CP2纳米疫苗分别在pH=7和pH=5的水溶液中的体外溶出随时间变化图。
图7为DC摄取Zn/Ad@CP2的荧光照片,放大倍数400倍。
图8为Zn/Ad@CP3纳米疫苗激活DC表达共刺激分子CD86的结果图。
图9为Zn/Ad@CP3纳米疫苗的抗原交叉提呈结果图。
具体实施方式
本发明用以下实施例予以解释,这些实施例的目的只是为了解释而不是以任何方式限制本发明。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售产品。其中,部分试剂和原料购买情况如下:
CpG碱基序列:5'-TCC ATG ACG TTC CTG ACG TT-3',金斯瑞生物科技股份有限公司定制,作为佐剂分子,为带负电的非甲基化胞嘧啶和鸟嘌呤二核苷酸为核心的寡聚脱氧核苷酸CpG。
P多肽(多肽抗原P)氨基酸序列:NLVPMVATVKKPKYVKQNTLKLAT;
P2多肽(多肽抗原P2)氨基酸序列:FITC-NLVPMVATVKKPKYVKQNTLKLAT,其中FITC为绿色荧光基团;
P3多肽(多肽抗原P3)氨基酸序列:SIINFEKL。
下述样品命名规则为:Zn/Ad代表空载的配位自组装纳米粒。Zn/Ad@CPx代表共负载佐剂CpG和抗原多肽的纳米疫苗,其中x代表抗原多肽的种类。Zn/Ad@Px代表单负载抗原多肽的纳米疫苗。
图1为Zn/Ad@CP配位自组装纳米疫苗的示意图。
实施例1
一种配位自组装纳米疫苗的制备方法。具体通过如下步骤制备:
(1)将Ad溶解于水溶液中,得到Ad溶液,浓度为15mM;将六水合硝酸锌溶于水溶液中,得到Zn溶液,浓度为45mM;将多肽抗原P溶解于水溶液中,得到P抗原溶液,浓度为1mg/ml;将CpG溶解于水溶液中,得到CpG溶液,浓度为1mg/ml;
(2)取上述的Ad溶液、Zn溶液各100μl,混合均匀,之后加入CpG溶液13μl、抗原溶液133μl,混合均匀之后调节pH值至8,涡旋振荡得到悬液。
(3)将上述悬液通过高速离心得到沉淀,弃去上清液之后,加入超纯水300μl,超声之后得到纳米疫苗悬液。
实施例2
纳米疫苗的制备步骤同实施例1,不同之处在于,将多肽抗原P用P2替换(P2抗原溶液浓度也为1mg/ml),制备得到的样品名称为Zn/Ad@CP2。
实施例3
纳米疫苗的制备步骤同实施例1,不同之处在于,将多肽抗原P用P3替换(P3抗原溶液浓度也为1mg/ml),制备得到的样品名称为Zn/Ad@CP3。
实施例4
纳米疫苗的制备步骤同实施例1,不同之处在于,不加CpG溶液,将多肽抗原P用P3替换(P3抗原溶液浓度也为1mg/ml),制备得到的样品名称为Zn/Ad@P3。
实施例5
纳米疫苗的制备步骤同实施例1,不同之处在于,不加CpG溶液和抗原溶液,制备得到的样品名称为空载Zn/Ad纳米粒。
实施例6
一种配位自组装纳米疫苗的制备方法(不同初始投料浓度的空载Zn/Ad纳米粒)。具体通过如下步骤制备:
(1)将Ad溶解于水溶液中,得到Ad溶液,浓度范围为5mM~30mM,具体分别为5mM、15mM、30mM;将六水合硝酸锌溶于水溶液中,得到Zn溶液,浓度范围为15~100mM,具体分别为15mM、45mM、100mM;
(2)取上述的Ad溶液、Zn溶液各100μl,混合均匀(15mM Zn对应混合5mM Ad溶液,45mM Zn溶液对应混合15mM Ad溶液,100mM Zn溶液对应混合30mM Ad溶液),之后调节pH值至8,涡旋振荡后得到悬液。
(3)将上述悬液通过高速离心得到沉淀,弃去上清液之后,加入超纯水300μl,采用超声仪分散沉淀物之后得到纳米疫苗悬液。
实施例7
一种配位自组装纳米疫苗的制备方法(含不同药物负载量的纳米疫苗)。具体通过如下步骤制备:
(1)将Ad溶解于水溶液中,得到Ad溶液,浓度15mM;将六水合硝酸锌溶于水溶液中,得到Zn溶液,浓度45mM;将多肽抗原P溶解于水溶液中,得到P抗原溶液,浓度1mg/ml;将CpG溶解于水溶液中,得到CpG溶液,浓度1mg/ml;
(2)取上述的Ad溶液、Zn溶液各100μl混合均匀,重复三次得到三组同样的Ad+Zn混合液,之后,在三组混合液中分别加入CpG溶液19.5μl与P抗原溶液344μl、CpG溶液13μl与P抗原溶液133μl、CpG溶液9.75μl与P抗原溶液295μl,分别各自混合均匀之后调节pH值至8,涡旋振荡,得到3组悬液。
(3)将上述悬液通过高速离心得到沉淀,弃去上清液之后,加入超纯水300μl,采用超声仪分散沉淀物之后得到纳米疫苗悬液。
检测例1
实验名称:Zn/Ad@CP纳米疫苗的结构和形貌表征
实验设备:马尔文动态光散射仪(DLS);JEM-1400Plus透射电镜(TEM);Nanodrop2000微量分光光度计。
实验材料:实施例1样品Zn/Ad@CP、实施例2样品Zn/Ad@CP2、实施例5样品Zn/Ad、实施例6不同初始投料浓度的空载Zn/Ad纳米粒、实施例7含不同药物负载量的Zn/Ad@CP纳米疫苗。
实验过程:将Zn/Ad和Zn/Ad@CP样品溶液各取3微升,滴加到TEM铜网上,并通过真空烘箱取出残留溶剂,用于TEM形貌拍摄,其中电压设置为120kV。将原合成得到的Zn/Ad和Zn/Ad@CP溶液分别稀释到1ml,采用规格为10mm*10mm*40mm的石英比色皿,用DLS测试其粒径大小,每个样品连续测试2次,间隔30s,最终取两次测试的平均值为最终数据。取1ml上述经过粒径测试的溶液加入zeta电位专用样品皿中,每个样品连续测试3次,取平均值为最终zeta电位数据。分别取1mg Zn/Ad@CP2样品加入到两管10ml超纯水、调节pH值为7或5的试管中,并在0、2、4、8和24小时取样,即将试管离心之后取上清液,用nanodrop测试荧光强度,并计算得到对应时间点的多肽溶出率。
实验结果:如图4所示,空载的Zn/Ad纳米粒尺寸约为100纳米,颗粒形貌为粗糙的球形颗粒(图2)。共负载CpG佐剂和抗原的Zn/Ad@CP纳米疫苗尺寸与空载纳米粒的粒径接近,形貌上无明显差别,均为粗糙球形颗粒(图3)。通过表面电位的测试(图5),空载Zn/Ad显示出接近中性的电荷,而共负载药物的纳米粒具有更低的表面电位(~-30mV),这可能是由于纳米粒子在原位包裹药物分子的同时,也会吸附一部分药物分子在其表面,导致其表面电荷发生了改变。
Zn/Ad@CP的药物包封率通过间接法得出,即将实施例1步骤2得到的悬液离心分离得到上清液,通过测量上清液中药物分子的浓度倒推药物的包封率,其中多肽的定量由高效液相色谱法得出,CpG的定量通过qubit荧光定量法得到。由定量结果可知,多肽的包封率约为50%,CpG的包封率则达到了几乎100%。
为了优化合成工艺配方,如表1所示,本发明还研究了Zn离子溶液和Ad溶液的不同初始浓度对自组装载体的影响,较低的投料浓度,如Zn:15mM,Ad:5mM,得到的自组装载体的产率较低,约为10%,而过高的投料浓度(Zn:100mM,Ad:30mM)则会导致形成的颗粒尺寸显著变大(>200nm)。目前业内普遍认为最适宜用于体内递送的纳米颗粒的尺寸为接近100nm的大小。
表1
同时本发明还研究了自组装载体装载不同质量的药物的影响,如表2所示,在纳米疫苗最终成分组成分析上,高多肽负载量的纳米疫苗,即自组装载体∶CpG∶多肽质量比为50∶1∶5.3与100∶1∶9.7,制备过程中多肽的包封率偏低,约30%,而质量比为75∶1∶5.0的纳米疫苗,具有相对较高的多肽包封率,约49%,因此本实施例中,优选质量比为75∶1∶5.0的纳米疫苗用于后续研究。
表2
本发明还研究了该种Zn/Ad@CP2纳米疫苗的体外溶出过程,如图6所示,在中性条件下,该种纳米疫苗在24小时内几乎保持了相同的溶出效率,这部分溶出的多肽可能是纳米粒表面吸附的多肽。值得一提的是,当将该种纳米粒疫苗置于pH=5的水溶液中,发现纳米粒子即刻解离,完全释放出负载的药物分子,该种现象可能是由于腺嘌呤分子进一步质子化导致的。这样的酸性响应特性,有利于该种纳米疫苗在溶酶体中进行分解,导致溶酶体内部离子浓度大大提高,从而有利于溶酶体外部的水分子进入溶酶体,导致溶酶体溶胀破裂,产生了原先溶酶体内部物质的溶酶体逃逸现象。
上述实验证明了本发明的配位自组装纳米疫苗具有良好的颗粒尺寸及粒径分布,同时可有效负载抗原和佐剂药物分子,此外该纳米疫苗具有酸性环境释放药物分子的能力。
检测例2
实验名称:DC体外摄取纳米疫苗实验。
实验设备:尼康Ts2R-FL荧光倒置显微镜。
实验材料:组1为带荧光标记(FITC)的多肽P2溶液(多肽浓度200μg/ml),组2为Zn/Ad@CP2(多肽浓度200μg/ml)。
实验过程:培养DC2.4细胞,将DC2.4细胞计数并稀释成8×10
实验结果:加入等剂量多肽药物共孵育2小时之后,如图7所示,游离多肽组几乎未见荧光信号,而纳米颗粒负载多肽(Zn/Ad@CP2)组具有清晰的绿色荧光信号(FITC,标记了多肽P2),弥散至整个细胞,勾勒出细胞的形状。同时通过对比溶酶体荧光斑点位置与绿色荧光信号位置,发现二者并不完全重合,说明有部分的多肽抗原已成功地经过溶酶体逃逸扩散至胞质中。上述结果说明,对比游离药物,Zn/Ad纳米粒子负载的药物形式更容易被DC所摄取,并且产生明显的溶酶体逃逸现象。
检测例3
实验名称:纳米疫苗体外刺激DC成熟实验。
实验设备:流式细胞仪BD FACSAria III。
实验材料:组1为PBS阴性对照组,组2为游离CpG组,组3为游离CpG和游离多肽P3混合组(Free CP3),组4为空载Zn/Ad纳米粒组,组5为Zn/Ad@CP3组,组6为脂多糖(LPS)阳性对照组。
实验过程:在6孔板中加入2×10
实验结果:如图8所示,Zn/Ad@CP3实验组对比游离药物组(CpG组、游离CP3混合组)显著上调了细胞成熟标志物CD86的表达,增长了约~200%,同时该组的CD86表达接近于LPS阳性对照组。此外空载纳米颗粒组Zn/Ad也具有一定的刺激DC成熟的能力,该组的CD86表达量为~50%,低于含CpG负载的纳米疫苗Zn/Ad@CP3组。上述实验结果说明,用Zn/Ad纳米粒负载药物和佐剂的纳米疫苗可以显著上调DC的CD86表达,可以更加有效的促进DC细胞成熟。
检测例4
实验名称:体外抗原交叉递呈实验。
实验设备:流式细胞仪BD FACSAria III。
实验材料:组1为PBS阴性对照组,组2为游离P3多肽组,组3为游离CpG和游离多肽P3混合组(Free CP3),组4为空载Zn/Ad纳米粒组,组5为Zn/Ad@P3单载组(未添加CpG),组6为Zn/Ad@CP3共负载组。
实验过程:在6孔板中加入2×10
实验结果:如图9所示,Zn/Ad纳米粒负载的单药组(组5)和双药物(组6),具有较高的H-2Kb(SIINFEKL)阳性细胞比例,而游离药物组仅具有极低的阳性细胞比例,鲜明的实验结果说明,Zn/Ad纳米粒可以有效地递送抗原至细胞质中,该部分抗原在胞内被加工之后与MHC-Ⅰ型分子结合形成抗原-MHC复合物,再被递呈至DC细胞表面。
本发明中,首先用天然的具有较好生物安全性的腺嘌呤配体与金属锌离子配位络合,用一种简单绿色的方法合成得到配位自组装纳米疫苗,实现抗原和佐剂药物分子的共负载和共递送。本发明中还发现,该种Zn/Ad@CP纳米疫苗具有酸性pH响应的能力,在环境pH值接近5的情况下可以实现药物的释放。得益于合适的纳米尺寸,该种纳米疫苗可以提高抗原提呈细胞对药物的摄取能力,有力地刺激DC细胞成熟,并且协助外源性的抗原实现交叉呈递。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
