弹性蛋白降解肽作为腹膜透析患者血管钙化标志物的应用
文献发布时间:2023-06-19 09:52:39
技术领域
本发明属于生物医学领域,具体涉及弹性蛋白降解肽作为腹膜透析患者血管钙化标志物的应用。
背景技术
心血管疾病(cardiovascular disease, CVD)是腹膜透析(peritonealdialysis, PD)患者的主要死因之一,尽管透析技术不断提高,PD患者的心血管死亡风险仍可达正常人的15-20倍。改善全球肾脏病预后组织指出,合并血管钙化的慢性肾脏病3a-5D期患者CVD风险最高。
临床常使用平片评估PD患者的血管钙化,然而平片成像易受肠胀气、食物、组织重影等因素影响,无法客观、准确判断血管钙化的部位及程度,且重复性较差。在评估钙化进展及治疗相关钙化变化时,平片的应用具有一定局限性。CT是血管钙化评估的金标准,反复检查增加了患者辐射暴露剂量,且其价格昂贵,不利于随访。
血管钙化的影像评估方法众多,但仅能识别已经发生血管钙化的人群,无法评估未来血管钙化的发生风险。目前尚缺乏可良好评估PD患者血管钙化发生风险的生物标志物。
发明内容
为了解决以上问题,本发明的目的在于提供一种弹性蛋白降解肽作为腹膜透析患者血管钙化标志物的应用。
本发明提出以PD患者血清弹性蛋白降解肽EDPs作为血管钙化的生物标志物,基于血清EDPs水平初步评估PD患者发生血管钙化的风险,以指导临床治疗。该方法具有经济、可重复、易操作的优点,克服了传统血管钙化影像学评估的局限性。
为了实现上述目的,本发明提供以下技术方案:
检测弹性蛋白降解肽的试剂在制备腹膜透析患者血管钙化诊断产品中的应用,只要是能够实现测定样本EDPs的试剂其均视为本发明的保护范围。
进一步的,所述诊断产品的检测样本为血浆或血清,但不限于血浆或血清,其他能够反映患者体内EDPs浓度的组织或体液也可作为标本。
进一步的,所述血管钙化为腹主动脉钙化。
进一步的,检测弹性蛋白降解肽的试剂包括特异性识别弹性蛋白降解肽的抗体,或者是偶联有可检测标记的抗体,可检测标记可选择荧光基团、化学发光基团、催化底物显色的酶等。
优选的,所述诊断产品包括诊断试剂盒。
本发明还公开了一种诊断腹膜透析患者血管钙化的试剂盒,所述试剂盒包括检测弹性蛋白降解肽的试剂,该试剂盒可以是基于酶联免疫方法的ELISA检测试剂盒、时间分辨荧光试剂盒等,也可以是检测试纸条。
使用诊断产品对腹膜透析患者的弹性蛋白降解肽进行检测的流程及判定标准如下所示:
(1)测定腹膜透析患者弹性蛋白降解肽EDPs的浓度; (2)比较待测样本弹性蛋白降解肽EDPs的水平与参考浓度水平来判断腹膜透析患者是否有发生血管钙化的风险;当所测样本生物标志物的水平高于参考浓度时,待测样本的主体未来发生血管钙化的风险较高,或已发生严重的血管钙化,同时可联合其他临床指标如年龄、透析龄、血清尿酸水平等指标综合评估血管钙化的风险,并行密切随访。
有益效果:本发明提供了一种弹性蛋白降解肽作为腹膜透析患者血管钙化标志物的应用,本发明通过对PD患者血清EDPs进行定量检测,比较不同程度血管钙化之间EDPs水平的差异及EDPs与血管钙化的关系,并联合使用EDPs及多个临床常用指标共同建立预测模型,得出血清EDPs可作为评估PD患者血管钙化风险的生物标志物进行应用,在指导临床决策方面具有重要的意义。
附图说明
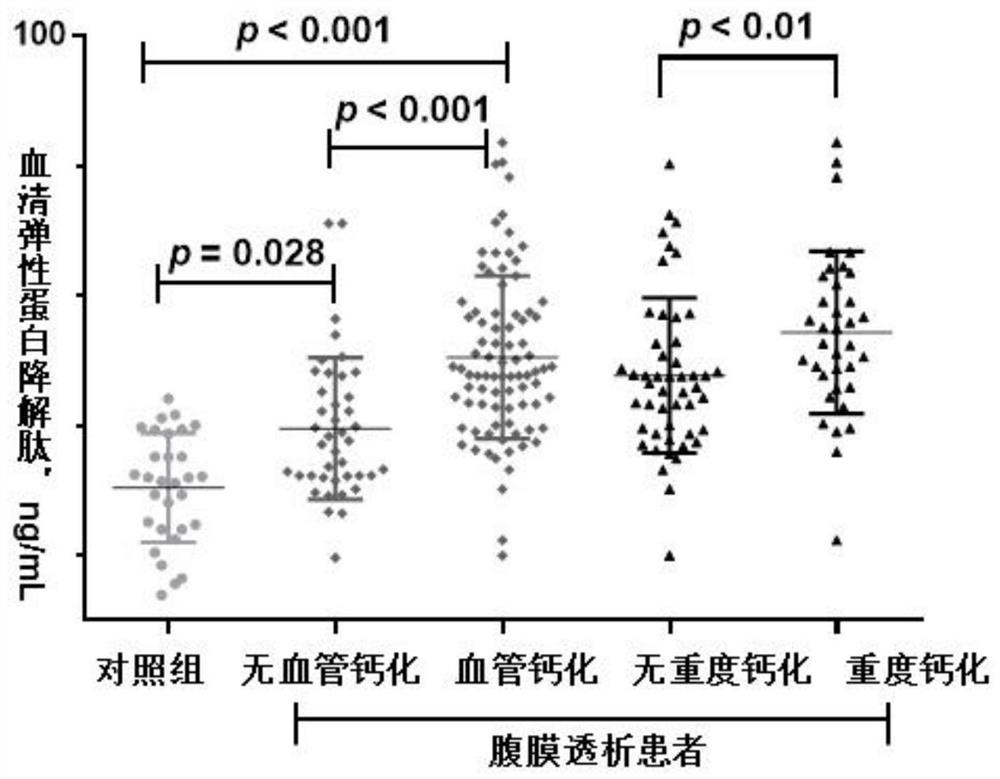
图1 为通过ELISA法测定PD患者及正常人群血清EDPs水平的散点图。
图2 为不同钙磷代谢相关指标预测PD患者发生腹主动脉钙化(AAC)风险的ROC曲线图。
图3 为PD患者发生AAC的预测模型图,其中(A)为ROC曲线图,(B)为诺莫图。
图4 为将所有PD患者按照AAC程度进行分组用以评估EDPs与AAC严重程度的相关关系图。
图5 为PD患者发生重度AAC的预测模型图,其中(A)为ROC曲线图,(B)为诺莫图。
具体实施方式
下面结合具体实施例来进一步描述本发明,但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1 血清EDPs与PD患者AAC的关系
(1)PD患者及正常人血清样本的收集
收集肾功能正常且尿蛋白阴性的正常对照受试者(30例)及腹膜透析患者(126例)的血清。所有研究对象清晨空腹留取血样,室温下放置半小时后使用4℃恒温离心机以4000g离心10min,取上层血清于-80℃冻存,并避免反复冻融。
(2)ELISA法测定所有研究对象的血清EDPs水平
(3)所有PD患者使用腹部多层螺旋CT评估PD患者有无发生AAC。所述AAC定义为腹主动脉走行区出现密度>130HU,体积>1mm
(4)对比PD患者与正常人血清EDPs水平差异,及有无AAC的PD患者之间血清EDPs水平差异。
(5)使用ROC曲线评估EDPs及其他钙磷代谢指标对AAC的预示作用。
(6)统计建模:采用单因素logistic回归进行危险因素初筛,将
(7)检测结果
PD患者及正常健康人群血清EDPs水平如表1所示,表示为中位数(四分位数)。
表1
如表2所示,发生AAC的PD患者血清EDPs水平明显高于无AAC者,表示为中位数(四分位数)。
表2
如表3所示,最终PD患者AAC的预测模型共纳入了4个变量,其中高龄、长透析龄、高EDPs为PD患者发生AAC的危险因素,尿酸为其保护因素。
表3
对85例AAC及41例非AAC患者进行ROC分析,按照约登指数最大化法,EDPs用于诊断PD患者发生AAC的截断值为 43.22 ng/mL,将由该界值诊断的AAC四格表结果示于表4。如表4所示,在85例AAC患者中,阳性为63例(敏感度74.1%),在41例非AAC患者中,阴性为29例(特异度为70.7%)。
表4
如图2所示,相较于其他钙磷代谢指标,血清EDPs预测PD患者发生AAC的ROC曲线下面积最大。联合使用多个指标可显著提高预测PD患者发生AAC的风险(图3A),构建诺莫图后可根据不同指标对PD患者行个性化的AAC风险评估(图3B)。
所述ELISA操作步骤按照说明书(上海强克生物技术有限公司,AviseraBioscience,SK00806-01,Human soluble elastin ELISA kit)进行。
①设置标准孔、空白孔、样品孔,在对应的孔中加入标准品和样品;
②在标准孔及样品孔中加入特异性的抗弹性蛋白降解肽的IgG抗体50μL,室温孵育2h;
③在标准孔及样品孔中加入10倍浓缩的生物素标记的人弹性蛋白降解产物标准品50μL,室温孵育2h,彻底洗涤;
④每孔加入辣根过氧化物酶标记亲和素100μL,避光室温孵育1h,彻底洗涤;
⑤每孔加入终止液100μL,15min内在450nm波长下测定各孔吸光度值(OD值);
⑥绘制标准曲线,根据标准曲线计算样品浓度;
⑦血清EDPs竞争性ELISA检测方法标准曲线的建立:将2000ng/mL标准蛋白倍比稀释浓度分别为2000、400、80、16、3.2、0.64、0ng/mL,按ELISA试剂盒操作,在450nm波长下测定吸光度值(OD 值),绘制标准曲线。
实施例2 血清EDPs与PD患者AAC轻重程度的关系
(1)将所有发生AAC的PD患者按照AAC的严重程度分组。所述AAC的严重程度评估方法为:测量CT每一横截面主动脉钙化对应的圆心角度数,将最大圆心角定义为钙化角度,钙化角度≥90°者为重度AAC。
(2)对比不同程度AAC的PD患者之间血清EDPs水平差异,行EDPs与AAC严重程度之间的相关性分析。
(3)统计建模:采用单因素logistic回归进行危险因素初筛,将
(4)结果
如表5所示,重度AAC的PD患者血清EDPs水平明显高于轻度AAC的患者,表示为中位数(四分位数)。
表5
如图4所示,PD患者血清EDPs水平与AAC的严重程度呈正相关(
如表6所示,最终PD患者重度AAC的预测模型共纳入了4个变量,高龄、长透析龄、高磷、高EDPs为PD患者发生重度AAC的危险因素。
表6
对36例重度AAC及49例轻度AAC患者进行ROC分析,EDPs用于诊断PD患者发生重度AAC的截断值为 48.55 ng/mL,将由该界值诊断的重度AAC四格表结果示于表7。如表7所示,在36例重度AAC患者中,阳性26例(敏感度72.2%),在49例轻度AAC患者中,阴性33例(特异度67.3%)。
表7
联合使用多个指标可显著提高预测PD患者发生重度AAC的ROC曲线下面积(图5A)。构建诺莫图后可根据不同指标对PD患者行个性化的重度AAC风险评估(图5B)。
- 弹性蛋白降解肽作为腹膜透析患者血管钙化标志物的应用
- 血管钙化的生物标志物及其应用
