一种犬免疫球蛋白的分离纯化方法及其应用
文献发布时间:2023-06-19 10:13:22
技术领域
本发明属于血液制品技术领域,具体涉及一种犬免疫球蛋白的分离纯化方法及其应用,尤其涉及一种纯度高、收率高、操作简单的犬免疫球蛋白的分离纯化方法及其应用。
背景技术
血浆免疫球蛋白是血浆中除白蛋白外含量最丰富的血浆蛋白质,免疫球蛋白G是最重要的一类免疫球蛋白,其含有多种生物学活性,主要功能是参与免疫防御反应。其适应症主要包括预防细菌和病毒感染,代替异种血清制品,抑制原发性免疫反应等。
随着宠物犬的增多,对于犬血浆制品的需求也在增多。目前纯化血浆免疫球蛋白的方法主要为基于Cohn-Oncley法或Kistler-Nitschmamn低温乙醇法,此外聚乙二醇沉淀法、离子交换层析法和pH4处理法也常用于纯化血浆免疫球蛋白。例如CN100569287公开了一种犬静脉注射免疫球蛋白、其制备方法及其制剂,是由来自健康犬的血浆或血清,经低温乙醇法或利凡诺结合低温乙醇法分离、制备得到的pH值在3.0-5.4,纯度不低于95%的可用于犬静脉注射的免疫球蛋白,以及用该免疫球蛋白配制成含5-15%麦芽糖、5-10%葡萄糖或3-10%葡萄糖盐水中的一种或两种保护剂,同时蛋白含量为1-15%的免疫球蛋白注射液。
但是现有犬血浆免疫球蛋白的提取纯化的工艺繁杂,血浆组分的分离、沉淀制备、溶解和过滤等工艺步骤多、周期长、环境要求高、资源需求量高,制品纯度低,较低的纯度会影响制品的稳定性和临床应用的安全性,导致更多的用药不良反应。
目前国内外均在进行免疫球蛋白产品的生产工艺优化。最为普遍的低温乙醇工艺的优化方式为:先利用低温乙醇工艺得到的不同组分,再将之与不同类型的层析方法相结合,生产白蛋白、免疫球蛋白和其它多种蛋白。例如CN111166877A公开了一种狂犬病人免疫球蛋白的制备方法,经过低温乙醇法分离提取免疫球蛋白、再经Capto DEAE离子交换层析纯化、超滤、巴氏灭活、深层过滤、低pH孵放灭活病毒后,配制分装成狂犬病人免疫球蛋白。
此外采用组合层析法也用于纯化血浆免疫球蛋白,但是存在的组合层析需要3步或以上层析,步骤繁杂、介质需求量高,实际生产中所需的介质成本巨大,生产效率低,难以用于规模化制备。
发明内容
针对现有技术的不足,本发明的目的在于提供一种犬免疫球蛋白的分离纯化方法及其应用,尤其提供一种纯度高、收率高、操作简单的犬免疫球蛋白的分离纯化方法及其应用。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种犬免疫球蛋白的分离纯化方法,所述分离纯化方法包括:将犬血浆的离心上清液依次进行阳离子交换层析和疏水层析,得到犬免疫球蛋白。
本发明所涉及的犬免疫球蛋白的分离纯化方法创造性地将预处理后的健康犬血浆仅通过特定的两步层析组合方式即阳离子交换层析和疏水层析即可提高犬免疫球蛋白的纯度,通过HPLC检测,纯度≥95%,多聚体含量≤5%,收率达到70%,制品的纯度更高,杂蛋白含量更低,极大地提高了应用的安全性。与传统的低温乙醇沉淀工艺比较,减少了后续组分低温乙醇沉淀和深层过滤分离步骤,工艺时间缩短了24-48h,且减少了沉淀、深层过滤和溶解工艺过程中犬免疫球蛋白的收率损失。
其中阳离子交换层析主要起到将血浆上清中白蛋白去除的作用,疏水层析利用蛋白质之间疏水性质差异直接将免疫球蛋白洗脱,实现免疫球蛋白与其他蛋白有效分离,两步层析纯化,有效缩短分离周期。且100L介质的层析规模即可处理相当于100-1000L的血浆原料,完全可放大于实际生产。
在本发明中,所述阳离子交换层析的方法具体包括:将犬血浆的离心上清液泵入平衡后的阳离子交换层析柱,然后采用洗脱缓冲液进行洗脱,收集洗脱液。
优选地,所述阳离子交换层析柱的装填介质示例性地可以选择CM QZT6FF、SP QZT6FF、CM QZT XL、SP QZT XL、CM Sepharose FF、SP Sepharose FF、SP Sepharose XL和Capto S等。
优选地,所述阳离子交换层析柱的柱床体积与上样体积的比例为1:(2-40),例如1:2、1:5、1:10、1:15、1:20、1:25、1:30、1:35或1:40等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
优选地,所述阳离子交换层析柱的平衡方式为:用含有不超过100mmol/L柠檬酸钠(例如90mmol/L、80mmol/L、70mmol/L、60mmol/L、50mmol/L、40mmol/L、30mmol/L等)、pH=4.0-6.9(例如pH=4.0、pH=5.0、pH=6.0、pH=6.9等)的缓冲液平衡2-5个柱体积(例如2个柱体积、3个柱体积、4个柱体积、5个柱体积等),上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
在上述平衡处理中,缓冲液的pH值特定选择4.0-6.9的范围是因为若pH值进一步升高会降低阳离子交换介质的吸附容量,使得大量免疫球蛋白流穿,降低阳离子交换层析的收率;若pH值进一步降低会使部分杂蛋白带上正电而吸附在阳离子交换介质上,这将大大降低离子交换层析的分离精度。
优选地,所述犬血浆的离心上清液在泵入前用0.45μm的微滤膜进行过滤。
优选地,所述洗脱为用不超过100mmol/L柠檬酸钠(例如90mmol/L、80mmol/L、70mmol/L、60mmol/L、50mmol/L、40mmol/L、30mmol/L等)、不超过1.5mol/L氯化钠(例如1.5mol/L、1.0mol/L、0.5mol/L等)、pH=4.0-6.9(例如pH=4.0、pH=5.0、pH=6.0、pH=6.9等)的缓冲液进行洗脱;上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
上述洗脱过程中,缓冲液的pH值特定选择4.0-6.9的范围是因为若pH值进一步升高会使部分杂蛋白同时洗脱,从而降低免疫球蛋白的纯度;若pH值进一步降低会使免疫球蛋白变性失活,降低免疫球蛋白的活性收率。
优选地,所述洗脱的流速为60-240cm/h,例如60cm/h、100cm/h、150cm/h、200cm/h或240cm/h等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
在本发明中,所述疏水层析的方法具体包括:将阳离子交换层析后的洗脱液泵入平衡后的疏水层析柱,然后采用洗脱缓冲液进行洗脱,收集洗脱液。
优选地,所述疏水层析柱的装填介质示例性地可以选择Butyl QZT FF、Butyl-SQZT FF、Octyl QZT FF、Phenyl QZT FF(HS)、Phenyl QZT FF(LS)、Butyl Sepharose 4FF、Butyl-S Sepharose 6FF、Octyl Sepharose 4FF、Phenyl Sepharose6FF(HS)、PhenylSepharose 6FF(LS)、Capto Butyl、Capto Octyl、Capto Phenyl ImpRes、Capto Phenyl(HS)等。
优选地,所述疏水层析柱的柱床体积与上样体积的比例为1:(2-20),1:2、1:5、1:8、1:10、1:12、1:15、1:16、1:18或1:20等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
优选地,所述疏水层析柱的平衡方式为:用含有不超过100mmol/L(例如90mmol/L、80mmol/L、70mmol/L、60mmol/L、50mmol/L、40mmol/L、30mmol/L等)柠檬酸钠、不超过2mol/L(例如2mol/L、1.5mol/L、1mol/L、0.5mol/L等)硫酸铵、pH=4.0-6.0(例如pH=4.0、pH=5.0、pH=6.0等)的缓冲液平衡2-5个柱体积(例如2个柱体积、3个柱体积、4个柱体积、5个柱体积等),上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
上述操作中加入硫酸铵的作用是增大免疫球蛋白与疏水层析介质之间的吸附作用,提高免疫球蛋白在疏水介质上的吸附载量,其浓度范围不超过2mol/L是因为若浓度进一步提高会使得疏水性较弱的杂蛋白也吸附在疏水层析介质上,从而降低疏水层析的分离精度。
优选地,所述阳离子交换层析后的洗脱液在泵入前用硫酸铵调节电导率至50-150mS/cm(例如50mS/cm、80mS/cm、100mS/cm、120mS/cm、150mS/cm等),用盐酸或氢氧化钠调节pH至4.0-6.0(例如pH=4.0、pH=5.0、pH=6.0等),再用0.45μm的微滤膜进行过滤。上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
优选地,所述洗脱为用不超过100mmol/L(例如90mmol/L、80mmol/L、70mmol/L、60mmol/L、50mmol/L、40mmol/L、30mmol/L等)柠檬酸钠、不超过1mol/L(例如1mol/L、0.8mol/L、0.5mol/L、0.3mol/L等)硫酸铵、pH=4.0-6.0(例如pH=4.0、pH=5.0、pH=6.0等)的缓冲液进行洗脱。上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
上述操作中加入硫酸铵的作用是调节免疫球蛋白与疏水层析介质的吸附作用强度,实现有效洗脱,其浓度范围不超过1mol/L是因为若浓度进一步提高会增大免疫球蛋白与疏水介质的相互作用,造成洗脱峰拖尾,分离选择性下降。
优选地,所述洗脱的流速为60-240cm/h,例如60cm/h、100cm/h、150cm/h、200cm/h或240cm/h等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
在本发明中,所述犬血浆的离心上清液的获取方式为:犬血浆离心后用纱布过滤,调节pH至4.0-6.9(例如pH=4.0、pH=5.0、pH=6.0、pH=6.9等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述),再次离心,取上清,稀释。
优选地,所述离心的方式为2-8℃(例如2℃、4℃、6℃、8℃等)下,以8000-12000r/min(例如8000r/min、9000r/min、10000r/min、11000r/min、12000r/min等)的速度,离心20-40min(例如20min、30min、40min等);上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
优选地,所述纱布为8层及以上纱布。
优选地,所述pH的调节剂为0.5-3mol/L的酸,例如0.5mol/L、1mol/L、1.5mol/L、2mol/L、2.5mol/L或3mol/L等;所述酸可以选择醋酸或盐酸等。
优选地,所述稀释用含有不超过100mmol/L(例如90mmol/L、80mmol/L、70mmol/L、60mmol/L、50mmol/L、40mmol/L、30mmol/L等)柠檬酸钠、pH=4.0-6.9(例如pH=4.0、pH=5.0、pH=6.0、pH=6.9等)的缓冲液进行稀释;上述各项数值范围内的其他具体点值均可选择,在此便不再一一赘述。
优选地,所述稀释至蛋白浓度为5-20g/L,例如5g/L、10g/L、15g/L、20g/L等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
第二方面,本发明提供一种如第一方面所述的犬免疫球蛋白的分离纯化方法在制备犬免疫球蛋白制品中的应用。
第三方面,本发明提供一种犬免疫球蛋白制品的制备方法,所述制备方法包括:将第一方面所述的分离纯化方法得到的犬免疫球蛋白进行超滤浓缩和缓冲液置换处理:调节洗脱液的pH至3.7-4.7,用10-50kDa的超滤膜包超滤,超滤稀释液为生理盐水,调整蛋白质浓度5-15%、pH=3.7-4.7、钠离子含量低于100mmo/L、电导率为2-10mS/cm。
优选地,所述超滤浓缩和缓冲液置换处理后还包括:在超滤后溶液中加入甘氨酸至0.2-0.3mol/L,例如0.2mol/L、0.22mol/L、0.25mol/L、0.28mol/L或0.3mol/L等,该数值范围内的其他具体点值均可选择,在此便不再一一赘述。
上述加入甘氨酸的作用是提高免疫球蛋白的稳定性,减少制品在后续低pH孵放病毒灭活操作过程中的活性损失。
优选地,所述超滤浓缩和缓冲液置换处理后还包括病毒灭活处理:将处理后的犬免疫球蛋白制品调节pH至3.8-4.2,于24-26℃的环境中存放21天以上。
相对于现有技术,本发明具有以下有益效果:
本发明所涉及的犬免疫球蛋白的分离纯化方法创造性地将预处理后的健康犬血浆仅通过特定的两步层析组合方式即阳离子交换层析和疏水层析即可提高犬免疫球蛋白的纯度,通过HPLC检测,纯度≥95%,多聚体含量≤5%,收率达到70%,制品的纯度更高,杂蛋白含量更低,极大地提高了应用的安全性。
与传统的低温乙醇沉淀工艺比较,减少了后续组分低温乙醇沉淀和深层过滤分离步骤,工艺时间缩短了24-48h,且减少了沉淀、深层过滤和溶解工艺过程引起的犬免疫球蛋白收率损失。
其中阳离子交换层析主要起到将血浆上清中白蛋白去除的作用,疏水层析利用蛋白质之间疏水性质差异直接将免疫球蛋白洗脱,实现免疫球蛋白与其他蛋白有效分离,两步层析纯化,有效缩短分离周期。且100L介质的层析规模即可处理相当于100-1000L的血浆原料,完全可放大于实际生产。
附图说明
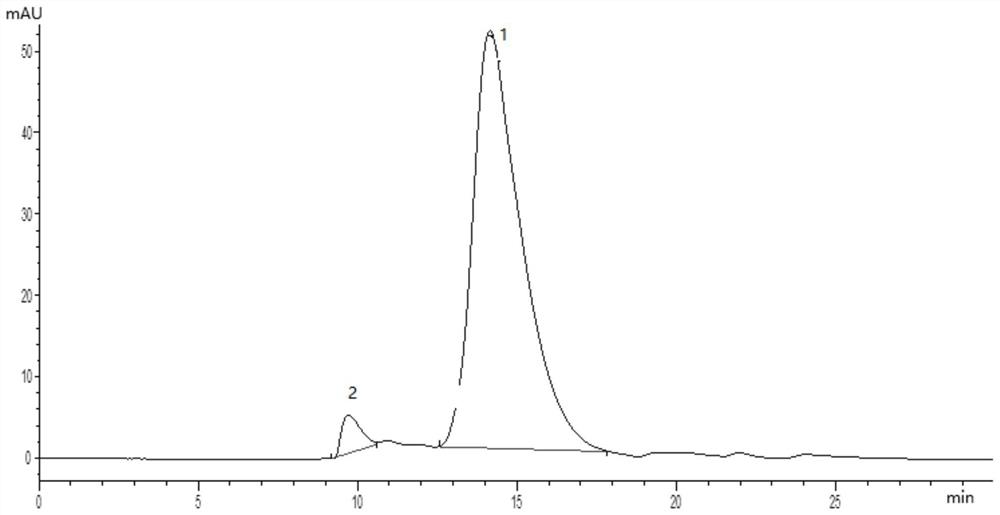
图1是实施例1中的HPLC图谱;
图2是实施例3中的HPLC图谱。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
下述实施例中所涉及的犬免疫球蛋白的纯度测定方法和多聚体含量的测定方法为HPLC,其色谱柱型号为TSK-GEL G3000 SW
实施例1
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,具体如下:
(1)犬血浆预处理:取-20℃下的新鲜冷冻犬血浆在4℃冰箱缓慢融化后离心(4℃,10000r/min,30min),离心上清用纱布(8层)过滤。采用0.5mol/L盐酸调节pH为5.0,再次离心(4℃,10000r/min,30min),取上清,采用平衡缓冲液(柠檬酸钠50mmol/L、pH=5.0)稀释至蛋白浓度5g/L。
(2)阳离子交换层析:将CM QZT 6FF介质装填在层析柱内,柱床体积与上样体积的比例为1:5,装填好的层析柱使用平衡缓冲液(柠檬酸钠50mmol/L、pH=5.0)平衡5个柱体积;犬血浆离心分离后上清液经过0.45μm的微滤膜过滤后泵入层析柱;再使用缓冲液(柠檬酸钠50mmol/L、氯化钠1.0mol/L、pH=5.0)洗脱,收集层析过程中的洗脱液;层析过程中控制流速240cm/h。
(3)疏水层析:将疏水层析介质Phenyl QZT FF(HS)装填在层析柱内,柱床体积与上样体积的比例为1:5,装填好的层析柱使用平衡缓冲液(柠檬酸钠50mmol/L、硫酸铵1mol/L、pH=6.0)平衡5个柱体积;将阳离子交换层析的洗脱液调节pH为6.0,并用硫酸铵调节电导率至100mS/cm,再经过0.45μm的微滤膜过滤后泵入层析柱;再采用缓冲液(柠檬酸钠50mmol/L、硫酸铵0.5mol/L、pH=4.5)洗脱层析柱,收集层析过程中的洗脱液;层析过程中控制流速240cm/h。
(4)超滤浓缩和缓冲液置换:用0.1mo1/L氢氧化钠溶液调节层析混合液pH=4.1。用10kDa的超滤膜包超滤层析混合液,超滤稀释液为生理盐水,调整制品蛋白质浓度10%、pH=4.1、钠离子含量50mmol/L、电导率4.0mS/cm,得到犬免疫球蛋白制品溶液。
(5)在上述犬免疫球蛋白制品溶液中加甘氨酸至终浓度0.25mol/L,调节pH=4.0,在25℃环境中放置21天灭活病毒。
测定该工艺条件下制得的犬免疫球蛋白的纯度为96.1%,多聚体含量为2.0%,收率为70%。其HPLC图谱如图1所示(图中1代表犬免疫球蛋白单体,2代表犬免疫球蛋白多聚体)。
实施例2
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,具体如下:
(1)犬血浆预处理:取-20℃下的新鲜冷冻犬血浆在4℃冰箱缓慢融化后离心(4℃,10000r/min,30min),离心上清用纱布(8层)过滤。采用0.5mol/L盐酸调节pH为6.0,再次离心(4℃,10000r/min,30min),取上清,采用平衡缓冲液(柠檬酸钠50mmol/L、pH=6.0)稀释至蛋白浓度10g/L。
(2)阳离子交换层析:将SP QZT 6FF介质装填在层析柱内,柱床体积与上样体积的比例为1:5,装填好的层析柱使用平衡缓冲液(柠檬酸钠20mmol/L、pH=6.0)平衡5个柱体积;犬血浆离心分离后上清液经过0.45μm的微滤膜过滤后泵入层析柱;再使用缓冲液(柠檬酸钠20mmol/L、氯化钠1.0mol/L、pH=6.0)洗脱,收集层析过程中的洗脱液;层析过程中控制流速120cm/h。
(3)疏水层析:将疏水层析介质Octyl Sepharose 4FF装填在层析柱内,柱床体积与上样体积的比例为1:5,装填好的层析柱使用平衡缓冲液(柠檬酸钠100mmol/L、硫酸铵1.5mol/L、pH=5.5)平衡5个柱体积;将阳离子交换层析的洗脱液调节pH为5.5,并用硫酸铵调节电导率至120mS/cm,再经过0.45μm的微滤膜过滤后泵入层析柱;再采用缓冲液(柠檬酸钠100mmol/L、硫酸铵1.0mol/L、pH=5.5)洗脱层析柱,收集层析过程中的洗脱液;层析过程中控制流速120cm/h。
(4)超滤浓缩和缓冲液置换:用0.1mo1/L氢氧化钠溶液调节层析混合液pH=4.1。用10kDa的超滤膜包超滤层析混合液,超滤稀释液为生理盐水,调整制品蛋白质浓度10%、pH=4.1、钠离子含量50mmol/L、电导率4.0mS/cm,得到犬免疫球蛋白制品溶液。
(5)在上述犬免疫球蛋白制品溶液中加甘氨酸至终浓度0.25mol/L,调节pH=4.0,在25℃环境中放置21天灭活病毒。
测定该工艺条件下制得的犬免疫球蛋白的纯度为95.5%,多聚体含量为3.5%,收率为69%。
实施例3
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,具体如下:
(1)犬血浆预处理:取-20℃下的新鲜冷冻犬血浆在4℃冰箱缓慢融化后离心(4℃,10000r/min,30min),离心上清用纱布(8层)过滤。采用0.5mol/L盐酸调节pH为6.5,再次离心(4℃,10000r/min,30min),取上清,采用平衡缓冲液(柠檬酸钠20mmol/L、pH=6.5)稀释至蛋白浓度15g/L。
(2)阳离子交换层析:将Capto S介质装填在层析柱内,柱床体积与上样体积的比例为1:15,装填好的层析柱使用平衡缓冲液(柠檬酸钠20mmol/L、pH=6.5)平衡5个柱体积;犬血浆离心分离后上清液经过0.45μm的微滤膜过滤后泵入层析柱;再使用缓冲液(柠檬酸钠20mmol/L、氯化钠1.0mol/L、pH=6.5)洗脱,收集层析过程中的洗脱液;层析过程中控制流速60cm/h。
(3)疏水层析:将疏水层析介质Capto Butyl装填在层析柱内,柱床体积与上样体积的比例为1:15,装填好的层析柱使用平衡缓冲液(柠檬酸钠20mmol/L、硫酸铵2mol/L、pH=6.5)平衡5个柱体积;将阳离子交换层析的洗脱液调节pH为6.5,并用硫酸铵调节电导率至150mS/cm,再经过0.45μm的微滤膜过滤后泵入层析柱;再采用缓冲液(柠檬酸钠20mmol/L、硫酸铵1.0mol/L、pH=6.5)洗脱层析柱,收集层析过程中的洗脱液;层析过程中控制流速60cm/h。
(4)超滤浓缩和缓冲液置换:用0.1mo1/L氢氧化钠溶液调节层析混合液pH=4.1。用10kDa的超滤膜包超滤层析混合液,超滤稀释液为生理盐水,调整制品蛋白质浓度10%、pH=4.1、钠离子含量50mmol/L、电导率4.0mS/cm,得到犬免疫球蛋白制品溶液。
(5)在上述犬免疫球蛋白制品溶液中加甘氨酸至终浓度0.25mol/L,调节pH=4.0,在25℃环境中放置21天灭活病毒。
测定该工艺条件下制得的犬免疫球蛋白的纯度为96.1%,多聚体含量为3.8%,收率为70%。其HPLC图谱如图2所示(图中1代表犬免疫球蛋白单体,2代表犬免疫球蛋白多聚体)。
实施例4
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,方法与实施例3的区别仅在于:步骤(2)阳离子交换层析中,平衡缓冲液的pH=7.5,洗脱缓冲液的pH=7.5,其他条件均保持不变。
测定该工艺条件下制得的犬免疫球蛋白的纯度为95.1%,多聚体含量为3.0%,收率为45%。
实施例5
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,方法与实施例3的区别仅在于:步骤(2)阳离子交换层析中,平衡缓冲液的pH=3.5,洗脱缓冲液的pH=3.5,其他条件均保持不变。
测定该工艺条件下制得的犬免疫球蛋白的纯度为75%,多聚体含量为2.9%,收率为65%。
实施例6
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,方法与实施例3的区别仅在于:步骤(3)疏水层析中,平衡缓冲液中硫酸铵的浓度为3mol/L,其他条件均保持不变。
测定该工艺条件下制得的犬免疫球蛋白的纯度为87%,多聚体含量为5.2%,收率为62%。
实施例7
本实施例提供一种犬免疫球蛋白的分离纯化方法和犬免疫球蛋白制品,方法与实施例3的区别仅在于:步骤(3)疏水层析中,洗脱缓冲液中硫酸铵的浓度为2mol/L,其他条件均保持不变。
测定该工艺条件下制得的犬免疫球蛋白的纯度为88%,多聚体含量为4.8%,收率为40%。
申请人声明,本发明通过上述实施例来说明本发明的一种犬免疫球蛋白的分离纯化方法及其应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 一种犬免疫球蛋白的分离纯化方法及其应用
- 从牛初乳中工业化分离纯化免疫球蛋白A、免疫球蛋白G和乳铁蛋白的方法
