联合基因治疗
文献发布时间:2023-06-19 11:21:00
技术领域
本发明涉及基因治疗的施用,特别是开发用于尤其是单基因疾病中的基因递送的有效组合策略。
背景技术
基因治疗旨在矫正作为疾病发展基础的缺陷基因。解决这一问题的常用方法涉及将正常基因递送至细胞核。然后,可将这一基因插入靶细胞的基因组中或可保持为游离基因。可以通过多种方法(包括使用病毒载体)将矫正基因递送至受试者的靶细胞。近年来,已经开发了基于不同类型的病毒(例如,逆转录病毒、腺病毒、腺相关病毒、慢病毒等)的多种重组基因转移载体,并经临床试验对其进行了测试。由于诸如转导不同组织的不同类型的分裂细胞和非分裂细胞的能力以及建立稳定长期的转基因表达的能力的特性,基于腺相关病毒(AAV)的基因转移载体已成为受青睐的载体。
所有病毒载体用于基因递送均有若干缺点:(1)任何类型的载体均无法有效地转导大量临床相关的细胞类型和组织,(2)由于先前暴露于野生型病毒,相当大比例的患者对多种病毒载体已存在抗体(即,是血清反应阳性的),导致病毒介导的转导消除或显著减少,(3)已经报道了针对大多数(即使不是所有)的病毒载体,甚至针对AAV,会诱导体液、先天和细胞免疫反应(Calcedo et al.,Hum Gene Ther Methods,2018),(4)在病理是完全或部分缺乏特定蛋白质的疾病中,转基因产物的表达可能触发针对治疗性蛋白质自身或针对用病毒载体转导的细胞的T细胞介导的免疫反应(Hollinger&Chamberlain,Curr Opin Neurol,2018;Sherman et al.,Front Immunol,2017),(5)病毒介导的特定转基因产物的表达是不可控的并且通常难以预测,这可能导致基因表达水平过高,造成毒性,或者过低,造成缺乏治疗活性,以及最后(6)由于在生长器官中的DNA稀释,游离基因表达(例如,作为AAV介导的基因治疗的结果)随着时间自动降低,而这对于特别是儿科单基因疾病是相当大的问题。
因此,尽管基因治疗代表了治疗单基因疾病的非常易驾驭的方法,但是该技术严重受限于不能安全和有效地多次施用病毒载体。已经开发出多种方法来使得能够重复施用病毒载体并且避免针对转基因自身的免疫反应,包括免疫抑制治疗方案(Sherman et al.,Front Immunol,2017;Unzu et al.,J Trans Med,2012),开发了患者非血清阳性的嵌合病毒血清型,以及在免疫系统发育时的羊膜内基因递送(Hayashita-Kinoh et al.,MolTher,2015)。然而,对于任何基因治疗应用,特别是对遗传性无效病症,重复施用病毒基因治疗仍然是相当大的挑战。
发明内容
因此,本发明的目的是克服与施用基因治疗有关的上述问题,特别是转基因多核苷酸的重复给药以及触发针对转基因和/或载体自身的免疫反应的问题。更进一步地,本发明旨在满足本领域内的其他现有需求,例如开发用于基因治疗的安全有效的治疗策略,作为可行的长期治疗范例,即使在对病毒载体具有显著免疫反应性的情况下。
本发明通过利用本发明的组合方法,利用病毒基因治疗和外来体介导的基因递送的独特优势来实现这些和其他目的。在第一方面,本发明涉及一种组合治疗,其基本上包含两种主要组分,即(i)包含编码目的蛋白(POI)的转基因的病毒载体,和(ii)基于细胞外囊泡(EV)的载体,其包含任何DNA、RNA或DNA/RNA多核苷酸形式的转基因,例如mRNA或任何其他类型的线性RNA多核苷酸、环状RNA(circRNA)、小环DNA(mini-circle DNA)、线性DNA多核苷酸、质粒DNA(pDNA),并且/或者包含RNA和DNA残基两者的任何类型的多核苷酸。POI可以是蛋白质、肽、蛋白质或肽的任何部分,或其任何组合,或与一个或多个结构域、区、构建体、位点或接头融合而将增强其治疗活性或效力的任何POI。在本发明的一些实施方案中,POI还可以以蛋白质或肽的形式递送,即通过工程化基于EV的载体以递送蛋白质形式的POI。可以例如通过在产生EV的细胞中过表达POI或通过将POI融合到外泌体多肽,然后在产生EV的细胞中表达这种基因构建体,使得能够将POI的定向EV装载到基于EV的载体中,从而实现对EV(诸如外泌体)的工程化,以包含目的蛋白和/或肽。因此,在一些实施方案中,递送编码POI的转基因的病毒载体可以与以蛋白质形式递送POI的基于EV的载体组合。在进一步的实施方案中,基于EV的载体可包含多核苷酸形式的转基因和转基因编码的POI,并且这种基于EV的载体可以有利地与编码相应转基因的病毒载体组合。重要的是,使用基于病毒载体的系统和基于EV的系统的转基因递送的本发明的组合表现出若干令人惊讶的技术效果,特别是当使用基于EV的载体递送时,不存在由转基因触发的免疫反应,尽管当通过病毒载体递送时转基因产物触发免疫反应。另外,内源性装载RNA或DNA多核苷酸的基于EV的载体显示出甚至更低的触发抗转基因免疫反应的倾向。这意味着本发明对重复、长期基因治疗问题提供了一种全新且出乎意料的解决方案,即与相同转基因产物的病毒基因治疗递送相结合,基于EV递送线性RNA或DNA分子,例如编码POI的mRNA或pDNA(优选以内源方式装载到基于EV的载体中),将能够进行长期、安全和有效的治疗,而不触发针对病毒载体或转基因的体液、先天或T细胞介导的免疫反应。
不希望受任何理论的束缚,推测当使用EV递送时,不存在针对转基因的任何免疫反应是至少三种机制的结果,即(i)当使用基于EV的载体递送转基因时,不存在各种病毒基因成分(诸如,对于RNA病毒而言,折叠的RNA稳定结构域),(ii)非TLR触发的基于EV的载体的内化,和/或(iii)EV中存在免疫调节分子(诸如HLA-G)。
因此,转基因(更特别是其转基因产物)的优选施用方式是使用病毒载体(例如,AAV)初始递送转基因,随后是使用基于EV的载体递送后续剂量的转基因。重要的是,本发明人还认识到,可以应用联合治疗以靶向不同的身体区室,例如,施用病毒基因治疗以靶向中枢神经系统(CNS)和施用基于EV的载体以靶向外周,或反之亦然。如上所述,在可选的实施方案中,可以将基于EV的载体和病毒载体同时递送至患者,例如,作为通过相同或不同途径施用的两种单独的药物组合物,或作为包含基于EV的载体和病毒载体两者的单一药物组合物。
不希望受任何具体说明或示例的限制,可以如下说明本发明的联合治疗:
-两种药物组合物的平行给药:一种组合物包含有包含转基因的病毒载体,而另一种组合物包含有包含多核苷酸形式的转基因的基于EV的载体。平行给药之后可以是一剂或多剂的病毒载体,并且有利地是一剂或多剂的基于EV的载体。
-两种药物组合物的顺序给药:一种组合物包含有包含转基因的病毒载体,并且在至少一次后续施用中,另一种组合物包含有包含多核苷酸形式的转基因的基于EV的载体。
-两种药物组合物的平行给药:一种组合物包含有包含转基因的病毒载体,而另一种组合物包含基于EV的载体,该基于EV的载体包含该转基因编码的POI,其中POI以多肽形式存在。平行给药之后可以是一剂或多剂的病毒载体,并且有利地是一剂或多剂的基于EV的载体,其中POI以蛋白质形式或以对应于转基因的多核苷酸形式存在。
-两个药物组合物的顺序给药:一个组合物包含有包含转基因的病毒载体,并且在至少一次后续施用中,基于EV的载体包含该转基因编码的POI,其中POI以多肽形式存在。
-两种药物组合物的平行给药:一种组合物包含有包含转基因的病毒载体,而另一种组合物包含基于EV的载体,该载体包含该转基因编码的POI,其中POI以多肽和转基因多核苷酸的形式存在。平行给药之后可以是一剂或多剂的病毒载体,并且有利地是一剂或多剂的基于EV的载体,其中POI以蛋白质形式和/或以对应于转基因的多核苷酸形式存在。
-两种药物组合物的顺序给药:一种组合物包含有包含转基因的病毒载体,并且在至少一次后续施用中,基于EV的载体包含该转基因编码的POI,其中POI以多肽形式和/或多核苷酸转基因形式存在。
本发明非常适用于治疗儿科遗传疾病,例如非限制性示例如C型尼曼-皮克病,I型、II型和III型高雪氏病(Gaucher’s disease),尿素循环障碍如精氨酸琥珀酸尿症,以及杜氏肌营养不良症(DMD)。
在另一方面,本发明涉及一种治疗方法,其包含向需要其的受试者施用(i)包含转基因(其编码转基因产物,即POI)的病毒载体和(ii)包含转基因的基于EV的载体的步骤。有利地,如上所述,本发明特别适合于治疗遗传疾病,特别是儿科单基因疾病,其中患者需要用所述转基因治疗多于一次。特别地,本发明提供了一种高度安全且有效的解决方案,以解决患者具有针对所述病毒载体的预先存在的抗体和/或患者在施用该病毒载体后产生针对该病毒载体的抗体的问题。令人惊奇但重要的方面是,本发明还解决了患者产生针对转基因和/或由转基因表达的POI的抗体的问题,因为这一问题可能对安全性和重要的基因治疗活性具有不利影响。
在另一方面,本发明涉及一种制备联合治疗的方法,该联合治疗包含病毒载体和用于递送相同转基因的基于EV的载体。本发明的方法通常包含以下步骤:(a)用包含转基因的病毒载体基因组感染第一宿主细胞,并收集由所述第一宿主细胞产生的病毒载体,和(b)遗传修饰第二宿主细胞以产生基于EV的载体,该载体在DNA或RNA多核苷酸(例如,mRNA、circRNA和/或pDNA多核苷酸)中包含所述转基因,并收集第二宿主细胞产生的基于EV的载体。步骤(a)和(b)可以任何顺序来顺序或并行执行,这取决于哪种方法是最实惠和资源有效的。在一个重要的实施方案中,步骤(a)和(b)中使用的宿主细胞可为相同的细胞类型。成功避免针对转基因的免疫反应的关键在于将基于内源性EV的载体装载策略用于转基因,即通过亲本产生EV的细胞的基因工程装载携带转基因的DNA或RNA多核苷酸(诸如mRNA、circRNA、小环DNA和/或pDNA多核苷酸),或所述转基因的高效外源装载(例如,以mRNA、circRNA、小环DNA、线性DNA多核苷酸和/或pDNA的形式)。
因此,本发明针对重复施用转基因进行基因治疗的问题提供了完全出乎意料的解决方案,对基因治疗领域具有潜在的重大影响。
附图说明
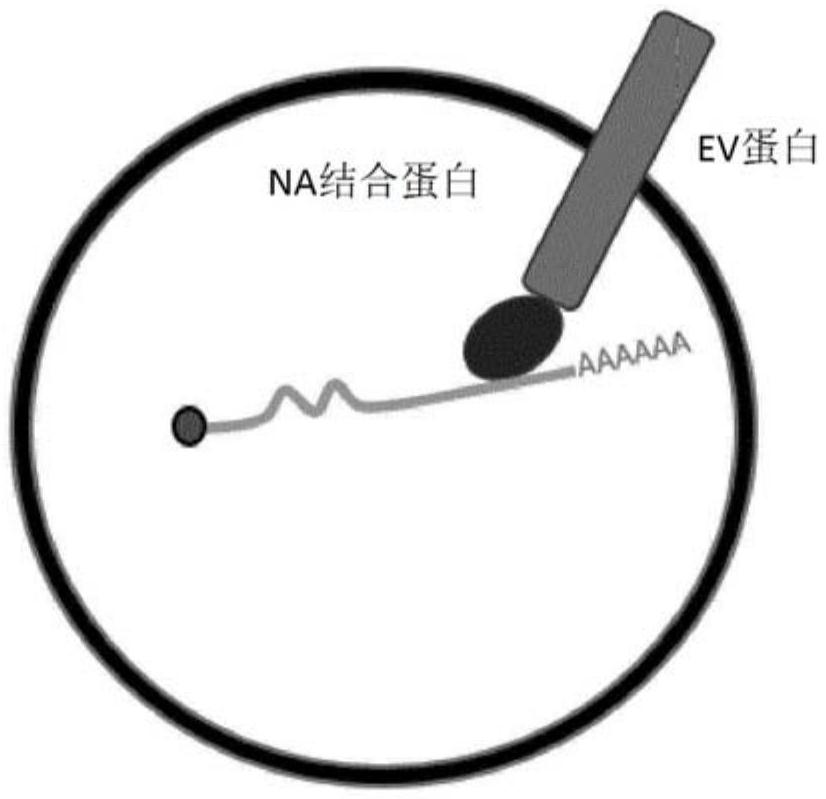
图1显示了通过产生EV的细胞来源的内源遗传工程将目的转基因装载到基于EV的载体中的示意图。该图示显示了EV蛋白和核酸结合蛋白之间的融合蛋白如何在这种情况下实现mRNA转基因的内源性装载。
图2显示了使用(以第一剂量)AAV载体和(以第二剂量)基于MSC衍生的基于EV的载体重复递送纳米荧光素酶转基因。
图3比较了抗转基因(即抗eGFP)抗体针对eGFP转基因的产生,该eGFP转基因使用以下方式施用于C57BL/6小鼠:(a)两剂AAV或(b)一剂AAV和一剂基于FIEK293T的EV,所述EV内源性装载有编码eGFP的mRNA。
具体实施方式
本发明通常涉及解决与重复施用病毒基因治疗有关的问题,特别是需要克服患者中抗载体和可能甚至更重要的抗转基因抗体的产生。
因此,在第一方面,本发明涉及联合治疗,其包含(i)病毒载体,其包含编码目的蛋白(POI)的转基因,和(ii)基于EV的载体,其包含DNA或RNA多核苷酸形式的转基因(例如,mRNA、circRNA、小环DNA、线性DNA和/或pDNA)。在一个有利的实施方案中,首先使用病毒载体递送来施用转基因,然后使用基于EV的载体进行转基因的第二次和任选地甚至进一步的剂量施用。重要的是,可以使用不同的递送方法,即使用病毒载体递送或使用基于EV的载体递送,将转基因递送至不同的器官、组织和/或身体区室。如下文进一步详细概述的,基于EV的载体和病毒载体可基本上同时施用于受试者,因为EV通常具有免疫调节作用,其可用于减弱针对病毒载体的免疫反应。
本发明的转基因可正常地编码蛋白质、多肽或其任何组合(所谓的POI)。在病毒基因治疗的情况下,转基因和相应的POI的递送通常触发抗POI抗体的产生,从而导致POI的活性降低和/或完全中和。抗转基因自身、POI或病毒载体的抗体的产生意味着病毒基因治疗的重复给药通常是不可能的。然而,本发明通过使用内源性或外源性装载有包含相同转基因的多核苷酸的EV而不触发免疫反应,提供了对这一问题的出人意料的解决方案。
重要的是,本发明可广泛应用于各种病毒载体,包括选自逆转录病毒、水泡性口炎病毒、腺病毒、腺相关病毒、慢病毒、单纯疱疹病毒、柯萨奇病毒等的病毒载体。
术语“细胞外囊泡”或“EV”在本文中可互换使用,并且应理解为涉及从以任何形式的细胞获得的任何类型的囊泡,例如微囊泡(例如,从细胞质膜脱落的任何囊泡)、外泌体(例如,来自内体、溶酶体和/或内溶酶体途径的任何囊泡)、凋亡小体、ARMM(包含蛋白1[ARRDC1]介导的微囊泡的抑制蛋白结构域)、微粒和囊泡结构等。EV可为经过基因修饰或基因工程的,在这种情况下,EV衍生自基因修饰/工程的生产细胞,该生产细胞通常包含重组转基因或蛋白质产物,该重组转基因或蛋白质产物被并入由那些细胞产生的EV中。术语“修饰的”表示囊泡已使用遗传或化学方法修饰,例如通过产生EV的细胞的遗传工程或通过例如化学缀合,例如将部分附着到外泌体表面。EV的尺寸可以有很大变化,但EV通常具有纳米级的流体动力学直径,即低于1000nm的直径。显然,EV可来源于体内、离体和体外的任何细胞类型。优选的EV包括外泌体和微泡,但其他EV在各种情况下也可能是有利的。更进一步地,所述术语还应当理解为涉及细胞外囊泡模拟物,通过例如膜挤出、超声处理或其他技术获得的基于细胞膜的囊泡等。更进一步地,当本文的教导涉及单数的EV和/或作为离散的天然纳米粒子样囊泡的EV时,应当理解,所有此类教导对于多个EV和EV群同样相关并且适用于多个EV和EV群。
在优选的实施方案中,本发明的基于EV的载体是任何细胞外囊泡(EV),例如外泌体、微泡或其任何组合。本发明的一个优选实施方案是使用包含腺病毒、慢病毒或AAV载体的联合治疗来递送所述转基因,并与基于EV的载体一起递送相同的转基因,其可同时或顺序给予。
在高度优选的实施方案中,联合治疗的基于EV的载体被内源性修饰以包含目的转基因。优选地,转基因以mRNA、环状RNA、小环DNA和/或pDNA的形式存在,但也可以使用其他形式的DNA、RNA或DNA/RNA多核苷酸。通过产生EV的细胞来源的遗传工程,当细胞产生囊泡时,转基因多核苷酸内源性装载到EV中,从而实现转基因及其编码的POI的非免疫原性递送。内源性装载到EV通常基于EV蛋白和核酸(NA)结合蛋白之间融合蛋白的使用,其中NA结合蛋白结合至RNA或DNA多核苷酸(优选mRNA、环状RNA、小环DNA、线性DNA和/或pDNA转基因)(即与之相互作用),并将它们装载到EV中。在优选的实施方案中,包含在融合蛋白中的NA结合蛋白为Cas6、Cas9、Cas13、PUF、PUF531、PUFx2、TALEN、锌指、核酸酶、转录因子中的至少一种,或其任何组合、结构域、区域或突变体。重要的是,将编码转基因的多核苷酸外源性装载到EV中是转基因装载的另一种易驾驭的方法,其似乎避免了在重复施用转基因时抗转基因抗体产生的问题。用于将mRNA、circRNA、小环DNA、线性DNA和/或pDNA装载到EV中的外源性装载策略包括电穿孔、微流体、转染到细胞中或直接转染到已经从产生EV的细胞来源收获的EV中等。
根据本发明的联合治疗非常适用于在医学上使用,有利地用于治疗遗传性疾病,并且更具体地用于治疗单基因疾病。本发明的联合治疗特别适用于以下疾病:溶酶体贮积症(LSD)、遗传性代谢错误(IME)、肌病、线粒体疾病、过氧化物酶体异常、炎性疾病、癌症、神经退行性疾病、神经疾病,以及基本上任何其他疾病、病痛(ailment)、病况、综合征或疾病状态。与本发明的联合治疗相关的具体患者类别包括产生针对转基因、针对转基因所递送到其中的细胞、针对POI或针对病毒载体自身的抗体的患者。更进一步地,对于在施用病毒载体时或之后引发先天、体液或T细胞介导的免疫反应的患者,其非常适于用本发明的基于EV的转基因递送载体进行后续治疗。类似地,当已知患者已存在针对病毒载体或转基因产物的抗体时,本发明的基于EV的载体代表高度易驾驭的非免疫原性干预。此外,由于基于病毒的载体和基于EV的载体之间药代动力学和药效学特征不同,联合治疗的两种组分(即病毒载体和基于EV的载体)可以采用不同的施用途径和/或不同的制剂。例如,病毒载体可通过脑室内或鞘内施用至CNS中,而EV可静脉内、皮下和/或肌内施用,反之亦然,这取决于病毒载体的类型、基于EV的载体的类型以及待治疗的疾病。作为非限制性示例,治疗伴有神经疾病的溶酶体贮积病的合适方法可以是:通过使用施用至CNS(例如,通过鞘内或脑室内施用)的病毒载体,与所述RNA或DNA转基因的基于EV的载体递送并行或顺序组合,递送编码缺失或缺陷酶或转运蛋白(例如,GBA、NPC1、CLN6、IS2、LAMP2、α或β甘露糖苷酶等)的转基因,例如通过静脉注射或皮下注射全身施用。或者,如上所述,病毒和基于EV的载体也可以以分开的药物组合物或以相同的药物组合物使用相同的施用途径施用,例如静脉内施用。在优选的实施方案中,以第一剂量施用病毒载体介导的转基因递送,然后以第二和后续剂量以基于EV的载体递送相应的转基因,其中第二剂量可以与第一病毒载体剂量同时施用,或者在已经施用病毒载体剂量之后施用。
在进一步地方面,本发明涉及一种治疗方法,其包含向需要其的受试者施用(i)包含编码POI的转基因的病毒载体和(ii)包含所述转基因的基于EV的载体的步骤。
“同时或平行施用/递送/给药”可以意指通过相同途径并且同时或基本上同时施用至少两种活性成分。
“分开施用/递送/给药”可以意指通过不同途径同时或基本上同时施用至少两种活性成分。
“顺序施用/递送/给药”可以意指在不同时间施用至少两种活性成分,施用途径相同或不同。更具体地,“顺序”可以指一种活性成分的全部施用在另一种或其他成分开始施用之前进行。因此,在施用一种或多种其他活性成分之前,可在数月内施用一种活性成分。在这种情况下没有同时治疗。还可以设想在数周内交替施用每种活性成分。
术语“施用”、“给药”和“递送”在本说明书中可互换使用。本发明的联合治疗可通过各种不同的施用途径施用于人或动物受试者,例如耳(耳部)、口腔、结膜、皮肤、牙、电渗透、宫颈内、鼻窦内、气管内、肠内、硬膜外、羊膜外、体外、血液透析、渗透、间质、腹腔内、羊膜内、动脉内、关节内、胆道内、支气管内、囊内、心内、软骨内、尾部内、海绵体内、腔内、脑内、脑室内、脑池内、角膜内、冠状内(牙)、冠状动脉内、海绵体内、真皮内、椎间盘内、导管内、十二指肠内、硬膜内、表皮内、食管内、胃内、牙龈内、回肠内、病灶内、管腔内、淋巴内、髓内、脑膜内、肌内、眼内、卵巢内、心包内、腹腔内、胸膜内、前列腺内、肺内、窦内、椎管内、滑膜内、腱内、睾丸内、鞘内、胸内、小管内、肿瘤内、鼓室内、子宫内、血管内、静脉内、静脉内推注、静脉滴注、心室内、膀胱内、玻璃体内、离子电渗、冲洗、喉、鼻、鼻饲、封闭给药技术、眼科、口服、口咽、其他、胃肠外、经皮、关节周围、硬膜外、神经周围、牙周、直肠、呼吸(吸入)、眼球后、软组织、蛛网膜下、结膜下、皮下、舌下、粘膜下、局部、经皮、经粘膜、经胎盘、经气管、经鼓膜、输尿管、尿道和/或阴道施用;和/或上述施用途径的任何组合,其通常取决于待治疗的疾病和/或待施用的药物组合物的特性。
如上所述,这种联合方法特别适用于已存在针对病毒载体或转基因产物的抗体的患者、发展针对病毒载体或转基因产物的抗体的患者、患有需要用不同载体到达不同器官、身体隔室或组织的疾病的患者等。在本发明的一个有利的实施方案中,病毒载体和基于EV的载体可通过相同或不同的施用途径施用,以便利用与不同的递送载体相关的固有优势。
在进一步的实施方案中,病毒载体和基于EV的载体转基因递送实际上同时或顺序进行。施用方案之间的选择将取决于各个方面,诸如实际或预期的抗体滴度,对病毒基因治疗的一般实际或预期的免疫反应,不同类型载体要达到的靶器官等。在联合治疗的一种优选给药方案中,转基因的基于病毒载体的递送进行1次或至多2次或少数几次,而转基因的EV载体递送则重复进行,即进行超过1次,但通常进行超过2次或潜在地用于慢性、长期治疗(即施用数十至数百至数千次)。令人惊讶的实现——可以在不触发抗转基因免疫反应的情况下,递送以RNA或DNA多核苷酸(例如,mRNA、circRNA、小环DNA、线性DNA或pDNA)形式内源性装载转基因的基于EV的载体,意味着可以使用基于EV的载体方法在延长的时间段内“补充”病毒基因治疗,从而为重复基因治疗施用问题提供了最佳解决方案。
在进一步的方面,本发明涉及一种制备本发明的联合治疗的方法。本发明的制备方法通常可包含以下步骤:(a)用包含转基因的病毒载体基因组感染第一宿主细胞,并收集由所述第一宿主细胞产生的病毒载体,和(b)遗传修饰第二宿主细胞以产生基于EV的载体,该载体在DNA或RNA多核苷酸(例如,mRNA、circRNA、小环DNA、线性DNA和/或pDNA多核苷酸)中包含所述转基因,并收集由第二宿主细胞产生的基于EV的载体。这两个步骤可以同时、以任何顺序来顺序和/或平行进行。
在优选的实施方案中,用于病毒载体产生的第一宿主细胞和用于基于EV的载体产生的第二宿主细胞是相同的细胞类型。合适的细胞来源包括羊膜来源的细胞;胎盘来源的细胞;羊膜上皮细胞;来自例如骨髓、脂肪组织、华通氏胶(Wharton’s jelly)、HEK细胞的间充质基质细胞等。在优选的实施方案中,步骤(b)中的遗传修饰包括在第二宿主细胞(其可与第一宿主细胞类型相同,如上所述)中表达包含EV蛋白和NA结合蛋白的融合蛋白,其中所述NA结合蛋白与mRNA、其他形式的线性RNA、环状RNA、小环DNA、线性DNA和/或pDNA转基因相互作用并将它们装载到EV中。在优选的实施方案中,NA结合蛋白选自群组,该群组包含Cas6、PUF、PUF531、PUFx2、Cas6中的至少一种,或其任何结构域、区段、区域、序列、突变体、变体或组合。通常,适用于本发明上下文的NA结合蛋白包括PUF、PUF531、PUFx2(其包含来自人类Pumilio 1蛋白的两个PUF结构域)、PUFeng、DDX3X、EEF2、EEF1A1、HNRNPK、HNRNPM、HNRNPA2B1、HNRNHPH1、HNRNPD、HNRNPU、HNRNPUL1、NSUN2、Cas6、Cas13、Cas9、WDR1、HSPA8、HSP90AB1、MVP、PCB1、MOCS3、DARS、ELC2、EPRS、GNB2L1、IARS、NCL、RARS、RPL12、RPS18、RPS3、RUVBL1、TUFM、hnRNPA1、hnRNPA2B1、DDX4、ADAD1、DAZL、ELAVL4、ELAVL1、IGF2BP3、HNRNPQ、RBFOX1、RBFOX2、U1 A、PPR家族、ZRANB2、NUSA、IGF2BP1、IGF2BP2、Lin28、KSRP、SAMD4A、TDP43、FUS、FMR1、FXR1、FXR2、EIF4A1-3、MS2外壳蛋白、DEAD、KH、GTP_EFTU、dsrm、G-patch、IBN_N、SAP、TUDOR、RnaseA、MMR-HSR1、KOW、RnaseT、MIF4G、zf-RanBP、NTF2、PAZ、RBM1CTR、PAM2、Xpo1、Piwi、CSD、RipTALs、Bats和MOrTL1和2、BurrH、R2DBD、MBP1、Skn-1bZL、RORα1、dnaA,及其任何组合、衍生物、结构域、区域、位点、突变变体或部分。
包含在根据本发明的融合蛋白中的EV蛋白可选自包含以下非限制性示例的群组:CD9、CD53、CD63、CD81、CD54、CD50、FLOT1、FLOT2、CD49d、CD71、CD133、CD138、CD235a、ALIX、同线蛋白(Syntenin)-1、同线蛋白-2、Lamp2b、TSPAN8、多配体聚糖-1、多配体聚糖-2、多配体聚糖-3、多配体聚糖-4、TSPAN14、CD37、CD82、CD151、CD231、CD102、NOTCH1、NOTCH2、NOTCH3、NOTCH4、DLL1、DLL4、JAG1、JAG2、CD49d/ITGA4、ITGB5、ITGB6、ITGB7、CD11 a、CD11b、CD11 c、CD18/ITGB2、CD41、CD49b、CD49c、CD49e、CD51、CD61、CD104、白介素受体、免疫球蛋白、MHC-I或MHC-II成分、CD2、CD3ε、CD3ζ、CD13、CD18、CD19、CD30、CD34、CD36、CD40、CD40L、CD44、CD45、CD45RA、CD47、CD86、CD110、CD111、CD115、CD117、CD125、CD135、CD184、CD200、CD279、CD273、CD274、CD362、COL6A1、AGRN、EGFR、GAPDH、GLUR2、GLUR3、HLA-DM、HSPG2、L1CAM、LAMB1、LAMC1、ARRDC1、PDGFRN、ATP2B2、ATP2B3、ATP2B4、BSG、IGSF2、IGSF3、IGSF8、ITGB1、ATP1A2、ATP1A3、ATP1A4、ITGA4、SLC3A2、ATP1A1、ATP1B3、ATP2B1、LFA-1、LGALS3BP、Mac-1α、Mac-1β、MFGE8、SLIT2、STX3、TCRA、TCRB、TCRD、TCRG、VTI1A、VTI1B和任何其他EV蛋白,及其任何组合、衍生物、结构域、变体、突变体或区域。特别有利的EV蛋白包括CD63、CD81、CD9、CD82、CD44、CD47、CD55、LAMP2B、ICAM、整联蛋白、ARRDC1、多配体聚糖、同线蛋白和Alix,及其衍生物、结构域、变体、突变体或区域。
用于产生病毒载体和基于EV的载体的宿主细胞可基本上选自任何类型的细胞来源,包括原代细胞、细胞系、存在于多细胞生物中的细胞,或基本上可用于产生病毒载体和/或EV的任何其他类型的细胞来源。宿主细胞可在悬浮培养物中、在贴壁培养物中、在珠或其他移动元件上,或在任何其他类型的培养系统中和在任何类型的容器中生长。根据本发明的宿主细胞还可包括体内产生EV的细胞和病毒载体。本发明的宿主细胞可选自多种细胞、组织和/或细胞系,例如间充质基质细胞(MSC),可从例如骨髓、脂肪组织、华通氏胶、围产期组织、胎盘、牙芽、脐带血、皮肤组织等获得;成纤维细胞;羊膜细胞,更具体地是任选表达各种早期标志物的羊膜上皮细胞;髓样抑制细胞;M2极化巨噬细胞;脂肪细胞;内皮细胞;成纤维细胞;人脐带内皮细胞(HUVEC);人胚肾(HEK)细胞,诸如HEK293、HEK293T、适于悬浮培养和/或无血清培养的HEK细胞;内皮细胞系,诸如微血管或淋巴内皮细胞;红细胞;红系祖细胞;软骨细胞;通过羊膜穿刺获得的或来自胎盘的任何细胞;来自气道或肺泡的上皮细胞;成纤维细胞;内皮细胞等。而且,免疫细胞,诸如B细胞、T细胞、NK细胞、巨噬细胞、单核细胞、树突细胞(DC)也在本发明的范围内,并且基本上任何类型的能够产生病毒载体和EV的细胞也涵盖在本文中。宿主细胞对于待治疗的患者可以是同种异体的、自体的或甚至是异种的,即细胞可来自患者自身或来自不相关的、匹配的或不匹配的供体。
在进一步的实施方案中,根据本发明的制备方法可另外包含将病毒载体和/或基于EV的载体配制在药物组合物中的步骤。这两种载体类型可配制在相同类型的药物组合物中或可配制在不同类型的药物组合物中。这种选择的关键是施用途径、不同载体的剂量和待治疗的疾病。在一个实施方案中,在相同的药物组合物或不同的药物组合物中,病毒载体可以与基于EV的载体几乎同时递送。本发明的配制缓冲液通常是含有一种或多种添加剂的水溶液。这些添加剂可包括诸如人血清白蛋白(HAS)的蛋白质、诸如海藻糖或蔗糖的糖类、高分子量结构添加剂(其可为诸如HSA的蛋白质)和水中的缓冲组分。如在本发明的上下文中使用的,“缓冲化合物”或“缓冲组分”应理解为是指用于将水性悬浮液维持在所需pH的物质。该水溶液还可含有一种或多种氨基酸。
配制缓冲液可有利地用作基于EV的载体和病毒载体之一或两者的储存缓冲液。储存可在零下温度下进行,例如在-5摄氏度或更低,优选-20摄氏度或甚至更优选-80摄氏度下进行。可通过在室温下冻干或蒸发,干燥粗制或纯化形式的基于EV的载体和/或病毒载体的水性制剂。
如前所述,用于配制的溶液可有利地包含糖类、高分子量结构添加剂(诸如HAS)、缓冲组分和水中的一种或多种。溶液还可包括一种或多种氨基酸。这些组分的组合用于在冷冻、解冻、冻干和/或施用和循环时保持基于EV的载体和/或病毒载体的活性。尽管优选的糖是海藻糖,但也可以使用其他糖,诸如乳糖、蔗糖、甘露醇、葡萄糖、肌醇、果糖、麦芽糖或半乳糖。此外,可使用糖类的组合,例如海藻糖和甘露醇,或蔗糖和甘露醇。高分子量结构添加剂有助于防止载体在冷冻过程中聚集,并在液态、冷冻或冻干状态下提供结构支持。在本发明的上下文中,如果结构添加剂大于5000道尔顿,则认为结构添加剂是“高分子量”的。优选的高分子量结构添加剂是人血清白蛋白。但是,也可以使用其他物质,诸如羟乙基纤维素、羟甲基纤维素、葡聚糖、纤维素、明胶或聚维酮。氨基酸可用于在水悬浮液冷却和解冻时进一步保持载体感染性。优选的氨基酸是精氨酸,但也可以使用其他氨基酸,诸如赖氨酸、鸟氨酸、丝氨酸、甘氨酸、谷氨酰胺、天冬酰胺、谷氨酸或天冬氨酸。缓冲组分通过维持相对恒定的pH来缓冲溶液。取决于所需的pH范围,优选在7.0至7.8之间,可以使用各种缓冲剂。合适的缓冲液包括磷酸盐缓冲液和柠檬酸盐缓冲液。此外,优选水溶液含有用于将最终制剂调节至适当等渗盐浓度的中性盐。合适的中性盐包括氯化钠、氯化钾或氯化镁。优选的盐是氯化钠。
基于EV的载体的下游处理和纯化可使用选自包括以下的一组技术的方法来实现:液相色谱(LC)、高效液相色谱(HPLC)、珠粒洗脱色谱、旋转过滤、渗滤、切向流过滤(TFF)、中空纤维过滤、离心、免疫沉淀、流场分离、透析、基于微流体的分离等,或其任何组合。在一个有利的实施方案中,基于EV的载体的纯化使用过滤(优选渗滤或超滤(UF)或切向流过滤(TFF))和色谱法(例如,尺寸排阻LC、离子交换LC和/或珠粒洗脱LC)的顺序组合进行。组合纯化步骤通常可提高所得到的基于EV的载体制剂的纯度,并进而带来优良的治疗活性。
类似地,病毒载体的纯化是本领域熟知的,并且包括诸如离心和色谱技术的纯化技术。本领域熟知的其他方法可以包括浓缩、过滤、渗滤或与合适的缓冲液或药物赋形剂混合。可以将基于EV的载体和病毒载体的制剂分成单位剂量和多剂量等分试样进行分配,这将保留批次的基本特征。本发明可有利地用于多种疾病、病况和病痛,包括但不限于:α-甘露糖苷贮积症;天冬氨酰葡萄糖胺尿症;胆固醇酯贮积病;胱氨酸病;Danon病;法布里病;法伯病;岩藻糖苷贮积症;半乳糖唾液酸贮积症;Ⅰ型高雪氏病;Ⅱ型高雪氏病;Ⅲ型高雪氏病;I型GM1神经节苷脂贮积症;Ⅱ型GM1神经节苷脂贮积症;Ⅲ型GM1神经节苷脂贮积症;GM2-山德霍夫氏病;GM2-泰伊-萨克斯二氏病;GM2-神经节苷脂贮积症;AB变体;粘脂贮积病II;克拉伯病;溶酶体酸性脂肪酶缺乏症;异染性脑白质营养不良;MPS Ⅰ-贺勒氏症;MPS Ⅰ-施艾氏症;MPS Ⅰ胡-射综合征;MPS ⅠⅠ-亨特氏综合征;MPS ⅠⅠⅠA-沙费利波综合征A型;MPS ⅠⅠⅠB-沙费利波综合征B型;MPS ⅠⅠⅠB-沙费利波综合征C型;MPS ⅠⅠⅠB-沙费利波综合征D型;MPSIV-莫尔基奥A型;MPS IV-莫尔基奥B型;MPS ⅠⅩ-透明质酸酶缺乏症;MPS VI-拉米氏症;MPS Ⅶ-斯莱综合征;粘脂贮积病I-唾液酸沉积症;粘脂贮积病IIIC;IV型粘脂贮积病;多发性硫酸酯酶缺乏症;神经元蜡样脂褐质沉积症Tl;神经元蜡样脂褐质沉积症T2;神经元蜡样脂褐质沉积症T3;神经元蜡样脂褐质沉积症T4;神经元蜡样脂褐质沉积症T5;神经元蜡样脂褐质沉积症T6;神经元蜡样脂褐质沉积症T7;神经元蜡样脂褐质沉积症T8;A型尼曼-皮克病;B型尼曼-皮克病;C型尼曼-皮克病;庞贝病;致密性成骨不全症;唾液酸贮积病;辛德勒病;沃尔曼病;线粒体复合物I缺乏症;线粒体复合物II缺乏症;线粒体复合物Ⅲ缺乏症;线粒体复合物IV缺乏症;线粒体复合物V(ATP合酶)缺乏症;原发性辅酶Q10缺乏症(COQ 10D);脑、眼、牙、耳和骨异常(CODAS)综合征;由PolG突变引起的线粒体疾病;慢性进行性眼外肌麻痹综合征(CPEO);Alpers-Huttenlocher综合征(AHS);儿童肌-脑性肝病谱(ChildhoodMyocerebrohepatopathy Spectrum,MCHS);肌阵挛性癫痫肌病感觉性共济失调(MEMSA);共济失调神经病变谱(Ataxia Neuropathy Spectrum,ANS);线粒体隐性共济失调综合征(MIRAS);感觉性共济失调神经病伴构音障碍和眼外肌瘫痪(SANDO);常染色体隐性进行性眼外肌麻痹(arPEO);常染色体显性进行性眼外肌麻痹(adPEO);线粒体DNA耗竭综合征;线粒体周围神经病并胃肠型脑病(MNGIE);耳聋肌张力障碍综合征;3-甲基戊烯二酸尿症;结合性氧化磷酸化缺乏症;肌病、乳酸酸中毒和铁粒幼红细胞性贫血综合征(MLASA);高尿酸血症;肺动脉高压;肾衰竭和碱中毒(HUPRA)综合征;Leigh综合征;法国-加拿大型Leigh综合征;弗里德赖希共济失调;Gracile综合征;Bjornstad综合征;多发性线粒体功能障碍综合征(MMDS);早发性共济失调伴眼部运动失用症和低白蛋白血症(EAOH);腓骨肌萎缩症-2A2;莱伯遗传性视神经病(LHON);婴儿猝死综合征;肌阵挛性癫痫伴破碎红纤维(MERRF);MERRF/MELAS重叠综合征;神经病变;共济失调;色素性视网膜炎(NARP);线粒体肌病;脑肌病;乳酸性酸中毒和卒中样发作(MELAS);伴有脑干和脊髓受累和乳酸升高的脑白质病(LBSL);由SDH突变引起的线粒体疾病;痉挛性截瘫;副神经节瘤;嗜铬细胞瘤;视神经萎缩1型;乙基丙二酸脑病;肉毒碱-酰基肉毒碱转位酶缺乏症;原发性全身性肉毒碱缺乏症;脑肌酸缺乏综合征-1;脑肌酸缺乏综合征-2或脑肌酸缺乏综合征-3;肉毒碱棕榈酰基转移酶1(CPT 1)缺乏症;肉毒碱棕榈酰基转移酶2(CPT II)缺乏症;短链酰基辅酶A脱氢酶缺乏症;极长链酰基辅酶A脱氢酶缺乏症;长链3-羟酰基辅酶A脱氢酶(LCHAD)缺乏症;多种酰基辅酶A脱氢酶缺乏症;戊二酸血症IIA;戊二酸血症IIB;戊二酸血症IIC;丙酮酸羧化酶缺乏症;丙酮酸脱氢酶缺乏症;丙酮酸脱氢酶El-α缺乏症;丙酮酸脱氢酶磷酸酶缺乏症;丙酮酸脱氢酶E3-结合蛋白缺乏症;丙酮酸脱氢酶E2缺乏症;丙酮酸脱氢酶El-β缺乏症;3-羟酰基辅酶A脱氢酶(SCHAD)缺乏症/(HADH)缺乏症;脑肌酸缺乏综合征(CCDS)1;CCDS2;GLUT1缺乏综合征1;婴儿期严重进行性肌阵挛癫痫1A(Unverricht和Lundborg);进行性肌阵挛性癫痫2A(Lafora);进行性肌阵挛性癫痫2B(Lafora);早期幼儿癫痫性脑病(EIEE)1型;EIEE 3型;EIEE 8型;EIEE 12型;EIEE 15型;EIEE 16型;EIEE 18型;多发性先天性异常-低张力-癫痫发作综合征2(MCAHS 2)/EIEE 20型;EIEE 21型;EIEE 23型;EIEE 25型;EIEE 28型;EIEE29型;EIEE 34型;EIEE 35型;小头畸形,癫痫发作和发育迟缓(MCSZ);Aicardi-Goutieres综合征(AGS)1型;AGS 2型;AGS 3型;AGS 4型;AGS 5型;AGS 6型;先天性糖基化障碍(CDG)Ia型;CDG Ib型;CDG Ic型;CDG Id型;CDG Ie型;CDG If型;CDG Ig型;CDG Ih型;CDG Ii型;CDG Ij型;CDG Ik型;CDG 1 1型;CDG Im型;CDG In型;CDG Io型;CDG Ip型;CDG Iq型;CDGIr型;CDG Is型;CDG It型;CDG Iu型;CDG Iw型;CDG Ix型;CDG Iy型;CDG Iz型;CDG IIa型;CDG IIb型;CDG IIe型;CDG IId型;CDG IIe型;CDG IIf型;CDG IIg型;CDG IIh型;CDGIIi型;CDG IIj型;CDG IIk型;CDG IIl型;CDG IIn型;常染色体隐性脊髓小脑性共济失调1型;早发性共济失调伴眼球运动失用症和低蛋白血症;Marinesco-Sjogren综合征;科克因综合征,A型/UV-敏感性综合征2;科克因综合征,B型/脑-眼-面-骨综合征1/着色性干皮侏儒综合征/UV-敏感性综合征;Charlevoix-Saguenay型痉挛性共济失调;佩-梅二氏病/痉挛性截瘫2;X连锁遗传性铁粒幼细胞贫血伴共济失调;脑桥小脑发育不全(PCH)Ia型;PCH Ib型;PCH Ic型;PCH 2a型;PCH 2b型;PCH 2c型;PCH 2d型;PCH 2e型;PCH 3型;PCH 4型;PCH5型;PCH 6型;PCH 8型;PCH 9型;PCH 10型;常染色体隐性脊髓小脑性共济失调(SCAR)2(SCAR2);SCAR7;SCAR 8;SCAR 10;SCAR 14;SCAR 16;SCAR 18;SCAR 20;鸟氨酸转氨甲酰酶缺乏症;瓜氨酸血症;精氨酸琥珀酸尿症;精氨酸血症;氨基甲酰磷酸合成酶I缺乏症;血色素沉着病;门克斯病;威尔逊病;钼辅因子缺乏症A;钼辅因子缺乏症B;脑组织铁沉积神经变性病(NBIA)1/HARP综合征;NBIA 2B/婴儿神经轴索营养不良1/常染色体隐性遗传性帕金森病14;NBIA 3;NBIA 4;NBIA 6;Kufor-Rakeb综合征;痉挛性截瘫35;Woodhouse-Sakati综合征;岩藻糖苷贮积症;痉挛性截瘫30/遗传性感觉神经病变型lie/常染色体显性遗传智力低下9;酪氨酸血症(TYRSN)1型;TYRSN 2型;TYRSN 3型;同型半胱氨酸血症;亚硫酸盐氧化酶缺乏症;苯丙酮尿症;枫糖尿病(MSUD)Ia型;MSUD Ib型;MSUD II型;戊二酸血症I型;甲基丙二酸尿症mut(0)型;全羧化酶合成酶缺乏症;丙酸血症;异戊酸血症;过氧化物酶体生物发生障碍1A(Zellweger);过氧化物酶体生物发生障碍3A(Zellweger);过氧化物酶体生物发生障碍4A/4B(Zellweger);过氧化物酶体生物发生障碍5A/5B(Zellweger);过氧化物酶体生物发生障碍6A/6B(Zellweger);过氧化物酶体生物发生障碍7A/7B(Zellweger);过氧化物酶体生物发生障碍8A/8B(Zellweger);过氧化物酶体生物发生障碍10A(Zellweger);过氧化物酶体生物发生障碍11A/11B(Zellweger);过氧化物酶体生物发生障碍12A(Zellweger);过氧化物酶体生物发生障碍13A(Zellweger);肾上腺脑白质营养不良(ALD),Perrault综合征(PRLT)1;PRLTS1;PRLTS2;PRLTS3;PRLTS4和PRLTS5。
现在将通过所附的非限制性实施例进一步示例和说明本发明及其各个方面、实施方案、替代方案和变体,这些实施例自然也可以在不脱离本发明的范围和主旨的情况下进行大量修改。
实验部分和实施例
载体构建体设计和克隆
作为仅用于说明目的的非限制性实施例,为了使用基于EV的载体以mRNA形式加载和递送转基因,将各种NA结合结构域及其变体(例如,PUF、PUFeng(PUF蛋白的工程版本)、Cas6、Cas13等)与几种外泌体多肽(例如、CD81、CD63、CD9、同线蛋白、多配体聚糖、Alix、CD133等)组合使用。ORF通常通过合成产生,并克隆到哺乳动物表达载体pSF-CAG-Amp中。简单地说,按照制造商说明书(NEB),用酶NotI和Sail消化合成的DNA和载体质粒。按照制造商的说明(NEB),使用T4连接酶将限制性的、纯化的DNA片段连接在一起。通过在补充氨苄青霉素的平板上的细菌转化选择成功的连接事件。按照制造商的说明,用于转染的质粒通过“maxi-prep”产生。
病毒载体通常获自病毒载体的商业制造商,例如Addgene、Oxford Genetics或Vector Biolabs。简单地说,如下面对AAV载体的说明,将目的基因(例如,报道子,诸如纳米荧光素酶或GFP,或编码治疗性POI的GOI,诸如NPC1或GBA)克隆到pAAV顺式质粒中。随后用mega或maxi prep方法大规模制备pAAV顺式质粒和辅助质粒(Ad辅助载体和AAV rep/cap载体),然后在24孔板中转染到合适的生产病毒的细胞(诸如FIEK293T细胞)中。目的AAV血清型包括血清型1、2、3、4、5、6、7、8、9、10和合成AAV血清型(诸如AAV-DJ或AAV 6.2)等。除AAV外,其他目的病毒载体包括慢病毒载体、腺病毒载体、逆转录病毒以及各种其他病毒载体。
细胞培养和转染
根据实验设计和测定,细胞培养包括转导细胞以稳定表达基于EV的载体或病毒载体,其中在其他情况下瞬时转染和EV产生是足够的。病毒和基于EV的载体的生产细胞主要在悬浮培养物或贴壁培养物中、在珠粒或其他可移动元件上,或在任何其他类型的培养系统和任何类型的容器中生长。根据本发明的生产细胞可选自多种细胞、组织和/或细胞系,例如间充质基质细胞(MSC)(可从例如骨髓、脂肪组织、华通氏胶、围产期组织、胎盘、牙芽、脐带血、皮肤组织等获得);成纤维细胞;羊膜细胞,更具体地是任选表达各种早期标志物的羊膜上皮细胞;髓样抑制细胞;M2极化巨噬细胞;脂肪细胞;内皮细胞;成纤维细胞;人脐带内皮细胞(HUVEC);人胚肾(HEK)细胞,诸如HEK293、HEK293T、适于悬浮培养和/或无血清培养的HEK细胞;内皮细胞系,诸如微血管或淋巴内皮细胞;红细胞;红系祖细胞;软骨细胞;通过羊膜穿刺术获得的或来自胎盘的任何细胞;来自气道或肺泡的上皮细胞;成纤维细胞;内皮细胞等。为简洁起见,本文仅提及几个示例。通常将HEK293T细胞接种到15cm培养皿中(9×10
在病毒转导和产生用于产生基于EV的载体生产系统的稳定细胞系的情况下,通常使用慢病毒(LV)转导,对细胞来源(诸如BM-MSC、WJ-MSC、成纤维细胞、羊膜上皮细胞、成纤维细胞、各种内皮细胞和上皮细胞)进行病毒转导。通常,在感染前24小时,100.000个细胞(例如,成纤维细胞、MSC等)或200.000个细胞(例如,HEK293T)铺在6孔板中。加入2μL的LV和任选的Polybrene(或海地美溴铵,在孔上的终浓度为8μg/mL),并在转导后24小时,将转导细胞的细胞培养基改为新鲜的完全培养基。在转导后72小时,进行嘌呤霉素选择(4-6μg/ml),通常进行7天,然后分析融合多肽的稳定表达。还使用非病毒转染方法(包括电穿孔、脂质转染、用聚阳离子试剂(诸如PEI)转染等)产生稳定的细胞。稳定转染的细胞通常在2D培养物、悬浮生物反应器或贴壁细胞生物反应器中培养,随后收获条件培养基用于制备基于EV的载体。如上所述进行各种制备和纯化步骤,标准工作流程包括以下步骤:预清除上清液,基于过滤浓缩,基于色谱法去除污染物,以及任选地在合适缓冲液中配制所得外泌体组合物,用于体外和/或体内测定。
检测和分析
蛋白质印迹、qPCR和RNA seq是评价转基因在EV中富集的有效且方便的分析方法。简单地说,对于蛋白质印迹,根据制造商的说明书(Invitrogen,Novex PAGE 4-12%胶)进行SDS-PAGE,由此每孔上样1×10
对于EV尺寸测定,用配备有分析软件的NanoSight(RTM)仪器进行纳米颗粒跟踪分析(NTA),或有时用Particle Metrics机进行。对于在NanoSight(RTM)上的记录,使用13或15的摄像机水平和所有采集后设置的自动功能。经常使用电子显微法和荧光显微法验证和评估EV或病毒形态和大小。
如上所述,使用各种方法分离和纯化EV,该方法通常为过滤(诸如TFF)和尺寸排阻液相色谱法、离子交换色谱法和/或珠粒洗脱液相色谱法的组合。通常,收集含有EV的培养基,并在300g下低速旋转5分钟,然后在2000g下旋转10分钟,以去除较大的颗粒和细胞碎片。然后,将上清液用0.22μm注射器式滤器过滤,并进行不同的纯化步骤。使用具有100kDa截止过滤器的Vivaflow 50R切向流(TFF)装置(Sartorius)或具有100或300kDa截止中空纤维过滤器的KR2i TFF系统(SpectrumLabs)将大体积渗滤并浓缩至约20ml。然后,将预浓缩的培养基加载到珠粒-洗脱柱(FliScreen(RTM)或HiT rap(RTM)Capto Core 700柱,GEHealthcare Life Sciences)上,连接至AKTAprime(RTM)plus或AKTA Pure 25(RTM)色谱系统(GE Healthcare Life Sciences)。根据制造商的说明,选择用于柱平衡、样品装载和柱原位清洁程序的流速设置。根据UV吸光度色谱图收集样品,并使用Amicon Ultra-15 10kDa分子量截止旋转过滤器(Millipore)浓缩至终体积为100μl,并保存在-80℃用于进一步的下游分析。为了评估蛋白质和RNA洗脱图谱,使用100kDa和300kDa中空纤维过滤器,使用KR2i TFF系统对培养基进行浓缩和渗滤,并在Tricorn 10/300Sepharose 4Fast Flow(S4FF)柱(GE Healthcare Life Sciences)上分析样品。
实施例1:使用AAV和MSC EV重复递送纳米荧光素酶转基因
根据标准方案,通过使用腺病毒纳米荧光素酶表达构建体在HEK293T生产细胞中制备AAV载体。通过慢病毒基因转移对人永生化MSC进行工程化,以稳定地表达CD63和NA结合蛋白Cas13或PUF之间的融合构建体,从而将纳米荧光素酶mRNA内源性封装到EV中。分离EV,并用切向流过滤(TFF)和珠粒洗脱色谱法浓缩。对AAV载体和分离的EV进行纳米颗粒跟踪分析,以确定颗粒浓度。然后将1e10 AAV颗粒,或1e10 EV,或1e10 AAV颗粒和1e10 EV两者与新鲜培养基一起加入到6个孔,这些孔用Huh 7细胞以50%汇合接种。将细胞在37℃和5%CO
实施例2:抗eGFP抗体的产生在AAV和EV介导的基因治疗之间是不同的
本实施例旨在验证,使用用于转基因递送的病毒载体(在这种情况下是AAV9)和用于递送相同转基因的基于EV的载体的组合的基因治疗能够在体内重复施用,而不会产生抗第二剂量的抗转基因抗体。将AAV9介导的递送后的EV介导的转基因递送与AAV载体的再施用进行比较,其中按照与上述相同的原理制备编码eGFP的AAV载体和内源性装载有编码eGFP的相应mRNA的基于EV的载体(使用CD81-Cas6融合蛋白用于mRNA装载),但是这里两种载体类型在HEK293T宿主细胞中产生。在(i)施用AAV9eGFP载体(1e10 AAV9颗粒)一次(图3中的AAV),(ii)在重复施用AAV9eGFP载体(图3中的AAV+AAV),以及(iii)在依次施用AAV9eGFP和HEK-EV-eGFP mRNA(1e10EV颗粒)(AAV+EV)之后,对取自C57BL/6小鼠的血液样本进行体外抗体ELISA测定,以定量抗eGFP的抗转基因抗体产量。用标准品进行系列稀释以产生标准曲线,其允许测量由PBMC释放的抗体浓度。从图3可以看出,重复施用AAV9eGFP载体大量诱导抗eGFP抗体产生,而与单独的AAV9eGFP相比,使用AAV9eGFP载体和HEK-EV-eGFPmRNA的组合治疗基本上未显示附加的抗转基因抗体产生。
- 联合基因治疗
- 基于RNAi技术的多基因联合基因治疗的质粒载体
