一种4-氢苯并1,2氮杂膦-3-酮-1-氧化物系列化合物的高效率制备方法和用途
文献发布时间:2024-04-18 19:44:28
技术领域
本发明涉及含氮杂膦-3-酮-1-氧化物骨架的含氮、膦衍生物,具体涉及一种4-氢苯并[1,2]氮杂膦-3-酮-1-氧化物系列化合物的高效率制备方法和用途。
背景技术
氮杂膦-3-酮-1-氧化物及其衍生物是具有P-N键的有机磷化合物,在农业中用作杀虫剂,在杀灭昆虫和螨虫方面具有很高的活性((a)Annual Report of ChineseChemical Industry,Chemical Industry Press,Beijing,1999.(b)J.Zhiqian,L.Yue,L.Shu.Treatment of organophosphate-contaminated wastewater by acidichydrolysis and precipitation.Journal of HazardousMaterialsB129(2006)234–238.)。含有P-N键核心骨架结构的有机磷化合物普遍存在,广泛存在于药物和含膦配体或者具有重要生物或药物活性的有机分子当中,在药物化学领域中磷的功能还可以有效地改变它们的药用特性和生物反应,并在治疗开发中用作前药。在材料科学和有机合成等方面也具有重要的应用价值。((a)M.J.Sofia,W.Chang,P.A.Furman,R.T.Mosley,B.S.J.Ross.Med.Chem.2012,55,2481-2531.(b)O.Molt,T.Schrader.Synthesis2002,2633-2670.)。因此,开发一种简洁有效的氮-磷键形成方法是非常可取的,以及其他合成应用氮杂膦-3-酮-1-氧化物对药物的生物活性有很大影响。近几十年来,随着自由基化学的快速发展,利用金属盐、过氧化物、光催化剂等容易通过单电子转移(SET)或氢原子转移(HAT)生成的以P-N键为自由基受体构建X-p(X=C,N,O或S)键((a)Phosphorus,Sulfur,andSilicon and the Related Elements.2017,589-96.(c)L.Chen,X.Liu,Y.Zou.Adv.Synth.Catal.2020,1724-818.)为构建有机磷化合物开辟了新的途径,是构建磷P–N键的方法是必不可少的工具,为合成氮杂膦-3-酮-1-氧化物衍生物提供了许多可供选择的途径。
经过文献调研发现,近年来有许多新的研究报道过渡金属催化、光催化和电催化下基于p中心自由基形成C-P、N-P、S-P和O-P键的研究进展以及有机化学中P中心自由基磷酸化研究(B.Cai,J.Xuan,W.Xiao.Visible light-mediated C-P bond formationreactions.Science.Bulletin.2019,64:337-50.)。但在无环环境中以P-N键为自由基受体合成氮杂膦-3-酮-1-氧化物是合成化学家长期面临的挑战。基于氮杂膦-3-酮-1-氧化物骨架所具有的天然的强效生物或药物活性方面的特性,结合二苯基磷酰基甲基丙烯酰胺在有机化学中丰富多样的反应性,我们的策略使用N-丁基-N-二苯基磷酰基甲基丙烯酰胺作为在温和光氧化还原条件下原位产生的各种自由基的受体,以获得多种含P-N键的氧化物。在这种多组分工艺中得到的酰胺是一种广泛存在于许多天然产物和药物中的结构基序,并且可以转化为有价值的膦酮氧化物、氧吲哚以及β、β-二取代胺,突出了这种转化的合成潜力。这些基序的极性策略包括亲核烯化和烷基化、共轭加成和醛醇缩合。因此,我们预计开发新的合成方法合成氮杂膦-3-酮-1-氧化物类化合物将具有十分强大的重要的理论研究价值和工业生产方面的现实意义。
基于此,本发明旨在通过发展一类无金属催化的自由基反应。通过光氧化还原催化循环外化各种起始自由基的生成,可以确保反应的普遍性和合成实用性。使用结构上更加稳定且廉价易得的N-芳基磷酰基丙烯酰胺化合物作为原料,在光催化的反应条件下发生反应,二苯基磷酰基甲基丙烯酰胺作为自由基受体,与磺酰基自由基发生反应,高效率、高化学选择性地合成含氮杂膦-3-酮-1-氧化物系列化合物。
本发明方法无须任何金属元素作为催化剂或反应促进剂,对各类基团如卤素(氟、氯、溴、碘)、不饱和烯基基团,氰基、酯基、硝基等敏感基团具有良好的兼容性,这些基团本身具有良好的反应活性,因此所得产物能够通过其他的有机化学反应发生进一步的转化,从而在氮杂膦-3-酮-1-氧化物骨架上引入更多的官能团。反应只需乙腈作为溶剂即可发生反应,对于大部分常规官能团反应产率极高,可达100%的定量产率,极大地方便了分离提纯操作,因而具有十分优越的工业生产潜力。
发明内容
本发明目的在于提供一种4-氢苯并[1,2]氮杂膦-3-酮-1-氧化物系列化合物的高效率制备方法,本发明的方法化学选择性高,底物适用性广、反应条件简单,操作简便、催化剂经济性,成本低、副产物少、产品纯度高、便于分离提纯、可适用于较大规模的制备。
本发明是这样实现的,在有机溶剂中,采用N-丁基-N-二苯基磷酰基甲基丙烯酰胺和对甲苯磺酰氯作为反应底物,在25℃的条件下,催化剂作用,反应12-16小时,可高效得到产物4-氢苯并[1,2]氮杂膦-3-酮-1-氧化物系列化合物。反应通式如下:
其中R
其中,所述的反应条件为在435nm左右的蓝光光照条件下进行。所述的催化剂为金属Ir配合物fac-Ir(ppy)
在本发明的有益效果是:反应无须其他促进剂,在蓝光光照的条件下即可进行;催化剂用量低,催化剂与底物的摩尔数比为1-10mol%,优选1.0–5.0mol%。反应物N-芳基磷酰基甲基丙烯酰胺和磺酰氯的摩尔数比例为1:1.15就能非常顺利地进行,由此反应体现出反应物的高效性;反应的产率极高,无其它副产物,十分有利于分离提纯,由此也体现了反应具有原子经济性和环境友好性。产物对于卤素(氟、氯、溴、碘),不饱和烯基基团,氰基、硝基等敏感基团具有良好的兼容性,这些基团本身具有良好的反应活性,因此所得产物能够通过其他的有机化学反应发生进一步的转化,构建其他一些新型的含氮杂膦-3-酮-1-氧化物结构的化合物,因此在生物医药、农药和材料科学等领域具有非常好的应用前景。
附图说明
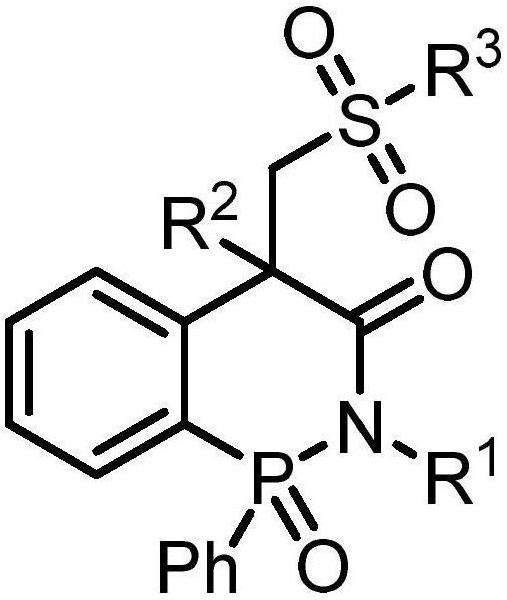
图1是根据本发明方法所得产物4-氢苯并[1,2]氮杂膦-3-酮-1-氧化物系列化合物的结构通式。
图2是产物3a的单晶衍射图(CCDC 2266222)。
具体实施方式
实施例一:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、对甲苯磺酰氯(40.3mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下,435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-甲苯磺酰甲基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3a。产率:95%。以下是产物3a的核磁共振实验数据:
实施例二:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(682mg)、对甲苯磺酰氯(437mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(42mg)、碳酸钾(849mg)溶于有机溶剂乙腈(8.0mL)中,在25℃氮气氛围下435nm蓝光照射反应18小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-甲苯磺酰甲基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3a。产率:87%。以下是产物3a的核磁共振实验数据:
实施例三:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(6.82g)、对甲苯磺酰氯(4.37g)、三(2-苯基吡啶)铱(260mg)、磷酸钾(8.49g)溶于有机溶剂乙腈(80mL)中,在25℃氮气氛围下435nm蓝光照射反应18小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-甲苯磺酰甲基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3a。产率:90%。以下是产物3a的核磁共振实验数据:
实施例四:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2g)、对甲苯磺酰氯(43.7g)、三(2-苯基吡啶)铱(2.60g)、磷酸钾(84.9g)溶于有机溶剂二氯甲烷(0.8L)中,在25℃氮气氛围下435nm蓝光照射反应20小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-甲苯磺酰甲基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3a。产率:91%。以下是产物3a的核磁共振实验数据:
实施例五:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、环丙烷磺酰氯(42.2mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、醋酸钠(84.9mg)溶于有机溶剂二氯乙烷(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-(环丙基磺酰基)甲基-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3b。产率:77%。以下是产物3b的核磁共振实验数据:
实施例六:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、丙烷-2-磺酰氯(42.8mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg,0.4mol)溶于有机溶剂甲苯(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-(异丙基磺酰基)甲基-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3c。产率:51%。以下是产物3c的核磁共振实验数据:
实施例七:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(682mg)、哌啶-1-磺酰氯(521mg)、三(2-苯基吡啶)铱(26mg)、磷酸钾(849mg)溶于有机溶剂乙腈(10mL)中,在25℃氮气氛围下435nm蓝光照射反应19小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-(哌啶-1-基磺酰基)甲基)-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3d。产率:66%。以下是产物3d的核磁共振实验数据:
实施例八:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、噻吩-2-磺酰氯(50.1mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-(噻吩-3-基磺酰基)甲基)-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3e。产率:87%。以下是产物3e的核磁共振实验数据:
实施例九:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、苯并噻吩-2-磺酰氯(69.6mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品4-(苯并[b]噻吩-3-基磺酰基)甲基)-2-丁基-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3f。产率:77%。以下是产物3f的核磁共振实验数据:
实施例十:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、喹啉-8-磺酰氯(68.3mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-1-苯基-4-(喹啉-5-基磺酰基)甲基)-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3g。产率:63%。以下是产物3g的核磁共振实验数据:
实施例十一:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、(1S)-(+)-10-樟脑磺酰氯(75.3mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-(((1R,4S)-7,7-二甲基-2-氧代二环[2.2.1]庚烷-1-基)甲基)磺酰基)甲基)-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3h。产率:48%。以下是产物3h的核磁共振实验数据:
实施例十二:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、4-甲氧基苯磺酰氯(62.0mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-((4-甲氧基苯基)磺酰基)甲基)-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3i。产率:85%。以下是产物3i的核磁共振实验数据:
实施例十三:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、4-(叔丁基)苯磺酰氯(60.9mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg,0.4mol)溶于有机溶剂1,4-二氧六环(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-((4-叔丁基)苯基磺酰基)甲基)-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3j。产率:69%。以下是产物3j的核磁共振实验数据:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、4-溴苯磺酰氯(76.7mg)、三(2-苯基吡啶)铱(2.6mg)、磷酸钾(84.9mg)溶于有机溶剂乙腈(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品4-((4-溴苯基)磺酰基)甲基)-2-丁基-4-甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮1-氧化物3k。产率:72%。以下是产物3k的核磁共振实验数据:
实例十五:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、4-硝基苯磺酰氯(66.5mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、吡啶(70mg)溶于有机溶剂N,N-二甲基甲酰胺(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品2-丁基-4-甲基-4-((4-硝基苯基)磺酰基)甲基-1-苯基-4-氢苯并[c][1,2]氮杂膦-3(2H)-酮-1-氧化物3l。产率:82%。以下是产物3l的核磁共振实验数据:
实例十六:
在氮气氛围下将N-丁基-N-二苯基磷酰基甲基丙烯酰胺(68.2mg)、4-氰基苯磺酰氯(60.5mg)、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐(4.2mg)、醋酸钾(84.9mg)溶于有机溶剂1,4-二氧六环(1.0mL)中,在25℃氮气氛围下435nm蓝光照射反应16小时,反应过程中用TLC板监测至完全反应。后处理通过快速柱层析分离得纯净的产品4-(2-丁基-4-甲基-1-氧化-3-氧代-1-苯基-2,3,4-三氢苯并[c][1,2]氮杂膦-4-基)甲基磺酰基)苯甲腈3m。产率:84%。以下是产物3m的核磁共振实验数据:
实例十七:
本发明对目标化合物3a-3m开展了的针对鳞片状A549肺癌细胞株抗肿瘤活性的试验。具体方法如下:
通过本发明所述的方法得到的目标化合物3a-3m具有较好的抗肿瘤活性,能够对鳞片状A549肺癌细胞株产生积极的抑制作用,在治疗肿瘤方面具有潜在的广阔研究前景。
取对数生长期的鳞片状A549肺癌细胞株,以8000/孔的细胞数接种于96孔板(90μL/孔),培养24h后,以20μL/孔加入不同浓度的的目标化合物,分别培养12h、24h、和48h后,加入1.0mg/mL的溶液。继续培养4h后弃上层清,每孔加入100μLDMSO,震荡15min溶解,用酶标仪在570nm处检测OD值,按下列公式计算细胞抑制率,实验重复三次,细胞增值抑制率的计算方法如下式:
通过实验获得OD
表I含4-戊烯亚氨砜基脒系列化合物的生物活性测试结果
从上表中可以看到,通过本方法获得的4-氢苯并[1,2]氮杂膦-3-酮-1-氧化物对A549肺癌细胞表现出了良好的抑制活性,有望成为防治恶性肿瘤的途径之一。例如,化合物3b对于该细胞株的半抑制浓度(IC
- 一种制备1,2-二氢-(4H)-3,1-苯并恶嗪-4-酮化合物的方法
- 2-(4-(2-(1-异丙基-3-甲基-1H-1,2,4-三唑-5-基)-5,6-二氢苯并f咪唑并1,2-d1,4氧氮杂*-9-基)-1H-吡唑-1-基)-2-甲基丙酰胺的多晶型物、其制备方法和药物用途
- 制备N-(3-氨基氧杂环丁烷-3-基)甲基-2-(1, 1-二氧代-3, 5-二氢-1, 4-苯并硫杂氮杂环庚三烯-4-基)-6-甲基-喹唑啉-4-胺的方法
