吡咯并吡啶-苯胺化合物的制备方法
文献发布时间:2024-04-18 19:58:21
相关申请的交叉引用
本申请要求2021年1月21日提交的美国临时申请号63/139,981的优先权,该临时申请以其整体并入本文以用于所有目的。
联邦资助的研究和开发下的发明权利的声明
不适用
对通过光盘提交的“序列表”、表格或计算机程序列表附录的引用
不适用
背景技术
1型神经纤维瘤病(NF1)发生在大约1:3,500的新生儿中,并且是影响人类神经功能的最常见的常染色体显性单基因疾病之一。临床上,NF1疾病的特征是存在良性周围神经肿瘤(称为神经纤维瘤),涉及NF1基因双等位基因突变的雪旺细胞,以及其他肿瘤和非肿瘤临床表现。参见Jousma等人,Pediatr.Blood Cancer,62:1709-1716,2015。NF1与多种皮肤疾病相关,包括真皮神经纤维瘤;丛状神经纤维瘤;咖啡牛乳色斑;以及腋窝和腹股沟雀斑。超过95%的NF1患者会出现皮肤神经纤维瘤,并且可以出现在身体的任何部位,引起瘙痒、刺激、感染、身体疼痛和毁容。此外,真皮神经纤维瘤与社会孤立和焦虑有关。
NFl是由NF1中的一个或多个种系突变引起的,NF1是一种使RAS途径失活的基因。由于NF1基因编码Ras-GAP蛋白,NF1缺失导致Ras-GTP升高。因此,NF1研究主要集中于测试Ras信号通路中的抑制剂,包括Ras-MAPK级联。参见Jousma等人,Pediatr.Blood Cancer,62:1709-1716,2015。已鉴定出四种不同的MAPK级联,并根据其MAPK模块进行命名。参见Akinleye等人,“血液学与肿瘤学杂志”(Journal ofHematology&Oncology)》6:27,2013。MEK蛋白属于一个酶家族,位于四个MAP激酶信号通路中各自特定MAPK靶标的上游。其中两种MEK蛋白MEK1和MEK2密切相关并参与该信号通路级联。MEK1和MEK2抑制剂已被证明可以有效抑制Ras下游的MEK信号传导,从而为靶向MEK治疗NF1提供了强有力的理论依据。参见莱斯等人,“药物化学快报”(Medicinal Chemistry Letters)3:416-421,2012。
目前可用的MEK抑制剂设计为具有用于全身递送的口服生物利用度,并且与显着的副作用相关,包括左心室射血分数降低、肌酸磷酸激酶升高、肺炎、肾衰竭、腹泻、感染、荨麻疹和斑丘疹,所有这些副作用都是剂量限制的或需要永久停药。此外,临床试验显示长期大剂量施用MEK抑制剂会产生副作用。参见黄等人,“眼药理学与治疗学杂志”(J.Ocul.Pharmacol.Ther.),25:519-530,2009。例如,PD0325901,一种目前正在进行临床试验的MEK抑制剂,已表现出与共济失调、精神错乱和晕厥相关的神经副作用。此外,全身暴露于MEK抑制剂还观察到许多其他副作用,包括:痤疮样皮疹、CPK升高、恶心、呕吐、腹泻、腹痛和疲劳。因此,需要抑制MEK来治疗NF1相关的真皮神经纤维瘤的疗法,所述疗法限制这些严重的副作用。
血管、角质细胞和黑素细胞区室的良性皮肤肿瘤通常发生在出生时或儿童时期。这些病变在本申请中被称为“胎记”,可导致美观问题、毁容和社交焦虑。在某些情况下,这些病变会倾向于使个体出现功能障碍或未来罹患恶性肿瘤。这些胎记可能是零星的,也可能是潜在神经皮肤综合征的一部分。
血管胎记包括,例如鲜红斑痣/毛细血管畸形、血管瘤、小叶毛细血管瘤、动脉血管畸形、淋巴管畸形、血管畸形、血管瘤和其他血管瘤。角化细胞痣是指角化细胞表皮痣和皮脂腺痣。黑素细胞痣(通常称为痣)包括例如先天性痣、多发性雀斑(可能出现在例如LEOPARD等综合征中)、皮肤雀斑(ephiledes)(雀斑(freckles))和斑痣。
神经皮肤综合征,也称为胎记,例如鲜红斑痣,与皮肤中的先天性低流量血管畸形(毛细血管畸形)相关,如果不治疗,所述先天性低流量血管畸形会肥大并形成结节(Minkis,K.等人,“激光在外科和医学上的应用”(Lasers Surg Med.),(2009)41(6):第423-426页)。激光疗法通常用于治疗鲜红斑痣,但通常无法完全解决。表皮痣是常见的皮肤镶嵌式疾病,分为角质细胞痣和类器官痣。类器官痣包括皮脂腺痣(NS)。据报道,NS的免疫标记与磷酸化ERK染色的增加相关(Aslam,A等人,“临床和实验皮肤病学”(Clinical andExperimental Dermatology)(2014)39:第1-6页)。非类器官角化细胞性表皮痣(KEN)的特征是良性先天性色素沉着过度皮肤病变。具有局部表皮增厚的表皮痣在出生时就存在或在儿童时期变得可见。儿童胎记中也出现的其他皮肤疾病包括痣细胞痣、小叶毛细血管瘤、先天性痣、皮肤雀斑(ephiledes)(雀斑(freckles))、多发性雀斑(可能发生在包括LEOPARD综合征在内的多种综合征中)、毛细血管瘤、斑痣、动静脉畸形、淋巴管畸形和先天性黑素细胞痣。雀斑样痣可发生在儿童时期(如LEOPARD综合征等综合征),其具有可激活RAS/MAPK通路的突变,也可在成人中获得。在某些情况下,胎记不适合手术切除和/或激光治疗。在某些情况下,胎记如果未经治疗,可能会发展为病变和/或增殖性皮肤病。
ERK/MEK通路的调节可能对胎记具有治疗作用。据报道,镶嵌型RAS病中存在RAS突变,即非类器官KEN和皮脂腺痣(Farschtschi S等人,“BMC医学基因组学”(BMC MedicalGenetics),(2015);16:第6页;以及Sun,BK等人,“研究性皮肤病学杂志”(JournalofInvestigative Dermatology,(2013);3:第824-827页)。因此,抑制Ras信号通路(包括Ras-MAPK级联)可能有助于治疗胎记。
已经识别了四种不同的MAPK级联并根据它们的MAPK模块进行命名。参见Akinleye等人,“血液学与肿瘤学杂志”(Journal ofHematology&Oncology),6:27,2013。MEK蛋白属于一个酶家族,位于四个MAP激酶信号通路中各自特定MAPK靶标的上游。其中两种MEK蛋白MEK1和MEK2密切相关并参与该信号通路级联。MEK1和MEK2抑制剂显示可以有效抑制Ras下游的MEK信号传导(Rice等人,“药物化学快报”(Medicinal Chemistry Letters),3:416-421,2012),从而为靶向MEK治疗胎记提供了理论依据。
目前可用的MEK途径抑制剂被设计为具有用于全身递送的口服生物利用度,但与一种或多种显著副作用相关,包括左心室射血分数降低、肌酸磷酸激酶升高、肺炎、肾衰竭、腹泻、感染、荨麻疹和斑丘疹,所有这些副作用都是剂量限制的或需要永久停药。此外,临床试验已显示长期高剂量使用MEK抑制剂会产生一种或多种副作用。(黄等人,“眼科药理学与治疗学杂志”(J.Ocul.Pharmacol.Ther.)》,25:519-530,2009)。例如,PD0325901是一种经过临床测试的MEK抑制剂,已表现出一种或多种与共济失调、精神错乱和晕厥相关的神经副作用。此外,全身暴露于MEK抑制剂还观察到许多其他副作用,包括:痤疮样皮疹、CPK升高、恶心、呕吐、腹泻、腹痛和疲劳。因此,需要治疗胎记并限制与全身暴露于MEK/ERK通路抑制剂相关的一种或多种副作用的疗法。
式(I)的化合物首次作为MEK抑制剂在WO 2018/213810中公开,用于治疗皮肤疾病或与其相关的皮肤病症。如WO 2018/213810所述,通过式(II)所示化合物与5当量的2-(氨氧基)乙醇在THF中反应制备式(I)化合物或其盐:
所公开的反应需要大量过量的2-(氨氧基)乙醇,这对大规模生产去除提出了挑战。更重要的是,该反应对2-(氨氧基)乙醇原料中存在的杂质(例如乙二醇、某些溶剂残留物如DMSO、DMF等)非常敏感,因此需要满足严格的规格以确保作为活性成分(API)的式(I)化合物的成功制造。然而,市售的2-(氨氧基)乙醇材料纯度和杂质特征不一致,这反过来又会对最终产品作为活性成分(API)的质量产生严重影响。因此,仍然需要开发适合大规模制造式(I)化合物的改进方法。本发明解决了这一需求并且还提供了相关优点。
概述
第一方面,本发明提供了一种式(I)所示化合物或其盐的制备方法:
所述方法包括:
6a)将式(K)所示化合物或其盐:
与第一碱和甲硅烷基化剂在第一溶剂中接触以形成包含O-甲硅烷基保护的式(K)化合物的第一混合物;和
6b)将包含式(II)所示化合物或其盐的第二混合物:
添加至步骤6a)的第一混合物中以形成式(I)所示化合物。
第二方面,本发明提供了一种式(I)所示化合物或其盐的制备方法:
所述方法包括:
3)在甲苯中用叔丁醇钠将式(VI)所示化合物或其盐:
转化为式(V)所示化合物或其盐:
4a)将所述式(V)所示化合物或其盐与六氯乙烷和双(三甲基硅烷基)氨基锂(LiHMDS)在THF中接触以形成式(IVa)所示化合物或其盐:
4b)将式(L)所示苯胺:
添加至包含式(IVa)所示化合物或其盐的步骤4a)的反应混合物中以形成式(III)所示化合物或其盐:
5)将式(III)所示化合物或其盐与亚硫酰氯和氯化氢在1,4-二恶烷中接触以形成式(II)所示化合物的HCl盐:
6a)将式(K)所示化合物或式(K-1)所示的其对甲苯磺酸盐:
与4-甲基吗啉和三甲基氯硅烷(TMSCl)在四氢呋喃(THF)或甲基叔丁基醚(MTBE)中接触以形成第一混合物;和
6b)将包含式(II)的HCl盐和四氢呋喃(THF)或甲基叔丁基醚(MTBE)的第二混合物添加至步骤6a)的第一混合物中以形成式(I)所示化合物或其盐。
第三方面,本发明提供了一种式(K)所示化合物或其盐的制备方法:
所述方法包括:
7)将下式所示的2-羟基异吲哚啉-1,3-二酮:
与2-溴乙醇和非亲核碱在非质子溶剂中接触以形成式(J)所示的2-(2-羟基乙氧基)异吲哚啉-1,3-二酮:
8a)在醇溶剂中利用氨处理2-(2-羟基乙氧基)异吲哚啉-1,3-二酮以提供式(K)所示的化合物;和
8b)任选将式(K)所示化合物转化成盐。
第四方面,本发明提供了一种式(XI)所示的MEK抑制剂或其盐的制备方法:
所述方法包括:
a)将H
b)将第一混合物与式(XII)所示化合物或其盐反应:
以形成式(XI)所示化合物,
其中:
A环是C
R
第五方面,本发明提供了一种式(XI)所示的MEK抑制剂或其盐的制备方法:
所述方法包括:
a)将H
b)将第一混合物与式(XIII)所示化合物或其盐:
反应以形成式(XI)所示化合物,
其中:
A环是C
R
第六方面,本发明提供了一种式(X)所示化合物:
附图简述
图1示出了制备式(I)化合物的实施方式之一。
图2示出了制备2-(氨氧基)乙醇(即,式(K)和/或2-(氨氧基)乙醇的对甲苯磺酸盐(即式(K-1))的实施方式之一。
图3显示了经由步骤4-6制备式(I)化合物的选定实施方式。
发明详述
I.通用
本发明提供了通过两个步骤由式(II)化合物制备式(I)化合物的方法:6a)使2-(氨氧基)乙醇(即式(K))或其盐(例如,式(K-1))与碱和甲硅烷基化剂接触以形成包含O-甲硅烷基保护的式(K)化合物的第一混合物;6b)将包含式(II)化合物或其盐的第二混合物添加至步骤6a)的第一混合物中以形成式(I)表示的化合物。相对于式(II)化合物,本发明方法仅使用小于1.5当量的2-(氨氧基)乙醇或其盐,因此减少了在大规模生产中除去过量2-(氨氧基)乙醇的负担。本方法以约5公斤的大生产规模提供作为活性成分(API)的式(I)化合物,其纯度和杂质特征满足药物开发的要求。
为了具有一致的2-(氨氧基)乙醇的纯度和/或杂质特征,本发明还提供了用于制备2-(氨氧基)乙醇或其盐、特别是其对甲苯磺酸盐的方法。令人惊奇的是,当在步骤6a)中使用2-(氨氧基)乙醇的对甲苯磺酸盐(即,式(K-1))时,式(II)化合物向式(I)化合物的转化出乎意料地顺利进行。结果,可以高纯度地分离式(I)化合物,HPLC或UPLC方法(测定)>95面积%。
II.定义
“烷基”是指具有所示碳原子数的直链或支链饱和脂族基团(即,C
“亚烷基”是指具有所示碳原子数的直链或支链饱和脂族基团(即,C
“烯基”是指具有至少2个碳原子和至少一个双键并具有所示碳原子数的直链或支链烃(即,C
“炔基”是指具有至少2个碳原子和至少一个三键并具有所示碳原子数的直链或支链烃(即,C
“卤素”是指氟、氯、溴和碘。
“烷氧基”是指具有将烷基连接至连接点的氧原子的烷基:烷基-O-。烷氧基可具有任何合适数量的碳原子,例如C
“芳基”是指具有任何合适数量的环原子和任何合适数量的环的芳香环系统。芳基可包括任何合适数量的环原子,例如6、7、8、9、10、11、12、13、14、15或16个环原子,以及6至10、6至12或6至14个环成员。芳基可以是单环、稠合形成双环或三环基团、或通过键连接形成联芳基。代表性的芳基包括苯基、萘基和联苯基。其他芳基包括具有亚甲基连接基团的苄基。一些芳基具有6至12个环成员,例如苯基、萘基或联苯基。其他芳基具有6至10个环成员,例如苯基或萘基。其他一些芳基有6个环成员,例如苯基。芳基可以是取代的或未取代的。
“杂芳基”是指含有5至16个环原子的单环或稠合双环或三环芳族环集合,其中1至5个环原子是杂原子,例如N、O或S。杂原子还可以被氧化,例如但不限于-S(O)-和-S(O)
杂芳基可以通过环上的任意位置连接。例如,吡咯包括1-、2-和3-吡咯,吡啶包括2-、3-和4-吡啶,咪唑包括1-、2-、4-和5-咪唑,吡唑包括1-、3-、4-和5-吡唑,三唑包括1-、4-和5-三唑,四唑包括1-和5-四唑,嘧啶包括2-、4-、5-和6-嘧啶,哒嗪包括3-和4-哒嗪,1,2,3-三嗪包括4-和5-三嗪,1,2,4-三嗪包括3-、5-和6-三嗪,1,3,5-三嗪包括2-三嗪,噻吩包括2-和3-噻吩,呋喃包括2-和-3-呋喃,噻唑包括2-、4-和5-噻唑,异噻唑包括3-、4-和-5-异噻唑,恶唑包括2-、-4-和5-恶唑,异恶唑包括3-、4-和-5-异恶唑,吲哚包括1-、2-和3-吲哚,异吲哚包括1-和2-异吲哚,喹啉包括2-、3-和4-喹啉,异喹啉包括1-、3-和-4-异喹啉,喹唑啉包括2-和4-喹唑啉,噌啉包括3-和4-噌啉,苯并噻吩包括2-和3-苯并噻吩,苯并呋喃包括2-和-3-苯并呋喃。
一些杂芳基包括具有5至10个环成员和1至3个包括N、O或S的环原子的杂芳基,例如吡咯、吡啶、咪唑、吡唑、三唑、吡嗪、嘧啶、哒嗪、三嗪(1,2,3-、1,2,4-和1,3,5-异构体)、噻吩、呋喃、噻唑、异噻唑、恶唑、异恶唑、吲哚、异吲哚、喹啉、异喹啉、喹喔啉、喹唑啉、酞嗪、噌啉、苯并噻吩和苯并呋喃。其他杂芳基包括具有5至8个环成员和1至3个杂原子的杂芳基,例如吡咯、吡啶、咪唑、吡唑、三唑、吡嗪、嘧啶、哒嗪、三嗪(1,2,3-、1,2,4-和1,3,5-异构体)、噻吩、呋喃、噻唑、异噻唑、恶唑和异恶唑。一些其它杂芳基包括具有9至12个环成员和1至3个杂原子的杂芳基,例如吲哚、异吲哚、喹啉、异喹啉、喹喔啉、喹唑啉、酞嗪、噌啉、苯并噻吩、苯并呋喃和联吡啶。其他杂芳基包括具有5至6个环成员和1至2个包括N、O或S的环原子的杂芳基,例如吡咯、吡啶、咪唑、吡唑、吡嗪、嘧啶、哒嗪、噻吩、呋喃、噻唑、异噻唑、恶唑和异恶唑。
一些杂芳基包括5至10个环成员且仅含氮杂原子,例如吡咯、吡啶、咪唑、吡唑、三唑、吡嗪、嘧啶、哒嗪、三嗪(1,2,3-、1,2,4-和1,3,5-异构体)、吲哚、异吲哚、喹啉、异喹啉、喹喔啉、喹唑啉、酞嗪和噌啉。其他杂芳基包括5至10个环成员并且仅包含氧杂原子,例如呋喃和苯并呋喃。一些其他杂芳基包括5至10个环成员并且仅包含硫杂原子,例如噻吩和苯并噻吩。其他杂芳基还包括5至10个环成员和至少两个杂原子,例如咪唑、吡唑、三唑、吡嗪、嘧啶、哒嗪、三嗪(1,2,3-、1,2,4-和1,3,5-异构体)、噻唑、异噻唑、恶唑、异恶唑、喹喔啉、喹唑啉、酞嗪和噌啉。
“甲硅烷基化剂”是指能够在分子中引入甲硅烷基(R
“碱”是指使水去质子化以产生氢氧根离子的官能团。可用于本发明的碱包括有机碱和无机碱。示例性的有机碱包括胺、碱金属羧酸盐、碱金属醇盐、金属酰胺和烷基或烯基金属化合物,如本文所定义。示例性的无机碱包括碱金属碳酸氢盐、碱金属碳酸盐、碱金属磷酸三盐、碱金属磷酸二盐、碱金属氢氧化物和碱金属氢化物,如本文所定义。可在本发明中用作碱的胺包括叔胺、芳香胺碱和脒基(amidine-based)化合物,如本文所定义。
“第一碱”、“第二碱”等是指如上文所定义且在本发明的实施方式中所描述的碱。基本命名规范仅出于清楚的目的而用于本文所述的方法的相关步骤,并且它们不要求按数字顺序。如本文所述的本发明的选定实施例中可以不存在一些碱。本领域技术人员将在本文的实施方式和权利要求中使用术语的上下文中理解这些碱命名规范(“第一碱”、“第二碱”)的含义。
“非亲核碱”是指空间位阻的有机碱,所述有机碱是弱亲核体。非亲核碱的非限制性实例包括本文定义的叔胺和基于脒的化合物。
“叔胺”是指具有式N(R)
“芳族胺碱”是指含N的5-至10-元杂芳基化合物或具有式N(R)
本文的“基于脒的化合物”是指包括但不限于1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)和1,5-二氮杂双环[4.3.0]九碳-5-烯(DBN)的一类化学化合物。
“碱金属羧酸盐”是指由碱金属阳离子或鏻和羧酸根阴离子(RC(O)O
“碱金属碳酸氢盐”是指由碱金属阳离子和碳酸氢根阴离子(HCO
“碱金属碳酸盐”是指由碱金属阳离子和碳酸根阴离子(CO
“碱金属磷酸三盐”是指由碱金属阳离子和磷酸根阴离子(PO
“碱金属磷酸二盐”是指由碱金属阳离子和磷酸氢盐阴离子(HPO
“碱金属氢氧化物”是指由碱金属阳离子和氢氧根阴离子(OH
“碱金属醇盐”是指由碱金属阳离子和醇盐阴离子(RO
“金属氨化物”是指由金属中心与-NR
“烷基-和烯基金属化合物”是指由与烷基或烯基键合的金属中心组成的一类化合物。可用于本发明的烷基和烯基金属化合物包括但不限于正丁基锂、异丙基氯化镁、三正丁基镁酸锂、二正丁基镁、二仲丁基镁和乙基正丁基镁。
“碱金属氢化物”是指由碱金属阳离子和氢化物阴离子(H
“溶剂”是指能够溶解溶质的物质,例如液体。溶剂可以是极性或非极性的、质子或非质子的。极性溶剂通常具有大于约5的介电常数或高于约1.0的偶极矩,非极性溶剂具有低于约5的介电常数或低于约1.0的偶极矩。质子溶剂的特征在于具有可被去除的质子,例如具有羟基或羧基。非质子溶剂缺乏此类基团。代表性的极性质子溶剂包括醇(甲醇、乙醇、丙醇、异丙醇等)、酸(甲酸、乙酸等)和水。代表性的极性非质子溶剂包括二氯甲烷、氯仿、四氢呋喃、甲基四氢呋喃、乙醚、1,4-二恶烷、丙酮、乙酸乙酯、二甲基甲酰胺、乙腈、二甲亚砜和N-甲基吡咯烷酮。代表性的非极性溶剂包括烷烃(戊烷、己烷等)、环烷烃(环戊烷、环己烷等)、苯和甲苯。其他溶剂可用于本发明。
“非质子溶剂”是指缺乏酸性氢的溶剂。因此,它们不是氢键供体。非质子溶剂的共同特点是溶剂可以接受氢键、溶剂不具有酸性氢、溶剂溶解盐。非质子溶剂的实例包括但不限于N-甲基吡咯烷酮(NMP)、四氢呋喃(THF)、2-甲基四氢呋喃(MeTHF)、乙酸乙酯(EtOAc)、丙酮、二甲基甲酰胺(DMF)、乙腈(MeCN)、二甲亚砜(DMSO)、碳酸丙烯酯(PC)和六甲基磷酰胺(HMPA)。
“第一溶剂”、“第二溶剂”等是指如上文所定义且在本发明的实施方式中所描述的溶剂。溶剂命名规范仅用于本文所述的方法步骤中的清晰目的,并且它们不要求按数字顺序。如本文所述的本发明的选定实施方式中可以不存在一些溶剂。本领域技术人员将理解这些溶剂命名规范(例如,“第一溶剂”、“第二溶剂”)在本文的实施方式和权利要求中使用该术语的上下文中的含义。
“氯化剂”是指能够将氯基团-Cl添加至化合物的试剂。代表性的氯化剂包括但不限于三氯氧化磷、亚硫酰氯、草酰氯和硫酰氯。
“第一氯化剂”和“第二氯化剂”是指如上文所定义且在本发明的实施方式中描述的氯化剂。氯化剂命名规范仅用于本文所述的方法步骤中的清楚目的,并且它们不要求按数字顺序。本领域技术人员将理解这些氯化剂命名规范(例如,“第一氯化剂”、“第二氯化剂”)在本文的实施方式和权利要求中使用该术语的上下文中的含义。
为了清楚起见,下表总结了相应方法步骤3)至6)中使用的溶剂、碱和氯化剂命名规范:
“碘化剂”是指能够将碘基团-I添加至化合物的试剂。代表性的碘化剂包括但不限于碘和N-碘-双(三甲基甲硅烷基)酰胺。
“保护基团”是指使官能团对一组特定的反应条件不反应的化合物,但所述化合物随后可在后续的合成步骤中除去以使官能团恢复至其原始状态。此类保护基团是本领域普通技术人员众所周知的,并且公开于“《有机合成中的保护基团》(Protective Groups inOrganic Synthesis)”,第4版,T.W.Greene和P.G.M.Wuts,约翰·威利父子公司(JohnWiley&Sons),纽约,2006年,其全部内容通过引用并入本文。
“接触”是指使至少两种不同的物质接触以使它们能够反应的过程。然而,应当理解,所得的反应产物可以直接由所添加的试剂之间的反应产生,或者由可在反应混合物中产生的一种或多种所添加的试剂的中间体产生。
“脱保护”是指使用一种或多种化学物质或试剂除去如上所定义的保护基团(例如,甲硅烷基基团),使得官能团(-OH基团)恢复至其原始状态。
“粗品”是指包含所需化合物(例如,式(I)的化合物)和至少一种其他物质(例如,溶剂、试剂(例如,酸或碱)、起始原料、或产生所需化合物的反应的副产物)的混合物。
除非另有具体说明,“纯度%”或“纯度面积%”(例如,95%或95面积%)是指通过HPLC或UPLC方法(例如,如本文所述的化学开发HPLC方法或UPLC方法)测定的化合物(例如,式(I)的化合物)在曲线下面积(AUC)中的纯度。
“盐”是指本发明的方法中使用的化合物的酸式盐或碱式盐。可用于本发明的盐包括但不限于磷酸盐、硫酸盐、氯化物、溴化物、碳酸盐、硝酸盐、乙酸盐、甲磺酸盐、钠盐、钾盐和钙盐。药学上可接受的盐的示例性实例是无机酸(盐酸、氢溴酸、磷酸等)盐、有机酸(乙酸、丙酸、谷氨酸、柠檬酸等)盐、季铵(碘甲烷、碘乙烷等)盐和碱金属或碱土金属盐(钠、钾、钙等)。应当理解,药学上可接受的盐是无毒的。关于合适的药学上可接受的盐的附加信息可参见《雷明顿药物科学(Remington's Pharmaceutical Sciences)》,第17版,马克出版公司(Mack Publishing Company),宾夕法尼亚州伊斯顿市,1985年,其通过引用并入本文。
“约”是指包括指定值的数值范围,本领域普通技术人员会认为该范围与指定值相当相似。在一些实施方式中,术语“约”意指在使用本领域通常可接受的测量的标准偏差内。在一些实施方式中,约是指延伸至指定值的+/-10%的范围。在一些实施方式中,约是指指定值。
当本文中的“一个/一种”用于指一组取代基或“取代基组”时,意指至少一个。例如,当化合物被“一个”烷基或芳基取代时,该化合物任选地被至少一个烷基和/或至少一个芳基取代,其中每个烷基和/或芳基任选地不同。在另一实例中,当化合物被“一个”取代基取代时,该化合物被至少一个取代基取代,其中每个取代基任选地不同。
III.式(I)化合物的制备方法
第一方面,本发明提供了一种式(I)所示化合物或其盐的制备方法:
所述方法包括:
6a)将式(K)所示化合物或其盐:
与第一碱和甲硅烷基化剂在第一溶剂中接触以形成包含O-甲硅烷基保护的式(K)化合物的第一混合物;和
6b)将包含式(II)所示化合物或其盐的第二混合物:
添加至步骤6a)的第一混合物中以形成式(I)所示化合物。
A.步骤6
式(K)化合物可以是中性形式或盐形式。在一些实施方式中,式(K)化合物为中性形式。在一些实施方式中,式(K)化合物是其盐。在一些实施方式中,式(K)化合物是其HCl、硫酸盐、半硫酸盐或对甲苯磺酸盐。在一些实施方式中,式(K)化合物为式(K-1)所示的其对甲苯磺酸盐:
相对于式(II)化合物,式(K)化合物或其盐可以过量。在一些实施方式中,相对于式(II)化合物,式(K)化合物或其盐的量为约1.1至约5当量、约1.1至约4当量、约1.1至约3当量、约1.1至约2当量、或约1.1至约1.5当量。在一些实施方式中,相对于式(II)化合物,式(K)化合物或其盐的量为约1.1至约1.5当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.1至约3当量、约1.1至约2当量、或约1.1至约1.5当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.1至约1.5当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.25当量。
甲硅烷基化剂可以是任意三烷基甲硅烷基化剂。在一些实施方式中,甲硅烷基化剂是三烷基甲硅烷基化剂。在一些实施方式中,甲硅烷基化剂是三乙基甲硅烷基化剂或三甲基甲硅烷基化剂。在一些实施方式中,甲硅烷基化剂是三甲基氯硅烷(TMSCl)。
相对于如上所述的式(K)化合物或其盐,甲硅烷基化剂可以等量或过量。在一些实施方式中,相对于式(II)化合物,甲硅烷基化剂的量为约1.2至约5.5当量、约1.2至约4.4当量、约1.2至约3.3当量、约1.2至约2.2当量、约1.2至约2.0当量、或约1.2至约1.6当量。在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约3.3当量、约1.2至约2.2当量、约1.2至约2.0当量、或约1.2至约1.6当量。在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约2.0当量。在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约1.6当量。在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.35当量。在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.7当量。
第一碱可以是有机碱或无机碱,如本文所定义。在一些实施方式中,第一碱是有机碱。在一些实施方式中,第一种碱是叔胺。在一些实施方式中,三胺是三甲胺、三正丁基胺、N,N-二异丙基乙胺、N-甲基吡咯烷、N-甲基吗啉(也称为4-甲基吗啉)、二甲基苯胺、二乙基苯胺、1,8-双(二甲基氨基)萘、奎宁环、1,4-二氮杂二环[2.2.2]辛烷(DABCO)或其组合。在一些实施方式中,叔胺是三乙胺、N,N-二异丙基乙胺或4-甲基吗啉。在一些实施方式中,叔胺是三乙胺。在一些实施方式中,叔胺是N,N-二异丙基乙胺。在一些实施方式中,叔胺是4-甲基吗啉。在一些实施方式中,第一碱是三乙胺、N,N-二异丙基乙胺或4-甲基吗啉。在一些实施方式中,第一碱是三甲胺。在一些实施方式中,第一碱是N,N-二异丙基乙胺。在一些实施方式中,第一碱是4-甲基吗啉。
相对于式(II)化合物和/或相对于式(K)化合物或其盐,第一碱可以过量。当式(K)化合物为盐形式时,需要额外量的第一碱来中和式(K)化合物的盐。
当式(K)化合物呈中性形式时,在一些实施方式中,相对于式(II)化合物,第一碱的量为约2至约5当量、约2至约4当量、约3至约5当量或约3至约4当量。在一些实施方式中,相对于式(II)化合物,第一碱的量为约3至约5当量。在一些实施方式中,相对于式(II)化合物,第一碱的量为约3至约4当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约2至约5当量、约2至约4当量、约3至约5当量、或约3至约4当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约3至约5当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约3至约4当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约3.4当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约2至约5当量、约2至约4当量、约3至约5当量、或约3至约4当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约3至约5当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约3至约4当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约3.4当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约2至约5当量、约2至约4当量、约3至约5当量、或约3至约4当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约3至约5当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约3至约4当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约3.4当量。
当式(K)化合物为中性形式时,在一些实施方式中,相对于式(K)化合物,第一碱的量为约2至约3当量。在一些实施方式中,相对于式(K)化合物,三乙胺的量为约2至约3当量。在一些实施方式中,相对于式(K)化合物,三乙胺的量为约2.7当量。在一些实施方式中,相对于式(K)化合物,N,N-二异丙基乙胺的量为约2至约3当量。在一些实施方式中,相对于式(K)化合物,N,N-二异丙基乙胺的量为约2.7当量。在一些实施方式中,相对于式(K)化合物,4-甲基吗啉的量为约2至约3当量。在一些实施方式中,相对于式(K)化合物,4-甲基吗啉的量为约2.7当量。
当式(K)化合物呈盐形式时,在一些实施方式中,相对于式(II)化合物,第一碱的量为约3至约6当量、约3至约5当量、约4至约6当量或约4至约5当量。在一些实施方式中,相对于式(II)化合物,第一碱的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,第一碱的量为约4至约5当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约3至约6当量、约3至约5当量、约4至约6当量、或约4至约5当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约4至约5当量。在一些实施方式中,相对于式(II)化合物,三乙胺的量为约4.4当量。在一些实施方式中,相对于式(II)的化合物,N,N-二异丙基乙胺的量为约3至约6当量、约3至约5当量、约4至约6当量、或约4至约5当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约4至约5当量。在一些实施方式中,相对于式(II)化合物,N,N-二异丙基乙胺的量为约4.4当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约3至约6当量、约3至约5当量、约4至约6当量、或约4至约5当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约4至约5当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约4.4当量。在一些实施方式中,相对于式(II)化合物,4-甲基吗啉的量为约5.5当量。
当式(K)化合物呈盐形式时,在一些实施方式中,相对于式(K)化合物的盐,第一碱的量为约3至约5当量。在一些实施方式中,相对于式(K)化合物的盐,三乙胺的量为约3至约5当量。在一些实施方式中,相对于式(K)化合物的盐,三乙胺的量为约3.5当量。在一些实施方式中,相对于式(K)化合物的盐,N,N-二异丙基乙胺的量为约3至约5当量。在一些实施方式中,相对于式(K)化合物的盐,N,N-二异丙基乙胺的量为约3.5当量。在一些实施方式中,相对于式(K)化合物的盐,4-甲基吗啉的量为约3至约5当量。在一些实施方式中,相对于式(K)化合物的盐,4-甲基吗啉的量为约3.5当量。在一些实施方式中,相对于式(K)化合物的盐,4-甲基吗啉的量为约4.5当量。在一些实施方式中,式(K)化合物的盐为式(K-1)所示的对甲苯磺酸盐。
在一些实施方式中,相对于式(II)化合物,式(K)化合物或其盐的量为约1.1至约1.5当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约2.0当量;当式(K)化合物呈中性形式时,相对于式(II)化合物,4-甲基吗啉的量为约3至约5当量;或当式(K)化合物呈盐形式时,相对于式(II)化合物,4-甲基吗啉的量为约4至约6当量。当式(K)化合物为中性形式时,在一些实施方式中,相对于式(II)化合物,式(K)化合物的量为约1.1至约1.5当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约2.0当量;相对于式(II)化合物,4-甲基吗啉的量为约3至约5当量。当式(K)化合物为中性形式时,在一些实施方式中,相对于式(II)化合物,式(K)化合物的量为约1.25当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.35当量;相对于式(II)化合物,4-甲基吗啉的量为约3.4当量。当式(K)化合物呈盐形式时,在一些实施方式中,相对于式(II)化合物,式(K)化合物的盐的量为约1.1至约1.5当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约2.0当量;相对于式(II)化合物,4-甲基吗啉的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.1至约1.5当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.2至约2.0当量;相对于式(II)化合物,4-甲基吗啉的量为约4至约6当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.25当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.35当量;和相对于式(II)化合物,4-甲基吗啉的量为约4.4当量。在一些实施方式中,相对于式(II)化合物,式(K-1)化合物的量为约1.25当量;相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.7当量;和相对于式(II)化合物,4-甲基吗啉的量为约5.5当量。
步骤6a)中的第一溶剂可以是本文所定义的非质子溶剂。在一些实施方式中,第一溶剂是四氢呋喃(THF)、2-甲基四氢呋喃(2-MeTHF)、乙腈(ACN)、二氯甲烷(DCM)、甲基叔丁基醚(MTBE)、庚烷、乙酸异丙酯(IPAc)或其组合。在一些实施方式中,第一溶剂是四氢呋喃(THF)、2-甲基四氢呋喃(2-MeTHF)、甲基叔丁基醚(MTBE)或其组合。在一些实施方式中,第一溶剂包括四氢呋喃(THF)。在一些实施方式中,第一溶剂是四氢呋喃(THF)。在一些实施方式中,第一溶剂包括甲基叔丁基醚(MTBE)。在一些实施方式中,第一溶剂是甲基叔丁基醚(MTBE)。
在步骤6a)中,在接触甲硅烷基化剂之前,式(K)化合物或(K-1)化合物可以首先与第一溶剂中的第一碱接触,其中第一溶剂和碱各自如本文所定义和描述。在一些实施方式中,在接触甲硅烷基化剂之前,首先使式(K)化合物或(K-1)化合物与第一溶剂中的第一碱接触。在一些实施方式中,在接触甲硅烷基化剂之前,首先使式(K)化合物或(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触。在一些实施方式中,在接触甲硅烷基化剂之前,首先使式(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触。在一些实施方式中,在接触甲硅烷基化剂之前,首先使式(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触以形成包含沉淀物的混合物,所述沉淀物包含4-甲基吗啉的对甲苯磺酸盐。在一些实施方式中,在接触甲硅烷基化剂之前过滤包含4-甲基吗啉的对甲苯磺酸盐的沉淀物。
在步骤6a)中,中性形式的式(K)化合物可以为包含第一溶剂和第一碱的溶液,其中所述溶液可以通过式(K)化合物的盐(例如式(K-1)化合物)与第一碱在第一溶剂中接触来制备;第一溶剂和碱各自在本文中定义和描述。在一些实施方式中,中性形式的式(K)化合物是包含4-甲基吗啉和甲基叔丁基醚(MTBE)的溶液,其通过使式(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触,然后过滤包含4-甲基吗啉的对甲苯磺酸盐的沉淀物来制备。
在一些实施方式中,第一混合物中的O-甲硅烷基保护的式(K)化合物如下式所示:
在一些实施方式中,第一混合物包含由下式表示的O-甲硅烷基保护的式(K)化合物:
步骤6a)的第一混合物可以分开形成或原位形成。在一些实施方式中,步骤6a)的第一混合物原位形成。在一些实施方式中,步骤6a)的第一混合物原位形成并直接用于步骤6b)。
包含式(II)化合物或其盐的第二混合物还可包含第二溶剂。在一些实施方式中,第二混合物还包含第二溶剂。
第二溶剂可以是如本文定义的非质子溶剂。在一些实施方式中,第二溶剂是四氢呋喃(THF)、2-甲基四氢呋喃(2-MeTHF)、乙腈(ACN)、二氯甲烷(DCM)、甲基叔丁基醚(MTBE)、庚烷、乙酸异丙酯(IPAc)或其组合。在一些实施方式中,第二溶剂是四氢呋喃(THF)、2-甲基四氢呋喃(2-MeTHF)、甲基叔丁基醚(MTBE)、庚烷、乙酸异丙酯(IPAc)或其组合。在一些实施方式中,第二溶剂包括四氢呋喃(THF)。在一些实施方式中,第二溶剂是四氢呋喃(THF)。在一些实施方式中,第二溶剂是甲基叔丁基醚(MTBE)、庚烷或乙酸异丙酯(IPAc)。在一些实施方式中,第二溶剂包括甲基叔丁基醚(MTBE)。在一些实施方式中,第二溶剂是甲基叔丁基醚(MTBE)。
式(II)化合物可以是盐形式。在一些实施方式中,式(II)化合物是其HCl盐。
在一些实施方式中,第二混合物包含式(II)的HCl盐。在一些实施方式中,第二混合物包含式(II)的HCl盐和四氢呋喃(THF)。在一些实施方式中,第二混合物包含式(II)的HCl盐和甲基叔丁基醚(MTBE)。在一些实施方式中,第二混合物是包含式(II)的HCl盐的悬浮液。在一些实施方式中,第二混合物是包含式(II)的HCl盐和四氢呋喃(THF)的悬浮液。在一些实施方式中,第二混合物是包含式(II)的HCl盐和甲基叔丁基醚(MTBE)的悬浮液。
第二混合物可以在一段时间内(例如,0.5至2小时)缓慢添加,使得步骤6b)的反应混合物维持在不超过约10℃的温度。在一些实施方式中,在约0.5至约2小时的时间内缓慢添加第二混合物。在一些实施方式中,在步骤6b)中,在一段时间内缓慢添加第二混合物,同时保持温度不超过约10℃。在一些实施方式中,在步骤6b)中,在约0.5至约2小时的时间内缓慢添加第二混合物,同时维持不超过约10℃的温度。在一些实施方式中,在步骤6b)中,在一段时间内缓慢添加包含式(II)的HCl盐和四氢呋喃(THF)的第二混合物,同时保持温度不超过约10℃。在一些实施方式中,在步骤6b)中,在约0.5至约2小时的时间内缓慢添加包含式(II)的HCl盐和四氢呋喃(THF)的第二混合物,同时维持不超过约10℃的温度。在一些实施方式中,在步骤6b)中,在一段时间内缓慢添加包含式(II)的HCl盐和甲基叔丁基醚(MTBE)的第二混合物,同时保持温度不超过约10℃。在一些实施方式中,在步骤6b)中,在约0.5至约2小时的时间内缓慢添加包含式(II)的HCl盐和甲基叔丁基醚(MTBE)的第二混合物,同时保持温度不超过约10℃。
一般而言,步骤6a)和6b)可以在任何合适的温度下进行。在一些实施方式中,步骤6a)和6b)各自在不超过约10℃的温度下进行。在一些实施方式中,步骤6a)和6b)各自在约-5℃至约10℃或约-5℃至约5℃的温度下进行。在一些实施方式中,步骤6a)和6b)各自在约-5℃至约10℃的温度下进行。在一些实施方式中,步骤6a)和6b)各自在约0℃至约10℃的温度下进行。在一些实施方式中,步骤6a)和6b)各自在约-5℃至约5℃的温度下进行。
式(I)化合物可以通过各种方法(例如,溶剂交换、沉淀和/或重结晶)分离。在一些实施方式中,通过包括以下的步骤分离式(I)化合物:6c)溶剂交换;6d)沉淀。在一些实施方式中,步骤6c)包括用乙醇对步骤6b)的反应混合物进行溶剂交换。在一些实施方式中,步骤6d)包括从包含乙醇和水的混合物中沉淀式(I)化合物。可以在步骤6c)之前和/或步骤6d)之后进行活性炭处理。在一些实施方式中,在步骤6c)之前首先用活性炭处理反应混合物。在一些实施方式中,将来自步骤6d)的包含式(I)化合物的沉淀物重新溶解在溶剂中,然后用活性炭处理所得溶液。
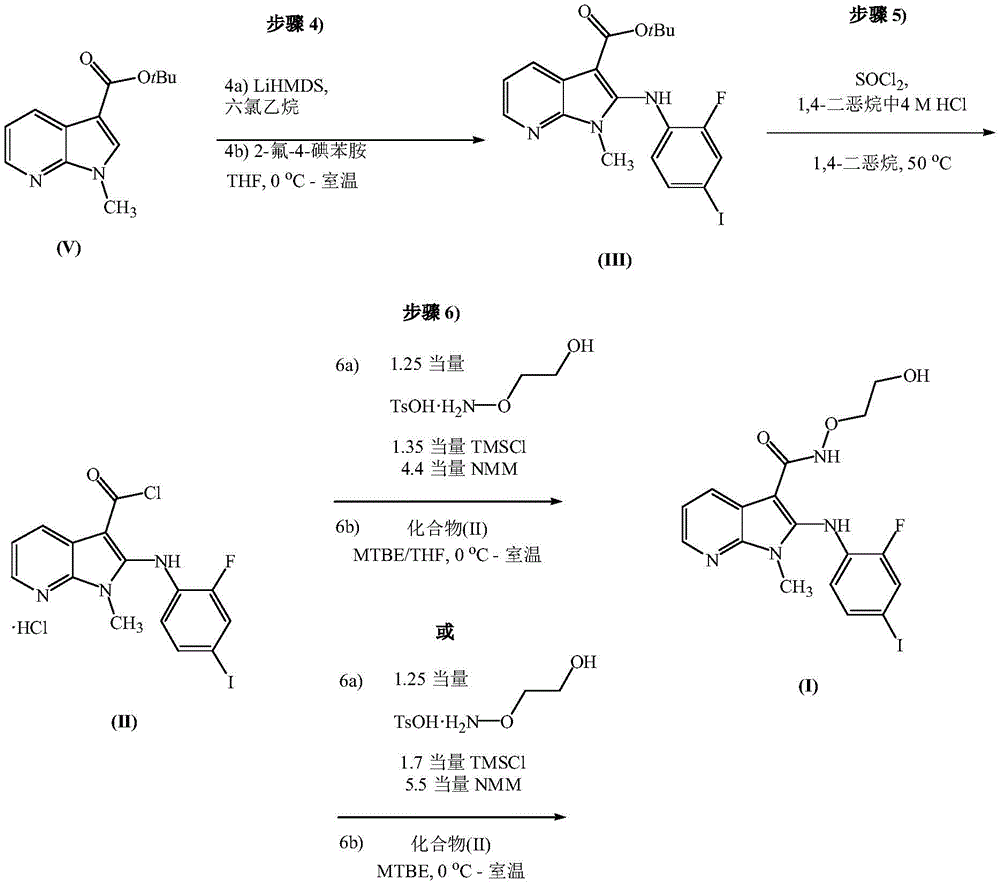
B.步骤5
在一些实施方式中,该方法在步骤6a)之前还包括:
5)将式(III)所示化合物或其盐:
与第一氯化剂和氯化氢在第三溶剂中接触以形成式(II)所示化合物的HCl盐:
第一氯化剂可以是能够将式(III)化合物中的-C(O)O
相对于式(III)化合物,第一氯化剂可以过量。在一些实施方式中,相对于式(III)化合物,第一氯化剂过量至少5当量。在一些实施方式中,相对于式(III)化合物,第一氯化剂的量为约10当量。在一些实施方式中,第一氯化剂是亚硫酰氯,相对于式(III)化合物,亚硫酰氯的量为约10当量。
步骤5)中的第三溶剂可以是本文所定义的非质子溶剂。在一些实施方式中,第三溶剂是醚。在一些实施方式中,第三溶剂包括1,4-二恶烷。
氯化氢(HCl)可以是在第三溶剂中的溶液。在一些实施方式中,氯化氢是在1,4-二恶烷中的溶液。在一些实施方式中,氯化氢是浓度为约4M的1,4-二恶烷溶液。
相对于式(III)化合物,氯化氢(HCl)可以过量。在一些实施方式中,相对于式(III)化合物,氯化氢的量为约5至约6当量。在一些实施方式中,相对于式(III)化合物,氯化氢的量为约6当量。
在一些实施方式中,氯化氢是浓度为约4M的1,4-二恶烷溶液;相对于式(III)化合物,氯化氢的量为约5至约6当量。在一些实施方式中,氯化氢是浓度为约4M的1,4-二恶烷溶液;相对于式(III)化合物,氯化氢的量为约6当量。
一般而言,步骤5)可以在任何合适的温度下进行。在一些实施方式中,步骤5)在约20℃至约60℃的温度下进行。在一些实施方式中,步骤5)在约30℃至约60℃、40℃至约60℃、或50℃至约60℃的温度下进行。在一些实施方式中,步骤5)在50℃至约60℃的温度下进行。在一些实施方式中,步骤5)在约50℃的温度下进行。
式(II)化合物的HCl盐可以通过各种方法(例如,溶剂交换和/或沉淀)分离。在一些实施方式中,式(II)的HCl盐通过以下步骤分离:
5a-1)用烃溶剂稀释步骤5)的反应混合物以形成浆液,或
5a-2)用烃类溶剂对步骤5)的反应混合物与进行溶剂交换,形成浆液;
5b)过滤浆液以分离固体;和
5c)在惰性气体下干燥固体得到式(II)的HCl盐。
在一些实施方式中,烃溶剂包括正庚烷。
在一些实施方式中,式(II)的HCl盐通过包括以下的步骤来分离:
5a-1)将步骤5)的反应混合物用正庚烷稀释以形成浆液;
5b)过滤浆液以分离固体;和
5c)在惰性气体下干燥固体得到式(II)的HCl盐。
在一些实施方式中,式(II)的HCl盐通过包括以下的步骤来分离:
5a-2)用正庚烷对步骤5)的反应混合物进行溶剂交换以形成浆液;
5b)过滤浆液以分离固体;和
5c)在惰性气体下干燥固体得到式(II)的HCl盐。
所述惰性气体可以为氮气或氩气;并且干燥可以在真空下进行。在一些实施方式中,惰性气体是氮气并且干燥在真空下进行。
C、步骤4
在一些实施方式中,该方法在步骤5)之前还包括:
4a)将式(V)所示化合物或其盐:
与第二氯化剂和第二碱在第四溶剂中接触以形成式(IVa)所示化合物或其盐:
/>
将式(V)所示化合物或其盐与碘化剂和第二碱在第四种溶剂中接触,以形成式(IVb)所示化合物或其盐:
和
4b)将(IVa)或(IVb)化合物或其盐与式(L)所示苯胺或其盐:
与第三碱在第五溶剂中反应以形成所述式(III)所示化合物或其盐:
在一些实施方式中,该方法在步骤5)之前还包括:
4a)将式(V)所示化合物或其盐:
与第二氯化剂和第二碱在第四溶剂中接触以形成式(IVa)所示化合物或其盐:
和
4b)将(IVa)化合物或其盐与式(L)所示苯胺或其盐:
与第三碱在第五溶剂中反应以形成所述式(III)所示化合物或其盐:
关于通过式(IVa)化合物进行的步骤4a),第二氯化剂可以是能够在式(V)的1-甲基-1H-吡咯并[2,3-b]吡啶-3-甲酸叔丁酯的2-位上添加氯基团-Cl的试剂。在一些实施方式中,第二氯化剂是三氯氧磷、亚硫酰氯、草酰氯、六氯乙烷、甲苯磺酰氯或其组合。在一些实施方式中,第二氯化剂是六氯乙烷或甲苯磺酰氯。在一些实施方式中,第二氯化剂是六氯乙烷。
相对于式(V)化合物,第二氯化剂的量可以为至少1当量。在一些实施方式中,相对于式(V)化合物,第二氯化剂的量为约1.1至约1.5当量。在一些实施方式中,相对于式(V)化合物,第二氯化剂的量为约1.1当量。在一些实施方式中,相对于式(V)化合物,六氯乙烷的量为约1.1至约1.5当量。在一些实施方式中,相对于式(V)化合物,六氯乙烷的量为约1.1当量。
第二碱和第三碱可以各自独立地为金属氨化物、碱金属醇盐、或其组合,其中金属氨化物和碱金属醇盐各自如本文所定义和描述。
步骤4a)中的第二碱和步骤4b)中的第三碱各自独立地是如本文所定义的金属氨化物。在一些实施方式中,第二碱和第三碱各自独立地是金属酰胺。在一些实施方式中,第二碱是第一金属氨化物并且第三碱是第二金属氨化物,其中第一金属氨化物和第二金属氨化物相同。在一些实施方式中,第二碱是第一金属氨化物并且第三碱是第二金属氨化物,其中第一金属氨化物和第二金属氨化物不同。在一些实施方式中,金属氨化物是二异丙基氨基锂(LDA)、双(三甲基甲硅烷基)氨基锂(LiHMDS)、双(三甲基甲硅烷基)氨基钾(KHMDS)或2,2,6,6,-四甲基哌啶锂(LiTMP)。在一些实施方式中,第二和第三碱各自包括双(三甲基甲硅烷基)氨基锂(LiHMDS)。在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS)。
步骤4a)中的第二碱是本文所定义的金属氨化物;步骤4b)中的第三碱包括如本文所定义的碱金属醇盐(例如,碱金属叔丁醇盐)。在一些实施方式中,步骤4a)中的第二碱为金属氨化物;步骤4b)中的第三碱包括碱金属醇盐。在一些实施方式中,步骤4a)中的第二碱为金属氨化物;步骤4b)中的第三碱包括碱金属叔丁醇盐。在一些实施方式中,金属氨化物是二异丙基氨基锂(LDA)、双(三甲基甲硅烷基)氨基锂(LiHMDS)、双(三甲基甲硅烷基)氨基钾(KHMDS)或2,2,6,6,-四甲基哌啶锂(LiTMP)。在一些实施方式中,碱金属叔丁醇盐为叔丁醇钠或叔丁醇钾。在一些实施方式中,步骤4a)中的第二碱包括双(三甲基甲硅烷基)氨基锂(LiHMDS);步骤4b)中的第三碱包括叔丁醇钾。在一些实施方式中,步骤4a)中的第二碱为双(三甲基甲硅烷基)氨基锂(LiHMDS);步骤4b)中的第三碱包括叔丁醇钾。在一些实施方式中,步骤4a)中的第二碱为双(三甲基甲硅烷基)氨基锂(LiHMDS);步骤4b)中的第三碱为叔丁醇钾。
当步骤4a)和4b)在一锅法或两步中进行时,第二和第三碱可以在步骤4a)和4b)的每一个中单独添加。或者,当第二和第三碱相同并且步骤4a)和4b)在一锅中进行时,可以在步骤4a)中一次添加合并的第二和第三碱的总量。
当单独添加第二碱和第三碱时,相对于式(V)化合物,第二碱的量至少为1当量。在一些实施方式中,相对于式(V)化合物,第二碱的量为约1.1至约2当量。在一些实施方式中,相对于式(V)化合物,第二碱的量为约1.1至约1.5当量。在一些实施方式中,第二碱是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其量为约1.1至约1.5当量。在一些实施方式中,第二碱是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其量为约1.1或约1.2当量。
当单独添加第二碱和第三碱时,相对于式(V)化合物,第三碱的量为至少2当量。在一些实施方式中,相对于式(V)化合物,第三碱的量为约2至约3.5当量。在一些实施方式中,相对于式(V)化合物,第三碱的量为约2至约2.5当量。在一些实施方式中,第三碱是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其量为约2至约2.5当量。在一些实施方式中,第三碱是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其量为约2.3当量。在一些实施方式中,第三碱是叔丁醇钾,相对于式(V)化合物,其量为约2.5至约3.5当量。在一些实施方式中,第三碱是叔丁醇钾,相对于式(V)化合物,其量为约3当量。
在一些实施方式中,步骤4a)和4b)以一锅法进行。
当步骤4a)和4b)以一锅法进行时,第三碱是第二碱的一部分;并在步骤4a)中添加合并的第二碱和第三碱(作为第二碱)的总量。在一些实施方式中,第二碱和第三碱是相同的碱,相对于式(V)的化合物,总量为约3至约4当量;并在步骤4a)中添加总量。在一些实施方式中,第二碱和第三碱是相同的碱,相对于式(V)的化合物,总量为约3.5当量;并在步骤4a)中添加总量。在一些实施方式中,相对于式(V)化合物,第二碱和第三碱各自是总量为约3至约4当量的双(三甲基甲硅烷基)氨基锂(LiHMDS);并在步骤4a)中添加总量。在一些实施方式中,相对于式(V)化合物,第二碱和第三碱各自是总量为约3.5当量的双(三甲基甲硅烷基)氨基锂(LiHMDS);并在步骤4a)中添加总量。
在一些实施方式中,该方法在步骤5)之前还包括:
4a)将式(V)所示化合物或其盐:
与碘化剂和第二碱在第四溶剂中接触,以形成式(IVb)所示化合物或其盐:
和
4b)将(IVb)化合物或其盐与式(L)所示苯胺或其盐:
与第三碱在第五溶剂中反应以形成所述式(III)所示化合物或其盐:
关于通过式(IVb)化合物进行的步骤4a),碘化剂可以是能够在式(V)的1-甲基-1H-吡咯并[2,3-b]吡啶-3-甲酸叔丁酯的2-位上添加碘基团-I的试剂。在一些实施方式中,碘化剂是原位碘化剂。在一些实施方式中,当第二碱为双(三甲基甲硅烷基)氨基锂(LiHMDS)时,碘化剂为下式所示的由双(三甲基甲硅烷基)氨基锂(LiHMDS)与碘反应形成的原位碘化剂:
在一些实施方式中,通过将包含式(V)化合物或其盐和碘的混合物添加至双(三甲基甲硅烷基)氨基锂(LiHMDS)或其溶液以形成式(IVb)化合物。
在一些实施方式中,相对于式(V)化合物,碘的量为约1.05至约1.2当量。
关于通过式(IVb)化合物进行的步骤4a)和4b),第二碱和第三碱及其添加物如上所述。在一些实施方式中,双(三甲基甲硅烷基)氨基锂(LiHMDS)(作为第二碱和第三碱)可以在步骤4a)和4b)的每一个中单独添加或在步骤4a)中添加一次,如本文所述。
当第二碱是单独添加的双(三甲基甲硅烷基)氨基锂(LiHMDS)时,在一些实施方式中,相对于式(V)化合物,步骤4a)中双(三甲基甲硅烷基)氨基锂(LiHMDS)的量为约1.1至约1.5当量。在一些实施方式中,相对于式(V)化合物,双(三甲基甲硅烷基)氨基锂(LiHMDS)在步骤4a)中的量为约1.1当量。
当第三碱是单独添加的双(三甲基甲硅烷基)氨基锂(LiHMDS)时,在一些实施方式中,相对于式(V)化合物,双(三甲基甲硅烷基)氨基锂(LiHMDS)的量为约2至约2.5当量于步骤4b)中。在一些实施方式中,相对于式(V)化合物,双(三甲基甲硅烷基)氨基锂(LiHMDS)在步骤4b)中的量为约2.3当量。
当步骤4a)和4b)以一锅法进行时,在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其总量为约3至约4当量;并在步骤4a)中添加总量。在一些实施方式中,相对于式(V)化合物,第二碱和第三碱各自是总量为约3.5当量的双(三甲基甲硅烷基)氨基锂(LiHMDS);并在步骤4a)中添加总量。
关于通过式(IVb)化合物进行的步骤4a)和4b),第二碱和第三碱及其添加物如上所述。在一些实施方式中,双(三甲基甲硅烷基)氨基锂(LiHMDS)(作为第二碱和第三碱)可以在步骤4a)和4b)的每一个中单独添加或在步骤4a)中添加一次,如本文所述。
关于步骤4b),为了避免在步骤4b)结束时式(L)的苯胺过量,相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量优选为约0.9至约1.1当量。在一些实施方式中,相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为不超过1.1当量。在一些实施方式中,相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为约0.95至约1.1当量。在一些实施方式中,相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为约1.05当量。在一些实施方式中,相对于式(IVa)化合物,式(L)的苯胺的量为不超过1.1当量。在一些实施方式中,相对于式(IVa)化合物,式(L)的苯胺的量为约0.95至约1.1当量。在一些实施方式中,相对于式(IVa)化合物,式(L)的苯胺的量为约1.05当量。在一些实施方式中,相对于式(IVb)化合物,式(L)的苯胺的量为不超过1.1当量。在一些实施方式中,相对于式(IVb)化合物,式(L)的苯胺的量为约0.95至约1.1当量。在一些实施方式中,相对于式(IVb)化合物,式(L)的苯胺的量为约1.05当量。
当步骤4a)和4b)分两步进行时,在一些实施方式中,将式(L)的苯胺添加到第五溶剂中的式(IVa)或(IVb)化合物或其盐中。当步骤4a)和4b)分两步进行时,在一些实施方式中,将式(L)的苯胺添加至第五溶剂中的式(IVa)化合物或其盐中。当步骤4a)和4b)分两步进行时,在一些实施方式中,将式(L)的苯胺添加至第五溶剂中的式(IVb)化合物或其盐中。
当步骤4a)和4b)在一锅中进行时,在一些实施方式中,将式(L)的苯胺添加到包含式(IVa)或(IVb)化合物或其盐的步骤4a)的反应混合物中。当步骤4a)和4b)在一锅中进行时,在一些实施方式中,将式(L)的苯胺添加至包含式(IVa)的化合物或其盐的步骤4a)的反应混合物中。当步骤4a)和4b)在一锅中进行时,在一些实施方式中,将式(L)的苯胺添加至包含式(IVb)化合物或其盐的步骤4a)的反应混合物中。
当步骤4a)和4b)在一锅中进行时,在一些实施方式中,第二碱和第三碱是相同碱,相对于式(V)化合物,其总量为约3至约4当量;在步骤4a)中添加总量;相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为约0.95至约1.1当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)或(IVb)化合物或其盐的反应混合物中。在一些实施方式中,第二碱和第三碱是相同的碱,相对于式(V)的化合物,总量为约3.5当量;在步骤4a)中添加总量;相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为约1.05当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)或(IVb)化合物或其盐的反应混合物中。在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其总量为约3至约4当量;在步骤4a)中添加总量;相对于式(IVa)或(IVb)化合物,式(L)苯胺的量为约0.95至约1.1当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)或(IVb)化合物或其盐的反应混合物中。在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其总量为约3.5当量;在步骤4a)中添加总量;相对于式(IVa)或(IVb)化合物,式(L)的苯胺的量为约1.05当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)或(IVb)化合物或其盐的反应混合物中。在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其总量为约3至约4当量;在步骤4a)中添加总量;相对于式(IVa)化合物,式(L)苯胺的量为约0.95至约1.1当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)化合物或其盐的反应混合物中。在一些实施方式中,第二碱和第三碱各自是双(三甲基甲硅烷基)氨基锂(LiHMDS),相对于式(V)化合物,其总量为约3.5当量;在步骤4a)中添加总量;相对于式(IVa)化合物,式(L)的苯胺的量为约1.05当量;将式(L)的苯胺添加到步骤4a)的包含式(IVa)化合物或其盐的反应混合物中。
步骤4a)中的第四溶剂可以是本文所定义的非质子溶剂。在一些实施方式中,第四溶剂是醚。在一些实施方式中,第四溶剂包括四氢呋喃(THF)。
步骤4b)中的第五溶剂可以是如本文所定义的非质子溶剂。在一些实施方式中,第五溶剂是醚。在一些实施方式中,第五溶剂包括四氢呋喃(THF)。
在一些实施方式中,第四溶剂和第五溶剂各自包括四氢呋喃(THF)。在一些实施方式中,第四溶剂和第五溶剂各自为四氢呋喃(THF)。
一般而言,步骤4a)和4b)可以在任何合适的温度下进行。在一些实施方式中,步骤4a)和4b)各自在约-5℃至约25℃的温度下进行。在一些实施方式中,步骤4a)在约0℃至约10℃的温度下进行。在一些实施方式中,步骤4b)在0℃至约25℃的温度下进行。在一些实施方式中,步骤4b)在约0℃至约10℃的初始温度下进行,然后升温至约15℃至约25℃的温度。
在步骤4b)结束时,在一些实施方式中,用氯化铵水溶液淬灭步骤4b)的反应混合物。
可以通过各种方法(例如,溶剂交换和/或沉淀)分离式(III)化合物或其盐。在一些实施方式中,通过包括以下的步骤来分离式(III)化合物或其盐:4c)溶剂交换;和/或4d)沉淀。在一些实施方式中,步骤4c)包括将淬灭的混合物进行第一溶剂交换成包含THF和水的双相混合物;以及双相混合物与乙醇的第二次溶剂交换。在一些实施方式中,步骤4d)包括从包含乙醇和水的混合物中沉淀式(III)化合物或其盐。在一些实施方式中,通过从包含异丙醇和水的混合物中沉淀来分离式(III)化合物或其盐(无需蒸馏反应溶剂,例如,THF和/或交换溶剂)。
D、步骤3
在一些实施方式中,该方法在步骤4a)之前还包括:
3)将式(VI)所示化合物或其盐:
转化为式(V)所示化合物或其盐:
在一些实施方式中,用叔丁醇的盐在第六溶剂中进行步骤3)。在一些实施方式中,叔丁醇的盐是叔丁醇钠。
步骤3)中的第六溶剂可以是如本文所定义的非质子溶剂。在一些实施方式中,第六溶剂是如本文所定义的非极性溶剂。在一些实施方式中,第六溶剂包括甲苯。在一些实施方式中,第六溶剂是甲苯。
一般而言,步骤3)可以在任何合适的温度下进行。在一些实施方式中,步骤3)在约95℃至约110℃的温度下进行。在一些实施方式中,步骤3)在约97℃至约107℃的温度下进行。
E.步骤1和2
在一些实施方式中,该方法在步骤3)之前还包括:
1a)将式(IX)所示化合物或其盐N-甲基化:
得到式(VIII)所示化合物或其盐:
1b)将式(VIII)化合物或其盐氧化为式(VII)所示化合物或其盐:
和
2)将式(VII)化合物酯化,得到式(VI)所示化合物或其盐:
/>
在一些实施方式中,用1,4-二氮杂双环[2.2.2]辛烷(DABCO)和碳酸二甲酯在二甲基甲酰胺(DMF)中进行步骤1a)。在一些实施方式中,相对于式(IX)化合物,DABCO的量为约0.1当量。在一些实施方式中,碳酸二甲酯和DMF的体积比为19:1。
一般而言,步骤1a)可以在任何合适的温度下进行。在一些实施方式中,步骤1a)在约80℃至约86℃的温度下进行。
在一些实施方式中,用亚氯酸钠和氨基磺酸在水中进行步骤1b)。
一般而言,步骤1b)可以在任何合适的温度下进行。在一些实施方式中,步骤1b)在约0℃至约18℃的温度下进行。
在一些实施方式中,用甲醇和硫酸进行步骤2)。
一般而言,步骤2)可以在任何合适的温度下进行。在一些实施方式中,步骤2)在约58℃至约68℃的温度下进行。
在一些实施方式中,式(I)、(III)、(IVa)、(V)、(VI)、(VII)、(VIII)和(IX)中任一项的化合物为盐形式。在一些实施方式中,步骤6b)中的式(II)化合物为盐形式。在一些实施方式中,步骤5)中的式(II)化合物为其HCl盐。
适用的盐形式的实例包括盐酸盐、氢溴酸盐、硫酸盐、甲磺酸盐、硝酸盐、马来酸盐、乙酸盐、柠檬酸盐、富马酸盐、酒石酸盐(例如,(+)-酒石酸盐、(-)-酒石酸盐或其混合物,包括外消旋混合物)、琥珀酸盐、苯甲酸盐以及带有氨基酸(例如谷氨酸)的盐。可以通过本领域技术人员已知的方法制备此类盐。当本发明的化合物含有相对碱性的官能团时,可以通过使此类化合物的中性形式与足量的所需酸(纯酸或在合适的惰性溶剂中)接触来获得酸加成盐。可接受的酸加成盐的实例包括衍生自无机酸(如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等)的酸加成盐,以及衍生自有机酸(如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲磺酸等)的酸加成盐。还包括氨基酸的盐(例如精氨酸盐等),以及有机酸盐(例如葡萄糖醛酸或半乳糖醛酸等)。
药学上可接受的盐的示例性实例是无机酸(盐酸、氢溴酸、磷酸等)盐、有机酸(乙酸、丙酸、谷氨酸、柠檬酸等)盐和季铵(碘甲烷、碘乙烷等)盐。应当理解,药学上可接受的盐是无毒的。关于合适的药学上可接受的盐的附加信息参见《雷明顿药物科学》,第23版,2020年,其通过引用并入本文。
药学上可接受的酸加成盐的实例包括衍生自无机酸(如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等)的盐,以及衍生自相对无毒的有机酸(如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲磺酸等)的盐。还包括氨基酸的盐(例如精氨酸盐等),以及有机酸(例如葡萄糖醛酸或半乳糖醛酸等)的盐(参见,例如,Berge等人,“药用盐(Pharmaceutical Salts)”,药物科学杂志(JournalofPharmaceutical Science),1977,66,1-19)。
在一些实施方式中,式(I)、(III)、(IVa)、(V)、(VI)、(VII)、(VIII)和(IX)中任一项的化合物为中性形式。在一些实施方式中,式(I)化合物是中性形式。
F.选定的实施方式
在第二方面,本发明提供了式(I)所示化合物或其盐的制备方法:
所述方法包括:
3)在甲苯中用叔丁醇钠将式(VI)所示化合物或其盐:
转化为式(V)所示化合物或其盐:
4a)将所述式(V)所示化合物或其盐与六氯乙烷和双(三甲基硅烷基)氨基锂(LiHMDS)在THF中接触以形成式(IVa)所示化合物或其盐:
4b)将式(L)所示苯胺:
添加至包含式(IVa)化合物或其盐的步骤4a)的反应混合物中以形成式(III)所示化合物或其盐:
5)将式(III)所示化合物或其盐与亚硫酰氯和氯化氢在1,4-二恶烷中接触以形成式(II)所示化合物的HCl盐:
6a)将式(K)所示化合物或式(K-1)所示的其对甲苯磺酸盐:
与4-甲基吗啉和三甲基氯硅烷(TMSCl)在四氢呋喃(THF)或甲基叔丁基醚(MTBE)中接触以形成第一混合物;和
6b)将包含式(II)的HCl盐和四氢呋喃(THF)或甲基叔丁基醚(MTBE)的第二混合物添加至步骤6a)的第一混合物中以形成式(I)所示化合物或其盐。
关于步骤3),在一些实施方式中,相对于式(VI)化合物,叔丁醇钠的量为约2当量。在一些实施方式中,步骤3)在约97℃至约107℃的温度下进行。
关于步骤4a)和4b),在一些实施方式中,步骤4a)和4b)以一锅法进行。在一些实施方式中,在步骤4a)中,相对于式(V)化合物,双(三甲基甲硅烷基)氨基锂(LiHMDS)的总量为约3.5当量;并在步骤4a)中添加总量。在一些实施方式中,在步骤4a)中,相对于式(V)化合物,六氯乙烷的量为约1.1当量。在一些实施方式中,在步骤4b)中,相对于式(IVa)化合物,式(L)的苯胺的量为约0.98当量。在一些实施方式中,在步骤4b)中,相对于式(IVa)化合物,式(L)的苯胺的量为约1.05当量。在一些实施方式中,步骤4a)和4b)各自在约-5℃至约25℃的温度下进行。
式(III)化合物可以如本文所述分离。在一些实施方式中,用氯化铵水溶液淬灭步骤4b)的反应混合物。在一些实施方式中,式(III)化合物或其盐通过以下步骤分离:
4c)将淬灭的混合物进行第一溶剂交换成包含THF和水的双相混合物;以及用乙醇对双相混合物进行第二溶剂交换;和
4d)从包含乙醇和水的混合物中沉淀得到式(III)化合物或其盐。
在一些实施方式中,通过从包含异丙醇和水的混合物中沉淀来分离式(III)化合物或其盐(无需蒸馏反应溶剂,例如THF,和/或交换溶剂)。
关于步骤5),相对于式(III)化合物,亚硫酰氯的量为约10当量。在一些实施方式中,氯化氢是在1,4-二恶烷中的溶液。在一些实施方式中,氯化氢是浓度为约4M的1,4-二恶烷溶液;相对于式(III)化合物,氯化氢的量为约6当量。在一些实施方式中,步骤5)在约50℃至约55℃的温度下进行。
式(II)化合物可以如本文所述分离。在一些实施方式中,式(II)化合物的HCl盐通过以下步骤分离:
5a-1)用正庚烷稀释步骤5)的反应混合物以形成浆液,或
5a-2)用正庚烷对步骤5)的反应混合物进行溶剂交换以形成浆液;
5b)过滤浆液以分离固体;和
5c)在氮气和真空下干燥固体得到式(II)化合物的HCl盐。
在一些实施方式中,式(II)化合物的HCl盐通过包括以下的步骤来分离:
5a-1)用正庚烷稀释步骤5)的反应混合物以形成浆液;
5b)过滤浆液以分离固体;和
5c)在氮气和真空下干燥固体得到式(II)化合物的HCl盐。
关于步骤6a),在一些实施方式中,相对于式(II)化合物,三甲基氯硅烷(TMSCl)的量为约1.35当量。在一些实施方式中,式(K)化合物为中性形式。在一些实施方式中,相对于式(II)化合物,式(K)化合物的量为约1.25当量。在一些实施方式中,当式(K)化合物为中性形式时,相对于式(II)化合物,4-甲基吗啉的量为约3.4当量。在一些实施方式中,式(K)的化合物是式(K-1)的对甲苯磺酸盐。在一些实施方式中,相对于式(II)化合物,式(K-1)的对甲苯磺酸盐的量为约1.25当量。在一些实施方式中,当式(K)化合物为式(K-1)对甲苯磺酸盐时,相对于式(II)化合物,4-甲基吗啉的量为约4.4当量。
关于步骤6a),在一些实施方式中,当式(K)化合物为式(K-1)的对甲苯磺酸盐时,相对于式(II)化合物,式(K-1)化合物的量为约1.25当量;4-甲基吗啉的量为约5.5当量;三甲基氯硅烷(TMSCl)的量为约1.7当量。在一些实施方式中,在接触甲硅烷基化剂之前,首先将式(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触以形成包含沉淀物的混合物,所述沉淀物包含4-甲基吗啉的对甲苯磺酸盐。在一些实施方式中,在接触甲硅烷基化剂之前过滤包含4-甲基吗啉的对甲苯磺酸盐的沉淀物。
关于步骤6a),在一些实施方式中,中性形式的式(K)化合物是包含4-甲基吗啉和甲基叔丁基醚(MTBE)的溶液,其通过使式(K-1)化合物与4-甲基吗啉在甲基叔丁基醚(MTBE)中接触,随后过滤包含4-甲基吗啉的对甲苯磺酸盐的沉淀物来制备。
在一些实施方式中,原位形成第一混合物。
关于步骤6b),在一些实施方式中,第二混合物包括甲基叔丁基醚(MTBE)。在一些实施方式中,第二混合物是包含式(II)的HCl盐和甲基叔丁基醚(MTBE)的悬浮液。在一些实施方式中,在步骤6b)中,在约0.5至2小时的时间内缓慢添加第二混合物,同时维持不超过约10℃的温度。
在一些实施方式中,步骤6a)在四氢呋喃(THF)中进行;步骤6b)在四氢呋喃(THF)和甲基叔丁基醚(MTBE)的混合物中进行。在一些实施方式中,步骤6a)和6b)各自在甲基叔丁基醚(MTBE)中进行。
在一些实施方式中,步骤6a)和6b)各自在-5℃至约10℃的温度下进行。
式(I)化合物可以如本文所述分离。在一些实施方式中,式(I)化合物通过以下步骤分离:
6c)用乙醇对步骤6b)的反应混合物进行溶剂交换;
6d)从包含乙醇和水的混合物中沉淀并过滤沉淀物得到式(I)的化合物。
在一些实施方式中,该方法在步骤3)之前还包括:
1a)将式(IX)所示的化合物或其盐:
与碳酸二甲酯和1,4-二氮杂双环[2.2.2]辛烷(DABCO)在二甲基甲酰胺中接触以形成式(VIII)所示的化合物或其盐:
1b)用亚氯酸钠和氨基磺酸在水中处理式(VIII)化合物或其盐,以形成式(VII)所示的化合物或其盐:
和
2)将式(VII)化合物或其盐与甲醇和硫酸反应,得到式(VI)所示化合物或其盐:
关于步骤1a),在一些实施方式中,相对于式(IX)化合物,DABCO的量为约0.1当量。在一些实施方式中,碳酸二甲酯和DMF的体积比为19:1。在一些实施方式中,步骤1a)在约80℃至约86℃的温度下进行。
在一些实施方式中,步骤1b)在约0℃至约18℃的温度下进行。
在一些实施方式中,步骤2)在约58℃至约68℃的温度下进行。
在一些实施方式中,式(I)、(III)、(IVa)、(V)、(VI)、(VII)、(VIII)和(IX)中任一项的化合物为中性形式。在一些实施方式中,式(I)化合物是中性形式。
IV.式(K)化合物的制备方法
在第三方面,本发明提供了式(K)所示化合物或其盐的制备方法:
所述方法包括:
7)将下式所示的2-羟基异吲哚啉-1,3-二酮:
与2-溴乙醇和非亲核碱在非质子溶剂中接触以形成式(J)所示的2-(2-羟基乙氧基)异吲哚啉-1,3-二酮:
8a)在醇溶剂中用氨处理2-(2-羟基乙氧基)异吲哚啉-1,3-二酮,得到所述式(K)化合物;和
8b)任选地将所述式(K)化合物转化为其盐。
在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮(也称为N-羟基邻苯二甲酰胺),步骤7)中的2-溴乙醇的量为约1.05至约1.5当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.4当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.1当量。
在一些实施方式中,步骤7)中的非亲核碱是如本文所定义和描述的叔胺。在一些实施方式中,步骤7)中的叔胺为三乙胺(TEA)、三正丁胺、N,N-二异丙基乙胺(DIPEA)、N-甲基吡咯烷、N-甲基吗啉(也称为4-甲基吗啉)、二甲基苯胺、二乙基苯胺、1,8-双(二甲氨基)萘、奎宁环、1,4-二氮杂二环[2.2.2]-辛烷(DABCO)或其组合。在一些实施方式中,叔胺是三乙胺或N,N-二异丙基乙胺。在一些实施方式中,叔胺是三乙胺。在一些实施方式中,叔胺是N,N-二异丙基乙胺。
在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,步骤7)中的叔胺的量为约1.05至约1.5当量或约1.05至约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,三乙胺的量为约1.05至约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,三乙胺的量为约1.1当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,三乙胺的量为约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,N,N-二异丙基乙胺的量为约1.05至约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,N,N-二异丙基乙胺的量为约1.1当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,N,N-二异丙基乙胺的量为约1.2当量。
在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.4当量,三乙胺的量为约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.2当量,N,N-二异丙基乙胺的量为约1.2当量。
在一些实施方式中,步骤7)中的非亲核碱是基于脒的化合物(例如,DBU或DBN)。在一些实施方式中,步骤7)中的基于脒的化合物为1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)或1,5-二氮杂双环[4.3.0]九碳-5-烯(DBN)。在一些实施方式中,基于脒的化合物是DBU。
在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,步骤7)中的基于脒的化合物的量为约1.0至约1.5当量或约1.0至约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,DBU的量为约1.0至约1.2当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,DBU的量为约1.0当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,DBU的量为约1.1当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,DBU的量为约1.2当量。
在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.1当量,并且DBU的量为约1.0当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.1当量,并且DBU的量为约1.1当量。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,2-溴乙醇的量为约1.2当量,并且DBU的量为约1.2当量。
在一些实施方式中,当步骤7)中的非亲核碱为叔胺(例如,TEA或DIPEA)时,步骤7)中的非质子溶剂为四氢呋喃(THF)、2-甲基四氢呋喃(2-MeTHF)、乙腈(ACN)、二氯甲烷(DCM)、甲基叔丁基醚(MTBE)、庚烷、异丙醇醋酸盐(IPAc)或其组合。在一些实施方式中,非质子溶剂包括乙腈(ACN)。在一些实施方式中,非质子溶剂是乙腈(ACN)。
在一些实施方式中,当步骤7)中的非亲核碱是基于脒的化合物(例如,DBU)时,步骤7)中的非质子溶剂包括二甲基甲酰胺(DMF)。在一些实施方式中,当步骤7)中的非亲核碱为DBU时,非质子溶剂包括二甲基甲酰胺(DMF)。在一些实施方式中,当步骤7)中的非亲核碱为DBU时,非质子溶剂为二甲基甲酰胺(DMF)。
一般而言,步骤7)可以在任何合适的温度下进行。在一些实施方式中,当步骤7)中的非亲核碱为叔胺(例如,TEA或DIPEA)时,步骤7)在约50℃至约100℃的温度下进行。在一些实施方式中,当步骤7)中的非亲核碱为叔胺(例如,TEA或DIPEA)时,步骤7)在约70℃至约80℃的温度下进行。在一些实施方式中,当步骤7)中的非亲核碱为基于脒的化合物(例如DBU)时,步骤7)在约20℃至约50℃的温度下进行。在一些实施方式中,当步骤7)中的非亲核碱为基于脒的化合物(例如DBU)时,步骤7)在室温下进行。在一些实施方式中,当步骤7)中的非亲核碱为基于脒的化合物(例如DBU)时,步骤7)在40℃的温度下进行。
可以通过各种方法(例如,过滤、萃取和/或沉淀)分离来自步骤7)的式(J)的2-(2-羟基乙氧基)异吲哚啉-1,3-二酮。
在一些实施方式中,2-(2-羟基乙氧基)异吲哚啉-1,3-二酮通过以下步骤分离:
7a)过滤包含三乙基胺HBr盐的固体以获得滤液;
7b)在至少1小时的时间内向滤液中添加水以形成浆液;和
7c)过滤浆液以分离2-(2-羟基乙氧基)异吲哚啉-1,3-二酮。
在一些实施方式中,2-(2-羟基乙氧基)异吲哚啉-1,3-二酮通过以下步骤分离:
7a)过滤包含三乙胺HBr盐或N,N-二异丙基乙胺HBr盐的固体,得到滤液;
7b)用乙酸乙酯萃取滤液(例如3次),用正庚烷研磨以形成沉淀;和
7c)过滤沉淀以分离2-(2-羟基乙氧基)异吲哚啉-1,3-二酮。
在一些实施方式中,当步骤7)中的碱是DBU时,2-(2-羟基乙氧基)异吲哚啉-1,3-二酮通过包括以下的步骤来分离:
7a)用乙酸乙酯萃取步骤7)的反应混合物,得到萃取液;
7b)浓缩萃取物,随后从乙酸乙酯和正庚烷中沉淀;和
7c)过滤沉淀以分离2-(2-羟基乙氧基)异吲哚啉-1,3-二酮。
在一些实施方式中,步骤8a)中的醇溶剂是甲醇、乙醇、异丙醇、或其组合。在一些实施方式中,醇溶剂包括甲醇。在一些实施方式中,醇溶剂是甲醇。
步骤8a)中的氨可以是在本文所述的醇溶剂中的溶液。在一些实施方式中,氨是甲醇溶液。在一些实施方式中,氨是浓度为约3.5M至约7M的甲醇溶液。在一些实施方式中,氨是浓度为约3.5M的甲醇溶液。在一些实施方式中,氨是浓度为约7M的甲醇溶液。
一般而言,步骤8a)可以在任何合适的温度下进行。在一些实施方式中,步骤8a)在约20℃至30℃的温度下进行。
来自步骤8a)的中性形式的式(K)化合物可以通过各种方法分离。在一些实施方式中,通过以下步骤将式(K)化合物分离为异丙醇溶液:
8a-1)过滤步骤8a)的反应混合物以除去邻苯二甲酰亚胺副产物,从而得到滤液;和
8a-2)用异丙醇对滤液进行溶剂交换,
其中步骤8a-1)和8a-2)重复至少一次。
在一些实施方式中,在步骤8b)中,式(K)化合物的盐是HCl盐、硫酸盐、半硫酸盐或对甲苯磺酸盐。在一些实施方式中,式(K)的盐是式(K-1)所示的对甲苯磺酸盐:
在一些实施方式中,步骤8b)的过程包括:
8b-1)使式(K)化合物与对甲苯磺酸在异丙醇中接触;
8b-2)将乙酸异丙酯添加到步骤8b-1)的反应混合物中以沉淀式(K-1)的对甲苯磺酸盐。
在一些实施方式中,式(K)化合物是根据如上所述的步骤8a-1)和8a-2)制备的异丙醇溶液。
在一些实施方式中,相对于式(K)的化合物,步骤8b-1)中的对甲苯磺酸的量为约1.0当量。
在一些实施方式中,通过过滤随后干燥将式(K-1)的对甲苯磺酸盐分离为固体。
一般而言,步骤8b-1)可以在任何合适的温度下进行。在一些实施方式中,步骤8b-1)在约35℃至45℃的温度下进行。在一些实施方式中,步骤8b-1)在约40℃的温度下进行。
在一些实施方式中,本发明提供了式(K-1)所示的化合物的制备方法:
/>
该方法包括:
7)将下式所示的2-羟基异吲哚啉-1,3-二酮:
与2-溴乙醇和三乙胺在乙腈中接触以形成下式所示的2-(2-羟基乙氧基)异吲哚啉-1,3-二酮:
8a)在甲醇中用氨处理2-(2-羟基乙氧基)异吲哚啉-1,3-二酮,得到所述式(K)化合物
8a-1)过滤步骤8a)的反应混合物以除去邻苯二甲酰亚胺副产物,从而得到滤液;
8a-2)用异丙醇对滤液进行溶剂交换,其中步骤8a-1)和8a-2)重复至少一次;
8b-1)使式(K)化合物与对甲苯磺酸在异丙醇中接触;
8b-2)将乙酸异丙酯添加到步骤8b-1)的反应混合物中以沉淀式(K-1)的对甲苯磺酸盐。
在一些实施方式中,步骤8b-1)中的式(K)化合物是来自步骤8a-2)的异丙醇溶液。
步骤7)、8a)和(8b-1)的反应条件如本文所述。在一些实施方式中,相对于2-羟基异吲哚啉-1,3-二酮,步骤7)中的2-溴乙醇的量为约1.4当量;相对于2-羟基异吲哚啉-1,3-二酮,步骤7)中三乙胺的量约为1.1当量;步骤8a)中的氨是浓度为约3.5M的甲醇溶液;步骤8b-1)中的式(K)化合物为步骤8a-2)的异丙醇溶液;相对于式(K)化合物,步骤(8b-1)中的对甲苯磺酸的量为约1.0当量。
V.MEK抑制剂的制备方法
在第四方面,本发明提供了式(XI)所示的MEK抑制剂或其盐的制备方法:
所述方法包括:
a)将H
b)将第一混合物与式(XII)所示化合物或其盐反应:
以形成式(XI)所示化合物,
其中:
A环是C
R
在第五方面,本发明提供了式(XI)所示的MEK抑制剂或其盐的制备方法:
包括:
a)将H
b)将第一混合物与式(XIII)所示化合物或其盐:
反应以形成式(XI)所示化合物,
其中:
A环是C
R
关于式(XI)、(XII)和(XIII)中的任一个,在一些实施方式中,A环是具有1至3个独立地选自N、C(O)、O和S的杂原子或基团作为环顶点的9-10元双环杂芳基,其是未取代的或被一个或多个R基团取代;每个R基团独立地为CN、卤素、C
关于式(XI)、(XII)和(XIII)中的任一个,在一些实施方式中,A环是具有1至2个独立地选自N、C(O)、O和S的杂原子或基团作为环顶点的5-6元单环杂芳基,其是未取代的或被一个或多个R基团取代;每个R基团独立地为CN、卤素、C
关于式(XI)、(XII)和(XIII)中的任一个,在一些实施方式中,A环是苯基,其是未取代的或被一个或多个R基团取代;每个R基团独立地为CN、卤素、C
关于式(XI)、(XII)和(XIII)中的任一个,在一些实施方式中,A环选自下组:
每个被0-3个R基团取代;且每个R基团独立地为CN、F、Me或OMe。
在一些实施方式中,步骤a)中H
在一些实施方式中,步骤a)中,H
关于步骤a),甲硅烷基化剂、第一碱、第一溶剂、第一混合物、其O-甲硅烷基保护的化合物和反应条件各自根据章节(III)进行描述。在一些实施方式中,甲硅烷基化剂是三甲基氯硅烷(TMSCl)。在一些实施方式中,第一碱是4-甲基吗啉。在一些实施方式中,第一混合物原位形成。在一些实施方式中,第一溶剂是四氢呋喃(THF)。
关于通过式(XII)的酰基氯的步骤b),在一些实施方式中,通过将包含式(XII)的化合物或其盐和第二溶剂的第二混合物添加至步骤a)的第一混合物中以形成式(XI)的化合物或其盐来进行步骤b)。第二溶剂和反应条件各自根据章节(III)进行描述。在一些实施方式中,第二溶剂是四氢呋喃(THF)或甲基叔丁基醚(MTBE)。
关于通过式(XIII)的酸的步骤b),在一些实施方式中,用一种或多种酰胺偶联试剂在溶剂中以形成式(XI)化合物或其盐来进行步骤b)。一种或多种酰胺偶联剂可以是能够活化式(XIII)的-C(O)OH基团形成酰胺得到式(XI)的化合物或其盐的任何肽偶联剂。合适的肽偶联剂包括N,N'-二环己基碳二亚胺(DCC)、N,N'-二异丙基碳二亚胺(DIC)、1-[双(二甲氨基)亚甲基]-1H-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(HATU)、3-[双(二甲氨基)甲基鎓基]-3H-苯并三唑-1-氧化物六氟磷酸盐(HBTU)、1-羟基-7-氮杂苯并三唑(HOAt)、羟基苯并三唑(HOBt)、苯并三唑-1-基氧基)三吡咯烷基磷六氟磷酸盐(PyBOP)和硫代羰基二咪唑(TCDI)。
在一些实施方式中,式(XI)化合物选自下组:
在一些实施方式中,式(XI)化合物选自下组:
VI.化合物
在第六方面,本发明提供了式(X)所示化合物:
在一些实施方式中,C
在一些实施方式中,式(X)化合物由式(K-1)表示:
VII.实施例
试剂购自商业来源并按收到时的原样使用。使用四甲基硅烷作为内参比,在布鲁克AVANCE 300光谱仪上在300MHz或AVANCE 500光谱仪上在500MHz下获得
常规分析方法
用于式(I)化合物的纯度测定的UPLC方法
化学开发HPLC方法-TFA
化学开发HPLC方法-甲酸
/>
实施例1:2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的开发和制备
使用过量的2-溴乙醇和三甲胺,反应顺利进行。然而,由于反应混合物中存在过量的试剂,化合物(J)的分离面临挑战。在化合物(J)的分离过程中,探索了减少过量的2-溴乙醇和三甲胺的反应条件。由于反应仅在2.5体积的乙腈中进行,因此最初,反应过程中沉淀的所有固体都是三甲胺氢溴酸盐。只需添加12体积的去离子水,盐首先溶解,然后从反应混合物中沉淀出干净的产物,并残余一些残留的三甲胺。
表1显示用于制备和分离2-(2-羟基乙氧基)异二氢吲哚-1,3-二酮(J)的各种反应条件。
表1:2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的制备
/>
条目1
条目2
条目3
条目5
条目6
条目7
2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的制备(条目7)
向用N
用于脱保护反应的任何替代试剂都需要产生不溶性副产物,该副产物可以通过过滤除去,因为式(K)化合物由于分解而不能通过蒸馏分离。考虑到这一点,使用乙二胺、乙醇胺和环己二胺(作为顺式和反式异构体的混合物)进行小规模筛选以脱保护,但只有乙二胺反应产生沉淀(参见表2的条目1-3)。在加热下重复脱保护反应试图推进完成环化并释放最终产物(参见表2的条目4)。
还进行了使用肼作为脱保护试剂的进一步工作。尝试制备2-(氨氧基)乙醇的THF溶液而不是分离的油,以最小化或消除最终产物的蒸馏。在使用肼的第一个实验(参见表2的条目5)中,反应停止,剩余8%的残留化合物(J)。该材料进行第二次肼脱保护反应,导致反应完成。通过多次氯仿处理并蒸发至干燥来分离该材料。在条目6中,一旦反应完成,直接将溶剂更换为THF。然而,两次蒸馏后仍剩余大量甲醇。还剩余不到1%的邻苯二甲酰亚胺副产物。没有进一步进行用肼的脱保护。
表2:2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的邻苯二甲酰亚胺脱保护
/>
实施例3:用氨对邻苯二甲酰亚胺脱保护以形成2-(氨氧基)乙醇(K)
进行了多次开发运行以确定氨作为用于该脱保护的试剂,如表3中所示。考虑使用氨作为脱保护剂,因为它便宜、容易去除并且以甲醇配制成不同浓度出售。
表3:使用氨的邻苯二甲酰亚胺脱保护
/>
初步研究表明邻苯二甲酰亚胺副产物确实不溶于甲醇溶剂。
条目1
条目2-6
条目7-10
条目11-12
实施例4:2-(氨氧基)乙醇的对甲苯磺酸盐(K-1)的开发和制备
将来自1:1异丙醇/乙酸异丙酯的产物(参见表4的条目1)分离为亮白色固体(30.2g,62%)。
表4:对甲苯磺酸盐(K-1)的形成
实施例5:2-(氨氧基)乙醇的对甲苯磺酸盐(K-1)的制备
为了消除在作为游离碱的化合物(K)的纯化中使用氯仿,使用叠缩方法(telescoped approach)将盐形成与氨介导的邻苯二甲酰亚胺脱保护进行结合。进行15-g试验反应来测试叠缩步骤(参见表5的条目1)。用3.5N氨溶液进行脱保护反应后,过滤除去邻苯二甲酰亚胺副产物。将甲醇滤液溶剂交换为异丙醇。在40℃下向该溶液中添加溶解在异丙醇中的一当量的pTSA。为了诱导盐结晶,将五体积的乙酸异丙酯添加到该批料中。将所得悬浮液过滤并干燥,得到收率60%的所需pTSA盐。验证批料的伸缩脱保护在700g化合物(J)上完成,得到所需的对甲苯磺酸盐(K-1),收率50%。
表5:通过叠缩方法形成对甲苯磺酸盐(K-1)
2-(氨氧基)乙醇的对甲苯磺酸盐(K-1)的制备(条目2)
向用N
实施例6:2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的优化和制备
N-羟基-邻苯二甲酰亚胺与2-溴乙醇的烷基化反应在各种条件下进行:
/>
结果总结于下表6中。
表6:形成2-(2-羟基乙氧基)异吲哚啉-1,3-二酮(J)的各种条件
/>
/>
/>
条目1
条目2
条目3
条目4
条目5
条目6
条目7
条目8
条目9
条目10
条目11
条目12
实施例7:步骤6a)和6b)的酰胺形成的开发
/>
步骤6a)和6b)的酰胺形成的进展总结并显示在表7和表8中。开发的主要目标如下:
·确定式(II)化合物的合适溶剂以避免其分解;
·优化活性炭处理以控制杂质或开发稳健的反应条件来控制杂质而不需要活性炭处理;
·结合2-(氨氧基)乙醇的pTSA盐的使用;和
·开发一种稳健的提供高收率和高纯度的化合物(I)的结晶方法。
确定式(II)化合物的合适溶剂
发现当材料悬浮在THF中一段时间(例如,>10小时)时发生化合物(II)的分解。因此,第一步行动是寻找合适的溶剂来悬浮化合物(II)以添加到步骤6a)的第一混合物中。溶剂筛选的结果列于表7中。
表7:化合物(II)在各种溶剂中的稳定性
*HPLC样品运行得太稀,该值不具有代表性。
根据浆液实验,显示出最少分解量的三种溶剂是MTBE、乙酸异丙酯(IPAc)和庚烷。
研究的下一步骤是尝试用各种溶剂使进料化合物(II)浆化并观察对式(I)化合物形成的影响(参见表8)。在所有四个条目中,根据HPLC检测,化合物(II)起始原料的纯度为79.1%。将THF与MTBE、IPAc和庚烷的结果进行比较,基于所形成的式(I)化合物的纯度,MTBE仅稍有优势。最终,根据这些结果选择MTBE进行进一步开发。
表8:步骤6a)和6b)的酰胺形成
条目3和4:74小时后,去除额外的等分试样,并且化合物(I)的HPLC面积%分别为70.6%和70.7%。
优化活性炭处理以控制杂质
一些使用50wt%体装料的Darco G-60活性炭来处理批料并去除杂质制备式(I)化合物的方法。这主要是为了去除晚洗脱的二聚体杂质(RRT 1.92)。表9研究了在标准THF条件下该处理所需的Darco G-60的量。反应条件:1.25当量2-(氨氧基)乙醇,1.35当量TMSCl,3.4当量NMM,5体积THF,10体积THF,0-50wt%诺芮特Darco G60,0℃-室温,30分钟,然后与活性炭搅拌1.5小时。Darco G60活性炭的负载量揭示了活性炭负载量增加导致二聚体杂质含量减少的趋势。在此特定实验中,需要50wt%的负载才能将二聚体杂质减少一半。
表9:RRT 1.92的杂质与活性炭装载量的比较
酰胺形成的开发
接下来的几个实验比较了在偶联反应中使用三乙基氯硅烷(TESCl)与三甲基氯硅烷(TMSCl)。使用TESCl(参见表10的条目1)的第一个实验使用IPAc作为溶剂来产生浆状化合物(II)。使用TESCl得到的条目1的杂质谱与使用TMSCl运行的反应相似。表10中的剩余反应使用TESCl或TMSCl和IPAc或MTBE作为化合物(II)的悬浮液溶剂进行比较。完全转化后用水淬灭反应,然后将双相混合物溶剂交换为水/IPAc或水/MTBE混合物。
表10:步骤6a)和6b)的酰胺形成
/>
通过2-(氨氧基)乙醇的盐形式形成酰胺的开发
研究了使用2-(氨氧基)乙醇盐的酰胺偶联步骤的开发,如表11中所示。为了比较,实施例13中使用的条件包括在表中的条目7中以说明可以获得的收率和纯度(54%收率,99.3面积%)。
条目2
表11:步骤6a)和6b)通过2-(氨氧基)乙醇盐形成酰胺
/>
/>
a:1分钟内添加的化合物(II);
b:缓慢添加化合物(II)(15分钟);
c:缓慢添加化合物(II)(32分钟);
d:在1小时内添加的化合物(II);第一次分离:THF/MTBE溶剂交换;重结晶#1:THF/MTBE;添加乙酸以帮助去除TMS基团;和
e:第一次分离:THF/MTBE溶剂交换/一些乙腈;重结晶#1:THF/MTBE;重结晶#2:EtOH/水(30:33体积比);添加乙酸以帮助去除TMS基团。
条目3-4
确定需要一种纯化方法来去除RRT为1.92的二聚体杂质和RRT为2.26的未知非极性杂质。结果发现,证明将固体部分溶解在四体积的THF中并用反溶剂沉淀材料可以有效去除二聚体。当使用16体积的IPAc作为反溶剂时,二聚体杂质减少了一半。此外,当使用16体积的甲苯作为反溶剂时,86%的二聚体被去除。
条目5
条目6
化合物(I)的制备(条目6):向反应器中添加化合物(K-1)(16.7g,0.067mol,1.25当量)、THF(125mL,5体积)和NMM(25.9mL,4.4当量)。pTSA盐溶解在混合物中。添加TMSCl(9.2mL,1.35当量),此时固体沉淀。将化合物(II)(25.4g,0.054mol,1.0当量)作为MTBE(500mL,20体积)的悬浮液在28分钟内添加,保持反应温度低于4℃。大约40分钟后认为反应完成。过滤该批料以除去一些固体,然后返回到干净的反应器中。将批料在真空下部分蒸馏,此时固体沉淀。通过过滤除去这些含有环化杂质的固体。将滤液返回至反应器并用10体积水、5体积乙醇和1当量处理。乙酸促进TMS裂解。将批料搅拌过夜,然后添加水、乙腈,最后添加MTBE进行真空蒸馏。该产品具有抗沉淀性。一旦固体被分离并干燥,回收率约为10g。纯度未测试,此时收率为40%。将产物在70℃下溶解于乙醇(30体积)中,并添加18体积的水保持70℃,但未观察到结晶。添加另外15体积的水以产生浊点。将批料冷却,收集固体并干燥。最终总收率仅为33%(8.26g),UPLC纯度为98.0面积%。
总之,基于表11的那些条目,关于使用pTSA盐和MTBE的过程的几个观察结果描述如下:
·使用MTBE代替THF消除了二聚体杂质(RRT 1.92);
·观察到,当缓慢添加化合物(II)时,RRT为0.97和RRT为2.26的杂质分别降低至1.2%和1.5%;和
·通过将批料温度保持在5℃以下,同时将化合物(II)悬浮液加入MTBE中,可以有效地阻止二聚体杂质的形成。通过将批料蒸馏至15体积、添加8体积的THF、搅拌1小时并通过过滤除去固体来除去环化杂质(RRT 0.97)。
式(I)化合物的重结晶
对于重结晶实验,使用一批97.2面积%的化合物(I)来确定重结晶对杂质分布的影响。探索了两种重结晶条件(参见表12)。第一种重结晶涉及不同的条件,其中将材料溶解在热乙醇中,在高温下添加水用于溶解材料,然后将溶液缓慢冷却。条目1和2是在这些条件下运行的。条目1和条目2的最终HPLC纯度分别为97.64%和97.50%。环化杂质(RRT 0.97)从起始批料中的1.18%降至条目1中的0.99%和条目2中的1.11%,并且二聚体杂质的浓度(RRT 1.92)基本保持不变。第二种重结晶是将材料溶解在热乙醇中,缓慢冷却溶液,然后在15℃下向溶液中缓慢加水。条目3在第二重结晶条件下运行。条目3的最终HPLC纯度为97.50面积%,环化杂质为1.24面积%,二聚体保持不变。数据表明,在较高温度下添加反溶剂水,然后缓慢冷却,可以去除环化杂质。该第一种重结晶条件在去除环化杂质方面有优势。
重结晶体积基于进入最终重结晶的粗产物的精确质量,而不是基于反应起始原料化合物(II)的投入量。因此,在重结晶之前干燥粗化合物(I)很重要。当重结晶条件应用于25g预验证批料(条目4)时,需要额外体积的水才能达到浊点。
表12:化合物(I)的重结晶
2-(氨氧基)乙醇pTSA盐(K-1)形成酰胺的进一步开发
进行若干反应以优化反应条件并提高化合物(I)的纯度,如表13中所示。
表13:通过2-(氨氧基)乙醇pTSA盐(K-1)优化酰胺形成
/>
/>
/>
条目1
条目2-3
条目4
条目5-6
条目7
条目8
化合物(I)的制备(条目8):向20L反应器中添加化合物(K-1)(201g,0.806mol,1.37当量)、THF(1.5L,5.5体积)和NMM(358g,3.54mol,相对于(K-1)4.4当量)。将混合物冷却至0℃。添加TMSCl(118g,1.09mol,相对于(K-1)1.35当量),同时将温度维持在-5℃。在20-L细口大瓶(carboy)中,添加化合物(II)(274g,0.588mol,1.0当量),随后添加MTBE(6L,21.8体积)。在1.25小时内添加化合物(II)悬浮液,保持反应温度低于5℃。用MTBE(600mL)冲洗大瓶并将冲洗液添加到批料中。将批料升温至20±5℃并在该温度下搅拌30分钟。同进程HPLC分析表明化合物(II)完全消耗。过滤该批料以除去一些固体,并用MTBE(2×600mL)冲洗反应器和滤饼。将滤液返回至干净的反应器(总体积8L)并将该批料在真空下蒸馏至最终体积1.35L。将乙醇(2.7L)添加至反应器中并将该批料第二次蒸馏至1.35L。添加乙醇(2.7L)并将该批料第三次蒸馏至约1.5L。将混合物冷却至20℃并添加乙醇(2.3L)。将混合物升温至68℃,但固体没有完全溶解。在70℃下,在2小时内添加水(2.7L)。添加约300mL水使所有固体溶解。将混合物在13小时内冷却至10℃。将批料在10℃老化4小时并过滤。用水(4×1.4L)冲洗反应器和滤饼。将湿滤饼(1131.3g)在70℃干燥四天,得到195.9g粗化合物(I)(72%)。
将粗化合物(I)(195.9g)和THF(2.7L)装入10L反应器中。将批料升温至54℃以溶解产物。添加Darco G60(135g,50wt%)并将温度调节至40℃。将悬浮液陈化1.5小时,然后过滤以除去碳。用THF(2L)冲洗反应器和滤饼。将滤液返回到清洁的反应器中。将批料真空蒸馏至1.35L,并将批料温度调节至40-41℃。将MTBE(2.7L)在1小时内添加到混合物中,保持温度在40℃。将批料在2小时内冷却至20℃,并在20℃下老化1小时。用MTBE(2×540mL)冲洗反应器和滤饼。湿滤饼重246.6g,在70℃下干燥两天,得到119.8g化合物(I)(收率44%)。产物的
实施例8:通过2-(氨氧基)乙醇TsOH盐(K-1)进一步开发步骤6a)和6b)的酰胺形成
使用化合物(K-1)或化合物(K-1)的游离碱在MTBE单一溶剂中进行比较实验,如表14所示。
表14:通过2-(氨氧基)乙醇pTSA盐形成酰胺(K-1)
/>
条目1
条目2
A.从化合物(K-1)的碱处理中回收化合物(K)
在表14的条目1中,在以化合物(K-1)开始的17体积MTBE中存在酰胺偶联反应的搅拌问题。如表14的条目2所示,在初始碱处理步骤期间NMM·TsOH盐的固体被去除,并且主要的酰胺偶联反应预计会产生不太稠的浆液。进行了一系列实验以了解并提高从化合物(K-1)中回收MTBE/NMM溶液中的化合物(K)。通过混合NMM和化合物(K-1)然后添加MTBE进行的反应不可重现,因为在添加MTBE之前溶液可能会变成固体物质。表15显示成功制备化合物(K)作为MTBE/NMM溶液的实验。
表15:化合物(K)在MTBE/NMM中溶液的分离
条目1
条目2和3
B.使用原位制备的化合物(K)溶液进行酰胺偶联
表15条目2的化合物(K)的溶液用于酰胺形成。酰胺偶联转化率为99.15%,反应混合物中化合物(I)的总纯度为84.15面积%。分离出粗化合物(I),纯度为97.17面积%。在EtOH/H
在步骤6a)和6b)的酰胺形成中使用原位制备的化合物(K)的溶液进行若干反应,如表16中所示。
表16:使用原位制备的2-(氨氧基)乙醇(K)溶液形成酰胺
/>
条目1
条目2
条目3
化合物(I)的制备(条目3):向10-L反应器中添加化合物(K-1)(227g,0.91mol,1.25当量)和MTBE(1.36L,4.0体积)并在20±5℃下开始搅拌。添加NMM(441mL,3.54mol,5.5当量)并在相同条件下继续搅拌批料30分钟。此后过滤该批料并用MTBE(2×0.51L,2×1.5体积)洗涤滤饼。将合并的滤液和洗涤液转移回反应器中并冷却至0℃。缓慢添加TMSCl(0.157L,1.24mol,1.7当量),同时保持批料温度低于5℃。在添加化合物(II)悬浮液之前将批料老化45分钟。在配备有机械搅拌的5L 3颈RBF中添加化合物(II)(340g,0.73mol,1.0当量),随后添加MTBE(3.4L,10体积)并搅拌35分钟以获得均匀悬浮液,然后添加该悬浮液用于酰胺偶联。使用转移泵在1小时20分钟内转移化合物(II)悬浮液,同时保持反应温度低于8℃。将RBF用MTBE(0.34L,1份体积)冲洗并添加到批料中。将批料在5℃下继续搅拌,然后升温至20±5℃并在该温度下搅拌30分钟。此后,取出同进程对照样品并且HPLC分析表明化合物(II)99.85%转化为化合物(I)。过滤该批料以除去所有固体,并用THF(2×0.68L,2×2体积)冲洗反应器并进行滤饼洗涤。将滤液返回至干净的反应器中,并将该批料在真空下蒸馏至最终体积约1.7L(5体积)。将乙醇(3.4L,10体积)添加到反应器中并将批料第二次蒸馏至~1.7L(THF在
将粗化合物(I)(238g)和THF(3.4L)装入10L反应器中。将批料加热至51.2℃(目标为60℃)以溶解产物。完全溶解后,将批料冷却至40℃,然后添加Darco G60(170g,50wt%),并将悬浮液陈化30分钟,然后过滤以除去碳(超过340g硅藻土(celite))。用THF(2×1.9L,2×3.5体积)冲洗反应器和滤饼。合并的滤液和洗涤液通过0.2μm在线过滤器并返回到清洁的反应器中。将批料真空蒸馏至~1.7L(5体积),然后加热至60-65℃以溶解。添加额外的THF(0.68L,1+1=2体积)然后将批料温度调整至40℃并添加化合物(I)晶种(3.4g)后观察到批料完全溶解。在相同条件下继续搅拌30分钟,然后开始在1小时30分钟内向混合物中添加MTBE(4.76L,14体积),同时将批料温度保持在40℃。在2小时内将批料冷却至20℃,并在过滤前在20℃下陈化1小时。用MTBE(2×0.68L,2×2体积)冲洗反应器和滤饼。湿滤饼重455g,在45℃下干燥36小时,得到189g化合物(I)(55%收率)。产物的
实施例9:步骤5的氯化的开发
在本文所述的一些方法中,化合物(II)的后处理和分离涉及用正庚烷多次蒸馏以除去过量的亚硫酰氯。通过用正庚烷稀释和过滤开发了一种改进的分离方法。改善分离的氯化步骤的几个条目和结果示于表17中。
表17:步骤5的氯化
条目1和2
条目3
化合物(II)的制备(条目3)
将在氮气下惰化的10-L夹套反应器通向含有氢氧化钠洗涤水溶液的大瓶。向反应器中装入化合物(III)(500g,1.07mol)和1,4-二恶烷(2.25L,4.5体积)。搅拌该批料并调节至19℃。在10分钟内添加亚硫酰氯(0.776L,10当量)并将温度升至26℃。在25℃的批料温度下,在15分钟内向该批料添加4M HCl的二恶烷溶液(1.6L,6.4mol,6当量)。将批料加热至50℃并老化24小时。同进程分析表明反应已完成。将批料冷却至22.5℃。将正庚烷(3.25L,6.5体积)添加至该批料中并将该批料搅拌30分钟。过滤悬浮液并用正庚烷(1.5L,3体积)冲洗滤饼。将批料在氮气下在过滤器上调节过夜,并在真空烘箱中于25-35℃下干燥。分离收率为91%(428g)。产物的
使用这种新的分离程序的优点包括:
·分解的机会较小。在通过分子内环化途径的加热蒸馏步骤期间,化合物(II)的纯度最有可能降低。
·批量时间要短得多,因为蒸馏通常会增加两天的时间。
·用庚烷进行蒸馏最终会稀释亚硫酰氯,这是不希望的,因为在作为废物处理之前需要将其淬灭。在不稀释亚硫酰氯的情况下,它可以在单个反应器中快速有效地骤冷,而不需要骤冷多个蒸馏桶。
为了保护用于在升高的温度下长时间干燥化合物(II)的设备,进一步优化了分离程序。因此,用4×3.3体积的正庚烷洗涤过滤的湿滤饼,得到几乎中性(pH~6-7)的滤液。
为了减少化合物(II)中作为残留溶剂的二恶烷,化合物(II)的干燥可以在升高的温度(35-38℃或约40℃)下进行。
实施例10:步骤4a)和4b)的氯化和苯胺形成的开发
A.步骤4a)的氯化
通过在0℃下将LiHMDS添加到吲哚(IV)和氯化剂的THF溶液中来进行反应。使用六氯乙烷的反应仅使用1.1当量的氯化剂和1.05当量的碱就完成。与1.1当量的反应甲苯磺酰氯的完成率为95%。参见,表18。结果表明,用1M NaOH碱洗可完全去除残留的甲苯磺酰基副产物。预计增加量的碱和甲苯磺酰氯将促使反应完成。由于已证明甲苯磺酰副产物可以通过萃取去除,因此额外当量的甲苯磺酰氯不会影响最终产物(IVa)的纯度。
表18:步骤4a)的氯化
B.步骤4b)的苯胺形成
通过在0℃下将2-氯-氮杂吲哚(IVa)的溶液添加到LiHMDS和2-氟-2-碘苯胺(缩写为苯胺)的THF溶液中来进行反应(参见表19的条目1)。反应剂量控制,内部温度恢复至起始温度后,反应完成。由于化合物(III)的N-H比苯胺N-H的酸性更强而似乎需要两当量的碱,因此在反应开始时使用稍微过量的碱。反应相当干净,后处理后样品中残留有过量的苯胺。
上述反应以31g规模进行(参见表19的条目2)。由于罐中苯胺的量保持在0.98当量,因此在起始原料完全消耗后,反应混合物中没有苯胺的积累。将产物在MTBE中打浆并过滤,然后将滤液进一步浓缩并在MTBE中重新打浆,以获得纯度>95%的第二批材料。
表19:步骤4b)的苯胺形成
C.步骤4a)和4b)的一锅法反应
通过向烧瓶中添加7-氮杂吲哚-3-叔丁酯和六氯乙烷,将物质溶解在THF中并冷却至0℃,并添加1.1当量LiHMDS同时保持温度低于4.2℃来进行反应。如HPLC所示,来自步骤4a)的氯化化合物(IVa)具有97.1%的纯度。在0℃下向烧瓶中添加苯胺并且滴加2.3当量LiHMDS同时保持温度低于6.1℃。使用苯胺作为限制试剂,并添加第二份苯胺以将剩余的氯化化合物(IVa)从8.7%减少至3.9%。水性后处理后,将样品在2体积的MTBE中浆化,过滤并干燥,得到呈浅棕色固体状的产物(18.66g,83%)(参见表20的条目1)。
上述反应以20g规模进行(参见表20的条目2)。反应顺利进行,分离出橙色固体产物(38.9g,97%),HPLC表明纯度为92%。所有杂质均可通过如上所述的后处理除去。
表20:步骤4a)和4b)的一锅法反应
实施例11:步骤4a)和4b)的氯化和苯胺形成的进一步开发
A.初始优化
为了化合物(II)和化合物(I)的方法的开发工作,制备了数批化合物(III),如表21中所示。
表21:步骤4a)和4b)的氯化和苯胺形成
/>
如在步骤6b)反应的后处理中所使用的,如果将THF/水混合物溶剂交换为乙醇/水,则材料不会在反应器的侧面形成壳。这用于化合物(III)的验证批料。
苯胺装置是完成化合物(I)验证批料(280g规模,表21的条目4)的三步法中的第一步。进行该反应也是为了验证新的分离策略,即在氯化铵淬灭后,将溶剂从THF更换为乙醇,而不是将THF更换为水。新的分离技术防止了“成壳(shelling)”问题,且不影响收率或纯度。分离出产物(543g,96%收率),为米色固体,通过HPLC测得纯度为97.9%。
化合物(III)的制备(条目4)
向在氮气下惰性化的10-L夹套反应器中添加双(三甲基甲硅烷基)氨基锂(1.0M,4.2L,4.2摩尔,3.5当量)。将混合物冷却至-3.5℃。向细口大瓶中装入化合物(V)(280g,1.2mol,1.0当量)、六氯乙烷(317g,1.33mol,1.1当量)和THF(1.24L,4.4体积)。搅拌大瓶中的混合物以形成均匀溶液。将含有化合物(V)和六氯乙烷的THF溶液在26分钟内添加到反应器中。加料期间批料温度升至7℃。将批料在5℃下搅拌1小时。同进程HPLC分析显示转化率大于98%。将2-氟-4-碘苯胺(314g,1.33mol,1.1当量)和THF(498mL,1.8体积)装入干净的大瓶中。搅拌混合物以溶解固体,然后在33分钟内将溶液转移至反应器。添加过程中的温度达到6.9℃。将批料温度调至15℃,老化14h。同进程HPLC分析显示,99%以上转化为化合物(III)。将批料冷却至2℃。通过在25分钟内添加饱和氯化铵(1.1L,3.9体积)来淬灭反应。将批料真空蒸馏(起始体积7.7L)至最终体积2.2L。在45-50℃下向批料中添加水(1.4L,5体积)。在批料温度30-40℃下添加乙醇(2.5L,8.9体积)。将批料真空蒸馏(起始体积6.5L)至最终体积4.2L。在批料温度54℃下添加乙醇(1.4L,5体积)。将批料冷却至20℃并搅拌9小时。过滤浆液并用乙醇(2×0.84L,3体积)和水(2.8L,10体积)冲洗。将批料在40-50℃干燥后,得到化合物(III),收率96%(543g)。
B.进一步优化
虽然所开发的方法在产物纯度和反应收率方面是稳健的,但反应可能不是体积有效的(参见表22的条目1)。为了进一步优化方法,根据表22所示的反应条件制备了数批化合物(III)。
表22:步骤4a)和4b)的氯化和苯胺形成
/>
改进的后处理程序:
1)用NH
2)在室温下将IPA/水(1/4,300体积)添加到反应混合物中并搅拌过夜;
3)将混合物冷却至0℃,过滤并用IPA/水(1/4,30体积)洗涤;
4)将滤饼在IPA(5体积)中于室温下浆化1小时;和
5)过滤混合物,用IPA(2体积)洗涤并在35℃真空烘箱中干燥,得到浅棕色固体。
条目3
实施例12:步骤4a)和4b)的碘化和苯胺形成的开发
使用I
表23:步骤4a)和4b)的碘化和苯胺形成
A.步骤4a)的碘化
碘化似乎经历与氯化反应不同的机制。完全添加LiHMDS后,碘颜色的消失以及主要含有起始原料的反应意味着原位生成的碘化物质的形成。进行反应以验证>1当量LiHMDS对于碘化反应发生的必要性。事实上,当反应中使用只有0.85当量LiHMDS时,通过HPLC仅观察到起始原料。原位形成N-碘代六甲基二硅烷(N-Iodo HMDS)的初步机制如下所示:
N-碘代六甲基二硅烷对水解敏感。由于LiHMDS已添加到吲哚(V)和碘的溶液中,LiHMDS首先与碘反应,当添加过量的LiHMDS时,碘化物质已经开始分解。添加额外的0.5当量I
鉴于上述,改变化合物(V)、碘和LiHMDS的添加顺序,其中将化合物(V)和碘的溶液添加到LiHMDS的溶液中。通过这种方式,原位碘化试剂应在发生任何类型的降解发生之前与吲哚反应。
B.通过碘化的步骤4a)和4b)的一锅法反应
重新安排添加顺序以将化合物(V)和I 2在5体积THF中的溶液添加至LiHMDS溶液中。HPLC表明碘化反应完成。将苯胺在2体积THF中的溶液滴加到2-碘氮杂吲哚(IVb)溶液中。HPLC表明SN Ar反应完成。用饱和NaHCO 3淬灭反应。将NH
上述反应以132g规模进行。猝灭反应后,通过蒸馏除去THF,从水中沉淀出所需产物。将该材料在乙醇中浆化。化合物(III)在乙醇中的溶解度非常低,而化合物(V)和2-氟-4-碘苯胺在乙醇中的溶解度中等。分离出化合物(III)的产物(232g,86%),为灰白色固体。
表24:步骤4a)和4b)通过碘化的单端口反应
实施例13:2-((2-氟-4-碘苯基)氨基)-N-(2-羟乙基)-1-甲基-1H-吡咯并[2,3-b]吡啶-3-甲酰胺(即式(I))的制备方法
式(I)化合物按照图1所示的步骤制备。
步骤1a)和1b):式(VII)化合物的制备
向400L反应器中添加化合物(IX)(17.0kg)、DABCO(1.31kg)和碳酸二甲酯(164kg,9体积)。开始搅拌,添加二甲基甲酰胺(16.0kg,1体积),并将反应器加热至87.4℃并保持24小时。HPLC分析显示转化率为99.58%,因此将批料冷却至20-30℃并真空蒸馏(27.5英寸汞柱,35.1℃)至最终体积87L(5体积)。将乙酸乙酯(153kg,10体积)添加反应器中,并将批料真空蒸馏(27.5英寸汞柱,<40℃)至最终体积为84L(5体积)。将EtOAc(153kg,10体积)添加反应器中,并将批料真空蒸馏(27.5英寸汞柱,<40℃)至最终体积85L(5体积),然后将温度调节至15-25℃。
向单独的容器中添加去离子H
向单独的容器中添加去离子H
所得固体的规格:
步骤2):式(VI)化合物的制备
向用N
在单独的容器中,通过在搅拌下将去离子H
所得固体的规格:
步骤3):式(V)化合物的制备
向用N
在单独的容器中,通过添加去离子H
将批料真空蒸馏(29英寸汞柱,<65℃)至最终体积124L(10体积)。将甲醇(182L,15体积)装入反应器中,并对批料进行真空蒸馏(27.5英寸汞柱,16.7℃),直至最终体积为128L(10体积)。将甲醇(182L,15体积)装入反应器中,并对批料进行真空蒸馏(27.3英寸汞柱,17.0℃),直至最终体积为128L(10体积)。将批料调节至50.5℃,并在2小时内添加去离子H
所得固体的规格:
步骤4a)和4b):式(III)化合物的制备
向用N
向用N
在单独的容器中,通过添加去离子H
向反应器中添加过滤的固体、EtOH(48.9kg,10体积),并在搅拌下将批料加热至40-50℃。该批料在40-50℃下保持30分钟,然后冷却至0-10℃。将批料过滤到之前使用的相同过滤器中,向反应器中添加EtOH(25kg,5体积),并且使冲洗液经过过滤的固体。将固体调节至液体停止滴落,转移至50℃的真空烘箱中,干燥64小时,得到产物(III)(11.7kg,93.6%)。
所得固体的规格:
步骤5):式(II)化合物的制备
向连接有2MNaOH洗涤器的用N
向反应器中添加正庚烷(120L,10体积,用200ppm Statsafe 6000处理)并将批料真空蒸馏(28英寸汞柱,最高温度35.6℃)至最终体积86L(7.5体积)。向反应器中添加正庚烷(123L,10体积)并将该批料真空蒸馏(28英寸汞柱,最高温度24.0℃)至最终体积为86L(7.5体积)。向反应器中添加正庚烷(123L,10体积)并将该批料真空蒸馏(29英寸汞柱,最高温度20.6℃)至最终体积为86L(7.5体积)。向反应器中添加正庚烷(116L,10体积)并将该批料真空蒸馏(29英寸汞柱,最高温度21.0℃)至最终体积为80L(7.5体积)。向反应器中添加正庚烷(120L,10体积)并将该批料真空蒸馏(28英寸汞柱,最高温度22.0℃)至最终体积为83L(7.5体积)。将批料在N
所得固体的规格:
步骤6a)和6b):式(I)化合物的制备
向用N
向用N
向用N
过滤固体,向反应器中添加去离子H
实施例14:2-((2-氟-4-碘苯基)氨基)-N-(2-羟乙基)-1-甲基-1H-吡咯并[2,3-b]吡啶-3-甲酰胺(即式(I))的制备方法
根据如图1所示的步骤4a)、4b)、5)、6a)和6b),由式(V)化合物以5千克的规模制备式(I)化合物。
步骤4a)和4b):式(III)化合物的制备
A.批料-1
在45-L细口大瓶中制备氯化铵(3305g,61.8摩尔)的纯化水(9L,3体积)的溶液。
将化合物(V)(3000g,12.9摩尔,1重量)、六氯乙烷(3507g,14.8摩尔,1.17重量)和无水四氢呋喃(THF,15L,5体积)添加到清洁干燥的100L夹套玻璃反应器中,同时保持氮气环境。一旦观察到完全溶解,将溶液转移至清洁干燥的大瓶中,并在氮气下储存直至需要。用无水THF冲洗100L反应器。
将2-氟-4-碘苯胺(3201g,13.5摩尔,1.07重量)和无水THF(6L,2体积)添加到100L夹套玻璃反应器中,同时保持氮气环境。一旦观察到完全溶解,将溶液转移至清洁干燥的大瓶中,并在氮气下储存直至需要。用无水THF冲洗100L反应器。
将双(三甲基甲硅烷基)氨基锂(45L,THF中1M,45摩尔,15体积)添加到100L夹套玻璃反应器中,同时保持氮气环境。将溶液搅拌并冷却至2℃。在51分钟内通过蠕动泵添加先前制备的化合物(V)/六氯乙烷的THF溶液,同时保持内部温度<10℃(最高温度为8.3℃)。在提交样品用于过程中UPLC之前,将批料再搅拌41分钟。没有检测到化合物(V)。通过蠕动泵在61分钟内添加先前制备的2-氟-4-碘苯胺的THF溶液,同时保持内部温度<10℃(最高温度为8.5℃)。提交样品用于同进程UPLC之前,将批料温度调整至20±5℃,并再搅拌15小时28分钟。化合物(IVa)为0.69面积%。在36分钟内将批料冷却至2℃,然后添加上述制备的氯化铵溶液,同时保持内部温度<10℃(最高温度为7.5℃)。该批料在真空(25英寸汞柱)、夹套温度50℃下蒸馏至27L(9体积)。蒸馏时间约为8小时。添加纯化水(36L,12体积)并在真空(27英寸汞柱)、夹套温度60℃下将批料蒸馏至38L(12.6体积)。蒸馏时间约为8.5小时。在蒸馏接近结束时观察到批料明显起泡,导致材料被推入反应器顶部和提升管中。添加乙醇(11L,3.7体积)。由于批料的厚度和粒度,通过循环批料来冲洗反应器壁的尝试没有成功。在尝试循环期间,注意到泄压阀(BOV)中出现了一个小裂纹。该批料被转移到大瓶中,同时安装了新的BOV。使用额外的乙醇(5L,1.7体积)以促进批料的转移并确保最小的转移损失。返回至100L的反应器后,将批料在15℃下搅拌12小时20分钟,然后转移至铺有纤维素滤纸的24英寸过滤器中。过滤很容易(10分钟)并且大部分批料很容易从反应器中除去。用纯化水(30L,10体积)冲洗反应器,并使用反应器冲洗液来洗涤湿滤饼。将湿滤饼(粗化合物(III))在氮气下调节18小时24分钟。使用乙醇(38L,12.7体积)将湿滤饼返回至100L反应器以帮助转移。将批料温度调节至20±5℃并将内容物搅拌41分钟。将批料温度调节至45±5℃并将内容物在该温度下搅拌2小时18分钟。将批料冷却至5±5℃,在该温度下搅拌2小时44分钟,然后转移至铺有纤维素滤纸的24英寸过滤器中。将滤饼用乙醇(20L,6.7体积)洗涤并在氮气下调节14小时19分钟。将滤饼在50±5℃真空下干燥至恒重,得到5229g呈灰白色固体的化合物(III)。
B.批料-2
在45-L细口瓶中制备氯化铵(3001g,56.1摩尔,1.1重量)在纯化水(8L,3体积)中的溶液。
将化合物(V)(2750g,11.8摩尔,1重量)、六氯乙烷(3210g,13.6摩尔,1.17重量)和无水四氢呋喃(THF,14L,5体积)添加到清洁干燥的100L夹套玻璃反应器中,同时保持氮气环境。一旦观察到完全溶解,将溶液转移至清洁干燥的大瓶中,并在氮气下储存直至需要。用无水THF冲洗100L反应器。
将2-氟-4-碘苯胺(2912g,12.3摩尔,1.06重量)和无水THF(6L,2体积)添加到100L夹套玻璃反应器中,同时保持氮气环境。一旦观察到完全溶解,将溶液转移至清洁干燥的大瓶中,并在氮气下储存直至需要。用无水THF冲洗100L反应器。
将双(三甲基甲硅烷基)氨基锂(41L,THF中1M,41摩尔,15体积)添加到100L夹套玻璃反应器(R100-4)中,同时保持氮气环境。将溶液搅拌并冷却至1.8℃。在55分钟内通过蠕动泵添加先前制备的化合物(V)/六氯乙烷的THF溶液,同时保持内部温度<10℃(最高温度为8.4℃)。在提交样品用于同进程UPLC之前,将批料再搅拌32分钟。没有检测到化合物(V)。通过蠕动泵在69分钟内添加先前制备的2-氟-4-10苯胺的THF溶液,同时保持内部温度<10℃。将批料温度调节至20±5℃,并在提交样品用于同进程UPLC之前再搅拌13小时50分钟。化合物(IVa)为0.82面积%。在58分钟内将批料冷却至1.9℃,然后添加上述制备的氯化铵溶液,同时保持内部温度<10℃。将批料在真空(26英寸汞柱)、夹套温度≤65℃下蒸馏至24L(9体积)。蒸馏时间约为8小时。添加纯化水(33L,12体积),并在真空(28英寸汞柱)、夹套温度≤65℃下将批料蒸馏至41.5L(15体积)。蒸馏时间约为5小时。在蒸馏接近结束时观察到批料明显起泡(参考ALB-DEV-18-0135)。将乙醇(12L,4体积)添加至100L反应器中,并将该批料在15±5℃下搅拌2小时31分钟。然后将批料转移至铺有纤维素滤纸的24英寸过滤器中。用纯化水(28L,10体积)冲洗反应器,并使用反应器冲洗液来洗涤湿滤饼。将湿滤饼(粗化合物(III))在氮气下调节67小时25分钟。使用乙醇(35L,12.7体积)将湿滤饼返回至100L反应器以帮助转移。将批料温度调节至20±5℃并将内容物搅拌35分钟。将批料温度调节至45±5℃并将内容物在该温度下搅拌44分钟。将批料冷却至5±5℃,在该温度下搅拌16小时36分钟,然后转移至铺有纤维素滤纸的24英寸过滤器中。将滤饼用乙醇(18L,6.5体积)洗涤并在氮气下调节1小时7分钟。将滤饼在50±5℃真空下干燥至恒重,得到4776g呈灰白色固体的化合物(III)。
C.步骤4a)和4b)的同进程测试结果
步骤5):式(II)化合物的制备
A.批料-1
100L滴底玻璃夹套反应器配备有两通道图表记录仪、热控制单元和冷凝器。反应器通过填充有4M氢氧化钠溶液的洗涤器系统排气。进行氮气放气,然后向反应器中添加无水1,4-二恶烷(24.5L,4.6体积)和化合物(III)(5209g,11.1摩尔,1重量,批料-1)。将批料温度调整至20±5℃。将亚硫酰氯(8.1L,1.6体积)添加到反应器中,同时保持批料温度<30℃,然后将4摩尔氯化氢的1,4-二恶烷溶液(16.7L,3.2体积)添加到反应器中,同时保持批料温度<30℃。将批料温度加热至55±5℃并将内容物搅拌14小时29分钟。此后,对该批料取样进行UPLC分析,得到2.6%的化合物(III)。将批料温度调节至20±5℃,然后将正庚烷(24L,4.6体积)添加至批料中。将批料蒸馏至43L(8体积),同时保持夹套温度≤50℃并保持批料温度<40℃。将正庚烷(36L,7体积)添加到反应器中,并在相同条件下将内容物蒸馏至32L(6体积)。将正庚烷(47L,9体积)添加到反应器中,并在相同条件下将内容物总共蒸馏3次至33L(6体积)。将批料温度调节至20±5℃并将批料搅拌17小时33分钟。将批料用聚丙烯布和纤维素滤纸过滤。将滤饼用正庚烷(52L,10体积)洗涤,在氮气下调节48小时43分钟,然后在30±5℃下真空干燥至恒重,得到5211g化合物(II)。
B.批料-2
100L滴底玻璃夹套反应器配备有两通道图表记录仪、热控制单元和冷凝器。反应器通过填充有4M氢氧化钠溶液的洗涤器系统排气。进行氮气放气,然后向反应器中添加无水1,4-二恶烷(22L,4.6体积)和化合物(III)(4747g,10.2摩尔,1重量,批料-2)。将批料温度调整至20±5℃。将亚硫酰氯(7.4L,1.6体积)添加到反应器中,同时保持批料温度<30℃,然后将4摩尔氯化氢的1,4-二恶烷溶液(15.3L,3.2体积)添加到反应器中,同时保持批料温度<30℃。将批料温度加热至55±5℃并将内容物搅拌17小时44分钟。此后,对该批料取样进行UPLC分析,得到2.0%化合物(III)。将批料温度调节至20±5℃,然后将正庚烷(22L,4.6体积)添加至批料中。将批料蒸馏至39L(8体积),同时保持夹套温度≤50℃并保持批料温度<40℃。将正庚烷(33L,7体积)添加到反应器中,并在相同条件下将内容物蒸馏至30L(6体积)。将正庚烷(43L,9体积)添加到反应器中,并在相同条件下将内容物总共蒸馏3次至30L(6体积)。将批料温度调节至20±5℃并将批料搅拌2小时4分钟。将批料用聚丙烯布和纤维素滤纸过滤。将滤饼用正庚烷(48L,10体积)洗涤,在氮气下调节62小时22分钟,然后在30±5℃下真空干燥至恒重,得到4711g化合物(II)。
C.步骤5的同进程测试结果
步骤6a)和6b):式(I)化合物的制备
用氮气冲洗200L的哈氏合金反应器,然后装入THF(38.5L,4体积)、2-(氨氧基)乙醇(2619g,65.5wt/wt,22.3摩尔)和n-甲基吗啉(6.9L,62.8mol,0.66重量)。将批料冷却至0±5℃并将三甲基氯硅烷(3914g,36.0摩尔,0.41重量)添加到反应器中,同时保持批料温度<10℃。将批料在0±5℃搅拌1小时。
72L玻璃反应器配备有图表记录仪并装入THF(32L,3.33体积)和化合物(II)(3200g,6.9摩尔,0.33重量)。将内容物搅拌5分钟直至观察到细悬浮液。在78分钟内将悬浮液转移至200L哈氏合金反应器,同时保持批料温度≤10℃。将第二份THF(32L,3.33体积)和化合物(II)(3201g,6.9摩尔,0.33重量)装入72L反应器中。将内容物搅拌3分钟直至观察到细悬浮液。在21分钟内将悬浮液转移至200L哈氏合金反应器,同时保持批料温度≤10℃。将第三份THF(32L,3.33体积)和化合物(II)(3172g,6.8摩尔,0.33重量)装入72L反应器中。将内容物搅拌6分钟直至观察到细悬浮液。在22分钟内将悬浮液转移至200L哈氏合金反应器,同时保持批料温度≤10℃。
将200L哈氏合金反应器中的批料的温度调节至0±5℃并将内容物搅拌33分钟。此后,对该批料取样进行UPLC分析,得到4.5%的化合物(II)。将批料在0±5℃下再搅拌1小时47分钟,然后第二次取样进行UPLC分析,得到3.7%的化合物(II)。将批料温度调整至20±5℃。将大约1/3的批料从200L哈氏合金反应器转移至72L反应器,用活性炭(1.6kg,0.17重量)处理并搅拌至少30分钟。将批料通过硅藻土垫过滤,并将批料溶液在室温下保存在大瓶中直至需要进一步处理。用该批料的剩余部分再重复该操作两次。用THF(20L)清洁并冲洗200L哈氏合金反应器。经过碳处理的批料溶液通过配有在线过滤器的传输管线返回到200L哈氏合金反应器。用THF(20L,2体积)冲洗大瓶,并将冲洗液通过配有在线过滤器的传输线转移至200L哈氏合金反应器。大约一半批料被转移到清洁干燥的玻璃大瓶中并在室温下保存。将纯化水(38L,4体积)装入200L哈氏合金反应器中,同时保持批料温度<30℃。将批料搅拌8分钟,然后转移至清洁干燥的玻璃大瓶中并在2-8℃下保持过夜。另一半批料返回200L哈氏合金反应器并用纯化水(38L,4体积)处理,同时保持批料温度<30℃。将批料在2-8℃下搅拌过夜。将批料在夹套温度≤45℃的情况下减压浓缩至最终批料体积为104L(11体积)。使用在线过滤器将甲基叔丁基醚(MTBE,58L,6体积)转移至200L哈氏合金反应器中,并在夹套温度≤50℃的情况下减压浓缩反应器内容物,直至最终批料体积为103-106L(11体积),总共四次。将预过滤的MTBE(58L,6体积)装入200L哈氏合金反应器中,将批料温度调节至20±5℃并将批料搅拌17小时13分钟。将批料用聚丙烯布和纤维素滤纸过滤。滤饼用预过滤的MTBE洗涤(2×48L,2×5体积)然后在氮气下调节63小时18分钟。用预过滤的MTBE(23L)清洁并冲洗200L哈氏合金反应器,然后用纯化水(96L,10体积)返回滤饼。将批料温度调节至20±5℃并将批料搅拌57分钟。将批料用聚丙烯布和纤维素滤纸过滤。将滤饼用纯净水洗涤(48L,5体积)然后在氮气下调节16小时58分钟。
将湿滤饼与预过滤的乙醇(110L,11体积)一起返回至反应器。将批料温度调节至80±5℃,搅拌批料直至观察到完全溶解(注:在75℃下观察到溶解)。在1小时8分钟内将纯化水(82L,8.5体积)添加到反应器中,同时将批料温度保持在>70℃。在约16小时内将批料温度缓慢调节至15±5℃并将批料在15±5℃下搅拌约6小时。将批料用聚丙烯布和纤维素滤纸过滤。将滤饼用纯化水(4×48L,4×5体积)洗涤,在氮气下调节18小时48分钟,然后在真空下在65±5℃下干燥至恒重,得到4605g化合物(I)。
此后,对该批料进行取样用于卡尔费休分析(USP<921>),得到1.3%的水;有机挥发性杂质(OVI)分析得到950ppm乙醇;未检测到THF、MTBE、1,4-二恶烷和正庚烷。将批料再干燥43小时35分钟,然后第二次取样用于卡尔费休分析(USP<921>),得到1.4%的水。卸载该批料得到4598g化合物(I)。
尽管为了清楚理解的目的已经通过说明和示例的方式详细描述了上述公开,但是本领域技术人员将理解,可以在所附权利要求的范围内实施某些改变和修改。此外,本文提供的每一篇参考文献均通过引用整体并入,其程度与每一篇参考文献单独通过引用并入的程度相同。当本申请与本文提供的参考文献之间存在冲突时,以本申请为准。
- 利用苯胺基锂化合物为催化剂制备醇化合物的方法
- 一种聚吡咯/聚苯胺电磁屏蔽复合材料的制备方法
- 一种(S)-N-(2,5-二(吡啶-4-基-苯基)吡咯烷-2-甲酰胺的制备方法
- 三苯胺-双(二甲硫基乙酸)系化合物及其制备方法和应用以及检测水环境中汞离子的方法
- 吡啶并吡啶并吡咯并 [ 3 , 2 - g ]吡咯并 [ 3 , 4 - e ]吲哚和吡啶并吡咯并[ 2 , 3 - a ]吡咯并 [ 3 , 4 -c ]咔唑化合物 ,其制备方法以及其药物组合物
- 吡啶并吡啶并吡咯并3,2-g吡咯并3,4-e吲哚和吡啶并吡咯并2,3-a吡咯并3,4-c咔唑化合物,制备它们的方法以及含它们的药物组合物
