由植物材料制备富含蛋白质的产品的改进方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及一种从植物材料如油籽制备富含蛋白质的产品如植物蛋白质分离物或蛋白质-纤维制剂的方法,以及通过所述方法可获得的产品在人类食品和/或动物饲料中的用途。特别地,本文提供的方法有利地利用基于低沸点共沸混合物的溶剂,所述低沸点共沸混合物由具有至多5个碳原子的非极性和亲脂性有机酯,与具有至多5个碳原子的醇组成,所述溶剂不仅使得不在需要使用有害的基于己烷的溶剂,而且容易从本文提供的方法中使用的废溶剂和/或母液中获得和回收,从而实现重复利用循环,并因此使得所公开的方法非常节能、适合于大规模工业生产以及生态友好。
背景技术
迫切需要向不断增长的人类群体提供具有足够营养品质的食品,所述食品以对环境无害并且从经济和技术观点来看可行的方式生产。
营养专家一致认为,通过消耗来自植物材料而不是来自动物来源的蛋白质,可以更好地满足人类对蛋白质摄入的需要。然而,源自植物材料的蛋白质的固有问题是,在其天然存在形式中,如在种子、豆类、果实和谷物中,它们通常包埋在包含纤维、多糖、脂肪、脂质、微量营养素和抗营养因子如酚类化合物、植酸盐(phytates)等的复杂基质中。
为了在食品或动物饲料配方中作为成分应用,这些蛋白质需要从源材料中提取并以纯化的形式分离出来,或至少以与膳食植物纤维的可消化混合物的形式提供。此外,在许多食品应用中,这些蛋白质的天然功能性质的保留是重要的,例如溶解性、与脂肪和油形成稳定乳液的能力、形成稳定凝胶、泡沫等的能力。
为了除去与蛋白质天然相关的不需要的成分,已知了并且目前正在使用了不同的纯化和分离技术。
通常,对于油籽和大豆,存在于植物源材料中的部分脂肪、油和脂质,可以通过机械手段如挤出或冷压从源材料中提取以产生油籽饼状物(oilseed cakes)。或者,所述脂肪、油和脂类可通过化学方法提取,例如在非极性和亲脂性溶剂如己烷中提取。在采用己烷提取的方法中,通常采用蒸汽和高温以在专门设计的脱溶剂器/烘烤步骤中,从粕料(meal)中除去己烷的残余物。
虽然己烷处理可能是从源材料中提取油的有效方式,但这种处理不仅高度耗能,而且由于天然蛋白质的部分和不可逆的变性,以及其相关功能性质如溶解度和/或与脂质形成稳定乳液的能力的损失,还可能对粕料中蛋白质的质量产生负面影响。除此之外,己烷是有毒的并且对环境有害。
为了避免蛋白质变性,近年来设计了提取方案,其中完全放弃使用己烷,并且在机械排出部分油之后,蛋白质的提取是从全脂种子或冷榨饼状物开始的。例如,已知其中植物材料经历一系列步骤的工艺,包括顺序使用水性和有机溶剂以获得蛋白质分离物。例如在WO02/060273中公开了一种这样的方法,其教导了用水和使用搅拌装置从向日葵花粕料中提取蛋白质,随后使用乙醇沉淀可溶性蛋白质。另一个例子包括WO2011/057407,其公开了从油菜籽/芸苔(canola)中获得蛋白质浓缩物和分离物的方法,并且教导了将乙醇加入到蛋白质与水的混合物中,并且从溶液中沉淀水溶性蛋白质的方法。WO2013/013949提供了另一个例子,其中公开了从油饼状物(oil cake)分离蛋白质的方法,包括以下步骤:(a)用水溶液提取蛋白质,(b)浓缩,和(c)添加水混溶性有机溶剂如甲醇、乙醇和丙酮,以获得蛋白质沉淀物。在该文献中,通过提供粗制植物蛋白质源在水中的悬浮液,并在搅拌釜反应器(STR)型装置中搅拌该悬浮液来进行蛋白质的提取。然后,干燥来自水和水混溶性溶剂的混合物的沉淀物,来实现蛋白质的分离。
NapiFeryn BioTech有限责任公司(波兰),提交的申请WO2019011904和WO2020016222中公开了值得注意的和高度优选的方法。其教导了这样的方法,分别以不含己烷的方式,从植物材料如油籽、豆类或扁豆中成功地获得天然和功能性蛋白质或植物蛋白质-纤维产物。所公开的方法通过以下步骤实现其目的:对植物材料进行优选的预处理,然后在温和且非破坏性的条件下使用水性溶剂部分提取水溶性蛋白质,然后使用所谓的“公认安全的”(GRAS)有机溶剂的新组合纯化固体残余物,其中该方法中使用的最后的溶剂,包含基于第三溶剂的总重量计至少90重量%的、具有至多5个碳原子的非极性(无极性)且亲脂性的有机酯,并且其中所述有机酯在室温下与第一水性溶剂至少部分可混溶且与第二醇基溶剂完全混溶,并且其中第三溶剂的量,以使得整个液相不分离成不同的液相。
尽管WO2019011904和WO2020016222的有利方法成功地解决了在不使用有毒溶剂如己烷的情况下除去不期望的组分的需要,并且由于使用乙醇和乙酸乙酯的组合而可以纯化高质量的植物蛋白质材料,但是它们在工业实践中实施的一个主要障碍是回收纯化形式(即纯度大于90%的)的乙酸乙酯的高成本。
这种高成本的主要原因是乙酸乙酯和类似的酯倾向于与醇,特别是乙醇形成共沸混合物,该共沸混合物极难分离成纯的组分部分。如果在系统中存在大量的水,则问题甚至更加复杂,这在涉及生物材料如植物的回收和分离过程的情况下,实际上是不可避免的。具体的三组分系统:水-乙醇-乙酸乙酯展示出形成多共沸物的能力,所述多共沸物呈均相共沸物的形式,如乙醇-乙酸乙酯或乙醇水,但也呈非均相共沸物的形式,如乙酸乙酯-水。
发明内容
本公开基于在处理废溶剂(也称为母液)期间进行的出乎意料且偶然的经验观察,所述废溶剂作为进行如WO2019011904和WO2020016222中所述的方法的一部分而获得。即,这些废溶剂的典型组成除了植物来源的材料如来自油籽加工的天然植物油如油菜籽、大豆、向日葵、亚麻等之外,还包含超过一半的乙酸乙酯(表示为质量分数w/w)和相当大量的乙醇和水。本领域技术人员在了解可能的三元和二元共沸物后,会预期当该混合物进行蒸馏或蒸发时,要获得的第一低沸点共沸物应该是含有大量水的共沸物。然而,我们惊奇地观察到,在10-50kPa的减压下蒸发废溶剂之后,获得了基本上不含水的馏出物。我们推测,这种与预期行为的偏离可能是由于存在来自加工的植物材料的植物衍生组分,和/或可能由于存在盐如NaCl、KCl、CaCl
不管根本原因如何,类似地令人惊讶的是观察到的效果,即所述回收的几乎不含水的(即含有小于10%的水)共沸混合物具有足够低的极性和亲脂性,以有效地替代WO2019011904或WO2020016222的至少90%纯的非极性和亲脂性有机酯溶剂。
作为这些观察的结果,发现了一种新的令人惊奇的节能的和易于放大的方法,用于含蛋白质的产品的纯化,例如源自豆类、谷物和油籽的蛋白质分离物或蛋白质-纤维混合物,其中两类主要的杂质,即酚类化合物和脂质,可以通过一系列极性递减的溶剂和溶剂混合物成功地除去,其中第一溶剂基本上是水(至少90%w/w),第二溶剂包含醇,而最终和大多数非极性溶剂是非极性和亲脂性有机酯与醇以8:1至1:1的比例混合的共沸混合物,并且其中最终混合物中的水的含量,以使得整个液相不分离成不同的液相。
所发现的方法的优点之一在于,具有例如乙酸乙酯和乙醇的混合物(其中乙酸乙酯与乙醇的比例为8:1至1:1,并且包含小于10%w/w的水含量)也可以相对容易地从在该方法中产生的废溶剂中回收。由于有机溶剂可以再循环或回收,这进一步减少了该方法的成本和由此产生的潜在的对环境有害的废物。由于乙酸乙酯与乙醇的低水共沸混合物比单独的纯溶剂的沸点低,因此可以有利地在相对低的能量输入下进行这种混合物的回收,例如通过任何技术如降膜蒸发、刮膜蒸发、真空蒸发、蒸馏和/或其组合等。
另一个优点是,在通过所公开的方法获得的最终富含蛋白质的产品中回收的植物蛋白质,表现出低水平的酚/多酚化合物和脂质杂质以及低水平的残余溶剂;即我们测定到它们含有以干重计小于1000ppm的乙醇和以干重计小于100ppm的乙酸乙酯。此外,由所公开的加工方法得到的蛋白质分离物和蛋白质-纤维产品,很大程度上保留了蛋白质的天然功能性,例如营养价值、溶解性、乳化能力、胶凝性质等,这使得这些含蛋白质的产品适合用作食品中的功能成分。这些和其它优点在此进一步解释。
本公开的目的是提供一种生产有营养价值的富含植物蛋白质的产品的流水线方法,该方法不仅在工业上适合而且在经济上可行。与先前已知的方法相比,本文所提出的方法通过从根本上简化溶剂回收过程来达到这些目的,同时提供类似的高品质的富含植物蛋白质的产品,甚至是从含有相当大量的油、脂肪和/或脂质的具有挑战性植物材料中,例如从油籽、豆科植物(legumes)和扁豆中。
在一个总的方面,提供了一种用于从植物材料(1)制备富含植物蛋白质的产品(42,44)的方法,其中,基于干重,所述植物材料(1)包含10-50重量%的蛋白质,所述方法包括以下步骤:
a)压碎或粉碎所述植物材料(1)以产生固体饼状物(2);
b)用含水第一溶剂提取固体饼状物(2),所述含水第一溶剂包含基于第一溶剂的总重量的至少90重量%的水,以获得第一固体部分和第一液体部分的混合物;
c)将第一液体部分(11)与第一固体部分(12)分离;
d)添加含醇第二溶剂,所述第二溶剂包含基于第二溶剂的总重量的至少50重量%的、在室温下可与水混溶的具有1至5个碳原子的醇,其中
所述添加包括将第二溶剂添加到第一固体部分(12)中,或其中
在添加第二溶剂之前,浓缩第一液体部分(11)以获得第一液体部分蛋白质浓缩物(11b),并且其中所述添加包括将第二溶剂添加到所述浓缩物(11b);
e)将通过在步骤d)中添加第二溶剂获得的混合物中的任何一种分离成第二液体部分(21,23)和第二固体部分(22,24);
f)将第三溶剂加入到步骤e)中获得的第二固体部分(22,24)中,所述第三溶剂包含基于第三溶剂的总重量的64-90重量%的、具有至多5个碳原子的非极性且亲脂性的有机酯,和10-35重量%的具有1至5个碳原子的醇的共沸混合物,并且其中所述有机酯在室温下与第一溶剂至少部分混溶且与第二溶剂完全混溶,并且其中第三溶剂的量以使得整个液相不分离成不同的液相;
g)将步骤f)中获得的混合物分离成第三液体部分(31,33)和第三固体部分(32,34),所述第三液体部分还被称为共沸废溶剂(31,33);
h)干燥步骤g)中获得的第三固体部分(32,34),以获得富含植物蛋白质的产物(42,44)。
在一个具体的方面,提供了加工工业规模量的植物材料并允许获得超过实验室规模量的最终植物蛋白质富集产物的方法。
在又一个方面,提供了通过本文所述的方法获得的或可通过本文所述的方法获得的富含植物蛋白质的产品。
最后但同样重要的是,还提供了本文所述的方法和产品在人类食物和/或动物饲料生产中的用途。
附图说明
为了更好地理解本公开的本质,结合附图参考以下详细描述,在附图中:
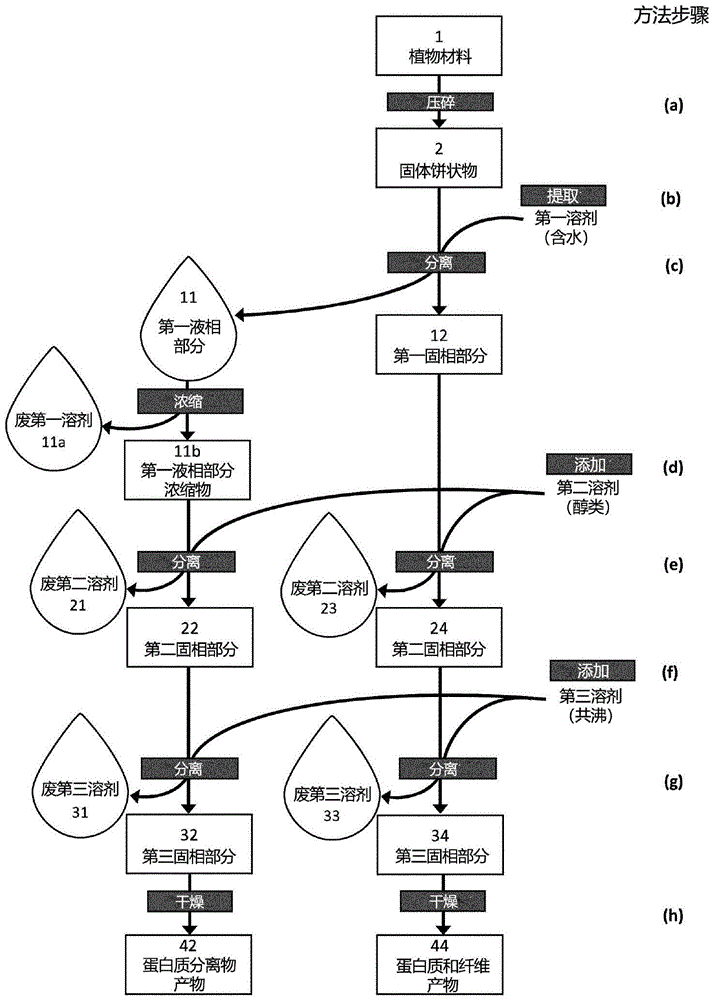
图1示意性地示出了所公开的方法的可能的实施方式,其中首先机械加工(步骤a)植物材料(1)以产生固体饼状物(2);然后在温和且非破坏性的条件下使用含水溶剂(“第一溶剂”)提取(步骤b)饼状物(2),随后分离(fractionation)(步骤c)成第一液相(11)和第一固相(12)。由于这两个相(11,12)都是有价值的植物蛋白质的来源,它们都可以进一步经历一系列极性递减的溶剂的处理和分离循环,包括包含至少50%的1至5个碳原子的醇的醇溶剂(步骤d;“第二溶剂”),随后分离(步骤e)和用共沸溶剂(步骤f;第三溶剂)处理所得的包含部分(fractions)的固相(22,24),共沸溶剂包含这种醇与1至5个碳原子的非极性亲脂性酯的共沸混合物。在另一轮分离(步骤g)之后,然后可以干燥(步骤h)所得的包含固相的部分(32,34),导致产生高质量的富含植物蛋白质的产物(42,44),例如植物蛋白质分离物(42)或植物蛋白质和纤维的混合物或粉末(44);
图2描绘了图1的示意图,另外概念性地展示了共沸溶剂的再循环和回收的优选实施方式,其中来自植物蛋白质分离物(42)的生产路径中的分离步骤g)的废共沸溶剂(废第三溶剂31)在植物蛋白质和纤维产品(44)的生产路径中的分离步骤g)中再利用,之后(作为废第三溶剂33),其可在溶剂回收设备(SRP)单元(例如蒸发器或蒸馏器)中经历溶剂回收过程(虚线),以根据所公开方法的实施方式,随后返回和再利用用于后续生产循环。或者,来自植物蛋白质分离物(42)和植物蛋白质和纤维产品(44)的生产路径的废共沸溶剂(31,33)均可直接送至SRP单元用于溶剂回收过程(实施方式未展示);
图3进一步描述了图2中所示方法的实施方式,其中,优选地,来自植物蛋白质分离物(42)的生产路径中的分离步骤e)的废醇溶剂(废第二溶剂21),也可以随后在植物蛋白质和纤维产品(44)的生产路径中的醇分离步骤e)中再利用。当然,此后,植物蛋白质和纤维产品(44)的生产路径中的废醇溶剂(废第二溶剂23)也可在另外的SRP单元(实施方式未展示)中经历溶剂回收过程;
图4示意性地展示了根据图1所示方法的实施方式的一般实施方式,进一步概念性地描述了干燥步骤h)也可以导致产生实质上另外部分的废共沸溶剂(废第三溶剂41和43);
图5示意性地展示了一个实施方式,其中这些另外部分的废共沸溶剂(41,43)还可以与来自分离步骤g)的废共沸溶剂(31,33)一起或独立地被再利用,通过在SRP(例如蒸发器或蒸馏器)中进行溶剂回收过程,然后通过返回到本文公开的方法中用于后续的富含植物蛋白质的产品生产循环。当然,废共沸溶剂再利用和/或回收方案的这个或其它实施方式可以独立地与分离步骤e)中的废醇溶剂的任何再利用和/或回收方案组合,例如图3中所示的方式;
图6概念性地示出了所公开的方法的实施方式,其涉及高度优选的共沸溶剂再利用和回收方案,其中来自分离步骤g)的废共沸溶剂,(31)和在植物蛋白质分离物的生产过程中获得的来自干燥步骤h)的废共沸溶剂的另外部分(41,43),以及任选地还来自植物蛋白质和纤维产品(44)的生产路径的,可以在植物蛋白质和纤维产品(44)的生产路径中的分离步骤g)中再利用。然后,由此产生的废共沸溶剂(33)可被引导至SRP以用于溶剂回收过程,以便根据所公开的方法,随后返回再用于后续的富含植物蛋白质的产品的生产循环。
图7展示了从大豆中获得的蛋白质分离物的方法流程。
图8展示了从大豆获得的蛋白质-纤维浓缩物的方法流程。
图9展示了从DRC获得的蛋白质分离物的方法流程。
图10展示了从DRC获得的蛋白质-纤维浓缩物的方法流程。
图11展示了大豆蛋白质分离物的总蛋白质含量的测定结果。
图12展示了大豆蛋白质分离物的含水量的测定结果。
图13展示了大豆蛋白质分离物的灰分含量的测定结果。
图14展示了大豆蛋白质分离物的脂肪含量的测定结果。
图15展示了大豆蛋白质分离物的总植酸盐含量的测定结果。
图16展示了DRC蛋白质分离物的总蛋白质含量的测定结果。
图17展示了DRC蛋白质分离物的含水量的测定结果。
图18展示了DRC蛋白质分离物的脂肪含量的测定结果。.
图19展示了DRC蛋白质分离物的灰分含量的测定结果。
图20展示了DRC蛋白质分离物的总植酸盐含量的测定结果。
图21展示了DRC蛋白质分离物的总酚含量的测定结果。
图22展示了大豆蛋白质分离物的分散性的测定结果。
图23展示了大豆蛋白质分离物的氮溶解度的测定结果。
图24展示了大豆蛋白质分离物的乳化能力的测定结果。
图25展示了大豆蛋白质分离物的发泡能力和稳定性的测定结果。
图26展示了大豆蛋白质分离物的最低胶凝浓度的测定结果。
图27展示了DRC蛋白质分离物的分散性测定结果。
图28展示了DRC蛋白质分离物的氮溶解度的测定结果。
图29展示了DRC蛋白质分离物的乳化能力的测定结果。
图30展示了DRC蛋白质分离物的发泡能力和稳定性的测定结果。
图31展示了DRC蛋白质分离物的最低胶凝浓度的测定结果。
图32展示了大豆蛋白质-纤维浓缩物的总蛋白质含量的测定结果。
图33展示了大豆蛋白质-纤维浓缩物的含水量的测定结果。
图34展示了大豆蛋白质-纤维浓缩物膳食纤维含量的测定结果。
图35展示了大豆蛋白质-纤维浓缩物的脂肪含量的测定结果。
图36展示了大豆蛋白质-纤维浓缩物的灰分含量的测定结果。
图37展示了对大豆蛋白质-纤维浓缩物的总植酸盐的测定结果。
图38展示了大豆蛋白质-纤维浓缩物的总酚含量的测定结果。
图39展示了DRC蛋白质-纤维浓缩物的总蛋白质含量的测定结果。
图40展示了DRC蛋白质-纤维浓缩物的含水量的测定结果。
图41展示了DRC蛋白质-纤维浓缩物的膳食纤维含量的测定结果。
图42展示了DRC蛋白质-纤维浓缩物的脂肪含量的测定结果。
图43展示了DRC蛋白质-纤维浓缩物的灰分含量的测定结果。
图44展示了DRC蛋白质-纤维浓缩物的总植酸盐含量的测定结果。
图45展示了DRC蛋白质-纤维浓缩物的总酚含量的测定结果。
图46展示了大豆蛋白质-纤维浓缩物的吸水和吸油能力的测定结果。
图47展示了DRC蛋白质-纤维浓缩物的吸水和吸油能力的测定结果。
定义和缩写
本文所用的术语“共沸混合物”或简单地“共沸物”是指两种或多种组分的混合物,他们一起表现为单一组分,使得混合物在单一温度下完全蒸发或完全冷凝,并且当混合物经历冷凝或蒸发时,后者包括例如蒸发,或者液相中的组分浓度与气相中的组分浓度相同并保持相同。
本文所用的术语“粕料(meal)”是指粉末形式的植物材料,例如面粉,所述植物材料实际上不含油和脂质,是通过用有机或溶剂油(mineral solvents)例如己烷提取这些油和脂质,随后通过用水蒸汽烘烤除去所述溶剂。本文所用的术语“溶剂油”是指通过裂化、精炼和/或精馏过程从化石沉积物如石油或烟煤中得到的溶剂。本文所用的术语“植物材料”具有其常规含义,是指来源于植物的材料,包括蔬菜、水果、种子、豆科植物(legumes)和谷物。本文所用的术语“植物原材料”具有其常规含义,是指可通过根据所公开的方法加工而转化成新的有用产物的植物原材料,所述产物例如包含最初存在于植物原材料中的蛋白质分离物。
如本文所用,术语“天然蛋白质”和“天然纤维”是指天然的蛋白质和天然的纤维。因此,如果最终的蛋白质-纤维产品含有天然蛋白质和天然纤维,则该蛋白质和纤维不能与存在于未加工的植物材料中的天然蛋白质和天然纤维区分开。
本文所用的术语“室温”是18至25℃之间的温度。
缩写“GRAS溶剂”代表“公认安全的(Generally Regarded As Safe)”并且根据Guidance for Industry,Q3C-Tables and List,U.S.Department of Health and HumanServices,Food and Drug Administration Center for Drug Evaluation and Research(CDER),Center for Biologics Evaluation and Research(CBER),February 2012,ICH,Revision 2.,属于第三类溶剂。在这方面,例如参见https://www.fda.gov/downloads/drugs/guidances/ucm073395.pdf。
缩写“STR”代表“搅拌釜反应器”。缩写“ALSEOS”代表如申请WO2019011904中公开的“油籽的含水低剪切提取”。缩写“CV”、“G”、“rpm”、“DW”和“NS”分别代表“柱体积”、“重力”、“每分钟转数”、“干重”和“氮溶解度”。
具体实施方式
本文公开的新方法的一般概念可被视为提供了一种工业上有利的替代方法,以替代分别如申请WO2019011904和WO2020016222中公开的生产植物蛋白质分离物(进一步称为“蛋白质分离物”)或植物蛋白质和植物纤维混合物(进一步称为“蛋白质纤维产品”)的方法。
本文公开的方法与所述两个申请中的任一个中公开的方法的不同之处在于,向第三分离步骤中加入包含或为共沸混合物的溶剂,所述共沸混合物包含64-90重量%的具有至多5个碳原子的非极性且亲脂性的有机酯和10-35重量%的具有1至5个碳原子的醇,而不是这种具有至多5个碳原子的非极性且亲脂性有机酯的几乎纯的(分析纯度级)且不含醇的溶液。
因此,在第一个总的方面,提供了一种用于从植物材料(1)制备富含植物蛋白质的产品(42,44)的方法,其中,基于干重,所述植物材料(1)包含10-50重量%的蛋白质,所述方法包括以下步骤:
a)压碎或粉碎所述植物材料(1)以产生固体饼状物(2);
b)用含水第一溶剂提取固体饼状物(2),所述含水第一溶剂包含基于第一溶剂的总重量的至少90重量%的水的,以获得第一固体部分和第一液体部分的混合物;
c)将第一液体部分(11)与第一固体部分(12)分离;
d)添加含醇第二溶剂,所述第二溶剂包含基于所述第二溶剂的总重量的至少50重量%的、在室温下可与水混溶的具有1至5个碳原子的醇,其中
·所述添加包括将第二溶剂添加到第一固体部分(12)中,或其中
·在添加第二溶剂之前,浓缩第一液体部分(11)以获得第一液体部分蛋白浓缩物(11b),并且其中所述添加包括将第二溶剂添加到所述浓缩物(11b);
e)将通过在步骤d)中添加第二溶剂获得的混合物中的任何一种分离成第二液体部分(21,23)和第二固体部分(22,24);
f)将第三溶剂加入到步骤e)中获得的第二固体部分(22,24)中,所述第三溶剂包含具有至多5个碳原子的非极性且亲脂性的有机酯,其还被称为“有机酯”,并且其中所述有机酯在室温下与第一溶剂至少部分混溶并且与第二溶剂完全混溶,并且其中第三溶剂的量以使得整个液相不分离成不同的液相;
g)将步骤f)中获得的混合物分离成第三液体部分(31,33)和第三固体部分(32,34),所述第三液体部分还被称为废第三溶剂(31,33);
h)干燥步骤g)中获得的第三固体部分(32,34),以获得富含植物蛋白质的产物(42,44)。
其中,
第三溶剂包含或为共沸混合物,基于第三溶剂的总重量,其包含:
·64-90重量%的有机酯,和
·10-35重量%的具有1-5个碳原子的醇,和
·少于10重量%,优选少于5重量%的水。
图1示意性地示出了这种通用方法的实施例。在此使用的溶剂,包括或作为共沸混合物,包括64-90重量%的有机酯,和10-35重量%的具有1-5个碳原子的醇,还被称为“有机酯和醇的共沸混合物”,或简称为“共沸溶剂”或“第三溶剂”。
目前公开的使用有机酯和醇的共沸混合物代替来自WO2019011904或WO2020016222的高纯度有机酯溶液的方法,令人惊讶地提供了具有相同或相当品质的富含植物蛋白质的产品,同时具有以经济可行和生态友好的方式扩大规模至工业水平生产能力的巨大优势。
这主要是由于包含64-90重量%的具有至多5个碳原子的非极性且亲脂性的有机酯、10-35重量%的具有1-5个碳原子的醇和小于10重量%的水(基于混合物的总重量)的共沸混合物,具有足够的化学稳定性,从而可以在随后的(分批生产中batchwiseproduction)或连续的工艺循环之间,通过例如汽化如蒸发,直接再循环、回收和/或回收利用。此外,例如乙醇或甲醇与乙酸乙酯或乙酸甲酯中任一种的共沸混合物,具有比它们各自单独的组分更低的沸点,这进一步减少了通过例如蒸发回收共沸物所需的能量。当然地,在工业规模水平上,这种能量节约可以导致操作成本、以及与用于所需溶剂的回收的设备的类型和数量相关的成本的显著降低。
本公开的方法提供了高品质的富含植物蛋白质的产品,其至少与通过WO2019011904或WO2020016222中所述的方法获得的此类产品的品质匹配。然而,由于大规模回收高纯度有机酯溶剂的选择复杂且昂贵,因此后一种方法主要适用于小规模操作,例如用于研究和开发目的分批生产。
相反,本文所提出的使用稳定的、可再循环的和易回收的有机酯和醇的共沸混合物的新方法,可以有利地用于大规模分批或甚至更有利地用于植物材料的连续加工,从而产生高产量的富含植物蛋白质的产物。由于有利的共沸溶剂选择,所提出的方法可以作为以工业规模部署的连续方法的一部分运行,以每年数千吨的量生产富含植物蛋白质的产品,可能以每周7天、每天24小时的方式运行,通常涉及每年超过6000个生产小时。
因此,在本公开的一个优选方面,提供了一种方法,其中,在该方法中获得的富含植物蛋白质的产物(42,44)的量,在分批生产方法中按每进料加工一批固体饼状物(2)或植物材料(1)计,或在连续生产方法中按每小时计,总计为至少1kg,优选至少5kg,更优选至少10kg,更优选至少20kg,最优选超过100kg。
在与上述方面相容的另一个实施方式中,提供了一种方法,其中在该方法中,提取的固体饼状物(2)的量,在分批生产方法中按每进料加工一批固体饼状物(2)计,或在连续生产方法中按每提取一小时计,为至少10kg,优选至少20kg,更优选至少30kg,更优选至少40kg,更优选至少50kg,更优选至少100kg,更优选至少200kg,甚至更优选至少500kg,最优选至少1000kg或更多/批。
在与上述实施方式相容的另一个实施方式中,提供了一种方法,其中在该方法中,压碎或粉碎的植物材料(1)的量,在分批生产方法中按每进料一批植物材料计,或在连续生产方法中按每压碎或粉碎一小时计,为至少10kg,优选至少20kg,更优选至少30kg,更优选至少40kg,更优选至少50kg,更优选至少100kg,更优选至少200kg,甚至更优选至少500kg,最优选至少1000kg或更多。
由于再循环和/或回收共沸溶剂的能力对通过所公开的方法可实现的产量提高具有如此大的影响,因此图1中示意性地示出的方法的优选实施方式示于图2中,进一步描述了用于这种共沸溶剂再循环和回收的可能方式的实施例。在该实施例中,来自蛋白质分离物(42)的生产路径中的分离步骤g)的废共沸溶剂(31),表示为“废第三溶剂31”,直接在蛋白质-纤维产品(44)的生产路径中的分离步骤g)中再利用(或再循环)。在蛋白质-纤维产品(44)的生产路径中,废共沸溶剂(31)向分离步骤g)中的直接添加,用实线画出的箭头示意性地示出。
在分离步骤g)中,或者在任何固体部分洗涤步骤中,当在前述的使用之后,废共沸溶剂不被水太稀释多和/或被植物材料衍生的化合物(主要是脂肪或者脂类)污染时,并且废共沸溶剂的含量仍然包括64-90重量%的有机酯,和10-35重量%的具有1-5个碳原子的醇的特定条件下时,废共沸溶剂的直接再利用是可能的。如果这些条件中的任何一个不满足,则可将这种废共沸溶剂送至溶剂回收设备(图2中的“SRP”)或SRP单元以进行共沸溶剂回收,其包括例如使用蒸发来除去水和/或任何植物材料衍生的污染物。
这种废共沸溶剂回收,示意性地展示在图2中,由虚线箭头表示,其中从蛋白质-纤维产品(44)的生产路径中的分离步骤g)获得的废共沸溶剂(33),表示为“废第三溶剂33”,被送至SRP单元,之后其被返回至“备用”共沸溶剂池,用于作为所公开的方法的步骤f)的一部分的新鲜共沸溶剂来添加。
当然,除了回收的废溶剂之外,“备用”共沸溶剂池还可以提供有例如充满、富集、或甚至定期或不定期地重新填充或补充新鲜的共沸溶剂或其形成组分的溶液,例如几乎纯的、高百分比和/或实验室级的具有1至5个碳原子的醇的有机酯的溶液。本领域技术人员容易理解,这构成了在回收溶剂以进一步再利用的工业中的通常做法,称为“净化”。这种做法源于这样一个事实,即在蛋白质加工厂中,即使在最有效的溶剂回收方法中,也将不可避免地发生一些溶剂损失,例如由于溢出、排放、分解等。为了补偿这些损失,可以将新鲜的、纯化的溶剂加入到回收的溶剂池中。用新鲜或纯化的溶剂或其组分部分置换回收溶剂的另一个可能的原因可能是,回收溶剂中不期望的杂质的积累。本文所述的普通净化做法当然可以包括在本文公开的方法的特定实施方式中。
除了植物材料衍生的污染物的程度之外,在废共沸溶剂中携带的水的含量是关键的决定因素,决定其是否可以在所公开的方法的实施方式中直接再利用或再循环,或者其是否将被引导至SRP以用于共沸溶剂回收。例如,通过本发明方法最终获得的蛋白质-纤维产品(44)中的植物蛋白质,通常比同样通过本发明方法可获得的蛋白质分离物(42)中存在的某些天然蛋白对变性更不敏感。我们估计,在所述方法的某些实施方式中,可在蛋白质-纤维产品(44)中获得的前一种蛋白质可以使用共沸溶剂分离,所述共沸溶剂可能是废共沸溶剂,包含不超过10重量%的水(基于第三溶剂的总重量),优选不超过7重量%的水,更优选不超过5重量%的水,甚至更优选不超过2重量%或甚至1重量%的水。
然而,当使用非极性亲脂性溶剂提取时(参见D.Fukushima,1969,Denaturationof soy proteins by organic solvents),可根据本发明的方法在蛋白质分离物(42)中获得的某些蛋白质得到了最佳保存,并因此受益于第三溶剂的添加,其为包含64-90重量%的有机酯、10-35重量%的具有1-5个碳原子的醇并包含尽可能少的水的共沸混合物。
因此,在另一方面,提供了一种方法,其中第三溶剂还包含小于7重量%的水,优选小于5重量%的水,更优选小于2重量%的水,甚至更优选小于1重量%的水,并且最优选小于0.5重量%的水,以第三溶剂中水的质量分数表示。
在所公开方法的其它优选实施方式中,以共沸混合物中有机酯的质量分数表示,共沸混合物包含65-85重量%的有机酯,优选70-84重量%的有机酯,更优选75-83重量%的有机酯,甚至更优选76-82.5重量%的有机酯,最优选76.5-82.2重量%的有机酯。
在优选的方面,有机酯具有小于0.4的相对极性。各种溶剂的相对极性值公开于:Solvents and Solvent Effects in Organic Chemistry,Wiley-VCH Publishers,3rded.,2003。相比之下,水具有1的相对极性。
由于所公开的方法最终旨在提供用于人类食品和潜在地用于动物饲料的富含植物蛋白质的产品,因此有机酯的选择不仅取决于其功能性,还取决于由健康和安全考虑。由于这些限制,在所公开方法的优选实施方式中,与具有1-5个碳原子的醇形成共沸混合物的有机酯是乙酸乙酯,其是食品工业中常用的有机酯,被认为是GRAS溶剂。
在所公开的方法的另外的实施例中,以共沸混合物中具有1至5个碳原子的醇的质量分数表示,共沸混合物包含12-32重量%的具有1至5个碳原子的醇,优选15-30重量%,更优选17-27重量%,甚至更优选18-25重量%,最优选19-22重量%,并且优选地为约20重量%的具有1至5个碳原子的醇。
在可能的实施方式中,具有1至5个碳原子的醇选自甲醇、乙醇、丙醇、异丙醇、丁醇、异丁醇或其组合。优选地,具有1至5个碳原子的醇具有0.8至0.4的相对极性。鉴于与上述选择合适的有机酯时相同的考虑,主要出于健康和安全考虑,在优选的实施方式中,具有1-5个碳原子的醇是乙醇,其也通常用于食品工业并被认为是GRAS溶剂。
根据上述内容,在所公开方法的另一个优选的实施方式中,共沸混合物包含乙酸乙酯和乙醇,基于第三溶剂的总重量,优选包含64-90重量%的乙酸乙酯和10-35重量%的乙醇。在进一步具体的实施方式中,以共沸混合物中乙酸乙酯的质量分数表示,共沸混合物可以优选地包含65-85重量%,优选70-84重量%,更优选75-83重量%,甚至更优选76-82.5重量%,最优选76.5-82.2重量%的乙酸乙酯,和12-32重量%,优选15-30重量%,更优选17-27重量%,甚至更优选18-25重量%,最优选19-22重量%,和优选地约20重量%的乙醇(以共沸混合物中乙醇的质量分数表示)。
在所公开的方法中,使用由乙酸乙酯和乙醇组成的、被公认为GRAS溶剂的共沸溶剂,从含蛋白质的植物材料特别是包括富含脂质的油籽中除去脂肪和脂质的残余物,带来了额外的好处,即不再需要使用从矿物油(mineral oils)中提取的有毒溶剂,尤其是包括己烷的。这也意味着消除了目前工业上用于从粕料中除去己烷残余物的常规步骤,所述步骤通常涉及使用蒸汽和高温,这些步骤显著限制了粕料中存在的蛋白质的可提取性和功能性。因此,在另一方面,提供了一种方法,其在不使用具有6个以上碳原子的有机或溶剂油如己烷的情况下进行。
根据所用的植物材料及其含量,在如图2所示的共沸溶剂回收的的替代实施方式中,来自蛋白质分离物(42)和蛋白质-纤维产品(44)的生产路径的废共沸溶剂(31,33)均可直接送至SRP单元,用于溶剂回收过程(实施方式未示出)。
独立于根据本文公开的方法的不同实施例的用于废共沸溶剂再循环和/或回收的所选策略,所述方法还可以包括废第二(或醇)溶剂的再循环和/或回收。这样的一个实施例象征性地描绘于图3中,其中,来自植物蛋白质分离物(42)的生产路径中的分离步骤e)的废醇溶剂(废第二溶剂21),直接加入到植物蛋白质和纤维产品(44)的生产路径中的醇分离步骤e)中,并因此在其中再利用。当然,此后,植物蛋白质和纤维产品(44)的生产路径中的废醇溶剂(废第二溶剂23)也可在另一SRP单元(未显示)中经历溶剂回收过程。
在本发明方法的其它可能的实施方式中,大量的直接可再利用的、可再循环的和/或可回收的废共沸溶剂,在此进一步称为“另外部分的废共沸溶剂”,也可通过干燥步骤h)产生,如图4所示(废第三溶剂41和43)。
因此,在下一方面,本文公开了方法,其中在步骤h)中干燥第三固体部分(32,34),产生另外部分的废第三溶剂(41,43),其还被称为另外部分的废共沸溶剂(41,43)。
如上所述,在图5所示的优选的实施方式中,通过在SRP中进行溶剂回收过程,如蒸发器或蒸馏器,另外部分的废共沸溶剂(41,43)也可以与来自分离步骤g)的废共沸溶剂(31,33),一起或独立地被再利用。此后,由此回收的共沸溶剂可以返回到“备用”共沸溶剂池中,用于作为根据所公开的方法的随后的富含植物蛋白质的产品生产循环中的步骤f)的一部分的新鲜共沸溶剂来添加。
图6示意性地显示了一种替代的且特别优选的共沸溶剂再利用和回收方式,其中SRP的负荷比图5的实施方式中的少。在该示意性实施方式中,来自分离步骤g)的废共沸溶剂(31),和来自在植物蛋白质分离物(42)的生产路径中的干燥步骤h)的另外部分的废共沸溶剂(41,43),以及任选地还从来自植物蛋白质和纤维产品(44)的生产路径中的,在植物蛋白质和纤维产品(44)的生产路径中的分离步骤g)中再利用。然后,由此产生的废共沸溶剂(33)可被引导至SRP以用于溶剂回收过程,以便根据所公开的方法,随后返回并再用于后续的富含植物蛋白质的产品的生产循环。
因此,在另一方面,提供了一种方法,其中在步骤f)中添加的第三溶剂的至少一部分从以下任一项中回收:所述废第三溶剂(31,33)、所述废另外部分的第三溶剂(41,43)或其组合。
在上述方面的优选实施方式中,提供了一种方法,其中,从以下任一项中回收的步骤f)中添加的部分第三溶剂:废第三溶剂(31,33)、另外部分的废第三溶剂(41,43)或其组合,包含至少5重量%的水,优选至少10重量%的水,可能至少15重量%、至少20重量%、至少25重量%的或至少30重量%的或更多的水(其中以废第三溶剂或其组合(31,33,41,43)中水的质量分数表示)
在前面两个实施方式的一个特定实施方式中,提供了一种方法,其中在步骤f)中添加的第三溶剂主要或完全从以下任一项回收:废第三溶剂(31,33)、另外部分的废第三溶剂(41,43)或其组合。类似地,在后者的可能的特定实施方式中,还提供了一种方法,其中,以下的任一项被主要或完全回收:来自步骤f)中添加的第三溶剂的废第三溶剂(31,33)、另外部分的废第三溶剂(41,43)或其组合,其中包含至少5重量%的水,优选至少10重量%的水,可能至少15重量%、至少20重量%、至少25重量%或至少30重量%的或更多的水(以废第三溶剂或其组合(31,33,41,43)中水的质量分数表示)的。
关于共沸溶剂的回收,在另一个优选的方面,提供了一种方法,其中第三溶剂的回收包括施加等于或低于200kPa,更优选等于或低于大气压(1个大气压,对应于101.325kPa)的操作压力,优选其中操作压力为20-50kPa(0.2-0.5bar)。
在另一个优选的方面,提供了一种方法,其中第三溶剂的回收包括蒸发步骤,所述蒸发步骤包括使用蒸发器或用蒸发器进行,所述蒸发器优选选自旋转蒸发器、刮膜蒸发器(wiped-film evaporators)、降膜蒸发器(scraped-film evaporators)、升膜蒸发器、短程蒸发器,优选降膜蒸发器。在另一个优选的方面,可以提供一种方法,其中第三溶剂的回收包括机械蒸汽再压缩。
当然,废共沸溶剂再利用和/或回收方式的任何上述或其它实施方式,可独立地与分离步骤e)中的废醇溶剂的任何再利用和/或回收方式组合,例如图3中所示的方案。
如以上示意性实施例所解释和显示的,在优选的实施方式中,在本文公开的用于生产蛋白质分离物(42)的方法中产生的废溶剂,特别是废共沸溶剂,可以优选地作为溶剂或者作为洗涤溶液,被再循环或再利用,用于本文公开的生产植物蛋白质-纤维产品(44)的方法中。
这是因为在温和的水性提取步骤b)和分离步骤c)之后获得的第一固体部分(12)中,与天然植物纤维一起保留的植物蛋白质,并不总是需要这样的纯溶剂,因为在所述步骤之后,第一液体部分(11)中,保留了大部分的天然水溶性植物蛋白质。具体而言,如果在给定的系统中超过可接受的水的极限,则可能由于相分离所致的剪切应力,天然水溶性植物蛋白质的大部分易于变得受损或变性,这可能发生在本文公开的方法的多溶剂系统中。
因此,在优选的实施方式中,与蛋白质-纤维产品(44)生产路径中的相应溶剂相比,在所公开方法中,在蛋白质分离物(42)生产路径中,步骤d)中添加的醇(或第二)溶剂的组成和/或在步骤f)中添加的共沸(或第三)溶剂的组成,将优选地包含更少量的水。
因此,在优选的实施方式中,提供了这样的方法,其中,以第二溶剂中水的质量分数表示,在蛋白质分离物(42)生产途径的步骤d)中加入的醇(或第二)溶剂包含小于7重量%的水,优选小于5重量%的水,更优选小于3或2重量%的水,和/或,其中,以第三溶剂中水的质量分数表示,在蛋白质分离物(42)生产途径的步骤f)中加入的共沸(或第三)溶剂包含小于2重量%的水,优选小于1重量%的水,最优选小于0.5重量%的水。
在一个可能的实施方式中,提供了一种方法,其中通过所公开的方法获得的富含蛋白质的产品是蛋白质-纤维产品(44)。
在另一个实施方式中,提供了一种方法,其中通过所公开的方法获得的富含蛋白质的产物是蛋白质分离物(42)。
在根据上述两个实施方式的优选实施方式中,提供了一种方法,其中蛋白质-纤维产品(44)和蛋白质分离物(42)都作为富含蛋白质的产品获得。
在所提供方法的一个具体实施方式中,步骤d)中的添加包括将第二溶剂添加到第一固体部分(12)中,并且步骤h)中获得的富含植物蛋白质的产品(42,44)是包含植物蛋白质和天然纤维的蛋白质-纤维产品(44),优选地,基于蛋白质-纤维产品(44)的总干重,其中植物蛋白质和天然纤维的总含量为至少30重量%。
可应用于上述实施方式的其它优选实施方式可见于WO2020016222,其通过引用结合到本文中。例如,在优选的实施方式中,基于第二溶剂的总重量,第二溶剂包含至少60重量%,优选至少70重量%,更优选至少80重量%,最优选至少90重量%的具有1至5个碳原子的醇,其在室温下可与水混溶。
在另一个具体的实施方式中,提供了一种方法,其中步骤h)中获得的富含植物蛋白质的产品(42,44)是蛋白质分离物(42),其中基于蛋白质分离物的总干重,蛋白质含量为至少90重量%,优选至少95重量%;并且其中
·在步骤d)中的添加之前,浓缩所述第一液体部分(11)以获得第一液体部分蛋白质浓缩物(11b),所述浓缩物(11b)优选包含基于所述浓缩物(11b)的总重量的50-90重量%的水,和基于浓缩物(11b)的总干重的至少40重量%的蛋白质含量,并且其中所述添加包括将包含至少90重量%的醇的第二溶剂添加至浓缩物(11b);以及
·其中在步骤f)中加入的第三溶剂优选包含小于2重量%的水,更优选小于1重量%的水,最优选小于0.5重量%的水,并且还优选其中
·基于第二固体部分(22)的总干重,在步骤e)中获得的第二固体部分(22)的蛋白质含量为至少60重量%;和/或
·基于第三固体部分(32)的总干重,在步骤g)中获得的第三固体部分(32)的蛋白质含量为至少90重量%。
在本方法的优选实施方式中,其中步骤h)中获得的富含植物蛋白质的产品是蛋白质分离物(42),并且根据所用的植物材料(1),能够提供一种方法,其中在步骤d)中,第一液体部分(11)进一步经历一个或多个渗滤步骤,以除去至少部分非蛋白质组分,和/或其中第一液体部分(11)可以经历蒸发步骤。
如WO2019011904中所解释的,其通过引用结合到本文中,在从第一固体部分(12)分离后,获得的用于生产蛋白质分离物(42)的第一液体部分(11),可以任选地进行另一固液分离步骤,使用例如过滤装置如自清洁过滤器或深度过滤器,或者第一液体部分可以在圆盘堆叠离心机(disc-stack centrifuges)或类似装置中进行离心,目的是除去可能存在于第一液相中的固体细粒和/或脂质。
在一个可能的实施方式中,浓缩第一液体部分(11)以获得第一液体部分蛋白质浓缩物(11b)并弃去含水第一溶剂(11a),优选包括超滤、蒸发或其组合。在一个实施方式中,第一液体部分(11)可以在TFF装置中进行超滤,所述TFF装置具有中空纤维型过滤膜、陶瓷膜或螺旋缠绕膜,所述过滤膜的开口尺寸(截断尺寸)足够小以保留存在于第一液相中的通常为6-20kD的蛋白质物质,同时对于存在于第一液体部分中的其它溶质如肽、多糖、寡糖、糖、酚类化合物、植酸盐和盐是可渗透的。或许,在超滤浓缩步骤之后,优选地,任选地采用新鲜水或用盐的水溶液对超滤滞留物的渗滤步骤,该步骤包含进一步的添加剂,以产生包含至少10重量%的溶解或沉淀的固体的第一液体部分浓缩物(11b),其中,基于浓缩物的总干重,在这样的第一液体部分浓缩物(11b)中的蛋白质含量为至少40重量%,优选至少50重量%,并且其中,基于蛋白质浓缩物的总重量,蛋白质浓缩物包含50-90重量%的水。任选地,第一液体部分浓缩物(11b)可以在真空下进行蒸发以除去过量的水(11a)。如WO2019011904中所解释的,技术人员了解一些不同的合适的浓缩技术,包括过滤、沉降、离心等,可以应用于第一液体部分(11)的不同部分,并且它们的所得浓缩产物可以随后合并以形成最终的富含蛋白质的第一液体部分浓缩物(11b),其可以根据本文提供的方法进一步加工以产生蛋白质分离物(42)。
在上述实施方式的一个优选的实施方式中,蛋白质分离物(42)包含基于干物质至少70重量%的天然植物基蛋白质,并且优选包含小于1重量%的碳水化合物,和/或小于0.2重量%的酚类化合物,和/或不含具有6个或更多个碳原子的有机溶剂或溶剂油。
在一个优选的实施方式中,通过步骤h)中公开的方法获得的富含蛋白质的产品(42,44)中的共沸溶剂的残留量,即蛋白质-纤维产品(44)或蛋白质分离物(42),低于食品当局所要求的可接受水平,通常低于1000ppm,优选低于100ppm,甚至更优选低于30ppm。
所公开的方法的可能实施方式的各个方面,可以取决于所选择使用的植物材料(1),特别是其脂肪和脂质含量,和/或纤维含量。植物材料(1)优选选自蔬菜、水果、种子、豆类、谷物及其组合。在一个可能的实施方式中,植物材料(1)是植物原材料,这意味着它是粗制的未加工的植物材料。植物材料(1)的实例包括油籽,包括油菜籽、芸苔、向日葵、红花或棉籽。可选的实施例包括豆类(pulses),例如大豆(soybeans)和其它豆子(beans)、豆科植物(legumes)和豌豆(peas),包括鹰嘴豆、红、绿、黄和褐色小扁豆等。在一个优选的实施方式中,植物材料(1)选自油籽,包括油菜籽、芸苔、向日葵籽、亚麻籽、红花籽、棉籽及其组合,其中植物材料优选油菜籽、大豆或向日葵。
植物原材料如油籽,如油菜籽、芸苔、向日葵、红花、棉籽等,豆类如大豆(soybeans)和其它豆子(beans),豆科植物(legumes)和豌豆(peas)如鹰嘴豆、红、绿、黄和褐色小扁豆等,具有共同的特征,即它们天然蛋白质含量的重要部分属于称为白蛋白和/或球蛋白的蛋白质类,即它们可溶于水和/或无机盐水溶液,所述无机盐水溶液含有阳离子如NH
本领域技术人员将理解,在根据本教导进行加工之前,可以对完整种子、豆子(beans)或谷物形式的植物原材料进行预选和/或干法分离,如脱皮(即除去荚和种子的外皮)。在可通过干法分级除去的部分中的蛋白质含量显著低于将进行进一步加工以获得蛋白质产品的部分中的蛋白质含量的情况下,这种操作可能是特别优选的。
因此,在一个实施方式中,可以提供这样的方法,其中例如如果植物原材料包含完整的种子、豆子(beans)或谷物,则在步骤a)之前,植物材料至少部分地去除了(deplete)具有外壳、树皮、外皮、壳等形式的贫蛋白质和富木质素的外层,优选使用合适的脱皮、干法分离或其组合的方法。
通常,对于油籽和大豆(soya),存在于植物原材料中的部分脂肪、油和脂质可以通过机械方法如挤出或冷压从植物原材料中提取,以产生油籽饼状物,或者所述脂肪、油和脂质可以通过化学方法如在非极性和亲脂性溶剂如己烷中提取来提取。在使用己烷提取的常规方法中,通常在专门设计的脱溶剂器/烘烤步骤中使用蒸汽和高温从粕料中除去残余的己烷。由于粕料中存在的蛋白质的部分且不可逆的变性以及相关功能性质的丧失,例如溶解度和/或与脂质形成稳定乳液的能力,这样的处理可能对粕料中蛋白质的质量具有负面影响。
鉴于上述内容,在一个可能的实施方式中,在步骤a)之前,使用机械手段,优选使用冷压将植物材料至少部分地脱脂。优选地,在使用机械方法的脱脂步骤中既不使用有机溶剂也不使用溶剂油。还优选地,植物原材料不被加热至高于75℃的温度。
如果植物原材料含有相当大量的脂肪、油和/或脂类,则所公开的方法的优点特别突出。因此,在一个实施方式中,基于干重,植物原材料包含至少5重量%,更优选至少10重量%,甚至更优选至少15重量%的脂肪、油和脂质。
如上所述,在所公开方法的步骤a)中,进行植物原材料的压碎或粉碎。该步骤有利于植物材料在用于提取的第一含水溶剂中的分布和悬浮。通过这样做,促进了压碎或粉碎的植物原材料(又名固体饼状物2)和用于提取的第一溶剂之间有效传质的条件。
在一个实施方式中,步骤b)中的第一溶剂是水或包含盐如NaCl、KCl、CaCl
从压碎或粉碎的植物材料中提取水溶性组分至第一溶剂,可通过任何适于促进悬浮或分散的固相与第一溶剂的连续液相之间的传质的技术来实现,例如:
i)在STR中混合;
ii)使被固定成填充床的经压碎或粉碎的植物原材料与渗透通过填充床的第一溶剂接触;
iii)通过将压碎或粉碎的植物材料悬浮在向上流动的第一溶剂中而使其接触;或
iv)通过使所述材料由于重力和/或离心力的作用沉降在所述第一溶剂中,使所述压碎或粉碎的植物原材料与所述第一溶剂接触。
本领域技术人员理解,根据在接触装置中产生的剪切量,所有这些使粉碎或粉碎的植物材料与第一溶剂接触的手段和机制可以分成两个不同的类别。在低剪切操作模式中,如在填充床、膨胀床或流化床中,或在重力沉降期间,接触装置中的剪切力和速度梯度处于低水平,以致于压碎或粉碎的植物原材料的完整性基本上得以保持,并且压碎或粉碎的植物原材料和第一溶剂之间的传质,主要由可溶性组分从压碎或粉碎的植物原材料扩散到停滞或缓慢流动的第一溶剂中主导,而不溶性组分如纤维和脂质基本上保持完整并被截留在固体基质中。相反,当使用高剪切操作模式时,如在STR中,其中由于搅拌引起的剪切率可能大大超过1001/s,特别是在搅拌器附近,由于搅拌装置产生的速度梯度和/或湍流的破坏性作用,通常不能保持压碎或粉碎的植物原材料的完整性。实际上,压碎或粉碎的植物材料的颗粒可能会破碎,随后将组成成分如细粒和脂质释放到液相中。这些细粒和脂质的释放可能对提取步骤更下游的工艺具有负面影响。在高剪切装置中蛋白质和脂质的共提取也可导致微乳液的形成,其中蛋白质、脂质、固体细粒和抗营养因子将被捕获在油脂状无定形体中,这对处理器造成严重问题,并使得蛋白质的分离(fractionation)、纯化和分离(isolation)的过程不可行。因此,在另一个实施方式中,在低剪切条件下进行步骤b)中的水溶性组分的萃取。
在一个可能的实施方式中,提供了一种方法,其中在步骤b)和c)之间,优选使用离心、过滤或其组合,除去步骤b)中获得的第一固体部分和第一液体部分的混合物中存在的至少部分的脂肪、油和脂质。在另一个优选的实施方式中,在步骤c)中第一液体部分(11)与第一固体部分(12)的分离,使用选自离心、沉降、过滤和/或其组合的技术进行。
在步骤d)中向第一液体部分浓缩物(11b)或第一固体部分(11)中加入第二溶剂将对液相的极性有影响,并可能改变蛋白质的溶解度,从而诱导蛋白质沉淀,和/或也可能分别改变蛋白质或蛋白质-纤维基质与其它组分和杂质如糖类、酚类化合物和/或异黄酮之间的相互作用的性质,使得这些杂质可分别从蛋白质或蛋白质-纤维基质中解离,并可分别在随后的固液分离步骤中从蛋白质分离物或蛋白质-纤维基质中除去。因此,在步骤d)中添加第二溶剂和替换第一溶剂,可促进从与其相关的杂质中有效分离和/或纯化,其中当蛋白质或蛋白质-纤维基质分别在第一(含水)溶剂中时,所述杂质不易去除。
本方法步骤d)中所用的第二溶剂的量,将由蛋白质在第一溶剂中的浓度、蛋白质在第一溶剂和第二溶剂的混合物中的溶解度以及与第二溶剂相关的变性作用来决定。在一个实施方式中,醇第二溶剂的量应使得步骤b)中使用的第一溶剂与步骤d)中使用的第二溶剂的重量比达到1:10至1:1,优选1:3至2:3。
在步骤d)中添加第二含醇溶剂后,产生混合物,其中蛋白质或蛋白质-纤维主要作为沉淀的第二固体部分(分别为22、24)存在,并且其中在液相中发现可溶性化合物如糖类、酚类化合物、异黄酮和其它杂质,所述液相是废第二含醇溶剂(21、23)。如果存在脂肪和脂质,则其将主要与固体部分(22,24)有关。
然后在步骤e)中,使用选自过滤、沉降、离心及其组合的技术从混合物中分离固体部分(22,24),以获得第二固体部分和第二液体部分。本领域技术人员理解,第二固体部分(22,24)包含痕量的在该方法中使用的溶剂,例如水和与水混溶的醇。第二固体部分也可含有在该方法的其它步骤中未除去的脂肪和脂质的残余物。
本领域技术人员还理解,在分离第二固体部分(22,24)之后,为了进一步提高蛋白质产物的纯度,可以使用另外的洗涤步骤,由此可以将醇第二溶剂的新鲜部分加入到第二固体部分(22,24),随后是选自过滤、沉降、离心及其组合的合适的固-液分离步骤。因此,在可能的实施方式中,提供了一种方法,其中在步骤e)之后和步骤f)之前,使用含醇第二溶剂对第二固体部分(22,24)进行另外的洗涤步骤,随后进行固液分离步骤。
然后,在步骤f)中得到的固-液混合物,优选在步骤g)中,使用过滤、沉降或离心分离,被分离成含有废共沸溶剂(31,33)的第三液体部分,和第三固体部分(32,34)。因此,在常规的实施方式中,可以提供这样的方法,其中步骤e)或g)中的分离包括选自过滤、沉降、离心及其组合的技术。
由于通过本文公开的共沸第三溶剂的作用除去脂质和其它非极性杂质,蛋白质或蛋白质-纤维基质的纯度进一步提高。本领域技术人员还理解,在分离第三固体部分(32,34)之后,为了进一步提高纯度和/或进一步除去第一和第二溶剂的残余物,可以使用另外的洗涤步骤,由此可以将共沸第三溶剂的新鲜部分加入到第三固体部分(32,34)中,随后进行选自过滤、沉降、离心及其组合的合适的固-液分离步骤。因此,在一个可能的实施方式中,提供了一种方法,其中在步骤g)之后和步骤h)之前,使用共沸第三溶剂对第三固体部分(32,34)进行另外的洗涤步骤,随后进行固液分离步骤。当然,根据如上所述的本公开的一般有利原则,在优选的可能实施方式中,在任何一个洗涤步骤中消耗的共沸溶剂也可直接再利用或再循环,或者,送至SRP用于共沸溶剂回收。
最后,将第三固体部分(32,34)进行干燥步骤h),所述第三固体部分分别为未干燥的蛋白质分离物或未干燥的蛋白质-纤维产品,其仍然是湿的和/或浸泡在共沸第三溶剂中,所述干燥步骤优选通过选自真空干燥、接触干燥、对流干燥、喷雾干燥、过热蒸汽干燥和/或它们的组合的技术进行。在干燥步骤h)之后,获得最终的富含植物蛋白质的产品,其中,优选地,基于第四固体部分的总干重,蛋白质分离物(42)的蛋白质含量超过90重量%,并且蛋白质-纤维产品(44)的蛋白质-天然纤维含量超过30重量%。
值得注意的是,本文公开的方法不需要使用极端条件,例如高温或pH的较大变化。相反,在整个公开的方法中,蛋白质所暴露的温度优选保持在0-70℃的范围内,更优选0-55℃之间,更优选4-50℃之间,更优选4-20℃之间,最优选10-20℃之间,而pH优选保持在4-8之间的范围内,尽管也可能包括在不同pH值下的洗涤步骤,因为在一些应用中,包括在高、碱性pH下的另外洗涤步骤可能是有帮助的,例如洗去可溶于碱性溶液的组分如蛋白质和脂质,同时保持基质的纤维组分完整。
如上所述,所公开的用于获得富含植物蛋白质的产品(42,44)的方法已经被优化用于食品,特别是由于溶剂的选择。因此,在一个重要的另外的方面,本文提供了本文公开的方法及其所得的富含植物蛋白质的产品(42,44)的用途,以获得用于消费的植物蛋白质,特别是用于人类食品或动物饲料。
已经参考如上所述的不同实施例描述了本公开的基本概念。但是应当认识到,易于根据本领域技术人员公知的各种修改和替换形式,来改变这些实施例。
此外,为了正确理解本文及其权利要求,应当理解,动词“包括”及其动词变化以其非限制性意义使用,以表示包括该词之后的项目,但不排除未具体提及的项目。此外,通过不定冠词“一(a)”或“一个(an)”不排除存在多于一个组分的可能性,除非上下文明确一个组分存在且仅存在一个组分。因此,不定冠词“一”或“一个”通常表示“至少一个”。
实施例
实施例1-制备油菜籽蛋白质分离物Raptein
进行标记为S-157和S-159的两个试验,并比较获得的RPI(油菜籽蛋白质分离物,Rapeseed Protein Isolate)样品的化学纯度和功能性。在生产样品S-157RPI的试验中,回收的共沸物用作第三溶剂,其组成为:~76%w/w的乙酸乙酯:<0.1%的水,余量为(adlimitum)乙醇。
在生产样品S-159RPI的试验中,使用工业纯度(>96%)w/w的乙酸乙酯作为第三溶剂。
从用于生产蛋白质分离物和蛋白质-纤维产物的废溶剂中回收共沸物。在20L旋转蒸发器(Heidolph)中,在40℃的温度和140mbar的绝对压力下完成回收。用于回收共沸物的废溶剂混合物的主要组分是:乙酸乙酯、乙醇、水、来源于油菜籽的脂质,例如油和磷脂,以及在该方法中使用的盐:NaCl,CaCl
起始材料由油菜籽加工公司提供。在S-159的情况下,饼状物是常规质量的冷压油菜籽饼状物(具有种皮/壳),而在S-157的情况下,饼状物是没有种皮/壳的冷压油菜籽仁。
这两个试验的起始材料的组成如下(%w/w DW,除了含水量):
获得油菜籽蛋白质分离物的方法的方案对于样品S-159和S-157是相似的,并描述于下文。
提取步骤
将6kg油菜籽饼状物悬浮于提取介质中:0.9%NaCl,0.1%Na
净化步骤
用0.1N NaOH将收集的粗提取物调节pH至pH=6.8,在STR中温育20分钟后,在桶式离心机中于4000G下对提取物进行固液分离,回收澄清的提取物作为上清液相。
[注意:在ALSEOS装置中的提取步骤可以在搅拌釜反应器中重复,通过将6kg油菜籽饼状物加入80L提取介质中,并在温和搅拌下(使用锚式或水翼叶轮的刚好悬浮的条件)在初始pH=5.8下在15℃下温育浆液4小时,接着将pH调节至pH=6.8,接着使用合适的技术例如在4000xG的桶式离心机进行固-液分离步骤,以回收澄清的提取物作为上清液相。]
UF/DF步骤
然后在采用10kDa(中空纤维,GE,UFP-10-E-8A)的错流膜过滤单元中,使用软化水作为渗滤介质,对澄清的提取物进行UF/DF步骤。渗滤体积的量为澄清提取物的原始体积的约2倍。在达到低于7mS/cm的电导率后,将截留物浓缩至最终截留物中干固体含量为约5%。
乙醇提取(Ethanolic)步骤
UF/DF步骤的浓缩UF截留物,在试验S-159中用乙醇(纯度>92%w/w)处理,在试验S-157中用乙醇(纯度>96%)处理。乙醇与UF截留物的比例为1.9:1(w/w)的浓度。在STR容器中,在剧烈搅拌下,在15分钟内完成乙醇的添加。温度保持在5℃。在另外15分钟的温育时间后,使用桶离心机以4000xG将混合物进行20分钟(min)的固-液分离步骤。取湿的沉淀物用于进一步处理,并弃去上清液。
乙酸乙酯洗涤步骤
将来自乙醇提取步骤的湿沉淀物与乙酸乙酯溶剂(溶剂3)以5:1溶剂混合,溶剂3:湿沉淀物5:1。
对于样品(S-159),使用工业质量(>96%w/w)的乙酸乙酯。
对于样品(S-157),使用回收的共沸物(76%(v/v)的乙酸乙酯,<0.1%的水,余量为(ad limitum)乙醇。
在STR装置中,在剧烈搅拌下,完成第三溶剂的添加。在另外15分钟的温育时间之后,将所得混合物在桶式离心机中以4000xG进行20分钟的固-液分离。将湿沉淀物用于进一步处理,并弃去上清液。
干燥步骤
对从乙酸乙酯洗涤步骤获得的湿沉淀物进行干燥步骤,包括:在真空盘式室干燥器中,在400mbar的绝对压力和40℃下,将所述饼状物干燥至约1%的含水量,然后研磨/校准所述饼状物以获得40-150微米的PSD(粒度分布,Particle Size Distribution),然后使校准的粉末在50mbar的真空室中在40℃下另外干燥48小时。
对样品S-157和S-159进行相同的步骤。
分析获得的样品的化学组成和功能性。
结果列于下表1中。
表1-实施例1
*由差分计算的:100%-[蛋白质%+水分%+脂肪%+灰分%+纤维%]
结论
油菜籽蛋白质分离物的两个样品都符合关键质量属性如化学纯度要求的范围,并且在功能特性方面是相当的。
实施例2-油菜籽蛋白质-纤维产品Raptein
原料:
试验S-157和S-159的净化步骤之后,在桶式离心机中的固-液分离步骤之后的沉淀相(湿的饼状物)用于生产分别标记为S-157PFP和S-159PFP的油菜籽蛋白质-纤维产品样品。
盐洗步骤
在STR容器中,在以下条件下对含有约15-20%干重的沉淀物进行盐洗:pH=4(用0.1HCl调节),温度大约15℃,介质为2%NaCl水溶液,比例5:1(w/w介质:沉淀物),在温和搅拌(刚好悬浮的条件)下温育30分钟。然后,在桶式离心机中,在4000xG下将混合物进行20分钟的固-液分离步骤。取出沉淀物用于进一步处理,并弃去上清液。
醇洗涤步骤
将从盐洗步骤获得的沉淀物(湿的饼状物)与纯度为(70%v/v,64%w/w)的乙醇混合,余量为(ad limitum)水。比例5:1(w/w)乙醇:沉淀物。
在STR中在温和搅拌(刚刚悬浮的条件)下混合,15分钟温育时间,温度约15℃,然后在桶式离心机中以4000xG,对混合物进行20分钟的固-液分离步骤。取出沉淀物用于进一步处理,并弃去上清液。
第一乙酸乙酯洗涤步骤
将来自醇洗涤步骤的沉淀物与第三溶剂混合。在S-159的情况下,它是乙酸乙酯(>96%w/w)。在S-157的情况下,回收了乙酸乙酯(76%v/v)和乙醇的共沸混合物。该溶剂混合物中的水含量<0.1%。比例:5:1(第三溶剂:沉淀)。
在STR中在剧烈搅拌下混合,15分钟温育时间,温度约15℃,然后在桶式离心机中以4000xG对混合物进行20分钟的固液分离步骤。取出沉淀物用于进一步处理,并弃去上清液。
第二乙酸乙酯洗涤步骤
将来自第一乙酸乙酯洗涤步骤的沉淀物与第三溶剂混合。在S-159的情况下,它是乙酸乙酯(96%w/w)。在S-157的情况下,它是回收的乙酸乙酯(76%v/v)和乙醇的共沸混合物。该溶剂混合物中的水含量<0.1%。配比:5:1(第三溶剂:颗粒)。
在STR中在剧烈搅拌下混合,15分钟温育时间,温度约15℃,然后在桶式离心机中以4000xG对混合物进行20分钟的固液分离步骤。取出沉淀物用于进一步处理,并弃去上清液。
干燥步骤
将来自第二乙酸乙酯洗涤步骤的湿的沉淀物置于40℃和绝对压力为400mbar的真空室干燥器中,直至含水量达到<1%(w/w)。然后在研磨机中研磨/校准该材料,以获得40-150微米的PSD(粒度分布)。然后将该材料置于40℃和绝对压力为50mba的真空室干燥器中24小时。
分析蛋白质-纤维产品的样品并比较其化学组成和功能性。
结果列于表2。
表2-实施例2
/>
结论
油菜籽蛋白质-纤维产品的两个样品都满足关键质量属性例如化学纯度要求的目标范围,并且在功能特性方面是相当的。
实施例3-使用回收的共沸物以不同溶剂组合物进行的中试试验(Pilot Runs),用于生产富含油菜籽/大豆蛋白质的产品,并评价所述产品的关键质量特性如化学纯度
目标和实验设置:
中试试验的主要目的是进一步证明,尽管溶剂组合物和回收被大大简化,但是甚至从含有大量油、脂肪和/或脂质的富有挑战性的植物材料,例如从油籽、豆科植物(legumes)或扁豆,也可以获得高质量的富含植物蛋白质的产品。
为了实现这一目的,我们用乙酸乙酯(EA)洗涤步骤所需的5种不同溶剂组合物进行实验,所有这些溶剂组合物都用于获得蛋白质-纤维产品,而其中4种用于获得蛋白质分离物产品。对于两种不同的原材料,即脱皮油菜籽饼(DRC)和大豆(在合适的情况下,进一步分别称为油菜籽或富含大豆蛋白质的产品),以相同的方式进行实验。然后,使用根据本文所述的方法获得的富含油菜籽/大豆蛋白质的产品,即使用回收的共沸物代替纯溶剂,产生与化学组成和/或功能性质相关的分析数据。
乙酸乙酯的回收
从最初用于蛋白质分离物和蛋白质-纤维浓缩物生产方法的废溶剂中回收乙酸乙酯,如NapiFeryn BioTech有限责任公司(波兰)的申请WO2019011904和WO2020016222中所公开的。在20L旋转蒸发器(Heidolph)中,在40℃的温度和140毫巴的绝对压力下进行回收。用于回收共沸物的废溶剂混合物的主要组分是乙酸乙酯、乙醇、水、来源于油菜籽的脂质类,例如油和磷脂,以及用于该方法的盐(例如NaCl)。回收的溶剂(即来自20LHeidolph蒸发器的轻质馏出物)的平均组成示于下表3中。
表3-回收的溶剂的平均组成(表4中的溶剂组合物2)
详细步骤描述
两种主要的蛋白质产物:在加工批次R-20、R-21中获得蛋白质分离物和蛋白质-纤维浓缩物。
进行的实验旨在在EA(乙酸乙酯)洗涤步骤中,用共沸物代替纯溶剂。不同的溶剂组合物示于下表4中。
表4-溶剂组合物[%w/w]
*在绝对压力50-200mbar和温度40℃的范围内运行600L的中试蒸发器。
根据以下描述的方法进行所述方法。
在每个方法开始时,制备原料:将R-20用全脂大豆和R-21用脱皮菜籽饼状物(dehulled rapeseed cake,DRC)磨碎并过筛,通过将盐溶解在RO水中制备介质。溶液含有氯化钠、亚硫酸钠、苯甲酸钠和乙醇。
1)大豆:R-20
该方法从萃取步骤开始,其中加入原料R-20并与稀盐溶液(介质)温和混合。在此阶段期间,获得原料悬浮液。控制浆液的温度并保持在6℃的水平,从大豆浆液中提取蛋白质持续24小时。将得到的RAE(提取后的残余物)离心分离成3个部分:脂肪(弃去)、CE1(粗提取物-加工成分离物)和谷粒(浓缩物的起始材料)。
CE在进入错流过滤系统的途中通过1μm过滤器,用于UF/DF(超滤和渗滤)。在过滤的第一步中,进行预浓缩,然后进行三种不同渗滤因子(乙酸盐缓冲液,0.9%NaCl,软化水)的渗滤步骤。此后,进行最终浓缩。结果,CE浓缩了几乎4倍,而其渗滤因子等于10,得到固体含量为约10%(w/w)和电导率为约5mS/cmUF的截留物。
然后将UF截留物进行乙醇诱导沉淀(EIP)。该工艺步骤对截留物使用较低的温度(<30℃),在达到该温度之后,将冷却的乙醇溶液(90%乙醇+10%水)逐渐加入到材料中,同时混合,以沉淀蛋白质。
醇的体积通过UF/DF浓缩物的量和70%体积/体积=64%(w/w)的最终浓度的设定点来确定。缓慢地进行乙醇添加以避免蛋白质变性。
在混合约25分钟(包括定量给料时间)后,将所得乙醇悬浮液进料至离心机中。SLS步骤后,有两个部分:富含蛋白质的残余物(进一步处理)和含有约64%乙醇的上清液-母液1(ML1)(随后用于浓缩物生产线上的乙醇洗涤)。
来自EIP步骤的固体残余物被分成四部分,并且其每一个随后与不同的溶剂混合:纯乙酸乙酯或根据表4中所列组成的不同共沸物。
溶剂的体积由蛋白质残余物的量确定。然后将所得悬浮液转移至离心机,在那里将其分离成固体和液体部分。SLS步骤后,鉴于与其高脂肪含量有关的材料特性,重复EAW(乙酸乙酯洗涤)。将所得富含蛋白质的饼状物转移至干燥阶段(如下所述)并将液体部分储存用于溶剂回收步骤(SRP)或用于浓缩物生产线上。
当从提取后的残余物(RAE)中获得谷粒时,开始蛋白质纤维浓缩物的生产。然后,用乙醇(ML1)和纯乙酸乙酯或共沸物作为溶剂,使谷粒进行4次洗涤步骤。第一洗涤步骤使用ML1,其与谷粒混合。然后将所得悬浮液转移至离心机,在那里将其分离成固体和液体部分。之后将乙醇谷粒(EtOH Kernel)分成5个部分,每个部分与不同的溶剂混合:纯乙酸乙酯或组成如表4所示的共沸物。以与分离物的EAW相同的方式进行下一步骤。SLS步骤后,鉴于材料的特性,EAW重复两次(总共3次EA洗涤)。进行第二次和第三次乙酸乙酯洗涤以除去过量的脂质。将所得富含蛋白质-纤维的饼状物转移至干燥阶段,并将液体部分储存用于SRP。
2)脱皮的油菜籽饼状物(DRC):R-21
对于R-20,该方法从提取步骤开始,这时加入原料R-21并与稀盐溶液(介质)温和混合时。在此阶段期间,获得原料悬浮液。控制浆液的温度并保持在6℃的水平。
将DRC浆液泵入ALSEOS单元(描述于WO2016093698),以开始从浆液中提取粗提取物的过程。在处理过程中,将盐溶液不断地加入到ALSEOS装置中,并将粗提取物收集在搅拌釜反应器中。蛋白质提取持续6小时。
在提取步骤(在收集了大于1CV=200L的粗提取物之后)中,将来自ALSEOS装置的RAE进料至离心机,在那里将混合物分离成两个部分-水基上清液(CE2与CE1合并)和谷粒(进一步加工成浓缩物)。
对合并的粗提取物(CE1&CE2),加入0.5M氢氧化钠将其pH值调节至6.8。将提取物加热至45℃,然后重复将pH调节至6.8的值。在下一方法步骤中,通过在回路中通过5μm过滤器来净化CE,然后通过1μm过滤器进入错流过滤系统中,在错流过滤系统中CE被引导至用于UF/DF(超滤和渗滤)。在过滤的第一步中,进行预浓缩,然后采用具有四种不同的渗滤因子(乙酸盐缓冲液,2%NaCl,0,45%NaCl,软化水)的渗滤步骤,然后进行最终浓缩。结果,CE被浓缩了几乎4倍,而其渗滤因子等于42,产生固体含量为约6%(w/w)和电导率为约4mS/cm的UF截留物。将该UF截留物的pH值调节至6.8,然后离心以除去残留的植酸盐。然后将含有蛋白质的截留物上清液进行乙醇诱导沉淀(EIP)。该方法步骤需要截留物上清液在较低的温度(<30℃)下,在达到该温度后,将冷却的乙醇溶液(90%乙醇+10%水)加入到持续混合的物质中以沉淀蛋白质。醇的体积通过UF/DF浓缩物的量和70%体积/体积=64%(w/w)的最终浓度的设定点来确定。缓慢加入乙醇以避免蛋白质变性。
在混合约25分钟(包括给料时间)后,将所得乙醇悬浮液进料至离心机。SLS步骤后,有两个部分:富含蛋白质的残余物(进一步处理)和含有约64%乙醇的上清液-母液1(ML1)(随后用于浓缩物线上的乙醇洗涤)。
来自EIP步骤的固体残余物被分成四部分,每一部分与不同的溶剂混合:纯乙酸乙酯或如表4所示的共沸物,溶剂的体积由蛋白质残余物的量确定。然后将输出的悬浮液转移至离心机,在那里将其分离成固体和液体部分。将所得富含蛋白质的饼状物转移至干燥阶段(如下所述)并将液体部分储存用于溶剂回收步骤(SRP)或用于浓缩物的生产线上。
当从RAE获得谷粒时,开始蛋白质纤维浓缩物的生产。然后,对谷粒进行5个洗涤步骤,使用盐溶液、乙醇(ML1)和纯乙酸乙酯或共沸物作为溶剂。开始时,对谷粒进行两次盐洗步骤。第一次是将谷粒与2%NaCl混合,调节pH值至4.0,并在离心机中分离所得悬浮液,得到两个部分:一部分含有谷粒,一部分含有上清液。弃去上清液,用0.9%NaCl(pH=4.0)、对谷粒进行第二次盐洗。接下来的洗涤步骤使用ML1,其与谷粒混合。然后将所得悬浮液转移至离心机,在那里将其分离成固体和液体部分。之后将乙醇谷粒分成5个部分,每个部分与不同的溶剂混合:纯乙酸乙酯或(根据表4的)共沸物。以与分离物的EAW相同的方式进行下一步骤。SLS步骤后,重复EAW(总共2次EA洗涤)。进行第二乙酸乙酯洗涤以除去过量的脂质。将所得富含蛋白质-纤维的饼状物转移至干燥阶段,并将液体部分储存用于SRP。
3)固体处理:干燥、磨粉、校准、包装(R-20,R-21)
RPI(蛋白质分离物)和RPC(蛋白质-纤维浓缩物)被引导至三个干燥阶段。
在第一干燥步骤中,除去大部分溶剂。然后,使用加湿空气除去残留溶剂。在最后阶段中,干燥产物直到其达到93%DW的设定值。
第一干燥步骤在盘式真空干燥器中在真空下进行。干燥温度等于60℃,压力设定为140mbar,并且根据材料的量,该过程的持续时间为约16-48小时。在下一步骤中,将材料研磨并筛分以确保粒度低于150μm。
第二干燥步骤被设计成通过使用预加增湿空气作为干燥介质,用水蒸气取代残余溶剂。为促进该过程,将材料置于配备有水鼓泡器的真空盘式干燥器中。将压力从640mbar摆动到140mbar使得空气能够半连续流动。温度保持在40℃,持续时间通常为72小时。
在最后(第三)干燥步骤中,将压力设定为800mbar,同时将温度升至60℃,持续5小时,之后将压力降至40mbar,再持续5小时。设定最后两个步骤以确保材料的湿度达到5-7%w/w的设定值,对成品取样以用于进一步分析并包装在贴标签的自立袋中(Doypack)。
原料的特性示于下表5中。
表5-原料
结果
中试实验的结果示于表6-12和图7-46中。
表6-蛋白质分离物产品的结果(大豆(Soybean))
-*未测定
表7-蛋白质分离物产品的结果(DRC)
-*未测定
表8-蛋白质分离物功能特性
*范围5.8-7.2
表9-蛋白质-纤维浓缩物产品结果(大豆)
-*未测定
表10-蛋白质-纤维浓缩物产品的结果(DRC)
-*未测定
表11-蛋白质-纤维浓缩物的功能特性(大豆)
*样品的pH范围:3.8-4.2
表12-蛋白质-纤维浓缩物功能特性(DRC)
*样品的pH范围:3.8-4.2
结论
本文提供的采用不同溶剂组合物的中试试验证明,使用回收的共沸物代替纯溶剂,在较好的质量属性内,高效生产富含油菜籽/大豆蛋白质的产品。产生了蛋白质产物并分析了其组成和功能性。基于这些结果,得出以下结论:
1.对于每种原料(大豆,DRC),用共沸物得到7种产物,用纯溶剂得到2种产物,然后在一种产物类型内对其进行比较(蛋白质分离物或蛋白质-纤维浓缩物);
2.所有蛋白质分离物样品(大豆,DRC)都满足关键质量属性如化学纯度的所需要求,并且在功能特性方面是相当的。
3.使用纯度较低的溶剂(乙酸乙酯含量高于70%的共沸物)对产物的测定的化学组成或其功能性没有显著影响。因此,可以得出结论,通过进一步的研究,建议使用纯度较低的溶剂用于工业化规模生产,能带来成本降低。与先前已知的方法相比,满足这些目标可以从根本上简化溶剂回收过程,同时提供类似的高质量植物蛋白富集产品。
4.另外,用具有较高水含量的溶剂洗涤的蛋白质-纤维产品(组合物5)具有较低的灰分含量,这被认为是积极的方面并且可能与盐的溶解有关。
分析方法描述
·干物质含量
将样品(2.0±0.5g植物原材料,1.0±0.5g蛋白质分离物/浓缩物)置于105℃温度下的水分分析仪中,由干燥前后样品重量的差异测定含水量。
·蛋白质含量
1)实施例3中的蛋白质含量根据AOAC Official Method 992.23(1992)测定。用Dumas燃烧法测定有机基质中总氮含量。在氧气氛中,将样品高温燃烧,氮定量转化为N
2)实施例1和2中的蛋白质含量是根据AOAC Official Method 2001.11(2005)通过凯氏定氮方法测定的。使用转化因子6.25来确定蛋白质的量(重量%)。
·灰分含量
根据WE 152/2009进行灰分含量分析(在原材料、蛋白质分离物和浓缩物中)。1g样品逐渐加热至550℃。然后将样品在烘箱中在600℃下焚化。
·脂肪含量
根据Weibull-Stoldt方法测定脂肪含量。样品(植物原材料和蛋白质分离物/浓缩物)用10%(v/v)HCl溶液水解,并使用红外加热系统加热至300℃。在提取体系中用石油醚提取水解的样品。
脂肪含量(X)根据下式计算(重量%):
其中:
a是干燥后包括样品脂肪的玻璃样品管的质量(g);
b是干燥后的玻璃样品管的质量(g);以及
c是样品(g)的质量。
·酚含量
根据Siger,et.al.(2004)和调整后的
使用如下所述的梯度条件通过HPLC/UV-VIS分析多酚提取物。
表13-酚类化合物的色谱分离参数
相相流动:1ml/min
波长:λ=320nm
注射:50μl
柱:生物液(Bionacom)流速C18(150mm×4.6mm,5μm)
·植酸盐含量
根据植酸(phytic acid(phytate))/总磷测定方法K-PHYTY 08/14,采用植酸(总磷)测定试剂盒Megazyme,进行植酸盐含量分析(在原料、蛋白质分离物和浓缩物中的)。
·总纤维
根据AOAC Official Method30991.43,Total,soluble,and insolubledietaryfibre in foods,Enzymatic-gravimetric method,MES-TRIS buffer,USA,1994,测定总纤维的含量(原料和蛋白质浓缩物中的)。
用于蛋白质分离物的功能性测试的方法
·分散性
根据以下步骤进行测定:将蛋白质分离物(最终蛋白质浓度5%w/v)称重到150ml烧杯中。加入10ml去离子水。使用磁力搅拌器在约500rpm下搅拌1小时。使用Dumas法(200μl,重复3次)测定分散的蛋白质含量。
用下式计算分散性:
其中:
溶液中的蛋白质浓度是指:
·氮溶解度(NS):
根据以下步骤进行测定:将蛋白质分离物(最终蛋白质浓度:5%w/w)一式两份称重到150ml烧杯中。向每个烧杯中加入10ml测试溶剂。搅拌样品直到粉末完全分散。将pH调节至所需值(0.1MNaOH和0.1M HCl)。在室温下搅拌1小时。在该时间结束时,用移液管吸取200μL等分试样(直接从烧杯中吸取)以使用Dumas法测定蛋白质浓度。然后,将1mL从烧杯转移至微量离心管,重复六次,并将其中的3个以13000rpm离心10分钟。小心地从离心机中取出并用移液管吸取200μL上清液等分试样以测定蛋白质含量(Dumas方法)。将剩余的3个重复放置在水浴(85℃)中30分钟。从水浴中取出样品并静置5分钟。以13000rpm离心样品10分钟。小心地从离心机中取出并用移液管吸取200μL上清液等分试样以测定蛋白质含量(Dumas方法)。
根据下式计算氮溶解度:
·乳化能力(EC):
根据以下步骤进行测定:称重蛋白分离物(最终蛋白浓度:1%w/w)至50ml离心管中。加入水,得到25g检测溶液。通过涡旋混合10秒。在室温下以450rpm搅拌1小时。将获得的溶液转移至烧杯中并测定其电导率。用油菜籽油在7200rpm下匀化(Homogenize)5分钟,并测定所得乳液的电导率。在均化的同时逐渐加入油,直到乳液的电导率突然下降,观察到乳液的转化。乳化能力表示为每克蛋白质匀化的油的克数。
根据调整(在烧杯中:使用25g 1%溶液)后的Karaca A.C.et al.,Food ResearchInternational;Emulsifying properties of chickpea,faba bean,lentil and peaproteins produced by isoelectric precipitation and salt extraction,2011,44,2742-2750分析乳化能力(EC)。
·发泡能力(FC)和发泡稳定性(FS)
根据以下步骤进行测定:将蛋白质分离物(最终蛋白质浓度:1%)称重到烧杯中并加入99ml去离子水。在磁力搅拌器上搅拌5分钟。在10000rpm下匀化1分钟。将获得的泡沫转移至量筒并读取泡沫体积。5分钟、15分钟、30分钟、60分钟和120分钟后读取体积。
V
V
V
根据调整后(用1%溶液)的Khattab R.Y.,Arntfield S.D.;Functionalproperties of raw and processed canola meal;LWT-Food Science and Technology42(2009)1119–1124分析发泡能力(FC)和泡沫稳定性(FS)。
·最低胶凝浓度(LGC)
根据以下步骤进行测定:称量适量的样品以获得离心管所需的浓度。加入30ml去离子水。涡旋几秒钟。将样品置于超声波清洗10分钟。在450rpm下搅拌20分钟。将20ml所得溶液转移至离心管中。在80℃水浴中加热样品1小时,在冷水浴中冷却10分钟。在4℃冷却2小时后,将离心管倒置1分钟,检查样品是否凝胶化。根据上述说明,通过测试不同浓度(以1个百分点的间隔)来找到最小胶凝浓度。
根据调整后(将20ml转移至新管中)的Khattab R.Y.,Arntfield S.D.;Functional properties of raw and processed canola meal;LWT-Food Science andTechnology 42(2009)1119–1124测定对凝胶化进行研究。
用于蛋白质浓缩物的功能性测试的方法
·吸水吸油能力(WAC和OAC)
根据以下步骤进行测定:将1g蛋白质浓缩物称量到50ml离心管中,一式三份。加入10g去离子水或油菜籽油,并振摇数次以分散样品。以450rpm搅拌1分钟。在22℃下4000g离心30分钟,轻轻地倒出所得上清液。将离心管倒置10分钟,使剩余的上清液流下。称量具有湿沉淀物的离心管。
A-空离心管的质量
B-检测样品的质量
E-包括湿沉淀物的离心管的重量
参考文献
J.P.D.Wanasundara et al.,,Oilseeds and fats,Crops and Lipids,2016,23(4),D407
J.P.D.Wanasundara,Critical Reviews in Food Science and Nutrition,2011,51(7),635-677
L.Campbell et al.,Canola/Rapeseed Protein:Future Opportunities andDirections—Workshop Proceedings of IRC 2015,Plants 2016,5,17
Manashi Das Purkayastha et al.,2013,J.Agric.Food Chem.,2013,61,10746-10756;dx.doi.org/10.1021/jf403657c|
Manashi Das Purkayastha et al.,2014,J.Agric.Food Chem.,2014,62,7903-7914dx.doi.org/10.1021/jf5023803|
G.L.Miller,Analytical Chemistry,1959,31,pp 426–428,10
V.A.McKie and B.V.McCleary,Journal of AOAC International,2016,99(3),738–743.
J.Vioque et al.,Journal of the American Oil Chemists'Society,2000,77(4),447–450
M.Garcia-Vaquero et al.,Food Research International,2017,99(3),971–978
A.Siger et al.,
- 含有脂肪间充质干细胞外泌蛋白提取物的干细胞组合物及提取物的制备方法及组合物的应用
- 绞股蓝提取物和雪松醇组合物及在防脱育发领域的应用
- 栀子提取物和氧代戊二酸组合物及在防脱育发领域的应用
