生物传感器
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及一种生物传感器。
背景技术
生物传感器是指可以通过使待分析的对象物质(分析物)与具有选择性特异性的生物受体发生反应并使用信号转换器测量其反应程度来确定对象物质的存在或量的装置或元件。
生物传感器根据变换方法分为电化学传感器、热传感器、光学传感器等,并且近年来,根据待分析的对象物质的类型,生物传感器的名称多种多样,例如糖传感器、细胞传感器、免疫生物传感器、DNA芯片等。
其中,电化学传感器由于能够将生物样品的量转换成易于处理成信息的电信号而被广泛用作生物传感器的变换方法。
韩国专利申请公开第10-2004-0105429号涉及一种使用血液作为样本的电化学生物传感器,并且提供了一种能够减小取决于血细胞比容量的测量误差的血糖传感器。
然而,与使用血液的血糖传感器相比,使用唾液、汗液和眼泪等体液进行非侵入式血糖浓度测量需要大量的样本。然而,由于体液的量有限,并且体液中含有极少量的葡萄糖,因此难以从体液中测量糖浓度。
为了准确测量少量体液中的糖浓度,需要提高传感器的分析分辨率,并且为了提高体液分析分辨率,必须施加大量的酶,或者必须使用昂贵的电极材料。然而,酶的施加量有限,并且这种传感器的大规模生产存在困难。因此,需要开发低成本、制造简单并且具有改进的体液分析分辨率的生物传感器。
发明内容
技术问题
本发明是为了解决上述现有技术的问题并且旨在提供一种即使使用极少量的体液也能够测量糖的生物传感器。
具体地,为了解决利用体液的非侵入式糖传感器比血糖传感器需要更多样本量的问题,本发明提供一种具有改进的分析分辨率并且即使在使用极少量的体液时也具有改进的浓度测量准确度的生物传感器。
然而,本发明要达到的目的并不限于上述目的,本领域技术人员通过下面的描述可以清楚地理解上面未提及的其他目的。
技术方案
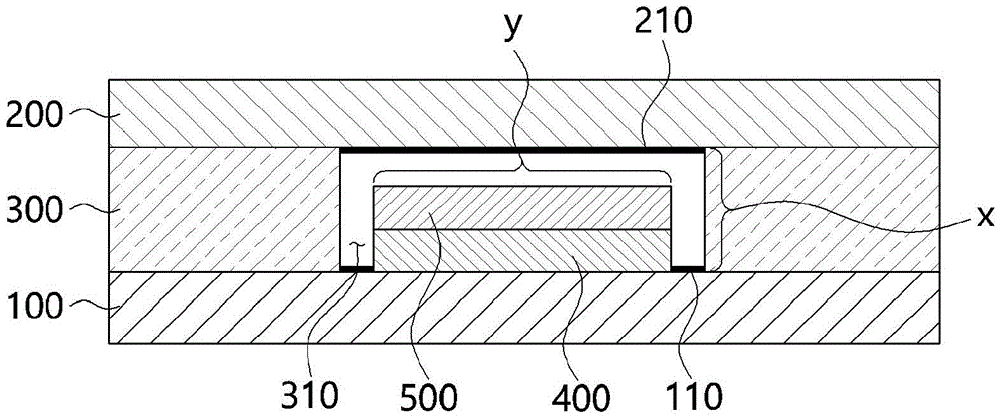
本发明提供一种生物传感器,包括:第一基板,在所述第一基板的一侧具有疏水性表面;第二基板,所述第二基板布置于所述第一基板上,并且在所述第二基板的一侧具有亲水性表面;支撑层,所述支撑层形成为具有预定高度,以在所述第一基板的所述疏水性表面和所述第二基板的所述亲水性表面之间提供空间;一个或多个电极层,所述电极层形成在所述第一基板上的所述空间内;以及酶反应层,所述酶反应层形成在所述电极层上。
根据本发明的一个实施例,支撑层可具有大于约25μm且小于约300μm的高度(y),并且支撑层可由聚合物树脂制成。
根据本发明的一个实施例,酶反应层可以包括选自由氧化酶和脱氢酶组成的组中的一种或多种。例如,氧化酶可以包括选自由胆固醇氧化酶、乳酸氧化酶、抗坏血酸氧化酶以及醇氧化酶组成的组中的至少一种,并且脱氢酶可以包括选自由葡萄糖脱氢酶、谷氨酸脱氢酶、乳酸脱氢酶和醇脱氢酶组成的组中的至少一种。
根据本发明的一个实施例,电极层可以包括工作电极层和参比电极层。电极层可以包括选自由碳电极层和金属电极层组成的组中的至少一种。例如,金属电极层可以包括金属层和形成在金属层上的金属保护层。
根据本发明的一个实施例,酶反应层可以设置在工作电极层上,并且酶反应层的面积可以为工作电极层面积的60%至330%。
有益效果
本发明的生物传感器即使使用极少量的体液也能够精确地测量糖,具体地,在通过将由支撑层和上基板组成的盖布置在酶反应层上而形成空的空间(space)的结构中,通过调整支撑层的高度和酶反应层的宽度来提高分析分辨率,从而即使是极少量的体液(样品),也能够提供测量更精细浓度的效果。
附图说明
图1是根据本发明实施例的毛细管型生物传感器的分解透视图。
图2是示出沿图1中的线B-B'截取的剖视图。
图3是根据本发明实施例的毛细管型生物传感器的俯视图(未示出第一基板和第二基板)。
图4是根据本发明实施例的微流控型生物传感器的分解透视图。
图5是图4中的线B-B'截取的剖视图。
图6是根据本发明实施例的微流控型生物传感器的俯视图(未示出第一基板和第二基板)。
图7是示出沿图1和图4中的线A-A'截取的剖视图。
图8是示意性示出根据本申请实施例的缩小型、基本型和扩展型的结构的剖视图。
图9是示出本申请的实验例中的表3的评估结果的图表。
图10是示出本申请的实验例中斜率根据支撑层的高度(x)和酶反应层的面积(y)的变化的图。
图11是示出本申请的实验例中斜率根据支撑层的高度(x)和样品(溶液)的体积的变化的图。
附图中的附图标记如下:
100:第一基板200:第二基板
110:疏水性表面210:亲水性表面
300:支撑层310:空间(空的空间)
400:电极层500:酶反应层
具体实施方式
本发明涉及一种生物传感器,其通过调节支撑层的高度和酶反应层的面积来提高分析分辨率,从而即使在极少量的体液的情况下也能提高传感器的检测准确度和精密度。
具体地,本发明涉及一种生物传感器,包括:第一基板,在所述第一基板的一侧具有疏水性表面;第二基板,所述第二基板布置于所述第一基板上,并且在所述第二基板的一侧具有亲水性表面;支撑层,所述支撑层形成为具有预定高度,以在所述第一基板的所述疏水性表面和所述第二基板的所述亲水性表面之间提供空间;一个或多个电极层,所述电极层形成在所述第一基板上的所述空间内;以及酶反应层,所述酶反应层形成在所述电极层上。
在本发明的生物传感器中,检测样品可以是诸如血液、体液(唾液、汗液、泪液等)、尿液等生物样品,也可以是除此之外的其他液体样品,但最优选为体液(唾液、汗水、眼泪等)。例如,检测样品可以含有葡萄糖或乳酸(乳酸盐)。
特别是,为了测量少量体液中的准确的糖浓度,需要提高分析分辨率,并且为了提高分析分辨率,通常将大量的酶施加到传感器上或者在传感器中使用昂贵的电极材料,但这种方法不适合传感器的大规模生产。因此,需要使用能够以低成本容易地制造的盖,并且即使施加相同量的酶,也可以根据盖的构造来提高分析分辨率。例如,本发明的生物传感器使用由支撑层和第二基板(上基板)组成的盖,因此可以用小于10μl的样品(体液)测量糖浓度,并且优选可以用1μl至7μl的样品(体液)测量糖浓度。当样品的量满足上述范围时,即使使用少量的体液也可以准确地测量糖浓度。
下面,将参照附图更详细地描述本发明的实施例。本说明书所附的以下附图只是示出了本发明的优选实施例并且用于结合本文的描述来帮助理解本发明的技术构思,因此本发明不应被解释为限于附图中所示的那些。
本文中使用的术语用于描述实施例并且不是旨在限制本发明的范围。如本文所用,单数形式也旨在包括复数形式,除非上下文清楚地另有说明。
还应当理解,在本说明书中使用的术语“包括”和/或“包含”不排除除了所提到的组件、步骤、操作和/或元件之外的一个或多个其他组件、步骤、操作和/或元件的存在或添加。在整个说明书中,相同的附图标记指代相同的元件。
本文可以使用空间相对术语“下方”、“下(面)”、“上方”、“上(面)”等来容易地描述如图所示的元件或组件与另一元件或组件的相关性。空间相对术语应当被理解为除了附图中所示的方向之外还包括元件在使用或操作期间的不同方向的术语。例如,当图中所示的一个元件被翻转时,被描述为布置在另一元件“下方”或“下(面)”的元件可以设置在另一元件“上方”或“上(面)”。因此,示例性术语“下(面)”可以包括下方和上方两个方向。该装置可以定向在其他方向,并且可以相应地解释本文中使用的空间相对术语。
<生物传感器>
根据本发明的生物传感器包括:第一基板100,其一侧具有疏水性表面110;第二基板200,其布置于第一基板100上,且第二基板200的一侧具有亲水性表面210;支撑层300,其形成为具有预定高度,以在第一基板100的疏水性表面110与第二基板200的亲水性表面210之间提供空间310;形成在第一基板100上的空间310内的一个或多个电极层400;以及形成在电极层400上的酶反应层500。
空间310可以根据各部件的设计以及支撑层300的高度来调节进入内部的样品的量。因此,在注入样品时,可以在不干扰样品流动的情况下,通过改变结构设计来改变空间310的面积来调节样品的量,并通过选择支撑层300的高度来确定样品的量。当支撑层300的高度增加时,空间的高度增加,因此可以增加待注入的样品的量,并且分析分辨率也随着支撑层300的高度增加而增加。在本申请中,空间的高度(厚度)是指第一基板的上表面与第二基板的下表面之间的距离,并且可以与支撑层的高度(厚度)相同。
另外,当酶反应层500的面积在允许范围内增加时,分析分辨率(斜率)可以增加,但是当调整样品的量时,分析分辨率(斜率)不受影响,这可以通过酶反应层500的反应面积与样品的对流现象引起的扩散之间的差异来解释。施加到酶反应层500上的样品量的大幅增加意味着从样品的上表面到反应物的上表面的长度增加。然而,酶反应层500的厚度的增加并不意味着反应程度的增加。为了使反应在适当的厚度下进行顺利的反应,在酶反应层500的上表面发生第一次反应后,反应后的样品和未反应的样品之间快速发生对流现象,引起未反应的样品与酶反应层500的上表面的二次反应,从而增大测量值。然而,由于随着酶反应层500的厚度增加,引起对流现象需要更长的时间,因此测量值可能很快会在厚度增加曲线的延长线上收敛。
因此,形成有电极层400的空间310区域的厚度适宜为1μm至500μm,从工艺操作的便利性角度考虑,优选为10μm至300μm,并且为了用作柔性贴片类型和延长的流路,更优选为50μm至300μm。优选地,从电极层400延伸的流路的厚度(即,样品入口部10的厚度)优选大于形成有电极层400的空间310的高度,以使得溶液的流动不受阻碍。
根据本发明的生物传感器理论上可以具有诸如下面的数学式1的关系式,以有利于体液的测量,从测定的准确度和效率的观点出发,以下数学式1的Z值表示分析分辨率(斜率),优选为满足30~700nA·mM
[数学式1]
Z=γ+αx+βy
上述数学式1中,Z=斜率(nA·mM
然而,支撑层的高度(y)需要足够厚以允许样品通过该空间。厚度过大或过小时,毛细管现象的压力和溶液的流速可能会改变,因此可能不适合应用上面的数学式1。当施加暴露于样品的工作电极层的整个面积时,将酶反应层的面积(x)代入式中可以更适合预测斜率(分析分辨率)。
图1是根据本发明实施例的毛细管型生物传感器的分解透视图,图2是示出沿图1的B-B'线截取的剖视图,图3为本发明实施例的毛细管型生物传感器的俯视图(未示出第一基板和第二基板)。
图4是根据本发明实施例的微流体型生物传感器的分解透视图,图5是示出沿图4的B-B'线截取的剖视图,图6是根据本发明实施例的微流控型生物传感器的俯视图(未示出第一基板和第二基板)。
此外,图7是示出沿图1和图4的线A-A'截取的剖视图。
参照图1至图7,根据本发明实施例的生物传感器包括第一基板100、第二基板200、支撑层300、空间310、电极层400和酶反应层500,电极层400可以包括工作电极层410和参比电极层420,并且酶反应层500可以形成在工作电极层410上。
第一基板100具有疏水性表面并且用作构成生物传感器的组件提供结构基础,第二基板200具有亲水性表面并且与支撑层300一起用于为构成生物传感器的部件提供结构性盖。在本发明中,第一基板具有疏水性表面的结构,第二基板具有亲水性表面可以意味着第一基板和第二基板彼此具有相对的疏水性或亲水性。
第一基板100和第二基板200可以各自独立地由诸如玻璃等硬质材料制成,或者可以以具有柔性特性的膜的形式实现,并且可以使用现有产品或将来开发的新颖产品。
在一个或多个实施例中,第一基板100和第二基板200可以包括:硅胶、玻璃、环氧玻璃钢、陶瓷等硬质材料;聚对苯二甲酸乙二醇酯(PET)、聚间苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚对苯二甲酸丁二醇酯等聚酯树脂;二乙酰纤维素、三乙酰纤维素等纤维素类树脂;聚碳酸酯类树脂;聚(甲基)丙烯酸甲酯、聚(甲基)丙烯酸乙酯等丙烯酸树脂;聚苯乙烯、丙烯腈-苯乙烯共聚物等苯乙烯类树脂;聚乙烯、聚丙烯、具有环或降冰片烯结构的聚烯烃、以及乙烯-丙烯共聚物等聚烯烃树脂;氯乙烯类树脂;尼龙、芳香族聚酰胺等酰胺类树脂;酰亚胺类树脂;聚醚砜类树脂;磺类树脂;聚醚醚酮类树脂;硫酸化聚苯类树脂;乙烯醇类树脂;偏二氯乙烯树脂;乙烯基丁醛树脂;烯丙基化物树脂;聚甲醛类树脂;环氧树脂等热塑性树脂或由它们的组合形成的柔性膜。此外,可以包括由诸如(甲基)丙烯酸、聚氨酯、丙烯酸聚氨酯、环氧树脂或硅酮等热固性树脂或紫外线固化树脂制成的膜,但是膜的材料不限于此。
第一基板100和/或第二基板200的厚度没有特别限制,但从强度、操作性、加工性、薄层特性的观点出发,可以为1至500μm,优选为1至300μm,更优选为5至200μm。
在一些实施例中,第一基板100和/或第二基板200可以包含添加剂。例如,作为添加剂,可以包含紫外线吸收剂、抗氧化剂、润滑剂、增塑剂、脱模剂、防着色剂、阻燃剂、成核剂、抗静电剂、颜料、着色剂等。
在一些实施例中,第一基板100和/或第二基板200可以在基板的一个表面或者两个表面上包括功能层。功能层可以具有包括硬涂层、抗反射层和气体阻隔层的结构等各种功能层,并且功能层不限于上述示例,并且根据用途可以包括各种功能层。
此外,第一基板100和/或第二基板200可以被表面处理。具体地,优选地,第一基板100的至少一个表面(例如上表面)经过处理而具有疏水性表面110,第二基板200的至少一个表面(例如下表面)经过处理而具有亲水性表面210。例如,表面处理可以通过诸如等离子体处理、电晕处理和底漆处理等干处理,并且可以包括诸如包括皂化的碱处理等化学处理。
在本发明的实施例中,为了利用毛细管效应在图1所示的结构中的空间310中产生畅通的流动,优选地,第一基板100的上表面被表面处理为具有疏水性,并且第二基板200的下表面被表面处理为具有亲水性。另外,由于酶反应层500是亲水性的,因此优选保证第一基板的疏水性表面层的厚度至少为50μm以上,以利于样品的畅通无阻。
在本发明的实施例中,对于如图4所示的微流控型模拟结构来说,优选地,第一基板100的下表面和上表面均经过疏水性表面处理,并且第二基板200的下表面优选经过亲水性表面处理。
在一些实施例中,如图4所示,第一基板100可以包括样品入口部10,其是用于投入样品的开口。此外,如图1和图4所示,第二基板200可以包括排气口20,其是用于排出内部空气以对样品产生毛细管效应的开口。
在一些实施例中,通过样品入口部10注入生物传感器内部的样品在通过空间310时与酶反应层500接触,并且将内部空气通过排气口20排出到外部。
支撑层300是与第二基板200一起用作盖的部件,支撑层300以预定的高度形成在第一基板100上以支撑第二基板200。在该结构中,在第一基板100和第二基板200之间设置有尚未形成支撑层300的空的空间,称为空间310。
在一个实施例中,支撑层300可以形成为与第一基板100的上表面接触,或者可以形成为与电极层400和酶反应层500的侧表面相邻。例如,支撑层300可以被配置为完全暴露电极层400和酶反应层500的上表面。
在一个实施例中,支撑层300可以形成为与布线单元430的上表面及侧表面相邻。例如,可以以覆盖部分或全部布线430的形式布置。
在一个实施例中,支撑层300可形成为具有大于约25μm且约500μm以下的高度,并且优选形成为具有50μm至300μm的高度。当满足高度范围时,可以提高分析分辨率,同时最小化所需的样本量。
在一个实施例中,支撑层300可以由聚合物树脂制成。聚合物树脂的类型没有特别限制。聚合物树脂不限于包括选自由以下物质组成的组中的至少一种物质:OCA(光学透明粘合剂)、PSA(压敏粘合剂)、OCR(光学透明树脂)、聚丙烯酸酯、聚甲基丙烯酸酯(例如PMMA)、聚酰亚胺、聚酰胺、聚乙烯醇、聚酰胺酸、聚烯烃(例如PE、PP)、聚苯乙烯、聚降冰片烯、苯基马来酰亚胺共聚物、聚偶氮苯、聚对苯二甲酰胺、聚酯(例如PET、PBT)、聚芳酯、肉桂酸酯类聚合物、香豆素类聚合物、邻苯二甲酰亚胺类聚合物、查耳酮类聚合物、芳香族乙炔类聚合物,但不限于此。
在一个实施例中,注入到该空间中的样品的量可以根据支撑层300的高度和第一基板上的尚未形成支撑层的空间310的面积来调节。关于第二基板200,上表面不一定具有特定性能,但下表面需要比第一基板100的上表面更具有亲水性,以利用毛细管型或微流体型结构。该空间的体积和高度可以通过支撑层300来调节,并且暴露在空间310中的第一基板100的上表面需要比第二基板200的下表面更具有疏水性,以利于样品(溶液)的畅通无阻的流动。
限定空间310的高度的支撑层300优选地由比第二基板200的下表面更具有疏水性的材料制成,并且可以通过激光切割来形成空间310,并且也可以形成作为空间的延伸的样品入口部10(参见图1)。第二基板200的下表面为经过亲水处理的膜,排气口20可以通过激光切割形成。第二基板200的排气口20的形状可以是圆形、正方形或矩形等,但不限于此。
电极层400可以布置在第一基板100上。例如,电极层400可以与第一基板100的上表面接触。电极层400可以用作在检测对象物质的氧化还原反应中产生的电子或空穴传输的通路。
在示例性实施例中,电极层400可以通过在第一基板100上印刷碳糊膜,或者可以通过在形成包含Au、Ag、Cu、Pt、Ti、Ni、Sn、Mo、Co、Pd及其合金中的至少一种的金属膜之后对该金属膜进行图案化来形成。
对于图案化,可以使用本领域常用的图案化工艺。例如,可以使用光刻法。
当电极层400还包括金属保护层时,在对金属层进行图案化之后形成金属保护层,或者在金属膜上形成氧化铟锡(ITO)或氧化铟锌(IZO)导电性氧化物膜之后,并将导电氧化物薄膜与金属膜一起进行图案化,从而一起形成金属层和金属保护层。
在示例性实施例中,电极层400可以形成为单层碳糊、混合有碳糊和介体的单层、或者包括通过在碳糊层上电镀形成的介体层的双层。由于碳糊层被提供作为电极,因此可以不需要额外形成金属电极。因此,可以实现生物传感器的薄膜化。另外,介体的类型可以包括选自由以下物质组成的组中的至少一种:铁氰化钾、细胞色素C、吡咯喹啉醌(PQQ)、NAD
电极层400可以包括工作电极层410和参比电极层420,还可以包括电连接到工作电极层410和/或参比电极层420的布线单元430。
工作电极层410被配置为用于感测由样本中包含的分析物的反应产生的电信号。在一个实施例中,可以在工作电极层410上形成酶反应层500,并且在酶反应层500上还可以形成聚合物膜层(未示出)。
工作电极层410可以设置在第一基板100上。在一个实施例中,工作电极层410可以设置为与第一基板100的上表面接触。工作电极层410可以用作在感测对象物质的氧化还原反应等中产生的电子或空穴传输的通路。具体地,工作电极层410可以检测酶反应层500中的酶与感测对象物质之间的反应所产生的电信号。感测对象物质可以是但不限于人体汗液、体液、血液等。例如,感测对象物质可以是葡萄糖或乳酸(lactate)。
在一种或多种实施方式中,工作电极层410可以包括选自由碳电极层和金属电极层组成的组中的一种或多种。
在一种或多种实施方式中,碳电极层包含选自由碳糊、热解石墨、玻璃碳、全氟化碳(PFC)、碳纳米管(CNT)等组成的组中的至少一种。碳电极层可以稳定地传输酶反应层500中产生的电子和/或空穴。
在一个或多个实施例中,碳电极层可以是包括或不包括介体的单层,并且还可以包括通过在碳电极层上电镀形成的介体层。例如,介体可以包括选自由以下物质组成的组中的至少一种:铁氰化钾、细胞色素C、吡咯喹啉醌(PQQ)、NAD
在一个实施例中,工作电极层410可以形成为单层碳糊。由于提供碳糊单层作为电极,因此可以省略金属电极。因此,可以实现生物传感器的薄膜化。
在一个实施例中,金属电极层可以包括金属层和设置在金属层的上表面的金属保护层。
在一个或多个实施例中,金属层包含选自由以下物质组成的组中的至少一种:金(Au)、银(Ag)、铜(Cu)、铂(Pt)、钛(Ti)、镍(Ni)、锡(Sn)、钼(Mo)、钯(Pd)、钴(Co)、及其合金。例如,可以使用APC合金(Ag-Pd-Cu合金)。
金属保护层具有导电性并且可以覆盖金属层的整个上表面。在一个实施例中,金属保护层可以设置为与金属层的上表面接触。金属保护层用于防止金属层因工作电极层410的氧化还原反应而被氧化和/或还原。
在一个或多个实施例中,工作电极层410可以包括选自由氧化铟锡(ITO)和氧化铟锌(IZO)组成的组中的至少一种。TO和IZO具有导电性且化学性质稳定,从而有效防止金属层的氧化还原反应。另外,金属保护层防止金属层与空气直接接触,从而防止构成金属层的金属元素的氧化。因此,可以提高通过金属层感测的电信号可靠性。
在一个实施例中,金属电极层可以设置在第一基板与碳电极层之间。
参比电极层420具有恒定电势并且用作用于获得与工作电极层410的电势差的参比电极。
在一个或多个实施例中,参比电极层420可以包括选自由以下物质组成组中的至少一种:银-氯化银(Ag/AgCl)电极、甘汞电极、硫酸汞电极、氧化汞电极等,并且考虑到电势在温度循环过程中具有较小的滞后性并且电势在高温下保持稳定,优选使用银-氯化银(Ag/AgCl)电极。银-氯化银(Ag/AgCl)电极可以由Ag/AgCl糊(paste)形成。
布线单元430可以形成在第一基板100上。在一个实施例中,布线单元430可以设置为与第一基板100的上表面接触,并且可以电连接到工作电极层410和/或参比电极层420。布线单元430可以用作传输电信号(例如由工作电极层410和参比电极层420测量的信号和驱动信号等)的通道。
在一个实施例中,连接到工作电极层410的布线和连接到参比电极层420的布线可以彼此电隔离。
在一个实施例中,布线单元430可以由与工作电极层410和/或参比电极层420的至少一部分相同的材料形成。在一些实施例中,布线单元430可以与工作电极层410和/或参比电极层420的至少一部分一体地形成。例如,布线单元430可以通过在第一基板100上形成金属膜并对金属膜进行图案化来一体地形成。
酶反应层500可用作样本中所包含的对象物质(分析物)的化学反应所发生的层。在一个实施例中,酶反应层500可以包括酶、介体和缓冲剂。
酶反应层500可以设置在电极层400上。例如,可以与电极层400的上表面直接接触。具体地,酶反应层500可以设置在工作电极层410上。在一个实施例中,酶反应层500可以设置为与工作电极层410的上表面接触。
根据本申请的一个实施例,酶反应层的面积(x)可以为工作电极层410的面积的60%至330%,优选地,可以为工作电极层410的面积为95%至330%。例如,当工作电极层410的上表面的面积为约2.83mm
酶可以与样品中所含的对象物质(分析物)结合形成酶-底物复合物,并调节化学反应的活化能,从而增加或降低新陈代谢的速度。
在一个或多个实施例中,酶可以根据待感测的测试材料的类型来选择,并且可以包括选自由氧化酶和脱氢酶组成的组中的一种或多种。
在示例性实施例中,氧化酶可以包括葡萄糖氧化酶、胆固醇氧化酶、乳酸氧化酶、抗坏血酸氧化酶以及醇氧化酶中的至少一种,并且脱氢酶可包括葡萄糖脱氢酶、谷氨酸脱氢酶、乳酸脱氢酶和醇脱氢酶中的至少一种。
可以根据示例性的氧化酶或脱氢酶而测量的检测物质(分析物)可以是葡萄糖、乳酸、胆固醇、抗坏血酸、酒精、谷氨酸等,并且可以测量它们的浓度。
例如,当生物传感器为乳酸传感器时,酶反应层可以含有乳酸氧化酶或乳酸脱氢酶。
在一个实施例中,氧化酶或脱氢酶可以通过交联剂来交联、固定和粘合。交联剂包括本发明所属技术领域中常用的交联剂,并且在一个实施例中,可以包括戊二醛(GA)或壳聚糖等。
酶反应层500可以通过例如将通过将氧化酶或脱氢酶与交联剂混合而获得的组合物涂覆到酶反应层上然后进行干燥来形成。
对于涂覆,可以使用本领域常用的涂覆方法,并且例如,可以使用诸如滴铸法等各种印刷方法。
酶反应层500可以含有米氏常数(Km)值为0.01至10mM的酶。因此,可以更有效地调节由酶的Km值确定的样品的可测量浓度范围。
另外,随着酶反应层500的面积增加,反应物的量增加,因此可以增大可测量值。然而,当酶面积小于电极层400的面积时,测量值可能出现误差,因此分散度也会增大。另一方面,当酶面积与电极层400的面积相比过大时,所需的样品的量也会增加,因此很难达到以极少量的样品提供高准确度生物传感器的目的,进而无法引入由支撑层和第二基板组成的覆,或可能由于覆过宽而降低毛细管效应,或者分析分辨率可能低于所需的斜率值。因此,酶反应层500的面积优选为暴露于样品的工作电极层410的面积的0.6至3.5倍,优选为0.95至3.3倍,更优选为1.02至2.9倍。
介体可以包括选自由以下物质组成的组中的至少一种:铁氰化钾、细胞色素C、吡咯喹啉醌(PQQ)、NAD
作为钌化合物,可以使用现有的钌化合物或将来使用的钌化合物,钌化合物优选为能够以氧化钌络合物的形式存在于反应体系中的钌化合物。只要钌络合物起到介体(电子输送体)的作用,其配体的种类就没有特别限制。
作为吩嗪硫酸甲酯及其衍生物,可以使用现有的或将来使用的化合物,例如可以是吩嗪硫酸甲酯和1-甲氧基-5-甲基吩嗪鎓甲基硫酸盐(1-甲氧基PMS)等。
缓冲液可以根据检测对象物质(样品)的类型和浓度适当地选择,只要即使对于具有各种pH值的样品也能够表现出预定的检测结果即可,没有特别限制。
在一个或多个实施例中,缓冲液包括选自由以下物质组成的组中的至少一种:磷酸盐缓冲盐水(PBS)、三(羟甲基)氨基甲烷(Tris)、三羟甲基氨基甲烷(Tris-HCl)、碳酸氢铵、4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、3-(N-吗啉代)丙磺酸(MOPS)、2-(N-吗啉代)乙磺酸(MES)、2,2-双(羟甲基)-2,2',2"-次氮基三乙醇(Bis-tris)、N-(2-乙酰氨基)亚氨基二乙酸(ADA)、哌嗪-N,N'-双(2-乙磺酸)(PIPES)、N-(2-乙酰氨基)-2-氨基乙磺酸(ACES)、3-(N-吗啉基)-2-羟基丙磺酸钠盐(MOPSO)、1,3-双(三(羟甲基)甲氨基)丙烷(Bis-trisPropane)、N,N-双(2-羟乙基)-2-氨基乙磺酸(BES)、2-[[1,3-二羟基-2-(羟甲基)丙-2-基]氨基]乙磺酸(TES)、3-(双(2-羟乙基)氨基)-2-羟基丙烷-1-磺酸(DIPSO),3-[[1,3-二羟基-2-(羟甲基)丙-2-基]氨基]-2-羟基丙烷-1-磺酸(TAPSO)、Trizma、哌嗪-1,4-双(2-羟基丙磺酸)二水合物(POPSO)、3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸(HEPPS)、N-(2-羟基-1,1-双(羟甲基)乙基)甘氨酸(TRICINE)、甘氨酰甘氨酸(GLY-GLY)、2-(双(2-羟乙基)氨基)乙酸(BICINE))、N-(2-羟乙基)哌嗪-N'-(4-丁磺酸)(HEPBS)、3-[[1,3-二羟基-2-(羟甲基)丙-2-基]氨基]丙-1-磺酸(TAPS)、2-氨基-2-甲基-1,3-丙二醇(AMPD)、N-(1,1-二甲基-2-羟乙基)-3-氨基-2-羟基丙磺酸(AMPSO)、N-环己基-2-氨基乙磺酸(CHES)、N-环己基-2-羟基-3-氨基丙磺酸(CAPSO)、1-氨基-2-甲基-1-丙醇(AMP)、N-环己基-3-氨基丙磺酸酸(CAPS)、4-(环己基氨基)-1-丁磺酸(CABS)以及溶原性培养基。
在一个实施例中,酶反应层500可进一步包含去离子水(DI水)等作为混合上述成分的溶剂。
下面将使用酶反应层500的检测原理来举例说明,当将含有检测对象物质(分析物)的样品注入生物传感器时,样品中所含的检测对象物质(例如,基板)被氧化酶或脱氢酶氧化,并且氧化酶或脱氢酶被还原。在这种情况下,电子转移介体通过引起催化反应而快速诱导酶的反应,使氧化酶或脱氢酶氧化,而自身被还原。还原的电子转移介体在施加有一定电压的电极表面上失去电子并通过电化学被重新氧化。由于样品中对象物质(分析物)的浓度与电子传递介体在氧化过程中产生的电流量或电流密度成正比,因此可以通过测量电流量或电流密度来测量对象物质(分析物)的浓度。
聚合物膜层(未示出)可以设置在酶反应层500上。在一个实施例中,聚合物膜层可以设置为与酶反应层500的上表面接触。聚合物膜层是选择性渗透膜,并且用作通过防止酶的氧化并保护酶免受外来物质影响来提高酶的稳定性并提高生物传感器的检测性能的层。
在一种或多种实施方式中,聚合物膜层可包括选自由氟基聚合物、水溶性聚合物和水不溶性聚合物组成的组中的至少一种。
在一个或多个实施例中,氟基聚合物可以包括全氟基聚合物(例如全氟磺酸类树脂),并且可以包括例如杜邦公司的Nafion(注册商标)等。
在一个或多个实施例中,水溶性聚合物可包括选自由以下物质组成的组中的至少一种:聚乙烯醇(PVA)、羟乙基纤维素(HEC)、羟丙基纤维素(HPC)、羧甲基纤维素(CMC)、醋酸纤维素(CA)和聚乙烯吡咯烷酮(PVP)。
在一种或多种实施方式中,水不溶性聚合物可包括选自由聚氨酯(PU)、聚碳酸酯(PC)和聚氯乙烯(PVC)组成的组中的至少一种。
<生物传感器的制造方法>
本发明包括用于制造上述生物传感器的生物传感器制造方法。
在一个实施例中,可以通过在第一基板上形成工作电极层、在工作电极层上形成酶反应层、以及在酶反应层上形成聚合物膜层来制造工作电极。
在一种或多种实施方式中,形成工作电极层的步骤可以通过选自由丝网印刷、凸版印刷、凹版印刷、平版印刷和光刻组成的组中的一种以上工艺来进行。
例如,通过丝网印刷将碳浆印刷在基板上,或形成包含选自由金(Au)、银(Ag)、铜(Cu)、铂(Pt)、钛(Ti)、镍(Ni)、锡(Sn)、钼(Mo)、钯(Pd)、钴(Co)及其合金组成的组中的至少一种的金属膜,并且通过光刻工艺等进行图案化来形成。
在一个实施例中,当工作电极层还包括金属保护层时,在对金属层首先进行图案化之后形成金属保护层,或在金属膜上形成氧化铟锡(ITO)或氧化铟锌(IZO)的导电氧化膜之后,将金属膜和导电性氧化物膜一起进行图案化,以一起形成金属层和金属保护层。
形成酶反应层的步骤和形成聚合物膜层的步骤可以通过本发明所属技术领域中常用的涂覆方法来形成。在一种或多种实施方式中,可以通过选自由流涂法、喷墨法和滴铸法组成的组中的任意一种来进行,并且优选为滴铸法。
在一个实施例中,参比电极可以使用Ag/AgCl糊等形成,并且可以通过与制造工作电极的方法基本相同的方法来制造。
在一个实施例中,可以通过利用层压机首先将支撑层300和第二基板200接合,然后将电极层400接合到其上来制造生物传感器。在另一个实施例中,可以通过将包括电极层400的第一基板100首先接合到支撑层300,然后使用层压机将第二基板200接合到其上来制造生物传感器。
通过上述制造方法制造的生物传感器可以表现出上述的所有特性。
<生物传感器信号的测量方法>
本发明包括使用通过上述生物传感器制造方法制造的生物传感器来测量分析物的电化学信号的方法。
在本说明书中,“电化学测量”是指通过应用电化学测量方法进行的测量,在一个或多个实施例中,可以采用电流测量法、电位差测量法、电量分析法等,优选为电流测量法。
在一个实施例中,本发明的测量生物传感器信号的方法包括:在使样本与生物传感器接触之后,向包括工作电极和参比电极的电极单元施加电压;测量施加时产生的响应电流值;以及基于响应电流值计算样品中的检测对象物质(分析物)的电化学信号。施加的电压没有特别限制,但在一种或多种实施方式中,以银-氯化银电极(Ag/AgCl电极)为基准,电压可以为-500至+500mV,优选为-200至+200mV。
在一个实施例中,在本发明的生物传感器信号测量方法中,可以在与样本接触之后保持未施加电压的预定时间段之后向电极单元施加电压,或在与试剂接触的同时向电极单元施加电压。
本发明的生物传感器信号测量方法可以通过最小化表现出不同的pH值的样品的测量偏差来提高生物传感器的准确度和精密度,从而进一步提高生物传感器的灵敏度。
<生物传感器信号测量系统>
本发明涉及一种用于测量样品中的检测对象物质(分析物)的电化学信号的生物传感器的电化学信号测量系统,其包括生物传感器、向生物传感器的电极单元施加电压的单元、以及测量电极单元中的电流的单元。
根据本发明的生物传感器信号测量系统,即使对于表现出各种pH范围的样品也表现出高测量准确度和精密度,并且可以提高测量灵敏度。
电压施加单元没有特别限制,只要与生物传感器的电极单元导通并且能够施加电压即可,并且可以使用公知的电压施加装置。在一个或多个实施例中,电压施加单元可以包括能够与生物传感器的电极单元接触的接触器和诸如直流电源等电源。
测量单元用于测量在施加电压时在电极单元中产生的多个电流,在一个或多个实施例中,可以是能够测量与从生物传感器的电极单元放出的电子量相关的响应电流值的任何装置,并且可以使用在传统或将来的生物传感器中使用的任何装置。
发明的实施方式
下面,将描述本发明的具体示例。然而,本发明不限于下面公开的实施例,而是可以以各种不同的形式来实现,提供本实施例仅是为了确保本发明公开的完整性以及使本发明所属技术领域的技术人员充分了解本发明的范围,本发明仅由权利要求的范围来限定。
制造例
由工作电极和参比电极组成的双电极结构设置在具有相对疏水的表面的第一基板(180μm,PET)上。工作电极和参比电极的尺寸均为2.83mm
使用手滴或分配器将一定量的葡萄糖氧化酶施加到工作电极上,然后以相同的方式施加一定量的壳聚糖。该完成上述工作后,以同样的方式涂敷一定量的Nafion,并且在上述工作完成后,以同样的方式加入一定量的戊二醛,1~3分钟后用PBS洗涤,然后完全干燥,从而形成酶反应层。
通过激光切割在具有与第一基板相比相对具有亲水性表面的第二基板(AMTE公司的ABF-AFG)上形成排气口。使用层压机将第二基板接合至第二基板以使用OCA(3M韩国,8146-4)形成支撑层。通过使用层压机将接合有OCA的第二基板接合到形成有制备的电极的第一基板上来制造生物传感器。
此外,根据由支撑层形成的空间的宽度,生物传感器的结构分为缩小型、基本型和扩展型来制造。图8示意性地示出了缩小型、基本型和扩展型结构。
实施例1:支撑层厚度为50μm的生物传感器的制造
在制造例中,将支撑层(OCA)的高度设定为50μm,使得空间的高度为50μm,以分别制造如图8所示的缩小型、基本型、扩展型结构的生物传感器。
实施例2:支撑层厚度为100μm的生物传感器的制造
在制造例中,将支撑层的高度设定为100μm,使得空间的高度为100μm,以分别制造如图8所示的缩小型、基本型、扩展型结构的生物传感器。
实施例3:支撑层厚度为150μm的生物传感器的制造
在制造例中,将支撑层的高度设定为150μm,使得空间的高度为150μm,以分别制造如图8所示的缩小型、基本型、扩展型结构的生物传感器。
比较例1:无空间的生物传感器的制造
在制造例中,制造了未形成有支撑层和第二基板的生物传感器。
比较例2:支撑层厚度为25μm的生物传感器的制造
在制造例中,将支撑层的高度设定为25μm,使得空间的高度为25μm,以制造基本型结构的生物传感器。
实验例1
根据支撑层的高度和结构,确认了测量所需的最小样品量,并将其结果总结在下表1中。作为样本使用了体液。
[表1]
*a=基本型结构,b=缩小型结构,c=扩展型结构(见图8)。
另外,通过表1的结果,图11中示出了根据支撑层的厚度的斜率。
从表1可以确认,在比较例1的情况下,需要大量的样品来测量糖。因此,可以确认,如比较例1那样未形成有盖的情况下,不适合使用难以收集大量样本的体液进行测量。
另外,可以确认,在实施例1的缩小型结构的情况下,样品量过少,小于1μL,而在实施例2和3的扩展型结构的情况下,样品量超过5μL。对此,在下面的实验例2中,对样品量满足1μL至5μL的范围的情况下的分析分辨率进行了确认。
实验例2
为了确认斜率影响因素,对可以用少量样品进行测量的实施例1至3确认了分析分辨率根据支撑层的高度和结构的变化,并将其结果总结于下表2中。
具体而言,通过使用CHI630仪器测量样品的电流并将样品的浓度和电流值变换为斜率(nA/mM)来获得分析分辨率。在本实验例中,制造实施例和比较例的生物传感器中,酶反应层的面积均被制造为参比电极的面积(2.83mm
[表2]
*a=基本型结构,b=缩小型结构,c=扩展型结构(见图8)。
另外,通过表2的结果,在图11的左侧示出了根据支撑层的高度的斜率,在右侧示出了根据结构(溶液体积)的斜率。
如表2和图11所示,在具有根据实施例的结构的生物传感器的情况下,确认了分析分辨率随着支撑层高度的增加而提高,但与溶液体积没有显着相关性。
另一方面,在比较例2的情况下,虽然通过实验例1确认可测定的样品量少,但酶反应层的厚度与空间的厚度(支撑层的高度)相近,因此毛细管效应不足。另外,暴露于待测量样品的酶反应层的面积因样品而异,因此误差范围较大,并且难以测量斜率。
实验例3
在本实验例中,在实验例2中,对于在实施例1至3中的基本型或缩小型结构中确认具有更好的分析分辨率的结构,与上述实验例2同样的方法确认了分析分辨率(斜率)随酶反应层的面积的变化,并将其结果总结在表3以及图9和图10中。
[表3]
*a=基本型结构,b=缩小型结构,c=扩展型结构(见图8),**A=工作电极面积的约90%,B=工作电极面积的约140%,并且C=工作电极面积的约210%。
从表3和图10可以看出,在根据实施例的结构中,随着酶反应层的面积增加,分析分辨率(斜率)提高。
另外,通过上述实验可以确认,生物传感器的分析分辨率受支撑层的高度和酶反应层的面积的影响较大。
产业上的可利用性
本发明的生物传感器即使使用极少量的体液也可以准确地测量糖。具体地,在通过将由支撑层和上基板组成的盖布置在酶反应层上而形成空的空间的结构中,通过调节支撑层的高度和酶反应层的宽度来提高分析分辨率,从而即使使用少量的体液(样品)也能提供测量更精细的浓度的效果。
- 一种高速无线人体穴位探测系统及其方法
- 一种人体穴位的检测方法及其专用穴位电图检测仪
