一种用于制备注射型自体i-PRF的装置及制备方法
文献发布时间:2023-06-19 09:57:26
技术领域
本发明涉及生物医学领域,尤其是一种用于制备注射型自体i-PRF的装置及制备方法。
背景技术
自体富血小板血浆(PRP)在20世纪70年代首次提出,并于20世纪80年代开始广泛使用。由于添加了可引起免疫排斥反应的抗凝成分且不易操作,为了延续PRP的优势,同时为避免上述缺点,Choukroun于2001年在法国制备的第二代血小板浓缩物,称为富血小板纤维蛋白(PRF)是在未添加抗凝剂的情况下通过一次离心自体静脉血而得到的富含高浓度血小板的纤维蛋白凝块。从超微结构来看,发现纤维蛋白网状结构的构象不同是两者相区别的主要结构特征,同时它们在密度及类型两方面也存在有明显区别。而纤维蛋白的密度是由其原料纤维蛋白原的数量决定的,其类型则取决于凝血酶总量与聚合速度。在传统PRP的制备过程中,未聚合的纤维蛋白会溶解于PPP而直接被弃掉,因此在后续加入凝血酶促凝血时,纤维蛋白原含量已大大降低,使聚合后的纤维蛋白网状结构的密度远低于生理血凝块,而由于外源性添加剂的作用,高凝血酶浓度使得纤维蛋白原的聚合速度远高于生理反应,形成的纤维蛋白网由四分子纤维蛋白原聚合形成,僵硬而缺乏弹性,不利于网罗细胞因子及促进细胞迁移。因此PRF纤维蛋白网状结构的成熟度优于PRP,与生理状态更加接近。同时PRF与传统PRP制品的细胞因子释放模式也不相同,PRP制品由于外源性添加剂的参与,瞬间激活了PRP中的血小板,并且激活后释放的细胞因子亦有起加速血小板激活作用的细胞因子,故其细胞因子的释放在加入外源性添加剂的时点附近出现集中即使用后愈合期的早期阶段,而后期的释放较少,细胞因子的释放并不均衡及持久。在软骨修复、肌腱修复、骨组织修复等临床应用领域,因其治疗和康复周期较长,持续的生长因子释放会更有效地促进组织的修复,而由于PRF的结构优势,使得细胞因子可以相对持久的释放,更大程度地满足了不同临床应用的需求。
近几年,已有多项研究证明PRF可以促进软组织修复与再生,并且PRF也开始被用于组织再生术的补充物。然而,目前制备出的PRF主要呈纤维凝块状,此形态的PRF不利于与其它生物材料结合,限制了其临床应用,而且在制备过程中还会存在有血液污染的问题。
发明内容
针对现有的不足,本发明提供一种用于制备注射型自体i-PRF的装置及制备方法。
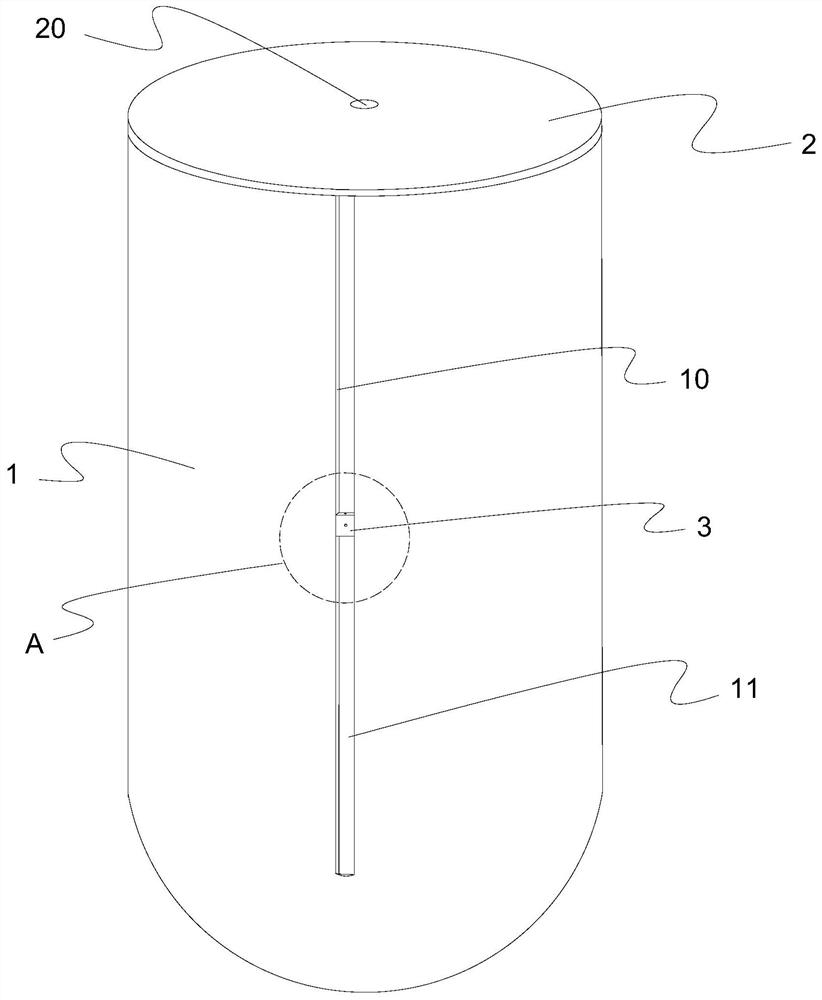
本发明解决其技术问题所采用的技术方案是:一种用于制备注射型自体i-PRF的装置,包括可放置于离心机中离心的桶形结构的离心管,所述离心管的管口密封连接有能使注射针穿过的保护盖;所述离心管的侧壁上沿轴向设置有轴向开口,并在轴向开口处密封连接有用于封闭轴向开口的能被刺穿的可穿刺膜;所述离心管的侧壁上还滑设有在轴向开口内滑动的滑块,所述滑块上设置有对应于轴向开口的通孔。
作为优选,所述保护盖是中心设有插入通孔的盖子,所述插入通孔的孔径与注射针的管径相匹配。
作为优选,所述保护盖是能被注射针刺穿的保护膜。
作为优选,所述保护膜和可穿刺膜一体成型并密封连接在离心管的侧壁上。
作为优选,所述可穿刺膜密封连接在轴向开口的端部并与离心管的内壁相持平,所述滑块紧贴着可穿刺膜滑设在轴向开口内。
作为优选,所述滑块上还设置有与通孔相导通的注射孔,所述通孔内安装有多通的多通阀。
作为优选,所述滑块还可拆装连接有能插入通孔的内部中空的穿刺件,所述穿刺件上密封连接有能与其中空部位相导通的并能吸取离心管中液体的收集容器。
一种制备注射型自体i-PRF的方法,应用前文任一项所述的用于制备i-PRF的装置,具体步骤如下:
S1,采自体血液并将所采血液注入离心管中;
S2,将离心管放入离心机中,配平后进行低速离心使血液分为PRF层和红细胞层;
S3,离心结束,取出离心管,并滑动滑块使得滑块上的通孔对准PRF层和红细胞层交界处或交界下1-1.5mm处的位置;
S4,利用穿刺针经过通孔刺破可穿刺膜插入血液中,提取PRF层至收集容器;
S5,将收集容器中的PRF摇匀即得到i-PRF。
作为优选,所述低速离心是在室温20-25℃、离心力40-60g、离心时间不大于5min的条件下进行的。
作为优选,所述穿刺针插入的深度为0.8-1.5cm。
本发明的有益效果在于:
1,该发明装置结构简单、方便使用,在使用中降低了血液接触细菌的风险,降低了血液污染的概率;
2,在制备过程中,除了刺破膜的过程可能会带入外界细菌以外,其它过程血液不会接触细菌。另外,也无需添加凝血酶或抗凝剂,没有产生免疫排斥的风险,使得提取的i-PRF更安全有效;
3,采用低速离心的方式使得纤维蛋白凝集速率减慢,能够制备出自体i-PRF,同时使得更多生长因子及白细胞保留在PRF中,更有利于组织愈合,并且这些生长因子能够缓慢释放来发挥作用,从而更好地促进组织的再生;
4,该发明制备的i-PRF为具有流动性的液体,可单独使用或与其它生物材料混合使用,扩大了其临床应用的范围,解决了利用传统装置和方法制得的PRF呈纤维凝胶状,不利于与其它生物材料结合的问题;也利于促进组织的愈合和再生使用操作简便,本发明装置的离心提取过程及混合过程的操作流程简易;
5,成本低廉,本发明中富血小板纤维蛋白是取自患者自体血液并离心后获得的,显著降低成本;
6,该发明制得的i-PRF为液态形式,使用时能减轻对术区的创伤,进而减轻患者痛苦。
附图说明
图1是本发明实施例的结构示意图;
图2是本发明实施例图1中A的放大结构示意图;
图3是本发明实施例的穿刺件和收集容器的组合结构示意图;
图4是本发明实施例i-PRF与PRP中TGF-β在各个检测点的释放量;
图5是本发明实施例i-PRF与PRP中IGF在各个检测点的释放量;
图中零部件名称及序号:1-离心管10-轴向开口11-可穿刺膜2-保护盖20-插入通孔3-滑块30-通孔31-注射孔4-穿刺件5-收集容器。
具体实施方式
为了更清楚地说明本发明实施例的目的、技术方案和优点更加清楚,下面将结合实施例对本发明作进一步说明,进行清楚、完整的描述,显然,所描述的实施例是本发明的部分实施例,而不是全部实施例。基于本发明的实施例,本领域普通技术人员在没有付出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。此外,本发明中所提到的方向用语,例如,“上”、“下”、“前”、“后”、“左”、“右”、“内”、“外”等,仅是参考附加图示的方向,使用的方向用语是为了更好、更清楚地说明及理解本发明,而不是指示或暗指本发明必须具有的方位,因此不能理解为对本发明的限制。
本发明实施例,如图1至图3中所示,一种用于制备注射型自体i-PRF的装置,包括可放置于离心机中离心的桶形结构的离心管1,即离心管1的一端是开口的另一端是封闭的,中间则是中空的用来盛放所采集的自体血液的容置空腔,所述离心管1的管口密封连接有能使注射针穿过的保护盖2,管口密封连接保护盖2则使得离心管1在离心过程中不会将血液洒出,也避免了血液与空气的接触,而为了能使得血液能被注入离心管1,则保护盖2就需要能被注射针穿过,在实际应用中,就先使用注射器和采血针进行自体采血,采集血液至注射器中,之后移除采血针,更换成无菌的注射针与注射器连接,然后注射针穿过保护盖2,就将采集到的非抗凝静脉血液沿离心管1的内壁注入离心管1中,血液的采集量则根据不同情况来采集,采集量以0-10ml为宜。此时对于保护盖2来说,一种方式是所述保护盖2是中心设有插入通孔20的盖子,所述插入通孔20的孔径与注射针的管径相匹配,这样保护盖2密封连接在离心管1的管口,在往离心管1中注入血液时,就使得注射针插入保护盖2中心设置的插入通孔20,注射针的头部就伸入了离心管1内,就能很方便的将血液注入离心管1中,同时由于插入通孔20的孔径是和注射针的管径是相匹配的,也就意味着其孔径是相对比较小的,不会对血液的离心产生影响;另一种方式则是所述保护盖2是能被注射针刺穿的保护膜,保护膜采用橡胶复合膜,在生产时就可以通过热塑封装的方式密封连接在离心管1的管口,简化了结构,更利于使用,使用中使注射针刺穿保护膜即可;同时也可以是这两种方式的组合使用,组合使用时则先在离心管1上密封连接保护膜,然后再在保护膜上安装带有插入通孔20的盖子即可;所述离心管1的侧壁上沿轴向设置有轴向开口10,即轴向开口10是从离心管的管口向管底延伸的,并在轴向开口10处密封连接有用于封闭轴向开口10的能被刺穿的可穿刺膜11,通过可穿刺膜11就将轴向开口10封闭起来,使得离心管1仍然是内部中空的桶状结构的管体,仍然可以用来盛装血液,而其能被刺穿则便于了血液分层后对PRF的提取,该可穿刺膜11可以同样采用橡胶复合膜,也通过热塑封装的方式密封连接在离心管1上,在保护盖2是保护膜的情况下,就可以使保护膜和可穿刺膜11一体成型并密封连接在离心管1的侧壁上,进一步简化产品的结构,能更好的降低成本;所述离心管1的侧壁上还滑设有在轴向开口10内滑动的滑块3,所述滑块3上设置有对应于轴向开口10的通孔30,滑块3在轴向开口10内的滑动就使得其能处于离心管1的不同高度处,其滑设则通过相互配合的滑轨和滑槽来实现,滑轨和滑槽就相对应的设置在离心管1和滑块3上,在离心管1设置滑槽,那么滑块3上就设置滑轨,相反,离心管1上设置滑轨,那么滑块3上就设置滑槽;通孔30对应于轴向开口10,就利于使用中对可穿刺膜11的刺穿。这样的装置结构简单、方便使用,在使用中能有效降低血液接触细菌的风险,也就降低了血液被污染的概率。
进一步的改进,所述可穿刺膜11密封连接在轴向开口10的端部并与离心管1的内壁相持平,即可穿刺膜11是设置在轴向开口10位于离心管1内壁的一侧,与离心管1内壁相持平就意味着可穿刺膜11和离心管1的内壁之间不会存在有接缝,也就不会影响到对血液的离心,能更好的分离PRF层和红细胞层,所述滑块3紧贴着可穿刺膜11滑设在轴向开口10内,就使得用于穿刺的部件在刺穿可穿刺膜11的过程中减少与外部环境接触的机会,降低了血液被污染的几率。
进一步的改进,如图1和图2中所示,所述滑块3上还设置有与通孔30相导通的注射孔31,所述通孔30内安装有多通的多通阀(未标出),这样就能通过该注射孔31注射其它生物材料,比如胶原蛋白、透明质酸等,然后再通过多通阀的控制就能很方便的将采集的PRF和其它生物材料混合在一起。
进一步的改进,所述滑块3还可拆装连接有能插入通孔30的内部中空的穿刺件4,如图3中所示,所述穿刺件4上密封连接有能与其中空部位相导通的并能吸取离心管1中液体的收集容器5;这样在通过离心管1将血液离心后,通过穿刺件4就很方便的穿过通孔30刺穿可穿刺膜,使得离心管1中被分离的液态的PRF能通过穿刺件4内部的中空部位流出,该穿刺件4可以是我们常规使用穿刺针,也可以是头部成穿刺针的穿刺结构,尾部设置有与收集容器5相连接的连接结构,比如卡合结构,此时收集容器5就可以是筒形结构,其一端与穿刺件4连接导通,另一端设有在其内部滑动的滑动件,比如我们常规使用的注射器,穿刺件4还可以是头尾均为穿刺针结构,收集容器5是内部为真空的,具有能被穿刺件4刺穿部位的容器,在穿刺件4将其刺穿后由于收集容器5内外的压力差,就能将离心管1中离心后的PRF吸入收集容器5中。
一种制备注射型自体i-PRF的方法,应用前文任一项所述的用于制备i-PRF的装置,具体步骤如下:
S1,采自体血液并将所采血液注入离心管中,首先选择采血针与注射器相连,采集血液至注射器中,然后移除采血针,更换为无菌注射针与注射器相连,最后通过注射针穿过离心管上的保护盖将血液注入离心管中;
S2,将离心管放入离心机中,配平后进行低速离心使血液分为PRF层和红细胞层,在将血液注入离心管中后,立即将离心管放入离心机内,进行低速离心,低速离心则是在室温20-25℃、离心力40-60g、离心时间不大于5min的条件下进行的,根据离心原理,离心力过大或离心时间过长都容易促使未额外添加抗凝剂的血液接触离心装置的管壁后立刻启动内源性凝血系统,最终生成凝胶型PRF,离心时红细胞和离心管下方的少量血小板会会较快的先沉淀下来,而上方的血小板和白细胞则在低速离心条件下,分散在上层PRF中,在这样的离心条件下就能将更多的血小板和白细胞富集在上层PRF中,可较好的实现白细胞、血小板集中在上层富集,在应用于软骨缺损处就能更有利于软骨的愈合。在这样条件下制备的PRF在15分钟内呈液态,流动性良好,白细胞计数为(3~8)×10
S3,离心结束,取出离心管,并滑动滑块使得滑块上的通孔对准PRF层和红细胞层交界处或交界下1-1.5mm处的位置,通过滑块的滑动就能使其停靠的离心管的任意一个高度位置上,就能很方便的利用穿刺针刺穿可穿刺膜来吸取PRF,而在对准下方约1-1.5mm位置时,就会尽可能的完全提取PRF;
S4,利用穿刺针经过通孔刺破可穿刺膜插入血液中,提取PRF层至收集容器,穿刺针插入的深度为0.8-1.5cm,就能方便稳定吸取,减少扰动、避免对PRF的提取结果产生影响,提取时缓慢匀速进行,同时对穿刺深度的限定,就能提取时避免离心分层的PRF层和红细胞层的扰动,优选刺入的深度约为1cm,提取的PRF层则被收集在相应的收集容器中;
S5,将收集容器中的PRF摇匀即得到i-PRF,此时提取的i-PRF的体积为采血量的1/10-1/2,得到的i-PRF就可以用来作为软骨修复的材料,随用随制备。
这样的i-PRF的制备方法简便、成本低廉,且未添加任何的抗凝剂或生物因子,其特性更接近天然的纤维蛋白基质材料,避免了免疫排斥反应、交叉感染现象以及凝血功能障碍出现的风险,制得的i-PRF可单独使用或通过体外混合的方式与其它生物材料(如胶原蛋白、透明质酸等)混合注入关节腔中,从而实现受损组织的修复与再生,如软骨、几件韧带、骨组织等。在进行软骨修复时对软骨前体细胞的垂直迁移具有刺激作用,并能分泌出类型不同的与软骨基质相关的蛋白,同时还可以促进前体细胞的分化,从而形成透明软骨基质,无需二次手术,可在膝关节镜手术下通过注射的方式将i-PRF单独或与其它生物材料混合注入软骨缺损处,从而使软骨修复与再生,可以减轻对术区的创伤。
在实施例中采集10ml未添加抗凝剂的人血于离心管内,随后立即将离心管放入离心机中并在60g条件下室温离心3分钟,离心完毕后将滑块滑动至血液分层交界面下1.5mm处,将注射器与滑块相连,注射针水平刺破离心管上的可穿刺膜,刺入深度约1cm,然后收集上层橙黄色的PRF,体积约为5ml,此时可根据实际使用需求提取,如高浓度提取0~3ml;中等浓度提取3~4ml;低浓度提取4~5ml,轻轻振荡摇匀即获得i-PRF。同时对所收集的i-PRF进行了生长因子体外释放量的检测,证明以此方法制备出的i-PRF对促进软骨修复有积极作用。
取少量i-PRF,按照《全国临床检验操作规程》(第4版)中白细胞和血小板计数的显微镜计数法进行检测。另外将i-PRF放置于37℃恒温培养箱中,使其释放生长因子至培养基中,分别在第15分钟、1小时、8小时、1天、3天和10天检测生长因子浓度。在每个时间节点,取少量样本,按照ELISA试剂盒说明测定TGF-β和IGF两种生长因子的浓度。检测结果如下:
(1)i-PRF中白细胞和血小板计数结果分别为:4.2×10
(3)生长因子IGF在各个检测点的释放量分别为:416,437,619,671,367,61pg/ml。
另外采集10ml人血至添加了抗凝剂的离心管中,在123g条件下离心7分钟,丢弃下层红细胞,在1107g条件下二次离心,离心10分钟,从上至下吸取约3/4的上层清液,丢弃,离心管中剩下的即为PRP。
取少量PRP,按照《全国临床检验操作规程》(第4版)中白细胞和血小板计数的显微镜计数法进行检测。另外将PRP放置于37℃恒温培养箱中,使其释放生长因子至培养基中,分别在第15分钟、1小时、8小时、1天、3天和10天检测生长因子浓度。在每个时间节点,取少量样本,按照ELISA试剂盒说明测定TGF-β和IGF两种生长因子的浓度。检测结果如下:
(1)PRP中白细胞和血小板计数结果分别为:3.9×10
(3)生长因子IGF在各个检测点的释放量分别为:263,49,43,26,19,23pg/ml
对比i-PRF和PRP的白细胞和血小板浓度,可以看出相应数值是接近的。其中,血小板对组织的修复和凝血起着重要作用,并通过其激活释放各类生长因子而发挥作用,因此可以认为i-PRF和PRP释放生长因子的总能力是相当的。另外,白细胞则在炎症反应和感染控制方面发挥作用,而i-PRF和PRP的白细胞浓度也是接近的,可以认为二者具备基本等同的抗感染能力。
如图4和图5中所示,就显示了PRP与本实施例中制得的i-PRF生长因子的体外释放模式,从中可以看出i-PRF与传统PRP制品的生长因子释放模式是不相同的,PRP制品由于外源性添加剂的参与,瞬间激活了PRP中的血小板,并且激活后释放的细胞因子亦有起加速血小板激活作用的细胞因子,故其细胞因子的释放在加入外源性添加剂的时点附近出现集中即使用后愈合期的早期阶段,而后期的释放较少,细胞因子的释放并不均衡及持久。而由于PRF的结构优势,使得细胞因子可以相对持久的释放,更大程度地满足了不同临床应用的需求。
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 一种用于制备注射型自体i-PRF的装置及制备方法
- 一种用于自体血液提纯注射中的注射装置及其制备方法
