一种抗肿瘤联合用药物组合物及其应用
文献发布时间:2023-06-19 09:58:59
技术领域
本发明属于生物医药领域,尤其涉及一种抗肿瘤联合用药物组合物及其应用。
背景技术
血小板反应蛋白-1(thrombospondins-1,THBS-1)是第一种被发现的天然血管生成抑制剂,其包括六个活性结构域。THBS-1的活性结构域the three typeⅠrepeats(3TSR)可以与CD36结合,激活P38MAPK和caspase-3,抑制内皮细胞的转移和促进其凋亡,从而抑制血管生成。这种抑制血管生成的方式在抑制癌症中起到了非常重要的作用。
CD47是另一个与THBS-1结合的受体,可以与THBS-1的C端结合。CD47和THBS-1结合能增强黑色素瘤的耐药性和促进胶质瘤的侵袭,阻断它们的结合能保护正常组织免受放疗的损伤。
血管内皮细胞生长因子-2(vascular endothelial growth factor recptor-2,VEGFR-2)是一种血管生成信号传递的主要介质。THBS-1和CD36结合能够抑制VEGFR-2的信号。另外,3TSR也能抑制血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)信号的传递,进而抑制VEGFR-2磷酸化。MMP-9是基质金属蛋白酶MMPs家族的成员,能够降解IV型胶原,促进癌症转移。在卵巢癌中,MMP-9对癌症的转移和侵袭的促进作用受到广泛的关注。当使用siRNA沉默MMP-9时,癌细胞的侵袭能力降低。而基质金属蛋白酶抑制因子-3(tissue inhibitors of matrix metalloproteinase,TIMP-3)能够有效抑制MMP-9的活性,且在胃癌中THBS-1和TIMP-3有共表达的趋势。
曲贝替定是一种从海洋生物海鞘中提取出来的四氢异喹啉类生物碱,有研究表明,曲贝替定的抑癌机制与THBS-1相关,曲贝替定能够促进THBS-1的表达,从而抑制血管生成。因此曲贝替定对乳腺癌、非小细胞肺癌、结肠癌、肾癌、卵巢癌、子宫内膜癌、黑色素癌、骨肉瘤和前列腺癌等有抑制活性。但曲贝替定市场价格高达1.3万元/mg,长期使用会给患者家庭造成严重的经济负担。
近年来,联合用药逐渐成为肿瘤治疗的研究热点,联合用药可以通过发挥药物的协同抗肿瘤作用,达到在减小化疗药物毒副作用的同时增加药物抗肿瘤效果的目的。但联合用药时,药物的相互作用有时也可能产生相反的结果。本领域一直致力于寻找可与曲贝替定联合使用并具有协同增效作用的联合用药物,以进一步提高癌症的治疗效果,同时减低药物的成本,使其更适于临床推广。
发明内容
为进一步提高癌症的治疗效果同时减低施用曲贝替定的药物成本,本发明提供了一种抗肿瘤联合用药物组合物及其应用。
本发明的技术方案:
一种抗肿瘤联合用药物组合物,包括有效量的肠内酯或能在机体内转化为肠内酯的植物木脂素前体,还包括有效量的曲贝替定。
进一步的,所述能在机体内转化为肠内酯的植物木脂素前体为肠二醇、开环异落叶松树脂酚、丁香树脂醇、牛蒡配基、落叶松脂醇、松脂酚或芝麻素中的一种或几种的组合。
进一步的,有效量的肠内酯与有效量的曲贝替定的摩尔比为50μM~500μM:1nM~10nM。
进一步的,有效量的肠内酯与有效量的曲贝替定的摩尔比为150μM:5nM。
进一步的,所述联合用药物组合物还含有药学上可接受的载体或赋形剂。
进一步的,所述药学上可接受的载体包括脂质体、胶束、树枝状大分子、微球或微囊。
进一步的,所述联合用药物组合物的剂型为片剂、颗粒剂、胶囊剂、溶液剂、丸剂、脂质体制剂或纳米粒制剂。
进一步的,所述联合用药物组合物为单一的复方制剂或分为肠内酯制剂和曲贝替定制剂两种单独的制剂;所述两种单独的制剂用于同时、分别或依次给药。
本发明所述抗肿瘤联合用药物组合物在制备抗肿瘤药物中的应用。
进一步的,所述肿瘤包括卵巢癌、乳腺癌、前列腺癌、脑胶质瘤、食管癌、胃癌、肝癌和结直肠癌。
本发明的有益效果:
本发明通过实验证实曲贝替定和肠内酯ENL联合应用能抑制卵巢癌的增殖、活性、转移、侵袭、血管生成并促进肿瘤细胞的凋亡,且两者联合应用与单独用曲贝替定或肠内酯ENL相比表现出协同增效作用。更进一步的,当两者联合使用时各自的用药量减半后,对卵巢癌的抑制作用比单一用药更强。
本发明通过实验证实了曲贝替定和肠内酯ENL在卵巢癌中有着相同的抗癌机制,其抑癌机制主要由THBS-1介导,可以发挥协同作用。在机制方面,它们通过促进THBS-1和TIMP-3的表达,进而抑制MMP-9,最后抑制VEGFR-2,发挥抑制血管生成的作用。此外,曲贝替定和ENL可以促进CD36的表达,THBS-1和CD36结合也能有效地抑制VEGFR-2磷酸化,从而抑制血管生成。另外,THBS-1和它的另一个重要受体,CD47结合时,可以促进癌症侵袭。而曲贝替定和ENL能有效地减少CD47的表达,减少二者的结合,从而抑制癌症的侵袭和转移。当两种药物联合使用的时候,对这些mRNA和蛋白的表达变化最明显,也从机制角度说明了两药联合使用效果最好。
本发明提供的曲贝替定与肠内酯ENL联合用药组合物可以通过使用成本较低的肠内酯ENL来减少成本较高曲贝替定的给药量,减少患者的经济负担。其次,当联合用药时,肠内酯ENL能减少曲贝替定所造成的脾重量减少,减少药物的不良反应。因此,将曲贝替定和肠内酯ENL联合使用可以促进曲贝替定在临床上的推广应用,为提高患者疗效、减少不良反应发挥重要作用。
附图说明
图1、图2依次为实施例2CCK-8实验中ES-2和A2780细胞增殖数量的对比图;
图3为实施例2克隆形成实验中ES-2培养基的克隆形成照片;
图4为实施例2克隆形成实验中ES-2的克隆形成数量对比图;
图5、图6依次为实施例2结晶紫实验中ES-2OE组和NC组结晶紫染色照片;
图7、图8依次为实施例2划痕实验中ES-2和A2780划痕宽度的照片;
图9、图10依次为实施例2划痕实验中ES-2和A2780迁移距离对比图;
图11为实施例2FCM流式细胞术中ES-2和A2780的流式散点图;
图12为实施例2Transwell实验中ES-2NC组和OE组细胞侵袭结果照片;
图13为实施例2血管生成抑制实验中成管结果免疫荧光成像照片;
图14-图17依次为实施例2血管生成抑制实验中细胞面积、骨架长度、接头数量和分支数量对比图;
图18-图23依次为实施例3Real-Time PCR实验中THBS1、CD36、TIMP3、VEGFR2、MMP9和CD47基因mRNA表达水平对比图;
图24、图25依次为实施例3Western blot实验中ES-2NC/OE组蛋白印迹照片;
图26-图31依次为实施例3Western blot实验中ES-2NC/OE组THBS1、CD36、TIMP3、VEGFR2、MMP9和CD47基因蛋白表达水平对比图;
图32、图33依次为实施例3Western blot实验中ES-2和A2780蛋白印迹照片;
图34-图40依次为实施例3Western blot实验中ES-2THBS1、CD36、TIMP3、VEGFR2、MMP2、MMP9和CD47基因蛋白表达水平对比图;
图41-图47依次为实施例3Western blot实验中A2780 THBS1、CD36、TIMP3、VEGFR2、MMP2、MMP9和CD47基因蛋白表达水平对比图;
图48为以THBS1为中心的分子平衡图;
图49-图52依次实施例4体内实验中ES-2NC/OE各组小鼠肿瘤体积曲线对比图;
图53为实施例4体内实验中ES-2NC/OE各组小鼠实体瘤照片;
图54-图56依次为实施例4体内实验中ES-2NC/OE各组小鼠肿瘤体积、肿瘤重量和肿瘤重量方差分析对比图;
图57为实施例4体内实验中各组小鼠的活体成像照片;
图58为实施例4体内实验中各组小鼠的体重曲线对比图;
图59、图60依次为实施例4体内实验中各组小鼠的体重和脾脏重量对比图。
具体实施方式
下面结合实施例对本发明的技术方案做进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置,若未特别指明,本发明实施例中所用的原料等均可市售获得;若未具体指明,本发明实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
实施例1
本实施例通过测定曲贝替定Trabectedin和肠内酯ENL的IC50值确定两者的给药浓度及协同指数(Combination Index)。
(1)本实施例用浓度为50、200、400、600、800、1000和1200μM/L的肠内酯ENL处理人源上皮性卵巢癌细胞系A2780,用浓度为50、100、150、200、250、300、400和500μM/L的肠内酯ENL处理人源上皮性卵巢癌细胞系ES-2,用浓度为1、2、3、4、5、6、8和10nM/L的曲贝替定Trabectedin处理人源上皮性卵巢癌细胞系A2780,用浓度为1、2、3、4、5、6、8和10nM/L的曲贝替定Trabectedin处理人源上皮性卵巢癌细胞系ES-2。
卵巢癌透明细胞癌细胞系ES-2(McCoy’s 5A培养基)、A2780(DMEM/1640培养基)购自ATCC。
根据不同药物浓度下卵巢癌细胞死亡率,确定肠内酯ENL的给药浓度范围为50~500μM/L,曲贝替定Trabectedin的给药浓度范围为1~10nM/L。
通过检测不同药物浓度下培养24小时后细胞数量与对照组的细胞数量的比值确定ENL及Trabectedin的IC50值,得到ENL在卵巢癌细胞系A2780的单一给药量是143.00±23.64μM,在卵巢癌细胞系ES-2的单一给药量是171.9±28.70μM;曲贝替定在卵巢癌细胞系A2780的单一给药量是4.76±0.98nM,在卵巢癌细胞系ES-2的单一给药量是3.60±0.25nM。
通过多次重复实验,本实施例确定ENL的有效浓度为150μM/L,Trabectedin的有效浓度为5nM/L。
(2)将ENL和Trabectedin联合用药并分别作用于卵巢癌细胞系A2780和卵巢癌细胞系ES-2,其中ENL和Trabectedin在联合用药中的给药量均为其单一给药量的一半。通过检测不同药物浓度下培养24小时后细胞数量与对照组的细胞数量的比值确定ENL及Trabectedin的IC50值,得到如表1所示的ENL和Trabectedin联合用药的协同指数。对照表2所示Chou-Talalay药物协同作用定量分析方法的CI值参考标准进行对比。
表1
表2
药物联合作用的CI值区间及其评价
对比结果表明ENL与Trabectedin联合用药在两种卵巢癌细胞系A2780和ES-2中均表现出协同作用,且均为协同级别。
实施例2
由于肿瘤的侵袭和转移是导致癌症预后不良的主要因素,血管生成又是肿瘤转移后种植的一个重要途径,因此本实施例在确定ENL与Trabectedin两种药物的使用浓度之后,将实验分为Ctrl组、Trabectedin组、ENL组和T+E联合用药实验组,分别对ENL与Trabectedin联合用药对卵巢癌细胞增殖、活性、迁移的抑制作用、对细胞凋亡的促进作用以及对血管生成的抑制作用进行了检验。
本实施例Trabectedin组的Trabectedin给药量为5nM,ENL组的ENL给药量为150μM,T+E联合用药实验组的Trabectedin给药量为2.5nM+ENL给药量为75μM。
(一)通过CCK-8细胞增殖实验检验ENL与Trabectedin联合用药对卵巢癌细胞系ES-2和A2780细胞增殖的抑制作用。
实验方法:细胞正常传代,细胞密度调整到5×10
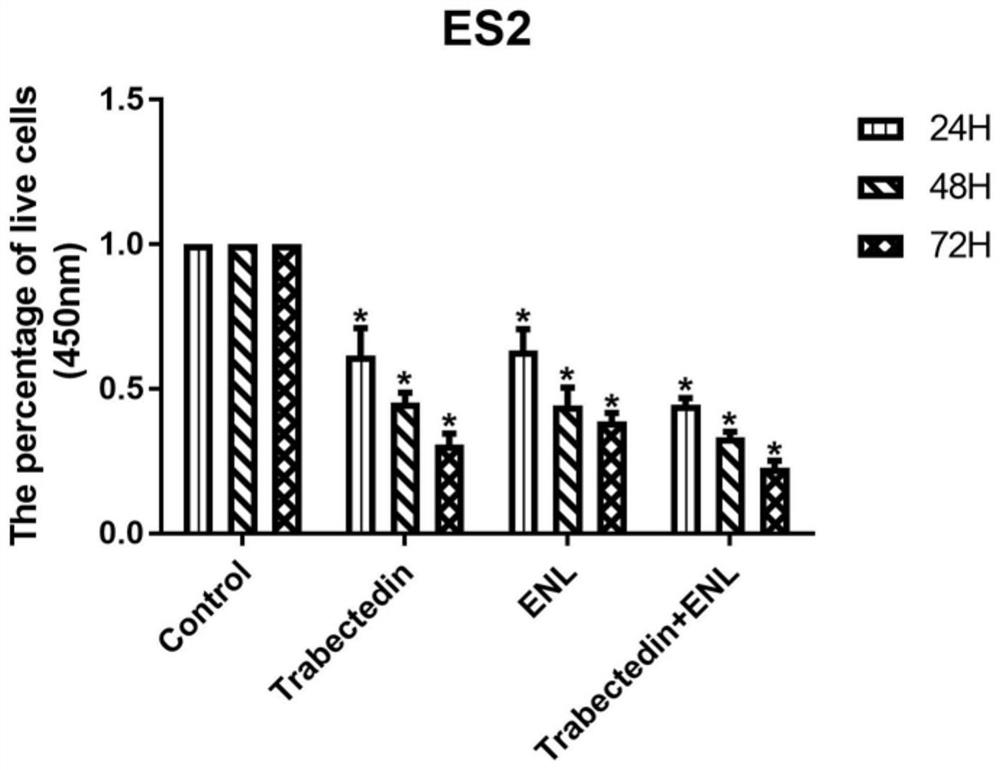
图1、图2依次为本实施例CCK-8细胞增殖实验中卵巢癌细胞系ES-2和A2780细胞增殖数量的对比图。由图1和图2可以看出,曲贝替定、ENL以及两者联合用药均能有效地抑制卵巢癌细胞的增殖,抑制效果呈时间依赖性,且两者联合使用抑制效果最好。
(二)通过克隆形成实验和结晶紫实验检验ENL与Trabectedin联合用药对卵巢癌细胞系ES-2细胞活性的抑制作用。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1,获得THBS1 overexpression(OE)组细胞系和negative control(NC)组细胞系,并对这两种细胞系进行结晶紫实验。
克隆形成实验方法:1000cell/dish接种细胞培养皿,每组三个重复,培养基中加入对应处理因素:Ctrl、ENL、Trabectedin、T+E,连续培养9-14天至colony size>50cells;计数克隆数。
结晶紫实验方法:细胞种入24孔板(500μl/well),加入不同的处理因素:Ctrl、ENL、Trabectedin、T+E,每组三个复孔。48h后,4%PFA固定细胞,1%结晶紫染色,自来水冲洗3遍,逐孔冲洗,静置晾干。
图3为本实施例克隆形成实验中卵巢癌细胞系ES-2培养基的克隆形成照片;图4为本实施例克隆形成实验中卵巢癌细胞系ES-2的克隆形成数量对比图。由图3和图4可以看出,曲贝替定、ENL以及两者联合用药均能有效地抑制卵巢癌ES-2细胞的活性,且两者联合使用抑制效果最好。
图5、图6依次为本实施例结晶紫实验中卵巢癌细胞系ES-2OE组和NC组结晶紫染色照片。由图5和图6可以看出,曲贝替定、ENL以及两者联合用药均能有效地抑制卵巢癌ES-2细胞的活性,且两者联合使用抑制效果最好。
(三)通过划痕实验检验ENL与Trabectedin联合用药对卵巢癌细胞系ES-2和A2780细胞迁移的抑制作用。
实验方法:细胞接种入24孔细胞培养板,过夜长满;次日,使用10μL枪头进行划痕,PBS洗三次,冲掉已划下的细胞;加入无血清培养液及不同处理因素:Ctrl、ENL、Trabectedin、T+E,分别于处理因素加入0h、24h时对划痕宽度进行拍照,来判断ENL与Trabectedin联合用药对卵巢癌细胞迁移的抑制作用。
图7、图8依次为本实施例划痕实验中卵巢癌细胞系ES-2和A2780划痕宽度的照片;图9、图10依次为本实施例划痕实验中卵巢癌细胞系ES-2和A2780迁移距离对比图。由图7-图10可以看出,曲贝替定、ENL以及两者联合用药均能有效地抑制卵巢癌细胞的迁移,且两者联合使用抑制效果最好。
(四)通过FCM流式细胞术检验ENL与Trabectedin联合用药对卵巢癌细胞系ES-2和A2780细胞凋亡的促进作用。
实验方法:不同的处理因素:Ctrl、ENL、Trabectedin、T+E分别培养细胞,常规培养基调整细胞浓度为5×10
图11为本实施例FCM流式细胞术中卵巢癌细胞系ES-2和A2780的流式散点图;由图11可以看出,曲贝替定、ENL以及两者联合用药均能有效地促进卵巢癌细胞的凋亡,且两者联合使用促进卵巢癌细胞凋亡效果最好。
(五)通过Transwell实验检验ENL与Trabectedin联合用药对卵巢癌细胞系ES-2细胞侵袭的抑制作用。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1,获得THBS1 overexpression(OE)组细胞系和negative control(NC)组细胞系。
实验方法:Matrigel胶加入上室,细胞密度至2~3×10
图12为本实施例Transwell实验中卵巢癌细胞系ES-2NC组和OE组细胞侵袭结果照片。由图12可以看出,与对照组相比,曲贝替定、ENL以及两者联合用药均能有效地抑制卵巢癌细胞的侵袭。与NC组相比,OE组卵巢癌细胞的侵袭能力明显受到抑制,这说明曲贝替定和ENL能促进THBS-1的表达,抑制卵巢癌细胞的侵袭,且两者联合使用效果最好。
(六)通过血管生成抑制实验检验ENL与Trabectedin联合用药对血管生成的抑制作用。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1且携带荧光素标签的慢病毒载体后,获得negative control(NC)组和THBS1overexpression(OE)组细胞系。
血管生成抑制实验方法:铺胶,准备HUVEC细胞悬液,10000个/孔细胞,按实验设计加入不同处理因素:Ctrl、ENL、Trabectedin、T+E;静置24h后,血管形成抑制率=[1-(Tubes
HUVEC(Endothelial cell grouth Medium培养基+生长因子)购自ATCC。
图13为本实施例血管生成抑制实验中成管结果免疫荧光成像照片;图14-图17依次为本实施例血管生成抑制实验中细胞面积、骨架长度、接头数量和分支数量对比图。通过图13-图17展示的荧光图像、细胞面积、骨架长度、接头数量和分支数量观察,曲贝替定、ENL以及两者联合用药均能够抑制人微血管内皮细胞(human microvascular endothelialcell-1,HMEC-1),进而能够抑制血管生成。而且本实施例证实OE组(过表达THBS1)与NC组相比可显著抑制血管生成,且ENL和Trabectedin联合应用效果更为明显,两者合用对血管生成的抑制效果最好。
实施例3
本实施例在确定ENL与Trabectedin两种药物的使用浓度之后,将实验分为Ctrl组、Trabectedin组、ENL组和T+E联合用药实验组,其中Trabectedin组的Trabectedin给药量为5nM,ENL组的ENL给药量为150μM,T+E联合用药实验组的Trabectedin给药量为2.5nM+ENL给药量为75μM。
本实施例根据基因测序和KEGG数据库查阅,以THBS-1为核心蛋白进行实验。对经过不同处理因素:Ctrl、ENL、Trabectedin、T+E处理24小时后的卵巢癌细胞中THBS1及相关通路基因蛋白及mRNA表达水平的影响进行了检验。
(一)通过Real-Time PCR实验检验了ENL与Trabectedin联合用药对卵巢癌细胞系ES-2中THBS1及相关通路基因(THBS1、CD36、TIMP3、VEGFR2、MMP9、CD47)mRNA表达的影响。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1,获得THBS1 overexpression(OE)组细胞系和negative control(NC)组细胞系。
Real-Time PCR实验方法:细胞样品提取总RNA,并逆转录为cDNA。Primer5软件设计特异引物,合成引物。数据采用2-△△CT法进行分析,检测mRNA表达水平。
图18-图23为本实施例Real-Time PCR实验中THBS1、CD36、TIMP3、VEGFR2、MMP9、CD47基因mRNA表达水平对比图。由图18-图23可以看出,ENL与Trabectedin单独或联合应用时THBS-1、CD36、TIMP-3基因的mRNA表达均得到提升,并以T+E组的提升效果最为明显;而VEGFR-2、MMP-9、CD47基因的mRNA表达均受到抑制,并以T+E组的抑制效果最为明显。
(二)通过Western blot实验检验了ENL与Trabectedin联合用药对卵巢癌细胞系ES-2中THBS1及相关通路基因(THBS1、CD36、TIMP3、VEGFR2、MMP9、CD47)蛋白表达的影响。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1,获得THBS1 overexpression(OE)组细胞系和negative control(NC)组细胞系。
Western blot实验:常规方法提取卵巢癌细胞系ES-2OE组和NC组细胞蛋白,测定蛋白样品的浓度,配胶,电泳,转膜,一抗,用于检测药物对THBS1相关通路蛋白表达的影响和THBS1/CD36/CD47三分子平衡规律,二抗孵育,洗膜,显色,成像分析。
图24、图25依次为本实施例Western blot实验中卵巢癌细胞系ES-2NC组和OE组蛋白印迹照片。图26-图31为本实施例Western blot实验中NC/OE组THBS1、CD36、TIMP3、VEGFR2、MMP9、CD47基因蛋白表达水平对比图。由图24-图31可以看出,ENL与Trabectedin单独或联合应用时THBS-1、CD36、TIMP-3基因的蛋白表达均得到提升,并以T+E组的提升效果最为明显;而VEGFR-2、MMP-9、CD47基因的蛋白表达均受到抑制,并以T+E组的抑制效果最为明显。
无论是在mRNA水平还是蛋白质水平,THBS-1、CD36、TIMP-3表达增加;VEGFR-2、CD47、MMP-9表达减少。其中T+E联合用药实验组蛋白表达的变化最明显,说明曲贝替定和ENL在抑制卵巢癌的机制上具有协同作用。当THBS-1过表达时,这种变化趋势更加明显,进一步说明了曲贝替定和ENL通过促进THBS-1的表达发挥抑制卵巢癌的作用。
(三)通过Western blot实验检验了ENL与Trabectedin联合用药对卵巢癌细胞系ES-2和A2780中THBS1及相关通路基因(THBS1、CD36、TIMP3、VEGFR2、MMP9、CD47)蛋白表达的影响。
图32、图33依次为本实施例Western blot实验中卵巢癌细胞系ES-2和A2780蛋白印迹照片;图34-图40依次为本实施例Western blot实验中卵巢癌细胞系ES-2THBS1、CD36、TIMP3、VEGFR2、MMP2、MMP9和CD47基因蛋白表达水平对比图;图41-图47依次为本实施例Western blot实验中卵巢癌细胞系A2780 THBS1、CD36、TIMP3、VEGFR2、MMP2、MMP9和CD47基因蛋白表达水平对比图。图32-图47结果显示,ENL与Trabectedin单独或联合用药均可提高THBS1/CD36/TIMP3的蛋白表达水平,并以T+E组的提升效果最为明显;ENL与Trabectedin单独或联合用药均可降低VEGFR2/MMP2/MMP9/CD47的蛋白表达水平,并以T+E组的抑制效果最为明显。
上述结果初步证实图48以THBS1为中心的分子平衡图,卵巢癌中ENL与Trabectedin单独或联合用药可促进THBS1表达,其与CD36、TIMP3呈正相关,与CD47、MMP2/MMP9和VEGFR2呈负相关。
结合图48总结出曲贝替定和ENL抑制卵巢癌的通路,主要内容可以分为两个部分。一方面,曲贝替定和ENL促进THBS-1和CD36的表达,这个过程有助于抑制血管生成。另外,两者结合数量增多,抑制VEGFR-2的表达。因为VEGFR-2与血管生成密切相关,所以进而抑制血管生成。另一方面,曲贝替定和ENL抑制CD47的表达,进而减少CD47和THBS-1结合,抑制癌症侵袭。另外,曲贝替定和ENL能直接抑制MMP-2和MMP-9的表达,也可以通过促进TIMP-3的表达抑制MMP-2和MMP-9,最终结果都能抑制癌细胞转移和侵袭。
实施例4
本实施例通过体内实验检验曲贝替定、ENL和THBS-1过表达对肿瘤生长和血管生成的抑制作用。
本实施例在确定ENL与Trabectedin两种药物的使用浓度之后,将实验分为Ctrl组、Trabectedin组、ENL组和T+E联合用药实验组,其中Trabectedin组的Trabectedin给药量为0.1mg/kg,ENL组的ENL给药量为1mg/kg,T+E联合用药实验组的Trabectedin给药量为0.05mg/kg+ENL给药量为0.5mg/kg,Ctrl组注射定体积PBS缓冲液。
为了观察过表达THBS-1对卵巢癌细胞的影响,本实施例应用卵巢癌细胞系ES-2构建过表达THBS1,获得THBS1 overexpression(OE)组细胞系和negative control(NC)组细胞系。
CDX裸鼠异体成瘤实验(Cell-Derived tumor Xenograft):选用胸腺破坏从而丧失免疫力的小鼠进行该实验。BALB/c裸鼠随机种瘤,随机分组;将细胞浓度调整为1×10
(一)对体内实验各组裸鼠左右两侧的肿瘤体积进行了监测,图49-图52依次本实施例体内实验中卵巢癌细胞系ES-2NC/OE各组肿瘤体积曲线对比图。
对实体瘤进行了拍照,对肿瘤体积和重量进行了测量,图53为本实施例体内实验中卵巢癌细胞系ES-2NC/OE各组实体瘤照片;图54和图55依次为本实施例体内实验中卵巢癌细胞系ES-2NC/OE各组肿瘤体积、肿瘤重量对比图。
由图49-图55可以看出,与左腿大腿根部细胞相比,小鼠右腿即ES-2OE组的实体瘤生长速率明显减慢并且右侧的实体瘤体积值和重量值均显著小于左侧,说明THBS-1能有效地抑制小鼠体内肿瘤生长。
图56为本实施例体内实验中卵巢癌细胞系ES-2NC/OE各组肿瘤重量方差分析对比图;在对左侧,右侧的实体瘤重进行双因素方差分析后发现,T+E组的实体瘤均明显轻于PBS及单独药物应用组,并且OE组在T+E处理之后的实体瘤重量又明显轻于NC组。
在给药方面,曲贝替定和ENL均能有效地抑制肿瘤在小鼠体内生长,而联合用药抑制效果最佳。
(二)处死小鼠前,我们对小鼠进行了活体成像拍照。图57为本实施例体内实验中各组小鼠的活体成像照片;由图57可以看出,小鼠右腿ES-2OE组的荧光素发光强度明显低于左腿ES-2NC组,也就是说OE组小鼠肿瘤周围血管生成较少,说明THBS-1能有效地抑制肿瘤血管生成。在给药方面,曲贝替定和ENL均能有效地抑制肿瘤周围血管生成,而联合用药抑制效果最佳。
(三)处死小鼠前对小鼠体重进行了监控;处死小鼠后对小鼠体重和小鼠的脾脏重量进行了称量。图58为本实施例体内实验中各组小鼠的体重曲线对比图;图59和图60依次为本实施例体内实验中各组小鼠的体重和脾脏重量对比图。
虽然图59显示不同药物处理后小鼠体重没有明显变化,但是从图58可以发现,联合用药组缓解了由曲贝替定用药后所带来的体重下降。更重要的是,图60显示,曲贝替定组的小鼠脾脏重量有明显的减轻,曲贝替定可能存在明显的副作用。与曲贝替定用药组相比,联合用药组小鼠的脾脏重量有所增加,说明联合用药组中的ENL能减少由曲贝替定所引起的不良反应。
- 一种抗肿瘤联合用药物组合物及其应用
- 一种抗肿瘤的联合用药物组合物及其应用
