一种成肌细胞永生化的方法
文献发布时间:2023-06-19 10:36:57
技术领域
本发明属于生物医药技术领域。更具体地,涉及一种永生化成肌细胞的方法,所得永生化成肌细胞可用于肌营养不良的病理生理学和治疗靶点的研究及相关药物的开发研究。
背景技术
肌营养不良症是指一组以进行性加重的肌无力和支配运动的肌肉变性为特征的遗传性疾病群。肌营养不良症包括先天性肌营养不良症、Becker型肌营养不良等多种类型。部分肌营养不良症会导致运动受损甚至瘫痪。临床上主要表现为不同程度和分布的进行性加重的骨骼肌萎缩和无力,也可累及心肌。肌营养不良的病理生理学和治疗靶点的研究一直受到人类成肌细胞有限增殖能力的限制。从病人的肌肉活检样本中分离制备出可靠和稳定的永生化成肌细胞系是研究病理机制,包括与肌肉老化有关的病理机制的有力工具,也是开发基于基因、细胞或药物生物疗法的创新工具。2011年Mamchaoui K等发表的文章《Immortalized pathological human myoblasts:towards a universal tool for thestudy of neuromuscular disorders》公开了成肌细胞永生化技术对肌营养不良疾病的意义。
正常组织来源的细胞在通常的体外培养条件下可生长和分裂,但经过有限次的细胞传代后,会停止增殖,发生衰老和死亡。这就限制了细胞培养技术的进一步应用.细胞永生化(cell immortalization)指体外培养的细胞经过自发的或受外界因素的影响从增殖衰老危机中逃离,从而具有无限增殖能力的过程。自发永生化的几率非常小,啮齿类动物为10
2015年Journal of Visualized Experiments期刊上发布的文章《Isolation andImmortalization of Patient-derived Cell Lines from Muscle Biopsy for DiseaseModeling》,描述了一种从少量肌肉或皮肤组织中分离活细胞用于原代细胞培养的技术。此外,还提供了一种从原代细胞中获得永生化肌源性细胞系和永生化成纤维细胞系的技术。总之,为下游应用和保存病人来源的细胞提供了一个可靠的方法。但是技术的缺陷:在永生化细胞之前,既病毒转导之前,需要使用流式细胞分选仪纯化肌源性CD56阳性的成肌细胞。这一步需要的细胞数量多,由此需要增加病毒转导之前细胞培养的时间,因为肌源性CD56阳性成肌细胞生长的速度较慢,故经过一段时间扩增后,CD56阳性细胞占比下降较快。其次流式分选会造成一定程度的细胞受损,影响细胞在病毒转导前的状态;再次,流式分选方法分离细胞无法获得百分百的CD56阳性细胞,病毒转导后肌源性CD56阳性成肌细胞比例不稳定,从而导致永生化的细胞群体需要再次进行分选才能获得较高纯度的永生化成肌细胞,增加了流程的工序和时间。最后,流式细胞分选仪分选阳性细胞的价格比较昂贵,且需要专门的仪器进行。除去采用流式分离肌源性CD56阳性的成肌细胞这一缺陷外,文章采用直接向铺有细胞的培养皿中添加逆转录病毒以达到将CDK4和hTERT目的基因导入细胞的目的,目前的研究数据表明,该方法逆转录病毒感染细胞的效果并不显著,筛选成功永生化肌源性CD56阳性细胞的可能性和成功率较低。
2011年Skeletal Muscle期刊上发布的文章《Establishment of clonalmyogenic cell lines from severely affected dystrophic muscles-CDK4 maintainsthe myogenic population》,提出了一种利用过表达细胞周期蛋白依赖性激酶4(Cyclin-dependent kinase4;CDK4)和人端粒酶逆转录酶(human telomerase reversetranscriptase;hTERT)的催化作用,以及随后的克隆步骤,建立永生化成肌细胞系的方法。但是,该技术的缺陷:与上述现有技术相同,直接向铺有细胞的培养皿中添加逆转录病毒以达到将CDK4和hTERT目的基因导入细胞的目的,目前的研究数据表明,该方法逆转录病毒感染细胞的效果并不显著,筛选成功永生化肌源性CD56阳性成肌细胞的可能性较低。本技术用于分离细胞的起始人肌肉活检样本有500到700mg,最后永生化细胞中肌源性CD56阳性成肌细胞为14%,在未进行CD56阳性细胞富集的情况下,进行克隆环筛选永生化肌源性CD56阳性单克隆细胞,筛选效率较低。
另外临床中常常会遇到样本差的问题,比如部分患者年龄大,肌肉疾病导致了肌肉萎缩,以及起始样本量很少(小于30mg),所以部分样本在分离后,其中的成肌细胞的绝对数量和比例都非常低,其中成肌细胞比例基本低于10%,甚至只有1%。对于此类样本目前尚难以成功进行高效的永生化和富集,难以获得较高纯度的永生化成肌细胞。
发明内容
本发明旨在对研发出一套针对永生化肌源性CD56阳性成肌细胞系建立的提升逆转录病毒感染效果,同时降低实验成本、降低操作复杂性,提升单克隆筛选效率的方法。该方法的最佳方案采用更低的细胞用量铺板进行低密度培养,结合逆转录病毒感染过程中以1100g离心30min优选条件下三次连续离心感染细胞,促进病毒对细胞的感染,增加永生化细胞在总细胞中的占比,并结合4-9次反复贴壁富集永生化成肌细胞的改进,以及操作条件的优化控制,极大提高逆转录病毒感染细胞效率,大幅提高永生化成肌细胞的得率;对于起始样本量非常少,尤其是成肌细胞比例非常低、低于10%甚至只有1%的样本,采用本发明的方法可成功进行永生化和富集,且大部分样本可以保证最终得到纯度在70%以上永生化的成肌细胞。
本发明的目的是提供一种永生化成肌细胞的方法。
本发明上述目的通过以下技术方案实现:
一种永生化成肌细胞的方法,包括如下步骤:
S1.细胞准备:
将肌肉样本分离得到的细胞用培养基重悬后铺细胞培养容器培养;
S2.病毒感染:
S21.一轮感染:吸除细胞培养容器中的上清,加入病毒液后进行离心,然后继续培养;
S22.依次重复S21多次,进行多轮感染;
S3.抗性筛选:
取出步骤S2培养后的细胞培养容器,进行抗性筛选,筛选后继续细胞培养;
S4.反复贴壁富集永生化成肌细胞
S41.步骤S3所得细胞进行细胞消化,并用培养基重悬,把细胞全部种到培养容器中,静置培养;
S42.将上清移至新的培养容器中,静置培养;
S43.重复步骤S42至少4次,取得最后一次静置培养获得的贴壁细胞,即得到富集后的永生化成肌细胞。
为了控制更佳的效果,上述方案中,优选地,步骤S1中培养至贴壁细胞数为500~8571个细胞/cm
更优选地,步骤S1中培养至贴壁细胞数为850~4285个细胞/cm
更优选地,步骤S1中培养至贴壁细胞数为1500~3800个细胞/cm
优选地,步骤S2所述离心条件为800~1500g离心20~60min。
更优选地,步骤S2所述离心条件为1100g离心30min。
优选地,步骤S22中依次重复S21一至四次。
更优选地,步骤S22中依次重复S21两次,进行二轮感染和三轮感染;即步骤S2病毒感染的步骤如下:
S21.一轮感染:吸除步骤S1培养后的细胞板中的上清,加入两种逆转录病毒混合液后封口,800~1500g离心20~60min,然后培养8~24小时;
S22.二轮感染:取出S21培养后的细胞板,吸除培养基,加入两种逆转录病毒混合液后封口,800~1500g离心20~60min,然后培养8~24小时;
S23.三轮感染:取出S22培养后的细胞板,吸除培养基,加入两种逆转录病毒混合液后封口,800~1500g离心20~60min,然后培养8~24小时。
优选地,步骤S21中培养时间为8~24小时。
优选地,步骤S43中重复步骤S42操作3-8次。
优选地,步骤S4中静置培养时间为0.25-1.2小时。
更优选地,步骤S4中静置培养时间为1小时。
另外,步骤S2所述病毒为基因工程化的病毒载体,其中包装有用于永生化成肌细胞的基因和用于抗性筛选的基因。
所述病毒载体可为逆转录病毒、慢病毒、腺病毒、腺相关病毒或杆状病毒等。
所述病毒载体中包装的用于永生化成肌细胞的基因可为SV40病毒T抗原、HPV-16病毒E6/E7蛋白编码基因、端粒酶逆转录酶(telomerase reverse transcriptase,TERT)、CDK4、Bim-1、Ras、Myc T58A突变体、HOX蛋白家族成员、p53蛋白siRNA、RB蛋白siRNA或以上基因的组合。
所述病毒载体中包装的用于抗性筛选的基因可为G418抗性基因(neo基因)、puromycin抗性基因(Pac基因)、hygromycin抗性基因(hph基因)、zeocin/phleomycin抗性基因(Sh ble基因)、blasticidin抗性基因(bsr/bls/BSD基因)或以上基因的组合。
作为一种可选择的优选方案,步骤S2所述病毒液为两种逆转录病毒混合液为两种逆转录病毒RV-Neo-hTERT和RV-puro-CDK4,分别是共表达neomycin抗性基因和端粒酶逆转录酶TERT(telomerase reverse transcriptase,TERT)的逆转录病毒,以及共表达puromycin抗性基因和细胞周期蛋白依赖性激酶4(Cyclin-dependent kinase 4,CDK4)的逆转录病毒。病毒由本公司依据2007年Chun-Hong Zhu等发表的文章进行构建、确认、生产和检测。
作为一种可选择的优选方案,步骤S3中抗性筛选所用抗生素为400μg/mL G418和100ng/mL puromycin。
所得永生化成肌细胞可置于37℃细胞培养箱中维持生长。
本发明上述方法中,步骤S1肌肉样本分离得到细胞的主要细胞成分包括:成红细胞、纤维细胞、成肌细胞、脂肪细胞等,经过步骤S1的处理后,贴壁细胞主要包括成纤维细胞和成肌细胞;直至步骤S4后,最后所得为高纯度的永生化成肌细胞。步骤S4的原理为:反复贴壁过程中,最先贴壁的是永生化的成纤维细胞,因此在控制好培养时间以及反复贴壁分离次数的条件下,可将绝大部分的永生化成纤维细胞去除,获得高纯度的永生化成肌细胞。
步骤S41中所述“细胞消化”的具体方法可选用:取出培养后的细胞板,吸除培养基,加入不含钙镁离子的杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline)冲洗细胞后,使用含有1mM EDTA的0.25%胰酶进行细胞消化,至大部分细胞变圆浮起,加入含有血清的完全培养基终止细胞消化。
另外,作为可参考的实施条件,上述方法中细胞培养的条件为30-40℃、70-100%湿度、2-15%CO
步骤S1中的培养基可选用如下成分的培养基:DMEM与Medium 199,Earle's Salts按照4:1的比例配置,加入200mL/L的胎牛血清。
步骤S3中所述“抗性筛选”所用培养基可选用如下成分的培养基:DMEM与Medium199,Earle's Salts按照4:1的比例配置,补充200mL/L胎牛血清,0.02M HEPES,1.4mg/LVitamin B12,0.03mg/L ZnSO4,0.055mg/L dexamethasone,2.5μg/L Human HGF,10μg/LHuman FGF-basic,100ng/mL puromycin,400μg/mL G418。
步骤S3中所述“细胞培养”所用培养基可选用如下成分的培养基:DMEM与Medium199,Earle's Salts按照4:1的比例配置,补充200mL/L胎牛血清,0.02M HEPES,1.4mg/LVitamin B12,0.03mg/L ZnSO4,0.055mg/L dexamethasone,2.5μg/L Human HGF,10μg/LHuman FGF-basic。
步骤S4中培养基的成分与步骤S3中“细胞培养”的培养基成分相同。
作为一种可参考选择的实施方案,以12孔板为例,步骤S1细胞准备的具体方法是:用Gelatin铺12孔板(0.5mL/孔),在37℃二氧化碳培养箱放置20min,然后吸除板中的Gelatin,然后继续在37℃二氧化碳培养箱放置30min,之后将成肌细胞用培养基重悬,按1.5×10
作为一种可参考选择的实施方案,步骤S3抗性筛选的方法为:吸除步骤S2培养后的细胞板中的上清后,加入胰酶将细胞消化下来,使用永生成肌细胞培养基,按照12孔板中1.5E4细胞/孔的密度种板,放置于37℃培养过夜;第二天去除培养基后,加入1mL含相应抗生素的永生成肌细胞培养基开始抗性筛选过程;每隔2-3天,吸除上清,重新加入新鲜的含有筛选抗生素的永生成肌细胞培养基;抗性筛选持续7-12天至未经感染的贴壁细胞全部死亡;逆转录病毒感染的贴壁细胞经筛选后的尚未死亡的部分继续用含有一半浓度的筛选抗生素的永生成肌细胞培养基培养。
本发明永生化成肌细胞的方法采用更低的细胞用量铺板进行低密度培养,结合逆转录病毒感染过程中以特定离心条件下连续离心感染细胞,促进病毒对细胞的感染,增加永生化细胞在总细胞中的占比,并结合多次差速贴壁富集永生化成肌细胞的改进,以及操作条件的优化控制,极大提高逆转录病毒感染细胞效率,大幅提高永生化成肌细胞的得率;对于起始样本量非常少,尤其是永生化的成肌细胞比例非常低、低于10%甚至只有1%的样本,采用本发明的方法进行永生化和富集,可以保证大部分样本最终得到纯度在70%以上永生化的成肌细胞,可以使得所有肌营养不良症患者受益。
而且,以12孔板为例,该技术方案中,以降低细胞密度种板(当未见明显细胞变圆、细胞飘起的现象,而且密度(细胞汇合度)达到3-15%左右时,预备做细胞感染,种板密度0.3×10
本发明的方案至少可以解决以下问题:(1)实验需要的细胞量小,对样本要求更低,对肌肉样本量的需求减少;(2)减小实验起始样本的巨大差异导致的试验结果的差异,缩短成肌细胞永生化所需时间,减少整个过程的费用;(3)提高逆转录病毒感染细胞的效果;(4)缩短成肌细胞永生化所需时间;(5)提升永生化单成肌细胞克隆的筛选效率;(6)减少整个过程的费用。
本发明具有以下有益效果:
本发明的永生化成肌细胞的方法,采用更低的细胞用量铺板进行低密度培养,结合逆转录病毒感染过程中以1100g离心30min条件下三次连续离心感染细胞,促进病毒对细胞的感染,增加永生化细胞在总细胞中的占比,并结合4-6次差速贴壁富集永生化成肌细胞的改进,以及操作条件的优化控制,极大提高逆转录病毒感染细胞效率,大幅提高永生化成肌细胞的得率,可100%获得永生化的成肌细胞,且大部分样本所得永生化成肌细胞的纯度可达70%以上。
对于起始样本量非常少、其中永生化的成肌细胞比例非常低、低于10%甚至只有1%的样本,采用本发明的方法流程进行永生化和富集,可以保证最终得到纯度在40%以上永生化的成肌细胞,这为其后的单克隆筛选降低了很多的工作量。因此,本发明技术可以覆盖使得所有肌营养不良症患者受益。
同时,本发明优化后的技术还具有以下多方面的优势:
1)降低了细胞的使用量,降低了对活体组织的取样量要求。
2)操作简单,实验成本降低,省略在病毒转导之前进行细胞扩增,并进行肌源性CD56阳性细胞的富集的操作。
3)本发明利用三次连续离心感染细胞的方法,有效的将CDK4和hTERT目的基因导入细胞,提升病毒感染效率,实现了细胞永生化的目的,同时免去了细胞传代的操作,简化实验过程,降低样本混淆及污染风险。
4)进行单克隆筛选前,利用成纤维细胞和成肌细胞贴壁速率不同,采用差速贴壁的方法对成肌细胞进行富集,加快筛选进程,减少了由于起始实验样本巨大的差异性带来的实验结果的不稳定性,提升单克隆筛选效率。
附图说明
图1.人肌肉活检样本分离出来的原代贴壁细胞感染前细胞形态和汇合度如图所示。编号分别为A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20的四个原代贴壁细胞在进行逆转录病毒感染前汇合度约为10%。Bar=100μm.
图2.人肌肉活检样本分离出来的原代贴壁细胞感染前CD56阳性原代成肌细胞比例。细胞编号分别为A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20。
图3.三轮逆转录病毒感染贴壁细胞后细胞状态如图所示。编号分别为A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20的四个原代贴壁细胞在逆转录病毒感染后细胞状态良好。Bar=100μm.
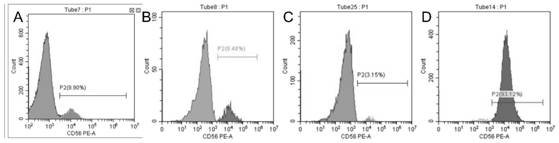
图4.三轮逆转录病毒感染贴壁细胞后细胞中CD56阳性细胞比例。细胞编号分别为A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20。
图5.抗性筛选结束后细胞状态。A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20的四个原代贴壁细胞在抗性筛选结束仍然有梭装成肌细胞存活。Bar=100μm.
图6.抗性筛选结束后CD56阳性永生化成肌细胞比例。细胞编号为A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20。
图7.反复贴壁富集永生化成肌细胞中每次贴壁的细胞状态。其中A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20显示四个不同来源样本,罗马数字I到VIII指示不同样本的贴壁次数。Bar=100μm.
图8.反复贴壁富集永生化成肌细胞过程中每次贴壁的细胞CD56阳性永生化成肌细胞比例。其中A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20显示四个不同来源样本,罗马数字I到VIII指示不同样本的贴壁次数。
图9.RT-PCR检测GMMU2永生化成肌细胞中成肌细胞的定向分化相关因子的表达。结蛋白(Desmin,Des)、成肌分化蛋白(Myogenic Differentiation,MyoD)、肌细胞生成素(Myogenin,MyoG)、配对盒蛋白7(Paired box protein7,Pax 7)、肌钙蛋白I(Cardiactroponin I,troponin I,TNNI 1、TNNI 2)、肌球蛋白重链(Myosin heavy chain,MyHC)和Dystrophin(DYS-N,Dystrophin蛋白N端;DYS-C,Dystrophin蛋白C端)、ACTB(β-Actin)。
图10.部分流式图显示GMMU2永生化成肌细胞单克隆筛选后形成的单克隆CD56的阳性率。第1行左1样本为抗体同型对照,其余流式图显示样本均为不同克隆。该样本共挑选24个克隆,定义CD56阳性大于80%为永生成肌细胞单克隆,则单克隆为永生成肌细胞的比例为91.6%,接近GMMU2永生化成肌细胞起始CD56阳性比例93%。
图11.永生化成肌细胞单克隆经诱导分化形成肌管。其中A).GMMU2;B)GMMU13;C)GMMU14;和D)GMMU20为四个不同来源样本的永生化成肌细胞单克隆。Bar=100μm.
图12.人肌肉活检样本来源贴壁细胞以不同细胞密度种板后采用连续3次离心介导的RV-Neo-EGFP逆转录病毒感染后细胞汇合度和EGFP表达荧光图。Bar=100μm.
图13.以4285个细胞/cm2的密度进行铺板的人肌肉活检来源的贴壁细胞经过1-4次RV-Neo-EGFP逆转录病毒感染所得细胞汇合度和EGFP表达如图。Bar=100μm.
图14.GMMU3抗性筛选后样本(起始CD56表达率为35.8%)以15,30,45和60分钟为反复贴壁富集永生化成肌细胞的贴壁时间进行反复贴壁,每次贴壁的细胞的CD56表达由流式检测。
图15.GMMU10抗性筛选后样本(起始CD56表达率为5.1%)以15,30,45和60分钟为反复贴壁富集永生化成肌细胞的贴壁时间进行反复贴壁,每次贴壁的细胞的CD56表达由流式检测。
图16.实验方案1、2在A)细胞扩增前、B)细胞扩增后、C)病毒感染后、D)抗性筛选13天以及E)停药后培养14天各个阶段的细胞状态图。Bar=100μm.
图17.实验方案3在A)起始细胞、B)病毒感染后C)抗性筛选13天以及D)停药后培养14天各个阶段的细胞状态图。Bar=100μm.
图18.实验方案4、5在A)细胞扩增前、B)细胞扩增后、C)病毒感染后、D)抗性筛选13天以及E)停药后培养14天各个阶段的细胞状态图。Bar=100μm.
图19.实验方案3在A)起始细胞、B)病毒感染后C)抗性筛选后以及D)反复贴壁富集后各个阶段的细胞CD56表达情况。
图20.实验方案4、5在A)细胞扩增前(即起始细胞)、B)细胞扩增后、C)病毒感染后、D)抗性筛选后以及E)反复贴壁富集后各个阶段的CD56表达情况。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。如7水合硫酸锌(ZnSO
实施例1
一、实验细胞:选用人肌肉活检样本分离出来的贴壁细胞,主要细胞成分为成纤维细胞和成肌细胞。人肌肉活检样本由南方医科大学第一临床医学院南方医院提供。
共四个样本,其编号分别为GMMU2,GMMU13,GMMU14和GMMU20,其起始肌肉活检样本的重量在20-60mg之间。
二、人成肌细胞的永生化,步骤如下:
1、细胞准备
(1)用0.1%的Gelatin铺12孔板(0.5mL/孔),在37℃,95%湿度,5%二氧化碳的细胞培养箱放置20min,然后吸除板中的Gelatin,然后继续在该细胞培养箱放置30min,之后取出放置在工作台中备用。
(2)将编号为GMMU2,GMMU13,GMMU14和GMMU20的细胞样本用培养基重悬,按1.5×10
(3)培养24小时后,镜下观察细胞的状态和密度,确认细胞生长状态良好且无细菌或真菌污染,细胞汇合度为3-15%之间或贴壁细胞数为1500~3800个细胞/cm
人肌肉活检样本分离出来的原代贴壁细胞培养24小时状态如图1所示。其中原代贴壁细胞中成肌细胞的比例(即CD56阳性细胞)由流式细胞仪检测。
2、病毒感染
(1)病毒:取出-80℃冻存的由本公司生产的RV-Neo-hTERT和RV-puro-mCDK4逆转录病毒,37℃水浴溶解,放置于4℃储存备用。
(2)一轮感染:取出已经铺板的贴壁细胞的12孔板,移液枪吸除12孔板的上清培养基,加入两种逆转录病毒各1mL,用封口膜对12孔板进行封口,放置在离心机中,1100g离心30min,去除封口膜后将12孔板放入37℃,95%湿度,5%二氧化碳的细胞培养箱培养24小时。
(3)二轮感染:取出含有经过一轮感染的成肌细胞的12孔板,移液枪吸除12孔板的培养基,加入两种逆转录病毒各1mL,用封口膜对12孔板进行封口,放置在离心机中,1100g离心30min,去除封口膜后将12孔板放入37℃37℃,95%湿度,5%二氧化碳的细胞培养箱培养24小时。
(4)三轮感染:取出含有经过二轮感染的成肌细胞的12孔板,移液枪吸除12孔板的培养基,加入两种逆转录病毒各1mL,用封口膜对12孔板进行封口,放置在离心机中,1100g离心30min,去除封口膜后将12孔板放入37℃,95%湿度,5%二氧化碳的细胞培养箱培养24小时。
三轮逆转录病毒感染贴壁细胞后细胞状态如图3所示。图4显示感染后细胞中的CD56阳性成肌细胞比例。
3、抗性筛选
(1)配制含有抗生素的永生成肌细胞培养基,成分为DMEM与Medium 199,Earle'sSalts按照4:1的比例配置,补充200mL/L胎牛血清,0.02M HEPES,1.4mg/L Vitamin B12,0.03mg/L ZnSO4,0.055mg/L dexamethasone,2.5μg/L Human HGF,10μg/L Human FGF-basic,100ng/mL puromycin,400μg/mL G418。
(2)吸除已经进行三次病毒感染的贴壁细胞的12孔板中的上清,胰酶消化细胞后对细胞进行传代,取5×10
(3)移液枪吸除6孔板中的上清,加入2mL含相应抗生素的永生成肌细胞培养基。
(4)每隔2至3天,吸除抗性筛选的成肌细胞的6孔板中的上清,重新加入2mL含相应抗生素的新鲜永生成肌细胞培养基。
(5)抗性筛选后,使用含有一半抗生素用量的永生成肌细胞培养基进行细胞培养。同时,取部分细胞进行流式细胞术检测成肌细胞比例。该培养基的成分为DMEM与Medium199,Earle's Salts按照4:1的比例配置,补充200mL/L胎牛血清,0.02M HEPES,1.4mg/LVitamin B12,0.03mg/L ZnSO4,0.055mg/L dexamethasone,2.5μg/L Human HGF,10μg/LHuman FGF-basic,50ng/mL puromycin,200μg/mL G418。
4、反复贴壁分离永生化成肌细胞
筛选后的细胞经过消化,用永生成肌细胞培养基重悬,把细胞全部种到培养皿中,37℃细胞培养箱静置1小时,然后将上清移至新的培养皿中,继续37℃细胞培养箱静置1小时,原培养皿添加DMEM培养基+10%胎牛血清后置于37℃细胞培养箱中进行培养。重复静置培养-转移上清-静置培养这个操作3-8次,即完成永生化成肌细胞的反复贴壁分离过程。该过程中的所有贴壁细胞都加入DMEM培养基+10%胎牛血清,置于37℃细胞培养箱中进行培养。所得细胞采用流式细胞术检测永生化成肌细胞比例。
永生成肌细胞培养基的成分为DMEM与Medium 199,Earle's Salts按照4:1的比例配置,补充200mL/L胎牛血清,0.02M HEPES,1.4mg/L Vitamin B12,0.03mg/L ZnSO4,0.055mg/L dexamethasone,2.5μg/L Human HGF and 10μg/L Human FGF-basic。
从人肌肉活检样本GMMU2,GMMU13,GMMU14和GMMU20分离得到的贴壁细胞在感染逆转录病毒之前细胞汇合度约为10%左右(图1),且从细胞形态中可分辨出该贴壁细胞主要含有成纤维细胞和成肌细胞,与文献报道相符。流式检测CD56表面表达显示样本起始成肌细胞比例不一,从3%到30%左右(图2)。完成逆转录病毒感染后,细胞增殖和形态都没有受到逆转录病毒感染的影响(图3),绝大部分样本(GMMU13,14和20)中成肌细胞比例轻微降低(图4),与成肌细胞生长速度低于成纤维细胞的文献报道相符。经过抗生素筛选后,所有样本都有部分细胞存活(图5),且还是保持了一定比例的成肌细胞(图6)。在采用反复贴壁进行成肌细胞富集这个步骤中,鉴于不同样本来源的成肌细胞和成纤维细胞贴壁能力的不同,贴壁的次数从4次到8次,每次贴壁后细胞形态可以大致反映贴壁细胞的种类(图7),而采用流式检测每次贴壁留存细胞样本中的CD56阳性可以看出,随着贴壁次数的增加,多数样本中成肌细胞比例逐渐增加,而不论是起始样本中成肌细胞比例低至3%或高达30%,经过这一系列的步骤,原代成肌细胞都可以被成功永生化,且其最终比例可稳定在70%以上(图8)。永生化的成肌细胞表达所有成肌细胞应表达的转录因子(图9,以GMMU2为例),且进行单克隆筛选时,单克隆是永生化成肌细胞的阳性率与反复贴壁富集后得到的永生化成肌细胞阳性率一致(图10,以GMMU2为例),从而极大地减少了后期单克隆筛选的工作量。得到的单克隆成肌细胞经过诱导可分化为肌管(图11),证明永生化的成肌细胞保留了其最重要细胞学功能。GMMU2、GMMU13、GMMU14和GMMU20所得永生化成肌细胞均已在体外生长超过3个月,远远超过原代细胞可在体外生长的时长,且永生化的成肌细胞增殖能力与早期原代成肌细胞相仿(数据未显示),说明本专利的永生化的过程确实使得原代成肌细胞永生化,摆脱了原代细胞的增殖衰老危机。
本发明上述方法,在病毒转导之前,未进行肌源性CD56阳性细胞的富集,降低操作复杂性,降低成本,保证了细胞活力。使用1.5×10
本发明采用三次连续离心感染细胞的方法,即细胞种板24小时后离心感染一次,继续培养8-24小时后,再离心感染一次,继续培养8-24小时后,进行第三次离心感染,增加了逆转录病毒对细胞感染的量,使永生化细胞数在总细胞数的占比增大,从而有利于后期永生化细胞系的筛选。同时因种板的细胞密度低,三次感染后细胞不会出现太密的情况,免去了细胞传代的操作,降低了实验的复杂性,减少了交叉污染的可能,便于实验人员操作。本发明利用成纤维细胞和成肌细胞贴壁速率不同,采用反复贴壁的方法对成肌细胞进行富集,加快筛选进程,减少了由于起始实验样本巨大的差异性带来的实验结果的不稳定性,提升单克隆筛选效率。
实施例2条件摸索
我们针对常见临床样本的“质”和”量“都不佳的情况,对永生化整体流程进行了设计和优化,使得可以从临床样本中稳定、高效、低成本地得到永生化的成肌细胞系。以下对方法中的关键步骤(感染的细胞密度、感染的次数、反复贴壁实验中每次贴壁的时长、反复贴壁的次数等)的实验条件进行考察。
1逆转录病毒感染起始的细胞密度
采用表达neomycin抗性基因和绿色荧光蛋白EGFP基因的逆转录病毒(RV-Neo-EGFP)感染人活检肌肉来源的贴壁细胞(包括原代成纤维细胞和原代成肌细胞),以感染前铺板密度为单因素进行考察,以下表格展示了感染前铺板密度为850cells/cm
实验具体步骤参考实施例1中第二部分“人成肌细胞的永生化步骤”的操作。其中RV-Neo-EGFP逆转录病毒由本公司生产,其病毒滴度为5.67×10
表1不同起始细胞密度连续感染三次后细胞汇合度和感染效率比较
其中“√”表示有进行图片收集。四种不同密度(850-14285cells/cm
2逆转录病毒感染的次数
采用表达neomycin抗性基因和绿色荧光蛋白EGFP基因的逆转录病毒(RV-Neo-EGFP)感染人活检肌肉来源的贴壁细胞(包括原代成纤维细胞和原代成肌细胞),感染前铺板密度为4285cells/cm2(1.5E4/well,12孔板),观察每次感染后(共4次)1)感染后细胞汇合度,2)感染效率。汇合度通过收集显微镜下明场图片判定;感染效率通过收集显微镜下荧光图片及每次感染后流式检测EGFP荧光率来判定。
实验具体步骤参考实施例1中第二部分“人成肌细胞的永生化步骤”的操作。其中,RV-Neo-EGFP逆转录病毒由本公司生产,其病毒滴度为5.67×10
表2病毒不同感染次数比较表。其中“√”表示有进行图片收集
随感染次数增加,EGFP阳性细胞比率持续增加(图13,表2),但由于在该细胞密度条件下,第4次感染前细胞汇合度已超过90%),易造成细胞分化,因此感染3次病毒较适宜。
另外,我们还对感染过程中离心条件进行了考察,结果显示800~1500g离心20~60min较佳;优选1100g离心30min。
3反复贴壁实验中每次贴壁的时长
以编号为GMMU3和GMMU10的抗性筛选后的细胞为样本,采用不同的反复贴壁时间(15min,30min,45min和1小时),观察贴壁后贴壁细胞中CD56阳性比例;实验具体步骤参考实施例1中第二部分“人成肌细胞的永生化步骤”进行。贴壁后对贴壁细胞进行拍照,记录细胞状态和细胞形态;贴壁细胞消化后采用流式检测CD56表达;以上的照片和流式图数据此次未添加入本资料。
当起始样本中永生化的成肌细胞比例较高时(图14,GMMU3样本,初始CD56%为35.8%),使用4个反复贴壁的不同贴壁时长进行贴壁操作,60min差速贴壁第5次CD56阳性率达最高90.46%,其余间隔时间均<90%,且在贴壁1-4次中,60min间隔时间能更快富集CD56阳性永生化成肌细胞,使细胞得到纯化。当起始样本中永生化的成肌细胞比例较低时(图15,GMMU10样本,初始CD56%为5.1%),在4个反复贴壁的不同贴壁时长中,30min贴壁时长的反复贴壁第7次可使CD56阳性永生化成肌细胞比率达到61.99%,但在贴壁1-4次中,60min间隔时间相对能更快使细胞得到纯化,与GMMU3样本的趋势一致。综上,选择60min作为反复贴壁的贴壁时长在不同的样本条件下都能得到较为满意的结果。
另外,我们还对反复贴壁的次数进行了考察,结果显示至少反复贴壁4次较佳;优选反复贴壁4-9次。
对比例本方法与原有方法的对比
成肌细胞永生化的过程由多个环节和因素构成,而其中每个环节和因素都有不同的实施方式,且整个过程受条件影响较为敏感。如何能稳定、高效、低价地将异质性极高的临床样本转化为永生化成肌细胞即为关键。
我们以临床样本中起始成肌细胞比例较低的一个样本(CD56阳性率为9.9%),综合现有成肌永生化步骤的不同实施方法和组合,设计实验对比了不同的实施方法和其组合对最终得到永生化的成肌细胞的影响。
成肌永生化的关键步骤为4步,分别是细胞准备、病毒感染、抗性筛选和富集。具体地,我们将每个步骤的实施方式做了优化改进,其中细胞准备的实施方式分为细胞扩增和无细胞扩增两种,病毒感染可以分为polybrene介导的感染和离心介导的三次连续感染两种,抗性筛选的实施方式只有一种,富集的实施方式分为反复贴壁富集或不富集。实验结果有两个评价指标,1)是否成功得到永生化的成肌细胞;2)永生化的成肌细胞占总体的比例。同时实验过程中,持续监测了每个步骤结束后成肌细胞的比例和细胞状态。
具体实验设计分组如下表所示:
表3一共5个实验方案在4个实验步骤中选取的不同的实施方法及其组合
实验步骤按照方案的不同,其简略步骤如下:
方案1、2
(1)细胞扩增:使用原代成肌细胞培养基,按照5×10
(2)病毒感染:第1天将细胞消化下来,使用原代成肌细胞培养基,按照5×10
(3)抗性筛选:设实验组(病毒感染的成肌细胞)、阴性组(未处理的成肌细胞),第1天将细胞消化下来,使用永生成肌细胞培养基,按照5×10
方案3
(1)细胞准备:这一步骤中不进行细胞增殖。
(2)病毒感染:第1天将细胞消化下来,使用原代成肌细胞培养基,按照1.5×10
(3)抗性筛选:设实验组(病毒感染的成肌细胞)、阴性组(未处理的成肌细胞),第1天将细胞消化下来,使用永生成肌细胞培养基,按照5×10
(4)富集:反复贴壁时间60min,4次。放置于37℃、5%CO2和95%相对湿度的培养箱中培养,流式检测CD56阳性率。
方案4、5
(1)细胞扩增:使用原代成肌细胞培养基,按照5×10
(2)病毒感染:病毒感染:第1天将细胞消化下来,使用原代成肌细胞培养基,按照1.5×10
(3)抗性筛选:设实验组(病毒感染的成肌细胞)、阴性组(未处理的成肌细胞),第1天将细胞消化下来,使用永生成肌细胞培养基,按照5×10
(4)富集:根据方案,对方案4的样本采用反复贴壁时间60min每次,一共4次进行贴壁处理。最后得到的细胞放置于37℃、5%CO2和95%相对湿度的培养箱中培养,流式检测CD56阳性率。
实验方案中,方案3是本技术方案,其他方案是综合其他已知方法中的步骤安排和实施细节加以设计。方案1、2、4、5在细胞准备步骤中,加入的细胞扩增步骤是参考了2007年Chun-Hong Zhu等发表的文章《Cellular senescence in human myoblasts is overcomeby human telomerase reverse transcriptase and cyclin-dependent kinase 4:consequences in aging muscle and therapeutic strategies for musculardystrophies以及文章Establishment of clonal myogenic cell lines from severelyaffected dystrophic muscles-CDK4 maintains the myogenic population中对应的条件进行了设计。方案1、2在病毒感染步骤中采取的polybrene介导的逆转录病毒感染实施方法是已知所有其他方法采用的惯常实施方法,方案3、4、5采取的是本技术方案的离心介导的连续3次感染。在富集步骤中,方案3和4采取的是本技术方案的反复贴壁进行永生化成肌细胞的富集,而方案5则按照文献Establishment of clonal myogenic cell lines fromseverely affected dystrophic muscles-CDK4 maintains the myogenic population省略富集这个步骤。
方案1和2在抗性筛选步骤之后没有细胞存活下来(图16D,E及表4),说明病毒感染步骤没有将目的基因导入细胞当中,对比方案3、4、5经过抗性筛选后细胞存活状态(图17,图18及表4)和CD56表达(图19,图20),可知当采用相同逆转录病毒和病毒滴度,由polybrene介导的逆转录病毒感染率远远低于离心介导的3次连续感染的感染率,无法通过抗性筛选阶段,最终成肌细胞永生化不成功。方案4和5的区别在于是否有反复贴壁富集这一步骤,未经反复贴壁富集最终细胞中只有0.84%为永生化的成肌细胞,而经过4次反复贴壁富集后,永生化成肌细胞的比例上升到了17.78%。如果将方案4和方案5得到的永生化细胞用于永生化成肌细胞的单克隆筛选,那么理论上方案4的样本中每6个克隆中就有一个是永生化的成肌细胞形成的单克隆,但是方案5中需要筛选120个单克隆才有可能得到1个永生化成肌细胞形成的单克隆。方案3与其他方案不同之处是省略了细胞增殖步骤,直接进入病毒感染,因此CD56阳性成肌细胞比例在接下去的每一步都相对较高(表4),最后不仅成功得到永生化的成肌细胞,同时最终的细胞中永生化成肌细胞比例达到90%以上,极大减轻了之后单克隆筛选的工作量。
表4
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种成肌细胞永生化的方法
- 一种鸡胚胸肌成肌细胞的分离培养方法
