基于多重PCR技术检测食源性致病菌的试剂盒及方法
文献发布时间:2023-06-19 11:05:16
技术领域
本发明属于生物技术领域,尤其涉及一种基于多重PCR技术检测食源性致病菌的试剂盒及方法。
背景技术
微生物因素是造成食物中毒的最主要原因,预防和控制食源性疾病已引起了世界各国重视,食源性致病菌的检测是食源性疾病预防与控制的关键技术环节。但食源性致病菌的种类繁多,样品相对复杂,为其检测带来诸多不便。传统的病原微生物检测主要依据其形态和生化特征,需要进行细菌分离、培养及一系列生化反应,用时长,程序烦琐,灵敏度较低,无法满足食品安全问题快速检测和报告的要求。因此,建立简便、快速、灵敏、特异、低成本的食源性致病菌检测方法迫在眉睫。
而多重PCR(Polymerase Chain Reaction,聚合酶链反应)快速检测致病菌的技术既能够满足食物中毒事件快速检测的需求,又能进行批量样本多种食源性致病菌筛检,灵敏度高并且降低了检测的费用。该技术可以广泛应用在疾病预防控制部门、药监部门和医疗机构,从而很大程度上完善现有的检测模式,提高目前的检测水平,提升对突发食物中毒事件的应对能力,对全国范围内食品安全突发事件的预防、控制、诊断和治疗都有着重大意义。
通过文献检索发现:肖性龙等人以多重荧光RT-PCR(Reverse Transcription-Polymerase Chain Reaction)检测病毒和液相芯片检测食源性致病菌为主线,研究了以磁珠为介质的病毒总核酸提取方法,其试剂配方中加有裂解液。吴清平研究了轮状病毒、诺瓦克病毒、星状病毒和甲肝病毒的分子检测方法,在多重RT-PCR的核酸提取过程中加入Taq聚合酶并加热,以达到最佳扩增效果。孙边成等人建立一种LAMP(loop-mediated isothermalamplification)分子鉴别检测体系,应用于包括8种细菌(沙门菌属、志贺菌属、金黄色葡萄球菌、副溶血性弧菌、E HEC(Enterohemorrhagic Escherichia coli,肠出血性大肠杆菌)、O157:H7、奇异变形杆菌、霍乱弧菌、单增李斯特菌和2种病毒(诺如病毒和轮状病毒),其中利用通用型核酸提取试剂盒对细菌增菌液和待检标本进行核酸提取。吴海平指出多重PCR技术具有高效性,在同一反应管内同时检出多种病原菌或对多个目的基因进行扩增分析,并建立了检测志贺菌、沙门菌和霍乱弧菌的多重PCR体系。Kawasaki S等人应用多重PCR同时检测肉类中的沙门氏菌、李斯特菌和大肠杆菌等。魏霜等人建立快速检测溶藻弧菌、副溶血弧菌、创伤弧菌、霍乱弧菌4 种食源性致病菌的五重PCR方法。另外,北京卓成惠生生物科技有限公司采用了Qiaxcel Ad vanced毛细管电泳仪作为检测平台,推出了五种致泻大肠杆菌的多重PCR检测试剂盒、副溶血弧菌毒力基因多重PCR检测试剂盒和大肠杆菌O157:H7毒力基因多重PCR检测试剂盒。
综合以上文献检索内容,国内已见多重荧光PCR检测食源性病原体研究中以磁珠或纯化柱为介质的核酸提取方法,整个提取过程需0.5-1小时,检测时间需要2-3小时。已见多重P CR在同一反应管内同时检出多种病原菌进行扩增分析的报道,未见对食源性病致病菌作全面多重检测的报道;已见简单的多重PCR和Qiaxcel Advanced毛细管电泳仪结合的检测平台,但未见的核酸快速提取、食源性致病菌极速荧光PCR结合的多重PCR检测的技术。
另外,样本核酸提取是病原体核酸检测的基础。现在国内外用得较多的核酸提取方法包括Trizol提取法(Life Technology),柱提法(Qiagen,Roche)和磁珠法(Chemagen、Thermo、金麦格)。Trizol提取法提取的核酸得率相对较低,且步骤较为繁杂,整个提取过程耗时1-2 小时,直接影响检测效率。磁珠法的试剂盒在一定程度上提高了核酸提取效率,简化了核酸提取的步骤,也提高了提取的速度,但整个提取过程仍需0.5-1小时。食源性致病菌检测需要操作简单、快速的样本前处理试剂,尤其对于临床样本量较大的病例,简单快速的核酸提取显得尤为重要。此外,常规的PCR扩增体系由于反应所需的酶和引物探针等的局限性,常常无法进行快速PCR且产生满足检测灵敏度需求的检测结果。此外,目前,鉴于多重PCR技术显示出的巨大商业价值和广阔的应用前景,国外很多生物技术公司已致力于多重PCR试剂以及相关技术的开发。此外,国内食源性致病菌试剂盒多为对致病菌单一或二重PCR的检测,有注册证的产品只有上海之江生物科技有限公司生产的金黄色葡萄球菌荧光定量检测试剂盒及深圳市生科源技术有限公司生产的沙门氏菌、志贺氏菌双重实时荧光定量检测试剂盒等为数不多的几个产品,远远不能满足目前市场对食源性致病菌检测的要求和需求。此外,传统的琼脂糖凝胶电泳检测操作复杂、耗时长、且一次检测的样本有限,对结果的判读建立在肉眼读取的基础上也极大的限制了检测的效率以及准确性。
发明内容
本发明实施例的目的在于提供一种基于多重PCR技术检测食源性致病菌的试剂盒,旨在解决背景技术中提出的问题。
本发明实施例是这样实现的,一种基于多重PCR技术检测食源性致病菌的试剂盒,其包括细胞裂解液、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pfu DNA聚合酶和荧光染料;所述细胞裂解液中包含蛋白酶K;所述第一缓冲液包含镁离子和PCR增强剂;所述第二缓冲液包含镁离子和酒石黄。
作为本发明实施例的一种优选方案,所述第一缓冲液中的镁离子浓度为20~30mM。
作为本发明实施例的另一种优选方案,所述第二缓冲液中的镁离子浓度为20~30mM。
作为本发明实施例的另一种优选方案,所述引物组包括:
金黄色葡萄球菌的nuc基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:1~2所示;
阪崎杆菌的cgcA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 3~4所示;
单增李斯特菌的hlyA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:5~6所示;
蜡样芽胞杆菌的gyrB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:7~8所示;
阪崎肠杆菌的cgcA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID N O:9~10所示。
作为本发明实施例的另一种优选方案,所述引物组包括:
霍乱弧菌O139的rfbN基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:11~12所示;
耶尔森菌的ail基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO:13 ~14所示;
副溶血弧菌的tlh基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 15~16所示;
副溶血弧菌的toxR基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID N O:17~18所示;
沙门氏菌的invA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 19~20所示;
志贺氏菌的ipaH基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 21~22所示;
霍乱弧菌O1的rfbN基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:23~24所示;
霍乱弧菌的ctxB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 25~26所示;
霍乱弧菌的hlyA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 27~28所示。
作为本发明实施例的另一种优选方案,所述引物组包括:
大肠杆菌ETEC的elt基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:29~30所示;
大肠杆菌EIEC的ipaH基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:31~32所示;
大肠杆菌O157的rfbE基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:33~34所示;
大肠杆菌EAEC的aggr基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:35~36所示;
大肠杆菌EPEC的eae基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:37~38所示;
大肠杆菌ETEC的est基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:39~40所示;
大肠杆菌的malB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 41~42所示。
作为本发明实施例的另一种优选方案,所述引物组包括:
诺如病毒的GI型基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 43~44所示;
诺如病毒的GII型基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 45~46所示;
扎如病毒的sapo基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 47~48所示;
星状病毒的Astv基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 49~50所示;
肠道腺病毒的Ad1基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 51~52所示;
轮状病毒的RotaF基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 53~54所示。
本发明实施例的另一目的在于提供一种基于多重PCR技术检测食源性致病菌的方法,其是采用上述试剂盒进行,包括以下步骤:
用细胞裂解液对待检测样本进行孵育处理,得到裂解产物;
将裂解产物、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pfu DNA聚合酶、荧光染料和水进行混合后,再进行多重PCR扩增,得到扩增产物;
对扩增产物进行分离检测。
作为本发明实施例的另一种优选方案,所述步骤中,孵育处理的温度为93~97℃。
作为本发明实施例的另一种优选方案,所述步骤中,利用Qiaxcel Advanced毛细管电泳仪能对扩增产物进行分离检测。
本发明实施例提供的一种基于多重PCR技术检测食源性致病菌的试剂盒,其样本裂解后的产物可直接用于该扩增体系进行PCR反应,不影响检测灵敏度,且大大提高检测效率。另外,本发明利用优化的多重PCR技术,在一管反应中同时检测多达10个病原体靶基因,灵敏度高,特异性强,而且提高了检测效率,降低了检测成本,其既能够满足食物中毒事件快速检测的需求,又能进行批量样本多种食源性致病菌筛检。
其中,本发明在核酸提取中添加了高效的细胞裂解液,无需繁琐的抽提纯化步骤,样本裂解后直接用于PCR扩增,能在10分钟内完成从取样至PCR模板的制备,并对核酸作最大程度的保护。提取后的核酸无需纯化,可直接用于扩增,既简化核酸提取过程,同时也大大节约成本。与目前市场上的各种进口、国产样本前处理试剂相比,该提取技术无核酸损失,得率高,对于大批量样本的核酸提取能显著提高效率。这种样本快速前处理方法在国内外都属首创。同时针对食源性监测除了会用到预增菌、血清、肛拭子等简单样本样本外,还会经常性的碰到复杂的食物和环境样本,本技术中研发了基于柱膜提取法的快速样本核酸提取仪,这是目前全球唯一基于柱提法并可配备电池的全自动提取设备,可一次提取16个样本,第一个样本的提取时间为5分钟,以后每个样的提取时间仅为1.5分钟。
另外,本发明利用多重PCR技术,在不影响检测灵敏度和特异性的条件下,一次反应中同时检测多种食源性致病菌的目的基因,能够检测的食源性病原体包括沙门氏菌、志贺氏菌、单增李斯特菌、变形杆菌、副溶血弧菌、霍乱弧菌(O1、O139)、蜡样芽胞杆菌、空肠弯曲菌、耶尔森氏菌、金黄色葡萄球菌、阪崎肠杆菌、大肠杆菌(EPEC(EnteropathogenicEscheri chia coli,致病性大肠杆菌),ETEC(Enterotoxigenic Escherichia coli,肠产毒性大肠杆菌),EIEC (Enteroinvasive Escherichia coli,肠侵袭性大肠杆菌),EAEC(Entericadhesive Escherichia coli, 肠黏附性大肠杆菌),O157:H7)、诺如病毒GⅠ和GⅡ型、轮状病毒、肠道腺病毒及扎如病毒,提高一次性检测致病菌的类别,其大大提高了检测效率,降低了检测成本。
此外,本发明应用Qiaxcel Advanced毛细管电泳仪则可以有效规避上述背景技术提到的弊端。其中,Qiaxcel Advanced毛细管电泳仪采用预制胶,省去了制胶、染色脱色、清洗等步骤,上样后无需手工操作,其对核酸片段的分离效果可达到分辨率5bp。该设备可实现高通量检测,检测效率高,且每12个样品的检测时间仅需10分钟。最后的数据分析全软件操作完成,数据分析标准化,减少人工判断的误差。本发明利用多重PCR技术与QiaxcelAdvanced 毛细管电泳仪的结合,灵敏度高,特异性强,且大大提高了检测效率,降低了检测成本。
附图说明
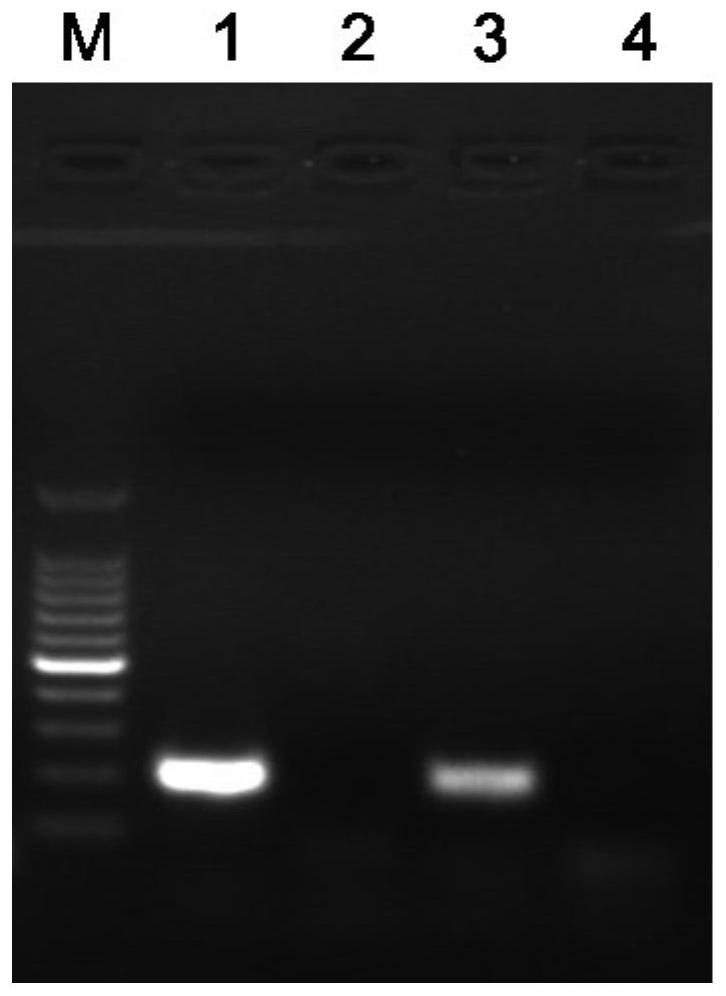
图1为本发明实施例提供的扩增体系与市场上的标准扩增体系的电泳结果对比图。
图2为利用Qiaxcel Advanced毛细管电泳仪对不同食源性致病菌进行检测的电泳结果图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
该实施例提供了一种基于多重PCR技术检测食源性致病菌的试剂盒,其包括细胞裂解液、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pfu DNA聚合酶和荧光染料;其中,细胞裂解液中包含20mg/mL的蛋白酶K、20mg/mL的溶菌酶、 10mM Tris缓冲液(pH7.0)、清洗液和酶裂解缓冲液;第一缓冲液包含镁离子和PCR增强剂,其镁离子浓度为20mM,PCR增强剂为0.2M;第二缓冲液包含镁离子和酒石黄,其镁离子浓度为20mM,酒石黄质量浓度为1%。
另外,该试剂盒可以用于5重PCR扩增体系,其引物组包括:
金黄色葡萄球菌的nuc基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:1~2所示;具体分别为:F5'-TTCTTCACGACTAAATAAACGCTCA-3',R5'-GGTACTACTAAA GATTATCAAGACGGCT-3'。
阪崎杆菌的cgcA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 3~4所示;具体分别为:F5’-TTGATCAGGTCGTCAGAATCTACGGGT-3’,R5’-GCAGATTGTCTTTGTCATACCCG-3’。
单增李斯特菌的hlyA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:5~6所示;具体分别为:F5’-TTCATCCATGGCACCACCA-3’,R5’ACACGCGGATGAAATCGATAAGTATA-3’。
蜡样芽胞杆菌的gyrB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:7~8所示;具体分别为:F5’-GCCCTGGTATGTATATTGGATCTAC-3’,F5’-GGTCATAATAACTTCTACAGCAGGA-3’。
阪崎肠杆菌的cgcA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID N O:9~10所示;具体分别为:F5’-TTGATCAGGTCGTCAGAATCTACGGGT-3’,F5’-GCAGATTGTCTTTGTCATACCCG-3’。
实施例2
该实施例提供了一种基于多重PCR技术检测食源性致病菌的试剂盒,其包括细胞裂解液、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pf u DNA聚合酶和荧光染料;其中,细胞裂解液中包含20mg/mL的蛋白酶K、20mg/mL的溶菌酶、10mM Tris缓冲液(pH7.0)、清洗液和酶裂解缓冲液;第一缓冲液包含镁离子和PCR增强剂,其镁离子浓度为30mM,PCR增强剂为0.2M;第二缓冲液包含镁离子和酒石黄,其镁离子浓度为30mM,酒石黄质量浓度为1%。
另外,该试剂盒可以用于9重PCR扩增体系,其引物组包括:
霍乱弧菌O139的rfbN基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:11~12所示;具体分别为:F5'-TCGTGGACCGAATGATAGTG-3',R5'-CTGCCACCCGTAATAAAGAG-3'。
耶尔森菌的ail基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO:13 ~14所示;具体分别为:F5'-GCTATATGAATGGCAAAGAGGAGG-3',R5'-TGCATCAACGGCAGTAACATATT-3'。
副溶血弧菌的tlh基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 15~16所示;具体分别为:5'-GTATTCACAACGTCAGGTAC-3',R5'-TTACCACTACCACTCTCATA-3'。
副溶血弧菌的toxR基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID N O:17~18所示;具体分别为:F5'-GCTAATGAGGTAGAAACA-3',R5'-ACGTAACGGGCCTAC A-3'。
沙门氏菌的invA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 19~20所示;具体分别为:F5'-GTGAAATTATCGCCACGTTCGGGC-3',R5'-AATCATCGCACCGTCAAAGGAACC-3'。
志贺氏菌的ipaH基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 21~22所示;具体分别为:F 5’-CGCAATACCTCCGGATTCC-3’,R 5’-TCCGCAGAGGCACTGAGTT-3’。
霍乱弧菌O1的rfbN基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:23~24所示;具体分别为:F5'-GGAAATTTGGACGCTCTTCG-3',R5'-TTAACGTCCTCTACGCTCAC-3'。
霍乱弧菌的ctxB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 25~26所示;具体分别为:F5'-GTTCGCGCTGGTGAAGGTTCA-3',R5'-TGGCATACCAGAGTCTTTCTGTG-3'。
霍乱弧菌的hlyA基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 27~28所示;具体分别为:F5'-GCTTTATTGTTCGATGCGTTAAAC-3',R5'-GATGCCAAAATTGTGCGTATCA-3'。
实施例3
该实施例提供了一种基于多重PCR技术检测食源性致病菌的试剂盒,其包括细胞裂解液、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pf u DNA聚合酶和荧光染料;其中,细胞裂解液中包含20mg/mL的蛋白酶K、20mg/mL的溶菌酶、10mM Tris缓冲液(pH7.0)、清洗液和酶裂解缓冲液;第一缓冲液包含镁离子和PCR增强剂,其镁离子浓度为25mM,PCR增强剂为0.2M;第二缓冲液包含镁离子和酒石黄,其镁离子浓度为25mM,酒石黄质量浓度为1%。
另外,该试剂盒可以用于7重PCR扩增体系,其引物组包括:
大肠杆菌ETEC的elt基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:29~30所示;具体分别为:F5'-TCTCTATGTGCATACGGAGC-3',R5'-CCATACTGATTGCCGCAA-3'。
大肠杆菌EIEC的ipaH基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:31~32所示;具体分别为:F5'-GTTCCTTGACCGCCTTTCCGATACCGTC-3',R5'-GCCGGTCAGCCACCCTCTGAGAGTA-3'。
大肠杆菌O157的rfbE基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ ID NO:33~34所示;具体分别为:F5'-TCCTCAGCTATAGGGTGCTTTTG-3',R5'-ATCGAAACAAGGCCAGTTTTTTAC-3'。
大肠杆菌EAEC的aggr基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ I D NO:35~36所示;具体分别为:F5'-GTATACACAAAAGAAGGAAGC-3',R5'-ACAGAATCGTCAGCATCAGC-3'。
大肠杆菌EPEC的eae基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:37~38所示;具体分别为:F5'-TCAATGCAGTTCCGTTATCAGTT-3',R5'-GTAAAGTCCGTTACCCCAACCTG-3'。
大肠杆菌ETEC的est基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO:39~40所示;具体分别为:F5'-TTTCCCCTCTTTTAGTCAGTCAA-3',R5'-GCAGGATTACAACACAATTCACAGCAG-3'。
大肠杆菌的malB基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 41~42所示;具体分别为:F5'-AGAGTTTGATCMTGGCTCAG-3',R5'-GGYTACCTTGTTACGACTT-3'。
实施例4
该实施例提供了一种基于多重PCR技术检测食源性致病菌的试剂盒,其包括细胞裂解液、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas Taq DNA聚合酶、牛血清白蛋白、Pf u DNA聚合酶和荧光染料;其中,细胞裂解液中包含20mg/mL的蛋白酶K、20mg/mL的溶菌酶、10mM Tris缓冲液(pH7.0)、清洗液和酶裂解缓冲液;第一缓冲液包含镁离子和PCR增强剂,其镁离子浓度为25mM,PCR增强剂为0.2M;第二缓冲液包含镁离子和酒石黄,其镁离子浓度为25mM,酒石黄质量浓度为1%。
另外,该试剂盒可以用于6重RT-PCR扩增,其引物组在每条特异性引物的5'端加上同源的尾巴序列,具体包括:
诺如病毒的GI型基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 43~44所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTCGCTGGATGCGNTTCCAT-3 ',R5'-GGGGTCCCAAAAGGGTCAGTCCTTAGACGCCATCATCATTTAC-3'。
诺如病毒的GII型基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 45~46所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTATGTTCAGRTGGATGAGRTTCTCWGA-3',R 5'-GGGGTCCCAAAAGGGTCAGTTCGACGCCATCTTCATTCACA-3'。
扎如病毒的sapo基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 47~48所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTCTCGCCACCTACRAWGCBT GGTT-3',R 5'-GGGGTCCCAAAAGGGTCAGTCGGRCYTCAAAVSTACCBCCCCA-3'。
星状病毒的Astv基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQ IDNO: 49~50所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTACYAGATTYGAGATCCGTG A-3',R5'-GGGGTCCCAAAAGGGTCAGTACRACATGTGCTGCTGTTACT-3'。
肠道腺病毒的Ad1基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 51~52所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTTTCCCCATGGCNCAYAACA C-3',R 5'-GGGGTCCCAAAAGGGTCAGTCCCTGGTAKCCRATRTTGTA-3'。
轮状病毒的RotaF基因的正向引物和反向引物,其核苷酸序列分别如序列表SEQID NO: 53~54所示;具体分别为:F 5'-GGGGTCCCAAAAGGGTCAGTTGTGAATCAGTRCTTGCSG A-3',R 5'-GGGGTCCCAAAAGGGTCAGTATCYCTVGATGGTGAATAGTTAGTRAT-3'。
实施例5
本发明实施例的另一目的在于提供一种基于多重PCR技术检测食源性致病菌的方法,其是采用上述实施例1提供的试剂盒进行,包括以下步骤:
S1、将含有细胞裂解液的核酸提取试剂和待检测样本置于自动加热离心装置中,并于95℃温度下进行孵育处理2min,并经离心,得到裂解产物。其中,传统核酸提取需要多步骤的抽提离心,核酸的提取纯化需要半小时至一小时。本发明改进后的核酸提取试剂含有高效的细胞裂解液,打破常规需要进行样本预增菌,将样本和核酸提取液融为一体,能在10分钟内完成从取样到核酸提取,并对RNA作最大程度的保护。提取后的核酸无需纯化,可直接用于扩增。与目前市场上的各种进口、国产核酸试剂相比,该提取技术尤其对于大批量样本的核酸提取能明显提高效率。另外,所得裂解产物便可直接用于后续荧光PCR检测。该自动加热离心装置为一体化装置,快速简便,降低了样品污染的可能性,并配有电池,非常适合每天现场进行大批量样本的检测。针对复杂样本,我们研制出基于柱膜法的全自动快速样本核酸提取仪,如图 2所示。第一个样本核酸仅需5分钟,之后每个样本1.5分钟就可以完成,30分钟内可完成1 6个样本的核算提取的制备,并可以配置电池。
S2、将上述裂解产物、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas TaqDNA 聚合酶、牛血清白蛋白、Pfu DNA聚合酶、荧光染料和水进行混合后,再置于16通道的微流控PCR样品反应板中,并使用快速实时荧光PCR仪进行多重PCR扩增,得到扩增产物;其中,该快速实时荧光PCR仪可在10分钟内完成DNA模板30个循环的扩增,该设备设计FA M和Cy5两个荧光通道,可同时检测被测目的基因及内标,可进行多达16种致病菌分析,符合临床对分子诊断技术的要求,其大大缩短了检测时间,结果输出效率大幅提高,尤其是对食物中毒的检测具有明显优势。
其中,上述PCR扩增体系为20μL,其组成如表1所示:
表1
另外,PCR反应条件为:预变性94℃、5min,94℃、45s,62℃、45s,72℃、45s,共35个循环,最后72℃延伸7min。
S3、利用Qiaxcel Advanced毛细管电泳仪能对扩增产物进行分离检测,可实现对多样品、多检测指标、不同灵敏度及分辨率要求的检测分析。Qiaxcel Advanced毛细管电泳仪检测平台能够检测15bp-10kb的DNA分子,最高分辨率达到5bp,检测速度达到10分钟每12个样本。这样一个检测平台完全满足对食源性病原体的多重检测。该检测平台的建立重点在于多重扩增体系的建立和对各病原体的特异引物设计。最终应确保扩增特异性达到99%,且扩增片段大小差异足以在Qiaxcel Advanced毛细管电泳仪平台上区分。
另外,Qiaxcel Advanced毛细管电泳仪检测系统本身具有如下先进的技术优势:1、高通量:可一次检测96个样;2、分离范围广,分辨率高:能够分离15bp-10kb的核酸分子,分辨率达到5bp;3、灵敏度高:0.1ng/μL;4、高质量的数字化结果:软件分析,提供样品的分子量大小;/5快速:自动化程度高。多重PCR技术与Qiaxcel Advanced毛细管电泳仪检测系统的结合是一个新的检测平台,灵敏度高,特异性强,而且大大提高了检测效率,降低了检测成本,在技术应用方面走在全国前列。这个环节的主要设计技术为检测平台的适配性,调试以及根据检测平台对试剂的优化。
实施例6
本发明实施例的另一目的在于提供一种基于多重PCR技术检测食源性致病菌的方法,其是采用上述实施例2提供的试剂盒进行,包括以下步骤:
S1、将含有细胞裂解液的核酸提取试剂和待检测样本置于自动加热离心装置中,并于97℃温度下进行孵育处理2min,并经离心,得到裂解产物。
S2、将上述裂解产物、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas TaqDNA 聚合酶、牛血清白蛋白、Pfu DNA聚合酶、荧光染料和水进行混合后,再置于16通道的微流控PCR样品反应板中,并使用快速实时荧光PCR仪进行多重PCR扩增,得到扩增产物。其中,PCR扩增体系和PCR反应条件与实施例5相同。
S3、利用Qiaxcel Advanced毛细管电泳仪能对扩增产物进行分离检测。
实施例7
本发明实施例的另一目的在于提供一种基于多重PCR技术检测食源性致病菌的方法,其是采用上述实施例3提供的试剂盒进行,包括以下步骤:
S1、将含有细胞裂解液的核酸提取试剂和待检测样本置于自动加热离心装置中,并于93℃温度下进行孵育处理2min,并经离心,得到裂解产物。
S2、将上述裂解产物、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas TaqDNA 聚合酶、牛血清白蛋白、Pfu DNA聚合酶、荧光染料和水进行混合后,再置于16通道的微流控PCR样品反应板中,并使用快速实时荧光PCR仪进行多重PCR扩增,得到扩增产物。其中,PCR扩增体系和PCR反应条件与实施例5相同。
S3、利用Qiaxcel Advanced毛细管电泳仪能对扩增产物进行分离检测。
实施例8
本发明实施例的另一目的在于提供一种基于多重PCR技术检测食源性致病菌的方法,其是采用上述实施例4提供的试剂盒进行,包括以下步骤:
S1、将含有细胞裂解液的核酸提取试剂和待检测样本置于自动加热离心装置中,并于95℃温度下进行孵育处理2min,并经离心,得到裂解产物。
S2、将上述裂解产物、引物组、第一缓冲液、第二缓冲液、dNTPs、Fermentas TaqDNA 聚合酶、牛血清白蛋白、Pfu DNA聚合酶、荧光染料和水进行混合后,再置于16通道的微流控PCR样品反应板中,并使用快速实时荧光PCR仪进行多重PCR扩增,得到扩增产物。其中,PCR扩增体系和PCR反应条件与实施例5相同。
S3、利用Qiaxcel Advanced毛细管电泳仪能对扩增产物进行分离检测。
临床样本的验证:
一、将上述实施例5得到的裂解产物直接进行扩增,扩增产物(200bp)取5μL电泳后的结果如图1的泳道1所示,另外,同样的样本,用同样的引物组采用市场上的标准扩增体系进行扩增,电泳后的结果如图1的泳道3所示。从图中,可以看出,本发明实施例提供的扩增体系的扩增效率明显优于市场上的标准扩增体系。
二、利用上述实施例5~8提供的方法对不同食源性致病菌进行检测,其检测得到的电泳图如图2所示。图2中,泳道1:DNA ladder;泳道2-6:对金黄色葡萄球菌nuc、阪崎杆菌c gcA、单增李斯特菌hlyA、蜡样芽胞杆菌gyrBR和阪崎肠杆菌cgcA的五重扩增(2-6各泳道对应不同的模板浓度);泳道7-11:对大肠杆菌O157 rfbE、副溶血弧菌tlh、副溶血弧菌toxR、沙门氏菌invA、志贺氏菌ipaH、变形杆菌16S rRNA、空肠弯曲杆菌16S rRNA的7 重扩增(7-11各泳道对应不同的模板浓度);泳道12-16:对霍乱弧菌O139 rfbN、耶尔森菌 ail、副溶血弧菌tlh、副溶血弧菌toxR、沙门氏菌invA、志贺氏菌ipaH、霍乱弧菌O1 rf bN、霍乱弧菌ctxB、霍乱弧菌hlyA的9重扩增(12-16各泳道对应不同的模板浓度);泳道17-20:对大肠杆菌ETEC elt、大肠杆菌EIEC ipaH、大肠杆菌O157 rfbE、大肠杆菌EAEC aggr、大肠杆菌EPEC eae、大肠杆菌ETEC est、大肠杆菌malB的7重扩增(17-20各泳道对应不同的模板浓度);泳道21-24:对诺如病毒GI型、诺如病毒GII型、扎如病毒、星状病毒、肠道腺病毒、轮状病毒的6重扩增(21-24各泳道对应不同的模板浓度)。从图中可以看出,本发明实施例提供的方法可以同时对一个样品进行多种类别的致病菌检测。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110> 河南省疾病预防控制中心
<120> 基于多重PCR技术检测食源性致病菌的试剂盒及方法
<160> 54
<170> SIPOSequenceListing 1.0
<210> 1
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ttcttcacga ctaaataaac gctca 25
<210> 2
<211> 28
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ggtactacta aagattatca agacggct 28
<210> 3
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ttgatcaggt cgtcagaatc tacgggt 27
<210> 4
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
gcagattgtc tttgtcatac ccg 23
<210> 5
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ttcatccatg gcaccacca 19
<210> 6
<211> 26
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
acacgcggat gaaatcgata agtata 26
<210> 7
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
gccctggtat gtatattgga tctac 25
<210> 8
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
ggtcataata acttctacag cagga 25
<210> 9
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
ttgatcaggt cgtcagaatc tacgggt 27
<210> 10
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
gcagattgtc tttgtcatac ccg 23
<210> 11
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
tcgtggaccg aatgatagtg 20
<210> 12
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
ctgccacccg taataaagag 20
<210> 13
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
gctatatgaa tggcaaagag gagg 24
<210> 14
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 14
tgcatcaacg gcagtaacat att 23
<210> 15
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
gtattcacaa cgtcaggtac 20
<210> 16
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 16
ttaccactac cactctcata 20
<210> 17
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 17
gctaatgagg tagaaaca 18
<210> 18
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 18
acgtaacggg cctaca 16
<210> 19
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 19
gtgaaattat cgccacgttc gggc 24
<210> 20
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 20
aatcatcgca ccgtcaaagg aacc 24
<210> 21
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 21
cgcaatacct ccggattcc 19
<210> 22
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 22
tccgcagagg cactgagtt 19
<210> 23
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 23
ggaaatttgg acgctcttcg 20
<210> 24
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 24
ttaacgtcct ctacgctcac 20
<210> 25
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 25
gttcgcgctg gtgaaggttc a 21
<210> 26
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 26
tggcatacca gagtctttct gtg 23
<210> 27
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 27
gctttattgt tcgatgcgtt aaac 24
<210> 28
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 28
gatgccaaaa ttgtgcgtat ca 22
<210> 29
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 29
tctctatgtg catacggagc 20
<210> 30
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 30
ccatactgat tgccgcaa 18
<210> 31
<211> 28
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 31
gttccttgac cgcctttccg ataccgtc 28
<210> 32
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 32
gccggtcagc caccctctga gagta 25
<210> 33
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 33
tcctcagcta tagggtgctt ttg 23
<210> 34
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 34
atcgaaacaa ggccagtttt ttac 24
<210> 35
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 35
gtatacacaa aagaaggaag c 21
<210> 36
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 36
acagaatcgt cagcatcagc 20
<210> 37
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 37
tcaatgcagt tccgttatca gtt 23
<210> 38
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 38
gtaaagtccg ttaccccaac ctg 23
<210> 39
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 39
tttcccctct tttagtcagt caa 23
<210> 40
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 40
gcaggattac aacacaattc acagcag 27
<210> 41
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 41
agagtttgat cmtggctcag 20
<210> 42
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 42
ggytaccttg ttacgactt 19
<210> 43
<211> 38
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 43
ggggtcccaa aagggtcagt cgctggatgc gnttccat 38
<210> 44
<211> 43
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 44
ggggtcccaa aagggtcagt ccttagacgc catcatcatt tac 43
<210> 45
<211> 46
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 45
ggggtcccaa aagggtcagt atgttcagrt ggatgagrtt ctcwga 46
<210> 46
<211> 41
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 46
ggggtcccaa aagggtcagt tcgacgccat cttcattcac a 41
<210> 47
<211> 43
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 47
ggggtcccaa aagggtcagt ctcgccacct acrawgcbtg gtt 43
<210> 48
<211> 43
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 48
ggggtcccaa aagggtcagt cggrcytcaa avstaccbcc cca 43
<210> 49
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 49
ggggtcccaa aagggtcagt acyagattyg agatccgtga 40
<210> 50
<211> 41
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 50
ggggtcccaa aagggtcagt acracatgtg ctgctgttac t 41
<210> 51
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 51
ggggtcccaa aagggtcagt ttccccatgg cncayaacac 40
<210> 52
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 52
ggggtcccaa aagggtcagt ccctggtakc cratrttgta 40
<210> 53
<211> 40
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 53
ggggtcccaa aagggtcagt tgtgaatcag trcttgcsga 40
<210> 54
<211> 47
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 54
ggggtcccaa aagggtcagt atcyctvgat ggtgaatagt tagtrat 47
- 基于多重PCR技术检测食源性致病菌的试剂盒及方法
- 果蔬中六种食源性致病菌多重LAMP检测引物、检测试剂盒及检测方法
