佛司可林在T细胞培养中的应用
文献发布时间:2023-06-19 11:26:00
技术领域
本发明属于细胞培养领域,具体涉及佛司可林在T细胞培养中的应用。
背景技术
近年来,肿瘤免疫领域飞速发展,正在革命性的改变肿瘤诊疗现状
根据分化程度的不同,可以将T细胞粗略的分为三个亚群:初始T细胞(naive Tcells,Tn)、效应性T细胞(Effector T cells,TE)和记忆性T细胞(Memory T cells,TM)。不同亚群细胞在抗肿瘤免疫中发挥的作用不尽相同,其中记忆性T细胞拥有较长的存活时间,在机体再次遇到初次致敏的抗原时,会产生二次增强性免疫应答,该亚群细胞的数量及比例在很大程度上决定了T细胞免疫的持久性
目前的对提高记忆性T细胞比例的研究主要通过改良体外培养条件进行。临床实践中最常用的提高细胞产品中记忆性T细胞含量的方法,主要是基于IL-7、IL-15、IL-21等细胞因子在记忆性T细胞形成及维持中发挥的关键作用,通过直接向培养系统中添加上述细胞因子或利用转基因的方式在T细胞中过表达上述细胞因子或(和)受体实现的
中国专利201811257117.2提供了一种CD4
中国专利201910376238.7提供了一种外周血记忆T细胞培养方法,所述方法包括:a)将由外周血分离得到的PBMC进行磁珠分选得到CD8
尽管这些方法能够在一定程度上提升细胞产品中记忆性T细胞的比例进而优化治疗效果,但同时存在较多的问题:大规模细胞培养所需细胞因子的量极大,会额外提高细胞产品制备成本;细胞因子的稳定性问题也会影响细胞产品质量的一致性。因此,上述几种细胞因子不能完全满足临床实践对提高T细胞产品中记忆性T细胞含量的要求,亟需筛选更多性质稳定、价格低廉,且能够显著提高记忆性T细胞比例的(小分子)化合物,以达到优化T细胞产品的生物学特性的目的。
[1]S.L.Topalian,J.M.Taube,D.M.Pardoll,Neoadjuvant checkpoint blockadefor cancer immunotherapy,Science 367(6477)(2020).
[2]C.H.June,R.S.O'Connor,O.U.Kawalekar,S.Ghassemi,M.C.Milone,CAR Tcell immunotherapy for human cancer,Science 359(6382)(2018)1361-1365.
[3]S.Mardiana,B.J.Solomon,P.K.Darcy,P.A.Beavis,Supercharging adoptiveT cell therapy to overcome solid tumor-induced immunosuppression,Sciencetranslational medicine 11(495)(2019).
[4]J.Sprent,C.D.Surh,T cell memory,Annual review of immunology 20(2002)551-79.
[5]S.K.Vodnala,R.Eil,R.J.Kishton,M.Sukumar,T.N.Yamamoto,N.H.Ha,P.H.Lee,M.Shin,S.J.Patel,Z.Yu,D.C.Palmer,M.J.Kruhlak,X.Liu,J.W.Locasale,J.Huang,R.Roychoudhuri,T.Finkel,C.A.Klebanoff,N.P.Restifo,T cell stemness anddysfunction in tumors are triggered by a common mechanism,Science 363(6434)(2019).
[6]J.G.Crompton,M.Sukumar,R.Roychoudhuri,D.Clever,A.Gros,R.L.Eil,E.Tran,K.Hanada,Z.Yu,D.C.Palmer,S.P.Kerkar,R.D.Michalek,T.Upham,A.Leonardi,N.Acquavella,E.Wang,F.M.Marincola,L.Gattinoni,P.Muranski,M.S.Sundrud,C.A.Klebanoff,S.A.Rosenberg,D.T.Fearon,N.P.Restifo,Akt inhibition enhancesexpansion of potent tumor-specific lymphocytes with memory cellcharacteristics,Cancer research 75(2)(2015)296-305.
[7]N.Cieri,B.Camisa,F.Cocchiarella,M.Forcato,G.Oliveira,E.Provasi,A.Bondanza,C.Bordignon,J.Peccatori,F.Ciceri,M.T.Lupo-Stanghellini,F.Mavilio,A.Mondino,S.Bicciato,A.Recchia,C.Bonini,IL-7and IL-15instruct the generationof human memory stem T cells from naive precursors,Blood 121(4)(2013)573-84.
[8]L.V.Hurton,H.Singh,A.M.Najjar,K.C.Switzer,T.Mi,S.Maiti,S.Olivares,B.Rabinovich,H.Huls,M.A.Forget,V.Datar,P.Kebriaei,D.A.Lee,R.E.Champlin,L.J.Cooper,Tethered IL-15augments antitumor activity and promotes a stem-cellmemory subset in tumor-specific T cells,Proceedings of the National Academyof Sciences of the United States of America 113(48)(2016)E7788-E7797.
[9]C.Alvarez-Fernandez,L.Escriba-Garcia,S.Vidal,J.Sierra,J.Briones,Ashort CD3/CD28 costimulation combined with IL-21enhance the generation ofhuman memory stem T cells for adoptive immunotherapy,Journal of translationalmedicine 14(1)(2016)214.
发明内容
为了解决上述问题,本发明提供了一种T细胞的培养方法,通过向培养基中添加佛司可林进行T细胞的培养,提高了培养物中记忆性T细胞的比例。
本发明中佛司可林英文为Forskolin,英文简写为FSK。
现有文献表明佛司可林对T细胞增殖有一定的抑制作用(宋兵,曾耀英,黄秀艳,等。Forskolin对小鼠体外T淋巴细胞活化、增殖和周期的影响[J]。中药材,2008(07):1008-1012。),但本申请发现佛司可林对不同T细胞亚群的增殖抑制具有显著的差异性,其对非记忆性T细胞的抑制远强于对记忆性T细胞的抑制。本发明的关键在于利用佛司可林对不同T细胞亚群具有差异化的增殖抑制这一特性。在添加佛司可林培养过程中,记忆性T细胞比例会逐步升高而非记忆细胞比例逐步下降,最终的结果是T细胞产品中记忆性T细胞的提高。
一方面,本发明提供了佛司可林在T细胞培养中的应用。
所述的佛司可林添加在T细胞培养基中。
所述佛司可林添加终浓度为0-40μM,优选为20μM。
在一些实施例中,所述的佛司可林与细胞因子共同作用。
优选地,所述的细胞因子包括但不限于白细胞介素、干扰素、趋化因子、生长因子。
进一步优选地,所述的细胞因子为白细胞介素,包括但不限于IL-2、IL-7、IL-15、IL-21。
在一些实施例中,所述的白细胞介素为IL-2,所述的IL-2的添加量为1000U/mL。
所述的T细胞培养基包括但不限于DMEM培养基,XVIVO培养基。
另一方面,本发明提供了一种T细胞的培养方法。
所述的培养方法中包括向培养基中添加终浓度为0-40μM的佛司可林。
优选地,所述的培养基中佛司可林的添加终浓度为20μM。
优选地,所述的培养基中还包括细胞因子,所述的细胞因子包括但不限于白细胞介素、干扰素、趋化因子、生长因子。
进一步优选地,所述的细胞因子为白细胞介素,包括但不限于IL-2、IL-7、IL-15、IL-21。
在一些实施例中,所述的白细胞介素为IL-2,所述的IL-2的添加量为1000U/mL。
在一些实施例中,所述的培养方法包括以下步骤:
(1)包被细胞培养板;
(2)单个核细胞分离;
(3)用含有佛司可林的培养基重悬细胞后种入培养板进行培养;
(4)转入培养瓶培养。
在一些实施例中,所述的步骤中还包括:
(5)对培养瓶中的培养物进行半量换液。
优选地,所述的培养方法的培养天数为12天。
再一方面,本发明提供了一种T细胞培养基。
所述的T细胞培养基中添加终浓度为0-40μM的佛司可林。
优选地,所述的T细胞培养基中添加终浓度为20μM的佛司可林。
优选地,所述的T细胞培养基中还包括细胞因子,所述的细胞因子包括但不限于白细胞介素、干扰素、趋化因子、生长因子。
进一步优选地,所述的细胞因子为白细胞介素。
在一些实施例中,所述的白细胞介素为IL-2,所述的IL-2的添加量为1000U/mL。
所述的T细胞培养基的基础培养基包括但不限于DMEM培养基,XVIVO培养基。
又一方面,本发明提供了一种T细胞培养物。
所述T细胞培养物通过前述的培养方法制备。
又一方面,本发明提供了一种记忆性T细胞。
所述的记忆性T细胞通过前述的培养方法制备。
又一方面,本发明提供了前述的培养方法和/或T细胞培养物和/或记忆性T细胞在制备肿瘤相关药物中的应用。
所述的药物中包括前述的T细胞培养物和/或记忆性T细胞。
所述的药物中还包括其他药学上可接受的载体。
又一方面,本发明提供了一种治疗肿瘤的药物。
所述的药物中包括前述的T细胞培养物和/或记忆性T细胞。
所述的药物中还包括其他药学上可接受的载体。
本发明的有益效果:
1、与未添加佛司可林的培养系统相比,添加佛司可林的培养系统获得的人T细胞产品中记忆性T细胞(CD62L
2、与未添加佛司可林的培养系统相比,添加佛司可林的培养系统获得的人T细胞体内、外存活时间延长。
附图说明
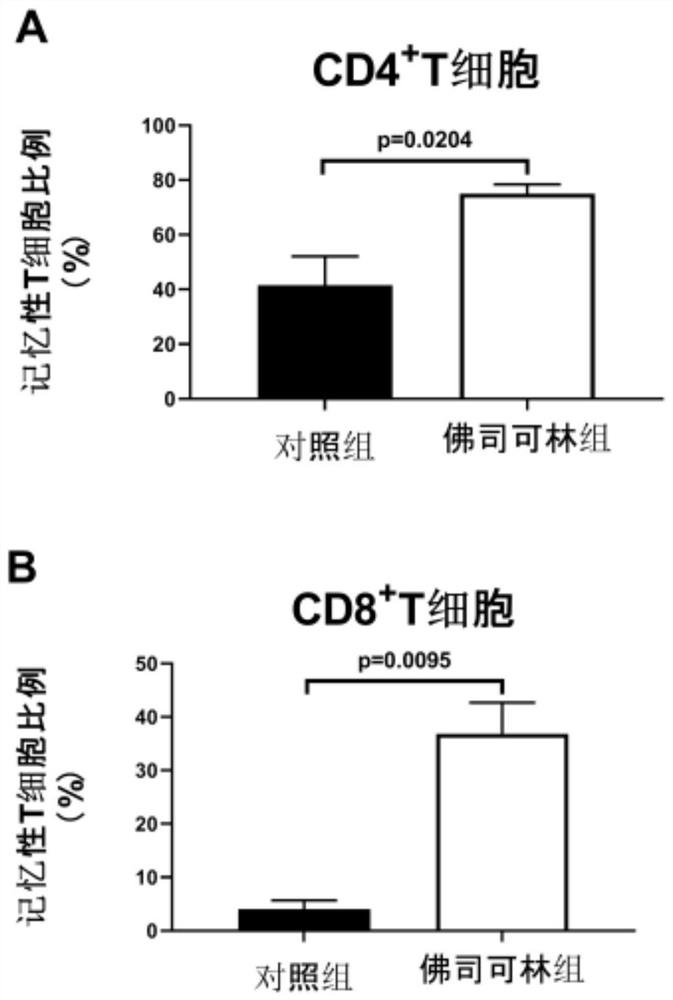
图1为T细胞培养终产品中记忆性CD8阳性T淋巴细胞比例检测的流式细胞仪分析结果(图中Q1为CD3
图2为T细胞培养终产品中记忆性CD4阳性T淋巴细胞比例检测的流式细胞仪分析结果(图中Q1为CD3
图3为T细胞培养终产品中记忆性T淋巴细胞(CD45RA
图4为对照组和佛司可林组细胞培养一段时间后不再添加佛司可林(撤掉佛司可林)进行培养,绘制体外扩增曲线。其中A为0-21天的局部放大图,B为0-28天整体扩增曲线。
图5为对照组和佛司可林组细胞在免疫缺陷小鼠体内存活情况。其中A为小鼠活体成像图片;B为根据DIO标记细胞荧光强度绘制的曲线。
图6为CD19
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1添加佛司可林对制备T细胞终产品的影响
本实施例的实验材料来源为健康志愿者的外周血。
实验试剂包括:血浆(志愿者自体血浆)、人淋巴细胞分离液(中国美德太平洋公司)、抗人CD3单克隆抗体(日本Takara公司)、重组人纤维连接蛋白(日本Takara公司)、XVIVO无血清培养液(美国Lonza公司)、IL-2(山东泉港药业有限公司)、佛司可林(中国MCE公司)、DMSO(美国Sigma公司)。
实验设备包括:FACSCanto II流式细胞仪(美国BD公司)。
细胞培养方法参考步骤如下:
(1)提前包被6孔板,每孔用1.0mL生理盐水添加抗人CD3单克隆抗体(终浓度1.5μg/mL)和重组人纤维连接蛋白(终浓度6μg/mL),充分混匀后在37℃,5%的CO
(2)抽取健康志愿者20mL外周血,用淋巴细胞分离液提取外周血单个核细胞(PBMC);此步骤亦可使用Ficoll密度梯度离心法获得PBMC。
(3)将步骤(2)分离得到的细胞计数后,分别用不含和含有佛司可林(终浓度为20μM)的XVIVO无血清培养液(添加1000U/mL的IL-2和2.5%自体血浆)按1×10
(4)培养4天后,分别将细胞转移入新的细胞培养瓶,并分别补加10倍体积新鲜的不含、含有佛司可林(终浓度为20μM)的XVIVO无血清培养液(添加1000U/mL的IL-2和2.5%自体血浆),继续放置于37℃,5%的CO
(5)之后隔天对步骤(4)中的细胞进行半量换液,即分别用一半体积的不含、含有佛司可林(终浓度为20μM)的新鲜无血清培养液(添加1000U/mL的IL-2和2.5%自体血浆)替换6孔板中的培养液。
(6)培养12天即可得到T细胞终产品,将利用不含、含有佛司可林的培养液得到的细胞分别命名为对照组和佛司可林组。分别取2×10
(7)取步骤(6)得到的T细胞终产品,细胞密度为1×10
(8)分别取1×10
实施例2添加佛司可林对制备T细胞终产品的影响
本实施例的实验方法参照实施例1,区别在于培养基中的佛司可林的添加终浓度为40μM。
结果表明,本实施例得到的T细胞终产品在CD8阳性和CD4阳性T细胞亚群中,佛司可林组的记忆性T细胞比例均高于对照组。同时,统计结果显示佛司可林可以显著提升T细胞终产品中记忆性T细胞比例,且有统计学上的差异。
与IL-2共同作用时,佛司可林组细胞体外扩增较对照组更为持久,其中不添加IL-2组在7-14天保持增殖优势,而添加IL-2组在7-32天保持增殖优势。
体外存活实验结果显示佛司可林组细胞体内扩增较对照组更为持久。
实施例3添加佛司可林对制备CAR-T细胞终产品的影响
实验材料:健康志愿者外周血。
实验试剂:
血浆(志愿者自体血浆)、人淋巴细胞分离液(中国美德太平洋公司)、CD3
实验设备:
FACSCanto II流式细胞仪(美国BD公司)。
细胞培养步骤:
(一)纯化获得CD3
(1)提前包被6孔板,每孔用1.0mL生理盐水添加抗人CD3单克隆抗体(终浓度1.5μg/mL)和RetroNectin(终浓度6μg/mL),充分混匀后在37℃,5%的CO
(2)抽取健康志愿者20mL外周血,用淋巴细胞分离液提取外周血单个核细胞(PBMC);
(3)细胞计数后,每1×10
(4)用磁珠分离液轻轻混匀后,600g离心10分钟后,弃上清,再次用磁珠分离液重悬后过分离柱,并用磁珠分离液冲洗一次;
(5)取下分离柱,用助推柄将包含CD3
(6)将分离得到的CD3
(二)T细胞慢病毒侵染(计为d1天)
向由步骤(一)得到的CD3
(三)去除病毒液(计为d2天)
小心的将步骤(二)处理的细胞培养液吸去,按每孔5mL分别加入新鲜的不含、含有佛司可林(终浓度为20μM)的无血清培养液(添加1000U/mL的IL-2和2.5%自体血浆),继续培养。
(四)扩增培养(计为d4天)
将步骤(三)中的细胞转移至新的175cm
(五)CAR-T终产品检测(计为d8天)
培养8天即可得到CAR-T细胞终产品,将利用不含、含有佛司可林的培养液得到的细胞分别命名为对照组和佛司可林组。分别取2×10
- 佛司可林在T细胞培养中的应用
- 佛司可林及其衍生物在制备抗肺纤维化药物中的应用
