一种产志贺毒素大肠埃希氏菌的选择性分离培养方法
文献发布时间:2023-06-19 11:26:00
技术领域
本发明涉及微生物检测技术领域,尤其涉及一种产志贺毒素大肠埃希氏菌的选择性分离培养方法。
背景技术
产志贺毒素大肠埃希氏菌(Shiga toxin-producing Escherichia coli,STEC)是指一类携带了一种或多种志贺毒素基因的全球性食源性致病菌,可引起人类水样腹泻、出血性肠炎以及高死亡率的溶血性尿毒综合症等。美国食源性疾病数据显示STEC已成为危害排名前3位的食源性致病菌。STEC包括O157、O26、O45、O103、O104、O111、O121、O145等400多种血清型,其中O157:H7是致病力强、且最为常见的血清型。但近年来,非O157 STEC血清型已在世界范围内引起散发感染和爆发流行,呈增加趋势,其感染率可达总STEC感染的30%-60%,已成为全球儿童急性肾衰竭的主要原因之一。
我国的食品安全国家标准中尚无针对性的STEC标准检测方法,现有的国标方法GB4789.6-2016针对致泻大肠埃希氏菌大类,STEC作为其中的一个分类缺乏特异性和专属性;GB 4789.36-2016仅针对STEC O157,不适用于其他血清型STEC的检测。有效检测方法的缺少导致实际样品中STEC的检出率较低,致使全国性相关监测、风险评估工作难以开展。美国FDA/BAM、USDA/MLG及ISO等针对STEC规定了相应的检验方法,上述方法中STEC增菌培养基均使用了不同种类和浓度的抑菌物质,以降低背景杂菌的干扰。然而,由于STEC菌株的遗传多样性非常丰富,不同血清型的STEC菌株对抑菌物质的耐受性存在较大差异,抑菌物质的使用可能会抑制部分STEC菌株的生长,导致“假阴性”检测结果。多篇文献报道STEC菌株的实际分离率远远低于样品中志贺毒素基因的阳性率,现有STEC标准检测方法受到了严峻挑战。
综上所述,为解决现有技术中的不足,迫切需要建立一种产志贺毒素大肠埃希氏菌的选择性分离培养方法,以实现食品中STEC高效准确的分离与检测。
发明内容
本发明的目的是针对现有技术中的不足,提供一种产志贺毒素大肠埃希氏菌的选择性分离培养方法。
为实现上述目的,本发明采取的技术方案是:
提供一种产志贺毒素大肠埃希氏菌的选择性分离培养方法,步骤包括:
将食品样品加至酸处理培养基中,混匀并室温放置一定的时间后,加入中和/促生长培养基并培养一定的时间后,采用产志贺毒素大肠埃希氏菌显色培养基或麦康凯培养基进行划线分离。
优选地,步骤包括:
S1、以无菌操作称取一定量的食品样品,并加至盛有酸处理培养基的无菌均质杯或无菌均质袋进行均质处理,即得样品匀液;
S2、将所述样品匀液于室温环境下静置一段时间;
S3、以无菌操作加入中和/促生长培养基,混合均匀后进行增菌培养,即得增菌培养液;
S4、在无菌环境下,采用无菌接种环,将所述增菌培养液划线接种于产志贺毒素大肠埃希氏菌显色培养基或麦康凯培养基,进行选择性分离培养。
优选地,步骤还包括:
S5、在所述选择性分离培养结束后,挑取特征菌落,进行后续鉴定和确认。
优选地,所述酸处理培养基的配制方法包括:
以胰酪胨大豆肉汤培养基作为基础培养基,加入谷氨酸,并采用1mol/L HCl溶液调节pH至2.0,于121℃压力蒸汽灭菌15-20分钟后,即得所述酸处理培养基。
优选地,所述谷氨酸的终浓度为2mmol/L。
优选地,所述中和/促生长培养基的配制方法包括:
以胰酪胨大豆肉汤培养基作为基础培养基,加入Tris生物碱以及丙酮酸钠,于121℃压力蒸汽灭菌15-20分钟后,即得所述中和/促生长培养基。
优选地,所述Tris生物碱的终浓度为1.5%。
优选地,所述丙酮酸钠的终浓度为0.1%。
优选地,步骤S3中所述增菌培养为于36℃±1℃培养18-24小时。
优选地,步骤S4中所述选择性分离培养为于36℃±1℃培养18-24小时。
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
本发明利用大肠埃希氏菌天然耐低酸的特性,开发了基于酸处理的STEC选择性分离培养方法,通过增菌前有效抑制背景干扰菌,从而保证目标菌STEC在增菌过程中的有效增殖。该方法对于STEC的分离效果大大优于现有技术方法,且经过优化的中和/促生长培养基配方对常见胁迫状态的STEC菌株具有一定的修复作用,可提高食品中STEC菌株的检出率。本发明方法操作简单,对STEC菌株分离效果好,且不使用选择性抑菌剂,避免了因菌株耐受性差异造成的漏检,大大提高了STEC检测方法和检出率准确性。
附图说明
图1为对营养胁迫和冷冻胁迫状态的12株STEC菌株酸处理后的生长情况图;
图2为中和/促生长培养基中不同添加成分对营养胁迫状态STEC菌株生长的影响图;
图3为中和/促生长培养基中不同添加成分对冷冻胁迫状态STEC菌株生长的影响图;
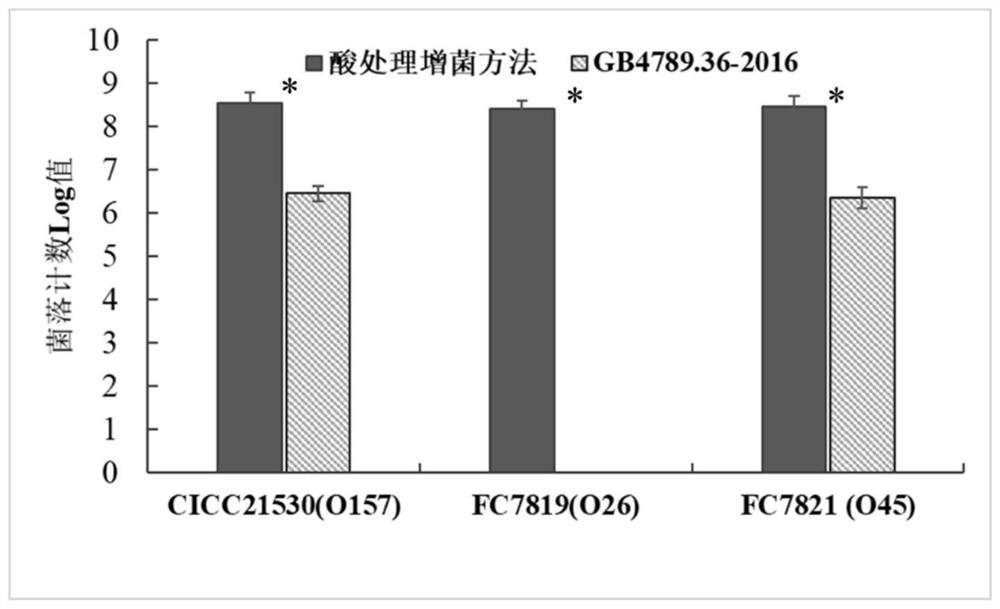
图4为本发明方法与GB4789.36对人工污染样品定量检测结果图。
具体实施方式
提供一种产志贺毒素大肠埃希氏菌的选择性分离培养方法,步骤包括:
S1、采用天平以无菌操作称取25g±0.25g的食品样品,并加至盛有125mL酸处理培养基的无菌均质杯或无菌均质袋进行均质处理5min,即得样品匀液;
S2、将所述样品匀液于20℃-25℃室温环境下静置2小时;
S3、以无菌操作加入125mL中和/促生长培养基,混合均匀后于36℃±1℃进行增菌培养18-24小时,即得增菌培养液;
S4、在无菌环境下,采用无菌接种环,将1环所述增菌培养液划线接种于产志贺毒素大肠埃希氏菌显色培养基或麦康凯培养基,于36℃±1℃进行选择性分离培养18-24小时;
S5、在所述选择性分离培养结束后,挑取特征菌落,进行后续鉴定和确认;
其中,所述酸处理培养基的配制方法包括:以胰酪胨大豆肉汤培养基作为基础培养基,加入谷氨酸(终浓度为2mmol/L),并采用1mol/L HCl溶液调节pH至2.0,于121℃压力蒸汽灭菌15-20分钟后,放置冷却备用即可;
其中,所述中和/促生长培养基的配制方法包括:以胰酪胨大豆肉汤培养基作为基础培养基,加入Tris生物碱(终浓度为1.5%)以及丙酮酸钠(终浓度为0.1%),于121℃压力蒸汽灭菌15-20分钟后,放置冷却备用即可。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
①筛选STEC酸处理培养条件
将12株STEC以及13株背景干扰菌,分别接种于新鲜TSB中,36℃过夜培养后,分别将STEC菌株和背景干扰菌稀释成10
结果显示,所有STEC试验菌株在pH2.0培养基中酸处理4h后均能存活,而13株背景干扰菌,则表现出了明显的耐酸性差异。其中Morganella morganii、Proteus vulgaris、Proteus mirabilis尽管比其它背景菌具有更强的耐酸性,但pH2.0处理2h后也丧失了存活能力。综上,pH2.0室温处理2h,可作为STEC菌株酸处理的有效筛选条件。
表1 STEC及背景干扰菌株在不同酸处理条件下的生长情况
②胁迫状态STEC菌株的耐酸性评价
将营养胁迫(TSB过夜培养后室温放置45天)和冷冻胁迫(生理盐水菌悬液-20℃冷冻处理7天)状态的12株STEC菌株分别进行计数,然后稀释成10
营养胁迫和冷冻胁迫状态的12株STEC,在酸处理培养基(pH 2.0)室温培养2h后,均显示出了较好的生长特性(图1)。研究结果显示,低酸处理不会明显影响胁迫状态STEC菌株的生长。
③增菌前与增菌后酸处理STEC菌株的分离效果
选择CICC21530(O157)、FC7819(O26)和FC7821(O45)3株STEC菌株,以及8种常见背景干扰菌,研究增菌前与增菌后酸处理对STEC菌株分离效果的影响。各取1mL过夜培养的背景干扰菌液,等比例混合后,分别稀释到10
增菌前酸处理:将1mL上述混合菌液接种至9mL pH2.0的TSB,室温处理2h后,转移至90mL TSB培养基,36℃培养18h后,采用大肠埃希氏菌显色培养基进行STEC计数;增菌后酸处理:将1mL混合菌液接种至90mL TSB培养基,36℃培养18h后,吸取1mL增菌液接种至9mLpH2.0的TSB,室温处理2h后,采用大肠埃希氏菌显色培养基进行STEC计数。
增菌前酸处理和增菌后酸处理,STEC和背景菌的定量检测结果表明(表2):对于不同接种量的背景菌,增菌前进行酸处理,大肠埃希氏菌显色培养基上均未检出相关背景菌,而3株STEC的检出数量均在10
表2增菌前和增菌后酸处理STEC和背景菌菌落计数结果
④STEC菌株酸处理后中和/促生长培养基的优化
本发明以TSB为基础培养基,以Tris生物碱作为pH调节剂,分别评价了酸水解酪蛋白、酵母提取物和丙酮酸钠等作为中和/促生长培养基配方,对常见胁迫状态下STEC生长的影响。本研究考察的中和/促生长培养基配方分别为:1)TSB-1.5%Tris-1%酸水解酪蛋白(TSB-酪蛋白氨基酸)、2)TSB-1.5%Tris-0.6%酵母提取物(TSB-酵母提取物)、3)TSB-1.5%Tris-0.1%丙酮酸钠(TSB-丙酮酸钠)、4)TSB-1.5%Tris-1%酸水解酪蛋白-0.6%酵母提取物-0.1%丙酮酸钠(TSB-复合)。其中1.5%的Tris生物碱可使酸处理培养基与中和/促生长培养基等比例混合后,pH恢复至中性。
使用酸处理培养基,将营养胁迫和冷冻胁迫状态的6株代表性STEC菌株稀释成1~10CFU/100μL,加入到96孔板中,室温处理2h后,分别加入100μL上述4种不同配方的中和/促生长培养基,36℃培养18h~24h,使用酶标仪连续监测STEC目标菌的生长情况。
图2显示了酸水解酪蛋白、酵母提取物和丙酮酸钠等不同添加成分,对营养胁迫状态STEC菌株生长的影响,结果表明对于试验的STEC试验菌株,不同配方均未表现出明显差异;图3显示了不同添加成分对冷冻胁迫状态STEC菌株生长的影响,结果表明丙酮酸钠相比于其他成分具有一定的促生长作用,特别是对于血清型O111、O145的STEC菌株。因此,本研究选择TSB-1.5%Tris-0.1%丙酮酸钠(TSB-丙酮酸钠)作为STEC酸处理后的中和/促生长培养基。
为测试本发明中产志贺毒素大肠埃希氏菌选择性分离培养方法在食品实际样品检测中的效果,同时与现有技术方法GB4789.36-2016进行比较评价。本研究在市场上购买了新鲜牛肉馅样品,采用GB4789.36-2016进行STEC检测,结果显示样品STEC阴性,本底污染微生物数量为4.2×10
人工污染样品的制备:取新鲜培养的STEC菌株CICC21530(O157),FC7819(O26)和FC7821(O45)的菌悬液,分别制备污染量约为1CFU/g的人工污染样品。
采用本发明建立的产志贺毒素大肠埃希氏菌的选择性分培养离方法进行人工污染样品检测:1)取25g人工污染样品,加入125mL pH2.0的酸处理培养基,混匀后室温放置2h;2)加人125mL中和/促生长培养基36℃培养18-24h;3)使用大肠埃希氏菌显色培养基进行目标菌STEC的划线分离和计数。
采用GB4789.36-2016方法进行人工污染样品中STEC菌株的检测:1)取25g人工污染样品,加入225mL肉汤,混匀后36℃培养18-24h;2)取增菌后的mEC+n肉汤,使用大肠埃希氏菌显色培养基进行目标菌STEC的划线分离和计数。
检测结果表明,在样品本底污染量为4.2×10
综上所述,本发明利用大肠埃希氏菌天然耐低酸的特性,开发了基于酸处理的STEC选择性分离培养方法,通过增菌前有效抑制背景干扰菌,从而保证目标菌STEC在增菌过程中的有效增殖。该方法对于STEC的分离效果大大优于现有技术方法,且经过优化的中和/促生长培养基配方对常见胁迫状态的STEC菌株具有一定的修复作用,可提高食品中STEC菌株的检出率。本发明方法操作简单,对STEC菌株分离效果好,且不使用选择性抑菌剂,避免了因菌株耐受性差异造成的漏检,大大提高了STEC检测方法和检出率准确性。
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。
- 一种产志贺毒素大肠埃希氏菌的选择性分离培养方法
- 一种被变形杆菌污染的产志贺毒素大肠埃希氏菌的纯化方法
