预测癌症患者对化疗反应的标志物及应用
文献发布时间:2023-06-19 11:34:14
技术领域
本发明涉及肿瘤学领域,具体地涉及一种预测癌症患者对化疗(化学疗法) 反应的标志物及应用。
背景技术
肺癌是全世界男性和女性癌症死亡的主要原因,每年死亡人数超过一百万。肺腺癌(AD)是非小细胞肺癌(NSCLC)的主要类型,近年来发病率增加。尽管在治疗该疾病方面取得了很大进展,尤其是针对某些基因的新药物和抗 PD-1免疫疗法的利用,但是铂基(顺铂或卡铂)双药化疗仍是标准的首选药物,晚期NSCLC患者无敏感EGFR突变(NCCN指南;http://www.nccn.org/professionals/)的常规治疗可改善生存结果。不幸的是,化疗功效不足,因为大多数临床实验中的缓解率均低于40%。近年来,化疗已达到治疗平台,进展甚微,只有少数患者受益。因此,临床医生迫切需要选择可能从化疗中受益的最佳患者来参与这种毒性治疗。
发明内容
本发明提供了一种预测癌症患者对化疗反应的标志物及应用。
本发明提供一种预测癌症患者对化疗反应的标志物,所述标志物过氧化物酶6。
进一步,所述癌症为肺癌。
更进一步,所述癌症为肺腺癌。
更进一步,所述化疗是铂基双药化疗。
本发明还提供一种所述的标志物的检测试剂及包含该检测试剂的试剂盒。
本发明通过标志物实现预测癌症患者对化疗反应的敏感性,可用于化学疗法反应预测和指导患者的个性化治疗。
附图说明
图1是用主数字标记并显示在代表性的2D-DIGE图像中的人肺腺癌中差异表达的蛋白质斑点。
图2是通过DeCyder 6.5软件分析的药物敏感肿瘤与耐药组织之间的上调(左)和下调(右)点。
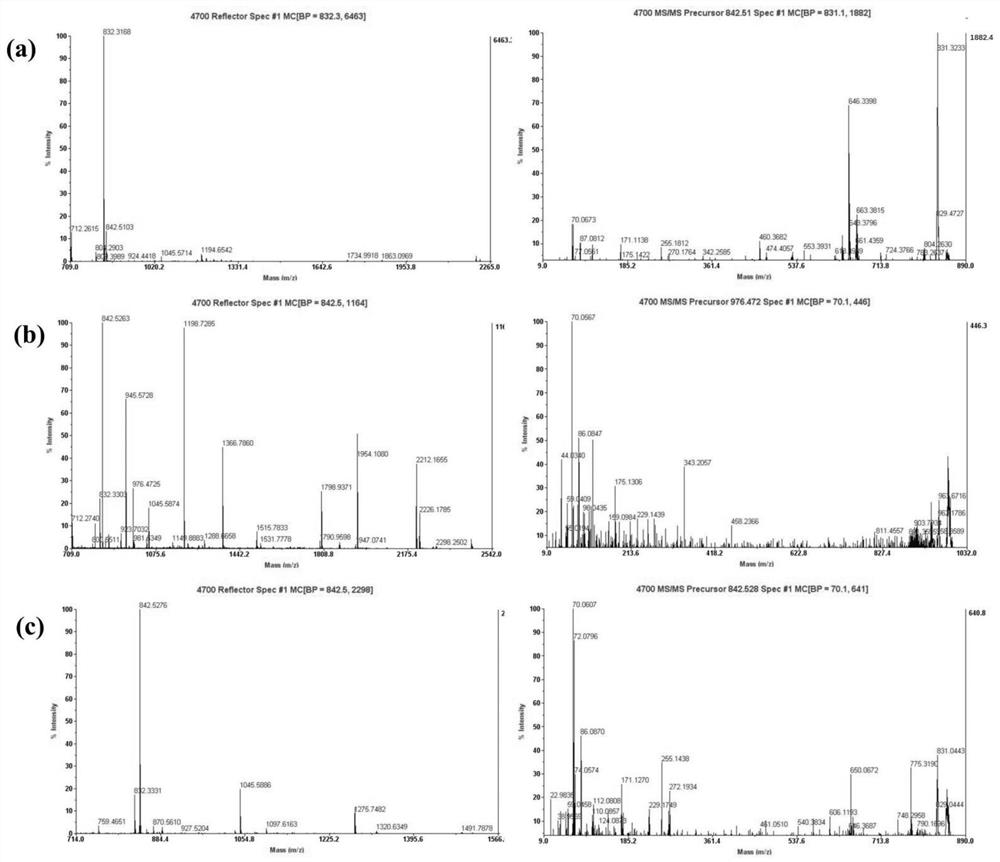
图3是胰蛋白酶消化后的PRDX2(a)、PRDX6(b)和凝溶胶蛋白(c)的 MALDI-TOF MS光谱(左)及对应的MS/MS光谱(右)。
图4是基于SWISS-PORT和NCBInr数据库中功能注释的差异表达蛋白分类。
图5是PRDX2、PRDX6和凝溶胶蛋白的免疫化学筛选的结果和统计分析。
具体实施方式
下面结合具体实施方式对本发明作详细说明。
本发明的目的在于提供一种预测癌症患者对化疗反应的标志物及应用。
样品采集
所有组织均从中国医学科学院肿瘤研究所和医院的患者中收集。这些患者中均没有在化疗之前接受过抗肿瘤治疗。所有组织样品均由经验丰富的医师通过支气管镜检查并由两名经验丰富的病理学家独立检查。对于 2D-DIGE,在2007-2008年期间获得了六对具有不同化疗反应的治疗前的新鲜原发性肺腺癌(表1)。排除经组织病理学评估确认的坏死组织。切除后立即将样品在液氮中速冻,并保存在-80℃直至使用。为了进行免疫组织化学分析,在1999-2008年间通过支气管镜获得92个石蜡包埋的预处理的肺癌组织。所有入选患者在化疗前均未接受抗肿瘤治疗。所有入选患者的化疗均采用基于顺铂的方案(两种药物)。对于所有参与者,都可获得临床病理信息(年龄、性别、病理、分化、吸烟史、TNM分期和化疗反应)。该研究得到中国医学科学院肿瘤研究所和医院医学伦理委员会的批准。在涉及人类参与者的研究中执行的所有程序均符合机构研究委员会的道德标准。所有参与者都理解并签署了知情同意书。
2D-DIGE
用预冷的研钵和研杵将约0.5g的组织在液氮中研磨成粉末。然后使用玻璃均化器在冰上于1ml裂解缓冲液(7M尿素,2M硫脲,4%CHAPS,30mM Tris-HCl(三羟甲基氨基甲烷盐酸盐),pH8.5,蛋白酶抑制剂混合物)均质。使用超声处理器在冰上超声处理10秒钟后,将样品离心30分钟(40,000×g)以去除颗粒物质。通过Bradford法(Bio-Rad)一式两份测定蛋白质浓度,并通过 SDS-PAGE确认。
用50mM的NaOH将蛋白质的pH调节至8.5,并用裂解缓冲液将浓度调节至5mg/mL。将来自六个样品对的等量蛋白质汇集在一起作为内标。每位患者的肿瘤均用Cy3或Cy5随机标记,而内标则使用400pmol荧光染料/ 50μg蛋白用Cy2标记。在黑暗中的冰上进行标记30分钟。然后在黑暗中的冰上添加1μL赖氨酸(10mM)进行淬灭反应10分钟。
DIGE实验设计如表1所示。将每例患者的50微克Cy3和Cy5标记的样品混合,然后与50微克Cy2标记的内标混合。然后将等体积的2份样品缓冲液(7M尿素,2M硫脲,4%CHAPS,1%Bio-Lyte,pH 3-10、20mg/mL DTT)加入样品,用补水缓冲液(7M尿素,2M硫脲,4%CHAPS,0.5% Bio-Lyte,10mg/mL DTT)调节最终体积至410μL。
表1.参与这项研究的肺腺癌患者的基本临床信息
使用PROTEAN IEF CELL等电聚焦仪(BIO-RAD公司)在17℃下将样品施加至24cm、pH梯度为3-10的IPG条带(BIO-RAD公司)主动再水合12 小时。等电聚焦总共进行80kV/h(30分钟内升至250V,在1000V下保持1h,在5h内升至10,000V,在10,000V下保持60kV/h)。将IPG条带在平衡缓冲液(6M尿素,2%SDS,50mM Tris-HCl,pH 8.8,30%甘油)中平衡,并在室温下用0.5%DTT补充15分钟,然后在室温下4.5%碘代乙酰胺平衡缓冲液中再孵育15分钟。
将IPG条带放在12%均质聚丙烯酰胺凝胶的顶部,该凝胶已使用Ettan DALT 12制胶器用低荧光玻璃板预制。使用Protean Plus系统(BIO-RAD公司)进行第二维SDS-PAGE。二维电泳后,在Typhoon 9410扫描仪上用对 Cy2(488/520nm)、Cy3(532/580nm)和Cy5(633/670nm)特定的激发/发射波长用Ettan DALT凝胶对准导向装置扫描凝胶。调整强度以确保每个图像的最大容积在60,000–90,000以内。
根据制造商的建议,使用DeCyder 6.5软件(GE Healthcare)进行2D-DIGE 分析。简而言之,使用DeCyder生物变异分析模块检测斑点(斑点的估计数量为2500),并同时匹配来自6种凝胶的所有36个蛋白质斑点图。所有匹配也被手动确认。具有错误发现率校正的配对t检验用于数据的统计分析。选择在PR和PD组织中差异表达的蛋白质斑点(比率≤-1.5或比率≥1.5,p≤ 0.05)。在12例患者中,至少有5例仅选择了以平均方向相同的方向改变的斑点进行鉴定。
凝胶内消化
用制备性凝胶进行斑点采摘。如“2D-DIGE”中所述进行二维电泳,不同之处在于IPG条带上装有1000μg蛋白质,并且凝胶用考马斯亮蓝染色。切下感兴趣的蛋白斑点,并用25mM碳酸氢铵,50%ACN脱色。然后通过离心冻干将凝胶完全干燥。用0.01μg/μL胰蛋白酶(Promega)在37℃下25mM 碳酸氢铵中的凝胶消化15h。收集上清液,并依次在40℃,5%TFA的条件下从凝胶中提取胰蛋白酶肽1h和30℃,2.5%TFA、50%ACN的条件下从凝胶中提取胰蛋白酶肽1h。合并提取物,并通过离心冷冻干燥完全干燥。
蛋白质鉴定
将肽混合物重新溶解在0.5%TFA中,然后将1μL肽溶液与1μL基质(30 %CAN,0.1%TFA中的4-羟基-α-氰基氨基甲酸)混合,然后点样在靶板上。在4800蛋白质组分析仪(Applied Biosystems)上进行基质辅助激光解吸电离串联飞行时间质谱(MALDI-TOF/TOFMS)。以正反射模式获取肽质量图,平均1500个激光发射/MALDI-TOF谱图和3000个发射/TOF/TOF谱图(分辨率为20,000)。使用4800校准混合物(Applied Biosystems)将光谱校准到0.1Da 之内的质量公差。挑选出质量范围为600-4000Da且最小信噪比为15的母体质量峰进行串联TOF/TOF分析。使用MASCOT数据库搜索算法(2.1版),使用组合的质量质谱图质询IPI人类数据库v3.23(包含66,619个蛋白质条目) 中的人类序列。进行搜索以允许氨基甲酰甲基化、氧化和最多缺失一次的胰蛋白酶裂解。肽耐受性和MS/MS耐受性均为0.2Da。所有自动数据分析和数据库搜索均由GPS ExplorerTM软件(3.6版;Applied Biosystems)完成。排除已知的污染物离子(角蛋白)。置信的鉴定具有统计上显着的(p≤0.05)蛋白质评分(基于质量和质量/质谱的组合)。消除了以不同名称和登录号出现在数据库中的蛋白质冗余。排除了鉴定出一种以上蛋白质的斑点。
免疫组织化学染色
总共使用92对的具有不同化疗反应的AD癌来检测PRXD2、PRXD6、凝溶胶蛋白(Gelsolin)和Rab2a的表达。根据制造商的规程,使用抗PRXD2 抗体(1:600稀释;Proteintech)、PRXD6(1:250稀释;Abcam)和凝溶胶蛋白(1:250稀释;Abcam)进行常规免疫组化SP染色。幻灯片显微镜分析是由两名经验丰富的病理学家在不了解患者信息的情况下以盲目方式独立进行的。细胞免疫染色强度分为0、1、2和3,阳性细胞的百分比分为以下几类: 0(0-5%),1(6-25%),2(26-50)%),3(51-75%)或4(76-100%)。各个部分的最终分数记录为-(负)、+(弱正)、++(正)和+++(强正);分数基于染色细胞的强度和数量。在这项研究中,阴性(-)和弱阳性(+)的评分被视为阴性,而阳性(++) 和强阳性(+++)的评分被视为阳性。
疗效评估
化疗后一周,所有患者均接受了进一步的肺部CT扫描。根据实体瘤反应评估标准(RECIST)(9)评估治疗效果:(i)完全反应(CR),所有可检测到的症状消失;(ii)部分反应(PR),线性肿瘤测量结果总和缩小≥30%;(iii)进行性疾病(PD),新病灶消失,目标病灶总和增加≥20%;(iv)稳定疾病(SD),PR 下降不足,PD上升不足。CR和PR被认为是有效的反应,SD和PD被认为是无效的反应。在两个治疗周期后,通过CT扫描将PR患者视为RECIST(1.1版)的对药物敏感的患者,而PD患者则被视为耐药。客观缓解率(ORR)和疾病控制率(DCR)分别通过(CR+PR)/总病例数×100%和(CR+PR+SD)/总病例数×100%计算。
统计分析
使用Wilcoxon配对检验评估药敏感和耐药肿瘤组织之间的差异,而使用SPSS21.0软件通过χ
结果
为了检测差异表达的蛋白质,通过2D-DIGE分析了通过支气管镜检查或化学预治疗从肺AD患者中获得的药物敏感和耐药的新鲜肿瘤组织。这6 名患者的特征显示在表1中。将12个用Cy3或Cy5标记的肺AD样品与用 Cy2标记的合并标准品一起在6凝胶中电泳,并通过Decyder 6.5软件分析图像(图1)。在2067个匹配的蛋白斑点中,在药物敏感肿瘤与耐药组织相比中有37个上调(比率药物敏感/耐药≥1.5,p≤0.05;配对t检验和错误发现率校正),32个下调(药物敏感/耐药≥-1.5,p≤0.05)(图2)。
差异表达蛋白质的鉴定
为了鉴定上述差异表达的蛋白质,应用质谱技术比较已知蛋白质的特征。切除52个差异表达的蛋白质斑点,这些斑点表现出足够的强度,与周围斑点的清晰分离以及一致的斑点形状和大小,随后通过胰蛋白酶在凝胶中消化,然后通过MALDI-TOF/TOF成功进行了分析。肽质量指纹图谱(PMF) 之后,使用Mascot Distiller软件通过分析单一同位素PMF来计算肽片段的质量负荷率(m/z)值。通过搜索Mascot查询系统、SWISS-PROT和NCBInr 蛋白质数据库,鉴定了相应的蛋白质。被确定为已知污染物的五个斑点(角蛋白1、2和10)和具有多个蛋白质身份的10个斑点被排除在进一步分析之外。在剩下的部分中,鉴定出代表肿瘤样品中19种上调和18种下调的非冗余蛋白的37个斑点(分别在图2中显示的19个上调斑点和18个下调斑点)。相应的蛋白质包括PRDX2、PRDX6和凝溶胶蛋白(图3)。根据SWISS-PORT和NCBInr数据库中的功能注释,这些差异表达的蛋白质可分为六类:(i)氧化还原调节蛋白、(ii)细胞骨架蛋白、(iii)细胞代谢酶或蛋白、(iv)细胞凋亡、(v) 信号转导介导的分子和(vi)其他功能蛋白(图4)。结果表明与化疗有关的蛋白质可能包括在细胞代谢,细胞凋亡,氧化还原调节,转录和信号转导中。
经验证的标本中感兴趣的蛋白质的免疫组织化学染色
为了验证蛋白质组学分析的结果,选择了PRD2、PRD6和凝溶胶蛋白进行IHC在一大批预处理样品中的进一步验证(表2)。根据上述评分方法,发现PRDX2蛋白表达在73例患者中为阴性(79.3%),在9例患者中为阳性(21.0 %)。至于PRDX6,染色结果在77例(83.6%)患者中为阴性,在15例(16.2 %)患者中为阳性。我们还发现,凝溶胶蛋白在83例(90.2%)患者中为阴性,在9例(9.6%)患者中为阳性(表3,图5)。
表2.样品的2D-DIGE特性实验设计
表3.通过免疫组化(IHC)分析PRXD2、PRXD6和凝溶胶蛋白在样品中的表达
PRDX2、PRDX6和凝溶胶蛋白与化疗反应之间关联
为了了解化疗反应与PRDX2、PRDX6的肺腺癌表达的关系,应用χ
表4.化疗反应与PRDX2、PRDX6和凝溶胶蛋白表达的相关性
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 预测癌症患者对化疗反应的标志物及应用
- 预测癌症患者预后的标志物及其应用
