DNA提取液以及革兰氏阳性菌DNA的提取方法
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及DNA的提取方法,特别涉及DNA提取液以及用于革兰氏阳性菌DNA的提取方法,属于细菌DNA的提取领域。
背景技术
在革兰氏阳性菌菌种鉴定及转化子筛选的过程中,经常要用到基因组DNA用于PCR扩增。传统的酚氯仿法具有通用性广、稳定性高的优点,因此应用较为广泛。然而其操作繁琐、耗时久的缺点使其难以满足大量样本DNA快速提取的要求,同时提取过程中需要使用氯仿、苯酚等有毒有害试剂,对操作人员的健康带来威胁,实验后产生的废弃物垃圾也可能会对环境产生污染。
目前市面上的的细菌基因组DNA提取试剂盒主要利用溶菌酶破碎细胞壁,蛋白酶水解蛋白质,使基因组DNA与蛋白质分离,并通过硅胶膜离心柱收集DNA,使用这种试剂盒提取的DNA浓度高、质量好,且不使用氯仿等有毒有害试剂,但这些试剂盒费用昂贵,含有需要冷藏的组分,且DNA提取仍需1h以上的时间,因此也不适合作为大量微生物样本DNA提取的用途。随后科研人员相继研发出碱裂解法、沸水浴法等快速提取革兰阳性菌基因组DNA的方法,虽然这些方法可以在短时间内提取出基因组DNA,但是提取的DNA含量低且质量差,以其作为PCR反应的模板容易导致PCR扩增的失败。
因此,开发出一种快速、环保、耗费低廉的革兰氏阳性菌基因组DNA提取方法对于菌种鉴定与革兰氏阳性菌转化子的筛选实验显得尤为重要。
发明内容
本发明的目的之一是提供一种DNA提取液;
本发明的目的之二是提供一种提取革兰氏阳性菌DNA的方法
本发明的上述目的是通过以下技术方案来实现的:
本发明首先提供了一组DNA提取液,由溶液Ⅰ、溶液Ⅱ、溶液Ⅲ和溶液Ⅳ组成;
其中,溶液Ⅰ的组成成分包括氯化钠、EDTA和Tris-HCl;优选的,各成分的浓度为:氯化钠0.15~0.20mol/L,EDTA 10~20mmol/L,Tris-HCl 10~20mmol/L,其中Tris-HCl的pH值为8.5;优选的,溶液Ⅰ的各组成成分的浓度为:氯化钠0.15mol/L,EDTA 10mmol/L,Tris-HCl 15mmol/L。
溶液Ⅱ是8%~12.5%质量体积分数的十二烷基硫酸三乙醇胺;优选的,溶液Ⅱ是10%质量体积分数的十二烷基硫酸三乙醇胺。
溶液Ⅲ是2.5~3.2mol/L氯化钾;优选的,溶液Ⅲ是3mol/L氯化钾。
溶液Ⅳ是水杨酸甲酯。
本发明进一步提供了一种应用所述DNA提取液提取革兰阳性菌基因组DNA的方法,包括:
(1)用无菌蒸馏水重悬培养物中的革兰氏阳性菌菌体,离心,弃去上清收集菌体;
(2)向溶液Ⅰ中加入溶菌酶后重悬所收集的菌体,静置;
(3)加入溶液Ⅱ颠倒混匀,静置;
(4)加入冰浴的溶液Ⅲ,混匀后离心,取上清加入溶液Ⅳ,震荡混匀至乳状,离心;
(5)取上层水相加入等体积异丙醇沉淀,离心,收集沉淀;
(6)用乙醇洗涤沉淀,离心,弃去乙醇,晾干沉淀,用TE溶解沉淀,即得。
作为本发明一种优选的具体实施方案,步骤(1)中所述的离心的转速为8000-12000rpm,离心的时间为0.5-2min;更优选的,所述的离心转速是10000rpm,离心时间是1min。
作为本发明一种优选的具体实施方案,步骤(2)中向溶液Ⅰ中加入溶菌酶至溶菌酶的浓度为5mg/ml;步骤(2)中所述的静置优选在37℃的温度下静置。
作为本发明一种优选的具体实施方案,步骤(3)中所述的静置可以在室温的温度下静置,所述的静置时间优选为10min。
作为本发明一种优选的具体实施方案,步骤(4)中所述的离心的转速为10000~11000rpm,离心时间为2~4min。
作为本发明一种优选的具体实施方案,按体积比计,溶液Ⅰ:溶液Ⅰ:溶液Ⅲ:溶液Ⅳ=9:1:5:10。
作为本发明一种优选的具体实施方案,步骤(6)中用70%乙醇洗涤沉淀,所述的离心优选为10000rpm离心1min。
本发明在溶菌酶处理破壁之后,利用能够强烈变性蛋白质的去垢剂十二烷基硫酸三乙醇胺,彻底裂解细胞并变性蛋白,从而避免了其他试剂盒中需要冷藏的蛋白酶K的使用。随后通过加入氯化钾溶液,使变性蛋白随着生成的十二烷基硫酸钾一同被沉淀,被离心除去,从而初步去除蛋白质。用以水杨酸甲酯为成分的蛋白去除液代替酚氯仿异戊醇抽提上清液,从而彻底去除蛋白杂质。水杨酸甲酯具有较小的极性与较大的密度,与酚氯仿异戊醇一样具有良好的蛋白变性与溶解膜组分作用,并且毒性小,不腐蚀皮肤,不属于危险化学品。由于水杨酸甲酯水溶性小,即使不进行平衡也不易吸收水相造成DNA的损失,避免了使用酚时需要进行复杂的水或Tris平衡的步骤,使用简单方便。
附图说明
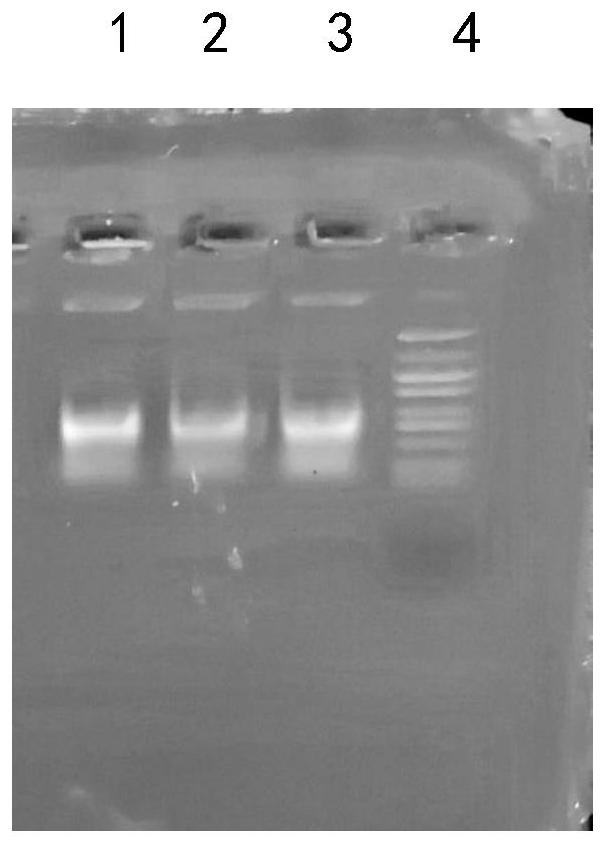
图1为提取的革兰氏阳性菌基因组DNA的凝胶电泳图;从左到右依次为:1~3泳道为利用本方法提取的DNA,4泳道为DL5000marker,大小为5000、2500、1000、750、500、250、100。
图2为提取的革兰氏阳性菌基因组DNA的200~400nm波长光度计扫描结果。.
具体实施方式
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1大肠杆菌基因组DNA的提取
用1ml无菌蒸馏水充分重悬2ml培养物中的大肠杆菌菌体,10000rpm离心1min,弃去上清收集菌体,用含有5mg/ml的溶菌酶(临用前加入)的溶液Ⅰ(氯化钠0.15mol/L,EDTA10mmol/L,pH值为8.5的Tris-HCl 15mmol/L)450μL重悬,在37℃静置裂解细胞壁;加入溶液Ⅱ(10%质量体积分数的十二烷基硫酸三乙醇胺)50μL颠倒混匀,室温静置10min;加入冰浴的溶液Ⅲ(3mol/L氯化钾)250μL,混匀后10000rpm离心,离心4min,取上清移入另一支试管中,加入水杨酸甲酯500μL,震荡混匀至乳状,11000rpm离心2min,取上层水相于另一支试管中(注意不要吸到下面的蛋白层与有机相),加入等体积异丙醇沉淀5min,10000rpm离心1min,收集沉淀;用1ml70%乙醇洗涤沉淀10000rpm离心1min,弃去乙醇,晾干沉淀,用200μlTE溶解沉淀。
图1为所提取的大肠杆菌菌体基因组DNA的电泳图,经过200~400nm波长光度计扫描,A260/A280=2.073,A260/A230=2.212,浓度为563ng/μL。
实施例2葡萄球菌基因组DNA的提取
用1ml无菌蒸馏水充分重悬2ml培养物中葡萄球菌菌体,10000rpm离心1min,弃去上清收集菌体,用含有5mg/ml的溶菌酶(临用前加入)的溶液Ⅰ(氯化钠0.2mol/L,EDTA20mmol/L,pH值为8.5的Tris-HCl 20mmol/L)450μL重悬,在37℃静置裂解细胞壁;加入溶液Ⅱ(12.5%质量体积分数的十二烷基硫酸三乙醇胺)50μL颠倒混匀,室温静置12min;加入冰浴的溶液Ⅲ(2.5mol/L氯化钾)250μL,混匀后11000rpm离心,离心3min,取上清移入另一支试管中,加入水杨酸甲酯500μL,震荡混匀至乳状,11000rpm离心2min,取上层水相于另一支试管中(注意不要吸到下面的蛋白层与有机相),加入等体积异丙醇沉淀5min,11000rpm离心1min,收集沉淀;用1ml70%乙醇洗涤沉淀10000rpm离心1min,弃去乙醇,晾干沉淀,用200μlTE溶解沉淀。
图2为所提取的葡萄球菌基因组DNA的200~400nm波长光度计扫描结果,A260/A280=2.092,A260/A230=2.235,浓度为570ng/μL。
- DNA提取液以及革兰氏阳性菌DNA的提取方法
- 一种植物基因组DNA的提取液和植物基因组DNA的提取方法
