一种提高腺病毒产毒能力的单克隆细胞、细胞库及制备方法
文献发布时间:2023-06-19 12:04:09
技术领域
本发明属于生物技术领域,尤其涉及一种提高腺病毒产毒能力的单克隆细胞、细胞库及制备方法。
背景技术
腺病毒是一种非整合型双链DNA病毒,在自然界广泛分布。使用腺病毒载体用于基因治疗研究安全、对人无致病、致畸和致癌性,生物安全性高。且其可装载大片段外源基因,同时在分裂和不分裂细胞中均能被感染,而且感染宿主范围广。因此利用腺病毒作为基因治疗载体非常合适。
由于现有的可用于腺病毒复制的细胞一般为293细胞,是具有异质性的一群细胞组成的细胞系,而每个单克隆细胞的产毒能力并不一致,因而可能会导致整体的腺病毒产毒能力不高。
针对以上缺点,本发明将通过筛选293T细胞和JH293细胞的腺病毒产毒能力,然后对产毒能力高的JH293细胞进行单克隆筛选,从而筛选出具有较高产毒能力的单克隆细胞。不仅如此,本发明还在GMP(药品生产质量管理规范)条件下对筛选出的单克隆细胞株建立三级细胞库,以便用于后期大规模生产。
发明内容
本发明实施例的目的在于提供一种提高腺病毒产毒能力的单克隆细胞、细胞库及制备方法,旨在解决背景技术中指出的现有技术存在的问题。
本发明实施例是这样实现的,一种提高腺病毒产毒能力的单克隆细胞的制备方法,包括以下步骤:
(1)比较腺病毒在细胞JH293和293T中的产毒效率;
(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
(3)验证各单克隆细胞分别对腺病毒Ad11和腺病毒Ad5的产毒能力,得到分别对Ad11和Ad5产毒能力较高的单克隆细胞。
作为本发明实施例的另一种优选方案,从产毒效率高的JH293细胞中筛选多个单克隆细胞,具体步骤为:
将原始的JH293细胞进行培养,待长满时,分至细胞培养瓶进行培养;
细胞密度约70~80%时,弃上清,清洗,然后进行消化处理,将其分散成单个细胞;
加入完全培养基终止消化,然后离心处理;
弃上清,重悬细胞并用台盼蓝计数;
利用细胞培养基将细胞稀释后加入到孔板中进行培养;
在显微镜下观察孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
将扩大培养的细胞进行冻存保种。
作为本发明实施例的另一种优选方案,验证各单克隆细胞分别对腺病毒Ad11和腺病毒Ad5的产毒能力,包括以下步骤:
将单克隆细胞分别在孔板中铺板,然后分别感染相同MOI的腺病毒种子;
感染至细胞开始从皿底脱落时,感染Ad11的细胞在荧光显微镜下拍照,然后收集细胞和上清,放置于-78~ -82℃;感染Ad5的细胞直接收集细胞和上清,放置于-78~ -82℃;
将腺病毒经-78~ -82℃和35~38℃反复冻融,待用;
将腺病毒从-78~ -82℃取出,放置于35~38℃再次进行冻融,离心处理;
将腺病毒原液感染JH293细胞;
观察孔板内每浓度梯度的细胞内被感染的空斑数目;
计算其产毒能力,得到分别对Ad11和Ad5产毒能力较高的单克隆细胞。
本发明实施例的另一目的在于提供一种所述的提高腺病毒产毒能力的单克隆细胞的制备方法制备得到的JH293-Clone21细胞,将单克隆细胞分别在孔板中铺板,然后分别感染相同MOI的腺病毒Ad11种子。
本发明实施例的另一目的在于提供一种所述的提高腺病毒产毒能力的单克隆细胞的制备方法制备得到的JH293-Clone3细胞,将单克隆细胞分别在孔板中铺板,然后分别感染相同MOI的腺病毒Ad5种子。
本发明实施例的另一目的在于提供一种提高腺病毒产毒能力的细胞库的制备方法,包括以下步骤:
(1)将权利要求1~3中任一所述的提高腺病毒产毒能力的单克隆细胞扩大培养并建立三级细胞库;
(2)对三级细胞库进行细菌、真菌、支原体、内毒素、染色体检定和核型分析。
作为本发明实施例的另一种优选方案,包括以下步骤:
将产毒能力比较高的JH293-Clone21细胞或JH293-Clone3细胞进行扩大培养;
待细胞足够时,弃上清,清洗,然后进行消化处理,将其分散成单个细胞;
在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后离心处理;
弃上清,重悬细胞并用台盼蓝计数;
弃上清,用冻存液重悬,然后冻存管中加细胞悬液;
将冻存管冻存,作为种子库;
种子库中取出细胞,进行复苏扩增培养后,按上述方法冻存至少50支细胞作为主细胞库;
主细胞库中取出细胞,进行复苏扩增培养后,按上述方法冻存至少50支细胞作为工作细胞库。
作为本发明实施例的另一种优选方案,冻存步骤为:将冻存管放于程序降温冻存盒中,将程序降温冻存盒放置于-78~ -82℃,第二天转移至液氮罐中。
本发明实施例的另一目的在于提供一种所述的提高腺病毒产毒能力的细胞库的制备方法制备得到的提高腺病毒产毒能力的JH293-Clone21细胞库。
本发明实施例的另一目的在于提供一种所述的提高腺病毒产毒能力的细胞库的制备方法制备得到的提高腺病毒产毒能力的JH293-Clone3细胞库。
本发明改进现有腺病毒扩增所用细胞系,提高腺病毒生产效率,同时在GMP(药品生产质量管理规范)条件下建立了能够用于大规模腺病毒生产的三级细胞库。本发明筛选出的单克隆细胞JH293-Clone21对腺病毒Ad11的产毒能力高,而单克隆细胞JH293-Clone3对腺病毒Ad5的产毒能力高,通过实验验证证明了可行性。
附图说明
图1为实施例1腺病毒在细胞JH293和293T中的产毒情况荧光示意图;
图2为实施例1腺病毒Ad11在JH293各单克隆细胞中的荧光强弱示意图;
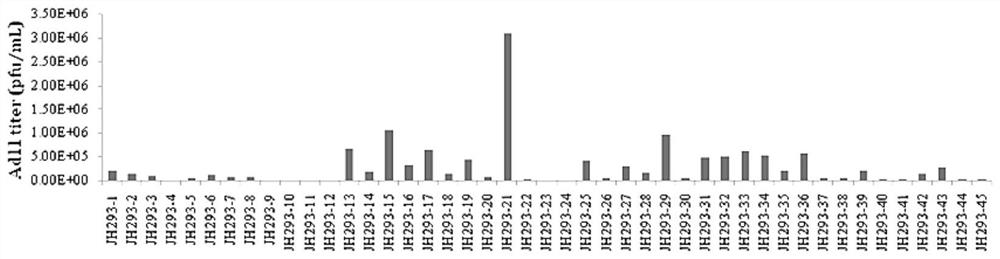
图3为实施例1各单克隆细胞产生的Ad11病毒滴度检测结果;
图4为实施例7三级细胞库的细胞鉴别等检查结果。
图5为实施例4各单克隆细胞产生的Ad5病毒滴度检测结果。
图6为实施例8三级细胞库的细胞鉴别等检查结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
以下结合具体实施例对本发明的具体实现进行详细描述。
实施例1
该实施例提供了一种提高腺病毒Ad11产毒能力的单克隆细胞的制备方法,包括以下步骤:
(1)比较腺病毒在细胞JH293和293T中的产毒效率;
前一天细胞分别铺板至6孔板,6x10^5/孔,第二天分别感染相同MOI(感染复数)的腺病毒Ad11种子,感染3天后观察细胞状态及荧光显微镜下拍照,结果见图1所示;
从结果可以看出,JH293的荧光表达效率能达到95%以上,且细胞状态较好;而293T细胞感染后,细胞漂浮较多,且荧光表达较弱;由此可以看到JH293细胞比293T细胞更易产毒;
(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约75%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1000rpm离心5min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad11的产毒能力;
3.1将45个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad11种子;
3.2感染3~5天至细胞开始从皿底脱落时,荧光显微镜下拍照(图2),然后收集细胞和上清,放置于-80℃;
3.3将腺病毒经-80℃和37℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将病毒从-80℃取出,放置于37℃进行第3次冻融,4℃下12000rpm离心5min;
3.6将病毒上清采用梯度稀释法(首个浓度稀释倍数为10^3,然后依次10倍稀释)稀释病毒,然后感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力,见图3;
从图2可以看出,腺病毒Ad11 在JH293各单克隆细胞中的荧光强弱不同,即产毒能力不同;同时结合病毒滴度检测结果图3可知,其产毒能力在1.3x10^3~6.36x10^6 pfu/mL之间,差异比较显著,且其原液的产毒能力最高达到了6.36x10^6 pfu/mL;因此从中选择了产毒能力较高的JH293-Clone21细胞建库。
实施例2
与实施例1不同的是:
步骤(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约70%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后800rpm离心6min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad11的产毒能力;
3.1将45个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad11种子;
3.2感染3~5天至细胞开始从皿底脱落时,荧光显微镜下拍照,然后收集细胞和上清,放置于-78℃;
3.3将腺病毒经-78℃和35℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将病毒从-78℃取出,放置于35℃进行第3次冻融,3℃下10000rpm离心6min;
3.6将病毒原液上清采用梯度稀释法(首个浓度稀释倍数为10^3,然后依次10倍稀释)稀释病毒,然后感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力。
实施例3
与实施例1不同的是:
步骤(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约80%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1100rpm离心4min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad11的产毒能力;
3.1将45个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad11种子;
3.2感染3~5天至细胞开始从皿底脱落时,荧光显微镜下拍照,然后收集细胞和上清,放置于-82℃;
3.3将腺病毒经-82℃和38℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将病毒从-82℃取出,放置于38℃进行第3次冻融,5℃下12500rpm离心4min;
3.6将病毒原液上清采用梯度稀释法(首个浓度稀释倍数为10^3,然后依次10倍稀释)稀释病毒,然后感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力。
实施例4
该实施例提供了一种提高腺病毒Ad5产毒能力的单克隆细胞的制备方法,包括以下步骤:
(1)比较腺病毒在细胞JH293和293T中的产毒效率;
前一天细胞分别铺板至6孔板,6x10^5/孔,第二天分别感染相同MOI的腺病毒Ad5种子,感染第2天后观察细胞状态,发现293T细胞漂浮较多,细胞状态变差,不利于Ad5的产毒。故选择JH293进行单克隆的筛选以及比较产毒能力。
(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约75%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1000rpm离心5min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad5的产毒能力;
3.1将42个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad5种子;
3.2感染3~5天至细胞开始从皿底脱落时,然后收集细胞和上清,放置于-80℃;
3.3将腺病毒经-80℃和37℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将腺病毒从-80℃取出,放置于37℃进行第3次冻融,4℃下12000rpm离心5min;
3.6将病毒原液上清采用梯度稀释法(首个浓度稀释倍数为10^3,然后依次10倍稀释)稀释病毒,然后感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力,见图5;
从图5病毒滴度检测结果可以看出,其产毒能力在4.12x10^7~1.38x10^11 pfu/mL之间,差异比较显著,且JH293-Clone3细胞其原液的产毒能力最高达到了1.38x10^11 pfu/mL;因此从中选择了产毒能力较高的JH293-Clone3细胞建库。
实施例5
与实施例4不同的是:
步骤(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约70%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后800rpm离心6min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad5的产毒能力;
3.1将42个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad5种子;
3.2感染3~5天至细胞开始从皿底脱落时,然后收集细胞和上清,放置于-80℃;
3.3将腺病毒经-78℃和35℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将腺病毒从-78℃取出,放置于35℃进行第3次冻融,3℃下10000rpm离心6min;
3.6将病毒原液上清采用梯度稀释法(首个浓度稀释倍数为10^3,然后依次10倍稀释)稀释病毒,然后感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力。
实施例6
与实施例4不同的是:
步骤(2)从产毒效率高的JH293细胞中筛选多个单克隆细胞;
2.1将原始的JH293细胞进行培养,待长满时,分至多个细胞培养瓶进行培养;
2.2待其中一瓶细胞密度约80%时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
2.3在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1100rpm离心4min;
2.4弃上清,用完全培养基重悬细胞并用台盼蓝计数;
2.5利用细胞培养基将细胞稀释(稀释比例以96孔板的每个孔至多含1个细胞为准)后加入到96孔板中进行培养;
2.6第二天在显微镜下观察96孔板,将含有1个细胞的孔做标记;待做标记的细胞在孔内长满后,将其扩大培养至细胞培养瓶;
2.7将扩大培养的细胞进行冻存保种;
(3)验证各单克隆细胞对腺病毒Ad5的产毒能力;
3.1将42个单克隆细胞分别在6孔板中铺板,6x10^5/孔,然后分别感染相同MOI的腺病毒Ad5种子;
3.2感染3~5天至细胞开始从皿底脱落时,然后收集细胞和上清,放置于-80℃;
3.3将腺病毒经-82℃和38℃反复冻融2次,待用;
3.4感染前一天铺板JH293细胞在96孔板,2000个细胞/孔;
3.5第二天将腺病毒从-82℃取出,放置于38℃进行第3次冻融,5℃下12500rpm离心4min;
3.6将腺病毒原液采用梯度稀释法(依次10倍稀释)感染JH293细胞,每种病毒3次重复,每个梯度12复孔;
3.7 10天后观察96孔板内每浓度梯度的细胞内被感染的空斑数目;
3.8计算其产毒能力。
实施例7
该实施例提供了一种所述的提高腺病毒产毒能力的细胞库的制备方法,包括以下步骤:
(1)将实施例1产毒高的单克隆细胞扩大培养并建立三级细胞库;
1)将上述产毒能力比较高的JH293-Clone21细胞进行扩大培养;
2)待细胞足够时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
3)在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1000rpm离心5min;
4)弃上清,用PBS重悬细胞并用台盼蓝计数;
5)弃上清,用冻存液(FBS:DMSO=9:1)重悬至1x10^7/mL,然后每支冻存管加1mL细胞悬液,将冻存管放于程序降温冻存盒中;
6)将程序降温冻存盒放置于-80℃,第二天转移至液氮罐;记录细胞作为种子库;
7)然后从冻存的种子库中取出1支,进行复苏扩增培养后,按上述方法冻存至少50支细胞作为主细胞库(MCB);
8)再从冻存的主细胞库中取出1支进行复苏扩增培养后,按上述方法冻存至少50支细胞作为工作细胞库(WCB);
(2)按照《中国药典》要求对三级细胞库进行细菌、真菌、支原体、内毒素、染色体检定和核型分析;
将上述建立的三级细胞库送第三方进行了细胞鉴别、细菌和真菌检查、支原体检查,结果见图4,可用于后期GMP级别的大规模生产;
从结果可以看出,其细菌、真菌、支原体检测均为阴性,内毒素含量小于0.25EU/mL,均符合《中国药典》要求;STR检测结果也表明所建立的单克隆细胞库与293细胞完全匹配,也符合《中国药典》要求。
实施例8
该实施例提供了一种所述的提高腺病毒产毒能力的细胞库的制备方法,包括以下步骤:
(1)将实施例2产毒高的单克隆细胞扩大培养并建立三级细胞库;
1)将实施例4产毒能力比较高的JH293-Clone3细胞进行扩大培养;
2)待细胞足够时,弃上清,用PBS清洗一遍,然后加入适量胰酶消化液在培养箱中进行消化处理,将其分散成单个细胞;
3)在显微镜下观察消化至单个细胞后,加入完全培养基终止消化,然后1000rpm离心5min;
4)弃上清,用PBS重悬细胞并用台盼蓝计数;
5)弃上清,用冻存液(FBS:DMSO=9:1)重悬至1x10^7/mL,然后每支冻存管加1mL细胞悬液,将冻存管放于程序降温冻存盒中;
6)将程序降温冻存盒放置于-80℃,第二天转移至液氮罐;记录细胞作为种子库;
7)然后从冻存的种子库中取出1支,进行复苏扩增培养后,按上述方法冻存至少50支细胞作为主细胞库(MCB);
8)再从冻存的主细胞库中取出1支进行复苏扩增培养后,按上述方法冻存至少50支细胞作为工作细胞库(WCB);
(2)按照《中国药典》要求对三级细胞库进行细菌、真菌、支原体、内毒素、染色体检定和核型分析;
将上述建立的三级细胞库送第三方进行了细胞鉴别、细菌和真菌检查、支原体检查,结果见图6,可用于后期GMP级别的大规模生产;
从结果可以看出,其细菌、真菌、支原体检测均为阴性,内毒素含量小于0.25EU/mL,均符合《中国药典》要求;STR检测结果也表明所建立的单克隆细胞库与293细胞完全匹配,也符合《中国药典》要求。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种提高腺病毒产毒能力的单克隆细胞、细胞库及制备方法
- 一种提高奶山羊冬季产奶能力的发酵饲料及其制备方法
