靶向GSK3α/β降解剂的制备及其医药用途
文献发布时间:2023-06-19 12:13:22
技术领域
本发明涉及药物化学领域,具体为GSK3α/β降解剂的制备及其医药用途。
背景技术
阿尔茨海默病(Alzheimer’s Disease,AD)是一种神经退行性疾病。目前AD病理主要存在两种假说:Aβ沉积和tau蛋白神经纤维缠结。由于Aβ药物的研发相继失败,tau蛋白假说逐渐受到了药物研发者的重视。Tau蛋白是一种微管相关蛋白,它主要起到维持微管稳定性的作用。在AD大脑中,tau蛋白过度磷酸化,从微管上脱落并聚集,形成具有神经毒性的神经元纤维缠结(NTFs),微管解聚并失去功能。神经纤维缠结的程度与AD进程高度相关,因此针对tau蛋白过度磷酸化设计治疗AD的药物具有重要意义。GSK3是Tau蛋白磷酸化的关键激酶,抑制GSK3活性能够有效减少Tau蛋白过度磷酸化。蛋白降解靶向嵌合体(PROTAC)技术作为一项新兴技术,PROTAC分子一端与目标蛋白结合,一端与E3连接酶结合,使目标蛋白泛素化,促进目标蛋白的降解。传统抑制剂蛋白抑制剂通过抑制目标蛋白活性来发挥作用,不能影响目标蛋白的含量,而PROTAC分子不同于传统蛋白抑制剂的原理,其能够将目标蛋白直接降解,减少目标蛋白的含量,从而发挥作用。该技术能够有效的减少药物的给药剂量且延长药效。开发基于PROTAC技术的小分子GSK3降解剂,对阿尔茨海默病或者其他GSK3蛋白相关疾病的治疗具有重要的意义。但是并非只要将E3连接酶配体和GSK3蛋白配体随机通过常规的linker连接起来就能具有靶向降解GSK3α/β的活性,而现有的E3连接酶配体、GSK3蛋白配体、linker的备选化合物较多,目前的文献报道也没有给出选择哪些E3连接酶配体和GSK3蛋白配体通过何种linker连接能够得到具备较好靶向降解GSK3α/β活性化合物的技术启示,虽然有PROTAC技术作为总的指导思想,想合成出具有较好GSK3α/β降解活性的化合物依然需要科研人员不断地探索。
发明内容
发明目的:基于蛋白降解靶向嵌合体(PROTAC)技术,开发一种新型的靶向GSK3α/β的降解剂,用于阿尔兹海默病或者其他GSK3蛋白相关疾病的治疗。
一种新型的靶向GSK3α/β的降解剂,包含结构如下所示的化合物:
其中,R选自Cl和I,m选自2,3,4,5和6,n选自1,2,4。
本发明化合物选自以下任意一种:
3-氨基-6-(4-((4-((1-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚-4-酰基)氨基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34a)
3-氨基-6-(4-((4-((1-(2-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基乙氧基)乙基)-1H-1,2,3-三唑4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶基-3-yl)吡嗪-2-羧酰胺(34b)
3-氨基-6-(4-((4-((1-(14-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)-3,6,9,12-四氧杂环丁酸酯)-1H-1,2,3-三唑-4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34c)
3-氨基-6-(4-((4-((1-(17-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基)-3,6,9,12,15-五氧杂庚基)-1H-1,2,3-三唑4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34d)
3-氨基-6-(4-((4-((1-(20-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基)-3,6,9,12,15,18-六氧杂二十烷基)-1H-1,2,3-三唑4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34e)
3-氨基-6-(4-((4-(2-(1-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)乙基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34f)
3-氨基-6-(4-((4-(2-(1-(2-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3--二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)乙基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶基-3-基)吡嗪-2-羧酰胺(34g)
3-氨基-6-(4-((4-(2-(1-(14-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基))-3,6,9,12-四氧杂环丁酸酯)-1H-1,2,3-三唑-4-基)乙基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34h)
3-氨基-6-(4-((4-(2-(1-(17-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基))-3,6,9,12,15-五氧杂庚基)-1H-1,2,3-三唑-4-基)乙基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34i)
3-氨基-6-(4-((4-(2-(1-(20-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基))-3,6,9,12,15,18-六氧杂二十烷基)-1H-1,2,3-三唑-4-基)乙基哌嗪-1-基)磺酰基)苯基)-N-(吡啶基-3-基)吡嗪-2-羧酰胺(34j)
3-氨基-6-(4-((4-(4-(1-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)1,3-二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34k)
3-氨基-6-(4-((4-(4-(1-(2-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)1,3--二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶基-3-基)吡嗪-2-羧酰胺(34l)
3-氨基-6-(4-((4-(4-(1-(14-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基))-3,6,9,12-四氧杂环丁酸酯)-1H-1,2,3-三唑-4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34m)
3-氨基-6-(4-((4-(4-(1-(17-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基))-3,6,9,12,15-五氧杂庚基)-1H-1,2,3-三唑-4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(34n)
3-氨基-6-(4-((4-(4-(1-(20-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基))-3,6,9,12,15,18-六氧杂二十烷基)-1H-1,2,3-三唑-4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶基-3-yl)吡嗪-2-羧酰胺(34o)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙基-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(35a)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(2-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)1-3-二氧代异吲哚啉-4-基)氨基)乙氧基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(35b)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(14-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚-4-基]氨基)-3,6,9,12-四氧杂环丁酸酯)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(35c)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(17-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基]氨基)-3,6,9,12,15-五氧杂庚基十七烷基)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(35d)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(20-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)-3,6,9,12,15,18-六氧代糖基)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(35e)
N-(3-(1-(2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)丙基)-5-(3-碘-4-甲氧基苯基)恶唑-4-羧酰胺(35f)
N-(3-(1-(2-(2-(2-(2-(((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)乙氧基)乙氧基)乙氧基)乙氧基)乙基)-1H-1,2,3-三唑-4-基)丙基)-5-(3-碘-4-甲氧基苯基)恶唑-4-羧酰胺(35g)
N-(3-(1-(14-((2-(2,6-二氧杂哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)-3,6,9,12-四氧杂环丁酸酯)-1H-1,2,3-三唑-4-基)丙基)-5-(3-碘-4-甲氧基苯基)恶唑-4-羧酰胺(35h)
N-(3-(1-(17-((2-(2,6-二氧杂哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)-3,6,9,12,15-五氧杂庚基)-1H-1,2,3-三唑-4-基)丙基)-5-(3-碘-4-甲氧基苯基)恶唑-4-羧酰胺(35i)
N-(3-(1-(20-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚-4-基-基)氨基)-3,6,9,12,15,18-六氧代己糖基)-1H-1,2,3-三唑-4-基)丙基)-5-(3-碘-4-甲氧基苯基)恶唑-4-羧酰胺(35j)
作为本发明的一种优选,对于通式(I)化合物,所述的m+n≥4,进一步优选m+n≥6。
作为本发明的更进一步优选,通式(I)化合物选自以下任意一种:
(1)m=4,且n=2;
(2)m=5,且n=2;
(3)m=6,且n=2;
(4)m=2,且n=4;
(5)m=3,且n=4;
(6)m=4,且n=4;
(7)m=5,且n=4;
(8)m=6,且n=4。
作为本发明的一种优选,通式(I)所示的化合物其药学上可接受的盐选自通式(I)化合物与酸形成的酸加成盐,所述的酸选自:氯化氢、溴化氢、硫酸、碳酸、草酸、柠檬酸、琥珀酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、马来酸、甲磺酸、苯磺酸、对甲苯磺酸或阿魏酸。
作为本发明的一种优选,对于通式(II)化合物,m=5或6,优选m=6,且R为Cl。
一种药物组合物,其中本发明所述的通式(I)和(Ⅱ)化合物或其药学上可接受的盐及药学上可接受的载体。
作为本发明的一种优选,所述的药物组合物被制备成片剂、胶囊、粉剂、糖浆、液剂、悬浮剂、冻干粉针或针剂中的任意一种剂型。
一种本发明所述的GSK3α/β的降解剂制备方法:
中间体化合物8a-c的合成:
中间体化合物12a-c的合成:
目标化合物34a-o及35a-j的合成:
本发明所述的化合物或其药学上可接受的盐在用于治疗神经退行性疾病,癌症或炎症。
本发明所述的化合物或其药学上可接受的盐用于治疗或预防GSK3α/β介导的疾病,优选GSK3α/β介导的神经退行性疾病,癌症或炎症,进一步优选GSK3α/β介导的神经退行性疾病。
有益效果:
本发明提供了一种新型的靶向GSK3α/β的降解剂,本发明所公示化合物能够有效的靶向降解细胞GSK3α/β,可作为阿尔兹海默病或者其他GSK3蛋白相关疾病的治疗剂。
附图说明
图1.本发明化合物设计思路
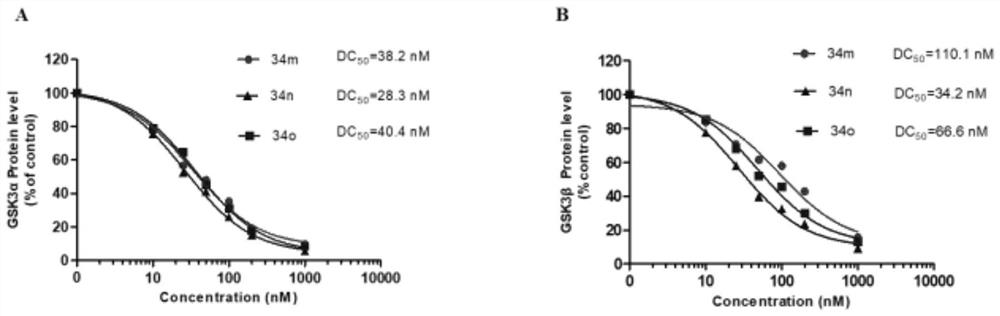
图2.化合物34m、34n和34o剂量依赖型的降解SH-SY5Y细胞中GSK3α(A)and GSKβ(B)
图3.分别使用34n与传统GSK3β抑制剂(AZD2858)处理HEK GSK3β293T细胞,34n处理后的细胞磷酸化Tau蛋白恢复较慢,34n比AZD2858具有更长的作用时间。
注:AZD2858:GSK3β小分子抑制剂(CAS No.:486424-20-8)
具体实施方法
中间体化合物8a-c的合成
中间体化合物12a-c的合成:
目标化合物16a-c的合成:
试剂及反应条件:(a)K
目标化合物19a-b的合成:
目标化合物25的合成:
试剂及反应条件:(a)AcONa,AcOH,110℃;(b)Na
目标化合物30a-b的合成:
试剂及反应条件:(a)HATU,DIPEA,DCM,rt;(b)CuSO
目标化合物34a-o及35a-j的合成:
试剂及反应条件:(a)DIPEA,DMF,85℃;(b)CuSO
实施例1:3-氨基-6-(4-(哌嗪-1-基磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(7)的合成
(1)3-氨基-6-溴-N-(吡啶-3-基)吡嗪-2-羧酰胺(2)的制备:
将3-氨基-6-溴吡嗪-2-羧酸甲酯(1)(2.0g,8.6mmol)和DBU(1.25mL,8.6mmol)加入到3-氨基吡啶(10g,106mmol)中,并在70℃下搅拌4h。反应完成后。将反应混合物用水(100mL)稀释,并用乙酸乙酯(3×100mL)萃取。合并的有机层经无水硫酸钠干燥,并在减压下浓缩。产物通过柱色谱纯化,得到化合物2(1.2g,50%),为黄色固体。
(2)4-((4-溴苯基)磺酰基)哌嗪-1-羧酸叔丁酯(4)的制备:
向4-溴苯磺酰氯(3)(5.1g,20mmol)无水二氯甲烷中的溶液中,加入N-Boc-哌嗪(5.0g,27mmol)和Et
(3)(4-((4-(叔丁氧基羰基)哌嗪-1-基)磺酰基)苯基)硼酸(5)的制备:
在-78℃和氮气保护条件下,将硼酸三异丙酯(3.5mL,15mmol)添加到化合物4(2.1g,5mmol)在无水THF(50mL)中的溶液中,然后逐滴添加正丁基锂(10mL,16mmol,1.6M)。将所得混合物搅拌2小时,然后使其升至室温另外搅拌16小时。加入水(5mL),然后搅拌2h。减压浓缩溶剂,通过硅胶柱色谱法纯化,得到为白色固体的化合物5(1.3g,70%)。
(4)4-(((4-(5-氨基-6-(吡啶-3-基氨基甲酰基)吡嗪-2-基)苯基)磺酰基)哌嗪-1-羧酸叔丁酯(6)的制备:
在甲苯(30mL)乙醇(6mL)的混溶液中,加入化合物2(1.0g,3.5mmol),化合物5(1.3g,3.5mmol)和Pd(dppf)Cl
(5)3-氨基-6-(4-(哌嗪-1-基磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(7)的制备:
向化合物6(1.34g,2.5mmol)的二氯甲烷(20mL)溶液中加入三氟乙酸(4mL)。将混合物在室温搅拌2h。并通过薄层色谱进行监测,当反应完成时。用饱和碳酸钠溶液将pH调节至10,然后用乙酸乙酯(3×30mL)萃取。合并的有机层经无水硫酸钠干燥并在减压下浓缩以获得固体,将其通过硅胶柱色谱法纯化,获得为黄色固体的化合物7(1.08g,98%)。
实施例2:3-氨基-6-(4-((4-(丙-2-炔-1-基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(8a)的制备:
将化合物6(0.8mmol),3-溴丙炔(1.6mmol),N,N-二异丙基乙胺(2mmol)在DMF中的混合物在室温搅拌2小时,并通过薄层色谱进行监测,反应完全后用水(20mL)稀释反应液,并用乙酸乙酯(3×40mL)萃取。合并的有机层经无水硫酸钠干燥,减压浓缩,通过柱色谱法纯化产物,得到化合物8a,为黄色固体。
实施例3:3-氨基-6-(4-((4-(丁-3-炔-1-基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(8b)的制备:
将化合物6(0.8mmol),4-溴丁炔(1.6mmol),N,N-二异丙基乙胺(2mmol)在DMF中的混合物在室温搅拌2小时,并通过薄层色谱进行监测,反应完全后用水(20mL)稀释反应液,并用乙酸乙酯(3×40mL)萃取。合并的有机层经无水硫酸钠干燥,减压浓缩,通过柱色谱法纯化产物,得到化合物8b,为黄色固体。
实施例4:3-氨基-6-(4-((4-(己-5-炔-1-基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(8c)的制备:
将化合物6(0.8mmol),4-溴丁炔(1.6mmol),N,N-二异丙基乙胺(2mmol)在DMF中的混合物在80℃条件下搅拌2小时,并通过薄层色谱进行监测,反应完全后用水(20mL)稀释反应液,并用乙酸乙酯(3×40mL)萃取。合并的有机层经无水硫酸钠干燥,减压浓缩,通过柱色谱法纯化产物,得到化合物8c,为黄色固体。
实施例5:5-(3-氯-4-甲氧基苯基)-N-(戊-4-炔-1-基)恶唑-4-羧酰胺(12a)的合成
(1)5-(3-氯-4-甲氧基苯基)恶唑-4-羧酸乙酯的制备(10a):
3-氯-4-甲氧基苯甲酸(9a)(0.93g,5mmol),Cs
(2)5-(3-氯-4-甲氧基苯基)恶唑-4-羧酸(11a)的制备:
向化合物10a(4mmol)的THF(10mL)溶液中加入NaOH(8mmol)。将混合物在室温搅拌16小时。通过薄层色谱监测反应进程。反应完成后,将反应混合物在真空中浓缩,并将得到的物质放入水中,并用2N HCl酸化,然后用乙酸乙酯(3×30mL)萃取。合并的有机萃取物用无水硫酸钠干燥并真空浓缩,得到白色固体状的11a。该中间体无需进一步纯化即可用于下一步。
(3)5-(3-氯-4-甲氧基苯基)-N-(戊-4-炔-1-基)恶唑-4-羧酰胺(12a)的制备:
将化合物11a 0.76g,3mmol),HATU(2.30g,6mmol)和DIPEA(1.8mL,10mmol)在DCM(15mL)中的混合物在室温下搅拌0.5h,然后加入4-戊炔-1-胺(0.33g,4mmol)并在室温下搅拌过夜。薄层色谱监测反应进程,当反应完成时,加入水(20ml),并用乙酸乙酯(3×40mL)萃取。合并的有机层用盐水洗涤,经无水硫酸钠干燥,过滤,并在减压下浓缩。粗残余物通过硅胶柱色谱法纯化为白色固体的化合物12a(0.87g,91%)。
操作步骤同实施例5(1)
(2)5-(3-氯-4-甲氧基苯基)恶唑-4-羧酸(11b)的制备:
操作步骤同实施例5(2)
(3)5-(3-氯-4-甲氧基苯基)-N-(戊-4-炔-1-基)恶唑-4-羧酰胺(12b)的制备:
操作步骤同实施例5(3)
实施例7:N-(3-叠氮丙基)-5-(3-氯-4-甲氧基苯基)恶唑-4-羧酰胺(12c)的制备:
操作步骤同实施例5(3)
实施例8:N-(2-(2-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)乙基)-2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚-4-基)氨基)乙酰胺(15)
泊马度度胺13(0.53g,2mmol),化合物14(0.65g,2.2mmol)和K
实施例9:N-(2-(2-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)乙基)-2-((2-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚-4-基)氨基乙酰胺(18)的制备:
操作步骤同实施例8
实施例10:2-(2,6-二氧代哌啶-3-基)-4-(2-(2-(2-(2--2-丙-1-基氧基)乙氧基)乙氧基)乙氧基)异吲哚啉-1,3-二酮(24)的制备:
(1)2-(2,6-二氧代哌啶-3-基)-4-羟基异吲哚啉-1,3-二酮(22)的制备:
4-羟基邻苯二甲酸酐20(0.50g,3mmol),3-氨基-哌啶-2,6-二酮盐酸盐21(0.50g,3mmol)和NaOAc(0.5g,6mmol)于HOAc(10mL)中在110℃下搅拌12小时。加入水(40mL),并用乙酸乙酯(3×80mL)萃取。合并的有机层经无水Na
(2)2-(2,6-二氧代哌啶-3-基)-4-(2-(2-(2-(2--2-丙-1-基氧基)乙氧基)乙氧基)乙氧基)异吲哚啉-1,3-二酮(24)的制备:
化合物22(0.27g,1mmol),23(0.41g,1.2mmol)和Na
实施例11:(2S,4R)-1-((R)-2-(庚基6-氨基)-3,3-二甲基丁酰基)-4-羟基-N-(4-(4-甲基噻唑-5-基)苄基)吡咯烷-2-甲酰胺(28)的制备:
6-庚酸(0.15g,1.2mmol),HATU(0.79g,2mmol)和DIPEA(0.6mL,3mmol)于DCM(10mL)中室温下搅拌0.5h,然后加入VHL配体26(0.46g,1mmol),并在室温下通过TLC监测搅拌,反应完成后。加入H
实施例12:(2S,4R)-1-((R)-2-(叔丁基)-4-氧代-6,9,12,15-四氧杂-3-氮杂十八烷基-17-炔酰基)-4-羟基-N-(4-(4-甲基噻唑-5-基)苄基]吡咯烷-2-羧酰胺(29)的制备:
操作步骤同实施例11
实施例13中间体化合物33a-e的合成:
向化合物32a-e(4.7mmol,1.3eq)和DIPEA(7.3mmol,2.0eq)在DMF中的溶液中加入化合物31(1g,3.6mmol)于85℃条件下搅拌,通过薄层色谱监测反应进程。反应完成后。加入水(40ml),并用乙酸乙酯(3×80mL)萃取。合并的有机层经无水硫酸钠干燥,过滤,并在减压下蒸发。粗残余物通过硅胶柱色谱法纯化为浅黄绿色固体的化合物33a-e。
33a.
33b.
33c.
33d.
33e.
实施例14:目标化合物16a-c,19a-b,25,30a-b的制备:
将含有炔基的中间体化合物8a-c(0.06mmol),含有叠氮化物的中间体化合物33a-e(0.08mmol,1.2eq),抗坏血酸钠(35.6mg,0.18mmol)溶解于tBuOH/DMF/DCM:1ml/1ml/1ml混合溶剂中,将CuSO
16a.
16b.
16c.
19a.
19b.
30a.
30b.
实施例15:通式(Ⅰ)化合物34a-o的制备:
操作步骤同实施例14
34a.
34b.
34c.
34d.
34e.
34f.
34g.
34h.
34i.
34j.
34k.
34l.
34m.
34n.
34o.
实施例16:通式(II)化合物35a-j的合成:
操作步骤同实施例14,产物均为黄色固体。
35a.
35b.
35c.
35d.
35e.
35f.
35g.
35h.
35i.
35j.
实施例17 Western blot实验检测目标化合物对GSK3α/β的降解活性:
将SH-SY5Y细胞(6×10
本发明化合物的药理学实验及结果如下:
采用Western blot检测本发明化合物对SH-SY5Y细胞中GSK3α/β的降解能力,按照每个化合物重复实验三次,实验结果表达为平均值。
表1本发明通式(I)化合物在0.1μM及1μM时对GSK3α/β的降解能力
表2本发明通式(II)化合物在1μM时对GSK3α/β的降解能力
实施例18
本发明在研发过程中基于PROTAC技术也曾尝试选择不同的E3连接酶配体、GSK3蛋白配体以及linker合成靶向GSK3α/β降解剂,采用Western blot检测本发明化合物对SH-SY5Y细胞中GSK3α/β的降解能力,按照每个化合物重复实验三次,实验结果表达为平均值。
表3基于PROTAC技术合成的部分未入选靶向GSK3α/β降解剂对GSK3α/β的降解能力
3-氨基-6-(4-((4-((1-(1-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧代异吲哚基-4-基)氨基)-2-氧代-6,9,12-三氧代-3-氮杂十四烷十四烷基-14-基)-1H-1,2,3-三唑-4-基)甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(16a)
3-氨基-6-(4-((4-(4-(1-(1-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基))-2-氧代-6,9,12-三氧杂-3--叠氮杂十四烷-14-基)-1H-1,2,3-三唑-4-基)丁基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(16b)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(1-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚基-4-基)氨基)-2-氧代-6,9,12-三氧杂-3-叠氮杂十四烷-14-基)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(16c)
3-氨基-6-(4-((4-((1-(1-((2-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚-4-基)氨基)-2-氧代-6,9,12-三恶唑-3-叠氮杂十四烷-14-基)-1H-1,2,3-三唑-4-甲基)哌嗪-1-基)磺酰基)苯基)-N-(吡啶-3-基)吡嗪-2-羧酰胺(19a)
5-(3-氯-4-甲氧基苯基)-N-(3-(1-(1-((2-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚-4-基)氨基)-2-氧代-6,9,12-三氧杂-3-叠氮杂十四烷-14-基)-1H-1,2,3-三唑-4-基)丙基)恶唑-4-羧酰胺(19b)
5-(3-氯-4-甲氧基苯基)-N-(3-(4-((2-(2-(2-((2-(2,6-二氧代哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)乙氧基)乙氧基)乙氧基)甲基)-1H-1,2,3-三唑-1-基)丙基)恶唑-4-羧酰胺(25)
5-(3-氯-4-甲氧基苯基)-N-(3-(4-(5-((((R)-1-((2S,4R)-4-羟基-2-((4-(4-甲基噻唑-5-基)苄基氨基甲酰基)吡咯烷-1-基)-3,3-二甲基-1-氧丁烷-2-基)氨基)-5-氧戊基)-1H-1,2,3-三唑-1-基)丙基)恶唑-4-羧酰胺(30a)
5-(3-氯-4-甲氧基苯基)-N-(3-(4-((R)-15-(((2S,4R)-4-羟基-2-((4-(4-甲基噻唑-5-基)苄基)氨基甲酰基)吡咯烷-1-羰基)-16,16-二甲基-13-氧代-2,5,8,11-四恶唑-14-氮杂十七烷基)-1H-1,2,3-三唑-1-基)丙基)恶唑-4-羧酰胺(30b)
实施例19在SH-SY5Y细胞中Western blot实验检测优选化合物34m,34n,34o分别在10nM,25nM,50nM,100nM,1000nM对GSK3α/β的蛋白水平的影响。
操作步骤同实施例17,结果见图2。
表1和2表明本发明化合物对SH-SY5Y中GSK3α/β均具有较好的降解能力。图2显示本发明代表性化合物34m、34n和34o剂量依赖型的降解SH-SY5Y细胞中GSK3α/β,有作为阿尔兹海默病或者其他GSK3蛋白相关疾病的治疗剂的潜力。
实施例20在GSKβ过表达细胞(HEK GSK3β293T)中,对比优选化合物34n与传统GSK3β小分子抑制(AZD2858)对GSK3β及GSKβ介导的过度磷酸化tau蛋白的影响。
(1)GSKβ过表达细胞(HEK GSK3β293T)模型的构建:将野生型HEK-293T细胞接种到6孔板中,并使其生长密度至40%时。使用转染试剂(ThermoFisher,#L3000008)将GSK3β质粒转染到野生型HEK-293T细胞。孵育6小时后,将转染溶液替换为新鲜培养基,再孵育育18小时后,即得GSKβ过表达细胞(HEK GSK3β293T)。
(2)分别用1μM优选化合物34n与传统GSK3β小分子抑制剂(AZD2858)与HEK GSK3β293T细胞孵育12h后,将含有药物的培养基倒出,并用新鲜培养基冲洗细胞,洗去残留药物后加入新鲜培养基继续培养,在指定时间点收集细胞,利用Western blot检测GSK3β及GSKβ介导的过度磷酸化tau(p
- 靶向GSK3α/β降解剂的制备及其医药用途
- PI3K/mTOR蛋白降解靶向嵌合体类化合物及其制备方法和医药用途
