一种非洲猪瘟病毒检测试剂盒
文献发布时间:2023-06-19 12:21:13
技术领域
本发明属于生物技术领域,具体涉及一种非洲猪瘟病毒检测试剂盒。
背景技术
非洲猪瘟(African swine fever,ASF)是由非洲猪痘病毒(African swine fevervirus, ASFV)感染引起的,巧猪、豪猪、野猪及家养猪易感,猪一旦感染后,主要临床症状表现为高热、食欲废绝、皮肤发绀,剖检后会发现淋巴结、肾、胃肠黏膜等出血,毒力强 的毒株感染猪后,造成的病死率可高达100%,虽然无该病毒感染人的报道,但发生该 病后对养猪业带来极大的危害,动物产品的销售、贸易等均受到严重限制,因此世界动 物卫生组织将其列为法定上报的动物疫病,在我国动物病原微生物名录中,也被列为一 类动物疾病。
ASFV二十面体对称,病毒粒子直径200nm,结构呈同心球状,最中央区域为核质体,其直径约80nm,由病毒基因组、完成基因早期转录所必需的酶以及一些DNA结合 蛋白组成,如p150、p37、p34、p14以及p14.5、p10,核质体外围是一些蛋白组成的核 衣壳,壳粒是其基本结构单位,共有1982-2172个。
1921年,ASF最早在肯尼亚出现,随后的几十年里该病发生于撒哈拉沙漠周边一些国家,1957年非洲大陆外的葡萄牙国家首次爆发该病,葡萄牙的这次ASF发生后很 快就被控制和消灭掉,到了1960年,里斯本附近地区又爆发了ASF,从该病爆发开始 到1995年,ASFV在伊比利亚半岛(西班牙和葡萄牙)的许多地区蔓延,上世纪70年 代末到80年代中后期,ASFV迅速扩散到世界其他的地方,其中影响较大的是另外一 些欧洲国家(如意大利、法国、荷兰、比利时等)和美洲的一些国家,多米尼加共和国 和巴西尤其严重。通过追根溯源发现,给健康猪饲喂污染ASFV的机场和港口的泔水, 是造成ASFV从疫区国家传播到无疫病国家的主要原因。一旦猪群感染,发病猪及猪肉 制品立马成为新的病毒传染源。西班牙ASFV的流行病学资料显示,控制措施如果能落 实到位,ASF还是可以清除的,然而在意大利的撒丁岛和非洲大陆,特别是非洲东南部 地区,该病毒仍持续存在。上世纪90年代到本世纪初,ASF的流行病学和分布情况发 生了改变,开始进入其他的一些地区,包括一些西非国家;1996年科特迪瓦发生ASF, 1997年尼日利亚和多哥发生ASF,1999年加纳发生ASF,2003年布基纳法索发生ASF,2010年乍得发生ASF等;在西非发生的同时,马达加斯加和毛里求斯这样的岛屿国家 也出现了ASF的流行;2007年,格鲁吉亚首次发生了ASF,随后向西北方向流行,再 次进入欧洲大陆。到目前为止,ASF己在非洲、美洲、欧洲及欧亚大陆交界处等许多国 家流行,2018年8月3日,中国确诊首例非洲猪瘟疫情,2018年之前,中国没有非洲 猪瘟。分子流行病学研究表明:传入中国的非洲猪瘟病毒属基因Ⅱ型,与格鲁吉亚、俄 罗斯、波兰公布的毒株全基因组序列同源性为99.95%左右,通常非洲猪瘟跨国境传入 的途径主要有四类:一是生猪及其产品国际贸易和走私,二是国际旅客携带的猪肉及其 产品,三是国际运输工具上的餐厨剩余物,四是野猪迁徙。中国已查明疫源的68起家 猪疫情,传播途径主要有三种:一是生猪及其产品跨区域调运,占全部疫情约19%;二 是餐厨剩余物喂猪,占全部疫情约34%;三是人员与车辆带毒传播,这是当前疫情扩散 的最主要方式,占全部疫情约46%。
PCR检测具有检测特异性高、灵敏度强、操作简单、可大批量检测等特点,用于检测各种组织、体液中病原微生物的核酸,与其它试验相比,此方法更加快速、敏感,且 不需要分离培养病原微生物,并能进行大批量的流行病学调查。Steiger等首先根据AS FV DNA保守区序列设计一对PCR引物,用建立的PCR检测细胞培养和感染组织中的 ASFV核酸,虽然该对引物检测时灵敏高,但在血液样品检测时,可能会检出假阳性, 并伴有非特异性条带产生。本发明的目的在于提供一种PCR检测方法,具有高度的特 异性和能适应ASFV变异的性能。
发明内容
本发明的目的在于提供适宜ASFV变异的PCR诊断试剂盒,其具有高度保守的引 物序列,可以更好的应对ASFV的变异以及具有高度的特异性。
本发明的制备和使用过程如下:
1.从NCBI上获得非洲猪瘟序列,通过NCBI Blast功能,获得保守序列,比对结 果见图1;
2.使用Primer Premier 6.0针对保守序列设计引物,设计的引物序列为:Primer:F 5’-CTGGCATAGGACGGAGTA-3’(Seq ID No.1),R 5’-CGCAACATTCGCATCTAC- 3’(Seq IDNo.2),扩增区域94354-94632,长度279bp;
3.样品处理
选择多只疑似非洲猪瘟的猪,采集每只病猪的的淋巴结、肾、胃、肠等若干份,-2 0℃冰箱中保存,并做好记录,称取每份样品10g,剪碎后加入5ml PBS缓冲液(pH值 为7.4),用组织匀浆机低温研磨,反复冻融2次,再次研磨,放入低温离心机以5000 r/min离心10min,上清液转移至另一支灭菌离心管内-20℃保存,用于DNA的提取;
4.样品DNA模板提取
将组织匀浆液转移至1.5ml离心管中,煮沸裂解10min,然后以10000r/min低温离心10min,将上清液移入另一支干净离心管内,-20℃保存,备用;
5.试剂盒组成
20支PCR反应管、300μl PCR反应混合物、2.0g琼脂糖、100μl溴化乙锭10μg/μl、0.25%溴酚蓝点样缓冲液100μl、5μl Taq酶(5U/μl);
6.PCR扩增
取步骤四样品5μl,加入15μl PCR反应混合物、1U Taq酶,PCR反应程序:95℃5min,94℃1min,55℃1min,72℃1min,35个循环;72℃10min,样品出现预定 大小的荧光带即为阳性。
本发明的有益效果是:
本发明提供的非洲猪瘟病毒检测试剂盒,其中包含的引物序列高度保守,可以检测 不同来源,突变的非洲猪瘟病毒,可以更好的应对非洲猪瘟病毒突变。
附图说明
图1序列对比图
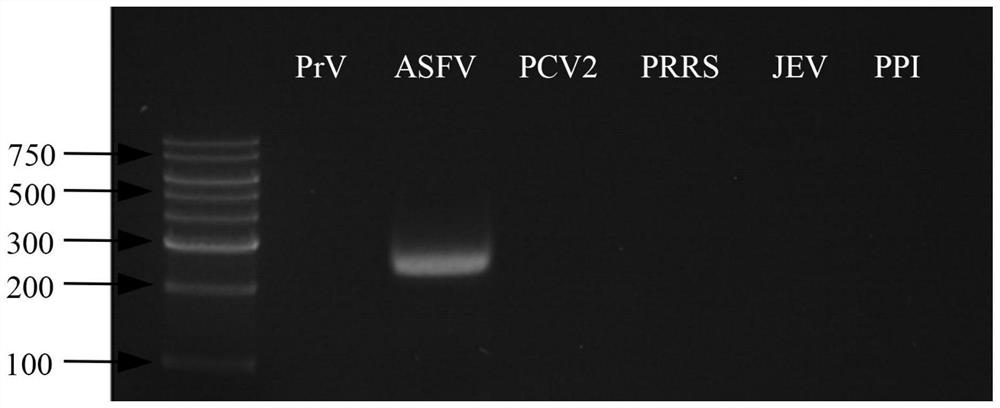
图2特异性检验结果图
图3不同种类非洲猪瘟病毒检测
图4敏感性检验结果图
具体实施方式
下面通过实施例对本发明做进一步详细说明,实施例仅用来说明本发明,并不限制 本发明的范围。
实施例1
本实施例涉及的材料和试剂见表1,实验仪器见表2;
表1实验材料和试剂
表2实验仪器设备
1.从NCBI上获得非洲猪瘟序列(序列号:U18466.2),通过NCBI Blast功能,获得保守序列,比对结果见图1;
2.使用Primer Premier 6.0针对保守序列设计引物,设计的引物序列为:Primer:F 5’-CTGGCATAGGACGGAGTA-3’(Seq ID No.1),R 5’-CGCAACATTCGCATCTAC- 3’(Seq IDNo.2),扩增区域94354-94632,长度279bp;
3.样品处理
选择多只疑似非洲猪瘟的猪,采集每只病猪的的淋巴结、肾、胃、肠等若干份,-2 0℃冰箱中保存,并做好记录,称取每份样品10g,剪碎后加入5ml PBS缓冲液(pH值 为7.4),用组织匀浆机低温研磨,反复冻融2次,再次研磨,放入低温离心机以5000 r/min离心10min,上清液转移至另一支灭菌离心管内-20℃保存,用于DNA的提取;
4.样品DNA模板提取
将组织匀浆液转移至1.5ml离心管中,煮沸裂解10min,然后以10000r/min低温离心10min,将上清液移入另一支干净离心管内,-20℃保存,备用;
5.试剂盒组成
20支PCR反应管、300μl PCR反应混合物、2.0g琼脂糖、100μl溴化乙锭10μg/μl、0.25%溴酚蓝点样缓冲液100μl、5μl Taq酶(5U/μl);
6.PCR扩增
取步骤四样品5μl,加入15μl PCR反应混合物、1U Taq酶,PCR反应程序:95℃5min,94℃1min,55℃1min,72℃1min,35个循环;72℃10min,样品出现预定 大小的荧光带即为阳性。
实验一试剂盒特异性检验
1.病料的收集和处理
选择多只疑似非洲猪瘟的猪,采集每只病猪的的淋巴结、肾、胃、肠等若干份,-2 0℃冰箱中保存,并做好记录,称取每份样品10g,剪碎后加入2ml PBS缓冲液(pH值 为7.4),用组织匀浆机低温研磨,反复冻融2次,再次研磨,放入低温离心机以5000 r/min离心10min,上清液转移至另一支灭菌离心管内-20℃保存,用于DNA的提取;
2.基因组DNA的提取
将组织匀浆液转移至1.5ml离心管中,煮沸裂解10min,然后以10000r/min低温离心10min,将上清液移入另一支干净离心管内,-20℃保存,备用;
3.用本试剂盒对步骤二的DNA样品,以及猪伪狂犬病病毒(Pseudorabies virus,PrV)、猪圆环病毒2型(Porcine circovirus 2,PCV2)、猪繁殖与呼吸综合征病毒(Porcinereproductive and respiratory syndrome virus,PRRS)、猪乙型脑炎病毒(Japaneseenceph alitis virus,JEV)、猪细小病毒(Porcine parvovirus infection,PPI)的cDNA为模板,用设 计的引物PCR扩增,观察结果,结果见图2。
根据实验结果可以看出,本试剂盒在猪瘟病毒样品中可以扩增出特异条带,在PrV、 PCV2、PRRS、JEV、PPI cDNA为模板的PCR体系中未扩增出特异条带,说明本试剂 盒特异性良好。
实验二:试剂盒敏感性检验
将初始浓度为400ng/μl的标准模板ASFV DNA分别按1:10、1:30、1:50、1: 70、1:90、1:100稀释,从每个稀释度各取2μl模板用ASFV PCR试剂盒进行检验, 观察结果,实验结果见图3。
结果显示1%稀释的PrV DNA模板也能用本试剂盒检测出来。
实验三:应对非洲猪瘟病毒变异能力检测
从NCBI上查找相差比较大的不同区域,不同时间段非洲猪瘟病毒序列(MN641876.1、MH910496.1、MN336500.2、M77121.1、NC044956.1、AY261365.1、NC044942.1、LR536725.1),人工合成相关的4Kb的DNA序列,插入pGEM-T载体,瞬时转染大肠 杆菌DH5а,挑选克隆测序,测序正确的菌株,扩大培养,用本试剂盒PCR检测,实验 结果见图3。
从实验结果可以看出,均出现了目的条带,说明本试剂盒能够很好的检测不同类型 的非洲猪瘟病毒,具有很好的抗病毒变异功能。
实验四:与其他方法的比较
收集猪血液95份,用本试剂盒与HA、ELISA方法分别检测样品,观察结果,实验 结果见表3。
表3不同检测方法非洲猪瘟病毒检出率
序列表
<110> 广州博识生物科技有限公司
<120> 一种非洲猪瘟病毒检测试剂盒
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ctggcatagg acggagta 18
<210> 2
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
cgcaacattc gcatctac 18
- 一种消除非洲猪瘟病毒检测假阳性的方法及检测非洲猪瘟病毒的试剂盒
- 一种非洲猪瘟病毒检测试剂盒
