用于患者结局的预后预测的系统及其使用方法
文献发布时间:2023-06-19 13:46:35
优先权
本专利申请要求于2019年4月10日提交的名称为“SYSTEM FOR PROGNOSTICATINGPATIENT OUTCOMES AND METHODS OF USING THE SAME”的美国临时专利申请第62/831,837号的优先权,该申请的全部内容由此通过引用并入本文。
背景技术
预测是医学的核心,因为预防和治疗干预是基于关于未来健康结局(outcome)的隐性或显性预期来进行或推荐的。预测目标在于基于预测变量集而量化这些未来健康结局的可能性。
癌症发展遵循的途径依赖于个体的微环境特征和具体基因突变。突变基因的直接产物和由癌症增殖引发的作为结果的微环境改变引起身体稳态上的显著变化。设计为检测和测量由癌细胞引发的稳态变化的非侵入性且客观的技术的发展可提供预后和预测信息,以就患者体内癌症引领更有效的治疗策略。
稳态(homeostasis)是生物体、细胞或群尽管外部状况或该内部平衡状态改变而保持内部状况相同的能力或趋势。应变稳态(allostasis)是通过生理或行为改变实现稳定或稳态的过程。稳态调节反映恒定的稳定性,而应变稳态意味着通过改变的稳定性。稳态系统必须维持在狭窄的范围内。这意味着稳态系统中的偏离会触发恢复性反应以矫正改变。相比之下,应变稳态系统的调节可在相对广的调节范围内进行。
压力是身体和/或情绪刺激,其可使生物体的稳态控制发生变化。压力可认为是输入、处理和结局反应。刺激可影响系统的稳态。生物体可处理刺激并确定刺激是否是压力源,这可导致应激反应。该过程可是周期性的,因为应变稳态涉及内部状况的调节,这是通过可使重要功能增加或降低到新的稳定状态的荷尔蒙和物理参数上的动态变化。应变稳态负荷(allostatic load)可认为是长期暴露于由慢性或反复刺激导致的升高或波动的应变稳态反应的成本。例如,癌细胞增殖及其在供氧中的核心作用可是身体机械和代谢压力的来源。
已经对应变稳态负荷作为评估身体健康状态的多系统方法进行了研究。应变稳态负荷负荷可描述为由自主神经系统(ANS)和内分泌系统介导的神经内分泌应激反应的激活,这可导致生理反应。对一段时间内心率变异性(HRV)波动的分析可用作为ANS状态和灵活性的测量。心脏受到副交感神经影响的持续性抑制控制。因此,通过副交感神经支配交感神经影响,静息心脏自主平衡有利于能量守恒。此外,一段时间上的心率可通过心动周期间变异性(beat-to-beat variability)表征,这也意味着迷走神经支配,因为交感神经对心脏的影响过慢而无法产生快速心动周期间改变。因此,低HRV可与增加的全因死亡风险相关联,并且低HRV可是疾病的标志。
应变稳态负荷评分和HRV可用作为压力相关健康风险的指标。对应变稳态负荷和HRV的分析显示,应变稳态负荷可随压力和压力相关疾病而增加,而HRV可随之降低。应变稳态负荷和HRV之间的这种负相关可由迷走神经张力介导,并可显示与健康风险评估的相关性。
血流动力学参数(Hdp)监视器或任何其他能够记录血流动力学或心脏电活动的设备用于感测和监视多种Hdp值。多种Hdp值可用于诊断患者的心血管状况。Hdp测量通常与心电图(ECG)结合进行,其可包括每搏输出量(SV)、每搏指数(SI)和心输出量(CO)的测量。这样的测量适用于患有心脏病的患者的诊断和治疗,诸如心力衰竭、高血压、冠状动脉疾病和心包疾病,以及阻塞性肺病和胸膜疾病以及肾功能不全。
HRV是心搏之间时间间隔变化的生理现象。其是通过心动周期间间隔上的变化测量的。其他术语也已用于描述连续心动周期中的振荡,诸如心脏周期变异性、R波-R波变异性和R波-R波间隔(RR间隔或RRI)血流速度图。用于识别HRV变量的示例处理包括记录RRI值、计算机数字化、伪影识别、HRV数据编辑、HRV间隔拒绝、HRV数据排序和插值、以及就时域HRV和频域HRV的采样。
发明内容
在实施例中,用于诊断或预后预测患者的健康状况或患者的生存质量(thequality of life)、生存或入院的系统可包括Hdp监视系统,该Hdp监视系统配置为检测、测量和存储由患者在基础或非暴露期期间表现出的就RRI值的多个第一值和由患者在暴露期之前、期间或之后表现出的就RRI值的多个第二值,患者在该暴露期中暴露于低能量电磁载波输出信号。系统还可包括电动生成器,该生成器适于致动以生成低能量电磁载波输出信号,用于在暴露期期间使患者暴露于该低能量电磁载波输出信号或将该低能量电磁载波输出信号应用到患者;以及处理系统,该处理系统可配置为同步Hdp监视系统和电动生成器。在一些实施例中,处理系统可在Hdp监视系统的内部或外部。在一些实施例中,处理系统可配置为感测和识别一个或多个调幅电磁频率。系统还可包括接口控制器,该接口控制器可与Hdp监视系统和电动生成器可操作地通信。在一些实施例中,Hdp监视系统可测量一个或多个RRI值、计算一个或多个HRV值、记录一个或多个HRV变化值、识别一个或多个调幅电磁频率、或其组合。在一些实施例中,处理系统可将一个或多个HRV值与库和电动生成器集成。在一些实施例中,系统的低能量电磁载波输出信号可包括在从约0.01Hz至约150kHz的范围中的调幅频率。
在一些实施例中,Hdp监视系统可配置为检测、测量和存储由一个或多个替代患者在基础或非暴露期期间表现出的就RRI值的多个第一值,和由一个或多个替代患者在暴露期期间或之后表现出的就RRI值的多个第二值,一个或多个替代患者在该暴露期中暴露于低能量电磁输出信号。在一些实施例中,系统可与电动生成器接口,该生成器适于致动以生成低能量电磁载波输出信号,用于在暴露期期间使替代患者暴露于该低能量电磁载波输出信号或将该低能量电磁载波输出信号应用到替代患者。系统可还包括处理系统,该处理系统配置为同步Hdp监视系统和电动生成器。处理系统可在Hdp监视系统的内部或外部。在一些实施例中,处理系统可配置为感测和识别一个或多个调幅电磁频率。在另外的实施例中,系统可包括接口控制器,该接口控制器与Hdp监视系统和电动生成器可操作地通信。在一些实施例中,Hdp监视系统可配置为测量一个或多个RRI值、计算一个或多个HRV值、记录一个或多个HRV变化值、识别一个或多个调幅电磁频率、或其组合。处理系统可将一个或多个HRV值与库和电动生成器集成。在一些实施例中,低能量电磁载波输出信号可包括在从约0.01Hz至约150kHz的范围中的调幅频率。
在一些实施例中,用于诊断或预后预测患者的健康状况或患者的生存质量、生存或入院的系统可包括Hdp监视系统,该Hdp监视系统可配置为检测、测量和记录由患者在暴露期期间表现出的就多个血液动力学参数中的每个的多个第一值。暴露期可包括患者在其中暴露于一个或多个电磁频率信号的时间段。系统还可包括电动频率生成器,该频率生成器适于在暴露期期间生成一个或多个电磁频率信号。一个或多个电磁频率信号可配置为影响细胞功能。系统还可包括处理系统,该处理系统可配置为同步Hdp监视系统和频率生成器,自动调谐载波信号以调节递送到患者的正向能量,并指示频率生成器通过调制载波信号的振幅以产生调幅电磁频率使患者暴露于一个或多个电磁频率信号中的每个。在一些实施例中,调幅电磁频率可从在10Hz至1000Hz的范围内选择。在另外的实施例中,多个血液动力学参数可包括RR间隔、心率、收缩压、舒张压、中位血压、脉压、每搏输出量、心输出量和总外周阻力中的一个或多个。在一些实施例中,处理系统可配置为至少基于就多个血液动力学参数中的每个多个的第一值致动频率生成器,以生成具有高度特异频率的一个或多个射频(RF)载波信号。在一些实施例中,频率生成器可包括可编程生成器。在另外的实施例中,可编程生成器可包括一个或多个可控生成器电路,其中每个可控生成器电路可配置为生成一个或多个RF载波信号。在一些实施例中,每个可控生成器电路可包括调幅(AM)频率控制信号生成器,其可配置为控制一个或多个RF载波信号的调幅变化。在另外的实施例中,RF载波信号可是27.12MHz的信号。在一些实施例中,系统还可包括计算设备,该计算设备可操作地连接到处理系统并且配置为存储至少一个计算统计算法,该计算统计算法配置为输出一个或多个变量以供在自动调谐载波信号中使用。
在一些实施例中,用于预后预测患者的生存质量、生存或入院的系统可包括Hdp监视系统,该Hdp监视系统可配置为检测、测量和记录由患者在暴露期期间表现出的就多个血液动力学参数中的每个的多个第一值。暴露期可包括患者在其中暴露于多个电磁频率信号的时间段。在一些实施例中,系统还可包括电动频率生成器,该频率生成器适于在暴露期期间生成一个或多个电磁信号。在一些实施例中,系统还可包括处理系统,该处理系统配置为同步Hdp监视系统和频率生成器,自动调谐载波信号以调节递送到患者的正向能量,并指示频率生成器通过调制载波信号的振幅以产生期望的电磁频率信号以使患者暴露于多个电磁频率信号中的每个。在一些实施例中,调幅电磁频率可从在10Hz至1000Hz的范围内选择。
在一些实施例中,用于诊断或预后预测患者的健康状况的方法可包括:由Hdp监视系统测量就RRI值的多个第一值,计算在患者暴露于RF载波信号期间由患者表现出的HRV值,处理HRV值并使患者暴露于具有高度特异频率的一个或多个RF载波信号,记录在一个或多个替代患者暴露于一个或多个RF载波信号期间由一个或多个替代患者表现出的代表性HRV值,存储代表性HRV变化值的多个第一值和多个第二值,并将来自预诊断或诊断患者的代表性HRV变化值输送到库以供进一步处理。在一些实施例中,一个或多个RF载波信号可包括在从约0.01Hz至约150kHz的范围中的调幅电磁频率。
在一些实施例中,诊断或预后预测患者的健康状况的方法可包括:由处理系统确定多个电磁频率信号以应用到患者;由处理系统自动调谐载波波以平衡递送到患者的正向能量;由可操作地连接到处理系统的频率生成器,通过调制载波信号的振幅以产生期望的电磁频率信号而使患者暴露于多个电磁频率信号中的每个,该电磁频率信号可配置为影响患者的细胞功能;由血液动力学参数(Hdp)监视系统测量在患者暴露于多个电磁频率信号期间由患者表现出的就多个血液动力学参数的多个第一值;并且分析多个第一值以提供就患者的健康状况的诊断。在一些实施例中,调幅信号可从在10Hz到1000Hz的范围内选择。在一些实施例中,方法还可包括将针对调幅电磁频率的单个频率暴露的频率反应识别为非反应性、反应性或后反应性。在另外的实施例中,多个血液动力学参数可包括RR间隔、心率、收缩压、舒张压、中位血压、脉压、每搏输出量、心输出量和总外周阻力中的一个或多个。在一些实施例中,方法可包括确定导致患者Hdp值改变的RF载波信号。在另外的实施例中,载波信号可包括27.12MHz的信号。在一些实施例中,自动调谐可包括基于计算统计算法的输出调节载波信号的正向能量。
在一些实施例中,预后预测患者的生存质量、生存和入院的方法可包括:由处理系统确定多个调幅电磁频率以应用到患者;由处理系统自动调谐载波波以平衡递送到患者的正向能量;由可操作地连接到处理系统的频率生成器,通过调制载波信号的振幅以产生期望的电磁频率信号而使患者暴露于多个调幅电磁频率中的每个,该调幅电磁频率可配置为影响患者的细胞功能;由Hdp监视系统测量在患者暴露于多个调幅电磁频率期间由患者表现出的就多个血液动力学参数的多个第一值;并且分析多个第一值以提供就患者的生存质量、生存和入院的诊断或预后。在一些实施例中,调幅电磁频率可从在10Hz到1000Hz的范围内选择。在一些实施例中,方法还可包括将针对调幅电磁频率的单个频率暴露的特异频率反应识别为非反应性、反应性或后反应性。在另外的实施例中,多个血液动力学参数可包括RR间隔、心率、收缩压、舒张压、中位血压、脉压、每搏输出量、心输出量和总外周阻力中的一个或多个。在一些实施例中,方法可包括确定导致患者Hdp值显著改变的调幅电磁频率。在一些实施例中,自动调谐可包括基于计算统计算法的输出调节载波信号的正向能量。在另外的实施例中,细胞功能可是微管电导率。
在一些实施例中,可编程生成器可通过电力激活并且构造成对温血哺乳动物对象中的细胞功能或功能障碍产生影响。在一些实施例中,可编程生成器可包括至少一个可控低能量电磁能量生成器电路,用于生成一个或多个高频率载波信号。至少一个生成器电路可包括至少一个调幅控制信号生成器,用于控制一个或多个载波信号的调幅变化;以及至少一个可编程调幅频率控制信号生成器,用于控制以该频率生成调幅的频率。在一些实施例中,每个可编程调幅频率控制信号生成器可适于将以该频率生成调幅的频率准确控制在相对于参考调幅频率的至少百万分之1000的准确度内,该参考调幅频率是从在0.01Hz至150kHz的范围内选择的。在一些实施例中,可编程生成器还可包括至少一个数据处理器,其构造并且布置用于与至少一个生成器电路通信并用于从控制信息源接收控制信息;以及连接位置,其配置为连接到导电应用器,该导电应用器可配置为以程序控制的频率向温血哺乳动物对象应用一个或多个调幅低能量发射。可根据温血哺乳动物对象的健康状况选择参考调幅频率。
附图说明
图1A-C图示了根据实施例的生存质量分析。
图2描绘了来自38例晚期肝细胞病患者的典则判别函数。整体健康状态值按三分位数分组:A.QoL≥65%、B.35%≤QoL<65%、C.QoL<35%。
图3图示了来自75例晚期肝细胞癌患者以及健康对照的典则判别函数。整体健康状态值按三分位数分组:A.QoL≥65%、B.35%≤QoL<65%、C.QoL<35%。
图4图示了根据实施例的根据预后预测组的生存曲线。
图5图示了根据实施例的与数据合并的数字同步血液动力学时间系列。数据通过数学算法处理以识别对在方框中示出的调幅电磁频率的特异血流动力学应激反应[各栏从左到右:时间(s)、搏动数、频率(Hz)、RR(ms)、dBP(mmHg)、SV(ml)和几何变换1至4]。
图6图示了根据实施例的根据肝细胞癌患者的分层C30指数评分的总体生存曲线。较低的C30指数评分说明较好的生存质量评估值。C30指数评分=Σ[(100-身体功能)+(100-角色功能)+(100-情绪功能)+(100-认知功能)+(100-社会功能)+(100-整体QOL)+疲劳+恶心+疼痛+呼吸困难+失眠+食欲不振+便秘+腹泻+经济困难]/15
图7A-E示出了根据一些实施例的就一个或多个患者人群的生存曲线。就患者人群的总体生存期曲线具有未达到+9.0个月(95%CI7.4-10.3)的中位总体生存期(mOS)。低风险组人群(蓝色曲线)具有未达到的mOS,并且高风险组人群(红色曲线)具有的mOS=7.1个月(95%CI4.8-9.4)(图99B)。
图8描绘了根据实施例的预测。根据接受第二EMF暴露过程的患者的风险指数、以天为单位测量的生存时间(OS)、功能状态(FS)、QoL和症状量表(SS)预测下一次暴露结果。预测的OS以天为单位报告;预测的FS、QoL和SS以百分比变化(分别为00%、-43%、+12%)报告。
图9A-B图示了根据一些实施例的具有预测数据的条形码编码。
图9C图示了根据实施例的有效频率模式。
图10描绘了根据实施例的如本文中描述的便携式医疗设备的样本使用场景。
图11描绘了根据实施例的便携式医疗设备的替代样本使用场景。
图12图示了根据实施例的便携式医疗设备的样本电路图。
图13图示了根据实施例的信号调制器的样本电路图。
图14图示了根据实施例的放大器的样本电路图。
图15图示了根据实施例的功率监视器的样本电路图。
图16A-B图示了根据实施例的信号调制器的流程图。
图17图示了根据实施例的信号调制器的流程图。
图18图示了根据替代实施例的信号调制器的流程图。
图19图示了根据多种实施例的调幅(AM)射频(RF)电磁场(EMF)。
图20描绘了根据实施例的集成医疗系统的说明性示意结构。
图21描绘了根据实施例的集成系统的说明性框图。
图22图示了根据实施例的用于训练计算统计算法的示例流程。
图23A图示了表示根据实施例的在一天或两天的过程中的信号暴露规程的图表。
图23B图示了表示在一天或两天的过程中带有反射能量测量的信号暴露规程的图表。
图23C图示了表示根据实施例的在一天或两天的过程中的信号暴露规程的图表。
图23D图示了表示根据实施例的在一天的过程中的信号暴露规程的图表。
图23E图示了表示根据额外实施例的在一天的过程中的信号暴露规程的图表。
图24图示了根据一些实施例的反射能量差异。
图25图示了根据实施例的用于治疗患者的样本过程流程。
图26图示了根据实施例的患者反应集的图表。
图27A图示了表示根据实施例的在一天的过程中的信号暴露规程的图表。
图27B图示了根据实施例的与第一频率暴露规程相比较的新有效频率的确定。
图28图示了根据实施例的有效频率的分布。
图29图示了根据另外实施例的有效频率的分布。
图30图示了根据实施例的正态概率图构建。
图31图示了根据实施例的条形码系统。
图32图示了根据另外实施例的条形码系统。
图33图示了根据实施例的用于诊断健康患者和肝细胞癌患者的条形码系统。
图34A图示了根据实施例的来自四种癌症类型的1,054个癌症特异频率的分布。
图34B图示了在21例患者中在暴露于不同的三组癌症特异频率期间疾病特异AMEMF和健康特异AMEMF的分布。
具体实施方式
本公开涉及用于表征、诊断或预后预测患者或温血哺乳动物对象的生存质量、生存或入院的Hdp监视系统。更具体地,本公开涉及集成Hdp系统,其能够通过RR间隔(RRI)值测量、监视和记录心脏的电活动并计算这些值以识别由于温血哺乳动物对象暴露于其调幅电磁频率(AMEMF)而导致的特异心率变异性(HRV)值,以便诊断或提供患者生存质量、生存或入院的预后。
在一些实施例中,健康状况可包括但不限于肝细胞癌、结肠直肠癌、乳腺癌、卵巢癌、胰腺癌、头颈癌、膀胱癌、肝癌、肾癌、黑色素瘤、胃肠癌、前列腺癌、小细胞肺癌、非小细胞肺癌、肉瘤、胶质母细胞瘤、T细胞和B细胞淋巴瘤、子宫内膜癌、或宫颈癌。
频率合成器可用于生成特异频率或这样的频率系列。用户可使用键盘或其他输入设备选择这样的频率,这继而可使电路在明确定义的时间间隔内打开或关闭生成的信号。
在实施例中,当将对象暴露于由可编程生成器发射的一个或多个射频载波信号时,处理系统可使用连接到患者或温血哺乳动物对象的ECG监视系统从测量和记录的RRI值计算血液动力学参数。Hdp监视系统测量并记录RRI值以供进一步处理。便携式医疗设备内部或外部的处理系统可执行旨在计算HRV值的计算处理系列。将HRV值组织、同步、聚合、记录和存储为代表性HRV变化值用于将在频率库(ILf)中执行的进一步计算统计过程。处理系统通过使用多种测量和记录的患者的HRV值提供Hdp监视系统的感测能力,并识别调幅电磁频率(AM EMF),其特征在于可识别的HRV值改变的模式。AM EMF是对温血哺乳动物对象(即患者)的细胞功能或功能障碍产生影响的信号的子集。Hdp监视系统使用探测器(更广义地描述为导电应用器)使患者暴露于射频载波信号,该探测器用于经由在身体的一个或多个确定部位处的局部接触将发射应用到患者。Hdp监视系统使用放置为与身体的一个或多个确定部位局部接触的电极测量和记录来自患者的RRI值。
在实施例中,Hdp监视系统可计算和识别代表性HRV变化值,该代表性HRV变化值可存储在的内部临时存储设备中用于异步传输到ILf。在替代实施例中,Hdp监视系统可通过与加密网络的无线连接将代表性HRV变化值同时传输到ILf。在替代实施例中,便携式医疗设备可将RRI值和与患者暴露于高度特异频率射频载波信号相关的信息传输到带有处理系统的外部设备,以便在传输到ILf之前计算和识别代表性HRV变化值。
在实施例中,Hdp监视系统或带有处理系统的外部设备可连接到加密网络。代表性HRV变化值可经由连接到加密网络平台的同步或异步连接传输到ILf,用于进一步计算统计计算过程。
在实施例中,处理系统可包括设备同步器、数据聚合器、存储设备和/或存储接口、和接口控制器。接口控制器可配置为将计算的HRV值和暴露于一个或多个调幅电磁频率进行匹配(同步)。额外地或替代地,接口控制器可配置为合并待存储(存储)的记录(数据聚合)用于进一步处理和传输,使得HRV值与暴露于一个或多个高度特异频率射频载波信号相链接,这样的HRV值是从该暴露测量的。Hdp监视系统和可编程生成器可经由接口控制器连接。对应于同步和数据聚合的模块和存储接口可布置在便携式医疗设备集成硬件解决方案中,或者作为集成硬件解决方案布置在具有计算能力的外部设备中。
在另一实施例中,Hdp监视系统可通过使患者暴露于一个或多个射频载波信号诊断或预断患者的健康状况、生存质量、生存或入院。可编程生成器可加载以指令,该指令配置为为具有特定健康状况的温血哺乳动物对象产生健康状况特异的AM EMF组。在实施例中,可准确控制AM EMF组。在实施例中,每个AM EMF可具有距预期调制频率约0.5Hz的分辨率。在另一实施例中,每个AM EMF可具有距预期调制频率约0.1Hz的分辨率。在又另一实施例中,AM EMF组可具有距预期调制频率约0.01Hz的分辨率。在还另一实施例中,每个AM EMF可具有距预期调制频率约0.001Hz的分辨率。
在实施例中,患者可以相对低且安全的能量水平暴露于AM EMF发射,这导致患者的低吸收水平。一般认为,温血动物体内的生理交换或电脉冲流(其将受到应用所公开系统的发射的影响)在低能量水平下是相似的。无论如何,在某些实施方式中,在暴露区域(在接触点处或接触点附近、或通过带有对象接收处理的导电应用器的感应)中的比吸收率(SAR)应当并且最优选地显著低于1.6mW/g活组织。
此外,在发射期间可稳定地维持发射,使得稳定性应当优选地在10
在某些实施方式中,可编程生成器可包括微处理器(或其他类似的集成电路),其配置为根据例如从处理系统加载的控制信息进行操作。在一些示例中,可编程生成器可组合其他监视系统,诸如ECG监视系统、便携式医疗设备或其他计算服务器,其所有一起操作并由处理系统作为一个单个的新系统同步。因此,新的和改进的可编程生成器可加载以更新的调幅电磁频率系列,该更新的调幅电磁频率系列是在单个温血哺乳动物对象中或从具有相同健康状况的温血哺乳动物对象的组中识别的。此外,如本文中描述的新的和改进的可编程生成器可支持不同的应用,诸如诊断、预后、搜索调幅电磁频率和治疗跟踪。微处理器(或集成电路)可控制可编程生成器的功能以产生期望的治疗发射。在一些示例中,可编程生成器可包括连接到低能量电磁发射的发射器的阻抗变换器和将发射应用到患者的探测器(例如,导电应用器)。阻抗变换器可配置为使发射器电路感测到的患者的阻抗与发射器电路的输出的阻抗基本上匹配。
Hdp监视系统可配置为测量RRI值、计算HRV值、并且记录用于AM EMF识别的代表性HRV变化值。识别的AM EMF可用于患者健康状况的诊断或预后。如图1-9中图示的,识别的AMEMF可用于患者的生存质量、生存或入院的预后预测。因此,如本文中描述的系统可包括Hdp监视系统,其测量RRI值并记录患者的多种识别的代表性HRV变化值。相应地,系统通常可使用放置为与身体的多种确定部位局部接触的电极测量患者的多种识别的RRI值。ECG监视系统可进一步包括子系统,该子系统配置为记录患者的多种识别的RRI值。计算和记录的HRV值可存储在一个或多个存储设备中。
可遵循既定过程计算和记录HRV值。在非暴露射频载波信号期期间的个体或患者的RRI值的初始测量或其RRI值在本文中识别为基础测量或基础RRI值。上述参数的初始测量可在放松期(诸如约15分钟)后在温血哺乳动物对象上进行,并且患者处于仰卧位(面部朝向上并且优选地手掌心也朝向上)或在另一舒适且放松的位置。
在获得上述初始测量之后,可将选择一个或多个射频载波输出信号的系列应用到对象,从而提供用于暴露测量或暴露RRI值。
可根据加载到可编程生成器中的控制程序对上述一个或多个射频载波信号进行调幅,该可编程生成器以某些预先确定的调幅频率生成AM EMF输出信号。在一些实施方式中,优选地在确定的时间段期间,最优选地在患者的至少十次心搏的时间段上或至少10秒的时间段上,使患者暴露于AM EMF输出信号或者在将这样的信号应用到患者。该过程通常可在患者连接到同步的Hdp监视系统和可编程生成器二者时进行,使得可在暴露期或应用期期间测量RRI值并且计算和记录HRV值。然而,HRV值还可或替代地是初始数据源,以如上文描述的在软件处理之后识别AM EMF信号和/或代表性HRV变化值。
在对象或患者进行上述指出的暴露或应用期间或之后测量的上述Hdp值在本文中分别称为暴露Hdp值、后暴露Hdp值。
通常应用于具有健康状况的多个患者的上述过程,可提供与健康状况或患者的生存质量、生存、或入院的预后相关的多个基础RRI值、多个暴露RRI值和多个后暴露RRI值。这些多个RRI值通常可多少是散点值,并且在计算之后可产生类似散点HRV值。相应地,为了定义代表性HRV变化值的目的,可将这样的散点值规律地提交到处理系统,使得处理系统可执行使用代表性HRV变化值识别调幅电磁频率的统计计算。
与上述一致,Hdp监视系统提供了用于软件处理Hdp值的装置,该Hdp值用于在一个或多个调幅电磁频率的识别、患者健康状况的诊断或患者的生存质量、生存或入院的预后中使用。识别的调幅电磁频率和代表性HRV变化值是代表性替代标记。这样的代表性替代标记通过在非暴露期和暴露期期间就预先诊断和诊断为健康或具有已知健康状况的患者测量和记录Hdp值,从Hdp监视系统通过处理系统确定。
为了诊断、AM EMF信号识别、患者的生存质量、生存或入院的预后的目的而采用的代表性替代标记可从来自代表性基础RRI测量值、代表性暴露RRI测量值和/或代表性后暴露RRI测量值的信息的计算组合中导出。这些计算组合可在ILf中执行。
凭借可变频率可编程生成器装置,暴露或应用AM EMF信号的时间段可在较宽的频率范围内;例如,就待发生变化的RRI值,在约0.01至约150MHz之间的范围内的AM EMF信号在任何具体频率值处可需要较短的时间段。因此,可需要AM EMF信号的范围段的连续暴露或应用,以便识别在心搏时间期间基础、暴露和后暴露HRV值实际发生时的AM EMF值,在该心搏时间时由Hdp监视系统测量并由处理系统处理RRI值以计算HRV值并且以确定代表性HRV变化值。
在如上文描述的集成在记录装置内或耦合到记录装置之外,处理系统可位于中央服务器处并由加密的基于网络的平台连接到Hdp监视系统或便携式设备,其可基于接收的或通信到中央服务器的记录的代表性HRV变化值执行分析。
下面关于图10-15的讨论说明了如上文描述的Hdp监视系统的多种示例以及可利用该监视系统的具体环境。
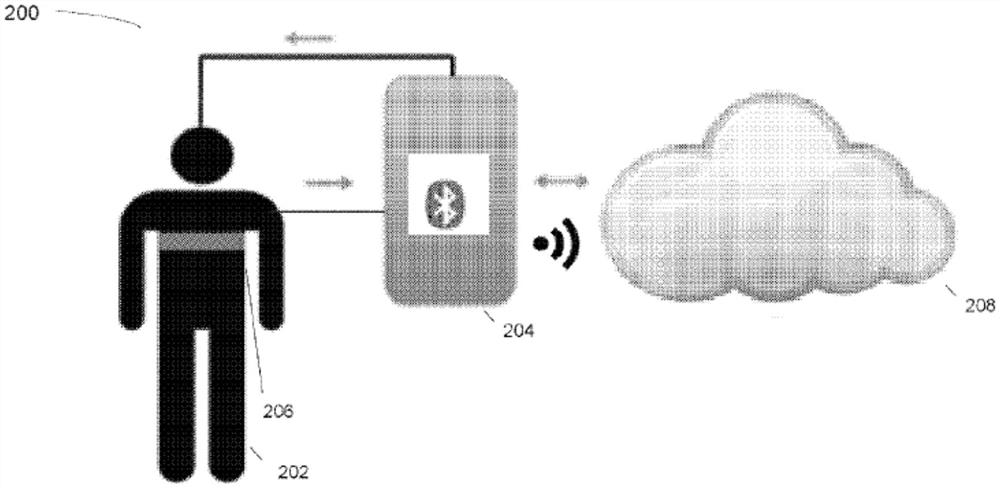
图10图示了用于监视患者102的样本系统100。在某些实施方式中,便携式医疗设备104可可操作地连接到与患者102接触的传感器组件106。在多种实施例中,传感器组件106可包括绕患者102系住的电极带(如图10中示出的)、天线和其他电传感器组件,用于应用电信号并检测与传感器组件106相关联的患者102的电反应。在一些实施例中,传感器组件106可是配置为放置在患者102口中的勺形天线。医疗设备104可配置为产生电信号集(例如,经由上文描述的可编程生成器设备)并经由电传感器组件106将信号传输到患者102。电传感器组件106可配置为测量由患者102产生的电反应并且将指示所测量的电反应的值返回到医疗设备104。在某些实施方式中,医疗设备104可将该信息传输到外部计算设备,诸如智能电话108或图21中图示的计算设备600,用于进一步处理。此外,在一些示例中,外部计算设备可可操作地连接到加密网络110,用于传输任何处理的信息以供远程计算设备(诸如远程服务器)进行远程存储和/或额外计算。
在一些实施例中,便携式医疗设备104可与诸如上文描述的外部计算设备合作工作。在这样的实施例中,可减少便携式医疗设备104的内部处理部件,从而减小便携式医疗设备的整体尺寸。然而,在一些实施例中,便携式医疗设备104可设计为使得其可就接收自患者102的电反应进行分析。
图11图示了用于监视患者202的示例系统200。在某些实施方式中,便携式医疗设备204(类似于上文描述的便携式医疗设备)可可操作地连接到与患者202接触的电传感器组件206。如上文描述的,电传感器组件206可包括由患者佩戴的电极带、天线等。医疗设备204可配置为产生电信号集(例如,经由如上文描述的可编程生成器设备)并经由传感器组件206将信号传输到患者202。传感器组件206可配置为测量由患者202产生的电反应,并将指示测量的电反应的值返回到医疗设备204。然而,与图10中不同,医疗设备204可配置为在返回的值的基础上进行额外分析。此外,在一些示例中,医疗设备204可可操作地连接到加密网络208,用于传输任何经处理的信息以供远程计算设备(诸如远程服务器)进行远程存储和/或额外计算。
图12描绘了便携式医疗设备300(诸如本文中描述的那些)的说明性电路图。医疗设备300可包括固定载频振荡器302和电流模式平衡调制器304。在某些实施方式中,频率振荡器302可配置为产生27.12MHz的信号。然而,应注意的是,该信号频率仅以示例的方式提供并且可基于便携式医疗设备300的预期功能变化。在某些实施方式中,频率振荡器302可配置为产生具有在1.0mHz和1.0Hz、1.0Hz和1.0kHz、1.0kHz和1.0MHz、1.0MHz和1.0GHz之间、和/或高于1.0GHz的频率的信号。
在一些示例中,调制器304可由直接数字合成器306生成的正弦电流调制,从而产生调制载波信号。在某些实施方式中,正弦电流可具有10MHz的频率分辨率和10ppm(百万分率)的频率准确度。在一些实施例中,频率准确度可是1ppm。在一些实施例中,频率准确度可是0.1ppm。在这些实施例中的每个中,如果生成的信号符合规定的准确度,则可将其定义为“高度特异”的。
调制载波信号可由放大器308放大。在某些实施方式中,放大器308可是AB类平衡RF放大器。放大器308的输出可由滤波器310滤波以减少谐波含量。滤波后的信号可由定向耦合器312处理并传送到功率监视器314和自适应匹配部件316。功率监视器314可配置为监视滤波后的信号的当前功率水平,并且如果必要的话向微处理器318提供调节信号。微处理器318可改变由合成器306生存的正弦电流,从而改变输出功率。在一些实施方式中,微处理器318可可操作地连接到医疗设备300的光学接口320,该光学接口320配置为显示从微处理器接收的信息。在一些示例中,光学接口320可包括输入设备,诸如触摸屏,以从医疗设备300的用户接收输入信息。
医疗设备300还可包括电池322和配置为管理和分配由电池生成的电力的功率管理部件324。在一些示例中,电池322可是耦合到充电部件326的可充电电池,充电部件326配置为当医疗设备300连接到外部电源时向电池提供充电信号。
如上所述,定向耦合器312的输出可传递到自适应匹配部件316。自适应匹配部件316还可连接到微处理器318并由其控制。一旦接收到来自微处理器318的指令,自适应匹配部件316可配置为向定位在患者身体上的一个或多个传感器提供RF输出信号。
在某些实施方式中,可凭借自动水平控制回路将滤波后的功率保持在期望的水平,如上文描述的,该回路包括功率监视器314和微处理器318,以便确保当电池322放电时电压上的变化不会显著影响治疗。通过调节自适应匹配部件316最小化反射功率以确保治疗信号向患者的有效输送。在一些示例中,可使用频率和持续时间命令在光链路上直接从计算机控制医疗设备300,并且医疗设备300可在限定的时间段之后返回到低功率状态。
图13图示了用于产生如上文描述的在图12的描述中的调制载波信号的示例电路图。如上所述,调制正弦信号可由直接数字合成器(DDS)402产生,DDS包括集成电流输出数模转换器(DAC)。在某些实施方式中,调制正弦信号可在约10Hz至约50kHz的频率范围内。
电流镜404可用于驱动电流模式平衡调幅器。电流镜404的输入可包括两个分量,来自DDS402的正弦波和DC电流,其是可调节的以将调制深度设置到期望范围,例如,原始信号的85%到90%。来自电流镜404的输出可形成作为高阻抗电流源操作的晶体管对的尾部(tail),该电流源的电流为2I
图14图示了用于放大器500(例如,如上文描述的在图12的描述中的放大器308)的示例电路图。可使用平衡放大器500放大来自电流模式调制器的信号以获得需要的信号水平。
放大器500的增益以及因此的输出水平在一定程度上取决于电池电压。因此,在放大器500之前的可是可变衰减器502,该可变衰减器502可调节以在电池放电时维持恒定的输出功率。衰减器502可在T衰减器配置中使用分流PIN二极管,其中通过二极管的较高电流产生较高衰减。如上所述,在某些实施方式中,放大器500可是带有并联RF设备的AB类平衡设计以增加电流容量。
输入变压器可将输入从单端信号转换为平衡信号,并且可匹配设备的输入阻抗。每对设备可放大信号的半个周期。因此,输出信号在削波前的峰值振幅可接近电池电压的两倍。输出变压器可将两个信号组合以产生最终的输出信号。AB类偏压确保任何交叉失真最小化。可选择输出平衡/非平衡转换器的阻抗转换比,使得可在有限的电源(电池)电压下生成期望的输出功率。平衡放大器设计抑制偶次失真产物;然而,可使用低通滤波器504(例如5阶低通滤波器)抑制奇次谐波。
图15图示了用于监视由放大器产生的RF正向和反射功率的示例电路图。可使用定向耦合器2602对来自放大器(例如放大器500)的输出进行采样,并且使用具有例如>30dB动态范围的对数功率检测器2604检测正向信号。可对输出信号进行低通滤波以从调幅信号获得平均包络功率。在某些实施方式中,平均包络功率可由模数转换器(ADC)2612测量,以允许微处理器向控制计算机报告该值以便在控制回路中使用,该控制回路在电池电压变化时维持恒定的输出功率。
在一些示例中,可使用比较器2606将检测电压与期望值进行比较,该检测电压等于平均输出功率。可使用带有适当时间常数的无源超前-滞后环路滤波器2608对数字输出进行滤波以维持控制回路的稳定性。可对环路滤波器2608的输出进行缓冲并将其用于驱动PIN二极管衰减器(诸如图14中的502)以调节整体增益以获得期望的输出功率。
定向耦合器2602还可使用对数功率检测器2610对自负载(在这种情况下是应用器)反射的功率进行采样。可使用低通滤波器确定平均水平,并且可使用ADC2612进行采样。控制计算机可比较正向功率和反射功率并调节应用器调谐单元2614以找到具有最低反射功率的设置或输送到患者的优化功率。可使用多种算法。例如,控制计算机可就值向上或向下依次调节三个元素中的每个,并且确定反射是否降低,迭代地重复此过程直到找到最小值。
如本文中描述的,患者预后或诊断可在测量的Hdp值和记录的Hdp值的帮助下进行。记录的Hdp值可在预先诊断为患有已识别的不良健康状况的或处于健康状况的多个患者中测量。如下文中更详细地描述的(图16-19),可在确定的时间并且就确定的时间段存储Hdp值。
在实施例中,系统包括用于测量和记录Hdp值的Hdp监视系统和配置为经由射频载波信号向患者提供一个或多个限定的频率的频率生成器。
在实施例中,系统可识别一个或多个AM EMF,其是RF载波信号的子组。一个或多个AM EMF可用于对温血哺乳动物对象中的细胞功能或功能障碍产生影响。温血哺乳动物对象暴露于一个或多个AM EMF可使代表性Hdp变化值以指示一个或多个RF载波信号是否对温血哺乳动物对象具有潜在生物影响的方式改变。代表性Hdp变化值中的改变的特异性可是用于温血哺乳动物对象的预后或诊断的替代标记。
在实施例中,系统可在由受保护的基于互联网的平台连接的服务器中存储一个或多个识别的调幅电磁频率组以形成调幅电磁频率(ILf)库。可对存储的数据进行组合、组织、比较和表征用于在患者健康状况的诊断或预后,或者患者的生存质量、生存或入院的预后中使用。
集成频率生成器可配置为发射或使温血哺乳动物对象暴露于一个或多个高度特异频率RF载波信号。此外,生成器可包括可编程生成器,其作为集成系统的部分可是电力可激活的。可编程生成器可用于对温血哺乳动物对象中的细胞功能或功能障碍产生影响。可编程生成器可包括一个或多个可控低能量电磁能量生成器电路,其配置为生成一个或多个RF载波信号。提供了包括一个或多个生成器电路或与一个或多个生成器电路通信的一个或多个微处理器或集成电路。在实施例中,一个或多个微处理器还可用于控制来自处理系统的控制信息的传输和接收。在实施例中,一个或多个生成器电路可包括一个或多个AM频率控制信号生成器,其配置为控制一个或多个RF载波信号的调幅变化。一个或多个生成器电路还可包括一个或多个可编程AM频率控制信号生成器,其配置为控制在该频率生成调幅的频率。
系统还可包括处理系统,其配置为集成并且同步Hdp监视系统和一个或多个可编程生成器。由Hdp监视系统测量和记录的、在温血哺乳动物对象暴露于由一个或多个可编程生成器发射的一个或多个RF载波信号时的多种Hdp值可由处理系统处理。从这样的处理所得的信息例如可存储在ILf中。处理系统还可控制、同步控制程序并将控制程序加载到具有AM EMF信号的特异系列的一个或多个可编程生成器中。由此,处理系统可集成和同步Hdp监视器、ILf和一个或多个可编程生成器以支持集成解决方案。
在实施例中,处理系统和ILf可是服务器的部分,该服务器通过受保护的网络平台连接到系统的其余部分。ILf可用于存储、组合、组织、比较、表征和处理AM EMF和记录的代表性Hdp变化值。ILf还可用于存储、组合、组织、比较、表征和处理生存质量、生存或入院值。ILf可存储和组织在温血哺乳动物对象或患者中识别的AM EMF系列和代表性Hdp变化值。ILf可存储和组织在温血哺乳动物对象或患者中识别的生存质量、生存或入院值系列。然后可将一个或多个AM EMF信号系列加载到一个或多个可编程生成器中。一个或多个可编程生成器可相对于一个或多个确定的或预先确定的参考AM频率以至少百万分之1000(ppm)的准确度准确地控制调幅的频率发射。在实施例中,AM EMF可在0.01Hz至150kHz的范围内。处理系统还可包括连接或耦合位置。连接或耦合位置可用于将处理系统连接或耦合到导电应用器,该应用器以准确控制的调制频率向温血哺乳动物对象应用一个或多个调幅低能量发射。
频率合成器可用于精确生成具体频率或频率系列。例如,用户可使用键盘或其他输入设备选择一个或多个频率,这继而可使电路在明确限定的时间间隔内打开或关闭生成的信号。
在实施例中,处理系统处理在暴露于由可编程生成器发射的一个或多个RF载波信号期间由连接到温血哺乳动物对象的Hdp监视系统测量和记录的Hdp值。Hdp监视系统可测量和记录Hdp值以供进一步处理。处理系统可结合一个或多个算法,该算法分析由Hdp监视系统获得的记录的Hdp值。处理系统使用对象的多种测量和记录的Hdp值并识别AM EMF,其特征在于Hdp变化值改变的可识别模式,本文中称为代表性Hdp变化值。处理系统通常使用放置为与身体的多种确定部分局部接触的电极以识别患者的多种测量和记录的Hdp值,该电极作为Hdp监视系统的部分。Hdp监视系统还包括记录部件,其记录患者的多种识别的测量Hdp值。在实施例中,记录部件可将测量的Hdp值存储在Hdp监视系统的存储设备中。在替代实施例中,记录部件可将测量的Hdp值存储在任何存储设备中,在该存储设备上可记录患者的多种识别的测量Hdp值以供立即和/或未来处理。例如,Hdp值可包括以下血液动力学参数中的一个或多个的值:RR间隔(例如在ECG上示出的从R峰到下一个R峰的间隔)(RRI)、心率(HR);收缩压(sBP)、舒张压(dBP)、中位血压(mBP)、脉压(PP)、每搏输出量(SV)、心搏出量(CO)和总外周阻力(TPR)。
在实施例中,处理系统可包括设备同步器、数据聚合器、存储设备和/或存储接口、和接口控制器。接口控制器可负责将Hdp值和暴露于一个或多个高度特异频率射频载波信号相匹配(同步)。额外地或替代地,接口控制器可负责以将Hdp值链接到暴露于一个或多个高度特异频率射频载波信号(这样的Hdp值测量自该暴露)的方式,合并待存储(存储)的记录(数据聚合)以供进一步处理(接口控制器)。Hdp监视系统和可编程生成器可经由接口控制器连接。对应于同步和数据聚合的模块以及存储接口可打包为便携集成硬件解决方案。
在另一实施例中,处理系统尤其可包括两个部件:统计挖掘部件和计算统计/演化博弈论部件。应当注意的是,如本文中使用的,计算统计是指多种类型的计算统计技术,包括例如深度机器学习。统计挖掘部件可包括一系列基于判别分析和支持向量机(SVM)的数学过程。Hdp值可是恒定选择的数值型变量以及其基于不同的完善的统计方法分析得出的依赖的新属性。使用多元判别分析和其他基于相关分量分析的坐标变换,Hdp值可表示为具有明确定义的阈值的代表性Hdp变化值的质心,以便优化共同度量(common metrics)。计算统计/演化博弈论部件可包括永久精化(permanently refined)聚类分析和更新数学算法,其执行或者通过新的判别属性执行截止型(cutoff)精化用于(1)识别就健康状况特异频率或就预后预测患者的生存质量、生存、或入院的反应模式,在此称为代表性Hdp变化值;以及(2)存储代表性Hdp变化值和对应的健康状况特异或生存质量、生存或入院频率。这些部件可经由加密通信在网络(诸如互联网)上连接到集成硬件解决方案的中央和安全服务器侧系统上实施。
在又另一实施例中,ILf可位于中央和安全服务器系统中。在实施例中,库可经由加密通信在网络(诸如因特网)上连接到集成硬件解决方案的所有实例。在这样的实施例中,网络解决方案可提供组合所有工作设备的实时、集成和演化的系统。从医生和患者报告结局(例如,生存质量、生存或入院)收集的永久更新的去身份患者人口统计学和临床信息数据与代表性Hdp变化值和对应AM EMF的记录组合,并且数据可存储在ILf中。代表性Hdp变化值的阈值可基于新添加的值精化。可对这样的数据进行结构化和处理以精化用于患者健康状况的诊断或预后的过程。ILf可具有计算能力以支持用于模式识别的计算统计和用于识别均衡点的演化博弈论,该均衡点表征就每个AM EMF系列和/或代表性Hdp变化值与对应于诊断和预后结局信息的最佳可能匹配。精化过程可实施为程序,该程序考虑了患者细分(segmentation)。可编程生成器通过处理系统中的接口控制器连接,以便在处理系统和可编程生成器之间输送数据。然后将精化的过程下载回集成硬件解决方案的处理系统模块,以便对可编程生成器重新编程。
接口控制器可将可编程频率生成器连接到处理系统以便允许数据输送。精化的程序可下载到处理系统,以便在治疗疗程之前或期间更新可编程频率生成器。
在实施例中,患者的健康状况的诊断或患者的生存质量、生存或入院的预后可基于由处理系统识别的一个AM EMF或AM EMF组和/或代表性Hdp变化值确定。在实施例中,多个测量和记录的Hdp值可在患者暴露于一个或多个RF载波信号期间提交到处理系统。处理系统可识别诊断有健康状况的患者中的AM EMF和/或代表性Hdp变化值。在实施例中,识别的AM EMF和代表性Hdp变化值可存储在ILf中。温血哺乳动物对象在暴露于选择的AM EMF组期间可具有多种Hdp值,该Hdp值由Hdp监视系统测量和记录,处理以识别对AM EMF暴露的特征性血液动力学反应模式。处理系统识别与选择的AM EMF组相关的代表性Hdp变化值。经处理的信息可存储在ILf中用于即时和/或未来的数据库比较。诊断识别可是搜索与患者的特定健康状况一致的反应模式的结果。预后识别可是搜索与患者的特定生存质量、生存或入院一致的反应模式的结果。处理系统可通过结合分析由Hdp监视系统获得的记录的Hdp数据的一系列数学算法来诊断患者的健康状况。处理系统可通过结合分析由Hdp监视系统获得的记录的Hdp数据的一系列数学算法来预断患者的生存质量、生存或入院。
在另一实施例中,用户可搜索一个或多个AM EMF。搜索过程可在患者暴露于一个或多个RF载波信号期间进行。例如,搜索一个或多个AM EMF可包括涉及在患者暴露于一个或多个RF载波信号期间Hdp监视系统审查存储在处理系统中的测量和记录的Hdp值的处理。一个或多个AM EMF的搜索过程可涉及应用数学算法以确定待由可编程生成器提供的特异频率系列。在实施例中,搜索处理可包括在暴露于AM EMF系列(诸如射频载波信号的子组)期间由Hdp监视系统处理测量和记录的Hdp值的处理,该AM EMF系列是由可编程生成器在具有未知健康状况的温血哺乳动物对象或具有已知健康状况的患者中产生的。关于对象或患者暴露于一个或多个RF载波信号的预先确定的序列,术语“准确控制”是指将调制的低能量电磁发射调制到较高频率(大于约1000Hz)至多约1Hz的分辨率内。例如,如果待应用到温血哺乳动物对象的确定的或预先确定的调制频率是约2000Hz,则这样的调制的低能量发射的准确控制要求生成的频率在约1999Hz和约2001Hz之间。处理系统在搜索过程期间识别AMEMF和代表性Hdp变化值。
在实施例中,可发现一个或多个新的AM EMF。发现过程可在个体或患者暴露于一个或多个高度特异频率RF载波信号期间进行。新AM EMF的发现可包括使处理系统在暴露于一个或多个RF载波信号期间从Hdp监视系统接收测量和记录的Hdp值。新AM EMF的发现可还涉及由可编程生成器应用数学算法以确定特异频率系列。在实施例中,搜索处理可在暴露于AM EMF系列期间处理来自Hdp监视系统的测量和记录的Hdp值,该AM EMF系列是由可编程生成器在具有已知健康状况的温血哺乳动物对象中产生的RF载波信号的子组。在实施例中,处理系统在发现新AM EMF的处理期间识别AM EMF和代表性Hdp变化值。
在实施例中,患者健康状况的诊断或患者的生存质量、生存或入院的预后可基于由处理系统识别的一个AM EMF或AM EMF组和/或代表性Hdp变化值确定。在实施例中,多个测量和记录的Hdp值可在患者暴露于一个或多个高度特异频率RF载波信号期间提交到处理系统。处理系统可识别诊断有健康状况的患者中的AM EMF和/或代表性Hdp变化值。处理系统可识别具有生存质量、生存结局或入院结局的患者中的AM EMF和/或代表性Hdp变化值。在实施例中,识别的AM EMF和代表性Hdp变化值可存储在ILf中。在暴露于选择的AM EMFS组期间,温血哺乳动物对象可具有多种Hdp值,该Hdp值由Hdp监视系统测量和记录,处理以识别对AM EMF暴露的特征性血液动力学反应模式。处理系统识别与选择的AM EMF组相关的代表性Hdp变化值。处理后的信息可存储在ILf中用于即时和/或未来的数据库比较。诊断识别可是搜索与患者的特定健康状况一致的反应模式的结果。预后识别可是搜索与患者的生存质量、生存结局或入院结局一致的反应模式的结果。处理系统可通过结合分析由Hdp监视系统获得的记录的Hdp数据的一系列数学算法,诊断患者的健康状况或预断患者的生存质量、生存或入院。
在另一实施例中,可使用户能够搜索AM EMF。搜索过程可在患者暴露于一个或多个RF载波信号期间进行。例如,搜索一个或多个AM EMF可包括涉及在患者暴露于一个或多个RF载波信号期间Hdp监视系统审查存储在处理系统中的测量和记录的Hdp值的处理。一个或多个AM EMF的搜索过程可涉及应用数学算法以确定待由可编程生成器提供的特异频率系列。在实施例中,搜索处理可包括在暴露于特异频率系列(诸如高度特异频率RF载波信号的子组)期间由Hdp监视系统处理测量和记录的Hdp值,该特异频率系列是由可编程生成器在具有未知健康状况的温血哺乳动物对象或具有已知健康状况的患者中产生的。
在又另一实施例中,系统可用于构建和更新ILf。用于以频率构建和更新ILf库的处理可使用处理系统以识别温血哺乳动物对象中的AM EMF和/或代表性Hdp变化值。处理系统可在由受保护的互联网平台连接的中央服务器中存储识别的AM EMF和代表性Hdp变化值。ILf可存储从具有已知健康状况的温血哺乳动物对象新识别的AM EMF。源自具有已知健康状况的温血哺乳动物对象的存储的AM EMF可经过处理,以允许未来患者的健康状况的诊断或患者的生存质量、生存或入院的预后。例如,在诊断有特定健康状况的患者中识别的一个或多个AM EMF可与其他温血哺乳动物对象一起用于诊断建议。作为额外的示例,在具有生存质量、生存或入院预后的患者中识别的一个或多个AM EMF可与其他温血哺乳动物对象一起用于预后建议。
上文提到的一个或多个RF载波信号可是由加载到可编程生成器中的控制程序产生的EMF输出信号,该可编程生成器能够以某些预先确定的AM频率生成EMF输出信号。最优选地,对象或患者在确定的时间段上的心搏时间期间暴露于EMF输出信号;最优选地,在患者的至少十次心搏时间或至少10秒的时间段的时间上。在一些实施例中,在患者的至少三次心搏时间或至少3秒的时间段的时间上,对象或患者暴露于EMF输出信号或将EMF输出信号应用到患者。该过程通常会在患者保持连接到或重新连接到同步的Hdp监视系统和系统的可编程生成器二者时发生,使得可在暴露期或应用期期间测量和记录Hdp值。然而,Hdp值也可或替代地是在执行软件处理之后识别AM EMF和/或代表性Hdp变化值的数据源。
对于在任何具体频率值处待使之发生变化的Hdp值,在较宽的频率范围内(例如,在从约0.01Hz至约150MHz之间的范围内的EMF频率),凭借可变频率可编程生成器设备,暴露或应用EMF频率输出信号的时间段可需要较短的时间段。因此,可需要连续暴露或应用EMF范围的区段,以便识别在基础、暴露和后暴露Hdp值变化发生时的EMF值。
系统还可包括输出信号频率测量和记录系统,其测量并记录表现出Hdp值的至少一些的Hdp变化值时的频率值,本文中其称为阈值。类似地,在患者暴露于输出信号或向患者应用输出信号的时间段之前、期间或之后,Hdp值记录器可就识别的Hdp值的每个测量并记录测量值的每个,这些值优选地彼此分开。
系统还可包括在执行或使患者暴露于细胞兴奋过程之前、期间或之后与Hdp值记录器集成或耦合到Hdp值记录器的处理系统部件。处理系统部件可包括程控计算器,其对多种记录的Hdp值进行一系列数学分析以获得代表性替代值,诸如AM EMF的识别和就不同的记录Hdp的每个的代表性Hdp变化值。在一些实施例中,处理系统部件可确定不同代表性Hdp值之间的比率,并将代表性Hdp值中的任一个或两个或在不同值之间的比率与预先确定的代表性值或比率(阈值)进行比较,该预先确定的代表性值或比率表征在使患者暴露于细胞兴奋过程时发生的AM EMF和/或代表性Hdp变化值的改变,其在已知健康或已知患有或可能发展出识别的不良健康状况的患者中预先确定。计算的代表性替代值的比较导致提供了患者健康状况的诊断或预后的指示,该代表性替代值,诸如记录的Hdp值或比率和在诊断具有相同健康状况的患者中识别的AM EMF和/或代表性Hdp变化值,与预先确定的代表性Hdp值或比率和/或识别的AM EMF和/或代表性Hdp变化值匹配。
处理系统组件可位于由受保护的网络平台连接的中央服务器处,其可基于接收到的或传送到中心的记录的Hdp信息执行分析。
图20描绘了根据实施例的用于集成医疗系统的说明性示意结构。如图20中示出的,用于诊断患者的健康状况或预后预测患者的生存质量、生存或入院的系统可包括Hdp监视系统和频率生成器。在实施例中,该系统还可包括处理系统。
Hdp监视系统为每个个体患者确定心血管功能储备。在实施例中,Hdp监视系统可接收来自患者的输入生理数据。输入生理数据可用于获得参数Z,该参数Z是或近似于患者的每搏输出量(SV)和患者的体循环血管阻力(SVR)的乘积。Hdp监视系统还可提供代表患者呼吸率(RR)的值。RR值可通过下述中的一个或多个确定:使用专用设备的测量,使用输入的生理数据执行的计算,或通过使用最佳估计(诸如基于患者的心率进估计)手动确定。本文中描述的系统可是具有患者侧部件和服务器侧部件的集成解决方案。患者侧部件可包括连接到可编程生成器的Hdp监视系统。Hdp监视系统和可编程生成器二者均可连接到处理系统,以使得能够同步设备并允许兼容的数据聚合。服务器侧部件可经由受保护的基于网络的平台与患者侧部件连接,并且可提供统计计算和数据存储。
在某些实施方式中,射频生成器可配置为在暴露期间测量和存储反射功率值,其与Hdp监视值同步用于进一步的计算和数据存储,如下文另外详细描述的。
系统的两个部件可实现如上文描述的实时双向数据输送。例如,一旦可编程生成器加载有选择的AM EMF系列的一个或多个控制程序,可编程生成器可从集成解决方案断开连接以允许门诊使用。可编程生成器可重新连接到集成解决方案,以允许批量上传更新数据并允许将自动治疗侧写(treatment profiling)输送回处理系统。
再次参考图20,Hdp监视器可提供用于为每个个体患者确定心血管功能储备的方法。该方法可包括a)接收来自患者的输入生理数据用于确定参数Z,该参数Z是或近似于患者的每搏输出量(SV)和体循环血管阻力(SVR)的乘积;b)提供代表患者的呼吸率(RR)的值,其中呼吸率(RR)值是通过使用专用设备、从输入生理数据计算或通过使用最佳估计手动提供的;c)执行心电图(ECG)和光电容积描记(PPG),其中ECG测量由心脏的电活动生成的生物电位并且PPG感测血流速率;以及d)基于连续心动周期中的振荡确定HRV。
该系统11包括导电应用器12、13,用于将一个或多个电磁发射应用到温血动物哺乳动物对象。存在多种不同形式的应用器,其可包括与接受治疗的对象形成紧密接触的导电探测器13。探测器13可通过同轴电缆12和阻抗匹配变压器14连接到电磁能量发射器(还参见图21)。
电子系统11可还包括连接器或耦合器,其用于连接到编程有控制信息的可编程设备或发射设备;该可编程设备诸如计算机或适合于接收应用存储设备52的接口或接收器16;该应用存储设备52诸如,例如,磁介质、半导体介质、光学介质或机械编码介质;该控制信息用于控制系统11的操作,以便将期望类型的低能量发射疗法应用到患者。
应用存储设备52可提供有微处理器,当应用到接口16时,该微处理器操作以使系统11应用期望的低能量发射疗法。应用存储设备52提供有微处理器,该微处理器与系统11内的微处理器21组合使用。在这样的情况下,应用存储设备52内的微处理器使得设备52能够与系统11和其他中央服务器通信。
系统11还可包括显示器17,其可显示系统操作的多种指示。此外,系统11可包括电源开关按钮18和19和/或用户界面21A(参考图21)。
图21描绘了根据实施例的Hdp监视系统的说明性框图。系统包括计算设备600。计算设备可包括多种附加部件,诸如基本配置601、总线/接口控制器640、存储设备650、输出设备660、外围设备670、通信接口680和/或其他计算设备690。一个或多个总线可配置为可操作地连接上述部件。例如,存储接口总线641可配置为可操作地连接存储设备650和总线/接口控制器640。此外,接口总线642可配置为将总线/接口控制器640与输出接口660、外围接口670和/或通信接口680可操作地连接。
基本配置601可包括处理器610、系统存储器620和配置为可操作地连接处理器和系统存储器的存储器总线630。在一些示例中,处理器610可包括一级缓存611、二级缓存612、处理器核心613、一个或多个寄存器614和存储器控制器615。在一些实现中,系统存储器620可包括多种软件或操作模块,诸如操作系统621、一个或多个应用622和程序数据624。
在一些示例中,存储设备650可包括可移动存储设备651,包括例如USB存储设备或其他类似的可移动介质。存储设备650还可包括不可移动存储设备652,诸如硬盘驱动器。在一些实施方式中,输出接口660可包括图形处理单元661、音频处理单元662、可操作地连接到图形处理单元和音频处理单元的一个或多个A/V端口663。在一些示例中,外部输出设备可可操作地连接到A/V端口663,该外部输出设备诸如监视器或其他类似显示器和/或扬声器或其他类似音频输出设备。
在一些示例中,外围接口670可包括串行接口控制器671、并行接口控制器672、以及可操作地连接到串行接口控制器671和并行接口控制器672的一个或多个I/O端口673。在一些示例中,外部设备(诸如打印设备)可经由一个或多个I/O端口673可操作地连接到计算设备600。
在一些实施方式中,通信接口680可包括配置为便于与其他通信设备690通信的网络控制器681。在一些示例中,网络控制器681可可操作地连接到一个或多个通信端口682,用于建立与其他通信设备690的通信。例如,可经由有线或无线数据通信链接建立通信。
在一些实施方式中,如图21中图示的系统可配置为在向患者应用电磁信号之前、期间和/或之后测量Hdp值。在实施例中,电路可提供有配置为与Hdp监视系统连接的连接器。替代地,电路可集成到Hdp监视系统中。包括了对框图的每个框或其功能的描述以有助于其理解。
Hdp监视系统的电子电路框图以预先确定的选择的调幅频率将AM EMF应用到患者。预先确定的选择的频率由存储在存储设备52和/或其他服务器中的AM频率值控制。指示应用到患者的多种预先确定的选择的AM频率,用于治疗患有不良健康状况的患者,已经诊断出该患者患有该不良健康状况。
在实施例中,集成或组合设备可允许在应用AM EMF或其他这样的信号之前、期间或之后感测患者的Hdp值和反射功率能量。在这方面特别令人感兴趣的是,测量和记录的Hdp和反射功率能量值可基于患者状况而不同。例如,测量和记录的Hdp和反射功率能量值可在因患有不同形式癌症的患者之间不同。此外,测量和记录的Hdp和反射功率能量值可在患有某种形式癌症的患者和健康患者之间不同。然而,对于患有相同或密切相关的不良健康状况的患者,这样的Hdp和反射功率能量值可是基本上相似的。测量和记录的代表性Hdp和反射功率能量变化值以及一个或多个AM EMF的识别相应地为多种形式的不良健康状况提供了诊断机会和/或提供了患者的生存质量、生存或入院的预后。此外,这样的Hdp变化值可允许健康患者状况的诊断或预后。
再次参考图20,微处理器21作为用于应用系统的控制器操作并且通过地址总线22、数据总线23和输入/输出(I/O)线25连接以控制系统的多种部件。微处理器21优选地包括用于操作代码、控制程序和临时数据的内部存储设备。此外,微处理器21包括输入/输出(I/O)端口和内部定时器。例如,微处理器21可是8位单片微控制器,诸如从Santa Clara,California的Intel Corporation可获得的8048或8051控制器。用于微处理器21的定时由系统时钟24提供,该系统时钟24包括时钟晶体26以及电容器27和28。系统时钟24可以适合于所使用的微处理器的具体类型的任何时钟频率运行。根据一个实施例,系统时钟24以8.0MHz的时钟频率操作。
通常,微处理器21的功能在于控制可控电磁能量生成器电路29以产生期望形式的调制低能量电磁发射,用于通过探测器13应用到患者。可控生成器电路29包括调制频率生成器电路31和载波信号振荡器32。微处理器21操作以通过振荡器禁用线33激活或取消激活可控生成器电路29。可控生成器电路29还包括AM调制器和功率生成器34,其操作以通过调制信号调制载波信号的振幅,该载波信号由载波振荡器32在载波信号线36上产生,该调制信号由调制频率生成器电路31在调制信号线37上产生。调制器34在调制载波信号线38上产生调幅载波信号,然后该调幅载波信号应用到滤波器电路39。滤波器电路39经由同轴电缆12和阻抗变换器14连接到探测器13。
微处理器21通过地址总线22、数据总线23和I/O线25控制可控生成器电路29的调制频率生成器电路31。具体地,微处理器21经由I/O线25选择存储在调制波形存储设备43中的期望波形。微处理器21还控制波形地址生成器41以在波形地址总线42上产生地址的序列,该地址应用到调制信号存储设备43以便检索所选择的调制信号。从波形查找表43中检索期望的调制信号并且其以数字形式应用到调制信号总线44。调制信号总线44应用到数模转换器(DAC)46,其将数字调制信号转换成模拟形式。然后该模拟调制信号应用到选择滤波器47,其在微处理器21的控制下通过使用包括电阻器48和电容器49和51的可变滤波器网络对模拟调制信号进行滤波,以便平滑由DAC46在调制信号线20上产生的波形。
在本实施例中,多种调制信号波形存储在查找表43中。在实施例中,查找表43可包含多达8种不同的调制信号波形,尽管在本公开的范围内可存储更多或更少的调制信号波形。已经成功采用的波形可包括方波波形或正弦波波形。其他可能的调制信号波形包括整流波形、正弦波形、三角波形以及所有上述波形的组合。
在实施例中,每个调制信号波形使用存储器的256字节并且通过检查256个连续地址从查找表43检索。注意的是,在本公开的范围内,每个波形可使用存储器的更多或更少字节,这对于相关领域的普通技术人员来说将是显而易见的。调制信号的频率由从查找表43检索波形的速度控制。在实施例中,这是通过将控制代码从微处理器21下载到包含在波形地址生成器41内的可编程计数器中实现的。可编程计数器的输出然后驱动异步计数器,该异步计数器在波形地址总线42上生成地址序列。
波形地址生成器41可是可编程的,例如从NEC可获得的定时器/计数器uPD65042C。例如,调制信号存储设备或查找表43可是编程有期望波形表的28C16电可擦除可编程只读存储器(EEPROM)。例如,数模转换器46可是DAC端口,诸如从AnalogDevices可获得的AD557JN;并且例如,选择性滤波器47可是从NationalSemiconductor或HarrisSemiconductor可获得的4052型多路复用器。在本公开的范围内可使用额外的或替代的部件。
微处理器21使用以控制可控生成器电路29的操作的调制控制信息可存储在应用存储设备52中或可变AM频率调谐设备中,该可变AM频率调谐设备适于将在高频率水平和低频率水平之间的AM频率加载到接口16。应用存储设备52可是能够存储信息以供以后检索的任何存储设备。应用存储设备52可由接口16连接到处理系统。
应强调的是,虽然附图将微处理器21图示为与应用存储设备52分离,微处理器和应用存储设备,其中从处理系统加载的控制程序存储到可编程生成器中。控制程序一旦加载到系统中则如本文中描述地控制系统的操作。在这种情况下,接口16将存在于微处理器21和应用存储设备52的组合和系统的其余部分之间。
接口16配置为适合在使用中的具体应用存储设备52。接口16将存储在应用存储设备52中的控制信息转换为可用于存储在微处理器21的存储器内的可用形式,以使得微处理器能够控制可控生成器电路29以产生期望的调制低能量发射。接口16可直接读取存储在应用存储设备52上的信息,或者其可通过与处理系统的通信链接读取信息。当应用存储设备52和微处理器21合并在相同设备中时,接口16配置为将微处理器连接到系统的其余部分。
存储在应用存储设备52中的控制信息为通过探测器13应用到患者的调制低能量RF电磁发射指定多种可控参数。这样的可控参数包括,例如,载波的振幅和频率、载波的调制的振幅和频率、发射的持续时间、发射的功率水平、发射的占空比(即,在应用期间所应用的脉冲发射的开启时间与关闭时间的比率)、就具体应用的不同调制频率的应用序列、以及就具体患者开具的治疗总数和每个治疗的持续时间。
例如,可选择载波信号和调制信号以便以调幅信号驱动探测器13,其中载波信号包括低于1GHz的谱频率分量,优选地在1MHz和900MHz之间;并且其中调制信号包括在约0.1Hz和约10MHz之间、在约1Hz和约150KHz之间、在约0.01Hz和约1,000Hz之间、或在约0.01Hz和约2,000Hz之间的谱频率分量。在实施例中,可将一个或多个调制频率排序以形成调制信号。
作为额外的特征,可提供电磁发射传感器53以检测在载波振荡器32的频率处的电磁发射的存在。发射传感器53可向微处理器21提供在期望频率处的电磁发射是否存在的指示。作为响应,微处理器21可执行动作,诸如在信息输出显示器17上显示错误消息、禁用可控生成器电路29等等。
系统还可包括功率传感器54,其检测与从患者返回或反射的功率量相比的通过探测器13应用到患者的功率量。该正向/反射功率比可指示在治疗疗程期间系统的正确使用。功率传感器54通过功率感测线56向微处理器21应用通过探测器13应用到患者的功率量相对于从患者反射的功率量的指示。
在功率感测线56上提供的指示可由微处理器21数字化和使用,例如,以检测和控制应用的功率的水平,和/或记录与在应用存储设备52上应用的实际治疗相关的信息。输送到处理系统的数据可包括,例如:就定时间段的应用数、每次治疗的实际时间和日期、尝试应用数、应用顺应性(application compliance,即在应用疗程期间探测器13是否就位)、以及具体调制频率的累积剂量。
优选地控制应用的功率水平以使得患者吸收的能量的比吸收率(SAR)为从1μW/kg组织至50W/kg组织。优选地,功率水平控制为以产生从100μW/kg组织到10W/kg组织的SAR。最优选地,功率水平控制为递送在仅0.2至1mW/kg范围内的全身平均SAR,其中1g峰值空间SAR在150至350mW/kg之间。这些SAR可在患者的任何组织中。系统还包括供电电路,其包括电池和充电器电路57和电池电压变化检测器58。
在本文中描述的系统和技术的某些应用中,特异频率信号或频率集的应用可有益于为患者提供预后和预测益处并且为患者提供治疗。例如,当治疗具体类型的癌症(诸如HCC)时,应用在从约0.01Hz至约20KHz的范围内、或在从约0.01Hz至约2KHz的范围内每3Hz或10Hz发生的AM EMP系列,其本质上可是治疗性的并且提供预后和预测信息(例如,通过测量患者对频率应用的HRV反应)。可测量额外的信息,诸如患者吸收的能量的量、患者反射的能量的量等等。
如上所述,为了管理到患者的选择的频率,可使用载波信号。例如,振荡器302可配置为产生具有特异频率(诸如27.12MHz)的载波信号。然而,通过调制载波波的振幅,例如,调制信号可以在从约0.01Hz至约20KHz的范围内、在从约10Hz至约1,000Hz的范围内、或者在从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列产生。在一些实施例中,调制信号可以在从约0.01Hz至约20KHz的范围内每1Hz发生的电磁频率系列产生。在一些实施例中,调制信号可以在从约10Hz至约1000Hz的范围内或者在从约10Hz至约2000Hz的范围内每3Hz发生的电磁频率系列产生。在一些实施例中,调制信号可以在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列产生。在一些实施例中,调制信号可以在从约10Hz至约1000Hz的范围内或者在从约10Hz至约2000Hz的范围内每10Hz发生的电磁频率系列产生。在一些实施例中,调制信号可以如以下表1中说明的电磁频率系列产生。
表1(单位:Hz)
在某些实施方式中,信号(诸如图19中示出的信号)可是通过调制载波信号的振幅产生的AM EMF信号的代表。如图19中示出的,通过调制信号的振幅,可实现变化的调制深度,从而产生具有特异调制频率的调制信号。然而,如图19中还示出的,在调幅期间,载波信号的频率保持不变,例如在本示例中为27.12MHz。
对于HRV的精确测量,为了识别人体中的生物替代物,高度精确且集成的系统可能够在非常短的时间间隔中识别时域非线性系统中的信号。例如,Hdp监视系统(诸如图16B中的系统900)可同步监视设备902、RF生成器904、数据库908和计算设备91,该数据库908配置为存储动态数据的库用于为了以精确、可靠和可再现的方式的血流动力学记录和数据处理,该计算设备9100配置为存储和执行统计计算算法和处理技术
在某些实施方式中,程序协调器906可配置为控制监视器902和频率生成器904,并且就每个新的频率调制暴露向监视器发送干预信号用于后验数据同步。数据过滤、数据同步、用于计算时域参数的数据处理和数据转换都可遵循严格的计算处理并且使用如下文描述的技术和处理自动进行。
如本文中描述的,为了收集数据以训练和改进统计算法910,可收集初始患者数据以训练初始计算统计算法(下文在图22的讨论中更详细地解释)。例如,图17图示了两个数据流,其可代表就患者集的数据收集。初始流1005包括就患者集收集常规治疗信息。这些患者可诊断为健康的或患有一个或多个疾病或病症(诸如HCC)。可监视患者的血液动力学参数并将其收集到初始数据集1007中。
类似地,第二数据流1010还可包括就使用电磁暴露的患者收集数据。例如,可确定特异频率集(或者可使用标准频率集)。RF生成器可产生这些频率并使患者集暴露于这些频率下。血液动力学监视器可测量患者对暴露的血液动力学反应,并将该数据收集和记录为数据集1012。
在某些实施方式中,如图17中描述的处理和技术可用于调谐治疗以适应特定患者。例如,如图18中示出的,可基于就其他患者收集的记录、就患者1105的初始测试结果和统计技术为患者1105自动确定或计算特定化的或调谐的治疗。例如,如图18中示出的,可如上文在图17的讨论中描述的那样收集患者记录。然后可分析和进一步处理患者记录以将记录转换成配置为输入到一个或多个计算统计算法中的数据格式。然后。计算统计算法的输出可进一步分析并与特定患者1105的信息(例如,人口统计学信息、先前测试结果、初始能量暴露信息)进行比较以确定患者的生存质量、生存或入院的诊断或预后。在某些实施方式中,诊断或预后方案可包括用于在如本文中描述的患者1105暴露于电磁能量期间使用的频率或能量水平的自动调谐集1110。
如图23A-D中示出的,可实施多种时间线用于使患者暴露于调制频率信号集。如图23A-D中示出的,患者可放松处于仰卧位。可包括约十分钟的非暴露的初始期,以允许患者放松并就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波信号(即,在没有调幅的恒定振幅下)达约十分钟的时期。在初始暴露期之后,患者可暴露于调制频率达约120分钟、约60分钟、约35分钟、或约10分钟。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz的范围内、在从约10Hz至约1,000Hz的范围内、或者在从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每3Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每4Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每5Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每6Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每7Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每8Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每9Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可约每10Hz发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每4Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每5Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每6Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每7Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每8Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每9Hz至约每10Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每9Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每8Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每7Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每6Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每5Hz的范围内发生。在一些实施例中,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz范围内的电磁频率系列可在约从每3Hz至约每4Hz的范围内发生。在一些实施例中,具体时间段为每频率约2或约3秒。在一些实施例中,具体时间段为每频率约2秒。在一些实施例中,具体时间段为每频率约3秒。在一些实施例中,具体时间段为每频率约4秒。在一些实施例中,具体时间段为每频率约5秒。在一些实施例中,具体时间段为每频率约6秒。在一些实施例中,具体时间段为每频率约7秒。在一些实施例中,具体时间段为每频率约8秒。在一些实施例中,具体时间段为每频率约9秒。在一些实施例中,具体时间段为每频率约10秒。
在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在一些实施例中,暴露期可为约35分钟(图23A-D)。在另外的实施例中,暴露期可为约10分钟(图23C和23D)。在一些实施例中,暴露时间可为约120分钟或约60分钟。在初始暴露期之后,系统可使患者暴露于另一载波信号期达约10分钟,在此期间患者的身体可从约120分钟、约60分钟、约35分钟或约10分钟的初始暴露期恢复(图23A-C)。在约十分钟的第二载波信号期结束时,患者可再次暴露于约120分钟、约60分钟、约35分钟或约10分钟的第二调制频率信号期(图23A-C)。如之前那样,在这段时间期间,频率集中的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,从约2秒至约3秒每频率,或约10秒每频率)。系统可重复循环通过频率中的每个达暴露期,其中暴露期可是约120分钟、约60分钟、约35分钟或约10分钟。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。在该第二暴露期之后,患者可再次暴露于载波频率下达约十分钟,在此之后治疗疗程结束。
上文描述的治疗时间线可包括暴露疗程。如图23A和23C中示出的,可在第二天对患者重复暴露疗程。暴露疗程可发生达连续或不连续的一天或多天。在一些实施例中,暴露疗程发生达一天。在一些实施例中,暴露疗程发生达连续的两天。在一些实施例中,暴露疗程发生达不连续的两天或更多天。在一些实施例中,暴露疗程的发生为每周一次、每周两次、每周三次、或其组合。在一些实施例中,暴露疗程的发生为每月1次、每月2次、每月3次、每月4次、每月5次、每月6次、每月7次、每月8次、每月9次、每月10次、每月11次、每月12次、每月13次、每月14次、每月15次、每月16次、每月17次、每月18次、每月19次、每月20次、每月21次、每月22次、每月23次、每月24次、每月25次、每月26次、每月27次、每月28次、每月29次、每月30次,或其组合。
在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月治疗疗程达总共约1年、约2年、约3年、约4年、约5年、约6年、约7年、约8年、约9年、约10年、约11年、约12年、约13年、约14年、约15年、约16年、约17年、约18年、约19年、约20年、约21年、约22年、约23年、约24年、约25年、约26年、约27年、约28年、约29年、约30年、约31年、约32年、约33年、约34年、约35年、约36年、约37年、约38年、约39年、约40年、约41年、约42年、约43年、约44年、约45年、约46年、约47年、约48年、约49年、约50年,或其组合。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约1年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约2年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约3年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约4年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约5年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约6年。在一些实施例中,治疗疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约7年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约8年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约9年。在一些实施例中,暴露疗程发生达连续或不连续的任何数量的天数,或任何数量的每月暴露疗程达总共约10年。
应注意的是,如图23A-E中示出的暴露时间表仅是以示例的方式提供的。在某些实施方式或患者特异的治疗时间线中,如图23A-E中示出的多种特定情况可改变或以其他方式发生变化。例如,调制频率暴露期的数量可改变为少于或多于两个。此外,载波频率暴露期的数量可改变为少于或多于两个。类似地,载波频率和/或调制频率暴露期的长度可改变。此外,调制频率可重复循环通过频率中的每个达一个或多个暴露期。
在一些实施例中,患者可放松处于仰卧位。可包括约十分钟的非暴露时间的初始期,以允许患者放松并就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波信号(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于调制频率暴露期达约35分钟。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,10秒每频率或3秒每频率)。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在初始暴露期之后,系统可使患者暴露于约10分钟的另一载波信号期,在此期间患者的身体可从初始暴露期恢复。在约十分钟的第二载波信号期结束时,患者可暴露于约10分钟的调制频率信号期。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,2或3秒每频率或10秒每频率)。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在该第二调制频率暴露期之后,患者可再次暴露于载波频率达约十分钟,在此之后暴露疗程结束。可在第二天对患者重复相同的暴露疗程。暴露疗程可发生达连续或不连续的一天或多天。在一些实施例中,暴露疗程发生达一天。在一些实施例中,暴露疗程发生达连续的两天。在一些实施例中,暴露疗程发生达不连续的两天。
在一些实施例中,患者可放松处于仰卧位。可包括约十分钟的初始非暴露期,以允许患者放松并就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波信号(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于约50分钟、约60分钟或者约120分钟的调制频率暴露期。在此期间,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、从约100Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列可应用到患者达约3秒每频率。系统可重复循环通过频率中的每个达暴露期。在该初始暴露期之后,系统可使患者暴露于另一载波信号期达约10分钟,在此期间患者的身体可从初始暴露期恢复,在此之后暴露疗程结束。可在第二天对患者重复相同的暴露疗程。暴露疗程可发生达连续或不连续的一天或多天。在一些实施例中,暴露疗程发生达一天。在一些实施例中,暴露疗程发生达连续的两天。在一些实施例中,暴露疗程发生达不连续的两天。
在一些实施例中,患者可放松处于仰卧位。可包括约十分钟的初始非暴露期,以允许患者放松并就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波信号(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于调制频率暴露期达约50分钟、约60分钟或者约120分钟。在此期间,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、从约100Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列可应用到患者达约3秒每频率。系统可重复循环通过频率中的每个达暴露期。在该初始暴露期之后,系统可使患者暴露于另一载波信号期达约10分钟,在此期间患者的身体可从初始暴露期恢复。在一些实施例中,系统可确定患者是否要暴露于调制频率信号达额外的时间段。如果患者将暴露达另一时间段,系统可使患者暴露于另一调制频率暴露期。在一些实施例中,额外的调制频率暴露包括使初始调制频率暴露期中的血液动力学参数(例如心率变异性)发生变化的调制频率。在一些实施例中,额外的调制频率暴露包括在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或从约10Hz至约2,000Hz的范围内每3Hz或10Hz发生的电磁频率系列。在初始或额外的调制频率暴露之后,系统可使患者暴露于另一载波波暴露期达约十分钟。如果患者不将暴露于另一调制频率期,处理可结束。可在第二天对患者重复相同的暴露疗程。暴露疗程可发生达连续或不连续的一天或多天。在一些实施例中,暴露疗程发生达一天。在一些实施例中,暴露疗程发生达连续的两天。在一些实施例中,暴露疗程发生达不连续的两天或更多天。
如图23D中图示的,在一些实施例中,患者可放松处于仰卧位。可包括约十分钟的初始非暴露阶段,以允许患者放松并就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波信号(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于调制频率暴露期达约35或约10分钟。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,约10秒每频率或约3秒每频率)。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在约35或约10分钟的初始暴露期之后,系统可使患者患者暴露于另一暴露期,该另一暴露期包括使血液动力学参数(例如,心率变异性)发生变化的初始调制频率。在一些实施例中,在约35或约10分钟的初始暴露期之后,系统可使患者患者暴露于另一暴露期,该另一暴露期包括不使血液动力学参数(例如,心率变异性)发生变化的初始调制频率。在一些实施例中,在约35或约10分钟的初始暴露期之后,系统可使患者患者暴露于另一暴露期,该另一暴露期包括如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。在该第二调制频率暴露期之后,患者可再次暴露于载波频率达约十分钟,在此之后暴露疗程结束。可在第二天对患者重复相同的暴露疗程。暴露疗程可发生达连续或不连续的一天或多天。在一些实施例中,暴露疗程发生达一天。在一些实施例中,暴露疗程发生达连续的两天或更多天。在一些实施例中,暴露疗程发生达不连续的两天或更多天。
如上所述,对于特定患者,治疗可定制或自动调谐,使得正向能量(例如,在载波和调制频率信号中使用的能量)特别选择为用于具体患者。可基于多种因素,诸如患者信息(例如,健康状况、体型和体重、先前治疗信息)为具体患者确定该自动调谐,以便在治疗期间应用到患者的正向能量,以及在治疗期间由患者的细胞吸收的能量处于就类似其他患者的正常或平均能量的特异范围或阈值内。如图23B中示出的,该自动调谐可在初始载波频率期之前执行。
此外,如图23B中示出的,在调制频率暴露期期间,也可测量反射能量。反射能量提供了多少正向能量未被吸收或传输通过患者的指示。由于传输能量对患者来说通常是恒定的,在治疗期间可认为传输能量对患者来说是可忽略的。因此,通过测量反射能量,系统可估计患者在暴露期间吸收的能量的量。
此外,通过测量反射能量,系统还可确定用于在具体疾病或病症的评估、诊断或预后中使用的替代数据点。例如,在如本文中描述的处理和技术的发展期间进行的相关研究中,观察到图24中的数据。如图24中示出的,通过测量和绘制就患者人群的正向能量相对于反射能量,可看到多种能量水平带。此外,对于肝细胞病患者,反射能量落入的带通常低于健康患者的反射能量带。当确定患者是否将(或可能)诊断为HCC时,这样发生的情况可用作另一因素。此外,由于HCC患者的反射能量水平较低,这可指示HCC患者在细胞水平上比健康患者吸收更多的能量,因此可能就如本文中描述的调制频率暴露导致癌细胞中的细胞功能障碍的原因提供了至少部分解释。
如上所述,图23A-23E图示了用于患者治疗的多种治疗时间线。这些时间线也总结在如图25中示出的处理流中。如图25中示出的,系统(例如,如图16B中示出的协调器906)可初始自动调谐6405用于特定患者的正向能量。在自动调谐之后,系统可使患者暴露6410于初始约10分钟的载波波信号。在初始暴露之后,如本文中描述的,系统可使患者暴露6415于初始调制频率信号达约120分钟、约60分钟、约35分钟或约10分钟。在初始调制频率暴露之后,系统可使患者暴露6420于另一载波波暴露期达约十分钟。系统然后可确定6425患者是否将暴露于调制频率信号达额外的时间段。如果患者将暴露达另一时间段,处理可返回到步骤6415,其中系统使患者暴露于另一调制频率暴露期达约120分钟、约60分钟、约35分钟或约10分钟。如果患者不将暴露于另一调制频率期,则处理结束。
在一些实施例中,系统可初始自动调谐6405用于特定患者的正向能量。在自动调谐之后,系统可使患者暴露6410于初始载波波信号达约十分钟。在初始约十分钟的暴露之后,如本文中描述的,系统可使患者暴露6415于初始调制频率信号达约120分钟、约60分钟、约35分钟或约10分钟。系统可然后可确定6425患者是否将暴露于调制频率信号达额外的时间段。如果患者将暴露达另一时间段,处理可返回到步骤6415,其中系统使患者暴露于另一调制频率暴露期达约120分钟、约60分钟、约35分钟或约10分钟。在一些实施例中,在初始调制频率暴露之后,系统可使患者暴露6415另一调制频率暴露。在一些实施例中,额外的调制频率暴露包括使血液动力学参数(例如,心率变异性)发生变化的调制频率。在一些实施例中,额外的调制频率暴露包括不使血液动力学参数(例如,心率变异性)发生变化的调制频率。在一些实施例中,额外的调制频率暴露包括在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。在初始或额外的调制频率暴露之后,系统可使患者暴露6420于另一载波波暴露期达约十分钟。如果患者不将暴露于另一调制频率期,则处理结束。
如上所述,暴露期的定时和次序如图25中示出的,该图25仅以示例的方式提供。此外,在某些实施方式中,是否执行另一暴露期的确定可由另一决策者(诸如患者的医生)确定。
本文中描述的统计算法可包括机器学习或其他类似的基于统计的建模技术。例如,所使用的具体算法可能取决于使用该算法的预期结局。例如,处理设备可配置为使用第一处理或算法以基于第一结局数据集计算对如上文描述的导出权重的精化,并且使用第二或不同的处理/算法以基于第二结局数据集计算对如上文描述的导出权重的精化。可使用不同的方法和算法一致地或基本上同时地计算精化的权重。然后可比较/进一步分析每个不同方法和算法的输出以确定哪个输出的评价最高,或者可将每个方法和算法的输出组合成组合度量。
在一些实施方式中,可基于大量人群训练如下文进一步详细描述的计算统计模型,例如,人群范围可从数千到数万的患者记录,该记录包括电生理学、人口统计学、病史信息、患者的生存质量、生存和/或入院。计算统计工具可包括但不限于惩罚回归/分类技术,诸如随机森林和梯度提升(例如,使用R或任何其他统计/数学编程语言实现)、贝叶斯信念网络、协同过滤、支持向量机和其他类似技术。可使用任何其他基于分类的计算统计工具,包括神经网络(如下文更详细描述)和支持向量机。因为计算统计工具可能是计算密集型的,计算统计工具中的一些或全部处理可在与监视系统分开的服务器上执行。
随机森林工具可如何应用于给定数据集的概述可说明分类工具可如何在解释给定输入数据方面工作。随机森林是决策树的集合。决策树是流程图状结构,其中每个节点代表在度量上的测试并且每个分支代表潜在测试结局。树以分类标签告终,该分类标签例如在计算每个度量之后最终所获取的决策。随机森林工具中的每个树在对给定度量集进行分类时获得“选票”。构建随机森林中涉及随机性的两个分量。首先,在每个树的创建时,选择总数据集的随机子样本以使树生长。其次,在树的每个节点处,选择“分裂变量(splittervariable)”并且将潜在患者分为两类。例如,可将一类中的患者(例如,对特异药物阳性反应)与另一类患者(例如,对特异药物阴性反应)分开。树通过额外的分裂变量生长,直到树的所有末梢节点(叶)纯粹是一个类或另一类。针对先前已经预留的患者记录“测试”树。每个患者测试记录根据记录中包括的就每个分裂变量的度量而从一个分支或另一分支往下,由此遍历树。基于记录在树中的着陆(land)位置向患者测试记录指派预测结局(选票)。可通过基础数据集的新随机分割重复整个处理,以产生额外的树并且最终产生“森林”。在每个情况下,可使用患者的不同子集构建树并测试其表现。
在发展以下示例实施方式中描述的结果时,训练预先确定数量的模型变型。例如,顺序标记每个模型变型(例如,针对100次运行,标记为从1-100)。在模型的每个运行中,软件将人群的预先确定的部分(例如,80%部分)随机采样为训练集并且预留其余部分(例如,20%)作为验证集。
如上所述,计算统计工具可在基础数据集的第一部分上训练模型,并且在该数据集的第二部分上或在另一分开的数据集上验证模型。在评价每个模型的表现时,可基于特异性和敏感性参数评估随机森林中的决策树内的基础决策的表现。例如,敏感性参数可基于对模型的正确预测患者是否具有对药物治疗呈阴性反应的风险的能力的测量。例如,敏感性参数可基于模型正确预测将对治疗呈阴性反应的患者的比例。特异性参数可基于待以特定药物治疗的患者以及由相关模型预测为对药物治疗呈阳性反应的患者的比例。有利的可是在高水平优化地平衡个体表现变量(诸如敏感性和特异性)。例如,通过将特异性设置为相对高的值(例如,95%),可调节分类器模型内的基础阈值以最小化假阳性。在定义了特异性之后,可将敏感性的测量视为表现测量的类型,例如就给定模型通常在15-35%的范围内;然而,敏感性的更小或更大的值也是可能的。
例如,如下文描述的,可采用验证规程验证训练模型的预测表现。在实施方式中,可使用验证阶段以判明用于分类未来患者的适当阈值评分(其中结局当前未知并且期望的是预测该结局),并且以确定由计算统计工具生成的每个分类器模型的预测表现。为了验证多种模型和相关联的阈值评分,可使用第二组个体,例如验证人群(或群组)。例如,所使用的验证人群可是新的验证人群。就验证群组中的患者结局最终作为这些患者通过治疗的进展学习。在实施例中,验证人群中的患者可不同于上文描述的用于训练模型的训练和测试患者的组。例如,患者的验证人群及其关联度量(验证度量)可独立于患者的训练人群和关联度量(训练度量)。在一些实施方式中,在验证度量和训练度量之间可存在重叠。
在一些实施方式中,可通过以下中的至少一项更新验证人群:1)调节验证度量中的一个或多个度量;以及2)基于将额外的一个或多个对象追加到构成验证人群的对象的人群而扩展验证度量。可基于更新的验证度量精化用于未来患者分类的阈值。例如,可使用当前正在接受治疗或监视的患者的度量或者以其他方式通过治疗而没有进展的患者的度量,以调节验证度量中的一个或多个度量。替代地或额外地,可将患者的度量作为来自新对象的度量添加到验证人群。可作为就患者的新度量调节的验证度量是在患者的监视或治疗期间确定的。在一些示例中,随着所监视的患者通过治疗而进展,可将患者的度量添加到验证人群和/或在患者通过治疗而进展之后可使用患者的度量调节验证度量中的度量。
在一些实施方式中,可通过以下中的至少一项更新训练人群:1)调节训练度量中的一个或多个度量;以及2)基于将额外的一个或多个对象追加到第一多个对象而扩展训练度量。可基于更新的训练度量重新训练分类器模型。例如,随着自当前患者确定额外的患者度量和/或从新患者确定度量,例如可在数量增加的度量上或在新的不同度量上重新训练模型,以提供更新的分类器模型。随着就当前患者确定新度量和/或就新患者确定度量时,或在患者已经通过治疗而进展之后,可更新训练人群。
图22图示了用于训练和验证的一个或多个分类器模型的样本流程,其用于如上文描述的计算的统计算法。可提供已知输入数据6502、6504、6506的集或人群作为用于训练和验证分类器模型的数据集。例如,已知患者记录数据集可包括1000名已诊断为患有特定疾病(诸如HCC)的患者、其药物治疗方案、以及每个患者相关联的结局。已知患者数据记录的一定百分比可用作为输入数据6502、6504、6506。例如,80%的或800个患者记录可用作为输入6502、6504、6506。
可将输入数据6502、6504、6506馈送到数据聚合器6508中。数据聚合器6508可配置为将患者数据匹配到用于计算统计算法的单个训练输入中,并且将训练输入配置为计算统计算法可读的格式。数据聚合器6508可将训练数据馈送到算法6510中。算法6510可包括一个或多个未经训练的数据结构,诸如数据树系列(例如,使用如上文描述的随机森林工具组织的)。使用训练输入变量和来自输入数据6502、6504、6506的已知结局,算法6510可迭代地处理训练集中的每个数据点,从而训练数据结构以更准确地产生预期(和已知)结局。
一旦算法6510已经耗尽输入数据6502、6504、6506,算法可生成一个或多个输出6512。输出6510可与预期输出(如从初始人群已知的)进行比较,以确定现在训练的算法6510的特异性和敏感性。在某些实施方式中,可使用验证数据6514以使用额外的患者记录进一步精化经训练的算法6510。例如,可将验证数据6514输入到验证模块中用于验证一个或多个经训练的算法6510。继续以上示例,验证数据6514可包括200个患者记录。通常,在训练数据集和验证数据集之间没有重叠,因为将相同的数据两次运行不具优点。
随着将经验证的分类器模型用于分类新患者(例如,如本文中描述,以就患者度量集产生新的输出),所产生的结局可用于更好地验证使用闭环反馈系统的处理。例如,随着对患者进行分类和治疗,治疗结果可包括在患者记录中,并且例如由患者的医生进行验证。现更新为包括已知结局的患者记录然后可作为反馈提供到验证模块。验证模块可处理反馈,将生成的输出与就患者的已知结局进行比较。基于这种比较,验证模块可进一步精化经验证的算法,从而提供其中模型规律地更新和升级的闭环系统。
一旦经过训练,算法6510可如本文中描述地实施。使用经训练的算法,系统(诸如系统900)可监视患者对应用的电磁能量的反应(例如,通过在暴露期间测量患者的HRV)以便既对患者是否患有例如HCC又就患者治疗的预后如何、或就患者的生存质量、生存或入院的预后如何进行诊断。如上所述,暴露于电磁能量的额外益处可在于在诊断和长期预后预测期间同时治疗癌症。
在某些示例中,可观察到患者对所应用能量的反应的即时改变。例如,如图26中示出的,左图指示在第一约35分钟的治疗疗程期间患者对多种应用频率的反应(例如,如上文结合图23A-D描述的)。图26的右图图示了在约十分钟的休息期之后患者对相同频率集的反应。在一些实施例中,发生患者对相同频率集的反应而没有约十分钟的休息期(如图23D中描述的)。如图26中示出的,虽然若干频率在患者中引起类似的反应,现在存在在患者中引起反应的新频率(例如,患者的HRV中的明显改变)和在休息期后患者对其无反应的若干先前识别的频率。这样的结果可指示由初始约35分钟的暴露期引起的患者中的即时细胞改变。
如图27A中图示的,在一些实施例中,患者可放松处于仰卧位置。可包括约十分钟的初始非暴露时间段(即,休息),以允许患者放松并且就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波频率(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于调制频率暴露期达约120分钟、约60分钟、约35分钟、或约10分钟。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,10秒每频率或3秒每频率)。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在初始调制频率暴露期之后,系统可确定使血液动力学参数(例如,心率变异性)发生变化的频率集,即“有效频率(activefrequencies)”。在一些实施例中,系统可确定新频率集,其使在第一暴露期期间的血液动力学参数发生或不发生变化。在一些实施例中,新频率集在使血液动力学参数(例如,心率变异性)发生或不发生变化的第一频率集的从约0Hz至约10Hz范围内,优选从约0Hz至约7Hz,如图27B中描述的在具有高肿瘤负荷和低肿瘤负荷的患者中那样。在一些实施例中,该新频率集可与如本文中描述的在从约0.01Hz至约20KHz的范围内、在从约10Hz至约1,000Hz的范围内、或者在从约10Hz至约2,000Hz的范围内每3Hz或10Hz发生的电磁频率系列组合,以提供患者特异的暴露规程。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,向患者施用患者特异暴露规程。在一些实施例中,在约十分钟的休息时间之前或之后施用患者特异暴露规程。在一些实施例中,患者特异暴露规程不包括不在血液动力学参数中产生变化(例如,心率变异性)的频率。
在一些实施例中,如图28中图示的,新的有效频率是由有效频率的分布确定的。在一些实施例中,有效频率的分布通过方程变换:X∩N(μ;σ
在一些实施例中,中心极限定理可提供均值的样本分布,其中
j=0,1,...,(u-1).
f-(u-0)δ,f-(u-1)δ,f-(u-2)δ,...,f-δ,
其中:
f是在之前步骤中选择的有效频率,通过构造
μ是可在f之下和之上添加的频率数;(方程4)
δ是这些频率之间的常数差。
那么,所研究的频率数可是:n=2u+1
通过构造,所描绘的频率分布(方程3)可具有均值
所描绘的频率集可是正态分布的:
在一些实施例中,正态性可不会发生在基线远端变量(baseline distalvariables)(DISD1,心率变异性)上。在一些实施例中,可发生异常点。如图29中图示的,可考虑两种类型的非典型值:异常点和影响点或杠杆点。
在一些实施例中,可进行异常点和影响点的识别。在一些实施例中,异常点和影响点的识别可通过正态概率图(Normal Probability Plot)的图形标准进行以检测潜在异常点和/或影响点,通过学生化残差(studentized residue)(RS)i和库克距离(Cook’sdistance)(D
在一些实施例中,可考虑线性回归模型:
Z(DIDS1)
(a)提交的观察(DISD1)可认为是异常点||RS||>2.0
(b)库克距离以分析答案i-次序(i-order of the answer)的影响可定义为:
其中,在Z(DISD1)作为Z(freq)的函数的线性回归模型中:
r
k是模型的参数数;
h
在一些实施例中,如果
如图30中描绘的,根据上文公开的实施例,正态概率图构造的影响点示例可具有就约3Hz的频率反应增量。在一些实施例中,就约3Hz的频率反应增量可独立于频率值。
在一些实施例中,在一些实施例中,患者可放松处于仰卧位置。可包括约十分钟的初始非暴露时间段(即,休息),以允许患者放松并且就多种血液动力学参数和HRV建立基线。在初始非暴露期之后,患者可暴露于载波频率(即,在没有调幅的恒定振幅下)达约十分钟。在初始暴露期之后,患者可暴露于调制频率暴露期达约120分钟、约60分钟、约35分钟、或约10分钟。在此期间,频率集的每个(例如,如本文中描述的,在从约0.01Hz至约20KHz、从约10Hz至约1,000Hz、或者从约10Hz至约2,000Hz的范围内每1Hz、3Hz或10Hz发生的电磁频率系列)可应用到患者达具体时间段(例如,10秒每频率或3秒每频率)。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每3Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约0.01Hz至约20KHz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约1,000Hz的范围内每10Hz发生的电磁频率系列。在一些实施例中,应用到患者的调制频率可是在从约10Hz至约2,000Hz的范围内每10Hz发生的电磁频率系列。系统可重复循环通过频率中的每个达暴露期。在调制频率暴露期之后,系统可确定使血液动力学参数(例如,心率变异性)发生变化的频率集(即“有效频率”)。在一些实施例中,系统可确定新频率集,其使在第一暴露期期间的血液动力学参数发生或不发生变化。在进一步的实施例中,该系统可就该使血液动力学参数发生或不发生变化的新频率集确定频率属性。在一些实施例中,作为非限制性示例,频率属性可是如图31中描绘的条形码系统。在一些实施例中,频率属性可归于代码,其中该代码可是代码0、代码-1、代码1、代码2,或其组合。如图32-33中图示的,在一些实施例中,频率属性可是代码0,其中代码0在条形码系统中图示为0个条;频率属性可是代码-1,其中代码-1在条形码系统中图示为1个条;频率属性可是代码1,其中代码1在条形码系统中图示为2个条;频率属性可是代码2,其中代码2在条形码系统中图示为3个条,3个顺序的条而没有在3个顺序的条之间的空隙;或它们的组合。在进一步的实施例中,代码0可指示在血液动力学参数(例如,心率变异性)中不产生改变的频率,代码-1可指示在血液动力学参数(例如,心率变异性)中产生减少的频率,代码1可指示在血液动力学参数(例如,心率变异性)中产生增加的频率,并且代码2可指示在血液动力学参数(例如,心率变异性)中产生非常高的增加或减少的频率。
在一些实施例中,条形码系统具有频率间隔。在一些实施例中,条形码系统具有的频率间隔为约1Hz、约3Hz、约5Hz、约10Hz、约20Hz、约30Hz、约40Hz、约50Hz、约60Hz、约70Hz、约80Hz、约90Hz、约100Hz、约125Hz、约150Hz、约175Hz、约200Hz、或在其之间包含的任何范围。在一些实施例中,条形码系统具有约100Hz的频率间隔。
以下示例仅出于说明和示例性目的提供,并且其不旨在以任何方式限制本发明。
示例1
对AM EMF暴露的血流动力学应激反应
在验证试验中,设计并使用了能够在AutemgEM生成器和TaskForceMonitor之间同步收集大量数字数据的集成系统,以识别对AM EMF暴露的血流动力学反应。构建了数学计算处理,其通过几何数据变换整合多元血流动力学参数分析,以便识别与其近邻不一致的点。通过自非平稳回归(self-non-stationary regression)产生解释模型,指示周期性波动、总体上升或下降趋势和允许的随机波动。如图5中展示的,统计时域测量在非常小的周期间隔期间识别由AM EMF频率调制引起的瞬时血液动力学变化。
根据频率调制计划,总计48例晚期肝细胞癌(HCC)患者和45名健康对照以仰卧位置暴露于27.12MHz载波频率达10分钟(基线期),随后暴露于以从10到20KHz的特异极低频率调制的相同载波频率达30分钟至55分钟(调制期)。从每搏血流动力学时间系列提取瞬时血流动力学反应变化用于在预测模型中进一步分析,该瞬时血流动力学反应特征在于几何变换参数值中的显著改变。这些提取的值代表整个血流动力学时间系列的小部份。
为了确定自主血流动力学应激反应是由27.12MHz载波频率引起的或是由载波频率的调制引起,在基线和调制周期之间进行比较分析,其中考虑了就每个患者的血流动力学应激反应事件的数量,将暴露时间作为协变量。就晚期HCC患者(p<0.0001)和健康对照(p=0.0156),在调制期期间观察到的血液动力学应激反应事件的数量显著高于在基线期期间观察到的事件(表2)。
表2
在调制期期间,观察到血流动力学应激反应事件的百分比在患有晚期HCC的患者中显著高于健康对照(p=0.0017)。
由Hdp监视系统从AM EMF暴露过程数据中提取的自主血流动力学应激反应特征代表对反复AM EMF刺激的应变稳态反应,这可反映个体患者的应变稳态负荷状态。Hdp监视系统记录的精确和即时的时域血流动力学变化代表对患者的应变稳态负荷容量(或过载)的稳健、客观和可重复的访问。
示例2
癌症中的生存质量(QoL)测量和预后
先前研究表明,在癌症患者中,生存质量测量与生存时间之间存在正相关关系。治疗前(基线)生存质量数据似乎为帮助医生建立用于治疗其癌症患者的预后标准提供了最可靠的信息。预测或预后指标定义为可用于估计给定结局(例如,生存期)的机率的任何独立变量(例如,健康相关的生存质量参数)。
与医生测量的粗略的表现状态(performance status)和毒性测量相比,生存的生存质量预测可较好地反映患者自身的功能和幸福感(well-being);比其他测量更早地指示患者幸福感的降低;并且与更积极的行为(诸如遵守医疗方案和影响生存的健康的生活方式)相链接,反映了影响病程的个体特征。如图6中示出的,生存质量分析可在治疗前(基线)设置中使用并且在后续评估期间使用,其具有两个区别的目标:基线QoL是指疾病特异的特征,而后续QoL是指治疗特异的特征。
在验证试验中,患有晚期HCC的患者和健康对照在每次EMF暴露治疗之前完成EORTCC30v3.0问卷(图1A-C)。总计收集问卷230份,并对QoL数据进行处理以供分析。从6,900个QoL数据点中,仅报告了7个缺失数据。我们为iOS操作系统开发了应用,用于使用EORTCC30进行数字QoL评估(QLQ-C30;葡萄牙语版本3.0)。数字QoL评估数据计算是基于EORTC建议获得的。
示例3
QoL参数与血流动力学应激反应值的相关性
由Hdp监视系统在AM EMF暴露过程期间收集的数字数据存储在从HCC患者和健康对照收集的数字血流动力学应激反应和数字QoL评估信息的大型数据库中。使用QoL评估参数结合来自HCC患者和健康对照的自主血流动力学应激反应值的初始相关性数据分析表明与根据其整体健康状态分层为三组值的相同HCC患者和健康对照组的高相关性水平(>95%相关性)(图2-3)。
基于QoL评估结合自主血流动力学应激反应值而分层在这三个区别的患者组中的晚期HCC患者,在中位总生存期上显示出显著差异(p=0.003)(图4)并且就入院风险显示出显著差异,其分别为A、B和C组的14%、40%和45%(p<0.001,logRank–MantelCox)。
示例4
就癌症患者的预测模型构建——就特异预测的维度选择
对来自QoL评估和血流动力学应激反应的多个变量进行单独地和组合地研究,用于根据期望的预测问题通过首要分量使用因子分析更好地区分结果。
癌症患者的QoL与感知的预后差异性水平之间的关系是动态过程。例如,在相似报告状况的患者中,与处于癌症治疗后期的晚期癌症患者的QoL评估相比,处于癌症治疗早期的晚期癌症患者的QoL评估报告良好表现状态和没有症状是较低差异性变量。在后期阶段,患者报告的评估是高度差异性的(存活时肿瘤负荷低相对于临终时肿瘤负荷高)。在该后一种情况下,QoL评估占总方差解释的72%-79%。另一方面,QoL评估仅占就处于癌症治疗早期的患者总方差解释的53%。初始QoL评估在预测模型中的价值有限,尤其是在晚期癌症患者中,因为患者中的大多数具有相似的中间QoL值。
血液动力学应激反应在早期评估中占总方差解释的接近50%,并且在癌症治疗的后期阶段下降到21%。考虑到血流动力学应激反应代表个体的应变稳态负荷状态,QoL评估和自主血流动力学应激反应数据值的组合对于构建预测模型可是非常有用的,尤其是对于晚期癌症患者中的预测模型来说。
示例5
通过选择代表相关QoL评估值和由Hdp监视系统收集的自主血流动力学应激反应值的小数量维度(<10),基于应用于健康对照人群的核函数(kernel function)的统计算法能够测量给定患者距理想健康状况的距离,从而为患者风险分层创建了简单的健康量表方案。这种门诊、非侵入性和快速的过程为具有癌症诊断的患者提供了独特的预测方案。
使用提出的预测模型将晚期HCC患者分层为低风险患者人群(24例患者)和高风险患者人群(14例患者),其具有高度显著的差异结局(p<0.001)(图7A-D)。令人惊讶的是,低风险患者人群似乎具有比先前预期的显著更好的结局,这表明与暴露于AM EMF相关联的潜在治疗益处。
与高风险患者人群相比,低风险患者人群与低癌症相关死亡发生率(2.0%)和低住院率(6.7%)相关联,该高风险患者人群在10个月的中位后续期间显示出高癌症相关死亡发生率(80.0%)和高入院率(91.3%)。
预测模型分层仅基于在暴露于AM EMF的第一暴露过程时收集的数据。由Hdp监视系统在额外的AM EMF暴露过程后收集的后续数据提供了额外的预测信息。在61%的晚期HCC患者中在第二暴露过程之后报告了QoL评估上的改善。与其他39%的患者相比,QoL评估上改善的患者具有显著较好的总体生存率(p=0.02)和显著降低的入院率(p=0.02)。
由Hdp监视系统从两个顺序的AM EMF暴露过程收集的当前和先前数据之间的比较提供了客观的QoL评估进展。此外,统计算法将来自顺序暴露的自主血流动力学应激反应值和QoL评估值相结合以馈送到预测模型。该动态分析预报了所测试的所有晚期HCC患者的生存质量、功能状态和用于未来暴露过程的症状量表进展。预测模型还以高准确度预报了健康风险状态和预期生存天数中的改变(图8)。
在顺序的EMF暴露之间的预测模型过程带来了与医生和医疗保健专业人员相关的即时预测信息。这些预测可改变实践、治疗选择和化疗剂量,并可为更好的医院财务规划提供信息。
预测模型中使用的预测变量和调制频率数据(引起自主血流动力学应激反应的频率)以条形码方案表示。这些图像允许计算机处理,用于识别数据库中的相似患者,并且可帮助构建与有利治疗结局相关联的频率组合(图9A-C)。
Hdp监视系统收集了在门诊部门中接受非侵入性AM EMF暴露过程的个体的高质量和即时数字数据。QoL评估和自主血流动力学应激反应值在第一和第二暴露时由统计算法进行处理,以便为患者、医生和医疗保健专业人员提供即时预测信息。
预测模型由选择的预测变量组支持,该组变量指示个体的应变稳态负荷状态。该第一报告途径和非侵入性方法在晚期HCC患者中显示出高度准确的预测。在由于治疗干预导致的预后和QoL评估进展方面的即时信息之外,预测模型还可选择最有可能从干预(例如,暴露于AM EMF)中受益的患者。
示例6
图34A图示了在不同健康状况中以表面上混沌的方式分布的从100Hz到40,000Hz的健康状况特异的AM EMF。通过使用本发明中描述的数学计算重新组织不同健康状况特异的AM EMF,我们获得由Hz=a+βx定义的线性方程,其中R
图34B图示了从约100Hz至约40,000Hz的健康状况特异的AM EMF就不同健康状况以确定的方式分布。统计算法允许识别在患者诊断中使用的AM EMF系列中的模式。该示例显示了在21例患者中在暴露于三个不同癌症特异频率组期间,疾病特异AM EMF和健康特异AM EMF的分布。
在上文的详细说明中,参考了附图,附图形成说明的一部分。在附图中,相似的符号通常指示相似的部件,除非上下文另外指示。在详细说明、附图及权利要求中描述的说明性实施例不意味是限制性的。在不脱离本文呈现的主题的精神或范围的条件下,可使用其他实施例并且可做出其他改变。将容易理解的是,如本文中总体上描述的并且在附图图示的,本公开的多种特征可在广泛多样的不同的配置中进行布置、替换、组合、拆分以及设计,所有这些均在本文中明确地考虑了。
本公开并不限制于所描述的具体系统、设备和方法,因为这些是可变化的。在描述中使用的术语仅仅是出于描述具体版本或实施例的目的,而不旨在限制范围。
如在本文件中使用的,单数形式的“一”和“该”包括复数指代,除非上下文明确地另外指明。除非另外限定,本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的意义。在本公开中,任何内容均不应解释为其承认在本公开中描述的实施例不享有凭借先前发明使该公开具有较早日期的权利。如本文件中使用的,术语“包含”意味着“包括但不限于”。
上文描述的本教导的实施例不旨在是穷尽的或将教导限制为在随后的详细描述中公开的精确形式。相反,选择和描述实施例使得本领域的其他技术人员可领会和理解本教导的原理和实践。
本公开不受在本申请中描述的具体实施例的限制,该实施例是旨在作为多种特征的说明。如对于本领域技术人员来说将显而易见的是,在不脱离本发明的精神和范围的情况下可进行许多修改和变化。根据前面的描述,在本文中列举的那些之外,在本公开的范围内的功能上等同的方法和设备对于本领域技术人员将是显而易见的。这样的修改和变型旨在落入所附权利要求的范围内。本公开仅由所附权利要求的条款以及这些权利要求享有的等同方案的全部范围限制。应理解的是,本公开不限于具体的方法、试剂、化合物、组合物或生物系统,其当然可发生变化。还应理解的是,本文中使用的术语仅仅是出于描述具体实施例的目的,而不旨在是限制性的。
就本文中基本上任何复数和/或单数术语的使用,本领域技术人员可从复数到单数和/或从单数到复数转换,只要适合于上下文和/或应用。为清楚起见,在本文中可明确记载多种单数/复数置换。
本领域技术人员将理解的是,总体上讲,本文中并且尤其是所附权利要求书中所使用的术语(例如,所附权利要求的限定部分)一般旨在为“开放性”术语(例如,术语“包含”应解释为“包含但不限”,术语“具有”应解释为“至少具有”,术语“包含”应被解释为“包含但不限于”等等)。当以术语“包括”多种部件或步骤描述多种部件、方法和设备时(解释为意味着“包含但不限于”),该部件、方法和设备可还“基本上由”多种部件或步骤“组成”或“由”多种部件或步骤“组成”,并且这样的术语应解释为基本上封闭元素的组。本领域技术人员将进一步理解的是,如果意图在于特定数量的引入的权利要求记载项,则这样的意图将在权利要求中明确记载,并且在没有这样的记载的情况下则不存在这样的意图。
例如,作为对理解的帮助,下列所附权利要求可含有对引导性短语“至少一个”以及“一个或多个”的使用以引入权利要求记载项。然而,这样的短语的使用不应解释为暗示了由不定冠词引入的权利要求记载项将含有这样的引入的权利要求记载项的任何具体权利要求限制为包含仅一个这样的记载项的实施例,即使当相同权利要求包括引入性短语“一个或多个”或者“至少一个”以及诸如“一”的不定冠词(例如,“一”应解释为意指“至少一个”或者“一个或多个”);对于用于引入权利要求记载项的定冠词的使用也是同样的情况。
另外,即使明确记载了特定数量的引入的权利要求记载项,本领域技术人员也将认识到,这样的记载应解释为意指至少所记载的数量(例如,仅仅记载“两个记载项”而没有其他修饰语的情况意指至少两个记载项、或者两个或更多个记载项)。此外,在那些使用了类似于“A、B和C中的至少一个”等的惯常表述的情况下,总体上讲,这样的结构旨在是在本领域技术人员对该惯例的理解的意义上的(例如,“具有A、B和C中的至少一个的系统”将包括但不限于仅具有A、仅具有B、仅具有C、具有A和B一起、具有A和C一起、具有B和C一起、和/或具有A、B和C一起的系统等等)。在那些使用了类似于“A、B和C中的至少一个”等的惯常表述的情况下,总体上讲,这样的结构旨在是在本领域技术人员对该惯例的理解的意义上的(例如,“具有A、B和C中的至少一个的系统”将包括但不限于仅具有A、仅具有B、仅具有C、具有A和B一起、具有A和C一起、具有B和C一起、和/或具有A、B和C一起的系统等等)。本领域技术人员将进一步理解的是,无论在说明书、权利要求或附图中,呈现两个或更多个替代术语的几乎任何转折性单词和/或短语应理解为考虑了包含术语中的一个、包含术语中的另一个、或两个术语都包含的可能性。例如,短语“A或B”将理解为包含“A”或“B”或“A和B”的可能性。
另外,当本公开的特征以马库什组的方式描述时,本领域技术人员将理解的是,本公开也由此以马库什组的任何单个元素或元素的子组描述。
如本领域技术人员将理解的,出于任何和所有目的,诸如在提供书面描述方面,本文中公开的所有范围也涵盖任何和所有可能的子范围以及其子范围的组合。任何列出的范围可容易地理解为是充分描述的,并且使得相同的范围能够至少拆分为相等的两份、三份、四份、五份以及十份等等。作为非限制性的示例,本文中讨论的每个范围可容易地拆分为下三分之一、中三分之一和上三分之一等等。如本领域技术人员还将理解的,所有的语言,诸如“至多”和“至少”等等,包括所记载的数字,并且其指的是可后续拆分为如上面讨论的子范围的范围。最后,如本领域技术人员将理解的,范围包括每个单个元素。因此,例如,具有1-3个单元的组指的是具有1、2或3个单元的组。类似地,具有1-5个单元的组指的是具有1、2、3、4或5个单元的组等等。
如本文中使用的,术语“约”是指可发生的数值上的变化,例如,通过现实世界中的测量或处理程序;通过这些程序中不经意的错误;通过在组合物或试剂的制造、来源或纯度中的差异;等等。通常,如本文中使用的,术语“约”意指大于或小于载明值或值的范围达所载明的值的1/10,例如±10%。术语“约”还指本领域技术人员将认为是等同的变化,只要这样的变化不涵盖现有技术实施的已知值。以术语“约”开头的每个值或值的范围还旨在涵盖载明的绝对值或值范围的实施例。无论是否由术语“约”修饰,权利要求中记载的数量值包括所记载的值的等同,例如,可发生的这样的值的数值量上的变化,但本领域技术人员将认为其是等同的。
多种上文公开的及其他特征和功能,或其替代,可组合到许多其他不同的系统或应用中。对于其中多种目前无法预见或无法预期的替代、修改、变型或改进,本领域技术人员可在之后做出,其中的每个旨在由所公开的实施例涵盖。
