一种hectd4基因敲除斑马鱼癫痫模型及其构建方法和应用
文献发布时间:2023-06-19 13:48:08
技术领域
本发明涉及基因敲除技术领域,具体涉及一种hectd4基因敲除斑马鱼癫痫模型及其构建方法和应用。
背景技术
CRISPR(clustered,regularly interspaced,short palindromic repeats)是一种来自细菌降解入侵的病毒DNA或其他外源DNA的免疫机制。在细菌及古细菌中,CRISPR系统共分成3类,其中Ⅰ类和Ⅲ类需要多种CRISPR相关蛋白(Cas蛋白)共同发挥作用,而Ⅱ类系统只需要一种Cas蛋白即可,这为其能够广泛应用提供了便利条件。目前,CRISPR/Cas9系统应用最为广泛。研究人员发现使用多个sgRNA靶向同一基因,可以最大限度地提高编辑效率,并将这种方法命名为CRISPANT技术。
在前期的癫痫患者的全外显子组测序(WES)结果中,筛选到可能引起癫痫疾病的基因HECTD4。斑马鱼作为脊椎动物,具有复杂的神经系统,遗传结构与人类相似,约70%的基因与人类共享,约84%的人类疾病已知相关基因也在斑马鱼中表达。与小鼠等啮齿类动物相比,斑马鱼遗传操作简单,更适合用于制备癫痫模型。且hectd4基因进化上较为保守,研究发现hectd4在斑马鱼胚胎早期表达量特别高。因此,本发明旨在利用CRISPANT技术建立hectd4基因敲除斑马鱼癫痫模型,该斑马鱼系可用于研究HECTD4突变与癫痫发病机制的关系及后续抗癫痫药物筛选。
发明内容
本发明提供了用于CRISPANT特异性敲除斑马鱼hectd4基因构建斑马鱼癫痫模型的sgRNA组合,通过CRISPANT技术,选育出hectd4基因缺失型斑马鱼,从而构建斑马鱼癫痫模型。
本发明采用以下技术方案:
本发明第一方面提供了一种sgRNA组合,所述sgRNA组合是用于CRISPANT特异性敲除斑马鱼hectd4基因构建斑马鱼癫痫模型的sgRNA组合,其序列如SEQ ID NO.1至SEQ IDNO.4所示。
进一步地,所述敲除斑马鱼hectd4基因是敲除斑马鱼hectd4基因第二个外显子上58bp片段,其序列如SEQ ID NO.7所示。
本发明第二方面提供了一种斑马鱼癫痫模型,所述斑马鱼癫痫模型是利用上述sgRNA组合敲除斑马鱼hectd4基因来构建。
进一步地,所述敲除斑马鱼hectd4基因是敲除斑马鱼hectd4基因第二个外显子上58bp片段,其序列如SEQ ID NO.7所示。
本发明第三方面提供了一种构建斑马鱼癫痫模型的试剂盒,包括如SEQ ID NO.1至SEQ ID NO.4所示的sgRNA组合。
进一步地,还包括Cas9蛋白。
本发明第四方面提供了上述sgRNA组合在构建斑马鱼癫痫模型中的应用,是利用所述sgRNA组合敲除斑马鱼hectd4基因来构建斑马鱼癫痫模型。
进一步地,所述敲除斑马鱼hectd4基因是利用所述sgRNA组合敲除斑马鱼hectd4基因第二个外显子上58bp片段,其序列如SEQ ID NO.7所示。
本发明第五方面提供了上述斑马鱼癫痫模型在筛选抗癫痫药物中应用。
本发明第六方面提供了一种斑马鱼癫痫模型的构建方法,包括如下步骤:
1)、靶向CRISPANT基因的sgRNA组合和检测引物的筛选:sgRNA组合序列如SEQ IDNO.1至SEQ ID NO.4所示,检测引物序列如SEQ ID NO.5至SEQ ID NO.6所示;
2)、将4个sgRNA和Cas9蛋白混合物注射到斑马鱼的受精卵中;
3)、F0代突变斑马鱼筛选:筛选出敲除有效的胚胎,培养至成鱼,获得F0代突变斑马鱼;
4)、获得可遗传的斑马鱼突变体的F1代:将F0代突变斑马鱼与野生型斑马鱼杂交得到F1代胚胎,筛选存在突变的胚胎,培养至成鱼,筛选得到可遗传的斑马鱼突变体的F1代。
本发明的有益效果是:
本发明提供了用于CRISPANT特异性敲除斑马鱼hectd4基因构建斑马鱼癫痫模型的sgRNA组合,通过CRISPANT技术,敲除斑马鱼hectd4基因第二个外显子上58bp片段,选育出hectd4基因缺失型斑马鱼,从而构建斑马鱼癫痫模型。
本发明使用多个sgRNA靶向同一基因,可以最大限度地提高编辑效率,更有效进行基因编辑。
本发明提供的斑马鱼癫痫模型为进一步开展HECTD4突变与癫痫发病机制的关系研究及筛选抗癫痫药物奠定了很好的基础。
附图说明
图1为CRISPR/Cas9敲除原理图。
图2为hectd4基因上打靶位点在基因组上的序列位置图。
图3为4条sgRNA电泳检测图(M表示为DNA Marker,从下向上依次为100bp、200bp、300bp、400bp、500bp、700bp、1000bp;编号1、2、3、4分别为sgRNA1、sgRNA2、sgRNA3、sgRNA4)。
图4为4条sgRNA活性验证电泳图(M表示为DNA Marker,从下向上依次为100bp、200bp、300bp、400bp、500bp、700bp、1000bp;编号1、2、3为sgRNA1单靶注射后胚胎,编号4、5、6为sgRNA2单靶注射后胚胎,编号7、8、9为sgRNA3单靶注射后胚胎,编号10、11、12为sgRNA4单靶注射后胚胎,WT为野生型)。
图5为hectd4 F0代基因型鉴定电泳图(M表示为DNA Marker,从下向上依次为100bp、200bp、300bp、400bp、500bp、700bp、1000bp;编号1-17表示为F0代剪鱼尾序号,WT为野生型)。
图6为hectd4 F1代基因型鉴定电泳图(M表示为DNA Marker,从下向上依次为100bp、200bp、300bp、400bp、500bp、700bp、1000bp;编号1-12表示为F1代剪鱼尾序号,WT为野生型)。
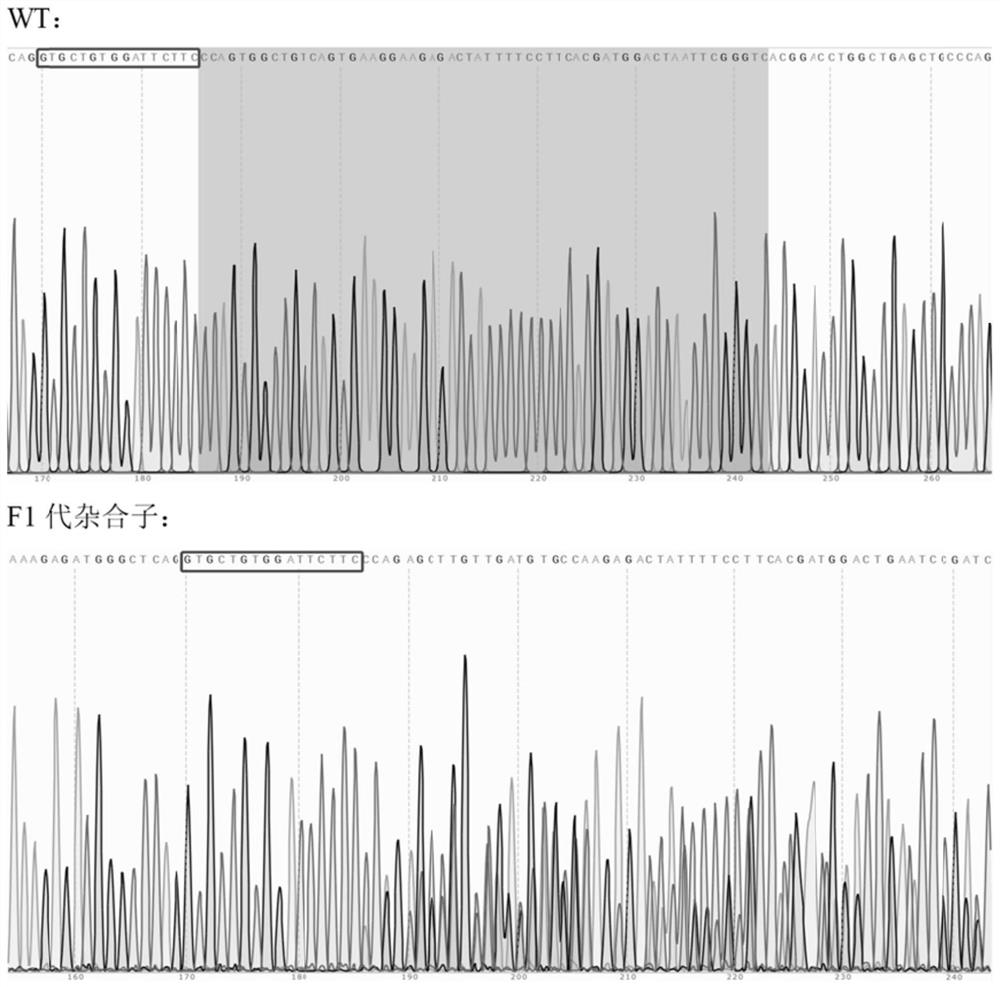
图7为hectd4 F1代野生型与突变体测序峰图对比。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细的说明。
实施例1
1)设计CRISPANT基因敲除靶位点和检测引物
在National Center for Biotechnology Information(NCBI)上查询斑马鱼hectd4基因的基因组DNA序列(基因编号为:XM_009303668),根据CRISPR/Cas9敲除原理(图1),在网站The ZFIN(https://zfin.org/)上设计hectd4基因的靶位点。靶点的选择必须遵循此标准:5’-GG-(N)18-NGG-3’。其中5’端的GG二核苷酸是T7启动子的一部分,设计靶位点时可以不受此限制,但是必须保证靶位点的3’端是NGG。靶点的选择位置必须在基因的结构域内,以确保靶位点碱基的插入或者缺失可以影响hectd4基因的整个结构域,从而来改变基因的表达。待敲除基因的靶位点位于hectd4基因的第二外显子(图2),sgRNA序列如表1所示。
表1 sgRNA序列
取hectd4基因的CRISPANT靶位点上下游约200bp的基因组区域于Primer Premier3.0软件中设计引物(如表2所示)。
表2引物序列
2)sgRNA合成及质检
使用以上设计好的引物,进行PCR实验检测设计好的sgRNA序列是否有误。确认无误后,将设计好的sgRNA送往商业公司(南京金斯瑞生物科技有限公司,以下简称南京金斯瑞)进行合成。
将收到的四条sgRNA以14000rpm的转速离心10min,沉淀RNA干粉。随后加入15μL的RNase-free双蒸水溶解RNA干粉。对溶解好的四条sgRNA进行质量检测。
首先,取1μL sgRNA溶液于紫外分光光度计上检测浓度,记录每条sgRNA的浓度及OD260/280数据。其次,取1μL sgRNA溶液与loading buffer混合进行琼脂糖凝胶电泳,检测sgRNA是否为单一条带。若sgRNA浓度较高(至少高于600ng/μL),且电泳条带为均一条带(如图3所示),则可进行显微注射实验。
3)单条sgRNA的活性验证
在进行正式打靶之前,需先测试设计的sgRNA是否能有效编辑。故而进行单条sgRNA的活性验证。将Cas9蛋白(南京金斯瑞,Z03389-50)分别和4个不同的sgRNA按表3体系进行络合,使Cas9蛋白的终浓度为250ng/μl,sgRNA的终浓度为100ng/μl。注射约1nL Cas9蛋白和sgRNA混合液于一细胞期的受精卵内。注射过的受精卵放置于E3水中,28℃孵化。在体式显微镜下观察胚胎表型,筛选正常发育的胚胎用于靶位点突变分析。
表3 sgRNA与cas9蛋白络合体系
4)Sanger测序检测sgRNA的有效性
对斑马鱼胚胎进行显微注射之后,挑选部分发育正常的早期胚胎,检测其hectd4基因是否存在突变,提前确认此次选择的靶位点是否有效果,显微注射操作是否规范。
a、提取斑马鱼基因组
斑马鱼胚胎受精24小时后(24hpf),分别收集野生型1管(做对照)和注射后实验组胚胎(各个实验组分别3管)于1.5mL Ep管中(每管5颗胚胎),加入裂解液提取基因组DNA。
b、PCR扩增目的序列
提取基因组DNA之后,使用表2引物序列,表4PCR反应体系扩增出目的DNA片段。
表4 PCR反应体系
震荡混匀之后离心,于PCR仪上进行扩增反应。反应条件为:预变性95℃5min,(变性95℃30s,退火56℃30s,延伸72℃30s)35个循环,再72℃8min。待反应结束后,离心PCR产物,取2μL样品点样于1.3%琼脂糖凝胶上进行电泳,检测PCR产物大小是否正确,如图4所示。
c、若PCR产物正确,送PCR产物进行Sanger测序,由测序的峰图来初步获得插入或缺失的信息,经tide网站比对后得出sgRNA敲除效率,确定sgRNA有效后,进行正式注射。
4)斑马鱼胚胎的显微注射
在受精后30min之内,用吸管吸取胚胎转移至用琼脂糖制作的显微注射专用培养皿中。
在进行显微注射之前,将Cas9蛋白和4个不同的sgRNA充分混匀配成一混合液,使Cas9蛋白的终浓度为250ng/μl,每个sgRNA的终浓度均为100ng/μl。注射约1nL Cas9蛋白和sgRNA混合液于一细胞期的受精卵内。注射过的受精卵放置于E3水中,28℃孵化。在体式显微镜下观察胚胎表型,筛选正常发育的胚胎用于靶位点突变分析。
选取3管胚胎(每管5枚)检测打靶敲除效率,检测步骤同上,确定敲除有效后,将剩余胚胎养大至两月龄。
5)F0代突变斑马鱼筛选
a、提取斑马鱼基因组
胚胎养至两月龄后,收集斑马鱼成鱼的部分尾鳍组织于1.5mL离心管中,向EP管中加入裂解液提取基因组DNA。
b、PCR扩增目的序列
提取基因组DNA之后,使用表2引物序列,表4PCR反应体系扩增出目的DNA片段。反应条件为:预变性95℃5min,(变性95℃30s,退火56℃30s,延伸72℃30s)35个循环,再72℃8min。待反应结束后,离心PCR产物,取2μL样品点样于1.3%琼脂糖凝胶上进行电泳,检测PCR产物大小是否正确。
c、若PCR产物正确,送PCR产物进行Sanger测序,由测序的峰图来获得插入或缺失的信息。筛选出携带有突变的F0代斑马鱼,实验结果如图5所示。
6)获得可遗传的斑马鱼突变体的F1代
通过前面一系列筛选确定了斑马鱼突变体F0代,紧接着将F0代突变体分别与野生型斑马鱼杂交得到F1代胚胎,置于28℃培养,在初期观察F1代的存活率。
如果从F1代胚胎中检测到存在突变,则将斑马鱼突变体的F1代养大至2-3个月。再分别对每条F1代斑马鱼成鱼进行剪尾,筛选F1代突变体(具体方法如步骤5)所述),实验结果如图6所示。
根据已筛选到的F1代突变体的Sanger测序结果分析,得出hectd4基因上58bp的大片段缺失。实验结果如图7所示,蓝色方框部分为缺失的58bp:CCAGTGGCTGTCAGTGAAGGAAGAGACTATTTTCCTTCACGATGGACTAATTCGGGTC。
序列表
<110> 浙江赛微思生物科技有限公司
<120> 一种hectd4基因敲除斑马鱼癫痫模型及其构建方法和应用
<160> 7
<170> SIPOSequenceListing 1.0
<210> 1
<211> 23
<212> DNA
<213> hectd4-sgRNA1(人工序列)
<400> 1
gtgctgtgga ttcttcccag tgg 23
<210> 2
<211> 23
<212> DNA
<213> hectd4-sgRNA2(人工序列)
<400> 2
cccgaattag tccatcgtga agg 23
<210> 3
<211> 23
<212> DNA
<213> hectd4-sgRNA3(人工序列)
<400> 3
cgatggacta attcgggtca cgg 23
<210> 4
<211> 23
<212> DNA
<213> hectd4-sgRNA4(人工序列)
<400> 4
actaattcgg gtcacggacc tgg 23
<210> 5
<211> 21
<212> DNA
<213> hectd4-F(人工序列)
<400> 5
ggagagtgag tgtgcgttaa g 21
<210> 6
<211> 22
<212> DNA
<213> hectd4-R(人工序列)
<400> 6
acaatcacat gctacatacc gc 22
<210> 7
<211> 58
<212> DNA
<213> 58bp缺失片段(人工序列)
<400> 7
ccagtggctg tcagtgaagg aagagactat tttccttcac gatggactaa ttcgggtc 58
- 一种hectd4基因敲除斑马鱼癫痫模型及其构建方法和应用
- 一种scn1lab基因敲除斑马鱼癫痫模型及其构建方法和应用
